Method Article
ゼブラフィッシュ成体における尾柄の骨格筋再生研究のための凍結損傷モデル
要約
このプロトコルは、成体ゼブラフィッシュにおけるいくつかの尾側筋腫の深刻な損傷を誘発するための凍結損傷モデルについて説明しています。この方法は、非哺乳類脊椎動物の重度の組織喪失後の骨格筋再生を研究するための新しいアプローチを提供します。
要約
骨格筋は、軽傷を負った後、衛星様幹細胞の活性化により再生と回復を遂げます。筋肉組織の重傷はしばしば人間の線維症を引き起こします。哺乳類と比較して、ゼブラフィッシュは臓器再生のためのより高い生来の能力を持っており、臓器への広範な損傷後の組織修復を研究するための強力なモデルを提供します。ここでは、凍結損傷モデルが、成体のゼブラフィッシュの尾柄の4つの筋腫に深刻な損傷を誘発することが説明されています。カスタムメイドのクライオプローブは、体型にフィットし、皮膚から正中線までの外側の筋肉組織を再現性よく傷つけるように設計されています。重要なことに、体の完全性は損なわれず、魚は水泳活動を続けました。骨格筋の変化は、組織切片上のサルコメアタンパク質の組織学的染色および蛍光染色によって評価された。この方法は、骨格筋の変性がどのように修復反応を誘発し、したがって成体ゼブラフィッシュの筋原性プログラムの再活性化を促進するかを理解することを目的とした新しい研究の道を開くでしょう。
概要
脊椎動物では、さまざまな組織の損傷した部分が生涯にわたって恒常性の再生と回復を受けます。再生および回復のためのこの能力は、典型的には、コンピテント幹細胞の存在または成熟細胞の増殖能力に依存する1,2。骨格筋は、サテライト細胞と呼ばれる局所幹細胞に関連する有糸分裂後筋線維を含む3,4,5,6。したがって、この組織は、中断された連続性の領域を効率的に密封するため、または軽度の創傷を修復するための細胞源を含む。しかし、哺乳類の骨格筋におけるより大きな体積損失の後には、線維症などの非再生的修復が続くことがよくあります7。動物モデルは、広範囲に損傷した臓器の再生を促進する生物学的メカニズムに関する新しい洞察を提供する可能性があります。
ゼブラフィッシュは、高い再生能力を持つ定評のあるモデル生物です。成体のゼブラフィッシュは、尾鰭の切断された部分または心室の切除された頂点を再生することができます8,9,10,11。さらに、凍結損傷法は、ゼブラフィッシュのひれと心臓の再生を研究するために以前に適用されています12、13、14、15。内臓の場合、凍結損傷法は、臓器の完全性を破壊することなく細胞死を誘導し、生理学的条件を模倣するという利点を有する16,17。組織破片は、創傷治癒中の自然なクリアランスによって崩壊し、その後修復プロセスが続きます。しかし、この方法を骨格筋に適用できるかどうかは、まだ確立されていません。
魚では、横方向の筋肉組織は水泳中に体幹を左右に曲げることを可能にします18。骨格筋は、結合組織5,19によって分離されたミオメアと呼ばれるメタメリックユニットに編成されています。ゼブラフィッシュは、レーザーアブレーションや刺し傷20,21,22,23,24によって引き起こされるような軽微な組織破壊の後に筋肉を再生することができますが、広範囲の損傷後に筋腫全体が再生できるかどうかは不明です。この知識のギャップは、おそらく適切な傷害モデルの欠如によるものです。このプロトコルは、複数の筋腫にまたがる骨格筋の広範な損傷を誘発するための新しいアプローチを確立します。記載された凍結損傷方法は、予冷されたステンレス鋼器具による筋線維の急速凍結および融解に基づいている。甚大な被害にもかかわらず、魚の健康はひどく損なわれませんでした。筋腫全体が復元される可能性があり、したがって、この研究は、成体のゼブラフィッシュの筋肉組織再生のメカニズムを研究するための新しいモデルシステムを提供します。
プロトコル
この研究は、関連するすべての倫理規則に同意して実施されました。ゼブラフィッシュは、欧州実験動物科学協会連盟(FELASA)のガイドライン25に従って飼育、飼育、維持されました。動物の飼育とすべての実験手順は、スイスのフリブールの州獣医事務所によって承認されました。
1.機器とセットアップ
- 研究用の機器を製造できる技術ワークショップでステンレス鋼クライオプローブの製造を手配します。
注意: 特定の寸法の機器の設計を提供します(図1A)。 - 手順中のプローブの取り扱い中に凍傷を避けるために、ハンドルをピペットチップに挿入し、テープで包みます。
- 麻酔作業液用のビーカー、魚を扱うためのスプーン、湿ったスポンジ、および処置後に魚が回復するようにシステム水の入ったタンクを準備します。
- すべての実験の前に、作業溶液を新たに準備してください。作業溶液を調製するには、ビーカー内の4 mLのシステム水に100 mLのトリカイン原液を加えます。
注:麻酔ストック溶液は、4 mLの蒸留水に溶解した980 gのトリカインで構成されています。1 M Tris-HCl、pH 9でpHを7に調整した後、蒸留水で溶液を1 Lまで満たします。原液は光に敏感で、琥珀色のボトルに4°Cで保存する必要があります。
2.筋肉凍結損傷の手順
- プローブを液体窒素に最低3分間浸すことから手順を開始します。スポンジをシステム水で濡らし、平らな面に置きます。
- 1匹の成体のゼブラフィッシュをトリカイン作業溶液に移し、1分または2分後にスプーンで魚にそっと触れて反応しないことを確認します。魚がまだ反応している場合は、もう少し待ちます。
- 麻酔をかけた魚を濡れたスポンジの上に置きます。尾柄を臀鰭の後方、尾鰭の前に配置します。
- 液体窒素からクライオプローブを取り外します。プローブを軽く振って、先端に液体窒素が残っていないことを確認します。
- へらの端を尾柄の体に垂直に置きます(図1C)。圧力をかけずにプローブをこの位置に6秒間保持します(図1D)。
注意: クライオプローブの重量は、機器と組織との接触を確保するのに十分です。 - 組織からクライオプローブを解放し、システム水を入れたタンクに魚を移します。
- 麻酔から目覚めた後、呼吸と水泳を再開する間、魚を監視します。30秒経っても手術運動が起こらない場合は、動物が自分で呼吸を開始するまで、システムの水をえらにピペッティングして魚を刺激します。
注意: 魚は回収タンクで数分以内に泳ぎを再開する必要があります。
注:次の日には、魚を撮影して水泳活動を監視することができます(ビデオ1 および ビデオ2)。ビデオ録画の前に、コントロールと負傷した魚を半透明の交配タンクに移し、少なくとも1分間慣れさせます。
3.尾柄の収集と固定
- その後のアッセイに適した2 mLの4%ホルマリンまたはその他の固定液、シャーレ、鉗子、および外科用はさみを準備します。
- 凍結損傷後の選択された時点で、地域の獣医事務所によって与えられた法的許可に従って魚を安楽死させます。
注:安楽死は、トリカイン溶液(300 mg / L)を約10分間過剰摂取することによって行われます。えらの動きの喪失と尾びれのつまみ反射は死を確認します。安楽死の時点は、再生の段階に応じて選択する必要があります:たとえば、凍結損傷後1日(dpci)から創傷クリアランスの3 dpciまで。筋肉再生の開始のための3 dpciから10 dpci;再生を進めるための10 dpciから30 dpciまで。そして組織修復の完了のために30 dpciの後。したがって、筋肉の変性と再生のさまざまなステップと生物学的プロセスを評価するには、凍結損傷後のさまざまな時点で魚のグループを安楽死させる必要があります。 - 安楽死させた魚を脱イオン水の入ったペトリ皿に入れます。はさみを使用して、尾柄の前後に体を切断します(図1E)。シャーレの脱イオン水で組織を出血させます。
- 尾柄を収集し、鉗子でマイクロ遠心チューブ内の準備した固定液に移します。
注意: チューブを数回慎重に反転させ、4°Cで一晩保持します。
4.尾柄の取り付け
- 固定した組織を1x PBSでロッカーで10分間洗浄します。次に、4°Cの脱イオン水中で予冷した30%スクロースを入れた2 mLのマイクロ遠心チューブに移し、チューブを数回静かに反転させます。微量遠心チューブを4°Cで24時間以上直立させておきます。
注意: 尾柄はスクロース溶液の上に浮かび、組織が脱水するにつれて沈み始めます。 - 埋め込み型に O.C.T. 封入剤の 5 mm 層を充填します。鉗子を使用して、培地の尾柄を調整します。金型の下部に配置し、横断セクションまたは冠状セクションの向きを調整します(図1F)。
- ドライアイスの箱で培地を凍らせます。組織が希望の位置に安定したらすぐに、O.C.T.が完全に凍結する前に金型の残りの部分を充填します。金型は-80°Cで最低1時間保管してください。
注:これらの条件下では、組織は何ヶ月も保存することができます。
5.クライオスタットで切片を切断する
- 切断厚さ25μmのクライオスタットを設置します。チャンバー温度を-26°C、試験片温度を-24°C、切断角度を12°に調整します。
- 凍結したブロックを検体と一緒にクライオスタットに入れ、ブロックの底と平行に切断するためにその向きを固定します。試料に到達するまで切断し、ブロックをトリミングしてサンプルの収集を容易にします。
- 6枚の接着スライドを用意します。サンプルの反復を準備するために、スライドに連続した番号でラベルを付けます。
- 切断を開始し、ラベル付けされた接着スライド上の組織切片を収集します。さらなる実験的要求に従ってスライド上のセクションを配置します。
- スライドを室温で1時間乾燥させます。-20°Cの密閉箱に保管してください。
注意: スライドは、この状態で最大1年間安全に保管できます。
結果
凍結損傷後の魚のモニタリング
動物に対するミオメア凍結損傷の影響を決定するために、凍結損傷後1日目の対照および凍結損傷魚のビデオ記録(dpci)および5 dpciが行われました。各グループには5匹の魚が含まれていました。1dpciでは、凍結損傷した魚は活発に泳ぐことができませんでしたが、渦巻き、畳み込み、平衡の低下などの異常な動きは見られませんでした(ビデオ1)。畜産システムでは、タンク内の位置と食物摂取量は、無傷の魚の位置と同様でした。通常の動作は、5 dpci のビデオ (ビデオ 2) に示されているように、次の数日間にわたって持続しました。結論として、尾柄の凍結損傷手順は動物の健康に深刻な影響を与えませんでした。
尾柄切片の組織学的解析
損傷の程度を評価するために、筋線維の破片が創傷に完全に吸収されたときであるため、4 dpciの時点が選択されました。体の背腹軸と前後軸に沿った凍結損傷の影響を分析するために、2つのグループの魚が使用されました(つまり、それぞれ、尾柄の冠状および横方向のセクション)(図1F)。
切片は、アニリンブルー、アシッドフクシン、およびオレンジG(AFOG)で構成されるトリクローム染色によって分析されました。この試薬の組み合わせを使用して、無傷の筋肉をオレンジ色、脊髄を濃い赤、コラーゲンマトリックスを青色で示しました。魚の筋肉組織のメタメリック単位である損傷した筋腫の数を決定するために、一連のセクションが分析されました(図2)。ミオコンマタと呼ばれるミオメア境界は、青色の着色によって検出されたコラーゲン沈着によって同定された。損傷領域は、オレンジ色の染色がないことによって決定されました。明らかなミオコンマタを有する標本を詳しく調べたところ、オレンジ染色の欠如から推測されるように、約4つの連続したミオメアが損傷していることが明らかになりました(n、魚の数= 4;図3A,A')。同じ魚の無傷の側が内部基準として機能しました。
体軸に垂直な創傷の深さを調べるために、4dpciおよび7dpciのゼブラフィッシュを用いて横断切片を作製した。後者の時点は、筋原性プログラムの活性化、したがって筋肉再生の開始に対応する。これらの標本のAFOG染色は、体の凍結損傷を受けた脇腹にオレンジ色の染色が広範囲に欠如していることを示し、変性した骨格筋のゾーンを画定しました(図3B、C)。4 dpciおよび7 dpciでは、創傷領域は皮膚から垂直中隔に向かって組織にまたがっていた。これは、凍結損傷法が尾柄の外側半分を深く標的とし、手術後7日間は機能的な筋肉を欠いていたことを示しています。まとめると、4つの筋腫が尾柄の片側に深刻な損傷を与えました。
横断切片の免疫蛍光分析
筋肉再生のダイナミクスを評価するために、魚の実験グループは4 dpci、7 dpci、10 dpci、および30 dpciで安楽死させました。尾柄の横断切片は、糸状アクチン[F-アクチン]に結合するファロイジン、サルコメアタンパク質を検出するトロポミオシン-1抗体、および核を標識するDAPIを用いた多色蛍光染色によって標識されました。すべての時点で、体の無傷の半分が内部統制を提供しました。F-アクチンとトロポミオシン1の両方が無傷の対照部分で強く検出され、損傷していない組織を示しています(図4)。
4 dpciでは、尾柄の損傷側には豊富なDAPI陽性細胞が含まれていましたが、F-アクチンとトロポミオシン1の免疫蛍光はほとんどまたはまったく観察されず、筋肉が変性した創傷領域を示しています(図4A-B ́)。7 dpciでは、トロポミオシン1とF-アクチンが垂直体の正中線に近い創傷の一部で検出されました(図4C-D ')。この発現パターンは、新しい筋線維の形成が尾柄で始まる位置を画定します。10 dpciでは、両方の筋肉マーカーが体の表面に向かって拡大し、骨格筋の再生が進んでいることが示唆されました(図4E-F ́)。30 dpciでは、体の両側でF-アクチン染色の同様の分布が示されました(図4G-H ́)。この所見は、尾柄の凍結損傷後に骨格筋が効率的に回復したことを示しています。
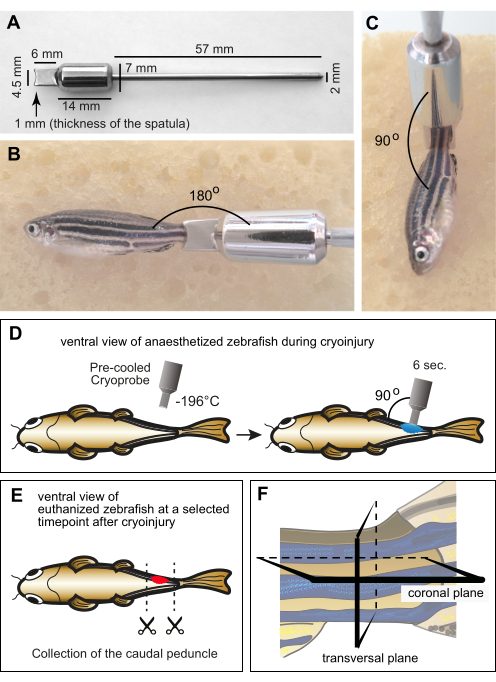
図1:ミオメア凍結損傷の実験セットアップ。 (A)ステンレス鋼製のカスタム製造クライオプローブの寸法。器具の遠位部分は、ゼブラフィッシュの体の湾曲を考慮して、深さ1mmの凹状のエッジを持つヘラで構成されています。ツールの中央部分は、おもりとして機能するシリンダーと、手順中にスパチュラの低温を維持するためのリザーバーで構成されています。器具の近位端は薄い金属製のハンドルの形をしています。(B,C)湿ったスポンジの上に成魚を麻酔し、尾柄にクライオプローブを付けます。プローブは室温であった。(B)プローブの縁を尾柄付近に水平に配置し、魚と道具の相対的なサイズを表示します。(C)凍結損傷の場合、ツールの先端は魚に対して垂直に配置されます。(D)操作を包括的に示すための魚の腹側からの凍結損傷手順の概略図。クライオプローブを液体窒素で予冷し、すぐに魚の片側に6秒間置いた。 (E)凍結損傷後の特定の時点で、魚は安楽死させられ、固定のために尾柄が収集されました。(F)固定された材料を組織学的に処理し、冠状面または横面に沿って切片化した。この図の拡大版を表示するには、ここをクリックしてください。
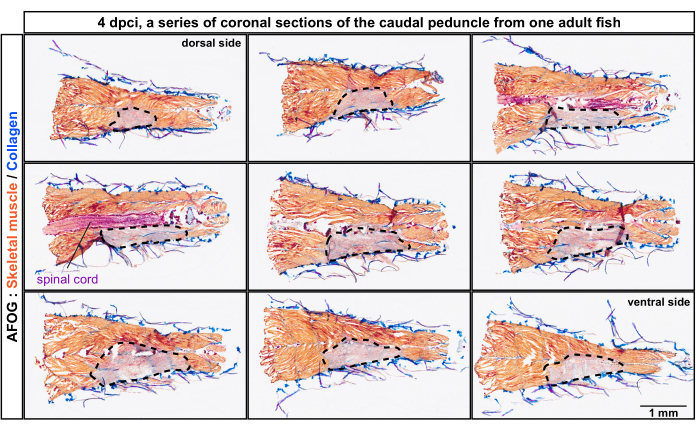
図2:尾柄の背側から腹側位置までの損傷した筋腫の組織学的解析。 凍結損傷後4日目の一連の冠状切片のAFOG染色(dpci)。セクションは、最初と最後のパネルの上部に示されているように、背側から腹側に向かっています。セクションは隣接しておらず、それらの間には約150μmの間隔があります。損傷していない筋肉は筋肉のオレンジ色の染色によって検出されますが、損傷した組織はこの染色がなく、灰色がかって見えます(破線で囲まれた領域)。皮膚などのコラーゲン含有組織は青色に染色されています。脊髄は棒状の構造として現れ、赤く染まっています。魚の数、n = 4。 この図の拡大版を表示するには、ここをクリックしてください。
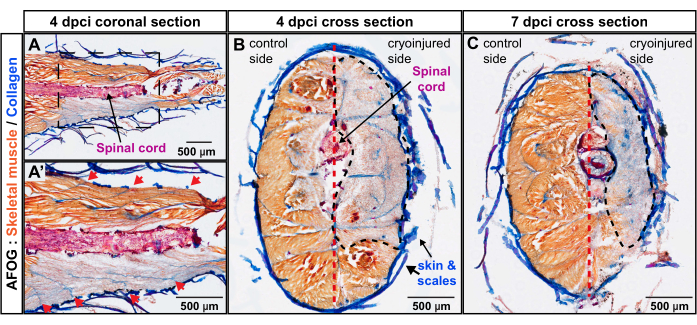
図3:AFOG染色を用いた尾柄の損傷の深さの評価。 (A,A')冠状断面は脊髄(赤く染まった水平棒)の高さにあります。下の画像は、上の画像の枠で囲まれた拡大領域を示しています。連続するミオメア境界は、脊髄に対して斜めに配置されたコラーゲン状の縞模様(青)として現れる(拡大画像A'の赤い矢印)。(B,C)断面には、オレンジ色に染まった筋肉のある無傷の脇腹と、灰色がかった染色のある凍結傷の脇腹が表示されます。損傷した領域は黒い破線で囲まれています。垂直セプタム(赤い破線で描かれている)は、体をコントロール側と凍結損傷側に細分化します。魚の数、n = 4時点あたり。この図の拡大版を表示するには、ここをクリックしてください。
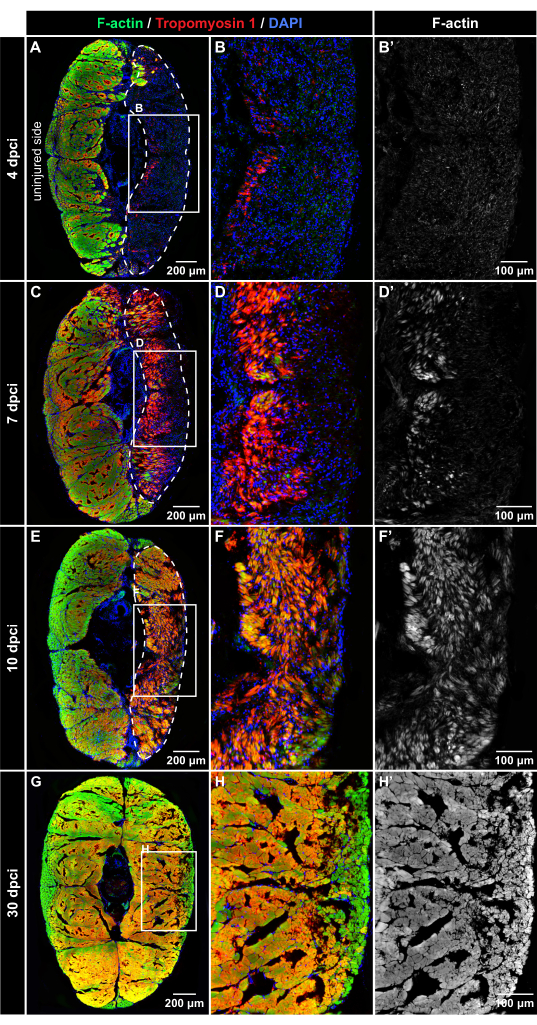
図4:凍結損傷後の筋タンパク質の免疫蛍光検出。パネルの左側および上部にラベル付けされた4 dpci、7 dpci、10 dpci、および30 dpciでの断面の蛍光染色(A-B ́)。4 dpciでは、損傷した組織(破線で囲まれた部分)はDAPI陽性(青)ですが、ファロイジン染色(緑)またはトロポミオシン-1免疫反応性(赤)がなく、凍結損傷後の筋線維の変性を示唆しています。(C-D')7 dpciでは、両方の筋肉マーカーが負傷領域に徐々に出現し、再生過程を示します。トロポミオシン-1は、新しく形成された繊維においてF-アクチンよりも強く見える。(E-F')10 dpciでは、損傷ゾーンは、F-アクチンと比較してより高い強度のトロポミオシン-1免疫反応性を示す新しい筋線維で満たされます。(G-H')30 dpciでは、体の両側に同様のパターンの筋線維が検出されます。パネル A、C、E、H のフレームは、右側の隣接する画像で拡大された領域を囲みます。ミオメアの外側で蛍光を発する真皮の鱗屑は、Adobe Photoshopを使用して画像から消去されました。魚の数、n = 4時点あたり。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ゼブラフィッシュは、筋肉再生のメカニズムを研究するためのアナムニオテ脊椎動物モデル生物を提供します。レーザーアブレーションまたは刺し傷などの既存の損傷方法のほとんどは、比較的軽微な組織破壊をもたらす20、21、22、23。外眼筋26では大切除が行われている。しかし、この外科的アプローチは、体壁を切断することによる健康被害のため、おそらく外側の筋肉組織にはあまり適していないでしょう。このような侵襲的な処置を避けるために、このプロトコルは、それにもかかわらず、尾柄に深刻な損傷をもたらす、より軽度の損傷について説明しています。このアプローチは、体の片側にあるいくつかの筋腫を非常に正確に標的にすることを可能にする表面的な操作に依存しています。凍結損傷モデルの強みは、その再現性と広範な筋肉変性を引き起こす能力にあります。これらの強みに基づいて、このモデルは、体が重大な筋肉の喪失にどのように反応するかを研究するための新しいパスを提供します。
極端な寒さの適用は熱ショックを引き起こし、それは影響を受けた筋肉組織の原形質膜および細胞小器官を破壊する27。その結果、損傷した筋線維は「偶発的な」細胞死を経験します28。その結果、損傷した組織は、創傷クリアランスの自然なメカニズムによって再吸収され得る。ゼブラフィッシュは、予冷されたプローブが正確な期間にわたって体に正しく配置されていたため、この研究の生存率はほぼ100%であったため、凍結損傷手順によく耐えます。ただし、傷が広すぎる場合(たとえば、圧力をかけすぎたり、凍結損傷の持続時間が長すぎたりした場合)、魚は手順の直後に異常な水泳運動を示す可能性があり、動物は人道的なエンドポイントとして安楽死させる必要があります。他の魚種の場合、クライオプローブへの曝露時間は体のサイズに応じて調整する必要があります。
凍結損傷後、魚は異常な動きの症状なしに水泳活動を再開することができます。ただし、凍結損傷を受けた魚は、対照魚よりも動的に泳ぐことができず、軽度の障害を示しています。凍結損傷後のさまざまな時点での魚の行動のさらなる定量化は、水泳パフォーマンスの時間的変化を決定するために必要になります。
尾柄の他の非筋肉組織に対する凍結損傷法の効果はまだ解明されていません。明らかに、最も外側の体層(すなわち、皮膚)は、処置によって損傷を受ける。これに関連して、凍結損傷法は、創傷治癒、スケール再生、および色素沈着パターンの回復を研究するための新しい戦略を提供することができます。さらに、筋腫の血管系と神経支配も凍結損傷の影響を受ける可能性があり、これらのトピックはさらなる調査が必要です。
凍結損傷モデルは、ゼブラフィッシュの心臓再生を調査するために以前に使用されてきました13、14、15、29。この方法は、コラーゲンに富む瘢痕の一過性の沈着のために心室切除方法10と比較していくつかの利点を示し、これはヒトにおける梗塞治癒応答をよりよく模倣する30。驚くべきことに、ゼブラフィッシュは複数の凍結損傷の後に心臓を再生することができます31。興味深いことに、凍結損傷はゼブラフィッシュヒレにも適用されており、組織溶解プロセスをもたらしています12。古典的なひれ切断とは対照的に、残りの凍結損傷した切り株には、死んだ物質と健康な細胞の混合物で歪んだマージンが含まれています。ゼブラフィッシュの臓器である心臓とヒレの両方を用いた研究は、大規模な組織損傷の後でも元の機能成分を回復するゼブラフィッシュの強力な能力を明らかにしました。凍結損傷した骨格筋が修復プロセスと再生プロセスの間の相互作用を活性化するかどうかは、将来の研究を保証します。
開示事項
著者は開示するものは何もありません。
謝辞
魚の世話をしてくれたV.ツィンマーマン、そしてこのプロジェクトの開始と予備的な結果について、トーマス・ビース博士、キャサリン・フェファーリ博士、リー・ギゴンに感謝します。この研究は、スイス国立科学財団(助成金番号310030_208170)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Program | |||
| ImageJ | National Institutes of Health (NIH) | ||
| Photoshop Version 23.5.3 | Adobe | ||
| Material/ Equipment | |||
| 35/10 mm Petri Dish | Greiner Bio-one | Item No.: 627102 | |
| Camera | Sony | / | HDR-PJ410 |
| Cryostat | Histcom | HRA C50 | |
| Formaldehyde ~36% | Sigma-Aldrich | 47630 | |
| Macro 50 mm f/2.8 EX DG lens | Sigma | / | Discontinued lense |
| Peel-A-Way Embedding Truncated Molds T8 | Polyscience, Inc. | 18985 | |
| Slides Superfrost Plus | Fisher Scientific | 12-550-15 | |
| Sponge | any | any | flat sponge, c.a. 7cm x 3 cm x 1 cm |
| Stainless steel cryoprobe | Custom-made | / | specifics in the article |
| Sucrose | Sigma-Aldrich | 84100 | |
| Surgical scissors | Any | / | |
| TCS SP2 | Leica | / | Discontinoued product |
| Tissue-Tek O.C.T. compound | Sakura Finetek | 4583 | |
| Tricaine (Anestethic) | Sigma | E10521 | |
| Dyes and Antibodies | |||
| Dapi | Sigma | 10236276001 | Concentration: 1/2000 |
| Phalloidin-Atto-565 (F-actin) | Sigma | 94072 | Concentration: 1 / 500 |
| Tropomyosin (TPM1) | DHSB | CH1 | Concentration: 1 / 50 |
| Recipies/Solutions | |||
| 1x PBS | 123 mM NaCl | Sigma | |
| 2.7 mM KCl | Sigma | ||
| 10 mM Na2HPO4 | Sigma | ||
| 1.8 mM KH2PO4 | Sigma | ||
| AFOG solution | 3 g Fuchsin | Fisher Scientific | |
| 2 g Orange G | Sigma | ||
| 1 g Anilin blue | Fulka AG | ||
| 200 ml acifidied distilled H2O (pH 1.1) |
参考文献
- Muneoka, K., Allan, C. H., Yang, X., Lee, J., Han, M. Mammalian regeneration and regenerative medicine. Birth Defects Research Part C: Embryo Today: Reviews. 84 (4), 265-280 (2008).
- Carlson, B. M. Some principles of regeneration in mammalian systems. Anatomical Record. Part B, New Anatomist. 287 (1), 4-13 (2005).
- Dumont, N. A., Bentzinger, C. F., Sincennes, M. -. C., Rudnicki, M. A. Satellite cells and skeletal muscle regeneration. Comprehensive Physiology. 5 (3), 1027-1059 (2015).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692 (2021).
- Tulenko, F. J., Currie, P., Cartner, S. C. Zebrafish myology. The Zebrafish in Biomedical Research. , 115-121 (2020).
- Siegel, A. L., Gurevich, D. B., Currie, P. D. A myogenic precursor cell that could contribute to regeneration in zebrafish and its similarity to the satellite cell. The FEBS Journal. 280 (17), 4074-4088 (2013).
- Corona, B. T., Wenke, J. C., Ward, C. L. Pathophysiology of volumetric muscle loss injury. Cells Tissues Organs. 202 (3-4), 180-188 (2016).
- Pfefferli, C., Jaźwińska, A. The art of fin regeneration in zebrafish. Regeneration. 2 (2), 72-83 (2015).
- Sehring, I. M., Weidinger, G. Recent advancements in understanding fin regeneration in zebrafish. WIREs Developmental Biology. 9 (1), 367 (2020).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Sanz-Morejón, A., Mercader, N. Recent insights into zebrafish cardiac regeneration. Current Opinion in Genetics & Development. 64, 37-43 (2020).
- Chassot, B., Pury, D., Jaźwińska, A. Zebrafish fin regeneration after cryoinjury-induced tissue damage. Biology Open. 5 (6), 819-828 (2016).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, A. The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11, 21 (2011).
- Schnabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS One. 6 (4), e18503 (2011).
- Gonzalez-Rosa, J. M., Martin, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138 (9), 1663-1674 (2011).
- Ryan, R., Moyse, B. R., Richardson, R. J. Zebrafish cardiac regeneration-Looking beyond cardiomyocytes to a complex microenvironment. Histochemistry and Cell Biology. 154 (5), 533-548 (2020).
- Jaźwińska, A., Sallin, P. Regeneration versus scarring in vertebrate appendages and heart. Journal of Pathology. 238 (2), 233-246 (2016).
- Alexander, R. The orientation of muscle fibres in the myomeres of fishes. Journal of the Marine Biological Association of the United Kingdom. 49, 163-290 (1969).
- Morin-Kensicki, E. M., Melancon, E., Eisen, J. S. Segmental relationship between somites and vertebral column in zebrafish. Development. 129 (16), 3851-3860 (2002).
- Berberoglu, M. A., et al. Satellite-like cells contribute to pax7-dependent skeletal muscle repair in adult zebrafish. Developmental Biology. 424 (2), 162-180 (2017).
- Montandon, M., Currie, P. D., Ruparelia, A. A. Examining muscle regeneration in zebrafish models of muscle disease. Journal of Visualized Experiments. (167), e62071 (2021).
- Pipalia, T. G., et al. Cellular dynamics of regeneration reveals role of two distinct Pax7 stem cell populations in larval zebrafish muscle repair. Disease Models & Mechanisms. 9 (6), 671-684 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Kaliya-Perumal, A. -. K., Ingham, P. W. Musculoskeletal regeneration: A zebrafish perspective. Biochimie. 196, 171-181 (2022).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. 54 (3), 213-224 (2019).
- Saera-Vila, A., et al. Myocyte dedifferentiation drives extraocular muscle regeneration in adult zebrafish. Investigative Ophthalmology & Visual Science. 56 (8), 4977-4993 (2015).
- Baust, J. G., Gage, A. A. The molecular basis of cryosurgery. BJU International. 95 (9), 1187-1191 (2005).
- Galluzzi, L., et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666 (2012).
- Chablais, F., Jaźwińska, A. The regenerative capacity of the zebrafish heart is dependent on TGFbeta signaling. Development. 139 (11), 1921-1930 (2012).
- Bise, T., Sallin, P., Pfefferli, C., Jaźwińska, A. Multiple cryoinjuries modulate the efficiency of zebrafish heart regeneration. Scientific Reports. 10 (1), 11551 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved