Method Article
زرع الكبد التقويمي الناجح في الفئران باستخدام تصوير الأوعية المقطعي المحوسب
In This Article
Summary
في هذا البروتوكول ، نناقش تنفيذ نموذج لزراعة الكبد التقويمية الناجحة (OLT) في الفئران. بالإضافة إلى ذلك ، تتم مناقشة المواد المساعدة لمزيد من تحليل سالكية الطعم الخيفي بعد نجاح OLT في الماوس ، وتحديدا باستخدام فحوصات التصوير المقطعي المحوسب (microCT).
Abstract
تصوير الأوعية بالتصوير المقطعي المجهري (microCT) هو مورد لا يقدر بثمن للباحثين. سمحت التطورات الجديدة في هذه التكنولوجيا بالحصول على صور عالية الجودة للأوعية الدموية الدقيقة وهي أدوات عالية الدقة في مجال زراعة الأعضاء. في هذا النموذج من زراعة الكبد التقويمية (OLT) في الفئران ، يتيح microCT الفرصة لتقييم مفاغرة الطعم الخيفي في الوقت الفعلي وله فائدة إضافية تتمثل في عدم الاضطرار إلى التضحية بالحيوانات الدراسية. يؤدي اختيار التباين ، بالإضافة إلى إعدادات الحصول على الصور ، إلى إنشاء صورة عالية الدقة ، مما يمنح الباحثين معلومات لا تقدر بثمن. وهذا يسمح بتقييم الجوانب التقنية للإجراء بالإضافة إلى تقييم العلاجات المختلفة على مدى فترة زمنية طويلة. في هذا البروتوكول ، نقوم بتفصيل نموذج OLT في الفئران بطريقة تدريجية وأخيرا نصف بروتوكول microCT الذي يمكن أن يعطي صورا عالية الجودة ، مما يساعد الباحثين في التحليل المتعمق لزراعة الأعضاء الصلبة. نحن نقدم دليلا خطوة بخطوة لزراعة الكبد في الماوس ، بالإضافة إلى مناقشة موجزة لبروتوكول لتقييم سالكية الكسب غير المشروع من خلال تصوير الأوعية بالأشعة المقطعية الدقيقة.
Introduction
الزرع هو العلاج الفعال الوحيد لمرض الكبد في المرحلة النهائية. لا يمكن إنكار أن فائدة زراعة الكبد ممتازة ، حيث يبلغ متوسط البقاء على قيد الحياة 11.6 سنة مقابل 3.1 سنة في قائمة الانتظار1. ومع ذلك ، هناك قيود كبيرة تحد من التطبيق الواسع لزراعة الكبد ، وتشمل الأهم من ذلك ، نقص الأعضاء المانحة المناسبة وعالية الجودة. وبالتالي ، سيتطلب توسيع مجموعة الأعضاء المانحة استراتيجيات مبتكرة تسمح باستخدام الطعم الخيفي الذي يعتبر حاليا غير مناسب اليوم ، مما يزيد من هامش الأمان للزرع. لذلك ، لتحسين الوصول إلى زراعة الكبد ، لا بد من إجراء دراسات قبل السريرية في الصغيرة.
أهمية خاصة لأبحاث زرع الأعضاء هي في الجسم الحي نماذج من زرع. زرع الكبد التقويمي للفأر (OLT) موجود منذ ما يقرب من 30 عاما2 وهو أمر حيوي لدراسة العديد من جوانب الزرع ، بما في ذلك توصيف الاستجابات المناعية ، وإصابة نقص التروية ، والرفض الحاد ، والآثار العلاجية للعوامل الجديدة ، والبقاء على قيد الحياة على المدى الطويل3،4،5،6،7. يعد استخدام الفئران لدراسة الزرع أمرا حيويا لأنه يسمح باستخدام خطوط الفئران المعدلة وراثيا لدراسة تأثير مسارات جزيئية محددة على نتائج الزرع. تم وصف البروتوكولات المعمول بها لزراعة كبد الفأر بشكل جيد سابقا 8,9.
توجد طرق متعددة للمفاغرة للوريد الأجوف السفلي فوق وتحت الكبد (IVC) والوريد البابي (PV) والقناة الصفراوية المشتركة (CBD). يعتمدون عادة على مفاغرة اليد أو تقنية الكفة الوعائية المعدلة المشابهة لزراعة رئة الفئران10،11،12. خطوة مهمة في الدراسة طويلة الأجل وبقاء الفئران المتلقية ، بالإضافة إلى تطوير برنامج مستدام لزراعة كبد الفأر ، هي القدرة على تقييم هذه المفاغرة الحرجة. غالبا ما تعتمد طرق التصوير لتقييم سالكية الطعم الخيفي للكبد على الموجات فوق الصوتية والتصوير المقطعي المحوسب (CT) في الإعداد السريري13,14. يتمتع التصوير المقطعي المحوسب بميزة واضحة على الموجات فوق الصوتية حيث يمكن أن يوفر مناظر للبطن بالكامل لتشمل كل مفاغرة ، على الرغم من أن الحصول على هذه المشاهدات بالموجات فوق الصوتية قد يكون صعبا بشكل خاص في الصغيرة. تم تخصيص أبحاث وموارد كبيرة لتطوير التصوير المقطعي المحوسب الدقيق لغرض تعزيز الدراسات على والمعلومات التي يمكننا جمعها من هذه النماذج للإصابة والمرض15،16. نصف هنا بروتوكولا لزراعة كبد الفأر التقويمي (الشكل 1) ونصف بإيجاز بروتوكولا للتصوير المقطعي المحوسب لتقييم سالكية الطعم الخيفي ومتانة المفاغرة.
Protocol
تم إيواء ذكور الفئران C57BL / 6J (30 جم من وزن الجسم) في ظروف خالية من مسببات الأمراض في مرفق بمستشفى الأطفال الوطني. تم تنفيذ جميع الإجراءات بشكل إنساني وفقا للمعاهد الوطنية للصحة ودليل المجلس القومي للبحوث للرعاية الإنسانية واستخدام المختبر وبموافقة اللجنة المؤسسية لرعاية واستخدام في مستشفى الأطفال على الصعيد الوطني (بروتوكول IACUC AR17-00045). راجع جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والأدوات والمعدات المستخدمة في هذا البروتوكول.
1. الإعداد الأولي لجراحة زرع الأعضاء
- إعداد الأجهزة الجراحية.
- قم بإعداد أجهزة المراقبة الجراحية (مثل جهاز مراقبة معدل ضربات القلب ، وثور النبض ، ونظام المراقبة المعياري) وآلات التخدير.
- إذا كان ذلك متاحا ، قم بتشغيل لوحة التسخين الجراحية إلى 42 درجة مئوية.
- تأكد من تشغيل آلات التهوية والتخدير لتدفئة مبخر الأيزوفلوران. املأ خزان التخدير ب 30 مل من الأيزوفلوران السائل وتأكد من توصيل جهاز التنفس الصناعي بالأكسجين.
ملاحظة: في هذا البروتوكول ، نحن لا تنبيب. استخدم فقط مخروط الأنف للأكسجين.
- سجل وزن جسم الفئران المتلقية والمانحة.
- قم بتشغيل المجهر الجراحي عالي الطاقة واضبط الارتفاع والتركيز حسب تفضيلات الجراح. التأكد من تشغيل الأجهزة الجراحية المتبقية (أي جهاز الكي الكهربائي).
- إعداد ووضع الأدوات الجراحية ، وكذلك العلاقات الجراحية من 10-0 النايلون (الشكل 2).
ملاحظة: تم تعقيم جميع الأدوات الجراحية عند 121 درجة مئوية لمدة 30 دقيقة. بالإضافة إلى ذلك ، يمكن أن تكون التكوينات المختلفة للأدوات الجراحية فعالة بنفس القدر. - تحضير الأصفاد للوريد البابي (PV) ودعامات القناة الصفراوية المشتركة (CBD) (الشكل 3). ضع قسطرة وعائية ، وكذلك PE10 ، على سطح معقم تحت المجهر عالي الطاقة. باستخدام شفرة جراحية # 11 ، قم بقطع قسطرة وعائية لتشكيل صفعة بطول 1.5 مم مع علامة تبويب حوالي 0.75 مم في الجزء العلوي من جسم الكفة ؛ قطع أنابيب البولي إيثيلين (PE10) إلى طول 2.5 مم. قم بتخزين الأساور والدعامات في محلول ملحي معقم حتى تصبح جاهزة للاستخدام.
ملاحظة: يستخدم نموذج الزرع هذا قسطرة وعائية 20 جيجا لصنع أصفاد لإعادة بناء الكهروضوئية ، بالإضافة إلى أنبوب بولي إيثيلين 10 (PE10) لإعادة بناء اتفاقية التنوع البيولوجي. جميع المفاغرة الأخرى مخيطة يدويا. - إعداد الحلول. قم بإعداد حقن الهيبارين الذي سيتم تسليمه عند 100 وحدة في 0.5 مل من محلول الهيستيدين - التربتوفان - كيتوغلوتارات (HTK). قم بتخزين محلول ملحي ، هيبارين مالح ، PBS ، و HTK على الجليد.
2. شراء الفئران المانحة
- حث التخدير في الفأر المانح عن طريق وضعه في غرفة استنشاق الأيزوفلوران. تأكد من أن تركيز الأيزوفلوران حوالي 2.5٪ مع تدفق أكسجين يبلغ 2 مل / دقيقة. انتظر 5 دقائق حتى تتطور طائرة التخدير الجراحية. لضمان المستوى المناسب من التخدير ، قرصة إصبع القدم الماوس لإثارة رد فعل. يشير عدم وجود رد فعل إلى أن المستوى المناسب من التخدير قد تم الوفاء به.
- حلق بطن الفأر باستخدام كليبرز الإلكترونية وضع الماوس في وضع ضعيف على لوحة الاحترار. تنظيف البطن مع البوفيدون اليود ، ثم 70 ٪ من الإيثانول. ضع مرهم العيون تحت عيون الفئران لمنع الجفاف.
- ضع الفأر تحت المجهر عالي الطاقة وحافظ على الفأر تحت التخدير باستخدام استنشاق الأيزوفلوران بتركيز 2٪ مع تدفق أكسجين قدره 2 مل / دقيقة.
- إجراء بضع البطن خط الوسط مع مقص (تفضيل الجراح) من عملية الخنجري إلى الارتفاق العانة. بعد ذلك ، قم بإجراء شق عرضي إضافي لإنشاء نمط "يشبه الصليب" أدنى من الأضلاع. باستخدام ملقط مرقئ البعوض ، تراجع عن عملية الخنجري لتحقيق التعرض الكافي لمحتويات البطن.
ملاحظة: يمكن تأمين الملقط حسب تفضيل الجراح. - أحشاء الأمعاء ووضعها على الجانب الأيسر من تجويف البطن في اسفنجة شاش مبللة. تعبئة الكبد عن طريق إنزال جميع المرفقات الرباطية.
- كشف الشريان الكبدي المناسب (pHA). قم بهيكلة الوعاء باستخدام ملقط منحنى واربطه بخياطة نايلون 10-0.
- تشريح كامل طول اتفاقية التنوع البيولوجي باستخدام مزيج من تشريح حاد وحاد. قم بإجراء بضع القناة (كبير بما يكفي لدعامة CBD) بالقرب من الحدود العلوية للبنكرياس قدر الإمكان لإعطاء طول مناسب للاستخدام في المستقبل (~ 1 سم من الحد السفلي للكبد). أدخل دعامة القناة الصفراوية في اتفاقية التنوع البيولوجي باستخدام ملقط ناعم وقم بتثبيتها بخياطة نايلون 10-0. اربط الجانب البعيد من اتفاقية التنوع البيولوجي باستخدام خياطة نايلون 10-0 (الشكل 4).
- اسحب الفص الكبدي الأيمن نحو الخنجري باستخدام إسفنجة شاش مبللة وفضح IVC. تعبئة IVC تحت الكبد (IHIVC) بعيدا عن الصفاق الخلفي وكي الوريد الكظري الأيمن باستخدام جهاز الكي المحمول باليد (انظر جدول المواد).
- تشريح الشريان الكلوي الأيمن والوريد و ligate مع 7-0 و 10-0 النايلون ، على التوالي. قطع الوريد الكلوي الأيمن والشريان والمرفقات الرباطية المتبقية. أخيرا ، قم بإزالة الكلية اليمنى.
ملاحظة: يتم ذلك للحصول على تعرض أفضل عند قطع IHIVC أخيرا. - حقن 0.5 مل من HTK البارد بمحلول الهيبارين 100 U من خلال PV بإبرة 30 جرام. انتظر 1 دقيقة حتى يوزع الهيبارين بشكل منهجي. قطع الوريد البابي متفوقا فقط على الوريد الطحال والوريد المساريقي العلوي.
- حقن ببطء محلول حفظ HTK البارد مع الهيبارين في IHIVC بإبرة 30 جم لتغذية الكبد المتبرع. توقف عن حقن المحلول بمجرد أن يصبح السائل القادم من الكهروضوئية صافيا. بعد اكتمال الحقن ، ضع مشبكا صغيرا على IHIVC أعلى مباشرة من الوريد الكلوي الأيمن واقطعه بشكل أدنى من المشبك. بمجرد اكتمال هذه الخطوة ، قم بإيقاف تشغيل جهاز التنفس الصناعي وإيقاف الأيزوفلوران لأن قد تم قتله رحيما للتو.
- قطع اتفاقية التنوع البيولوجي بعيدا إلى الدعامة التي تم وضعها مسبقا في الخطوة 2.7. بالإضافة إلى ذلك ، حدد القناة الكيسية ، واربط القناة بخياطة نايلون 10-0. بعد ذلك ، أمسك قبة المرارة بزوج من الملقط ، وقم بتشريحها خالية من حفرة المرارة باستخدام مزيج من التشريح الحاد والحاد. بمجرد تعبئة المرارة بشكل كاف ، باستخدام مقص زنبركي ، أكمل استئصال المرارة عن طريق قطع القناة الكيسية فوق الخيط الذي تم وضعه مسبقا.
- سحب الكبد بشكل سفلي لفضح IVC فوق الكبدي (SHIVC). قطع SHIVC مع إيلاء اهتمام خاص لإعطاء طول مناسب للمفاغرة في المتلقي.
- تشريح المرفقات الرباطية الإضافية الحرة للكبد وتسليم الكبد المانحة خارج الجسم الحي ووضع العضو في وعاء مع محلول ملحي بارد.
3. إعداد الجدول الخلفي من الطعم الخيفي الكبد
- ضع الثلج في وعاء معزول ، وضع طبق بتري على طبقة الثلج. ملء طبق بتري مع المياه المالحة الباردة. ضع طعم الكبد الخيفي في الطبق بحيث يتعرض السطح الحشوي.
- ضع PV من خلال الكفة المحددة مسبقا ، وحرك الوريد بحيث يتعرض السطح البطاني الداخلي. تأمين الكفة مع خياطة النايلون 10-0. تأكد من أن الخيط يقع داخل أخاديد الكفة للحصول على أفضل النتائج (الشكل 5).
- اضبط طعم الكبد الخيفي لفضح SHIVC ووضع اثنين 8-0 خيوط النايلون في اتجاه الساعة 3 و 9 ، على التوالي ، للمفاغرة النهائية في المتلقي. اضبط طعم الكبد مرة أخرى لفضح IHIVC ووضع اثنين 8-0 خيوط النايلون في اتجاه الساعة 3 و 9 ، على التوالي ، للمفاغرة النهائية في المتلقي.
4. عملية المستلم
ملاحظة: بما أن هذه عملية معقمة، استخدم القفازات ومعدات الحماية الشخصية المناسبة وتناول المضادات الحيوية. تطبيق 0.1 ملغ/ كغ من البوبرينورفين تحت الجلد كتسكين قبل الجراحة وقت الجراحة.
- فضح الأس الهيدروجيني كما هو الحال في عملية المتبرع ؛ استخدم فقط بضع البطن في خط الوسط بدلا من شق البطن الموصوف سابقا.
- تعبئة الكبد وقطع جميع المرفقات الرباطية. بالإضافة إلى ذلك ، اربط الأوعية الحجيبية اليسرى والمريئية بخياطة 10-0 نايلون.
- تراجع الكبد بشكل سفلي وتشريح حرر SHIVC من خلف الصفاق. بعد ذلك ، تراجع الكبد بشكل متفوق وتشريح IHIVC من خلف الصفاق. قم بكي الأوردة الصغيرة والأوردة القطنية حسب الضرورة باستخدام نفس التقنية الموضحة سابقا.
- الكي الوريد الكظري الأيمن مع الكي باليد وفضح هيلوم الكبد. اربط الأس الهيدروجيني بخياطة 10-0 نايلون. بعد ذلك ، قم بتشريح CBD خالية من PV وربط CBD بخياطة 7-0 بالقرب من تشعب اتفاقية التنوع البيولوجي لإعطاء طول مناسب لمفاغرة CBD.
- استخدم مشبكا صغيرا لربط IVC بالأشعة تحت الكبدية وربط PV مؤقتا بخياطة 7-0. ابدأ المرحلة الكبدية. وقف استنشاق إيزوفلوران.
ملاحظة: بعد تثبيت الوريد البابي و IVC ، يتم حظر العودة الوريدية الكبدية تماما في المرحلة الكبدية. يتم استقلاب إيزوفلوران المخدر المستنشق عن طريق الكبد. وبالتالي يتم إيقاف استنشاقه مؤقتا لأن التراكم يمكن أن يؤدي إلى انهيار قلبي رئوي. - من خلال PV الكبد الأصلي ، حقن 0.5 مل من الهيبارين المالحة بإبرة 30 جرام لطرد العضو.
- ضع المشابك الوعائية الدقيقة على SHIVC و IHIVC بشكل قريب وبعيد قدر الإمكان لترك طول مناسب للمفاغرة. قطع SHIVC الأصلي ، IHIVC ، PV (بالقرب من الخيط الذي تم وضعه مسبقا) ، وأي مرفقات رباطية متبقية بالكبد الأصلي للمتلقي وتسليم الكبد الأصلي خارج الجسم الحي.
ملاحظة: يجب أن يكون مشبك IHIVC فوق الوريد الكلوي الأيمن. - ضع الطعم الخيفي للكبد المتبرع داخل تجويف البطن واسحب هيلوم الطعم الخيفي للمتبرع لكشف PV. اغسل كل من المتبرع و PV الأصلي ب 0.5 مل من محلول الهيبارين الملحي باستخدام إبرة 30 جم لإزالة الهواء من الأوعية لتجنب انسداد الهواء. بعد ذلك ، أدخل الكفة المصنوعة مسبقا من PV المانحة في تجويف PV الكبد المتلقي وإذا لزم الأمر ، ضع خيوط البقاء للمساعدة في مفاغرة (8-0 خياطة). تأمين مفاغرة مع خياطة 7-0 (الشكل 6).
- تدوير اللوحة 180 درجة. إجراء مفاغرة مخيط يدويا مع خياطة 10-0 نايلون مع المتبرع و SHIVC الأصلي. بعد الانتهاء من مفاغرة الجدار الخلفي ، اغسل ب 0.5 مل من محلول الهيبارين الملحي لإزالة الهواء لتجنب انسداد الهواء. مفاغرة كاملة للجدار العلوي (الشكل 7).
- إزالة خياطة ربط PV أولا ؛ بعد ذلك ، قم بإزالة المشابك الوعائية من SHIVC لبدء إعادة التروية. إنهاء المرحلة الكبدية وإعادة تشغيل استنشاق إيزوفلوران. إجراء مفاغرة خياطة يدوية بخياطة من النايلون 10-0 ، بنفس طريقة مفاغرة SHIVC ، لإعادة بناء IHIVC. بعد الانتهاء من إعادة الإعمار ، قم بإزالة المشبك الصغير من IHIVC الأصلي والمانح لإعادة تركيبه (الشكل 8).
- قم بإجراء مفاغرة CBD عن طريق إنشاء بضع القناة على المتلقي CBD بالقرب من الخيط الذي تم وضعه مسبقا. أدخل الدعامة في اتفاقية التنوع البيولوجي المانحة في تجويف CBD المتلقي وقم بتأمين المفاغرة بخياطة 10-0 (الشكل 9).
- ري تجويف البطن مع 1 مل من المياه المالحة. تحقق من الارقاء وكي أي أوعية نزيف متبقية. أغلق شق البطن في طبقتين باستخدام خياطة 6-0.
- ضع في حاضنة دافئة (42 درجة مئوية) للتعافي ولا تترك دون مراقبة حتى يستعيد وعيه ونشاطه الكافي. يتم تطبيق 0.1 ملغ/ كغ من البوبرينورفين تحت الجلد بعد الجراحة ويستمر التطبيق كل 8-12 ساعة لمدة 48 ساعة بعد الجراحة. بالإضافة إلى ذلك ، يتم تطبيق كاربروفين (0.2 مل مذاب في 400 مل من الماء) من خلال زجاجة ماء المتلقي لمدة تصل إلى 7 أيام بعد الجراحة. راقب المتلقي لمدة 4-5 ساعات ، وبمجرد أن يتعافى تماما ، أعده إلى موقع السكن لأنه أصبح الآن آمنا مع الأخرى.
ملاحظة: يمكن إعطاء مسكنات الألم والمضادات الحيوية وفقا لتوصيات لجنة أخلاقيات المحلية.
5. تصوير الأوعية المجهرية للفأر
- بعد مراقبة الماوس لفترة الدراسة المحددة مسبقا ، قم بإعداد الماوس لتقييم سالكية الطعم الخيفي باستخدام تصوير الأوعية بالأشعة المقطعية الدقيقة.
- تأكد من تشغيل آلات التهوية والتخدير لتدفئة مبخر الأيزوفلوران. املأ خزان التخدير ب 30 مل من الأيزوفلوران السائل ، وتأكد من توصيل جهاز التنفس الصناعي بالأكسجين. قم بتشغيل الماسح الضوئي microCT وتأكد من أن جميع البرامج تعمل بشكل صحيح.
- ابدأ برنامج الاستحواذ على نظام الماسح الضوئي microCT.
- على شاشة وحدة التصوير المقطعي المحوسب الدقيق، انقر فوق تهيئة النظام واختر وضع التصوير المقطعي المحوسب.
- إخراج السرير نعلق سرير الماوس وقفله.
- قم بتشغيل لوحة التسخين إلى 42 درجة مئوية لقفص الاسترداد.
- املأ حقنة سعة 1 مل ب 100 ميكرولتر من عامل التباين CT. قم بتوصيل إبرة قياس 30 للإعطاء الوريدي للتباين في المستقبل. تأكد من عدم وجود فقاعات هواء في المحقنة.
- ضع الماوس في نظام تقييد الوريد الذيل. بمجرد أن يصبح الماوس داخل نظام التقييد تماما ، أغلق بوابة النظام ، واترك الذيل يسقط عموديا ، وامسحه بعناية بمحلول كحول (70٪ إيثانول).
ملاحظة: يمكن زيادة النجاح في قنية الوريد الذيل عن طريق تدفئة ذيل عن طريق الاحتفاظ به في يد قفاز لعدة دقائق. - أمسك الذيل باتجاه الجانب البعيد ، وضع إصبعين (السبابة والوسط) حول الذيل القريب من موقع الحقن المخطط. ضع الجانب البعيد من الذيل (أسفل موقع الحقن) بين الإبهام والبنصر.
- باستخدام كلتا المجموعتين من الأصابع ، اضغط قليلا وأدخل الإبرة في الوريد باستخدام عمق ضحل ، مع التأكد من أن المحقنة والإبرة موازية للذيل. أثناء تحرير ضغط السبابة عند الذيل القريب ، يتم تطبيق عامل التباين CT عن طريق الوريد. تجنب الشفط باستخدام المحقنة لأن ذلك قد يتسبب في انهيار الوريد.
ملاحظة: لا ينبغي الشعور بأي مقاومة أثناء الحقن إذا تم وضع الإبرة بشكل مناسب في الوريد. إذا كانت هناك مقاومة ، فقم بإزالة الإبرة وإعادة إدخالها فوق موقع الحقن الأصلي. إذا فشل قنية الوريد حتى بعد محاولتين ، استبدل الإبرة. - بعد حقن التباين بنجاح وإزالة الإبرة ، ضع ضغطا لطيفا على موقع الحقن باستخدام شاش معقم لوقف النزيف.
- انقل الماوس إلى غرفة استنشاق الأيزوفلوران واضبط التركيز على 2.5٪ مع تدفق أكسجين يبلغ 2 مل / دقيقة وانتظر 3-4 دقائق. بمجرد إنشاء مستوى التخدير ، انقل الماوس بسرعة إلى سرير الماسح الضوئي microCT وضعه في وضع الانبطاح على طاولة الماسح الضوئي (الشكل 10).
- تغطية عيون مع كمية مناسبة من مرهم العيون. ضع مخروط الأنف بشكل مناسب فوق وتأكد من تدفق الهواء والإيزوفلوران بشكل صحيح عبر مخروط الأنف. استخدم نفس معلمات التخدير الموضحة سابقا (الخطوة 5.12). قم بتشحيم وإدخال مسبار درجة حرارة المستقيم لمراقبة درجة حرارة جسم باستمرار أثناء التصوير.
- ضع جهاز التنفس الصناعي على اتصال بالماوس.
- استخدم الشريط اللاصق لتوصيل وسادة تخطيط القلب بالأطراف الخلفية اليسرى واليمنى واليسرى. استخدم جل الموجات فوق الصوتية لتحسين الإشارة بين وسادة تخطيط القلب والجلد.
- تحقق من تخطيط القلب وإشارة الجهاز التنفسي على برنامج الكمبيوتر لضمان رؤية مجمعات QRS المناسبة على الشاشة. للقيام بذلك ، تحقق من Logic Lead في علامة التبويب إعداد المصدر ، واختر العميل المتوقع الذي يوفر أوضح منحنى ECG.
ملاحظة: تتوافق الخيوط المنطقية مع وسادات تخطيط القلب الثلاثة المتصلة بالصدر الأيمن والأيسر وأسفل الساق. يمثل كل عميل متوقع منحنى تخطيط القلب. - اضبط الكسب على ارتفاع الإشارة المناسب ، وعادة ما يكون 4 أو 8 جيدا. حدد بوابة مزدوجة. ضمن علامة التبويب إعداد العرض ، اضبط إعدادات العرض للحصول على عرض إشارة واضح: حدد المربعات بجوار ECG و RESP واضبط كل منهما على 500. ضمن علامة التبويب إعداد الزناد ، تأكد من تحديد القناة أ والقناة ب و DualTrig .
- تأكد من تعيين المعلمات التالية أيضا: العتبة: عندما تنخفض الإشارة إلى ما دون هذه القيمة ؛ اضبط القيمة على 2500 ؛ التباطؤ: تأكد من أن الإشارة تعبر التباطؤ لإنشاء نقطة تشغيل برمجية تبدأ عندها دورة تشغيل جديدة ؛ اضبط القيمة على 300 ؛ التأخير: انتظر قبل إرسال الزناد ؛ اضبط القيمة على 100 ؛ منع: لا يمكن إنشاء إشارة خلال هذه الفترة ، اضبط القيمة على 200.
- تأكد من أن عتبة تخطيط القلب أقل من قيمة التباطؤ وأعلى من ذروة مقطع sT على شاشة العرض.
- تقدم إلى الماسح الضوئي واضغط على تحديث الصورة. احصل على صورة استطلاعية بالأشعة السينية للحيوان لتحديد مجال الرؤية المناسب وتغطية المسح التشريحي لصورة microCT اللاحقة.
- قم بإجراء الحصول على صور تصوير الأوعية بالتصوير المقطعي المحوسب باستخدام المعلمات التالية: التكبير: التركيز الفائق ، زاوية المسح الضوئي: مسح كامل (360) ، الطاقة: مفرد ، وضع المسح الضوئي: بوابات ، الإعداد: افتراضي (دوران كامل بزاوية 360 درجة ، الإعدادات الافتراضية لأنبوب الأشعة السينية 0.33 مللي أمبير و 55 كيلو فولت ، 0.750 درجة لكل خطوة ، إسقاط واحد لكل خطوة ، 1 × 1 تجميع ، ووقت التعرض 40 مللي ثانية ؛ البوابة المزدوجة تعني بوابات القلب والجهاز التنفسي) (الشكل 11).
- بعد الانتهاء من الفحص ، انقل إلى قفص استرداد مسخن مسبقا. بمجرد أن يتعافى تماما ، قم بنقله مرة أخرى إلى قفصه الأساسي.
- إعادة بناء صور التصوير المقطعي المحوسب باستخدام برنامج النظام. بعد تحميل الصورة ، اضبط الأشرطة الزرقاء بحيث تمتد على منطقة الاهتمام التشريحية ؛ قم بمعاينة شريحة لجعل مستوى الصوت أصغر ومقيدا بالماوس قدر الإمكان (تساعد هذه المرحلة على تقليل حجم الصورة المعاد بناؤها).
- قم بتشغيل مخطط حجم الاهتمام لتحسين حدود الصورة. اختر حجم فوكسل 40 ميكرومتر ومرشح إسقاط هان ومرشح حجم غاوسي (80 ميكرومتر). انتقل إلى خيارات متقدمة | البوابة المستندة إلى الصور وضبط نوافذ الزناد والمرحلة إلى 0.5 و 0.6 ، على التوالي ، اختر 10 مراحل لبوابات القلب ، ثم اضغط على زر إعادة بناء مستوى الصوت.
النتائج
بالنسبة لأولئك الباحثين الذين ليسوا جراحين ، أو ليسوا على دراية بالتشريح ، أو غير مرتاحين لتفسير النتائج الإشعاعية ، يجب إجراء تحليل مناسب للصور من قبل موظفين لديهم تدريب مناسب. يظهر نجاح OLT في الماوس في البروتوكول أعلاه. علاوة على ذلك ، لتعزيز مقاييس الدراسة وتقديم ملاحظات في الوقت الفعلي لنجاح عملية الزرع ، وكذلك القضاء على الحاجة إلى التشريح ، يمكن استخدام فحص تصوير الأوعية بالأشعة المقطعية الدقيقة لتوفير صور دقيقة وواضحة. الصور التمثيلية مضمنة في هذه المخطوطة (الشكل 11). يمكن رؤية صور تمثيلية للمفاغرة الفاشلة في الجسم الحي في الشكل 12.
يمكن لأولئك المطلعين على التشريح الكبدي والأوعية الدموية رؤية مفاغرة وريدية براءة اختراع من IVC. في بعض الحالات ، يمكن تصور الوريد البابي أيضا ، والذي يتم بسهولة في هذا النموذج بسبب صفعة الوريد البابي. يشير عرض المفاغرة المفتوحة إلى النجاح التقني للعملية. بالإضافة إلى ذلك ، يمكن أن توفر إعادة بناء 3D لهذه الصور معلومات إضافية للباحثين وصورة أكثر تفصيلا لتشريح الأوعية الدموية. باستخدام هذا النموذج أعلاه ، فإن معدل الوفيات في مجموعة الفئران OLT هو ~ 40-45٪.

الشكل 1: نظرة عامة على زراعة الكبد التقويمية. (أ) رسم بياني يصور المفاغرة الأربعة المختلفة: أ) مفاغرة IVC فوق الكبدية ، ب) مفاغرة IVC تحت الكبد ، ج: مفاغرة الوريد البابي ، د) مفاغرة القناة الصفراوية المشتركة. يشير كل سهم إلى موقع نسبي للمكان الذي يجب أن يكون فيه الوعاء أو القناة IVC فوق الكبدي (خطوة البروتوكول 2.13) ، IVC تحت الكبد (خطوة البروتوكول 2.11) ، الوريد البابي (خطوة البروتوكول 2.10) ، والقناة الصفراوية المشتركة (خطوة البروتوكول 2.7). ب: مخطط مفاغرة في الجسم الحي . شريط المقياس = 2 مم. اختصار: IVC = الوريد الأجوف السفلي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
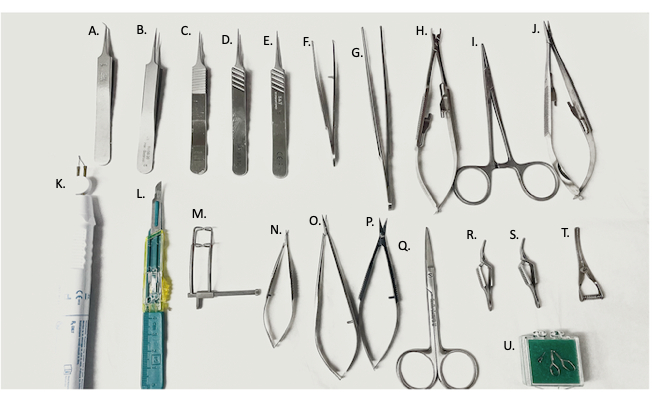
الشكل 2: الأدوات الجراحية المستخدمة في الجراحة. (أ) ملقط دقيق 45 درجة ، (B-E) ملقط دقيق ، (F) حامل إبرة منحني / ملقط ، (G) ملقط مستقيم ، (H) تطبيق مشبك الأوعية الدموية ، (I) مرقئ ، (J) حامل إبرة ، (K) جهاز كي كهربائي ، (L) شفرة # 11 ، (M) مبعدة للبطن ، (N ، O) مقص دقيق ، (P) مقص ناعم ، (Q) مقص جراحي ، (R ، S) مشابك Yasargil ، (T) مشبك الوريد البلدغ ، (U) المشبك الأوعية الدموية الدقيقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: سوار الوريد البابي ودعامة القناة الصفراوية. صورة خارج الجسم الحي للدعامات والأصفاد قبل الاستخدام. شريط المقياس = 3.5 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
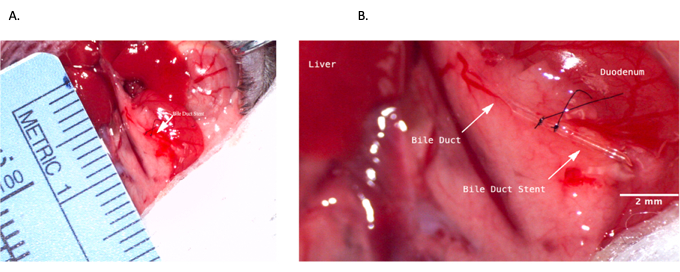
الشكل 4: دعامات القناة الصفراوية الشائعة أثناء عملية المتبرع. أ: إدخال دعامة القناة الصفراوية في القناة الصفراوية المشتركة. (ب) دعامة القناة الصفراوية المثبتة داخل القناة الصفراوية. شريط المقياس = 2 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
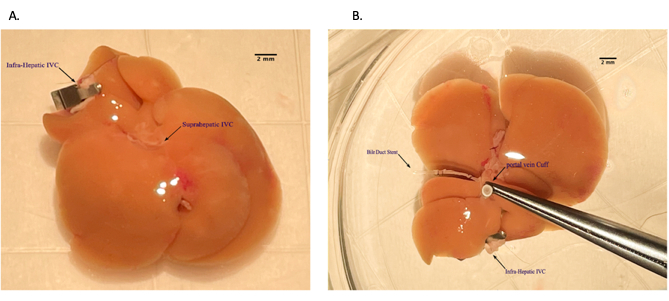
الشكل 5: وضع الكفة الوريدية البابية أثناء تحضير الطعم الخيفي الكبدي على الطاولة الخلفية. أ: خيط الوريد البابي عبر الكفة الوريدية. (ب) الوريد المقطوع فوق الكفة. شريط المقياس = 2 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
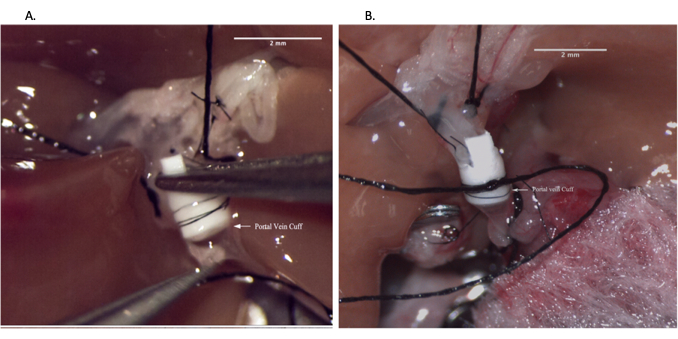
الشكل 6: مفاغرة الوريد البابي أثناء عملية المتلقي. (أ) إدخال الكفة الوريدية في الوريد البابي المتلقي. ب: مفاغرة الوريد البابي مثبتة بالخيط. شريط المقياس = 2 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
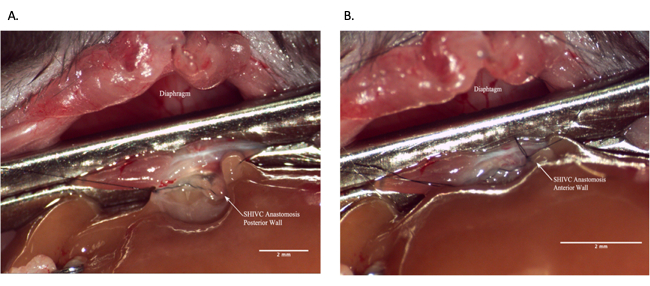
الشكل 7: مفاغرة IVC فوق الكبدية أثناء العملية المتلقية. (أ) اكتمل الجدار الخلفي للمفاغرة. (ب) مفاغرة SHIVC المكتملة. شريط المقياس = 2 مم. الاختصارات: IVC = الوريد الأجوف السفلي. SHIVC = IVC فوق الكبد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
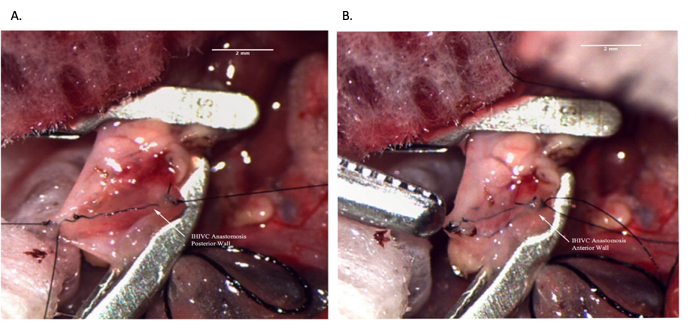
الشكل 8: مفاغرة IVC تحت الكبد أثناء عملية المتلقي. (أ) اكتمل الجدار الخلفي للمفاغرة. (ب) مفاغرة IHIVC المكتمل. شريط المقياس = 2 مم. الاختصارات: IVC = الوريد الأجوف السفلي. IHIVC = IVC تحت الكبد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
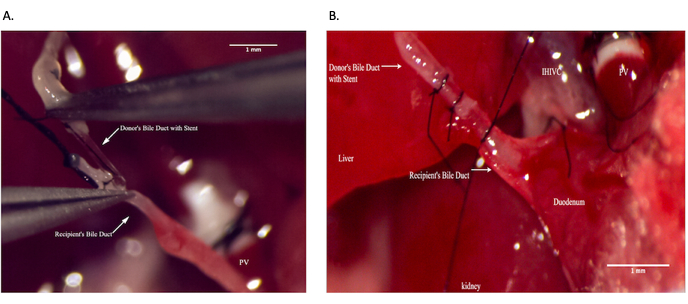
الشكل 9: مفاغرة القناة الصفراوية الشائعة أثناء عملية المتلقي. أ: وضع دعامة القناة الصفراوية داخل القناة الصفراوية المشتركة المتلقية. ب: تأمين مفاغرة القناة الصفراوية. شريط المقياس = 1 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 10: تصوير الأوعية بالأشعة المقطعية الدقيقة للفأر تحضير. أ: حقن وريد ذيل الفأر لإدارة التباين. (ب) تمرير الفأر عبر جهاز التصوير المقطعي المحوسب الدقيق. اختصار: microCT = التصوير المقطعي المحوسب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
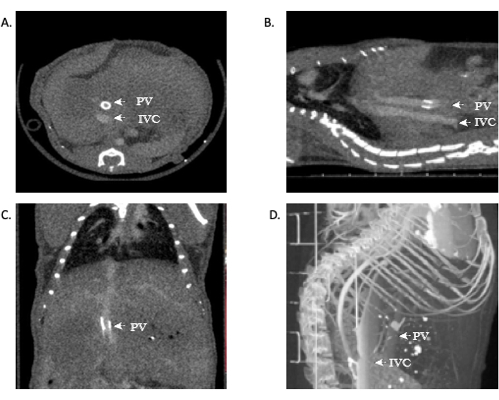
الشكل 11: صور تمثيلية توضح تصوير الأوعية بالتصوير المقطعي المحوسب الدقيق لسالكية الطعم الخيفي. (أ ، ب) يمكن رؤية التباين في جميع أنحاء IVC ، مما يدل على سالكية مفاغرة فوق الكبد وتحت الكبد. (ج) التباين في الوريد البابي ، مما يدل مرة أخرى على المباح. د: 3D إعادة بناء الأوعية الدموية. الاختصارات: microCT = التصوير المقطعي المحوسب ؛ IVC = الوريد الأجوف السفلي ؛ PV = الوريد البابي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
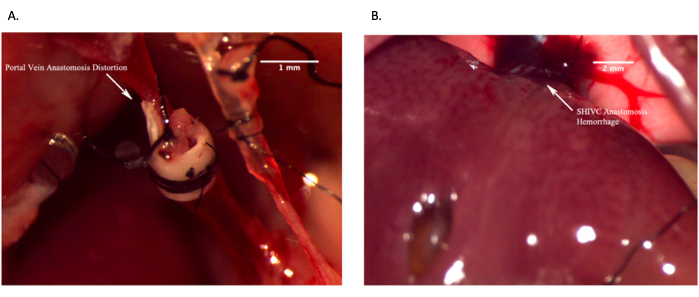
الشكل 12: صور تمثيلية تظهر مفاغرة فاشلة في الجسم الحي . (أ) فشل مفاغرة الوريد البابي بسبب تشوه الوريد مما يؤدي إلى نقص تدفق الدم. ب: فشل مفاغرة IVC فوق الكبدية بسبب النزيف المفرط. شريط المقياس = 2 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تم وصف OLT في القوارض بشكل جيد في الأدبيات2،8. لإجراء هذا الإجراء الذي يتطلب الكثير من الناحية الفنية ، غالبا ما تكون هناك حاجة إلى عدة سنوات من الجراحة المجهرية (أو الجراحة بشكل عام) لأن هذا ينطوي على فهم قوي للتشريح والقدرة التقنية. في تطوير هذا النموذج ، واجهنا العديد من المشكلات الفنية التي تدور جميعها حول المفاغرة. خاصة مع مفاغرة PV ، غالبا ما يكون من الصعب تثبيت الوريد لمفاغرة. لقد وجدنا أن وضع واحد أو اثنين من الغرز (تفضيل الجراح) يساعد في تسهيل وضع الكفة. وتجدر الإشارة إلى أن وضع المزيد من الغرز يزيد من وقت الجراحة.
بالإضافة إلى ذلك ، فإن SHIVC عميق داخل تجويف البطن ويصعب وضع مشبك عليه لإعطاء التعرض الكافي. لقد وجدنا أنه إذا كان الماوس مسترخيا قدر الإمكان في ضبط النفس ، فإن ذلك سيضيف إلى مرونة الوريد. في النهاية ، سيكون الأمر متروكا للجراح لتحديد الموضع المناسب مع الممارسة. علاوة على ذلك ، مع مفاغرة CBD ، تكون القناة مرة أخرى حساسة للغاية. قد يكون من الصعب وضع خيوط البقاء لتثبيت القناة ، وربما يساعد وضعها على قطعة صغيرة من الشاش في تثبيتها. أخيرا ، نظرا لأن جميع الثدييات الصغيرة حساسة بشكل فريد فيما يتعلق بوقت التخدير ، فمن المهم إجراء الجراحة في أسرع وقت ممكن. الأوقات الجراحية المثالية هي كما يلي: 1) عملية مانحة ، 45-60 دقيقة. 2) إعداد الجدول الخلفي ، 15 دقيقة ؛ 3) عملية المستلم ، 60-80 دقيقة. الممارسة سوف تساعد في تقليل الحركة الضائعة.
مع تقدم النماذج الحيوانية ، تقدمت أيضا القدرة على تقييم نجاح التدخلات الدراسية. تم استخدام MicroCT لأول مرة لإجراء دراسات حول الأوعية الدموية في الفئران في أواخر تسعينيات القرن العشرين17. هناك العديد من التحديات لإجراء دراسات تصوير الأوعية المجهرية الدقيقة والواضحة في القوارض. ومع ذلك ، فإن معظم التحديات تنشأ من دورات القلب والجهاز التنفسي القصيرة لهذه الثدييات. يتم التغلب على ذلك باستخدام التعرضات القصيرة للحد من آثار الحركة بالإضافة إلى ارتفاع معدلات طلاقة الفوتون18. بشكل عام ، وجدنا أن استخدام بوابات القلب ، وكذلك تعديل تركيزات الأيزوفلوران لتقليل معدل التنفس ، أنتج أوضح الصور. لقد وجدنا أيضا أن استخدام توقيت التباين الخاص بالقوارض لمراحل محددة: المرحلة الشريانية الكبدية ، والمرحلة البابية الوريدية ، والمرحلة المتأخرة قد حسنت أيضا التصور19. يتميز استخدام تباين ExiTron nano 12000 بالعديد من المزايا ويمكن أن يحسن جودة الصورة الإجمالية. يوفر أقوى تعزيز للتباين في الكبد20 والدم21. ميزة أخرى هي أن التباين موجود في الكبد لمدة تصل إلى 120 ساعة بعد الحقن الأولي ، مما قد يقلل من سمية الكبد المرتبطة به حيث يلزم تقليل التباين إذا كانت هناك حاجة إلى فحوصات متكررة20.
علاوة على ذلك ، نظرا لإجراء عمليات المسح باستخدام الفأر المخدر بالإيزوفلوران ، لا يتغير تحسين التباين مع هذا التغيير في علم وظائف الأعضاء20. من خلال استخدام تقنيات التصوير هذه وتباين ExiTron ، يمكن إجراء تقييم واضح للمفاغرة الناجحة في OLT. يسمح التصوير المقطعي المحوسب بالتقييم غير الجراحي للطعم الخيفي في الجسم الحي على مدى فترة طويلة. يقلل هذا البروتوكول من عدد التي يجب التضحية بها لتقييم مفاغرة الأوعية الدموية وإتاحة الفرصة لدراسة العلاجات على مدى عدة أسابيع وتأثيرها على الأوعية الدموية.
القيود
تجدر الإشارة إلى أنه في حين حدثت مراجعات متعددة لنموذج OLT لإتقان تقنيته ، فإن تصور المفاغرة باستخدام microCT لا يزال عملية مستمرة. علاوة على ذلك ، يقدم الماوس OLT نظرة ثاقبة فريدة في طب الزرع. ومع ذلك ، فهو ليس نموذجا شاملا لأنه من الصعب إبقاء هذه الفئران على قيد الحياة بعد أسبوع 1. يجب استخدام نماذج زرع إضافية أيضا لإثبات التجارب قبل السريرية.
الاستنتاجات
تقدم التقدم في التصوير المقطعي المحوسب بسرعة خلال العقد الماضي ، مما وفر للباحثين أدوات جديدة لا تقدر بثمن في مجال النماذج الحيوانية وزرعها. في المستقبل ، سيقدم التصوير 3D الأكثر تفصيلا مزيدا من الأفكار حول البحث والاكتشاف.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
يتم دعم SMB من قبل المعهد الوطني للسكري وأمراض الجهاز الهضمي والكلى (NIDDK) منحة R01DK1234750. يتم دعم BAW من خلال منحة المعهد الوطني للقلب والرئة والدم من المعاهد الوطنية للصحة R01HL143000.
Materials
| Name | Company | Catalog Number | Comments |
| #11 Blade | Fisher Scientific | 3120030 | |
| 4-0 silk suture | Surgical Specialties Corp. | SP116 | |
| 6-0 nylon suture | AD Surgical | S-N618R13 | |
| 7-0 nylon suture | AD Surgical | S-N718SP13 | |
| 8-0 nylon suture | AD Surgical | XXS-N807T6 | |
| 10-0 nylon suture | AD Surgical | M-N510R19-B | |
| 20 G Angiocath | Boundtree | 602032D | |
| 30 G Needle | Med Needles | BD-305106 | |
| Baytril (enrofloxacin) Antibacterial Tablets | Elanco | NA | |
| Bovie Chang-A-Tip High Temp Cauterizer | USA Medical and Surgical Supplies | BM-DEL1 | |
| Bulldog Vein Clamp 1 1/8 | Ambler Surgical USA | 18-181 | |
| C57BL/6J mice | Jackson Labs | ||
| Castroviejo Micro Dissecting Spring Scissors | Roboz Surgical Store | RS-5668 | |
| Dumont #5 - Fine Forceps | Fine Science tools | 11254-20 | |
| Dumont #5 Forceps | Fine Science tools | 11252-50 | |
| Dumont Medical #5/45 Forceps - Angled 45° | Fine Science tools | 11253-25 | |
| ExiTron nano 12000 | Miltenyi Biotec | 130 - 095 - 698 | CT contrast agent |
| Forceps | Fine Science tools | 11027-12 | |
| Halsted-Mosquito Hemostat | Roboz Surgical | RS-7112 | |
| heparin | Fresnius Lab, Lake Zurich, IL | C504701 | |
| histidine-trypotophan-ketoglutarate | University Pharmacy | NA | |
| Insulated Container | YETI | ROADIE 24 HARD COOLER | https://www.yeti.com/coolers/hard-coolers/roadie/10022350000.html |
| Isoflurane | Piramal Critical Care | NDC 66794-017-25 | |
| ketamine | Hikma Pharmaceuticals PLC | NDC 0413-9505-10 | |
| Mirco Serrefines | Fine Science tools | 18055-05 | |
| Mouse Rectal Temperature Probe | WPI Inc | NA | |
| NEEDLE HOLDER/FORCEPS straight | Micrins | MI1540 | |
| PE10 Tubing | Fisher Scientific | BD 427400 | |
| perfadex | XVIVO Perfusion AB | REF99450 | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | |
| Puralube Ophthalmic Ointment | Dechra | NA | |
| saline | PP Pharmaceuticals LLC | NDC 63323-186-10 | |
| Scissors | Fine Science tools | 14090-11 | |
| Small Mouse Restraint – 1” inner diameter | Pro Lab Corp | MH-100 | |
| SomnoSuite Small Animal Anesthesia System | Kent scientific | SS-MVG-Module | |
| Surgical microscope | Leica | M500-N w/ OHS | |
| U-CTHR | MI Labs | NA | CT Scanner software |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15008-08 | |
| xylazine | Korn Pharmaceuticals Corp | NDC 59399-110-20 | |
| Yasagil clamp | Aesculap | FT351T | |
| Yasagil clamp | Aesculap | FT261T | |
| Yasagil clamp applicator | Aesculap | FT484T |
References
- Rana, A., et al. Survival benefit of solid-organ transplant in the United States. JAMA Surgery. 150 (3), 252-259 (2015).
- Qian, S. G., Fung, J. J., Demetris, A. V., Ildstad, S. T., Starzl, T. E. Orthotopic liver transplantation in the mouse. Transplantation. 52 (3), 562-564 (1991).
- Nakano, R., et al. Dendritic cell-mediated regulation of liver ischemia-reperfusion injury and liver transplant rejection. Frontiers in Immunology. 12, 705465 (2021).
- Nakamura, K., et al. Antibiotic pretreatment alleviates liver transplant damage in mice and humans. Journal of Clinical Investigation. 129 (8), 3420-3434 (2019).
- Lee, S. K., et al. Patient-derived Avatar mouse model to predict the liver immune homeostasis of long-term stable liver transplant patients. Frontiers in Immunology. 13, 817006 (2022).
- Li, S. P., et al. Characterization and proteomic analyses of proinflammatory cytokines in a mouse model of liver transplant rejection. Oxidative Medicine and Cellular Longevity. 2022, 5188584 (2022).
- Huang, D. R., Wu, Z. J., Zhu, Y. Modified arterialization of orthotopic liver transplantation in a mouse model. Hepatobiliary Pancreatic Disease International. 9 (3), 264-268 (2010).
- Yokota, S., et al. Orthotopic mouse liver transplantation to study liver biology and allograft tolerance. Nature Protocols. 11 (7), 1163-1174 (2016).
- Chen, X. C., et al. Reduced complications after arterial reconnection in a rat model of orthotopic liver transplantation. Journal of Visual Experiments. (165), e60628 (2020).
- Nelson, K., et al. Method of isolated ex vivo lung perfusion in a rat model: lessons learned from developing a rat EVLP program. Journal of Visual Experiments. (96), e52309 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Lee, Y. G., et al. A rat lung transplantation model of warm ischemia/reperfusion injury: optimizations to improve outcomes. Journal of Visual Experiments. (176), e62445 (2021).
- Di Martino, M., et al. Imaging follow-up after liver transplantation. British Journal of Radiology. 89 (1064), 20151025 (2016).
- Vardar, B. U., Dupuis, C. S., Goldstein, A. J., Vardar, Z., Kim, Y. H. Ultrasonographic evaluation of patients with abnormal liver function tests in the emergency department. Ultrasonography. 41 (2), 243-262 (2022).
- Marx, J. Imaging. Animal models: live and in color. Science. 302 (5652), 1880-1882 (2003).
- Maehara, N. Experimental microcomputed tomography study of the 3D microangioarchitecture of tumors. European Radiology. 13 (7), 1559-1565 (2003).
- Garcia-Sanz, A., Rodriguez-Barbero, A., Bentley, M. D., Ritman, E. L., Romero, J. C. Three-dimensional microcomputed tomography of renal vasculature in rats. Hypertension. 31, 440-444 (1998).
- Badea, C., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating. Medical Physics. 31 (12), 3324-3329 (2004).
- Ma, G., et al. Assessment of hemodynamics in a rat model of liver cirrhosis with precancerous lesions using multislice spiral CT perfusion imaging. BioMed Research International. 2013, 813174 (2013).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media and Molecular Imaging. 11 (4), 272-284 (2016).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved