Method Article
Transplantation hépatique orthotopique réussie chez la souris à l’aide de l’angiographie par microtomodensitométrie
Dans cet article
Résumé
Dans ce protocole, nous discutons de la mise en œuvre d’un modèle de transplantation hépatique orthotopique réussie (OLT) chez la souris. De plus, les adjuvants permettant d’analyser plus en détail la perméabilité de l’allogreffe après une OLT réussie chez une souris sont également discutés, en particulier à l’aide de la microtomodensitométrie (microCT).
Résumé
L’angiographie par microtomodensitométrie (microTDM) est une ressource inestimable pour les chercheurs. Les nouvelles avancées de cette technologie ont permis d’obtenir des images de haute qualité de la micro-vascularisation et constituent des outils de haute fidélité dans le domaine de la transplantation d’organes. Dans ce modèle de transplantation hépatique orthotopique (OLT) chez la souris, la microtomodensitométrie offre la possibilité d’évaluer l’anastomose de l’allogreffe en temps réel et présente l’avantage supplémentaire de ne pas avoir à sacrifier les animaux d’étude. Le choix du contraste, ainsi que les paramètres d’acquisition de l’image, créent une image haute définition, qui donne aux chercheurs des informations inestimables. Cela permet d’évaluer les aspects techniques de la procédure ainsi que d’évaluer potentiellement différentes thérapies sur une longue période. Dans ce protocole, nous détaillons un modèle OLT chez la souris de manière progressive et décrivons enfin un protocole de microCT qui peut fournir des images de haute qualité, ce qui aide les chercheurs dans l’analyse approfondie de la transplantation d’organes solides. Nous fournissons un guide étape par étape pour la transplantation hépatique chez une souris, ainsi qu’un bref protocole d’évaluation de la perméabilité du greffon par micro-tomodensitométrie.
Introduction
La transplantation est le seul traitement efficace pour les maladies hépatiques en phase terminale. Indéniablement, le bénéfice de la transplantation hépatique est excellent, avec une survie médiane de 11,6 ans contre 3,1 ans sur la liste d’attente1. Cependant, il existe des contraintes importantes, qui limitent l’application à grande échelle de la transplantation hépatique, et comprennent surtout le manque d’organes de donneurs appropriés et de haute qualité. L’élargissement du bassin de donneurs d’organes nécessitera donc des stratégies innovantes qui permettront l’utilisation d’allogreffes actuellement considérées comme inadaptées aujourd’hui, augmentant ainsi la marge de sécurité pour la transplantation. Par conséquent, pour améliorer l’accès à la transplantation hépatique, il est impératif de mener des études précliniques chez les petits animaux.
Les modèles de transplantation in vivo sont particulièrement importants pour la recherche sur la transplantation. La transplantation hépatique orthotopique chez la souris existe depuis près de 30 ans2 et est essentielle à l’étude de nombreux aspects de la transplantation, notamment la caractérisation des réponses immunitaires, des lésions d’ischémie-reperfusion, du rejet aigu, des effets thérapeutiques de nouveaux agents et de la survie à long terme 3,4,5,6,7 . L’utilisation de souris pour étudier la transplantation est vitale car elle permet d’utiliser des lignées de souris transgéniques pour étudier l’impact de voies moléculaires spécifiques sur les résultats de la transplantation. Les protocoles établis de transplantation hépatique de souris ont été bien décrits précédemment 8,9.
Il existe plusieurs méthodes d’anastomoses pour la veine cave inférieure supra-hépatique et infra hépatique (IVC), la veine porte (PV) et le canal cholédoque (CBD). Ils reposent généralement sur l’anastomose de la main ou sur une technique de coiffe vasculaire modifiée similaire à la transplantation pulmonaire murine 10,11,12. Une étape importante dans l’étude à long terme et la survie des souris receveuses, ainsi que dans le développement d’un programme soutenu de transplantation hépatique de souris, est la capacité d’évaluer ces anastomoses critiques. Les modalités d’imagerie pour évaluer la perméabilité de l’allogreffe hépatique reposent souvent sur l’échographie et la tomodensitométrie (TDM) en milieu clinique13,14. La tomodensitométrie présente un avantage distinct par rapport à l’échographie car elle peut offrir des vues de l’ensemble de l’abdomen pour inclure toutes les anastomoses, bien que l’obtention de ces vues par échographie puisse être particulièrement difficile chez les petits animaux. D’importantes recherches et ressources ont été consacrées à la mise au point d’une microtomodensitométrie précise dans le but d’améliorer les études sur les animaux et les informations que nous pouvons recueillir à partir de ces modèles de blessures et de maladies15,16. Nous décrivons ici un protocole pour la transplantation hépatique orthotopique de souris (Figure 1) et décrivons brièvement un protocole pour la microTDM afin d’évaluer la perméabilité de l’allogreffe et la durabilité des anastomoses.
Protocole
Des souris mâles C57BL/6J (30 g de poids corporel) ont été hébergées dans des conditions exemptes d’agents pathogènes à l’animalerie du Nationwide Children’s Hospital. Toutes les procédures ont été effectuées sans cruauté conformément au Guide for the Humane Care and Use of Laboratory Animals du National Research Council et du National Research Council et avec l’approbation du Comité institutionnel de soins et d’utilisation des animaux de laboratoire de l’Hôpital national pour enfants (protocole IACUC AR17-00045). Voir le tableau des matériaux pour plus de détails sur tous les matériaux, instruments et équipements utilisés dans ce protocole.
1. Configuration initiale pour la chirurgie de transplantation
- Mettre en place des dispositifs chirurgicaux.
- Mettre en place des dispositifs de surveillance chirurgicale (c.-à-d. un dispositif de surveillance de la fréquence cardiaque, un oxymètre de pouls, un système de surveillance modulaire) et des appareils d’anesthésie.
- Si possible, allumez la planche chauffante chirurgicale à 42 °C.
- Assurez-vous que les appareils de ventilation et d’anesthésie sont allumés pour réchauffer l’évaporateur d’isoflurane. Remplissez le réservoir d’anesthésie avec 30 mL d’isoflurane liquide et assurez-vous que le ventilateur est connecté à l’oxygène.
REMARQUE : Dans ce protocole, nous n’intubons pas l’animal ; N’utilisez qu’un cône nasal pour l’oxygénation.
- Enregistrez le poids corporel des souris receveuses et donneuses.
- Allumez le microscope chirurgical haute puissance et ajustez la hauteur et la mise au point selon les préférences du chirurgien. Assurez-vous que les autres dispositifs chirurgicaux sont allumés (c.-à-d. appareil d’électrocautérisation).
- Préparez et disposez les instruments chirurgicaux, ainsi que les attaches chirurgicales en nylon 10-0 (figure 2).
REMARQUE : Tous les instruments chirurgicaux ont été autoclavés à 121 °C pendant 30 minutes. De plus, différentes configurations d’instruments chirurgicaux pourraient être tout aussi efficaces. - Préparez les brassards pour les endoprothèses de la veine porte (PV) et des voies cholédoques (CBD) (Figure 3). Placez l’angiocathéter, ainsi que le PE10, sur une surface stérile sous le microscope haute puissance. À l’aide d’une lame chirurgicale #11, coupez l’angiocathéter pour former un brassard de 1,5 mm de long avec une languette d’environ 0,75 mm en haut du corps du brassard ; Coupez le tube en polyéthylène (PE10) à une longueur de 2,5 mm. Conservez les brassards et l’endoprothèse dans une solution saline stérile jusqu’à ce qu’ils soient prêts à être utilisés.
REMARQUE : Ce modèle de transplantation utilise un angiocathéter de 20 G pour fabriquer des brassards pour la reconstruction PV, ainsi qu’un tube en polyéthylène 10 (PE10) pour la reconstruction du CBD. Toutes les autres anastomoses sont cousues à la main. - Préparez des solutions. Préparez une injection d’héparine qui sera administrée à 100 U dans 0,5 mL de solution d’histidine-tryptophane-cétoglutarate (HTK). Conservez la solution saline, l’héparine-solution saline, le PBS et la solution de conservation HTK sur de la glace.
2. Approvisionnement en souris donneuses
- Induire l’anesthésie chez la souris donneuse en la plaçant dans une chambre d’inhalation d’isoflurane. Assurez-vous que la concentration d’isoflurane est d’environ 2,5 % avec un débit d’oxygène de 2 mL/min. Attendez 5 min pour qu’un plan chirurgical d’anesthésie se développe. Pour assurer le bon niveau d’anesthésie, pincez l’orteil de la souris pour provoquer une réaction ; Une absence de réaction indique que le niveau d’anesthésie approprié a été atteint.
- Rasez l’abdomen de la souris à l’aide d’une tondeuse électronique et placez la souris en position couchée sur le dos sur la planche chauffante. Nettoyez l’abdomen avec de la povidone iodée, puis de l’éthanol à 70 %. Placez une pommade ophtalmique sous les yeux des souris pour éviter la sécheresse.
- Placez la souris sous le microscope à haute puissance et maintenez-la sous anesthésie à l’aide d’une inhalation d’isoflurane à une concentration de 2 % avec un débit d’oxygène de 2 mL/min.
- Effectuer une laparotomie médiane avec une paire de ciseaux (préférence du chirurgien) du processus xiphoïde à la symphyse pubienne. Ensuite, effectuez une incision transversale supplémentaire pour créer un motif en forme de croix inférieur aux côtes. À l’aide d’une pince hémostatique anti-moustique, rétractez le processus xiphoïde pour obtenir une exposition adéquate du contenu abdominal.
REMARQUE : Les pinces peuvent être fixées selon les préférences du chirurgien. - Éviscérez les intestins et placez-les sur le côté gauche de la cavité abdominale dans une éponge de gaze humide. Mobiliser le foie en enlevant toutes les attaches ligamentaires.
- Exposer l’artère hépatique appropriée (pHA). Squelettiser le vaisseau à l’aide d’une pince courbe et le ligaturer avec une suture en nylon 10-0.
- Disséquez toute la longueur du CBD à l’aide d’une combinaison de dissection tranchante et émoussée. Effectuez une ductotomie (assez grande pour le stent CBD) le plus près possible du bord supérieur du pancréas pour donner une longueur adéquate pour une utilisation future (~1 cm du bord inférieur du foie). Insérez l’endoprothèse des voies biliaires dans le CBD à l’aide d’une pince fine et fixez-la avec une suture en nylon 10-0. Liquez l’aspect distal du CBD à l’aide d’une suture en nylon 10-0 (Figure 4).
- Rétractez le lobe hépatique droit vers le xiphoïde à l’aide d’une éponge de gaze humide et exposez l’IVC. Mobiliser la CIV infra-hépatique (IHIVC) à l’écart du rétropéritoine et cautériser la veine surrénale droite à l’aide d’un appareil de cautérisation portatif (voir le tableau des matériaux).
- Disséquez l’artère rénale et la veine droites et ligaturez avec du nylon 7-0 et 10-0, respectivement. Coupez la veine rénale et l’artère droites et les attaches ligamentaires restantes. Enfin, retirez le rein droit.
REMARQUE : Ceci est fait pour avoir une meilleure exposition lors de la coupe finale de l’IHIVC. - Injecter les 0,5 mL de HTK froid avec une solution d’héparine à 100 U à travers le PV à l’aide d’une aiguille de 30 G. Attendez 1 min que l’héparine se distribue systématiquement. Coupez la veine porte juste au-dessus de la veine splénique et de la veine mésentérique supérieure.
- Injecter lentement une solution froide de conservation HTK avec de l’héparine dans l’IHIVC avec une aiguille de 30 G pour perfuser le foie du donneur. Arrêtez d’injecter la solution une fois que le fluide provenant du PV est clair. Une fois l’injection terminée, placez une micro-pince sur l’IHIVC juste au-dessus de la veine rénale droite et coupez juste en dessous de la pince. Une fois cette étape terminée, éteignez le ventilateur et arrêtez l’isoflurane car l’animal vient d’être euthanasié.
- Coupez le CBD distalement sur le stent qui a été précédemment placé à l’étape 2.7. De plus, identifiez le canal cystique et ligaturez-le avec une suture en nylon 10-0. Ensuite, saisissez le dôme de la vésicule biliaire avec une paire de pinces et disséquez en vous libérant de la fosse de la vésicule biliaire en utilisant une combinaison de dissection tranchante et émoussée. Une fois que la vésicule biliaire est suffisamment mobilisée, à l’aide d’une paire de ciseaux à ressort, complétez la cholécystectomie en coupant le canal cystique au-dessus de la suture précédemment placée.
- Rétractez le foie vers le bas pour exposer la CIV supra-hépatique (SHIVC). Couper le SHIVC en accordant une attention particulière pour donner une longueur adéquate à l’anastomose chez l’animal receveur.
- Disséquer les attaches ligamentaires supplémentaires libres au foie et livrer le foie du donneur ex-vivo et placer l’organe dans un récipient avec une solution saline froide.
3. Préparation de l’allogreffe hépatique sur la table arrière
- Placez de la glace dans un récipient isotherme et placez une boîte de Pétri sur le lit de glace. Remplissez la boîte de Pétri de sérum physiologique froid. Placez l’allogreffe hépatique dans la boîte de manière à ce que la surface viscérale soit exposée.
- Placez le PV à travers le brassard précédemment sélectionné et inversez la veine de manière à ce que la surface endothéliale interne soit exposée. Fixez le brassard avec une suture en nylon 10-0. Assurez-vous que la suture se trouve dans les rainures du brassard pour obtenir les meilleurs résultats (Figure 5).
- Ajustez l’allogreffe hépatique pour exposer le SHIVC et placez deux 8-0 sutures en nylon à 3' et 9 heures, respectivement, pour une éventuelle anastomose chez l’animal receveur. Ajustez à nouveau l’allogreffe hépatique pour exposer l’IHIVC et placez deux 8-0 sutures en nylon à 3' et 9 heures, respectivement, pour une éventuelle anastomose chez l’animal receveur.
4. Fonctionnement du destinataire
REMARQUE : Comme il s’agit d’une opération stérile, utilisez des gants et un équipement de protection individuelle approprié et administrez des antibiotiques. Administrer 0,1 mg/kg de buprénorphine par voie sous-cutanée comme analgésie préopératoire au moment de la chirurgie.
- Exposer le pHA comme dans l’opération donneuse ; N’utilisez qu’une laparotomie médiane au lieu de l’incision abdominale décrite précédemment.
- Mobiliser le foie et couper toutes les attaches ligamentaires. De plus, ligaturez les vaisseaux phréniques et parao-œsophagiens gauches avec une suture en nylon 10-0.
- Rétractez le foie vers le bas et disséquez le SHIVC du rétropéritoine. Ensuite, rétractez le foie par le haut et disséquez l’IHIVC du rétropéritoine. Cautériser les petites veines ponteuses et les veines lombaires si nécessaire en utilisant la même technique que celle décrite précédemment.
- Cautériser la veine surrénale droite à l’aide d’un cautéris manuel et exposer le hile hépatique. Mettez le pHA en contact avec une suture en nylon 10-0. Ensuite, disséquez le CBD sans PV et ligaturez le CBD avec une suture 7-0 près de la bifurcation du CBD pour donner une longueur adéquate pour l’anastomose du CBD.
- Utilisez une micro-pince pour clamper la CVI infra-hépatique et ligaturer temporairement le PV avec une suture 7-0. Commencez la phase an-hépatique. Arrêtez l’inhalation d’isoflurane.
REMARQUE : Après le clampage de la veine porte et de la veine IVC, le retour veineux hépatique est complètement bloqué au stade anhépatique. L’isoflurane anesthésique inhalé est métabolisé par le foie ; Ainsi, son inhalation est momentanément arrêtée car l’accumulation peut entraîner un collapsus cardio-pulmonaire. - À travers le PV du foie natif, injecter 0,5 mL d’héparine-solution saline avec une aiguille de 30 G pour rincer l’organe.
- Placer des pinces microvasculaires sur le SHIVC et l’IHIVC aussi proximalement et distalement que possible pour laisser une longueur adéquate pour l’anastomose. Coupez le SHIVC, IHIVC, PV natif (près de la suture précédemment placée) et toutes les attaches ligamentaires restantes au foie natif du receveur et délivrez le foie natif ex vivo.
REMARQUE : La pince IHIVC doit être au-dessus de la veine rénale droite. - Placez l’allogreffe hépatique du donneur à l’intérieur de la cavité abdominale et rétractez le hile de l’allogreffe du donneur pour exposer le PV. Rincer à la fois le donneur et le PV natif avec 0,5 mL de solution saline d’héparine à l’aide d’une aiguille de 30 G pour désaérer les vaisseaux afin d’éviter l’embolie gazeuse. Ensuite, insérez le brassard de PV du donneur précédemment fabriqué dans la lumière de la PV hépatique receveuse et, si nécessaire, placez des sutures de maintien pour aider à l’anastomose (suture 8-0). Fixez l’anastomose avec une suture 7-0 (Figure 6).
- Faites pivoter la planche de 180°. Effectuer une anastomose cousue à la main avec une suture en nylon 10-0 avec le donneur et le SHIVC natif. Après avoir terminé l’anastomose de la paroi postérieure, rincer avec 0,5 mL de solution saline à base d’héparine pour désaérer et éviter l’embolie gazeuse. Anastomose complète de la paroi supérieure (Figure 7).
- Retirez d’abord la suture de ligature de PV ; ensuite, retirez les pinces vasculaires de SHIVC pour commencer la reperfusion. Mettez fin à la phase an-hépatique et reprenez l’inhalation d’isoflurane. Effectuer une anastomose cousue à la main avec une suture en nylon 10-0, de la même manière que pour l’anastomose SHIVC, pour reconstruire l’IHIVC. Une fois la reconstruction terminée, retirez la micro-pince de l’IHIVC natif et du donneur pour la reperfuser (Figure 8).
- Effectuez l’anastomose du CBD en créant une ductotomie sur le CBD receveur près de la suture précédemment placée. Insérez l’endoprothèse dans le CBD donneur dans la lumière du CBD receveur et fixez l’anastomose avec une suture 10-0 (Figure 9).
- Irriguer la cavité abdominale avec 1 mL de solution saline ; Vérifier l’hémostase et cautériser les vaisseaux qui saignent restants. Fermez l’incision abdominale en deux couches en utilisant la suture 6-0.
- Placez l’animal dans un incubateur chaud (42 °C) pour qu’il se rétablisse et ne le laissez pas sans surveillance jusqu’à ce qu’il ait repris conscience et qu’il ait retrouvé une activité suffisante. Administrer 0,1 mg/kg de buprénorphine par voie sous-cutanée après la chirurgie et poursuivre l’administration toutes les 8 à 12 heures pendant 48 heures après la chirurgie. De plus, administrez du carprofène (0,2 ml dissous dans 400 ml d’eau) dans la bouteille d’eau de l’animal receveur jusqu’à 7 jours après la chirurgie. Observez l’animal receveur pendant 4 à 5 h, et une fois qu’il s’est complètement rétabli, remettez-le à l’endroit où il est logé, car il peut maintenant être en toute sécurité avec d’autres animaux.
REMARQUE : Des analgésiques et des antibiotiques peuvent être administrés selon les recommandations du comité local d’éthique animale.
5. Imagerie d’angiographie microCT de souris
- Après avoir observé la souris pendant l’intervalle d’étude prédéterminé, préparez la souris à évaluer la perméabilité de l’allogreffe à l’aide d’une angiographie par microtomodensitométrie.
- Assurez-vous que les appareils de ventilation et d’anesthésie sont allumés pour réchauffer l’évaporateur d’isoflurane. Remplissez le réservoir d’anesthésie avec 30 mL d’isoflurane liquide et assurez-vous que le ventilateur est connecté à l’oxygène. Allumez le scanner microCT et assurez-vous que tous les logiciels fonctionnent correctement.
- Démarrez le logiciel d’acquisition sur le système de scanner microCT.
- Sur l’écran de l’unité microCT, cliquez sur Initialiser le système et choisissez le mode de tomodensitométrie.
- Éjectez le lit ; Fixez le lit de souris et verrouillez-le.
- Allumez la planche chauffante à 42 °C pour la cage de récupération.
- Remplir une seringue de 1 mL avec 100 μL d’agent de contraste CT. Fixez une aiguille de calibre 30 pour l’administration intraveineuse future de produit de contraste. Assurez-vous qu’il n’y a pas de bulles d’air dans la seringue.
- Placez une souris dans le système de retenue des veines caudales. Une fois que la souris est complètement à l’intérieur du système de retenue, fermez la porte du système, laissez la queue tomber verticalement et essuyez-la soigneusement avec une solution d’alcool (éthanol à 70 %).
REMARQUE : Le succès de la canulation de la veine caudale peut être augmenté en réchauffant la queue de l’animal en la tenant dans une main gantée pendant plusieurs minutes. - Saisissez la queue vers la face distale et placez deux doigts (index et milieu) autour de la queue proximale au site d’injection prévu. Placez la face distale de la queue (sous le site d’injection) entre le pouce et l’annulaire.
- Avec les deux paires de doigts, appliquez une légère pression et insérez l’aiguille dans la veine en utilisant une faible profondeur, en veillant à ce que la seringue et l’aiguille soient parallèles à la queue. Tout en relâchant la pression de l’index au niveau de la queue proximale, administrer l’agent de contraste CT par voie intraveineuse. Évitez l’aspiration avec la seringue car cela peut provoquer l’affaissement de la veine.
REMARQUE : Aucune résistance ne doit être ressentie pendant l’injection si l’aiguille est correctement positionnée dans la veine. S’il y a une résistance, retirez l’aiguille et réinsérez-la au-dessus du site d’injection d’origine. Si la canulation de la veine échoue même après deux tentatives, remplacez l’aiguille. - Après avoir réussi à injecter le produit de contraste et à retirer l’aiguille, appliquez une légère compression sur le site d’injection à l’aide d’une gaze stérile pour arrêter le saignement.
- Transférez la souris dans la chambre d’inhalation d’isoflurane et réglez la concentration à 2,5 % avec un débit d’oxygène de 2 mL/min et attendez 3 à 4 minutes. Une fois qu’un plan d’anesthésie a été établi, transférez rapidement la souris sur le lit du scanner microCT et posez-la en position couchée sur la table du scanner (Figure 10).
- Couvrez les yeux de l’animal avec la quantité appropriée de pommade ophtalmique. Placez le cône nasal de manière appropriée sur l’animal et assurez-vous que l’air et l’isoflurane circulent correctement à travers le cône nasal. Utilisez les mêmes paramètres d’anesthésie que ceux décrits précédemment (étape 5.12). Lubrifiez et insérez une sonde de température rectale pour surveiller en permanence la température corporelle de l’animal pendant l’imagerie.
- Placez un respirateur en contact avec la souris.
- Utilisez du ruban adhésif pour fixer un coussinet ECG aux membres gauche, antérieurs et gauches antérieurs et gauches. Utilisez un gel à ultrasons pour améliorer le signal entre le coussinet ECG et la peau.
- Vérifiez l’ECG et le signal respiratoire sur le logiciel de l’ordinateur pour vous assurer que les complexes QRS appropriés sont vus sur le moniteur. Pour ce faire, cochez la case Logic Lead (Dérivation logique ) dans l’onglet Configuration de la source et choisissez la sonde qui offre la courbe ECG la plus claire.
REMARQUE : Les fils logiques correspondent aux trois électrodes ECG qui sont connectées à la hanche droite, à la poitrine gauche et au bas de la jambe. Chaque sonde représente une courbe ECG. - Réglez le gain pour une hauteur de signal appropriée, généralement 4 ou 8 est bon. Sélectionnez le double déclenchement. Sous l’onglet Configuration de l’affichage, ajustez les paramètres d’affichage pour une vue claire du signal : cochez les cases à côté de ECG et REEE et réglez-les sur 500. Sous l’onglet Configuration du déclencheur, vérifiez que les canaux A, B et DualTrig sont cochés.
- Assurez-vous que les paramètres suivants sont également définis : Seuil : lorsque le signal tombe en dessous de cette valeur ; définissez la valeur sur 2 500 ; Hystérésis : assurez-vous que le signal traverse l’hystérésis pour créer un point de déclenchement logiciel auquel un nouveau cycle de déclenchement commence ; définissez la valeur sur 300 ; Délai : attendre avant que le déclencheur ne soit envoyé ; définissez la valeur sur 100 ; Inhiber : aucun signal ne peut être généré pendant cette période, réglez la valeur sur 200.
- Assurez-vous que le seuil de l’ECG est inférieur à la valeur d’hystérésis et supérieur au pic du segment sT sur l’écran d’affichage.
- Faites avancer l’animal dans le scanner et appuyez sur Mettre à jour l’image. Acquérir une image radiographique de l’animal afin de sélectionner le champ de vision et la couverture anatomique appropriés pour l’image microCT subséquente.
- Effectuez l’acquisition d’images d’angiographie microCT à l’aide des paramètres suivants : Grossissements : Ultra mise au point, Angle de balayage : Balayage complet (360), Énergie : Simple, Mode de balayage : Gated, Réglage : Par défaut (rotation complète à 360°, réglages par défaut du tube à rayons X de 0,33 mA et 55 kV, 0,750° degré par étape, 1 projection par étape, binning 1 x 1 et temps d’exposition de 40 ms ; double déclenchement signifie déclenchement cardiaque et respiratoire) (Figure 11).
- Une fois l’analyse terminée, transférez l’animal dans une cage de récupération préchauffée. Une fois que l’animal s’est complètement rétabli, transférez-le dans sa cage principale.
- Reconstruisez des images microCT à l’aide d’un logiciel système. Après avoir téléchargé l’image, réglez les barres bleues de manière à ce qu’elle chevauche la zone anatomique d’intérêt ; Prévisualisez une tranche pour réduire le volume et le contraindre le plus possible à la souris (cette étape permet de réduire la taille de l’image reconstruite).
- Activez le contour du volume d’intérêt pour optimiser le contour de l’image. Choisissez une taille de voxel de 40 μm, un filtre de projection de Hann et un filtre de volume gaussien (80 μm). Aller à Avancé | Déclenchement basé sur l’image et ajustez les fenêtres de déclenchement et la phase à 0,5 et 0,6, respectivement, choisissez 10 phases pour le déclenchement cardiaque, puis appuyez sur le bouton de reconstruction du volume .
Résultats
Pour les chercheurs qui ne sont pas chirurgiens, qui ne sont pas familiers avec l’anatomie ou qui ne sont pas à l’aise avec l’interprétation des résultats radiologiques, l’analyse d’images appropriée doit être effectuée par du personnel ayant reçu une formation appropriée. Le succès d’un OLT chez une souris est démontré dans le protocole ci-dessus. De plus, pour améliorer les paramètres de l’étude et fournir une rétroaction en temps réel pour le succès d’une transplantation, ainsi que pour éliminer le besoin de nécropsie, une angiographie par microtomodensitométrie peut être utilisée pour fournir des images précises et claires. Des images représentatives sont incluses dans ce manuscrit (figure 11). Des images représentatives de l’échec de l’anastomose in vivo sont visibles à la figure 12.
Ceux qui sont familiers avec l’anatomie hépatique et la vascularisation peuvent voir des anastomoses veineuses patentes de la CIV. Dans certaines circonstances, la veine porte peut également être visualisée, ce qui est facile à réaliser dans ce modèle grâce au brassard de la veine porte. La visualisation d’anastomoses ouvertes indique le succès technique de l’opération. De plus, la reconstruction 3D de ces images peut fournir des informations supplémentaires aux chercheurs et une image plus détaillée de l’anatomie vasculaire. En utilisant ce modèle ci-dessus, la mortalité dans la cohorte de souris OLT est de ~40-45%.

Figure 1 : Vue d’ensemble de la transplantation hépatique orthotopique. (A) Dessin graphique représentant les quatre anastomoses différentes : i) anastomose IVC suprahépatique, ii) anastomose IVC infrahépatique, iii) anastomose de la veine porte, iv) anastomose des voies cholédoques. Chaque flèche indique un emplacement relatif pour l’endroit où le vaisseau ou le canal doit être coupé : la CVI supra-hépatique (étape du protocole 2.13), la CVI infra-hépatique (étape du protocole 2.11), la veine porte (étape du protocole 2.10) et le canal cholédoque (étape du protocole 2.7). (B) Diagramme in vivo des anastomoses. Barre d’échelle = 2 mm. Abréviation : IVC = veine cave inférieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
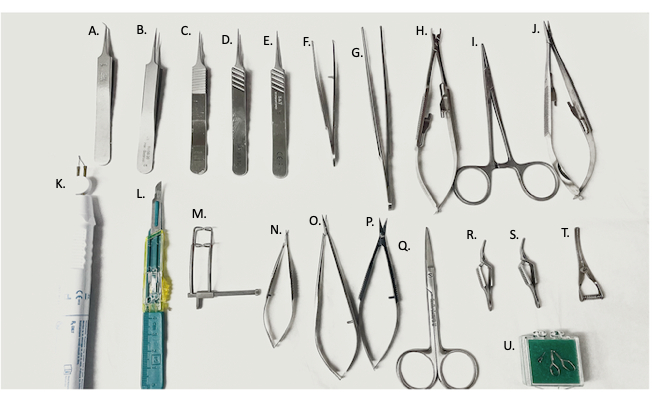
Figure 2 : Outils chirurgicaux utilisés en chirurgie. (A) pince fine à 45°, pince fine (B-E), (F) porte-aiguille courbé/pince, (G) pince droite, (H) applicateur de pince vasculaire, (I) hémostatique, (J) porte-aiguille, (K) dispositif d’électro-cautérisation, (L) lame #11, (M) écarteur abdominal, (N,O) micro-ciseaux, (P) ciseaux fins, (Q) ciseaux chirurgicaux, (R,S) pinces Yasargil, (T) pince veineuse bouledogue, (U) pince micro-vasculaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Manchette de la veine porte et endoprothèse des voies biliaires. Image ex vivo des endoprothèses et des brassards avant utilisation. Barre d’échelle = 3,5 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
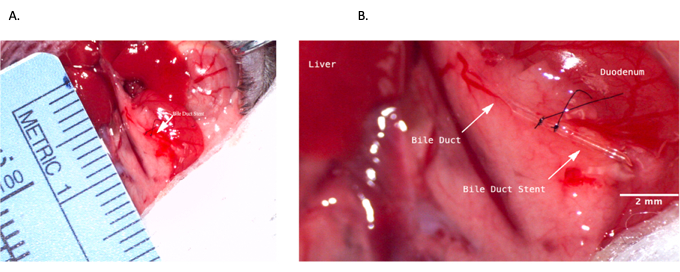
Figure 4 : Pose d’une endoprothèse des voies cholédoques pendant l’opération du donneur. (A) Insertion d’une endoprothèse des voies biliaires dans le canal cholédoque. (B) Endoprothèse des voies biliaires fixée à l’intérieur des voies biliaires. Barre d’échelle = 2 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
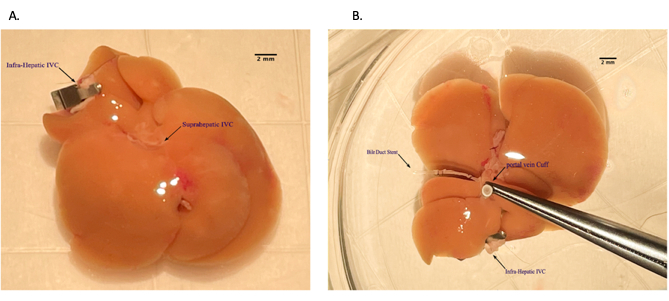
Figure 5 : Mise en place du brassard de la veine porte lors de la préparation de l’allogreffe hépatique sur la table arrière. (A) Enfilage de la veine porte à travers le ballonnet veineux. (B) Veine renversée au-dessus du brassard. Barre d’échelle = 2 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
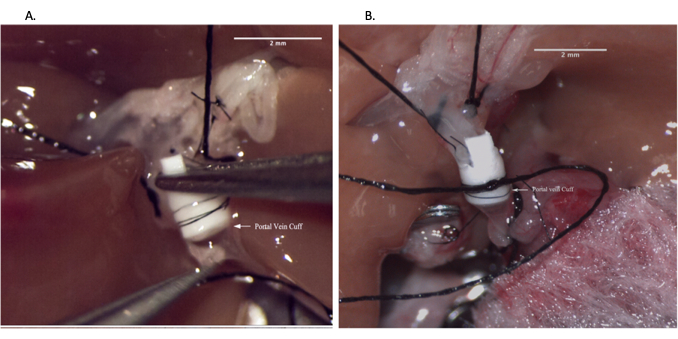
Figure 6 : Anastomose de la veine porte pendant l’opération du receveur. (A) Insertion du brassard veineux dans la veine porte receveuse. (B) Anastomose de la veine porte fixée par une suture. Barre d’échelle = 2 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
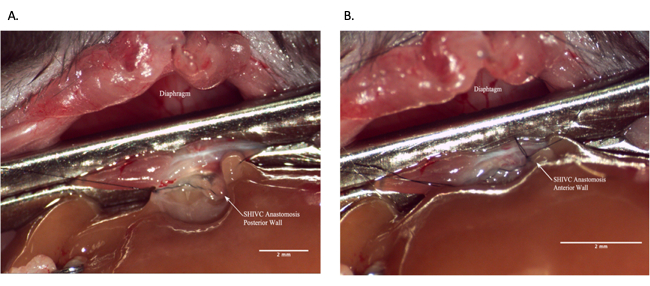
Figure 7 : Anastomose intrahépatique suprahépatique au cours de l’opération du receveur. (A) La paroi postérieure de l’anastomose est complète. (B) Anastomose SHIVC terminée. Barre d’échelle = 2 mm. Abréviations : IVC = veine cave inférieure ; SHIVC = IVC suprahépatique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
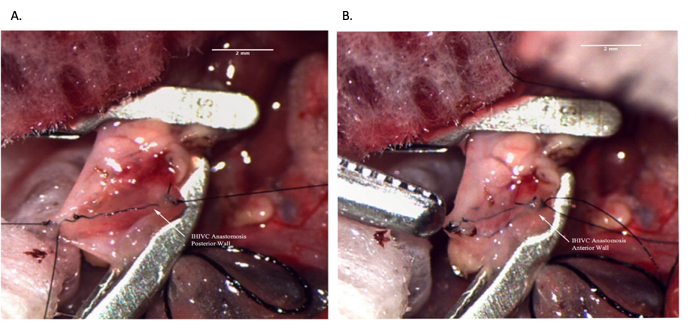
Figure 8 : Anastomose IVC infrahépatique pendant l’opération du receveur. (A) La paroi postérieure de l’anastomose est complète. (B) Anastomose IHIVC terminée. Barre d’échelle = 2 mm. Abréviations : IVC = veine cave inférieure ; IHIVC = IVC infrahépatique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
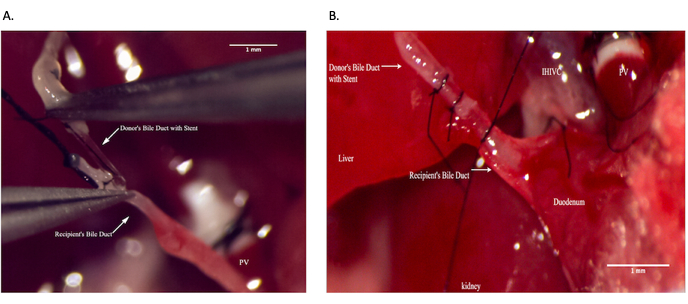
Figure 9 : Anastomose des voies cholédoques pendant l’opération du receveur. (A) Mise en place d’une endoprothèse des voies biliaires à l’intérieur du canal cholédoque receveur. (B) Sécurisation de l’anastomose des voies biliaires. Barre d’échelle = 1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 10 : Préparation animale d’angiographie par microTDM chez la souris. (A) Injection de la veine de la queue de la souris pour administrer un produit de contraste. (B) Souris passée à travers la machine microCT. Abréviation : microCT = microtomodensitométrie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
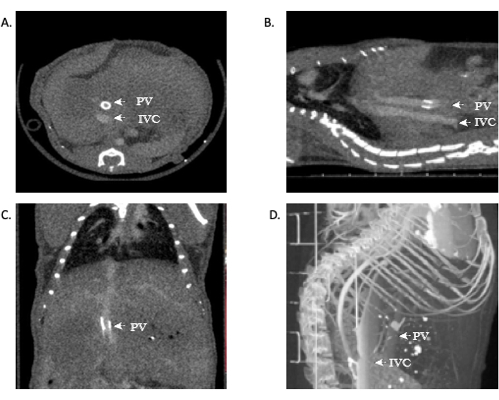
Figure 11 : Images représentatives montrant l’angiographie par microtomodensitométrie de la perméabilité de l’allogreffe. (A,B) Un contraste peut être observé dans l’ensemble de l’IVC, démontrant la perméabilité des anastomoses suprahépatiques et infrahépatiques. (C) Contraste dans la veine porte, démontrant à nouveau la perméabilité. (D) Reconstruction 3D du système vasculaire. Abréviations : microCT = microtomodensitométrie ; IVC = veine cave inférieure ; PV = veine porte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
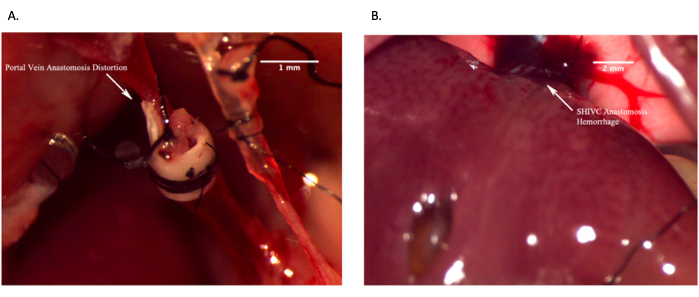
Figure 12 : Images représentatives montrant l’échec des anastomoses in vivo. (A) Échec de l’anastomose de la veine porte en raison d’une déformation de la veine entraînant un manque de circulation sanguine. (B) Échec de l’anastomose intrahépatique suprahépatique due à un saignement excessif. Barre d’échelle = 2 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’OLT chez les rongeurs a été bien décrite dans la littérature 2,8. Pour effectuer cette procédure techniquement exigeante, plusieurs années de microchirurgie (ou de chirurgie en général) sont souvent nécessaires, car cela implique une solide compréhension de l’anatomie et des capacités techniques. Lors de l’élaboration de ce modèle, nous avons été confrontés à plusieurs problèmes techniques liés aux anastomoses. En particulier avec l’anastomose PV, il est souvent difficile de stabiliser la veine pour l’anastomose. Nous avons constaté que la pose d’une ou deux sutures (préférence du chirurgien) aide à faciliter la mise en place du brassard. Il est à noter que la mise en place d’un plus grand nombre de points de suture augmente le temps chirurgical.
De plus, le SHIVC est profondément dans la cavité abdominale et il est difficile de placer une pince dessus pour donner une exposition adéquate. Nous avons constaté que si la souris est aussi détendue que possible dans sa retenue, cela ajoutera à la flexibilité de la veine. En fin de compte, ce sera au chirurgien de déterminer le placement approprié avec la pratique. De plus, avec l’anastomose du CBD, le conduit est à nouveau très délicat. Il peut être difficile de placer des sutures de maintien pour stabiliser le conduit, et peut-être, le placer sur un petit morceau de gaze aidera à sa stabilisation. Enfin, comme tous les petits mammifères sont particulièrement délicats en ce qui concerne le temps d’anesthésie, il est important d’effectuer la chirurgie le plus rapidement possible. Les temps chirurgicaux idéaux sont les suivants : 1) opération du donneur, 45-60 min ; 2) préparation de la table arrière, 15 min ; 3) Opération du récepteur, 60-80 min. La pratique aidera à réduire les mouvements gaspillés.
Au fur et à mesure que les modèles animaux progressent, la capacité d’évaluer le succès des interventions de l’étude a également progressé. La microtomodensitométrie a été utilisée pour la première fois à la fin des années 1990 pour mener des études sur le système vasculaire chez le rat17. Il y a de nombreux défis à relever pour réaliser des études d’angiographie microCT précises et claires chez les rongeurs. Cependant, la plupart des défis découlent des cycles cardiaques et respiratoires courts de ces mammifères. Ce problème est résolu par l’utilisation d’expositions courtes pour limiter les artefacts de mouvement ainsi que des taux de fluence de photons plus élevés18. En général, nous avons constaté que l’utilisation de la barrière cardiaque, ainsi que l’ajustement des concentrations d’isoflurane pour diminuer la fréquence respiratoire, produisaient les images les plus claires. Nous avons également constaté que l’utilisation d’une synchronisation de contraste spécifique aux rongeurs pour des phases spécifiques : la phase artérielle hépatique, la phase veineuse porte et la phase retardée a également amélioré la visualisation19. L’utilisation du contraste ExiTron nano 12000 présente plusieurs avantages et peut améliorer la qualité globale de l’image. Il offre la plus forte amélioration du contraste dans le foie20 et le sang21. Un autre avantage est que le produit de contraste est présent dans le foie jusqu’à 120 h après l’injection initiale, ce qui pourrait réduire la toxicité hépatique associée, car moins de contraste est nécessaire si des examens répétés sont nécessaires20.
De plus, étant donné que les scintigraphies sont effectuées avec la souris sous sédation avec de l’isoflurane, l’amélioration du contraste n’est pas modifiée par ce changement de physiologie20. En utilisant ces techniques d’imagerie et le contraste ExiTron, il est possible d’évaluer clairement les anastomoses réussies dans l’OLT. La microtomodensitométrie permet une évaluation non invasive des allogreffes in vivo sur une période prolongée. Ce protocole permet de diminuer le nombre d’animaux qui doivent être sacrifiés pour évaluer les anastomoses vasculaires et d’étudier les thérapies pendant plusieurs semaines et leurs effets sur le système vasculaire.
Limitations
Il est à noter que, bien que de multiples révisions du modèle OLT aient eu lieu pour perfectionner sa technique, la visualisation des anastomoses à l’aide de la microTDM est toujours un processus en cours. De plus, l’OLT de souris offre un aperçu unique de la médecine de transplantation. Cependant, il ne s’agit pas d’un modèle global car il est difficile de garder ces souris en vie au-delà d’une semaine. D’autres modèles de transplantation devraient également être utilisés pour étayer davantage les expériences précliniques.
Conclusions
Les progrès de la microtomodensitométrie ont rapidement progressé au cours de la dernière décennie, fournissant aux chercheurs de nouveaux outils inestimables dans le domaine des modèles animaux et de la transplantation. À l’avenir, une imagerie 3D plus détaillée permettra d’approfondir les connaissances en matière de recherche et de découverte.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
SMB est soutenu par la subvention de l’Institut national du diabète et des maladies digestives et rénales (NIDDK) R01DK1234750. BAW est soutenu par le National Institutes of Health, le National Heart Lung and Blood Institute R01HL143000 subvention.
matériels
| Name | Company | Catalog Number | Comments |
| #11 Blade | Fisher Scientific | 3120030 | |
| 4-0 silk suture | Surgical Specialties Corp. | SP116 | |
| 6-0 nylon suture | AD Surgical | S-N618R13 | |
| 7-0 nylon suture | AD Surgical | S-N718SP13 | |
| 8-0 nylon suture | AD Surgical | XXS-N807T6 | |
| 10-0 nylon suture | AD Surgical | M-N510R19-B | |
| 20 G Angiocath | Boundtree | 602032D | |
| 30 G Needle | Med Needles | BD-305106 | |
| Baytril (enrofloxacin) Antibacterial Tablets | Elanco | NA | |
| Bovie Chang-A-Tip High Temp Cauterizer | USA Medical and Surgical Supplies | BM-DEL1 | |
| Bulldog Vein Clamp 1 1/8 | Ambler Surgical USA | 18-181 | |
| C57BL/6J mice | Jackson Labs | ||
| Castroviejo Micro Dissecting Spring Scissors | Roboz Surgical Store | RS-5668 | |
| Dumont #5 - Fine Forceps | Fine Science tools | 11254-20 | |
| Dumont #5 Forceps | Fine Science tools | 11252-50 | |
| Dumont Medical #5/45 Forceps - Angled 45° | Fine Science tools | 11253-25 | |
| ExiTron nano 12000 | Miltenyi Biotec | 130 - 095 - 698 | CT contrast agent |
| Forceps | Fine Science tools | 11027-12 | |
| Halsted-Mosquito Hemostat | Roboz Surgical | RS-7112 | |
| heparin | Fresnius Lab, Lake Zurich, IL | C504701 | |
| histidine-trypotophan-ketoglutarate | University Pharmacy | NA | |
| Insulated Container | YETI | ROADIE 24 HARD COOLER | https://www.yeti.com/coolers/hard-coolers/roadie/10022350000.html |
| Isoflurane | Piramal Critical Care | NDC 66794-017-25 | |
| ketamine | Hikma Pharmaceuticals PLC | NDC 0413-9505-10 | |
| Mirco Serrefines | Fine Science tools | 18055-05 | |
| Mouse Rectal Temperature Probe | WPI Inc | NA | |
| NEEDLE HOLDER/FORCEPS straight | Micrins | MI1540 | |
| PE10 Tubing | Fisher Scientific | BD 427400 | |
| perfadex | XVIVO Perfusion AB | REF99450 | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | |
| Puralube Ophthalmic Ointment | Dechra | NA | |
| saline | PP Pharmaceuticals LLC | NDC 63323-186-10 | |
| Scissors | Fine Science tools | 14090-11 | |
| Small Mouse Restraint – 1” inner diameter | Pro Lab Corp | MH-100 | |
| SomnoSuite Small Animal Anesthesia System | Kent scientific | SS-MVG-Module | |
| Surgical microscope | Leica | M500-N w/ OHS | |
| U-CTHR | MI Labs | NA | CT Scanner software |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15008-08 | |
| xylazine | Korn Pharmaceuticals Corp | NDC 59399-110-20 | |
| Yasagil clamp | Aesculap | FT351T | |
| Yasagil clamp | Aesculap | FT261T | |
| Yasagil clamp applicator | Aesculap | FT484T |
Références
- Rana, A., et al. Survival benefit of solid-organ transplant in the United States. JAMA Surgery. 150 (3), 252-259 (2015).
- Qian, S. G., Fung, J. J., Demetris, A. V., Ildstad, S. T., Starzl, T. E. Orthotopic liver transplantation in the mouse. Transplantation. 52 (3), 562-564 (1991).
- Nakano, R., et al. Dendritic cell-mediated regulation of liver ischemia-reperfusion injury and liver transplant rejection. Frontiers in Immunology. 12, 705465 (2021).
- Nakamura, K., et al. Antibiotic pretreatment alleviates liver transplant damage in mice and humans. Journal of Clinical Investigation. 129 (8), 3420-3434 (2019).
- Lee, S. K., et al. Patient-derived Avatar mouse model to predict the liver immune homeostasis of long-term stable liver transplant patients. Frontiers in Immunology. 13, 817006 (2022).
- Li, S. P., et al. Characterization and proteomic analyses of proinflammatory cytokines in a mouse model of liver transplant rejection. Oxidative Medicine and Cellular Longevity. 2022, 5188584 (2022).
- Huang, D. R., Wu, Z. J., Zhu, Y. Modified arterialization of orthotopic liver transplantation in a mouse model. Hepatobiliary Pancreatic Disease International. 9 (3), 264-268 (2010).
- Yokota, S., et al. Orthotopic mouse liver transplantation to study liver biology and allograft tolerance. Nature Protocols. 11 (7), 1163-1174 (2016).
- Chen, X. C., et al. Reduced complications after arterial reconnection in a rat model of orthotopic liver transplantation. Journal of Visual Experiments. (165), e60628 (2020).
- Nelson, K., et al. Method of isolated ex vivo lung perfusion in a rat model: lessons learned from developing a rat EVLP program. Journal of Visual Experiments. (96), e52309 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Lee, Y. G., et al. A rat lung transplantation model of warm ischemia/reperfusion injury: optimizations to improve outcomes. Journal of Visual Experiments. (176), e62445 (2021).
- Di Martino, M., et al. Imaging follow-up after liver transplantation. British Journal of Radiology. 89 (1064), 20151025 (2016).
- Vardar, B. U., Dupuis, C. S., Goldstein, A. J., Vardar, Z., Kim, Y. H. Ultrasonographic evaluation of patients with abnormal liver function tests in the emergency department. Ultrasonography. 41 (2), 243-262 (2022).
- Marx, J. Imaging. Animal models: live and in color. Science. 302 (5652), 1880-1882 (2003).
- Maehara, N. Experimental microcomputed tomography study of the 3D microangioarchitecture of tumors. European Radiology. 13 (7), 1559-1565 (2003).
- Garcia-Sanz, A., Rodriguez-Barbero, A., Bentley, M. D., Ritman, E. L., Romero, J. C. Three-dimensional microcomputed tomography of renal vasculature in rats. Hypertension. 31, 440-444 (1998).
- Badea, C., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating. Medical Physics. 31 (12), 3324-3329 (2004).
- Ma, G., et al. Assessment of hemodynamics in a rat model of liver cirrhosis with precancerous lesions using multislice spiral CT perfusion imaging. BioMed Research International. 2013, 813174 (2013).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media and Molecular Imaging. 11 (4), 272-284 (2016).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon