Method Article
Trapianto ortotopico di fegato di successo nei topi che utilizzano l'angiografia con tomografia microcomputerizzata
In questo articolo
Riepilogo
In questo protocollo, discutiamo l'implementazione di un modello di trapianto ortotopico di fegato (OLT) di successo nei topi. Inoltre, vengono discussi anche gli adiuvanti per analizzare ulteriormente la pervietà dell'allotrapianto dopo il successo dell'OLT in un topo, in particolare utilizzando scansioni di tomografia microcomputerizzata (microCT).
Abstract
L'angiografia con tomografia microcomputerizzata (microCT) è una risorsa inestimabile per i ricercatori. I nuovi progressi in questa tecnologia hanno permesso di ottenere immagini di alta qualità della micro-vascolarizzazione e sono strumenti ad alta fedeltà nel campo dei trapianti di organi. In questo modello di trapianto ortotopico di fegato (OLT) nei topi, la microCT offre l'opportunità di valutare l'anastomosi dell'allotrapianto in tempo reale e ha l'ulteriore vantaggio di non dover sacrificare gli animali da studio. La scelta del contrasto, così come le impostazioni di acquisizione dell'immagine, creano un'immagine ad alta definizione, che fornisce ai ricercatori informazioni inestimabili. Ciò consente di valutare gli aspetti tecnici della procedura e di valutare potenzialmente diverse terapie per un periodo di tempo prolungato. In questo protocollo, descriviamo in dettaglio un modello OLT nei topi in modo graduale e infine descriviamo un protocollo microCT in grado di fornire immagini di alta qualità, che aiutano i ricercatori nell'analisi approfondita del trapianto di organi solidi. Forniamo una guida passo-passo per il trapianto di fegato in un topo, oltre a discutere brevemente un protocollo per valutare la pervietà dell'innesto attraverso l'angiografia microCT.
Introduzione
Il trapianto è l'unica terapia efficace per la malattia epatica allo stadio terminale. Innegabilmente, il beneficio del trapianto di fegato è eccellente, con una sopravvivenza mediana di 11,6 anni contro i 3,1 anni in lista d'attesa1. Tuttavia, ci sono vincoli significativi, che limitano l'ampia applicazione del trapianto di fegato e, soprattutto, la mancanza di organi donatori idonei e di alta qualità. L'ampliamento del pool di organi donati richiederà, quindi, strategie innovative che consentano l'utilizzo di allotrapianti oggi considerati non idonei, aumentando il margine di sicurezza per il trapianto. Pertanto, per migliorare l'accesso al trapianto di fegato, è imperativo condurre studi preclinici su piccoli animali.
Particolarmente importanti per la ricerca sui trapianti sono i modelli di trapianto in vivo. Il trapianto ortotopico di fegato nel topo (OLT) esiste da quasi 30 anni2 ed è fondamentale per studiare molti aspetti del trapianto, tra cui la caratterizzazione delle risposte immunitarie, il danno da ischemia-riperfusione, il rigetto acuto, gli effetti terapeutici di nuovi agenti e la sopravvivenza a lungo termine 3,4,5,6,7 . L'uso dei topi per studiare il trapianto è fondamentale in quanto consente l'uso di linee di topi transgenici per studiare l'impatto di specifici percorsi molecolari sugli esiti del trapianto. I protocolli consolidati di trapianto di fegato di topo sono stati ben descritti in precedenza 8,9.
Esistono diversi metodi di anastomosi per la vena cava inferiore sopraepatica e infraepatica (IVC), la vena porta (PV) e il dotto biliare comune (CBD). In genere si basano sull'anastomosi della mano o su una tecnica di cuffia vascolare modificata simile al trapianto di polmone murino 10,11,12. Un passo importante nello studio a lungo termine e nella sopravvivenza dei topi riceventi, così come nello sviluppo di un programma di trapianto di fegato di topo sostenuto, è la capacità di valutare queste anastomosi critiche. Le modalità di imaging per valutare la pervietà dell'allotrapianto di fegato spesso si basano sull'ecografia e sulla tomografia computerizzata (TC) in ambito clinico13,14. La TC ha un netto vantaggio rispetto all'ecografia in quanto può offrire viste dell'intero addome per includere ogni anastomosi, anche se ottenere queste viste con gli ultrasuoni può essere particolarmente difficile nei piccoli animali. Ricerche e risorse significative sono state dedicate allo sviluppo di microCT accurate allo scopo di migliorare gli studi sugli animali e le informazioni che possiamo raccogliere da questi modelli di lesioni e malattie 15,16. Qui descriviamo un protocollo per il trapianto ortotopico di fegato di topo (Figura 1) e descriviamo brevemente un protocollo per la microCT per valutare la pervietà dell'allotrapianto e la durata delle anastomosi.
Protocollo
I topi maschi C57BL/6J (30 g di peso corporeo) sono stati ospitati in condizioni prive di agenti patogeni presso il Nationwide Children's Hospital Animal Facility. Tutte le procedure sono state eseguite in modo umano secondo la Guida del NIH e del Consiglio Nazionale delle Ricerche per la cura e l'uso umano degli animali da laboratorio e con l'approvazione del Comitato per la cura e l'uso degli animali istituzionali del Nationwide Children's Hospital (Protocollo IACUC AR17-00045). Vedere la Tabella dei materiali per i dettagli relativi a tutti i materiali, gli strumenti e le attrezzature utilizzati in questo protocollo.
1. Configurazione iniziale per l'intervento chirurgico di trapianto
- Installare dispositivi chirurgici.
- Installare dispositivi di monitoraggio chirurgico (ad es. dispositivo di monitoraggio della frequenza cardiaca, pulse-ox, sistema di monitoraggio modulare) e macchine per anestesia.
- Se disponibile, accendere la tavola riscaldante chirurgica a 42 °C.
- Assicurarsi che le macchine per la ventilazione e l'anestesia siano accese per riscaldare l'evaporatore di isoflurano. Riempire il serbatoio dell'anestesia con 30 ml di isoflurano liquido e assicurarsi che il ventilatore sia collegato all'ossigeno.
NOTA: In questo protocollo, non intubiamo l'animale; Utilizzare solo un cono nasale per l'ossigenazione.
- Registrare il peso corporeo dei topi riceventi e donatori.
- Accendi il microscopio operatorio ad alta potenza e regola l'altezza e la messa a fuoco in base alle preferenze del chirurgo. Assicurarsi che i restanti dispositivi chirurgici siano accesi (ad es. dispositivo di elettrocauterizzazione).
- Preparare e disporre gli strumenti chirurgici, nonché le fascette chirurgiche di nylon 10-0 (Figura 2).
NOTA: Tutti gli strumenti chirurgici sono stati sterilizzati in autoclave a 121 °C per 30 min. Inoltre, diverse configurazioni di strumenti chirurgici potrebbero essere ugualmente efficaci. - Preparare i bracciali per gli stent della vena porta (PV) e del dotto biliare comune (CBD) (Figura 3). Posizionare l'angioettatere, così come il PE10, su una superficie sterile sotto il microscopio ad alta potenza. Utilizzando una lama chirurgica #11, tagliare l'angiocatetere per formare un bracciale lungo 1,5 mm con una linguetta di circa 0,75 mm nella parte superiore del corpo del bracciale; tagliare il tubo in polietilene (PE10) a una lunghezza di 2,5 mm. Conservare i bracciali e lo stent in soluzione fisiologica sterile fino al momento dell'uso.
NOTA: Questo modello di trapianto utilizza un angiocatetere da 20 G per realizzare bracciali per la ricostruzione del PV, nonché un tubo in polietilene 10 (PE10) per la ricostruzione del CBD. Tutte le altre anastomosi sono cucite a mano. - Prepara le soluzioni. Preparare un'iniezione di eparina che verrà somministrata a 100 U in 0,5 mL di soluzione di istidina-triptofano-chetoglutarato (HTK). Conservare la soluzione salina, eparina-salina, PBS e HTK su ghiaccio.
2. Approvvigionamento di topi donatori
- Indurre l'anestesia nel topo donatore mettendolo in una camera di inalazione di isoflurano. Assicurarsi che la concentrazione di isoflurano sia di circa il 2,5% con un flusso di ossigeno di 2 ml/min. Attendere 5 minuti affinché si sviluppi un piano chirurgico di anestesia. Per garantire il corretto livello di anestesia, pizzicare il mouse per suscitare una reazione; Una mancanza di reazione indica che il livello corretto di anestesia è stato raggiunto.
- Radere l'addome del mouse utilizzando un tagliacapelli elettronico e posizionare il mouse in posizione supina sulla tavola riscaldante. Pulisci l'addome con iodio povidone, quindi etanolo al 70%. Metti un unguento oftalmico sotto gli occhi dei topi per prevenire la secchezza.
- Posizionare il topo sotto il microscopio ad alta potenza e mantenerlo sotto anestesia utilizzando un'inalazione di isoflurano di concentrazione del 2% con un flusso di ossigeno di 2 ml/min.
- Eseguire una laparotomia della linea mediana con un paio di forbici (preferenza del chirurgo) dal processo xifoideo alla sinfisi pubica. Successivamente, eseguire un'ulteriore incisione trasversale per creare un motivo "a croce" inferiore alle costole. Utilizzando una pinza emostatica per zanzare, ritrarre il processo xifoideo per ottenere un'adeguata esposizione del contenuto addominale.
NOTA: Le pinze possono essere fissate a seconda delle preferenze del chirurgo. - Eviscerare l'intestino e posizionarlo sul lato sinistro della cavità addominale in una spugna di garza bagnata. Mobilizzare il fegato rimuovendo tutti gli attacchi legamentosi.
- Esporre l'arteria epatica corretta (pHA). Scheletrare il vaso utilizzando una pinza curva e legarlo con sutura di nylon 10-0.
- Sezionare l'intera lunghezza del CBD usando una combinazione di dissezione affilata e smussata. Eseguire una ductotomia (abbastanza grande per lo stent CBD) il più vicino possibile al bordo superiore del pancreas per dare una lunghezza adeguata per l'uso futuro (~1 cm dal bordo inferiore del fegato). Inserire lo stent del dotto biliare nel CBD con una pinza fine e fissarlo con una sutura di nylon 10-0. Legare l'aspetto distale del CBD utilizzando una sutura di nylon 10-0 (Figura 4).
- Ritrarre il lobo epatico destro verso lo xifoide utilizzando una spugna di garza bagnata ed esporre l'IVC. Mobilizzare l'IVC infraepatico (IHIVC) lontano dal retroperitoneo e cauterizzare la vena surrenale destra utilizzando un dispositivo di cauterizzazione portatile (vedere Tabella dei materiali).
- Sezionare l'arteria e la vena renale destra e legare rispettivamente con nylon 7-0 e 10-0. Tagliare la vena e l'arteria renale destra e gli attacchi legamentosi rimanenti. Infine, rimuovere il rene destro.
NOTA: Questo viene fatto per avere una migliore esposizione quando finalmente si taglia l'IHIVC. - Iniettare 0,5 mL di HTK freddo con una soluzione di eparina 100 U attraverso il PV con un ago da 30 G. Attendere 1 minuto affinché l'eparina si distribuisca sistematicamente. Tagliare la vena porta appena sopra la vena splenica e la vena mesenterica superiore.
- Iniettare lentamente la soluzione fredda di conservazione HTK con eparina nell'IHIVC con un ago da 30 G per perfondere il fegato del donatore. Interrompere l'iniezione della soluzione una volta che il fluido proveniente dal FV è limpido. Al termine dell'iniezione, posizionare una micro pinza su IHIVC appena sopra la vena renale destra e tagliare appena inferiormente alla pinza. Una volta completato questo passaggio, spegnere il ventilatore e interrompere l'isoflurano poiché l'animale è appena stato soppresso.
- Tagliare il CBD distalmente allo stent precedentemente posizionato al punto 2.7. Inoltre, identificare il dotto cistico e legare il dotto con una sutura in nylon 10-0. Quindi, afferrare la cupola della cistifellea con un paio di pinze e sezionare liberamente dalla fossa della cistifellea usando una combinazione di dissezione acuta e smussata. Una volta che la cistifellea è adeguatamente mobilizzata, utilizzando un paio di forbici a molla, completare la colecistectomia tagliando il dotto cistico sopra la sutura precedentemente posizionata.
- Ritrarre il fegato inferiormente per esporre l'IVC sopraepatico (SHIVC). Tagliare lo SHIVC prestando particolare attenzione a dare una lunghezza adeguata per l'anastomosi nell'animale ricevente.
- Sezionare ulteriori attacchi legamentosi liberi al fegato e consegnare il fegato del donatore ex-vivo e posizionare l'organo in un contenitore con soluzione fisiologica fredda.
3. Preparazione dell'allotrapianto di fegato sul tavolo
- Metti il ghiaccio in un contenitore isolato e posiziona una capsula di Petri sul letto di ghiaccio. Riempire la capsula di Petri con soluzione fisiologica fredda. Posizionare l'allotrapianto di fegato nella capsula in modo che la superficie viscerale sia esposta.
- Posizionare il PV attraverso la cuffia precedentemente selezionata ed estromettere la vena in modo che la superficie endoteliale interna sia esposta. Fissare il bracciale con sutura in nylon 10-0. Assicurarsi che la sutura si trovi all'interno delle scanalature della cuffia per ottenere i migliori risultati (Figura 5).
- Regolare l'alloinnesto epatico per esporre lo SHIVC e posizionare due 8-0 suture di nylon a ore 3' e 9, rispettivamente, per l'eventuale anastomosi nell'animale ricevente. Regolare di nuovo l'alloinnesto epatico per esporre l'IHIVC e posizionare due 8-0 suture di nylon a ore 3' e 9, rispettivamente, per l'eventuale anastomosi nell'animale ricevente.
4. Funzionamento del destinatario
NOTA: Poiché si tratta di un'operazione sterile, utilizzare guanti e dispositivi di protezione individuale adeguati e somministrare antibiotici. Somministrare 0,1 mg/kg di buprenorfina per via sottocutanea come analgesia preoperatoria al momento dell'intervento.
- Esporre il pHA come nell'operazione del donatore; Utilizzare solo una laparotomia della linea mediana invece dell'incisione addominale precedentemente descritta.
- Mobilizzare il fegato e tagliare tutti gli attacchi legamentosi. Inoltre, legare i vasi frenici e paraesofagei sinistri con sutura in nylon 10-0.
- Ritrarre il fegato inferiormente e sezionare lo SHIVC dal retroperitoneo. Successivamente, ritrarre il fegato superiormente e sezionare l'IHIVC dal retroperitoneo. Cauterizzare le piccole vene a ponte e le vene lombari secondo necessità utilizzando la stessa tecnica descritta in precedenza.
- Cauterizzare la vena surrenale destra con il cauterismo manuale ed esporre l'ilo epatico. Legare il pHA con una sutura in nylon 10-0. Successivamente, sezionare il CBD libero dal PV e legare il CBD con una sutura 7-0 vicino alla biforcazione del CBD per dare una lunghezza adeguata per l'anastomosi del CBD.
- Utilizzare un micro clamp per bloccare l'IVC infraepatico e legare temporaneamente il PV con una sutura 7-0. Iniziare la fase an-epatica. Interrompere l'inalazione di isoflurano.
NOTA: Dopo aver clampato la vena porta e l'IVC, il ritorno venoso epatico è completamente bloccato nella fase anepatica. L'anestetico isoflurano inalato viene metabolizzato dal fegato; Pertanto la sua inalazione viene momentaneamente interrotta poiché l'accumulo può portare al collasso cardiopolmonare. - Attraverso il PV del fegato nativo, iniettare 0,5 ml di eparina-soluzione salina con un ago da 30 G per lavare l'organo.
- Posizionare i morsetti microvascolari sullo SHIVC e sull'IHIVC il più prossimalmente e distalmente possibile per lasciare una lunghezza adeguata per l'anastomosi. Tagliare lo SHIVC, IHIVC, PV nativo (vicino alla sutura precedentemente posizionata) e qualsiasi attacco legamentoso rimanente al fegato nativo del ricevente e consegnare il fegato nativo ex vivo.
NOTA: Il morsetto IHIVC deve trovarsi sopra la vena renale destra. - Posizionare l'allotrapianto di fegato del donatore all'interno della cavità addominale e ritrarre l'ilo dell'allotrapianto del donatore per esporre il PV. Sciacquare sia il PV donatore che quello nativo con 0,5 mL di soluzione salina di eparina utilizzando un ago da 30 G per disarieggiare i vasi ed evitare l'embolia gassosa. Quindi, inserire la cuffia precedentemente realizzata del PV del donatore nel lume del PV del fegato ricevente e, se necessario, posizionare i punti di sutura per aiutare con l'anastomosi (sutura 8-0). Fissare l'anastomosi con la sutura 7-0 (Figura 6).
- Ruotare la tavola di 180°. Eseguire un'anastomosi cucita a mano con sutura in nylon 10-0 con il donatore e SHIVC nativo. Dopo aver completato l'anastomosi della parete posteriore, sciacquare con 0,5 mL di soluzione fisiologica di eparina per eliminare l'aria ed evitare l'embolia gassosa. Anastomosi completa della parete superiore (Figura 7).
- Rimuovere prima la sutura di legatura del PV; quindi, rimuovere le pinze vascolari da SHIVC per iniziare la riperfusione. Terminare la fase an-epatica e riprendere l'inalazione di isoflurano. Eseguire l'anastomosi a mano con sutura in nylon 10-0, allo stesso modo dell'anastomosi SHIVC, per ricostruire l'IHIVC. Dopo aver completato la ricostruzione, rimuovere il micromorsetto dall'IHIVC nativo e donatore per eseguire la riperfusione (Figura 8).
- Eseguire l'anastomosi del CBD creando una ductotomia sul CBD ricevente vicino alla sutura precedentemente posizionata. Inserire lo stent nel CBD del donatore nel lume CBD del ricevente e fissare l'anastomosi con la sutura 10-0 (Figura 9).
- Irrigare la cavità addominale con 1 mL di soluzione fisiologica; Controllare l'emostasi e cauterizzare eventuali vasi sanguinanti rimanenti. Chiudere l'incisione addominale in due strati utilizzando la sutura 6-0.
- Mettere l'animale in un'incubatrice calda (42 °C) per il recupero e non lasciare l'animale incustodito fino a quando non ha ripreso conoscenza e un'attività sufficiente. Somministrare 0,1 mg/kg di buprenorfina per via sottocutanea dopo l'intervento chirurgico e continuare la somministrazione ogni 8-12 ore per 48 ore dopo l'intervento. Inoltre, somministrare carprofene (0,2 ml disciolti in 400 ml di acqua) attraverso la bottiglia d'acqua dell'animale ricevente per un massimo di 7 giorni dopo l'intervento chirurgico. Osservare l'animale ricevente per 4-5 ore e, una volta che si è completamente ripreso, riportarlo nel luogo di stabulazione poiché ora è sicuro stare con altri animali.
NOTA: I farmaci antidolorifici e gli antibiotici possono essere somministrati secondo le raccomandazioni del comitato etico locale per gli animali.
5. Imaging angiografico microCT di topo
- Dopo aver osservato il topo per l'intervallo di studio predeterminato, preparare il topo a valutare la pervietà dell'allotrapianto utilizzando l'angiografia microCT.
- Assicurarsi che le macchine per la ventilazione e l'anestesia siano accese per riscaldare l'evaporatore di isoflurano. Riempire il serbatoio dell'anestesia con 30 ml di isoflurano liquido e assicurarsi che il ventilatore sia collegato all'ossigeno. Accendere lo scanner microCT e assicurarsi che tutto il software funzioni correttamente.
- Avviare il software di acquisizione sul sistema di scansione microCT.
- Sul monitor dell'unità microCT, fare clic su Inizializza sistema e scegliere la modalità di scansione TC.
- Espellere il letto; Fissare il piano del mouse e bloccarlo.
- Accendere il piano riscaldante a 42 °C per la gabbia di recupero.
- Riempire una siringa da 1 mL con 100 μL di mezzo di contrasto CT. Collegare un ago calibro 30 per la futura somministrazione endovenosa di mezzo di contrasto. Assicurarsi che non vi siano bolle d'aria nella siringa.
- Posiziona un topo nel sistema di ritenuta della vena caudale. Una volta che il mouse è completamente all'interno del sistema di ritenuta, chiudere il cancello del sistema, lasciare che la coda cada verticalmente e pulirla accuratamente con una soluzione alcolica (etanolo al 70%).
NOTA: Il successo nell'incannulamento della vena caudale può essere aumentato riscaldando la coda dell'animale tenendola in una mano guantata per diversi minuti. - Afferrare la coda verso l'aspetto distale e posizionare due dita (indice e medio) attorno alla coda prossimale al sito di iniezione pianificato. Posizionare l'aspetto distale della coda (sotto il sito di iniezione) tra il pollice e l'anulare.
- Con entrambe le dita, esercitare una leggera pressione e inserire l'ago nella vena a una profondità ridotta, assicurandosi che la siringa e l'ago siano paralleli alla coda. Mentre si rilascia la pressione del dito indice sulla coda prossimale, somministrare per via endovenosa il mezzo di contrasto TC. Evitare l'aspirazione con la siringa in quanto ciò può causare il collasso della vena.
NOTA: Non deve essere avvertita alcuna resistenza durante l'iniezione se l'ago è posizionato in modo appropriato nella vena. In caso di resistenza, rimuovere l'ago e reinserirlo al di sopra del sito di iniezione originale. Se l'incannulamento della vena fallisce anche dopo due tentativi, sostituire l'ago. - Dopo aver iniettato con successo il mezzo di contrasto e aver rimosso l'ago, applicare una leggera compressione sul sito di iniezione utilizzando una garza sterile per fermare l'emorragia.
- Trasferire il topo nella camera di inalazione dell'isoflurano e impostare la concentrazione al 2,5% con un flusso di ossigeno di 2 ml/min e attendere 3-4 minuti. Una volta stabilito un piano di anestesia, trasferire rapidamente il mouse sul letto dello scanner microCT e posizionarlo in posizione prona sul tavolo dello scanner (Figura 10).
- Copri gli occhi dell'animale con la giusta quantità di unguento oftalmico. Posiziona l'ogiva nasale in modo appropriato sull'animale e assicurati che l'aria e l'isoflurano scorrano correttamente attraverso l'ogiva. Utilizzare gli stessi parametri di anestesia descritti in precedenza (passaggio 5.12). Lubrificare e inserire una sonda di temperatura rettale per monitorare continuamente la temperatura corporea dell'animale durante l'imaging.
- Posizionare un respiratore a contatto con il mouse.
- Utilizzare il nastro adesivo per fissare un elettrocardiogramma agli arti posteriori sinistro, destro e sinistro. Utilizzare il gel per ultrasuoni per migliorare il segnale tra il pad ECG e la pelle.
- Controllare l'ECG e il segnale respiratorio sul software del computer per assicurarsi che i complessi QRS corretti siano visibili sul monitor. A tale scopo, selezionare Derivazione logica nella scheda Impostazione origine e scegliere la derivazione che offre la curva ECG più chiara.
NOTA: Le derivazioni logiche corrispondono ai tre elettrodi ECG collegati alla parte destra e sinistra del torace e alla parte inferiore della gamba. Ogni derivazione rappresenta una curva ECG. - Impostare il guadagno per un'altezza del segnale corretta, di solito 4 o 8 è buono. Selezionare il doppio gating. Nella scheda Display Set Up, regolare le impostazioni del display per una visualizzazione chiara del segnale: selezionare le caselle accanto a ECG e RESP e impostare ciascuno su 500. Nella scheda Trigger Set Up, verificare che il canale A, il canale B e DualTrig siano selezionati.
- Assicurarsi che siano impostati anche i seguenti parametri: Soglia: quando il segnale scende al di sotto di questo valore; impostare il valore su 2.500; Isteresi: assicurarsi che il segnale attraversi l'isteresi per creare un punto di innesco software in corrispondenza del quale inizia un nuovo ciclo di attivazione; impostare il valore su 300; Ritardo: attendere prima che il trigger venga inviato; impostare il valore su 100; Inibizione: durante questo periodo non è possibile generare alcun segnale, impostare il valore a 200.
- Assicurarsi che la soglia per l'ECG sia inferiore al valore di isteresi e al di sopra del picco del segmento sT sullo schermo del display.
- Far avanzare l'animale nello scanner e premere Aggiorna immagine. Acquisire un'immagine da ricognizione radiografica dell'animale per selezionare il campo visivo appropriato e la copertura della scansione anatomica per la successiva immagine microCT.
- Eseguire l'acquisizione di immagini per angiografia microCT utilizzando i seguenti parametri: Ingrandimenti: Ultra focus, Angolo di scansione: Scansione completa (360), Energia: Singola, Modalità di scansione: Gated, Impostazione: Predefinita (rotazione completa di 360°, impostazioni predefinite del tubo a raggi X di 0,33 mA e 55 kV, 0,750° gradi per passo, 1 proiezione per passo, binning 1 x 1 e tempo di esposizione di 40 ms; il doppio gating indica gating cardiaco e respiratorio) (Figura 11).
- Al termine della scansione, trasferire l'animale in una gabbia di recupero preriscaldata. Una volta che l'animale si è completamente ripreso, trasferiscilo di nuovo nella sua gabbia primaria.
- Ricostruisci le immagini microCT utilizzando il software di sistema. Dopo aver caricato l'immagine, impostare le barre blu in modo che si trovi a cavallo dell'area anatomica di interesse; Visualizzare l'anteprima di una sezione per ridurre il volume e vincolare il più possibile il mouse (questa fase consente di ridurre le dimensioni dell'immagine ricostruita).
- Attivare il contorno del volume di interesse per ottimizzare il contorno dell'immagine. Scegli la dimensione del voxel di 40 μm, il filtro di proiezione Hann e il filtro del volume gaussiano (80 μm). Vai a Avanzate | Gating basato su immagini e regolare le finestre di attivazione e la fase rispettivamente su 0,5 e 0,6, scegliere 10 fasi per il gating cardiaco, quindi premere il pulsante di ricostruzione del volume .
Risultati
Per quei ricercatori che non sono chirurghi, che non hanno familiarità con l'anatomia o che non si sentono a proprio agio nell'interpretare i risultati radiologici, una corretta analisi delle immagini dovrebbe essere eseguita da personale con una formazione adeguata. Il successo di un OLT in un mouse è dimostrato nel protocollo di cui sopra. Inoltre, per migliorare le metriche dello studio e fornire un feedback in tempo reale per il successo di un trapianto, oltre a eliminare la necessità di necroscopia, è possibile utilizzare una scansione angiografica microCT per fornire immagini accurate e chiare. Immagini rappresentative sono incluse in questo manoscritto (Figura 11). Immagini rappresentative di anastomosi fallita in vivo possono essere viste nella Figura 12.
Coloro che hanno familiarità con l'anatomia epatica e la vascolarizzazione possono vedere anastomosi venose pervie dell'IVC. In alcune circostanze, è possibile visualizzare anche la vena porta, il che è reso facilmente in questo modello grazie alla cuffia della vena porta. La visualizzazione delle anastomosi aperte indica il successo tecnico dell'operazione. Inoltre, la ricostruzione 3D di queste immagini può fornire ulteriori informazioni ai ricercatori e un'immagine più dettagliata dell'anatomia vascolare. Utilizzando questo modello sopra, la mortalità nella coorte di topi OLT è ~40-45%.

Figura 1: Panoramica del trapianto ortotopico di fegato. (A) Disegno grafico raffigurante le quattro diverse anastomosi: i) anastomosi sopraepatica IVC, ii) anastomosi IVC infraepatica, iii) anastomosi della vena porta, iv) anastomosi del dotto biliare comune. Ogni freccia indica una posizione relativa per il punto in cui il vaso o il dotto deve essere tagliato: IVC sopra-epatica (fase 2.13 del protocollo), IVC infraepatica (fase 2.11 del protocollo), vena porta (fase 2.10 del protocollo) e dotto biliare comune (fase 2.7 del protocollo). (B) Diagramma in vivo delle anastomosi. Barra della scala = 2 mm. Abbreviazione: IVC = vena cava inferiore. Fare clic qui per visualizzare una versione più grande di questa figura.
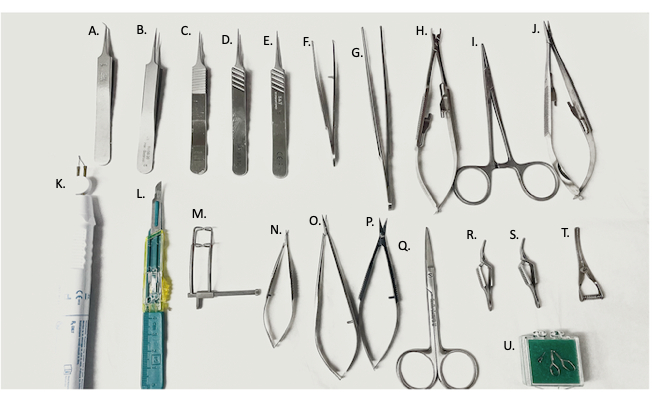
Figura 2: Strumenti chirurgici utilizzati in chirurgia. (A) pinza fine a 45°, (B-E) pinza fine, (F) porta-ago curvo/pinza, (G) pinza diritta, (H) applicatore di pinza vascolare, (I) emostato, (J) porta-ago, (K) dispositivo di elettrocauterizzazione, (L) lama #11, (M) divaricatore addominale, (N,O) micro-forbici, (P) forbici fini, (Q) forbici chirurgiche, (R,S) pinze Yasargil, (T) pinza venosa bulldog, (U) pinza microvascolare. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Cuffia della vena porta e stent del dotto biliare. Immagine ex vivo di stent e bracciali prima dell'uso. Barra della scala = 3,5 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
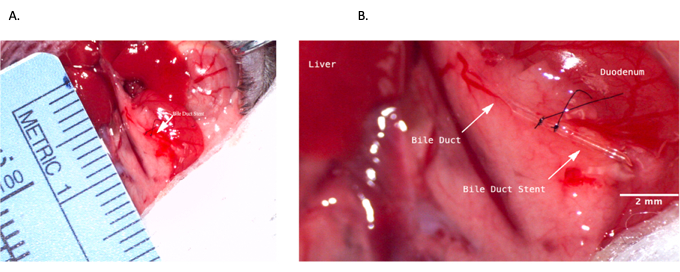
Figura 4: Stent del dotto biliare comune durante l'operazione del donatore. (A) Stent del dotto biliare inserito nel dotto biliare comune. (B) Stent del dotto biliare fissato all'interno del dotto biliare. Barra della scala = 2 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura 5: Posizionamento della cuffia della vena porta durante la preparazione dell'alloinnesto epatico. (A) Infilare la vena porta attraverso la cuffia venosa. (B) Vena estroflessa sopra il bracciale. Barra della scala = 2 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
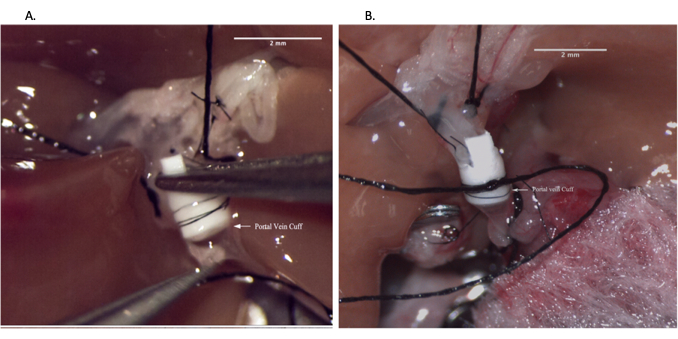
Figura 6: Anastomosi della vena porta durante l'operazione del ricevente. (A) Inserimento della cuffia venosa nella vena porta del ricevente. (B) Anastomosi della vena porta fissata con sutura. Barra della scala = 2 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
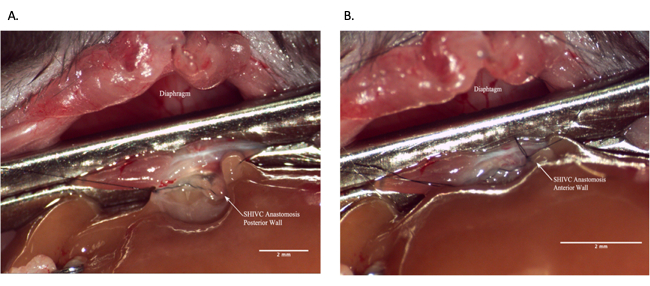
Figura 7: Anastomosi sopraepatica IVC durante l'operazione del ricevente. (A) La parete posteriore dell'anastomosi è completa. (B) Anastomosi SHIVC completata. Barra della scala = 2 mm. Abbreviazioni: IVC = vena cava inferiore; SHIVC = IVC sopraepatico. Fare clic qui per visualizzare una versione più grande di questa figura.
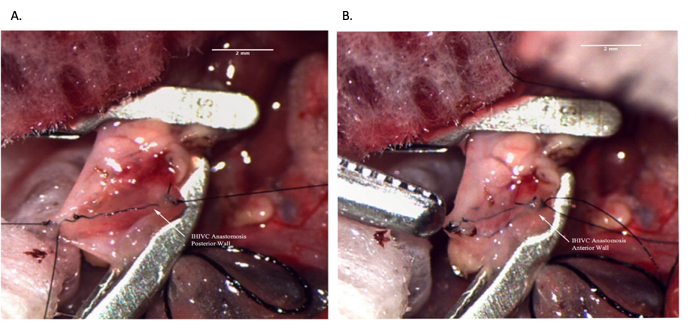
Figura 8: Anastomosi IVC infraepatica durante l'operazione del ricevente. (A) La parete posteriore dell'anastomosi è completa. (B) Anastomosi IHIVC completata. Barra della scala = 2 mm. Abbreviazioni: IVC = vena cava inferiore; IHIVC = IVC infraepatico. Fare clic qui per visualizzare una versione più grande di questa figura.
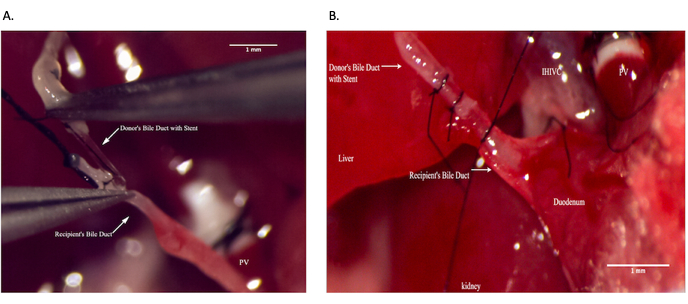
Figura 9: Anastomosi del dotto biliare comune durante l'operazione del ricevente. (A) Posizionamento dello stent del dotto biliare all'interno del dotto biliare comune ricevente. (B) Assicurare l'anastomosi del dotto biliare. Barra della scala = 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 10: Preparazione animale per angiografia microCT di topo. (A) Iniezione della vena caudale di topo per somministrare il mezzo di contrasto. (B) Topo che viene fatto passare attraverso una macchina microCT. Abbreviazione: microCT = tomografia microcomputerizzata. Fare clic qui per visualizzare una versione più grande di questa figura.
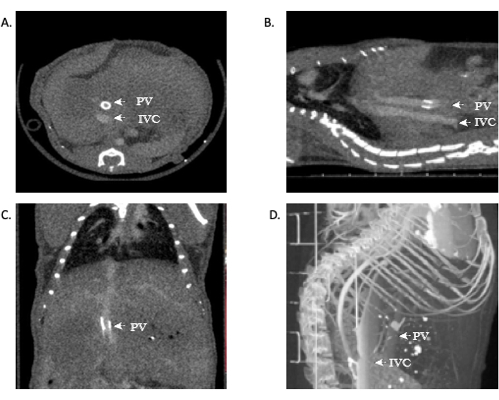
Figura 11: Immagini rappresentative che mostrano l'angiografia microCT della pervietà dell'allotrapianto. (A,B) Il contrasto può essere visto in tutto l'IVC, dimostrando la pervietà delle anastomosi sopraepatiche e infraepatiche. (C) Contrasto nella vena portale, dimostrando ancora una volta la pervietà. (D) Ricostruzione 3D del sistema vascolare. Abbreviazioni: microCT = tomografia microcomputerizzata; IVC = vena cava inferiore; PV = vena porta. Fare clic qui per visualizzare una versione più grande di questa figura.
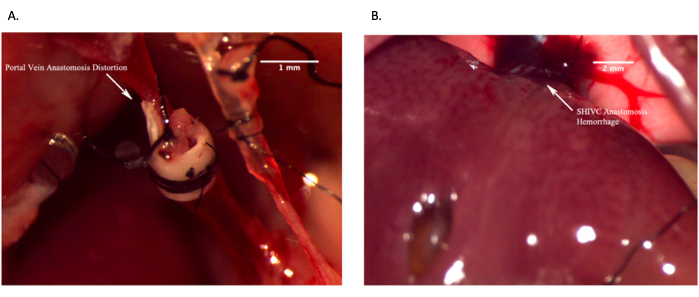
Figura 12: Immagini rappresentative che mostrano anastomosi in vivo fallite. (A) Anastomosi della vena porta fallita a causa della distorsione della vena con conseguente mancanza di flusso sanguigno. (B) Anastomosi IVC sopraepatica fallita a causa di sanguinamento eccessivo. Barra della scala = 2 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
L'OLT nei roditori è stata ben descritta in letteratura 2,8. Per eseguire questa procedura tecnicamente impegnativa, spesso sono necessari diversi anni di microchirurgia (o chirurgia in generale) in quanto ciò comporta una solida comprensione dell'anatomia e abilità tecniche. Nello sviluppo di questo modello, abbiamo affrontato diversi problemi tecnici che ruotano tutti intorno alle anastomosi. In particolare con l'anastomosi PV, è spesso difficile stabilizzare la vena per l'anastomosi. Abbiamo scoperto che il posizionamento di uno o due punti di sutura (preferenza del chirurgo) aiuta a facilitare il posizionamento della cuffia. Va notato che il posizionamento di più suture di soggiorno aumenta il tempo chirurgico.
Inoltre, lo SHIVC si trova in profondità all'interno della cavità addominale ed è difficile posizionare un morsetto per fornire un'esposizione adeguata. Abbiamo scoperto che se il topo è rilassato il più possibile nella sua contenzione, ciò aumenterà la flessibilità della vena. In definitiva, spetterà al chirurgo determinare il corretto posizionamento con la pratica. Inoltre, con l'anastomosi del CBD, il dotto è di nuovo molto delicato. Può essere difficile posizionare le suture per stabilizzare il dotto e, eventualmente, posizionarlo su un piccolo pezzo di garza aiuterà nella sua stabilizzazione. Infine, poiché tutti i piccoli mammiferi sono particolarmente delicati per quanto riguarda il tempo di anestesia, è importante eseguire l'intervento il più rapidamente possibile. I tempi chirurgici ideali sono i seguenti: 1) operazione di donatore, 45-60 min; 2) preparazione del tavolo posteriore, 15 min; 3) funzionamento del ricevitore, 60-80 min. La pratica aiuterà a ridurre lo spreco di movimento.
Con l'avanzare dei modelli animali, è aumentata anche la capacità di valutare il successo degli interventi di studio. La MicroCT è stata utilizzata per la prima volta per condurre studi sulla vascolarizzazione nei ratti alla fine degli anni '9017. Ci sono molte sfide nell'eseguire studi di angiografia microCT accurati e chiari nei roditori. Tuttavia, la maggior parte delle sfide deriva dai brevi cicli cardiaci e respiratori di questi mammiferi. Questo problema viene superato utilizzando esposizioni brevi per limitare gli artefatti da movimento e tassi di fluenza fotonica più elevati18. In generale, abbiamo scoperto che l'uso del gating cardiaco, così come la regolazione delle concentrazioni di isoflurano per ridurre la frequenza respiratoria, ha prodotto le immagini più chiare. Abbiamo anche scoperto che l'utilizzo della tempistica di contrasto specifica del roditore per fasi specifiche: fase arteriosa epatica, fase portale-venosa e fase ritardata ha anche migliorato la visualizzazione19. L'uso del contrasto ExiTron nano 12000 presenta diversi vantaggi e può migliorare la qualità complessiva dell'immagine. Offre il più forte miglioramento del contrasto nel fegato20 e nel sangue21. Un altro vantaggio è che il mezzo di contrasto è presente nel fegato fino a 120 ore dopo l'iniezione iniziale, il che potrebbe ridurre la tossicità epatica associata, poiché è necessario un minor mezzo di contrasto se sono necessarie scansioni ripetute20.
Inoltre, poiché le scansioni vengono eseguite con il topo sedato con isoflurano, l'aumento del contrasto non viene alterato con questo cambiamento nella fisiologia20. Utilizzando queste tecniche di imaging e il contrasto ExiTron, è possibile una chiara valutazione delle anastomosi di successo nell'OLT. MicroCT consente una valutazione non invasiva degli allotrapianti in vivo per un periodo prolungato. Questo protocollo riduce il numero di animali che devono essere sacrificati per valutare le anastomosi vascolari e offre l'opportunità di studiare le terapie per diverse settimane e il loro effetto sul sistema vascolare.
Limitazioni
Va notato che, sebbene siano state effettuate molteplici revisioni del modello OLT per perfezionarne la tecnica, la visualizzazione delle anastomosi mediante microCT è ancora un processo in corso. Inoltre, l'OLT del topo offre una visione unica della medicina dei trapianti. Tuttavia, non è un modello onnicomprensivo in quanto è difficile mantenere in vita questi topi oltre 1 settimana. Dovrebbero essere utilizzati anche altri modelli di trapianto per convalidare ulteriormente gli esperimenti preclinici.
Conclusioni
I progressi nella microCT sono progrediti rapidamente nell'ultimo decennio, fornendo ai ricercatori nuovi strumenti inestimabili nel campo dei modelli animali e dei trapianti. In futuro, l'imaging 3D più dettagliato offrirà ulteriori approfondimenti sulla ricerca e la scoperta.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
SMB è supportato dal National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK) R01DK1234750 di sovvenzioni. BAW è supportato attraverso il National Institutes of Health, National Heart Lung and Blood Institute, R01HL143000 di sovvenzioni.
Materiali
| Name | Company | Catalog Number | Comments |
| #11 Blade | Fisher Scientific | 3120030 | |
| 4-0 silk suture | Surgical Specialties Corp. | SP116 | |
| 6-0 nylon suture | AD Surgical | S-N618R13 | |
| 7-0 nylon suture | AD Surgical | S-N718SP13 | |
| 8-0 nylon suture | AD Surgical | XXS-N807T6 | |
| 10-0 nylon suture | AD Surgical | M-N510R19-B | |
| 20 G Angiocath | Boundtree | 602032D | |
| 30 G Needle | Med Needles | BD-305106 | |
| Baytril (enrofloxacin) Antibacterial Tablets | Elanco | NA | |
| Bovie Chang-A-Tip High Temp Cauterizer | USA Medical and Surgical Supplies | BM-DEL1 | |
| Bulldog Vein Clamp 1 1/8 | Ambler Surgical USA | 18-181 | |
| C57BL/6J mice | Jackson Labs | ||
| Castroviejo Micro Dissecting Spring Scissors | Roboz Surgical Store | RS-5668 | |
| Dumont #5 - Fine Forceps | Fine Science tools | 11254-20 | |
| Dumont #5 Forceps | Fine Science tools | 11252-50 | |
| Dumont Medical #5/45 Forceps - Angled 45° | Fine Science tools | 11253-25 | |
| ExiTron nano 12000 | Miltenyi Biotec | 130 - 095 - 698 | CT contrast agent |
| Forceps | Fine Science tools | 11027-12 | |
| Halsted-Mosquito Hemostat | Roboz Surgical | RS-7112 | |
| heparin | Fresnius Lab, Lake Zurich, IL | C504701 | |
| histidine-trypotophan-ketoglutarate | University Pharmacy | NA | |
| Insulated Container | YETI | ROADIE 24 HARD COOLER | https://www.yeti.com/coolers/hard-coolers/roadie/10022350000.html |
| Isoflurane | Piramal Critical Care | NDC 66794-017-25 | |
| ketamine | Hikma Pharmaceuticals PLC | NDC 0413-9505-10 | |
| Mirco Serrefines | Fine Science tools | 18055-05 | |
| Mouse Rectal Temperature Probe | WPI Inc | NA | |
| NEEDLE HOLDER/FORCEPS straight | Micrins | MI1540 | |
| PE10 Tubing | Fisher Scientific | BD 427400 | |
| perfadex | XVIVO Perfusion AB | REF99450 | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | |
| Puralube Ophthalmic Ointment | Dechra | NA | |
| saline | PP Pharmaceuticals LLC | NDC 63323-186-10 | |
| Scissors | Fine Science tools | 14090-11 | |
| Small Mouse Restraint – 1” inner diameter | Pro Lab Corp | MH-100 | |
| SomnoSuite Small Animal Anesthesia System | Kent scientific | SS-MVG-Module | |
| Surgical microscope | Leica | M500-N w/ OHS | |
| U-CTHR | MI Labs | NA | CT Scanner software |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15008-08 | |
| xylazine | Korn Pharmaceuticals Corp | NDC 59399-110-20 | |
| Yasagil clamp | Aesculap | FT351T | |
| Yasagil clamp | Aesculap | FT261T | |
| Yasagil clamp applicator | Aesculap | FT484T |
Riferimenti
- Rana, A., et al. Survival benefit of solid-organ transplant in the United States. JAMA Surgery. 150 (3), 252-259 (2015).
- Qian, S. G., Fung, J. J., Demetris, A. V., Ildstad, S. T., Starzl, T. E. Orthotopic liver transplantation in the mouse. Transplantation. 52 (3), 562-564 (1991).
- Nakano, R., et al. Dendritic cell-mediated regulation of liver ischemia-reperfusion injury and liver transplant rejection. Frontiers in Immunology. 12, 705465 (2021).
- Nakamura, K., et al. Antibiotic pretreatment alleviates liver transplant damage in mice and humans. Journal of Clinical Investigation. 129 (8), 3420-3434 (2019).
- Lee, S. K., et al. Patient-derived Avatar mouse model to predict the liver immune homeostasis of long-term stable liver transplant patients. Frontiers in Immunology. 13, 817006 (2022).
- Li, S. P., et al. Characterization and proteomic analyses of proinflammatory cytokines in a mouse model of liver transplant rejection. Oxidative Medicine and Cellular Longevity. 2022, 5188584 (2022).
- Huang, D. R., Wu, Z. J., Zhu, Y. Modified arterialization of orthotopic liver transplantation in a mouse model. Hepatobiliary Pancreatic Disease International. 9 (3), 264-268 (2010).
- Yokota, S., et al. Orthotopic mouse liver transplantation to study liver biology and allograft tolerance. Nature Protocols. 11 (7), 1163-1174 (2016).
- Chen, X. C., et al. Reduced complications after arterial reconnection in a rat model of orthotopic liver transplantation. Journal of Visual Experiments. (165), e60628 (2020).
- Nelson, K., et al. Method of isolated ex vivo lung perfusion in a rat model: lessons learned from developing a rat EVLP program. Journal of Visual Experiments. (96), e52309 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Lee, Y. G., et al. A rat lung transplantation model of warm ischemia/reperfusion injury: optimizations to improve outcomes. Journal of Visual Experiments. (176), e62445 (2021).
- Di Martino, M., et al. Imaging follow-up after liver transplantation. British Journal of Radiology. 89 (1064), 20151025 (2016).
- Vardar, B. U., Dupuis, C. S., Goldstein, A. J., Vardar, Z., Kim, Y. H. Ultrasonographic evaluation of patients with abnormal liver function tests in the emergency department. Ultrasonography. 41 (2), 243-262 (2022).
- Marx, J. Imaging. Animal models: live and in color. Science. 302 (5652), 1880-1882 (2003).
- Maehara, N. Experimental microcomputed tomography study of the 3D microangioarchitecture of tumors. European Radiology. 13 (7), 1559-1565 (2003).
- Garcia-Sanz, A., Rodriguez-Barbero, A., Bentley, M. D., Ritman, E. L., Romero, J. C. Three-dimensional microcomputed tomography of renal vasculature in rats. Hypertension. 31, 440-444 (1998).
- Badea, C., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating. Medical Physics. 31 (12), 3324-3329 (2004).
- Ma, G., et al. Assessment of hemodynamics in a rat model of liver cirrhosis with precancerous lesions using multislice spiral CT perfusion imaging. BioMed Research International. 2013, 813174 (2013).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media and Molecular Imaging. 11 (4), 272-284 (2016).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon