Method Article
التشكل ثلاثي الأبعاد في أمعاء على رقاقة باستخدام عضويات معوية مشتقة من مرضى التهاب الأمعاء
In This Article
Summary
يوفر دمج العضويات المعوية للكلاب ونظام الموائع الدقيقة Gut-on-a-Chip نماذج متعدية ذات صلة بأمراض الأمعاء البشرية. تسمح البروتوكولات المقدمة بتكوين 3D والنمذجة الديناميكية في المختبر للأمعاء ، مما يساعد في تطوير علاجات فعالة للأمراض المعوية في والبشر مع One Health.
Abstract
تمتلك أمعاء أوجه تشابه في علم التشريح وعلم الأحياء الدقيقة وعلم وظائف الأعضاء مع تلك الموجودة في البشر ، تصاب بشكل طبيعي باضطرابات معوية عفوية مماثلة للبشر. أدى التغلب على القيود المتأصلة في المواد العضوية ثلاثية الأبعاد (3D) في الوصول إلى السطح القمي للظهارة المعوية إلى توليد ثقافات أحادية الطبقة ثنائية الأبعاد (2D) ، والتي تكشف السطح اللمعي الذي يمكن الوصول إليه باستخدام الخلايا المشتقة من الكائنات العضوية. أدى دمج هذه الكائنات العضوية والثقافات أحادية الطبقة المشتقة من المواد العضوية في نظام Gut-on-a-Chip الموائع الدقيقة إلى تطوير التكنولوجيا بشكل أكبر ، مما يسمح بتطوير نماذج ديناميكية أكثر صلة من الناحية الفسيولوجية في الأمعاء المختبرية .
في هذه الدراسة ، نقدم بروتوكولا لتوليد مورفجينيست 3D من ظهارة الأمعاء باستخدام عينات الأنسجة المعوية الأولية التي تم الحصول عليها من المتضررة من مرض التهاب الأمعاء (IBD). نحن أيضا الخطوط العريضة لبروتوكول لتوليد والحفاظ على الثقافات أحادية الطبقة 2D وأنظمة الأمعاء على رقاقة باستخدام الخلايا المشتقة من المواد العضوية المعوية 3D. تعمل البروتوكولات المقدمة في هذه الدراسة كإطار تأسيسي لإنشاء نظام Gut-on-a-Chip microfluidic المصمم خصيصا للأنياب. من خلال وضع الأساس لهذا النهج المبتكر ، نهدف إلى توسيع تطبيق هذه التقنيات في البحوث الطبية الحيوية والانتقالية ، بما يتماشى مع مبادئ مبادرة صحة واحدة. من خلال استخدام هذا النهج ، يمكننا تطوير نماذج ديناميكية أكثر ملاءمة من الناحية الفسيولوجية في المختبر لدراسة فسيولوجيا الأمعاء في كل من والبشر. هذا له آثار كبيرة على التطبيقات الطبية الحيوية والصيدلانية ، لأنه يمكن أن يساعد في تطوير علاجات أكثر فعالية للأمراض المعوية في كلا النوعين.
Introduction
تمت دراسة التشكل الظهاري المعوي إلى حد كبير من خلال نماذج المختبر ، وهي مكلفة وتستغرق وقتا طويلا ولا تمثل بدقة عمليات النمو البشري1. علاوة على ذلك ، تفتقر نماذج زراعة الخلايا ثنائية الأبعاد الثابتة التقليدية إلى القدرة على تقليد التنظيم المكاني المعقد للبنية الظهارية ثلاثية الأبعاد2. نتيجة لذلك ، هناك حاجة إلى بروتوكول للحث على التشكل 3D في المختبر باستخدام الخلايا الظهارية المعوية من النماذج الحيوانية ذات الصلة بالإنسان لتعزيز فهمنا للهندسة الظهارية للأمعاء.
طورت المصاحبة التشريح المعوي وتركيبات الميكروبيوم التي تشبه بشكل ملحوظ البشر بسبب بيئتهم المشتركة ونظامهم الغذائي أثناء التدجين3. بالإضافة إلى هذا التشابه ، يشترك كل من البشر في العديد من الأمراض المزمنة التي يعتقد أنها تعزى إلى صحة الأمعاء. يمكن للكلاب ، مثل البشر ، أن تصاب تلقائيا بحالات مزمنة مثل السمنة ، والخلل الوظيفي المعرفي ، ومرض السكري ، ومرض التهاب الأمعاء (IBD) ، وسرطان القولون والمستقيمالغدي 4،5،6،7،8،9،10. على الرغم من تطور واستخدام الخلايا الظهارية البشرية والفئران في دراسات Gut-on-a-Chip السابقة2،11،12،13،14 ، لم يتم استخدام ظهارة الأمعاء للكلاب حتى الآن. نهجنا الجديد ، باستخدام ظهارة عضوية معوية للكلاب في نظام ثقافة ديناميكي مع مورفجيني ظهاري 3D ، له آثار كبيرة على كل من والطب البشري.
أدت التطورات الحديثة في ثقافة الأعضاء المعوية إلى إنشاء ثقافة عضوية معوية للكلاب15. يتضمن نظام الاستزراع هذا زراعة الخلايا الجذعية المعوية تحت تكييف مورفوجين محدد ، مما ينتج عنه نموذج ثلاثي الأبعاد بخصائص تجديد ذاتي مشتقة من الخلايا الجذعية البالغة16. ومع ذلك ، فإن إجراء مقايسات النقل أو الثقافات المشتركة للميكروبيوم المضيف يشكل صعوبات مع هذا النموذج ثلاثي الأبعاد بسبب الطبيعة المغلقة للتجويف المعوي17. لمعالجة هذا الأمر ، قام الباحثون بإنشاء طبقة أحادية 2D مشتقة من الكائنات العضوية المعوية ، مما يسمح بالتعرض للسطح اللمعي18,19. ومع ذلك ، يتم الحفاظ على كل من المواد العضوية 3D و 2D monolayers في ظل ظروف ثابتة ، والتي لا تعكس بدقة الميكانيكا الحيوية في الجسم الحي للبيئة الدقيقة المعوية. الجمع بين تكنولوجيا عضويات المشتقة من المريض مع مورفجينيسيس 3D في المختبر يمثل فرصة للبحث متعدية في الأمراض المزمنة متعددة العوامل. يمكن هذا النهج الباحثين من تطوير علاجات أكثر فعالية تفيد كل من البشر ومواصلة تطوير البحوث الانتقالية ، بما يتماشى مع مبادرة الصحة الواحدة ، وهي نهج تعاوني يعترف بالترابط بين صحة الإنسان والبيئة. وهو يعزز التعاون متعدد التخصصات لمواجهة التحديات الصحية المعقدة وتحقيق النتائج الصحية المثلى للجميع. من خلال فهم الترابط بين البشر والنظم الإيكولوجية ، تهدف المبادرة إلى التخفيف من المخاطر الناجمة عن الأمراض المعدية الناشئة والتدهور البيئي وغيرها من المخاوف الصحية المشتركة20،21،22.
يحدد هذا البروتوكول طرقا شاملة لزراعة الخلايا الظهارية المعوية للكلاب التي تم الحصول عليها من عضويات المريض على جهاز دقيق Gut-on-a-Chip مع غشاء مسامي قائم على polydimethylsiloxane (PDMS). إنشاء التشكل الظهاري 3D من خلال دمج العضويات المعوية وهذه التكنولوجيا القناة الهضمية على رقاقة تمكننا من دراسة كيفية تطور الأمعاء والحفاظ على تنظيمها الخلوي ومكانة الخلايا الجذعية. توفر هذه المنصة فرصة ثمينة للتحقيق في تأثير مجتمعات الميكروبيوم على صحة الأمعاء وفهم كيفية توليد هذه المجتمعات للمستقلبات الميكروبية التي تساهم في الفيزيولوجيا المرضية المعوية14,23. يمكن الآن توسيع هذه التطورات لتشمل عينات الأمعاء للكلاب ، مما يوفر للباحثين فرصا لاستكشاف العلاقة المعقدة بين ميكروبيوم الأمعاء وفسيولوجيا المضيف. هذا يفتح سبلا لاكتساب رؤى قيمة حول الآليات الأساسية للفيزيولوجيا المرضية المعوية وفهم الدور المحتمل للمستقلبات الميكروبية في كل من صحة والإنسان ، وكذلك الحالات المرضية المختلفة. البروتوكول المستخدم للكلاب Gut-on-a-Chip قابل للتكرار ، مما يجعله نموذجا تجريبيا مناسبا للطب المقارن ، حيث يتيح هذا النهج التحقيق في تفاعلات ميكروبيوم المضيف ، والتهابات مسببات الأمراض ، والآثار العلاجية القائمة على البروبيوتيك في كل من والبشر.
Protocol
تمت الموافقة على الدراسة وأجريت وفقا للجنة المؤسسية لرعاية واستخدام بجامعة ولاية واشنطن (ASAF # 6993). في هذا البروتوكول ، استخدمنا جهاز الموائع الدقيقة Gut-on-a-Chip الراسخ المصنوع من PDMS والذي تم تصنيعه داخليا2 (الشكل 1D). يمكن العثور على طرق مفصلة لتصنيع الجهاز الصغير Gut-on-a-Chip في التقارير السابقة 2,24. يوضح هذا البروتوكول تكاملا فريدا للعضويات المعوية ونظام الموائع الدقيقة (الشكل 2).
1. التنشيط السطحي للأمعاء على شريحة مصنوعة من PDMS
- قم بإعداد محلول بولي إيثيلين 1٪ (PEI) بإضافة 1 مل من محلول PEI بنسبة 50٪ إلى 49 مل من الماء المقطر (DI) في أنبوب مخروطي سعة 50 مل. اقلب الأنبوب مرتين إلى ثلاث مرات لخلط المحلول جيدا ، ثم قم بتصفية المحلول باستخدام مرشح حقنة 0.2 ميكرومتر.
ملاحظة: احتفظ بها مخزنة في درجة حرارة 4 درجات مئوية. - قم بإعداد محلول الجلوتارالدهيد (GA) بنسبة 0.1٪ عن طريق إضافة 100 ميكرولتر من محلول GA بنسبة 50٪ إلى 49.9 مل من DI في أنبوب مخروطي سعة 50 مل. اقلب الأنبوب مرتين إلى ثلاث مرات لخلط المحلول جيدا ، ثم قم بتصفية المحلول باستخدام مرشح حقنة 0.2 ميكرومتر.
ملاحظة: قم بتخزينه في درجة حرارة 4 درجات مئوية وتأكد من حمايته من التعرض للضوء المباشر. - ضع جهاز Gut-on-a-Chip في فرن جاف على حرارة 60 درجة مئوية واحتضنه لمدة لا تقل عن 30 دقيقة للتخلص من أي رطوبة متبقية.
- قم بتعريض جهاز Gut-on-a-Chip للعلاج بالأشعة فوق البنفسجية والأوزون لمدة 60 دقيقة باستخدام مولد الأشعة فوق البنفسجية / الأوزون.
ملاحظة: لضمان التنشيط الأمثل لأسطح PDMS أثناء المعالجة ، حافظ على مسافة حوالي 3 سم أو أقل بين مصباح الأشعة فوق البنفسجية والجهاز. تجنب اكتظاظ الأجهزة في المولد لتحقيق تنشيط السطح بكفاءة. - قم بتأمين مدخل القناة الدقيقة العلوية وتجاوزها وأنبوب المخرج باستخدام مشابك الموثق لتثبيتها. قم أيضا بتثبيت أنبوب المدخل للقناة الصغيرة السفلية.
- افصل أنبوب المخرج للقناة الدقيقة السفلية. تأكد من أن الأنبوب الجانبي للقناة الدقيقة السفلية يظل مفتوحا.
- باستخدام ماصة P100 الدقيقة ، أدخل 100 ميكرولتر من محلول PEI بنسبة 1٪ من خلال فتحة مخرج القناة الدقيقة السفلية.
ملاحظة: يوصى بإجراء هذه العملية بينما لا يزال الجهاز دافئا من التعرض للأشعة فوق البنفسجية / الأوزون. لاحظ أن محلول PEI يتدفق عبر القناة الدقيقة ويسقط محلول PEI ليخرج من الأنبوب الجانبي للقناة الدقيقة السفلية. - أعد توصيل أنبوب المخرج للقناة الدقيقة السفلية.
- قم بتأمين مدخل القناة الدقيقة السفلية وتجاوزها وأنبوب المخرج باستخدام مشابك الموثق لتثبيتها. قم أيضا بتثبيت أنبوب المدخل للقناة الدقيقة العلوية.
- افصل أنبوب المخرج للقناة الدقيقة العلوية. تأكد من أن الأنبوب الجانبي للقناة الصغيرة العلوية يظل مفتوحا.
- باستخدام ماصة P100 الدقيقة ، أدخل 100 ميكرولتر من محلول PEI بنسبة 1٪ من خلال فتحة مخرج القناة الدقيقة العلوية.
ملاحظة: لاحظ أن محلول PEI يتدفق عبر القناة الدقيقة ويسقط محلول PEI ليخرج من الأنبوب الجانبي للقناة الدقيقة العلوية. - أعد توصيل أنبوب مخرج القناة الدقيقة العلوية.
- بمجرد ملء كل من القنوات الدقيقة العلوية والسفلية بمحلول PEI بنسبة 1٪ ، اسمح للجهاز بالحضانة في درجة حرارة الغرفة (RT) لمدة 10 دقائق.
- قم بتنفيذ الخطوات 1.5-1.12 باستخدام محلول GA بنسبة 0.1٪.
- بمجرد ملء كل من القنوات الدقيقة العلوية والسفلية بمحلول GA بنسبة 0.1٪ ، اسمح للجهاز بالاحتضان في RT لمدة 20 دقيقة.
- نفذ الخطوات 1.5-1.12 باستخدام ماء DI لإزالة أي محلول تنشيط سطحي زائد.
- ضع الشريحة في فرن جاف على حرارة 60 درجة مئوية واتركها تجف طوال الليل.
ملاحظة: تأكد من إزالة مشابك الموثق من جميع الأنابيب لتجنب أي اصطدام بالأنبوب. تعد عملية التجفيف هذه ضرورية للتنشيط السطحي المتساوي للقناة الدقيقة داخل Gut-on-a-Chip12.
2. طلاء المصفوفة خارج الخلية (ECM) وإعداد وسط الثقافة لثقافة القناة الهضمية على رقاقة
- تحضير خليط ECM مع وسط قاعدي عضوي بحيث يكون التركيز النهائي للكولاجين I و Matrigel 60 ميكروغرام / مل و 2٪ (حجم / حجم) ، على التوالي.
ملاحظة: قم بإعداد 50 ميكرولتر من خليط ECM لكل شريحة أمعاء (أي 20 ميكرولتر من خليط ECM لكل قناة دقيقة علوية وسفلية و 10 ميكرولتر إضافية). قم بإعداد هذا في يوم الاستخدام وقم بتخزين هذا المحلول في درجة حرارة 4 درجات مئوية أو ضعه على الثلج حتى يصبح جاهزا للاستخدام. - أخرج Gut-on-a-Chip الذي تمت معالجته بالأشعة فوق البنفسجية / الأوزون و PEI و GA من الفرن الجاف.
ملاحظة: افحص تحت مجهر تباين الطور لمعرفة ما إذا كان هناك أي رطوبة متبقية. - اترك Gut-on-a-Chip يبرد في خزانة السلامة الحيوية لمدة 10 دقائق.
- قم بتأمين مدخل القناة الدقيقة العلوية وتجاوزها وأنبوب المخرج باستخدام مشابك الموثق لتثبيتها. قم أيضا بتثبيت أنبوب المدخل للقناة الصغيرة السفلية.
- افصل أنبوب المخرج للقناة الدقيقة السفلية.
- باستخدام ماصة صغيرة P100 ، أدخل 20 ميكرولتر من خليط ECM من خلال فتحة مخرج القناة الدقيقة السفلية.
ملاحظة: لاحظ أن خليط ECM يتدفق عبر القناة الدقيقة دون أي انحباس لفقاعة الهواء. في حالة وجود أي فقاعة هواء ، أدخل خليط ECM إضافيا إلى القناة الدقيقة السفلية حتى تختفي الفقاعة. - أعد توصيل أنبوب المخرج للقناة الدقيقة السفلية.
- قم بتأمين مدخل القناة الدقيقة السفلية وتجاوزها وأنبوب المخرج باستخدام مشابك الموثق لتثبيتها. قم أيضا بتثبيت أنبوب المدخل للقناة الدقيقة العلوية.
- افصل أنبوب المخرج للقناة الدقيقة العلوية.
- باستخدام ماصة P100 الدقيقة ، أدخل 20 ميكرولتر من خليط ECM من خلال فتحة مخرج القناة الدقيقة العلوية.
- أعد توصيل أنبوب المخرج للقناة الدقيقة العلوية.
- ضع الشريحة في حاضنة CO 2 مرطبة مع 5٪ CO2 عند 37 درجة مئوية لمدة 1 ساعة لتشكيل طبقة ECM على غشاء PDMS المعالج ب PEI و GA (الشكل 3 أ).
ملاحظة: تأكد من تثبيت جميع الأنابيب أثناء الحضانة. - أثناء حضانة طلاء ECM ، قم بإعداد حقنتين سعة 1 مل تحتويان على وسط البذر البارد ، وهو وسط الاستزراع العضوي الذي يفتقر إلى A8301 ولكنه يحتوي على 10 ميكرومتر Y-27632 و 2.5 ميكرومتر CHIR99021 ، كما ورد سابقا في Gut-on-a-Chip المشتقة من الكائنات العضويةالبشرية 2.
ملاحظة: تمت إزالة A8301 من الوسط لتعزيز ارتباط الخلايا ب ECM المطلي كما ورد سابقا2. اليوم 0 من ثقافة Gut-on-a-Chip يتطلب فقط تدفق القنوات الدقيقة العلوية. لذلك ، قم بإعداد حقنة كاملة للقناة العلوية بينما لا يقل عن 0.2 مل للقناة السفلية. - بمجرد اكتمال طلاء ECM ، أخرج الشريحة من الحاضنة وحرر المشبك إلى الأنبوب الجانبي المتصل بالقناة الدقيقة السفلية.
- قم بتوصيل حقنة سعة 1 مل مملوءة بوسط البذر بالإبرة الحادة المرتبطة بالقناة الدقيقة السفلية للأمعاء على رقاقة. أدخل بعناية وسط البذر (~ 50 ميكرولتر) إلى الأنبوب الجانبي. بمجرد ملء الأنبوب بالوسط المقدم ، قم بتأمين الأنبوب الجانبي المتصل بالقناة الدقيقة السفلية بمشبك موثق.
- حرر مشبك أنبوب المخرج المتصل بالقناة الدقيقة السفلية. أدخل وسيط البذر بعناية في القناة الدقيقة السفلية مما يسمح له بالتدفق بسلاسة عبر النظام. قم بتأمين أنبوب المخرج المتصل بالقناة الدقيقة السفلية بمشبك موثق بعد التروية.
- بعد ذلك ، افتح الأنبوب الجانبي المتصل بالقناة الدقيقة العلوية.
- قم بتوصيل حقنة سعة 1 مل مملوءة بوسط البذر بالإبرة الحادة المرتبطة بالقناة الدقيقة العلوية ل Gut-on-a-Chip. أدخل بعناية وسط البذر (~ 50 ميكرولتر) إلى الأنبوب الجانبي. بمجرد ملء الأنبوب بالوسط المقدم ، قم بتأمين الأنبوب الجانبي المتصل بالقناة الدقيقة العلوية بمشبك موثق.
- حرر أنبوب المخرج المتصل بالقناة الدقيقة السفلية. أدخل وسيط البذر بعناية في القناة الدقيقة العلوية مما يسمح له بالتدفق بسلاسة عبر النظام. قم بتأمين أنبوب المخرج المتصل بالقناة الدقيقة العلوية بمشبك موثق بعد التروية.
3. إعداد الخلايا العضوية المعوية للبذر
ملاحظة: لإنشاء نموذج Gut-on-a-Chip ، تم استخدام عضويات القولون (المشار إليها باسم القولون) المشتقة من مريض IBD في هذا البروتوكول. تم اشتقاق هذه القولونات من ثلاثة إلى خمسة أجزاء صغيرة من أنسجة القولون المأخوذة ، باتباع طريقة تم الإبلاغ عنها سابقا15،18. للحصول على أفضل النتائج ، من الضروري استخدام قولون الذي خضع لما لا يقل عن ثلاثة ممرات استزراع لإنشاء عضويات مستقرة مناسبة للتطبيقات في المختبر . يوصى بزراعة قولون لمدة لا تقل عن 3-4 أيام لتسهيل التمايز الكافي للخلايا متعددة السلالات داخل الكائنات العضوية ، مما يضمن نضجها الوظيفي وملاءمتها للتجارب اللاحقة في نموذج Gut-on-a-Chip. الحد الأقصى للمقطع لهذا العمل هو أقل من 20 ، كما هو موضح في دراسة سابقة أظهرت النمط الظاهري والنمط النووي غير المتغير خلال 20 مقطعا متتاليا25. وترد إشارات هؤلاء المانحين في الجدول التكميلي S1.
- استزراع قولون في 24 لوحة بئر مدمجة في 30 ميكرولتر من Matrigel 15,18 مع وسط ثقافة عضوي مدرج في جدول المواد ، والذي تم تعديله من الوسط المبلغ عنه سابقا 15،26،27. تم الحصول على الوسط المكيف عن طريق زراعة خلايا Rspo1 وخلايا HEK293 المصممة لإفراز Noggin28.
- تخلص من وسط الاستزراع العضوي من خلال الشفط الفراغي وأدخل 500 ميكرولتر من محلول استعادة الخلايا عند درجة حرارة باردة في كل بئر. احتضان لمدة 30 دقيقة على حرارة 4 درجات مئوية.
ملاحظة: عادة ، توفر ثلاثة آبار من أصل 24 صفيحة بئر من الكائنات العضوية المعوية الناضجة للكلاب كمية كافية من الخلايا المنفصلة لزرع جهاز Gut-on-a-Chip واحد مع 40-50 عضويا / مجال رؤية واحد عند تكبير x10. - قم بتعطيل قباب Matrigel ميكانيكيا لمدة 5 ثوان باستخدام ماصة P1000 الدقيقة. بعد ذلك ، اجمع التعليق العضوي في أنبوب مخروطي سعة 15 مل.
- جهاز طرد مركزي الأنبوب المخروطي عند 200 × جم و 4 درجات مئوية لمدة 5 دقائق ، تليها إزالة المادة الطافية.
- أدخل 1 مل من البروتياز الشبيه بالتريبسين في درجة حرارة الغرفة ، مع استكماله ب 10 ميكرومتر Y-27632 ، وأعد تعليق حبيبات الخلية عن طريق السحب باستخدام ماصة P1000 micropipette.
- ضع معلق الخلية في حمام مائي على حرارة 37 درجة مئوية واحتضنه لمدة 10 دقائق مع رج الخليط بشكل دوري.
- أدخل 5 مل من الوسط القاعدي العضوي الدافئ وماصة بقوة تعليق الخلية باستخدام ماصة P1000 الدقيقة حتى تصبح غائمة ، دون أي كتل خلية مرئية.
- مرر تعليق الخلية من خلال مصفاة خلوية بقطع 70 ميكرومتر للتخلص من أي حطام Matrigel ومجموعات الخلايا الكبيرة.
- جهاز طرد مركزي الأنبوب المخروطي عند 200 × جم و 4 درجات مئوية لمدة 5 دقائق ، تليها إعادة تعليق الحبيبات في وسط البذر. لبذر جهاز Gut-on-a-Chip واحد للكلاب ، استخدم 20 ميكرولتر من وسط البذر لإعادة تعليق حبيبات الخلية (على سبيل المثال ، استخدم 20 ميكرولتر من وسط البذر عند بذر جهاز Gut-on-a-Chip واحد).
- تعديل تركيز الخلايا القابلة للحياة إلى 1 × 107 خلايا / مل مع وسط البذر كما تم الإبلاغ عنه سابقا2. إجراء تقييم الجدوى باستخدام مقياس الدم عن طريق الجمع بين 10 ميكرولتر من تعليق الخلية مع 10 ميكرولتر من تريبان الأزرق ، ثم مراقبة الخلايا تحت المجهر.
ملاحظة: من الأهمية بمكان ضبط تركيز الخلية بشكل مناسب لضمان الارتباط الأمثل للخلية وتشكيل طبقة أحادية موحدة على غشاء الرقاقة. إذا كان العدد الأولي للخلايا غير كاف ، فقد يؤدي ذلك إلى تأخير أو فشل إنشاء طبقة أحادية متقاربة. على العكس من ذلك ، إذا كان عدد الخلايا مفرطا ، يمكن أن تتجمع الخلايا غير الملتصقة في كتل داخل القناة ، مما يؤدي إلى تأثيرات تركيز غير مرغوب فيها.
4. البذر وتشكيل خلية أحادية الطبقة 2D
- افصل أنبوب المخرج للقناة الدقيقة العلوية. تأكد من أن الأنبوب الجانبي للقناة الصغيرة العلوية يظل مفتوحا. قم بتأمين كل من مدخل ومخرج القناة الدقيقة السفلية باستخدام مشابك الموثق لتثبيتها.
- باستخدام ماصة صغيرة P100 أو P20 ، أدخل 20 ميكرولتر من تعليق الخلية من البروتوكول 3 إلى فتحة مخرج القناة الدقيقة العلوية (الشكل 3B البذر).
- قم بتأمين الأنبوب الجانبي ومدخل القناة الدقيقة العلوية باستخدام مشابك الموثق لتثبيتها. بعد ذلك ، أعد توصيل أنبوب المخرج بفتحة مخرج القناة الدقيقة العلوية ، مع التأكد من بقاء الأنبوب مفتوحا طوال العملية لتجنب أي ضغط يتم تطبيقه على القناة الدقيقة العلوية. بعد هذه الخطوة ، قم بتأمين أنبوب مخرج القناة العلوية ببطء باستخدام مشبك موثق لتثبيته.
- تحقق باستخدام المجهر من أن الخلايا موزعة بالتساوي في جميع أنحاء القناة الدقيقة العلوية.
ملاحظة: من المهم تثبيت الأنبوب لإيقاف حركة الوسط داخل القناة للسماح بظروف ثابتة مستقرة حتى يتم الانتهاء من ارتباط الخلية المرغوب فيه. - ضع الشريحة في حاضنة CO2 رطبة عند 37 درجة مئوية.
ملاحظة: يستغرق الأمر حوالي 3 ساعات حتى تلتصق الخلايا العضوية المعوية للكلاب بطلاء ECM (مرفق الشكل 3B ). - قم بتوصيل المحقنة المتصلة بالقناة الدقيقة العلوية ل Gut-on-a-Chip بمضخة حقنة موضوعة داخل حاضنة CO2 .
ملاحظة: اغسل الوسط بعناية في القناة الدقيقة باستخدام مقبض مضخة المحقنة وقم بإزالة الخلايا غير المنضمة. افحص الشريحة تحت المجهر للتأكد من أن أي خلايا غير متصلة قد تم غسلها بشكل فعال. - بدء تدفق وسط الاستزراع عند 30 ميكرولتر / ساعة باستخدام وسط البذر. هذا التدفق المستمر هو فقط للقناة الدقيقة العليا في البداية حتى إنشاء 2D أحادي الطبقة على Gut-on-a-Chip. بالنسبة للقناة الدقيقة السفلية ، اترك القنوات الدقيقة مثبتة والوسط غير متدفق.
- من اليوم التالي لبذر الخلايا ، قم بتغيير وسط الاستزراع إلى وسط الثقافة العضوية ، والذي يحتوي على A8301 ويفتقر إلى 10 ميكرومتر Y-27632 و 2.5 ميكرومتر CHIR99021 ، من وسط البذر.
- بمجرد إنشاء الطبقة الأحادية ، ابدأ التدفق المتوسط المستمر إلى القناة الدقيقة السفلية أيضا. عادة ما يستغرق الأمر من 2 إلى 3 أيام حتى تتمكن الخلايا الظهارية العضوية المعوية من من إنشاء طبقات أحادية ظهارية (الشكل 3C).
5. إنشاء مورفجينيسيس ثلاثي الأبعاد في القناة الهضمية على رقاقة
ملاحظة: بعد تشكيل الطبقات الأحادية المتقاربة في Gut-on-a-Chip ، تم إدخال تدفق متوسط لكل من القناة العلوية والقناة السفلية وسلالة الخلية لبدء التشكل ثلاثي الأبعاد إلى طبقة أحادية ثنائية الأبعاد كما هو موضح في الشكل 2.
- إدخال وسيط الثقافة العضوية في كل من القنوات الدقيقة العلوية والسفلية لبدء تطوير مورفجينيسيس 3D في نظام Gut-on-a-Chip. لتحقيق إجهاد القص البالغ 0.02 داين / سم2 في تصميم Gut-on-a-Chip الحالي (أي قناة ميكروية بارتفاع 500 ميكرومتر) ، قم بزيادة معدل التدفق إلى 50 ميكرولتر / ساعة29.
- ابدأ 10٪ من إجهاد الخلية و 0.15 هرتز من التردد ، على النحو الموصى به قبل2 ، باستخدام مفاعل حيوي منظم بالكمبيوتر يطبق إجهادا دوريا على الخلايا المزروعة في المختبر. ستطبق هذه العملية شفط الفراغ على جهاز Gut-on-a-Chip.
- الحفاظ على ظروف الثقافة هذه لمدة لا تقل عن 2 إلى 3 أيام. عادة ما يحدث التشكل ثلاثي الأبعاد للطبقة الأحادية المعوية للكلاب بعد 2 إلى 3 أيام من بدء تدفق القناة الجافية والشفط الفراغي (الشكل 3C).
6. توصيف القناة الهضمية على رقاقة
- تصوير الخلايا الحية
- قم بإزالة أي فقاعات هواء في Gut-on-a-Chip عن طريق تدفق الوسط برفق باستخدام مضخة المحقنة.
- افصل جهاز Gut-on-a-Chip عن مضخة المحقنة.
ملاحظة: تجنب أي مناورة يمكن أن تمارس الضغط داخل القناة الهضمية على رقاقة. - ضع الجهاز على المجهر لالتقاط صور لظهارة 3D المنشأة. لتصور بنية الطبقات الظهارية ثلاثية الأبعاد باستخدام تباين الطور ، استخدم أهداف 10x و 20x (الشكل 3C).
- تلطيخ المناعي
- قم بإعداد محلول الحجب عن طريق إذابة 1 جم من BSA في 50 مل من محلول ملحي عازل للفوسفات (PBS) لصنع 2٪ BSA. مرر المحلول من خلال مرشح حقنة 0.2 ميكرومتر للترشيح. احتفظ بهذا المحلول مخزنا عند 4 درجات مئوية.
- قم بإعداد محلول النفاذية من خلال الجمع بين 150 ميكرولتر من Triton X-100 مع 50 مل من محلول الحجب ، مما ينتج عنه تركيز نهائي بنسبة 0.3٪ Triton X-100. مرر المحلول من خلال مرشح حقنة 0.2 ميكرومتر للترشيح. احتفظ بهذا المحلول مخزنا عند 4 درجات مئوية.
- قم بإجراء تثبيت الخلايا عن طريق حقن 100 ميكرولتر من 4٪ PFA في كل من القنوات الدقيقة العلوية والسفلية كما هو موضح في الخطوات 2.4-2.11.
- شطف الخلايا عن طريق حقن 100 ميكرولتر من برنامج تلفزيوني في كل من القنوات الدقيقة العلوية والسفلية كما هو موضح في الخطوات 2.4-2.11.
- قم بإجراء نفاذية الخلايا عن طريق حقن 100 ميكرولتر من 0.3٪ Triton في كل من القنوات الدقيقة العلوية والسفلية كما هو موضح في الخطوات 2.4-2.11. ضع الجهاز في RT لمدة 30 دقيقة.
- شطف الخلايا عن طريق حقن 100 ميكرولتر من برنامج تلفزيوني في كل من القنوات الدقيقة العلوية والسفلية كما هو موضح في الخطوات 2.4-2.11.
- قم بإجراء حظر للخلايا لمنع الارتباط غير النوعي عن طريق حقن 100 ميكرولتر من 2٪ BSA لكل من القنوات الدقيقة العلوية والسفلية كما هو موضح في الخطوات 2.4-2.11. ضع الجهاز في RT لمدة 1 ساعة.
- حقن 20 ميكرولتر من محلول الأجسام المضادة الأساسي المخفف في 2٪ BSA ووضعه في RT لمدة 3 ساعات ، تليها الحضانة الليلية عند 4 درجات مئوية.
ملاحظة: تأكد من تثبيت جميع الأنابيب أثناء الحضانة عند 4 درجات مئوية طوال الليل. يجب أن يكون تركيز الجسم المضاد الأساسي أعلى بمقدار 2-5 مرات من التركيز الموصى به للتلطيخ العضوي أحادي الطبقة أو ثلاثي الأبعاد (الشكل التكميلي S1). - شطف الخلايا عن طريق حقن 100 ميكرولتر من برنامج تلفزيوني لكل من القنوات الدقيقة العلوية والسفلية كما هو موضح في الخطوات 2.4-2.11.
- حقن 20 ميكرولتر من محلول الأجسام المضادة الثانوي المخفف في 2٪ BSA ووضعه في RT لمدة 1 ساعة.
ملاحظة: تأكد من تثبيت جميع الأنابيب أثناء الحضانة. بدءا من هذه الخطوة ، من الضروري حماية إعداد الجهاز بورق الألمنيوم لمنع التبييض الضوئي. - شطف الخلايا عن طريق حقن 100 ميكرولتر من برنامج تلفزيوني لكل من القنوات الدقيقة العلوية والسفلية كما هو موضح في الخطوات 2.4-2.11.
- قم بإعداد محلول مشترك للتلطيخ المضاد ل F-actin و DAPI (دياميدينو -2-فينيليندول). حقن 20 ميكرولتر من المحلول المدمج في كل من القنوات الدقيقة العلوية والسفلية كما هو موضح في الخطوات 2.4-2.11.
- شطف الخلايا عن طريق حقن 100 ميكرولتر من برنامج تلفزيوني في كل من القنوات الدقيقة العلوية والسفلية كما هو موضح في الخطوات 2.4-2.11.
إجراء التصوير الفلوري لبنية الخلايا الظهارية 3D باستخدام مجهر مضان أو مجهر متحد البؤر.
7. وظيفة الحاجز الظهاري
- قم بإزالة أي فقاعات هواء في Gut-on-a-Chip عن طريق تدفق الوسط برفق باستخدام مضخة المحقنة. تأكد من أن جميع الأنابيب مفتوحة أثناء القياس.
- قم بإزالة Gut-on-a-Chip من مضخة المحقنة وضعها في RT لمدة 10 دقائق على الأقل.
- قم بإزالة أقطاب Ag / AgCl من محلول EtOH بنسبة 70٪.
- ضع قطبين كهربائيين Ag / AgCl في المدخل العلوي والمخرج السفلي ، على التوالي ، لقياس مقاومة الطبقة الظهارية باستخدام مقياس متعدد.
- ضع قطبين كهربائيين Ag / AgCl في المدخل السفلي والمخرج العلوي ، على التوالي. أبلغ عن متوسط هاتين القيمتين كقيمة مقاومة ل Gut-on-a-Chip.
ملاحظة: يجب قياس TEER الفارغ على Gut-on-a-Chip مع طلاء ECM فقط بدون ظهارة. - يمكن حساب قيمة المقاومة الكهربائية عبر الظهارة (TEER) (kΩ × cm2) باستخدام المعادلة (1).
TEER = (Ωt - Ωفارغة) × A (1)
حيث Ωt هي قيمة مقاومة تقاس في نقطة زمنية محددة منذ بداية التجربة ، Ωالفراغ هي قيمة مقاومة مقاسة في ذلك الوقت بدون ظهارة ، و A هي مساحة السطح المغطاة بطبقة خلية (حوالي 0.11 سم2 لتصميم Gut-on-a-Chip هذا29).- احسب TEER الطبيعي باستخدام المعادلة (2).
تير =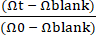 (2)
(2)
حيث Ω0 هي قيمة مقاومة عند نقطة وقت القراءة الأولية للتجربة كما ورد سابقا30 (الشكل 4C).
- احسب TEER الطبيعي باستخدام المعادلة (2).
النتائج
يسهل هذا البروتوكول بشكل موثوق التطور التلقائي لتشكل الأمعاء 3D في نظام Gut-on-a-Chip. يستخدم هذا النهج الخلايا الظهارية المعوية للكلاب التي تم الحصول عليها من الكائنات العضوية المعوية المشتقة من المصابة بمرض التهاب الأمعاء (IBD) (الشكل 1 ب). يمكن ملاحظة التجميع العرضي للتشكل ثلاثي الأبعاد للخلايا الظهارية المعوية للكلاب في جميع أنحاء القناة الدقيقة بعد 6-9 أيام من التدفق المتوسط (الشكل 3C). يمكن رصد هذه التغيرات المورفولوجية باستخدام تقنيات تباين الطور. في هذه الدراسة ، استخدمنا المواد العضوية المشتقة من كلبين تم تشخيصهما بمرض التهاب الأمعاء. والجدير بالذكر أن التشكل 3D الناجح لوحظ في نسختين بيولوجيتين ، تم تنفيذ كل منهما باستخدام نسختين تقنيتين. توفر نتائج هذه الدراسة أساسا للتحقيقات المستقبلية التي تنطوي على عضويات معوية مشتقة من متبرعين آخرين بالكلاب. توضح هذه النتائج إمكانية التطبيق والتكرار لنهجنا التجريبي ، والذي تم الإبلاغ عنه سابقا في العينات البشرية. تقدم هذه النتائج تأكيدا إضافيا على أن تقنية Gut-on-a-Chip قابلة للتطبيق على الخلايا الظهارية المعوية للكلاب كما ورد سابقا مع الدراسات التي تستخدم الخلايا الظهارية المعويةالبشرية 2.
أظهر هذا البروتوكول أنه يمكن استخدام تلطيخ التألق المناعي لتقييم بنية 3D للطبقات الأحادية المشتقة من العضوية التي شكلت هياكل تشبه الزغابات في رقائق الموائع الدقيقة باستخدام المجهر الفلوري التقليدي (الشكل 4 أ ، ب). يمكن تكييف هذا البروتوكول للتحقق من صحة الأنماط الظاهرية الخلوية المتمايزة والمنظمة مكانيا من خلال تلطيخ التألق المناعي. يوفر تصور التشكل ثلاثي الأبعاد داخل Gut-on-a-Chip فرصة ممتازة للتحقيق في استجابة المضيف خلال التفاعلات المرضية المختلفة14،23،31. عند دمجها مع الخلايا الظهارية المشتقة من المتبرعين بالمرضى ، كما هو موضح سابقا في البشر ، يمكن استخدام هذه التقنية لبناء نماذج شخصية للأمراض المعوية13. من خلال دمج التصوير المناعي مع تقنيات تصور الحمض النووي الريبي المستهدفة مثل التهجين الفلوري في الموقع ، يمكن أن يكون من الممكن إجراء تحليل مرئي للنسخ والبروتينات للمضيف داخل نظام Gut-on-a-Chip.
يعد الحفاظ على سلامة الغشاء المعوي أمرا حيويا للحفاظ على التوازن المعوي ، وتوفر منصة Gut-on-a-Chip ميزة قيمة من خلال السماح بالمراقبة الدقيقة والقياس الكمي لهذه الوظيفة الحاسمة. يوفر قياس TEER باستخدام تقنية Gut-on-a-Chip العديد من الفوائد. على سبيل المثال ، نجحت الدراسات السابقة في تقييم TEER أثناء زراعة الخلايا المعوية مع البكتيريا غير المسببة للأمراض والبروبيوتيك32 ، وكذلك في ظل ظروف الأمعاء المتسربة23. وهذا يسمح للباحثين بدراسة تأثير الحالات المختلفة على وظيفة الحاجز المعوي وتحديد التدخلات المحتملة لتعزيز صحة الأمعاء.
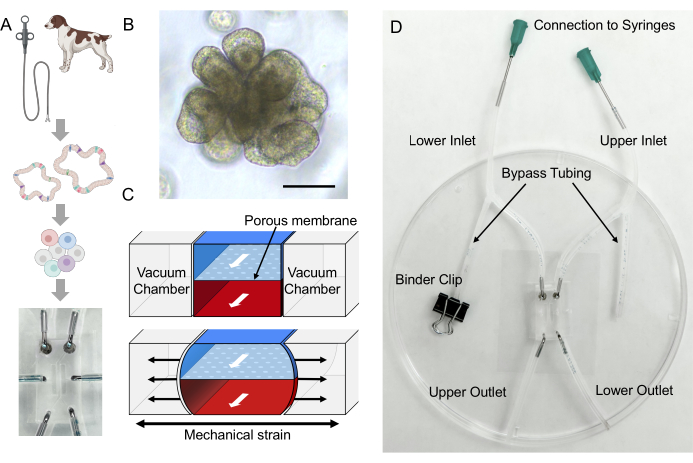
الشكل 1: إنشاء المشتقة من المريض IBD Gut-on-a-Chip. (أ) دمج العضويات المعوية المشتقة من المريض ومنصة Gut-on-a-Chip. يمكن إجراء خزعة التنظير الداخلي لعزل خلايا سرداب الأمعاء لتطوير عضويات معوية خاصة بالمتبرع. يمكن فصل الخلايا الظهارية إلى خلايا مفردة من الكائنات العضوية ، ثم زرعها في Gut-on-a-Chip القائم على PDMS وزراعتها في بيئة دقيقة ديناميكية فريدة. ب: صور تمثيلية للقولونويدات من مصاب بمرض التهاب الأمعاء. شريط المقياس = 100 ميكرومتر. (ج) يوضح هذا المخطط جهاز Gut-on-a-Chip يتكون من غشاء مسامي يوضع بين القنوات الدقيقة العلوية والسفلية. يشار إلى القناة الدقيقة العلوية بالمنطقة الزرقاء ، بينما يشار إلى القناة الدقيقة السفلية بالمنطقة الحمراء. توجد غرف مفرغة على كل جانب من القناة الدقيقة ، والتي تشوه الغشاء المسامي لتقليد الحركة التمعجية24. (د) يتضمن إعداد Gut-on-a-Chip Gut-on-a-Chip القائم على PDMS والذي تم تجميعه بأنابيب موضوعة على قسيمة غطاء 2,24. يعد الأنبوب الجانبي أمرا بالغ الأهمية لتجنب تراكم الضغط داخل القناة الدقيقة أثناء المناولة (أي الاتصال بالحقن). تستخدم مقاطع الموثق لتثبيت الأنبوب. يمكن غرس المواد الحساسة للحجم عبر الثقوب المفتوحة للمخرج العلوي أو السفلي. يمكن غرس وسط الثقافة العضوية عن طريق توصيل المحاقن بالإبر الحادة والتدفق عبر المدخل العلوي والسفلي. الاختصارات: IBD = مرض التهاب الأمعاء. PDMS = بوليديميثيل سيلوكسان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
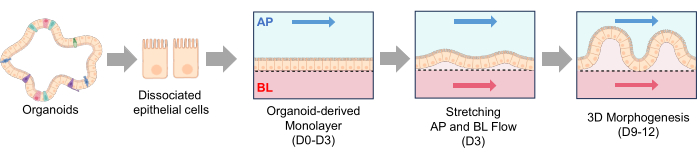
الشكل 2: تكوين تراكيب شبيهة بالزغابات في IBD Gut-on-a-Chip. تم زرع الخلايا الظهارية المنفصلة في أمعاء على رقاقة مغلفة ب ECM. بمجرد ربط الخلايا المنفصلة بغشاء PDMS ، بدأ التدفق القمي لمدة 3 أيام (D0-D3). عندما يتم تشكيل طبقة أحادية 2D متقاربة (D3) ، يبدأ التدفق القاعدي مع التمدد المتكرر (Stretching و AP و BL Flow). بعد 2-3 أيام من التدفق المزدوج وتمدد الغشاء ، تبدأ الطبقة الأحادية ثنائية الأبعاد في تطوير مورفجينيسيس ثلاثي الأبعاد ، وتتشكل الهياكل الشبيهة بالزغابات بعد 9 أيام من الثقافة (التشكل ثلاثي الأبعاد ، D9-D12). الاختصارات: ECM = مصفوفة خارج الخلية. PDMS = بوليديميثيل سيلوكسان ؛ AP = قمي ؛ BL = القاعدية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
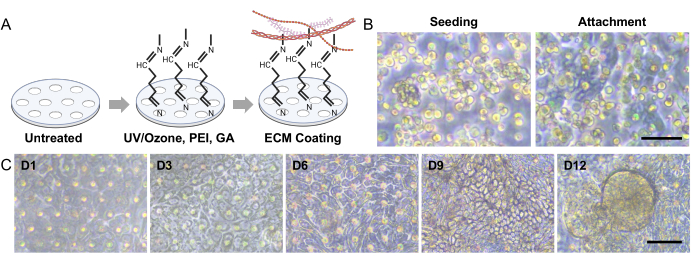
الشكل 3: البذر العضوي المعوي للكلاب والتشكل ثلاثي الأبعاد في القناة الهضمية على رقاقة . (أ) الخطوات التجريبية للتنشيط السطحي لغشاء مسامي في أمعاء على رقاقة تعتمد على PDMS. إن استخدام المعالجة بالأشعة فوق البنفسجية / الأوزون ، و PEI ، و GA جنبا إلى جنب يسهل الربط المتقاطع للأمينات الموجودة في محاليل ECM. تؤدي هذه العملية إلى تجميد مستقر لبروتينات ECM على الغشاء المسامي. (ب) توضح صور تباين الطور أشكال الخلايا مباشرة بعد البذر (يسار) و 3-5 ساعات بعد البذر (يمين). يعرض الغشاء المسامي بعد 3 ساعات من البذر مناطق أرق وأكثر قتامة حيث تلتصق الخلايا المفردة ، مما يبرز عملية التعلق. (ج) تصور صور تباين الطور التشكل 3D للطبقات الأحادية المعوية داخل نظام Gut-on-a-Chip. تم اشتقاق هذه الطبقات الأحادية من المصابة بمرض التهاب الأمعاء وتم استزراع هذه الخلايا العضوية لمدة 12 يوما في ظل ظروف ديناميكية ، والتي تضمنت تدفق السوائل وحركات التمدد. قضبان المقياس = 50 ميكرومتر (ب ، ج). الاختصارات: IBD = مرض التهاب الأمعاء. ECM = مصفوفة خارج الخلية ؛ PDMS = بوليديميثيل سيلوكسان ؛ PEI = بولي إيثيلينيمين. GA = الجلوتارالدهيد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
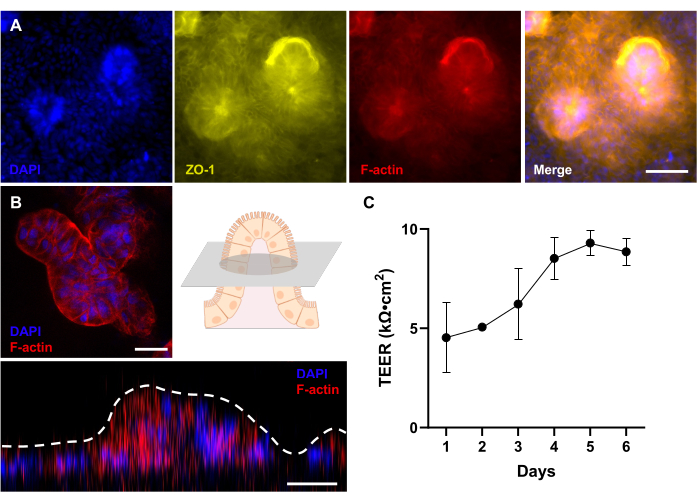
الشكل 4: تقييم التطور المورفولوجي ثلاثي الأبعاد في المشتقة من المريض Gut-on-a-Chip. (أ) التصوير المناعي لكلب IBD Gut-on-a-Chip ، يعرض منظرا من أعلى إلى أسفل لظهارة ثلاثية الأبعاد مطورة بالكامل بعد 12 يوما من الثقافة ، والتي يتم تقييمها بواسطة مجهر مضان. يتم تصور بروتين الوصلة الضيقة (ZO-1) باللون الأصفر. يظهر غشاء حدود الفرشاة (F-actin) باللون الأحمر ؛ والنوى ملطخة ب DAPI وتظهر باللون الأزرق. (ب) التصوير المناعي لكلب IBD Gut-on-a-Chip باستخدام مجهر متحد البؤر مع عدسة بعيدة المدى. كما هو موضح في المخطط ، يتم عرض صورة فلورية لمقطع عرضي لهيكل يشبه الزغب لظهارة 3D مطورة بالكامل بعد 12 يوما من الثقافة. بالإضافة إلى ذلك ، يظهر Z-stacking منظرا جانبيا لظهارة 3D ، والتي تكشف عن تكوين هياكل تشبه الزغب. يظهر غشاء حدود الفرشاة (F-actin) باللون الأحمر ، وتكون النوى ملطخة ب DAPI وتظهر باللون الأزرق. (ج) تم تقييم وظيفة الحاجز المعوي وقياسها بواسطة TEER في المشتقة من المريض Gut-on-a-Chips. تم الوصول إلى قيم TEER المستقرة في اليوم 5 من الثقافة على Gut-on-a-Chip. تعبر أشرطة الخطأ عن SEM للقياسات. تم قياس قيمة TEER بين اثنين من النسخ المتماثل البيولوجي مع تكرار تقني واحد. قضبان المقياس = 50 ميكرومتر (أ) ، 25 ميكرومتر (ب). الاختصارات: IBD = مرض التهاب الأمعاء. DAPI = 4 '، 6-دياميدينو -2-فينيليندول ؛ TEER = المقاومة الكهربائية عبر الظهارة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي S1: توصيف الأجسام المضادة متعددة النسيلة المضادة ل ZO-1 في الطبقات الأحادية المشتقة من القولون في وعلى أجهزة Gut-on-a-Chip. (أ) تلطيخ التألق المناعي ل ZO-1 باللون الأصفر مع F-actin باللون الأحمر وصورة تراكبها. شريط المقياس = 25 ميكرومتر. (ب) تم إجراء التصور المناعي ل ZO-1 باللون الأصفر في "رقائق الأمعاء المتسربة" في ظل ظروف مختلفة ، بما في ذلك التحفيز ببكتيريا البروبيوتيك (LGG + Cytokines أو VSL # 3 + Cytokines) والضوابط الخالية من الجراثيم دون تحفيز البروبيوتيك (السيتوكينات). شريط المقياس = 50 ميكرومتر. وهذا الرقم مستنسخ من Min et al.23. الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي S1: ملخص لمعلومات المتبرعين بالأنسجة. جدول ملخص لعمر المتبرعين والجنس والسلالة والتقييم النسيجي المرضي ودرجة مؤشر نشاط مرض التهاب (CIBDAI). CIBDAI هو نظام تسجيل رقمي يستخدم لاستنتاج الشدة السريرية في IBD33. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
تمثل هذه الدراسة الدليل الرائد على توافق الكائنات العضوية المعوية للكلاب مع تطوير نموذج Gut-on-a-Chip للكلاب. أدى دمج الكائنات العضوية المعوية والثقافات أحادية الطبقة المشتقة من المواد العضوية في نظام الموائع الدقيقة (أي نظام Gut-on-a-Chip) إلى تطوير التكنولوجيا بشكل أكبر ، مما يتيح إنشاء نماذج معوية في المختبر تحاكي عن كثب الديناميات الفسيولوجية وتكون أكثر تمثيلا للظروف البيولوجية. على وجه الخصوص ، نظرا لوجود عدد قليل جدا من التقارير عن ثقافة Gut-on-a-Chip باستخدام المواد العضوية المشتقة من IBD في البشر ، فإن الدراسة الحالية التي تستخدم Gut-on-a-Chip المشتقة من IBD للكلاب قد توفر رؤى رائدة في دراسة مرض التهاب الأمعاء في البشر.
يتطلب التطوير الناجح لمورفجيني 3D الظهاري المعوي للكلاب على Gut-on-a-Chip اهتماما دقيقا بالعديد من الخطوات الحاسمة. أولا ، قد يعيق السطح الكارهة للماء لقنوات الموائع الدقيقة PDMS التصاق ECM وربط الخلية اللاحق ، مما يستلزم تنشيط سطح PDMS قبل طلاء ECM وبذر الخلية (انظر قسم البروتوكول 1). لتحقيق ثقافة أحادية الطبقة مستقرة ، تعد إزالة الخلايا الزائدة غير المرتبطة أمرا بالغ الأهمية بعد ارتباط الخلية (خطوات البروتوكول 4.6-4.7). بالإضافة إلى ذلك ، فإن التحفيز الديناميكي ، مثل التدفق المتوسط المستمر وحركة الفراغ الشبيهة بالتمعج ، ضروري لتشكل 3D لظهارة الأمعاء (خطوة البروتوكول 5.2). يعد التعامل الدقيق أمرا ضروريا لتجنب فقاعات الهواء في القناة الدقيقة أثناء أي خطوات من ثقافة Gut-on-a-Chip.
إذا واجهت بذرا ضعيفا للخلايا في القناة الهضمية على رقاقة ، فقد يكون ذلك بسبب انخفاض عدد الخلايا أو ضعف ارتباط الخلية. لاستكشاف أخطاء أعداد الخلايا المنخفضة وإصلاحها ، من المهم فحص صحة الكائنات العضوية المعوية المحضرة من خلال مراقبة نموها في Matrigel. يمكن تقييم صلاحية الخلية عن طريق تلطيخ تريبان الأزرق بعد تفكك الخلية لضمان عدم موت أكثر من 20٪ من الخلايا. إذا كانت أعداد الخلايا القابلة للحياة غير كافية ، فيمكن محاولة تحسين ظروف الوسط العضوي. الاحتمال الآخر هو التفكك العضوي غير الكامل ، مما يؤدي إلى زيادة كتل الخلايا التي يزيد حجمها عن 70 ميكرومتر والتي تصبح محاصرة بواسطة المرشح. لحل هذه المشكلة ، يتمثل أحد الخيارات في تمديد مدة السحب أثناء تفكك الخلية. بدلا من ذلك ، يمكن تحريك الأنبوب المخروطي سعة 15 مل بلطف كل دقيقة أثناء خضوعه للعلاج بالبروتياز الشبيه بالتريبسين. قد يكون ضعف ارتباط الخلية بالقناة الهضمية على رقاقة بسبب طلاء ECM غير المناسب. أثناء عملية الطلاء ، ينصح بالتحقق بعناية من وجود فقاعات الهواء ومنع تكوينها عن طريق إضافة المزيد من محلول الطلاء برفق حسب الحاجة. يمكن أن يؤدي اكتظاظ الخلايا والفشل في غسل الخلايا غير العالقة إلى عدم كفاية الطبقة الأحادية الأولية. في مثل هذه الحالة ، يمكن تطبيق نبض خفيف عند دفع مكبس المحقنة. يمكن أن تساعد خطوات استكشاف الأخطاء وإصلاحها هذه في تحديد المشكلات ومعالجتها أثناء عملية ثقافة Gut-on-a-Chip.
في حين أن منصة Gut-on-a-Chip هذه تمكن من إنشاء طبقات ظهارية 3D متموجة ، فإننا ندرك الحاجة إلى تعقيد بيولوجي إضافي لتكرار البيئة الدقيقة المعوية بالكامل. من الأهمية بمكان النظر في التفاعلات بين الخلايا الظهارية واللحمة المتوسطة ، وترسب ECM لتجديد 3D ، ووجود خصائص crypt-villus التي تنشئ مكانة مناسبة للخلايا الجذعية. تلعب الخلايا اللحمية ، مثل الخلايا الليفية ، دورا حيويا في إنتاج بروتينات ECM وتنظيم التشكل المعوي34،35،36. إن إدراج خلايا اللحمة المتوسطة في هذا النموذج لديه القدرة على تعزيز كل من التشكل وكفاءة ارتباط الخلية. تلعب الطبقات البطانية ، التي تشمل الأوعية الدموية الشعرية والأوعية اللمفاوية ، دورا حاسما في التحكم في النقل الجزيئي وتجنيد الخلايا المناعية37,38. يمكن أن يكون إدراج الخلايا المناعية المشتقة من المريض ضروريا في نمذجة الأمراض المعوية لأنه يسمح بإظهار التفاعل بين المناعة الفطرية والتكيفية بالإضافة إلى إنشاء مناعة خاصة بالأنسجة39. بعد الانتهاء من مورفجينيسيس 3D على Gut-on-a-Chip ، يمكن تعديل وسيط الثقافة العضوية إلى وسيط تمايز عضوي. يمكن أن يكون هذا نهجا قابلا للتطبيق للحث على تمايز خلوي إضافي ، اعتمادا على الأهداف التجريبية.
يعد تصوير العمارة الدقيقة 3D في الموقع أمرا صعبا بسبب مسافة العمل الطويلة المطلوبة ، والتي يمكن التغلب عليها بهدف بعيد المدى. بالإضافة إلى ذلك ، فإن طرق التصنيع الدقيق والترابط طبقة تلو الأخرى تجعل من الصعب الوصول إلى الطبقات العليا للفحص باستخدام SEM. بالنسبة لتصميم Gut-on-a-Chip الحالي ، هناك حاجة إلى مضخة حقنة واحدة لكل جهاز دقيق Gut-on-a-Chip ، مما يشغل مساحة حاضنة CO2 ويمنع التجارب واسعة النطاق. هناك حاجة إلى الابتكارات لزيادة قابلية التوسع لمنصة سهلة الاستخدام وفحص عالي الإنتاجية.
تسمح هذه البروتوكولات الحالية بالتطوير التلقائي للطبقات الظهارية ثلاثية الأبعاد في المختبر ، متجاوزة قيود المواد العضوية ثلاثية الأبعاد التقليدية ، والطبقات أحادية الطبقة 2D ، وأنظمة زراعة الأجهزة الدقيقة الثابتة. يمكن التحكم في هذه البيئة الدقيقة المعوية الديناميكية في المختبر عن طريق إدخال ثقافة مشتركة لأنواع متنوعة من الخلايا. استكشفت الدراسات السابقة طرقا للتلاعب بالبيئة المكروية Gut-on-a-Chip ، بما في ذلك الزراعة المشتركة للميكروبيوم المعوي14,23 والخلايا أحادية النواةالمحيطية 30. هذه البيئة المكروية المعاد تشكيلها لها العديد من التطبيقات المحتملة ، بما في ذلك اختبار الأدوية والدراسات الميكانيكية الأساسية ونمذجة الأمراض. تحمل البيئة المكروية المعاد بناؤها إمكانات كبيرة لمجموعة واسعة من التطبيقات ، مثل اختبار الأدوية23،40،41 ونمذجة الأمراض 12،13،14،30 ، بالإضافة إلى التحقيقات الميكانيكية الأساسية لتشكل الأمعاء 42. يمكن إجراء مجموعة متنوعة من المقايسات إما عن طريق جمع المواد الطافية لتقييم المستقلبات 43 ، أو عن طريق جمع الخلايا للفحص الجينومي 2,32 ، أو عن طريق الفحص البصري للخلايا باستخدام أصباغ الخلايا الحية أو التثبيت للتصوير المناعي اللاحق 23,44.
تقدم هذه الدراسة بروتوكولا قابلا للتكرار لتطوير مورفجينيست 3D للطبقات الظهارية المعوية للكلاب في منصة Gut-on-a-Chip. يوفر الهيكل الظهاري 3D الناتج تمثيلا أكثر واقعية للبيئة الدقيقة المعوية ، والتي لديها إمكانات هائلة للتطبيقات في مختلف الدراسات الطبية الحيوية. من خلال الاستفادة من هذه البنية المعوية ، يمكننا إجراء المزيد من الأبحاث الانتقالية وربما تحقيق نتائج واعدة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح يعلنونه.
Acknowledgements
نود أن نشكر خدمة الطب الباطني للحيوانات الصغيرة في WSU (الدكتورة جيليان هينز ، الدكتورة سارة جيس ، شيلي إنساين LVT) ومنسقة الدراسات السريرية في WSU VTH Valorie Wiss لدعمهم في تجنيد الحالات وجمع العينات من العلماء المواطنين (المتبرعين بالمرضى). تم دعم هذا العمل جزئيا من قبل مكتب مدير المعاهد الوطنية للصحة (K01OD030515 و R21OD031903 إلى YMA) والجمعية اليابانية لتعزيز برنامج التحدي العلمي في الخارج للباحثين الشباب (202280196 إلى I.N.). تم إنشاء الشكل 1A والشكل 3A باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Organoid basal medium | |||
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| GlutaMAX | Gibco | 35050-061 | 2 mM, glutamine substitute |
| 1 M HEPES | VWR Life Science | J848-500ML | 10 mM |
| 100x penicillin–streptomycin | Corning | MT30009CI | 1x |
| Organoids and organoid medium | |||
| A-83-01 | PeproTech | 9094360 | 500 nM |
| B27 supplement | Gibco | 17504-044 | 1x |
| CHIR99021 | Reprocell | 04-0004-base | 2.5 µM |
| HEK293 cells engineered to secrete Noggin | Baylor College of Medicine | ||
| Murine EGF | PeproTech | 315-09-1MG | 50 ng/mL |
| Murine Wnt-3a | PeproTech | 315-20-10UG | 100 ng/mL |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | 1 mM |
| N2 MAX Media supplement | Gibco | 17502-048 | 1x |
| Nicotinamide | Sigma | N0636-100G | 10 mM |
| Noggin Conditioned Medium | NA | NA | 10% vol/vol |
| Primocin | InvivoGen | ant-pm-1 | 100 µg/ml |
| R-spondin1 (Rspo1) cells | Trevigen | 3710-001-01 | Rspo1 cells |
| R-Spondin-1 Conditioned Medium | NA | NA | 20% vol/vol |
| SB202190 | Sigma-Aldrich | S7067-25MG | 10 µM |
| Y-27632 | StemCellTechnologies | 72308 | 10 µM |
| [Leu15 ]-Gastrin I human | Sigma-Aldrich | G9145-.5MG | 10 nM |
| Reagents | |||
| 4% Paraformaldehyde solution | Fisher Scientific | AAJ19943K2 | |
| Alexa Fluor 647 Phalloidin | Thermo Fisher Scientific | A22287 | x250 dilution |
| Anti-Rabbit IgG H&L labeled with Alexa Fluor 555 | Abcam | ab150078 | x1,000 dilution |
| Anti-ZO-1 polyclonal antibody | Thermo Fisher Scientific | 61-7300 | x50 dilution |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen I, Rat Tail 3 mg/mL | Gibco | A10483-01 | |
| Diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | 62248 | x1,000 dilution |
| EMS Glutaraldehyde Aqueous 50% | Electron Microscopy Sciences | 16320 | |
| Matrigel Matrix | Corning | 356255 | |
| Poly(ethyleneimine) solution | Sigma | 408700-250ML | |
| TrypLE Express | Gibco | 12604-021 | |
| Materials and Equipment | |||
| 24-well culture plates | Corning | 3524 | |
| 87V Industrial Multimeter | Fluke Corporation | ||
| Centrifuge | Eppendorf | 5910R | |
| CO2 incubator | Eppendorf | C170i | |
| DMi8 fluorescence microscope | Leica microsystems | DMi8 | |
| Dry oven | Fisher Scientific | 15-103-0519 | |
| FlexCell FX-5000 Tension system | Flexcell International Corporation | ||
| Inverted phase-contrast microscope | Leica microsystems | DMi1 | |
| SP8-X inverted confocal microscope | Leica microsystems | SP8-X | |
| Syringe pump | Braintree Scientific | model no. BS-8000 120V | |
| Syringe, 3 mL sterile | BD Biosciences | 14-823-435 | |
| Syringes, 1 mL sterile | BD Biosciences | 14-823-434 | |
| UV/ozone generator | Jelight Company | model no. 30 | |
| Software | |||
| LAS X imaging software | Leica microsystems |
References
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, ethics, and humanities in medicine: PEHM. 4, 2 (2009).
- Shin, W., Kim, H. J. 3D in vitro morphogenesis of human intestinal epithelium in a gut-on-a-chip or a hybrid chip with a cell culture insert. Nature protocols. 17 (3), 910-939 (2022).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. BMC Biome. 6 (72), 1-11 (2018).
- German, A. J. The growing problem of obesity in dogs and cats. The Journal of Nutrition. 136, 1940-1946 (1940).
- Patronek, G. J., Waters, D. J., Glickman, L. T. Comparative longevity of pet dogs and humans: Implications for gerontology research. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 52 (3), B171-B178 (1997).
- Lutz, T. A. Mammalian models of diabetes mellitus, with a focus on type 2 diabetes mellitus. Nature reviews. Endocrinology. 19 (6), 350-360 (2023).
- Allenspach, K., Culverwell, C., Chan, D. Long-term outcome in dogs with chronic enteropathies: 203 cases. Veterinary Record. 178 (15), 368 (2016).
- Patnaik, A. K., Hurvitz, A. I., Johnson, G. F. Canine gastrointestinal neoplasms. Veterinary Pathology. 14 (6), 547-555 (1977).
- Saito, T., et al. Immunohistochemical analysis of beta-catenin, e-cadherin and p53 in canine gastrointestinal epithelial tumors. Journal of Veterinary Medical Science. 82 (9), 1277-1286 (2020).
- Kopper, J. J., et al. Harnessing the biology of canine intestinal organoids to heighten understanding of inflammatory bowel disease pathogenesis and accelerate drug discovery: A One Health approach. Frontiers in Toxicology. 3, 1-13 (2021).
- Jalili-firoozinezhad, S., et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nature Biomedical Engineering. 3 (7), 520-531 (2019).
- Shin, W., et al. Robust formation of an epithelial layer of human intestinal organoids in a polydimethylsiloxane-based Gut-on-a-Chip microdevice. Frontiers in Medical Technology. 2, (2020).
- Shin, Y. C., et al. Three-dimensional regeneration of patient-derived intestinal organoid epithelium in a physiodynamic mucosal Interface-on-a-Chip. Micromachines. 11 (7), 663 (2020).
- Tovaglieri, A., et al. Species-specific enhancement of enterohemorrhagic E. coli pathogenesis mediated by microbiome metabolites. Microbiome. 7 (1), 43 (2019).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 1-21 (2019).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunology. 8 (2), 352-361 (2015).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 1-17 (2020).
- Gabriel, V., et al. Canine intestinal organoids in a dual-chamber permeable support system. Journal of Visualized Experiments. 2 (181), 1-24 (2022).
- Yamada, A., et al. Confronting emerging zoonoses: the one health paradigm. Confronting Emerging Zoonoses: The One Health Paradigm. , 1 (2014).
- Lerner, H., Berg, C. The concept of health in One Health and some practical implications for research and education: what is One Health. Infection Ecology & Epidemiology. 5 (1), 25300 (2015).
- Garcia, S. N., Osburn, B. I., Jay-Russell, M. T. One Health for food safety, food security, and sustainable food production. Frontiers in Sustainable Food Systems. 4, 1-9 (2020).
- Min, S., et al. Live probiotic bacteria administered in a pathomimetic Leaky Gut Chip ameliorate impaired epithelial barrier and mucosal inflammation. Scientific Reports. 12 (1), 22641 (2022).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Qu, M., et al. Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research. 31 (3), 259-271 (2021).
- Sahoo, D. K., et al. Differential transcriptomic profiles following stimulation with lipopolysaccharide in intestinal organoids from dogs with inflammatory bowel disease and intestinal mast cell tumor. Cancers. 14 (14), 3525 (2022).
- Gabriel, V., et al. Standardization and maintenance of 3D canine hepatic and intestinal organoid cultures for use in biomedical research. Journal of Visualized Experiments. (179), 1-28 (2022).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell reports. 3 (4), 1128-1139 (2013).
- Shin, W., et al. A robust longitudinal co-culture of obligate anaerobic gut microbiome with human intestinal epithelium in an anoxic-oxic interface-on-a-chip. Frontiers in Bioengineering and Biotechnology. 7, 1-13 (2019).
- Shin, W., Kim, H. J. Intestinal barrier dysfunction orchestrates the onset of inflammatory host-microbiome cross-talk in a human gut inflammation-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 115 (45), E10539-E10547 (2018).
- Park, G. S., et al. Emulating host-microbiome ecosystem of human gastrointestinal tract in vitro. Stem Cell Reviews and Reports. 13 (3), 321-334 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Jergens, A. E., et al. A scoring index for disease activity in canine inflammatory bowel disease. Journal of Veterinary Internal Medicine. 17 (3), 291-297 (2003).
- Roulis, M., Flavell, R. A. Fibroblasts and myofibroblasts of the intestinal lamina propria in physiology and disease. Differentiation; research in biological diversity. 92 (3), 116-131 (2016).
- Göke, M., Kanai, M., Podolsky, D. K. Intestinal fibroblasts regulate intestinal epithelial cell proliferation via hepatocyte growth factor. The American Journal of Physiology. 274 (5), G809-G818 (1998).
- Powell, D. W., Pinchuk, I. V., Saada, J. I., Chen, X., Mifflin, R. C. Mesenchymal cells of the intestinal lamina propria. Annual Review of Physiology. 73, 213-237 (2011).
- Pappenheimer, J. R., Michel, C. C. Role of villus microcirculation in intestinal absorption of glucose: coupling of epithelial with endothelial transport. The Journal of Physiology. 553, 561-574 (2003).
- Agace, W. W. T-cell recruitment to the intestinal mucosa. Trends in Immunology. 29 (11), 514-522 (2008).
- Ambrosini, Y. M., Shin, W., Min, S., Kim, H. J. Microphysiological engineering of immune responses in intestinal inflammation. Immune Network. 20 (2), 13 (2020).
- Kasendra, M., et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Scientific Reports. 8 (1), 1-14 (2018).
- Sontheimer-Phelps, A., et al. Human Colon-on-a-Chip enables continuous in vitro analysis of colon mucus layer accumulation and physiology. Cellular and Molecular Gastroenterology and Hepatology. 9 (3), 507-526 (2020).
- Shin, W., et al. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow- dependent physical cues in a microengineered Gut-on-a-Chip. iScience. 15, 391-406 (2019).
- Gijzen, L., et al. An Intestine-on-a-Chip model of plug-and-play modularity to study inflammatory processes. SLAS Technology. 25 (6), 585-597 (2020).
- Kim, H. J., Lee, J., Choi, J. H., Bahinski, A., Ingber, D. E. Co-culture of living microbiome with microengineered human intestinal villi in a gut-on-a-chip microfluidic device. Journal of Visualized Experiments. (114), 3-9 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved