Method Article
使用炎症性肠病患者肠道类器官在犬肠道芯片中的三维形态发生
摘要
犬肠道类器官和Gut-on-a-Chip微流控系统的集成为人类肠道疾病提供了相关的转化模型。提出的协议允许肠道的 3D 形态发生和动态 体外 建模,有助于开发针对狗和人类肠道疾病的有效治疗方法。
摘要
犬类肠道在解剖学、微生物学和生理学方面与人类相似,狗自然会发展出与人类相似的自发性肠道疾病。克服了三维 (3D) 类器官在进入肠上皮顶端表面方面的固有局限性,导致了二维 (2D) 单层培养物的产生,其使用来自类器官的细胞暴露可触及的管腔表面。将这些类器官和类器官衍生的单层培养物整合到微流控 Gut-on-a-Chip 系统中,进一步发展了该技术,从而可以开发更具生理相关性的动态 体外 肠道模型。
在这项研究中,我们提出了一种方案,用于使用从受炎症性肠病 (IBD) 影响的狗获得的原代肠道组织样本生成犬肠上皮的 3D 形态发生。我们还概述了使用源自 3D 肠道类器官的细胞生成和维持 2D 单层培养物和肠道芯片系统的方案。本研究中提出的协议是建立专门为犬科动物设计的微流体 Gut-on-a-Chip 系统的基础框架。通过为这种创新方法奠定基础,我们的目标是扩大这些技术在生物医学和转化研究中的应用,与“同一个健康倡议”的原则保持一致。通过利用这种方法,我们可以开发更具生理相关性的 动态体外 模型,用于研究狗和人类的肠道生理学。这对生物医学和制药应用具有重要意义,因为它可以帮助开发更有效的治疗这两种物种的肠道疾病的方法。
引言
肠上皮形态发生主要通过实验动物模型进行研究,这些模型成本高昂、耗时且不能准确代表人类发育过程1.此外,传统的静态 2D 细胞培养模型缺乏模拟 3D 上皮结构的复杂空间组织的能力2。因此,需要一种使用来自人类相关动物模型的肠上皮细胞诱导 体外 3D 形态发生的方案,以推进我们对肠道上皮结构的理解。
伴侣犬的肠道解剖结构和微生物组组成与人类非常相似,因为它们在驯化过程中共享环境和饮食3.除了这种相似性之外,人类和狗都有各种慢性疾病,这些疾病被认为归因于肠道健康。狗和人类一样,可以自发地患上慢性疾病,例如肥胖、认知功能障碍、糖尿病、炎症性肠病 (IBD) 和结直肠腺癌 4,5,6,7,8,9,10。尽管在之前的 Gut-on-a-Chip 研究 2,11,12,13,14 中开发和使用了人类和小鼠上皮细胞,但直到现在还没有使用犬肠上皮细胞。我们的新方法,在具有 3D 上皮形态发生的动态培养系统中利用犬肠道类器官上皮,对犬和人类医学都有重要意义。
肠道类器官培养的最新进展导致了犬肠道类器官培养的建立15.该培养系统涉及在定义的形态原条件下培养肠道干细胞,从而产生具有源自成体干细胞的自我更新特性的 3D 模型16。然而,由于肠腔17 的封闭性,进行转运测定或宿主微生物组共培养会给该 3D 模型带来困难。为了解决这个问题,研究人员生成了一个源自肠道类器官的 2D 单层,允许暴露管腔表面18,19。然而,3D类器官和2D单层都保持在静态条件下,这并不能准确反映肠道微环境的体内生物力学。将患者来源的犬类器官技术与体外 3D 形态发生相结合,为慢性多因素疾病的转化研究提供了机会。这种方法使研究人员能够开发出更有效的治疗方法,使人类和狗都受益,并进一步推进转化研究,与“同一个健康倡议”保持一致,这是一种认识到人类、动物和环境健康相互联系的合作方法。它促进跨学科合作,以应对复杂的健康挑战,为所有人实现最佳健康结果。通过了解人类、动物和生态系统之间的相互依存关系,该倡议旨在减轻新出现的传染病、环境退化和其他共同健康问题带来的风险20,21,22。
该协议概述了在具有基于聚二甲基硅氧烷(PDMS)的多孔膜的Gut-on-a-Chip微设备上培养从患者类器官获得的犬肠上皮细胞的综合方法。通过整合犬肠道类器官和这种 Gut-on-a-Chip 技术来建立 3D 上皮形态发生,使我们能够研究肠道如何发育和维持其细胞组织和干细胞生态位。该平台提供了一个宝贵的机会来研究微生物组群落对肠道健康的影响,并了解这些群落如何产生有助于肠道病理生理学的微生物代谢物14,23。这些进展现在可以扩展到犬肠道样本,为研究人员提供探索肠道微生物组与宿主生理学之间复杂关系的机会。这为获得对肠道病理生理学潜在机制的宝贵见解和了解微生物代谢物在犬类和人类健康以及各种疾病状况中的潜在作用开辟了途径。用于犬类 Gut-on-a-Chip 的方案是可重复的,使其成为比较医学的合适实验模型,因为这种方法可以研究宿主-微生物组相互作用、病原体感染和基于益生菌的狗和人类的治疗效果。
研究方案
该研究已根据华盛顿州立大学机构动物护理和使用委员会 (ASAF# 6993) 批准和进行。在该协议中,我们利用了由PDMS制成的成熟的Gut-on-a-Chip微流控设备,该设备由内部制造2(图1D)。Gut-on-a-Chip 微器件的详细制造方法可以在以前的报告中找到 2,24。该协议展示了肠道类器官和微流体系统的独特集成(图2)。
1. 由PDMS制成的Gut-on-a-Chip的表面活化
- 通过在 50 mL 锥形管中将 1 mL 50% PEI 溶液加入 49 mL 蒸馏 (DI) 水中,制备 1% 聚乙烯亚胺 (PEI) 溶液。将试管倒置两到三次以充分混合溶液,然后使用0.2μm注射器过滤器过滤溶液。
注意:将其储存在4°C。 - 通过在 50 mL 锥形管中将 100 μL 50% GA 溶液加入 49.9 mL DI 中来制备 0.1% 戊二醛 (GA) 溶液。将试管倒置两到三次以充分混合溶液,然后使用0.2μm注射器过滤器过滤溶液。
注意:将其储存在4°C,并确保防止其暴露在直射光下。 - 将Gut-on-a-Chip设备置于60°C的干燥烘箱中,并孵育至少30分钟以消除任何残留的水分。
- 使用UV / Ozone发生器将Gut-on-a-Chip设备暴露于UV和臭氧处理60分钟。
注意: 为确保在治疗过程中 PDMS 表面的最佳激活,请在紫外线灯和设备之间保持约 3 厘米或更短的距离。避免发电机中的设备过度拥挤,以实现有效的表面活化。 - 使用活页夹固定上微通道的入口、旁路和出口管 clamp 将它们夹住。同时夹紧下微通道的入口管。
- 断开下微通道的出口管。确保下微通道的旁路管保持打开状态。
- 使用 P100 微量移液器,将 100 μL 1% PEI 溶液引入下微通道的出口孔。
注意: 建议在设备因紫外线/臭氧暴露而仍然温暖时执行此过程。观察流经微通道的PEI溶液,PEI溶液滴落,从下微通道的旁路管中流出。 - 重新连接下微通道的出口管。
- 使用活页夹固定下微通道的入口、旁路和出口管 clamp 将它们夹住。同时夹紧上微通道的入口管。
- 断开上微通道的出口管。确保上微通道的旁路管保持打开状态。
- 使用 P100 微量移液器,将 100 μL 的 1% PEI 溶液引入上微通道的出口孔。
注意: 观察流经微通道的 PEI 溶液,PEI 溶液滴落从上微通道的旁路管中流出。 - 重新连接上微通道的出口管。
- 一旦上微通道和下微通道都充满 1% PEI 溶液,让设备在室温 (RT) 下孵育 10 分钟。
- 使用0.1%GA溶液执行步骤1.5-1.12。
- 一旦上微通道和下微通道都充满 0.1% GA 溶液,让设备在室温下孵育 20 分钟。
- 用去离子水执行步骤 1.5-1.12 以去除任何多余的表面活化溶液。
- 将薯片放入60°C的干燥烤箱中,晾干过夜。
注意: 确保从所有管道上取下粘合夹,以避免管道受到任何撞击。这种干燥过程对于Gut-on-a-Chip12内微通道的均匀表面活化至关重要。
2. 用于Gut-on-a-Chip培养的细胞外基质(ECM)包被和培养基制备
- 用类器官基础培养基制备ECM混合物,使胶原I和基质胶的终浓度分别为60μg/ mL和2%(体积/体积)。
注意:每个肠道芯片准备 50 μL ECM 混合物(即,每个上下微通道 20 μL ECM 混合物和 10 μL 额外微通道)。在使用当天准备并将该溶液储存在4°C或将其置于冰上直至可以使用。 - 从干燥的烤箱中取出经过 UV/Ozone、PEI 和 GA 处理的 Gut-on-a-Chip。
注意: 在相差显微镜下检查是否有任何残留水分。 - 让 Gut-on-a-Chip 在生物安全柜中冷却 10 分钟。
- 使用活页夹固定上微通道的入口、旁路和出口管 clamp 将它们夹住。同时夹紧下微通道的入口管。
- 断开下微通道的出口管。
- 使用 P100 微量移液器,通过下微通道的出口孔引入 20 μL ECM 混合物。
注意: 观察流经微通道的 ECM 混合物,没有任何气泡滞留。如果存在任何气泡,则将额外的 ECM 混合物引入下微通道,直到气泡消失。 - 重新连接下微通道的出口管。
- 使用活页夹固定下微通道的入口、旁路和出口管 clamp 将它们夹住。同时夹紧上微通道的入口管。
- 断开上微通道的出口管。
- 使用 P100 微量移液器,通过上微通道的出口孔引入 20 μL ECM 混合物。
- 重新连接上微通道的出口管。
- 将芯片置于含有5%CO2的湿润CO2培养箱中,在37°C下放置1小时,以在用PEI和GA处理的PDMS膜上形成ECM层(图3A)。
注意: 确保所有管子都夹紧在孵育过程中。 - 在ECM包被的孵育过程中,制备两个含有冷接种培养基的1 mL注射器,冷接种培养基是缺乏A8301但含有10μMY-27632和2.5μM CHIR99021的类器官培养基,如先前在源自人类类器官的Gut-on-a-Chip中报道的那样2。
注意:如先前报道的那样,从培养基中去除 A8301 以增强细胞与包被 ECM 的附着2。Gut-on-a-Chip 培养的第 0 天只需要上微通道流。因此,为上通道准备一个完整的注射器,而为下通道准备至少 0.2 mL。 - ECM 涂层完成后,将芯片从培养箱中取出,并将夹具松开到连接到下微通道的旁路管上。
- 将装有接种培养基的 1 mL 注射器连接到连接到 Gut-on-a-Chip 下微通道的钝端针头。小心地将接种培养基(~50μL)引入旁通管中。一旦管子充满引入的介质,用粘合夹固定连接到下微通道的旁路管。
- 松开 clamp 连接到下微通道的出口管。小心地将播种介质引入下部微通道,使其顺利流过系统。灌注后用粘合夹固定连接到下微通道的出口管。
- 接下来,打开连接到上微通道的旁路管。
- 将装有接种培养基的 1 mL 注射器连接到连接到芯片上部微通道的钝端针头。小心地将接种培养基(~50μL)引入旁通管中。一旦管子充满引入的介质,用粘合夹固定连接到上微通道的旁路管。
- 松开连接到下微通道的出口管。小心地将播种培养基引入上部微通道,使其顺利流过系统。灌注后用粘合夹固定连接到上微通道的出口管。
3.用于接种的犬肠道类器官细胞制备
注意:为了生成 Gut-on-a-Chip 模型,本协议中使用了源自 IBD 患者狗的犬结肠类器官(称为结肠类器官)。这些结肠来自三到五个活检结肠组织的小碎片,遵循先前报道的方法15,18。为了获得最佳结果,使用至少经过三次培养传代的犬结肠来建立适合体外应用的稳定类器官至关重要。建议将犬结肠培养至少 3-4 天,以促进类器官内多谱系细胞的充分分化,确保其功能成熟度和适用于 Gut-on-a-Chip 模型中的后续实验。这项工作的最大传代限制小于 20,正如之前的一项研究所表明的那样,该研究证明了在连续 20 次传代中未改变的表型和核型25。这些供体的信号在补充表S1中列出。
- 使用材料表中列出的类器官培养基在包埋在30μL基质胶15,18中的24孔板中培养犬结肠,该培养基由先前报道的培养基15,26,27修改而来。通过培养 Rspo1 细胞和经过工程改造以分泌 Noggin28 的 HEK293 细胞获得条件培养基。
- 通过真空抽吸弃类器官培养基,并在冰冷的温度下将 500 μL 细胞回收溶液引入每个孔中。在4°C孵育30分钟。
注意:通常,成熟犬肠道类器官的 24 孔板中的三个孔提供足够数量的解离细胞,以在 x10 放大倍率下接种具有 40-50 个类器官/一个视野的单个 Gut-on-a-Chip 设备。 - 使用P1000微量移液器对Matrigel圆顶进行机械破坏5秒。随后,将类器官悬浮液收集在 15 mL 锥形管中。
- 将锥形管在200 ×g 和4°C下离心5分钟,然后除去上清液。
- 在室温下引入 1 mL 胰蛋白酶样蛋白酶,补充有 10 μM Y-27632,并使用 P1000 微量移液器移液重悬细胞沉淀。
- 将细胞悬浮液置于37°C的水浴中,孵育10分钟,同时定期摇动混合物。
- 引入 5 mL 温热的类器官基础培养基,并使用 P1000 微量移液管用力移液细胞悬液,直至其变得浑浊,没有任何可见的细胞团块。
- 将细胞悬液通过截留值为 70 μm 的细胞过滤器,以消除任何基质胶碎片和大细胞簇。
- 将锥形管在200× g 和4°C下离心5分钟,然后将沉淀重悬于接种培养基中。对于一个犬 Gut-on-a-Chip 装置的接种,使用 20 μL 接种培养基重悬细胞沉淀(即,接种一个 Gut-on-a-Chip 装置时使用 20 μL 接种培养基)。
- 如前所述,用接种培养基将活细胞的浓度修改为 1 ×10 7 个细胞/mL2。通过将 10 μL 细胞悬液与 10 μL 台盼蓝混合,使用血细胞计数器进行活力评估,然后在显微镜下观察细胞。
注意:适当调整细胞浓度以确保最佳细胞附着和在芯片膜上形成均匀的单层至关重要。如果初始细胞数量不足,则可能导致汇合单层的延迟或失败。相反,如果细胞数量过多,非贴壁细胞会在通道内聚集成团块,从而导致不良的浓缩效应。
4. 2D细胞单层的接种和形成
- 断开上微通道的出口管。确保上微通道的旁路管保持打开状态。使用活页夹固定下微通道的入口和出口amp 夹住它们。
- 使用P100或P20微量移液器,将方案3中的20μL细胞悬液引入上微通道的出口孔(图3B 接种)。
- 使用粘合夹固定上微通道的旁通管和入口管amp.然后,将出口管重新连接到上微通道的出口孔,确保管道在整个过程中保持打开状态,以避免对上微通道施加任何压力。完成此步骤后,使用活页夹慢慢固定上通道的出口管 clamp 将其夹住。
- 使用显微镜验证细胞是否均匀分布在整个上微通道中。
注意:重要的是要夹紧管子以阻止介质在通道内移动,以允许稳定的静态条件,直到完成所需的细胞连接。 - 将芯片置于37°C的潮湿CO2 培养箱中。
注意:犬肠道类器官细胞附着在ECM涂层上大约需要3小时(图3B 附着)。 - 将连接到 Gut-on-a-Chip 上微通道的注射器连接到位于 CO2 培养箱内的注射器泵。
注意: 使用注射泵的旋钮小心地将培养基冲洗到微通道中,并取出未结合的细胞。在显微镜下检查芯片,以确保任何未附着的细胞已被有效洗掉。 - 用接种培养基以 30 μL/h 的速度启动培养基的流动。这种连续流动最初仅适用于上微通道,直到在芯片上建立 2D 单层。对于下部微通道,保持微通道夹紧且介质未冲洗。
- 从接种细胞后的第二天开始,从接种培养基中将培养基更改为类器官培养基,其中含有A8301并且缺乏10μMY-27632和2.5μM CHIR99021。
- 一旦建立单层,也启动连续的介质流向下微通道。犬肠道类器官上皮细胞通常需要 2 到 3 天才能建立上皮单层(图 3C)。
5. 犬类Gut-on-a-Chip中3D形态发生的建立
注意:在Gut-on-a-Chip中形成汇合的单层后,引入上通道和下通道的介质流动以及细胞菌株,以启动2D单层的3D形态发生,如 图2所示。
- 将类器官培养基引入上微通道和下微通道,以启动 Gut-on-a-Chip 系统中 3D 形态发生的开发。为了在现有的 Gut-on-a-Chip 设计(即 500 μm 高度的微通道)中实现 0.02 dyne/cm 2 的剪切应力,将流速增加到 50 μL/h29。
- 按照2之前的建议,启动10%的细胞菌株和0.15Hz的频率,使用计算机调节的生物反应器将循环菌株应用于 体外培养的细胞。这个过程将对 Gut-on-a-Chip 设备施加真空吸力。
- 将这些培养条件维持至少 2 至 3 天。犬肠单层的 3D 形态发生通常发生在硬脑膜通道流动和真空抽吸开始后 2 至 3 天(图 3C)。
6. 犬类 Gut-on-a-Chip 的表征
- 活细胞成像
- 使用注射泵轻轻流动介质,去除 Gut-on-a-Chip 中的任何气泡。
- 断开 Gut-on-a-Chip 设备与注射泵的连接。
注意: 避免任何可能在 Gut-on-a-Chip 内施加压力的操作。 - 将设备放置在显微镜上以捕获已建立的 3D 上皮的图像。为了使用相差可视化3D上皮层的结构,请使用10倍和20倍物镜(图3C)。
- 免疫荧光染色
- 通过将 1 g BSA 溶解在 50 mL 磷酸盐缓冲盐水 (PBS) 中以制备 2% BSA 来制备封闭溶液。将溶液通过0.2μm的注射器过滤器进行过滤。将该溶液储存在4°C。
- 通过将 150 μL Triton X-100 与 50 mL 封闭溶液混合来制备透化溶液,最终浓度为 0.3% Triton X-100。将溶液通过0.2μm的注射器过滤器进行过滤。将该溶液储存在4°C。
- 如步骤2.4-2.11所述,通过将100μL的4%PFA注入上微通道和下微通道来进行细胞固定。
- 如步骤2.4-2.11所述,将100μL的PBS注入上微通道和下微通道,冲洗细胞。
- 如步骤2.4-2.11所述,通过将100μL的0.3%Triton注入上微通道和下微通道来进行细胞的透化。将设备置于室温下 30 分钟。
- 如步骤2.4-2.11所述,将100μL的PBS注入上微通道和下微通道,冲洗细胞。
- 如步骤2.4-2.11所述,通过将100μL的2%BSA注射到上微通道和下微通道中,进行细胞封闭以防止非特异性结合。将设备置于室温下1小时。
- 注入20μL用2%BSA稀释的一抗溶液,并将其置于室温下3小时,然后在4°C孵育过夜。
注意:确保所有管子在4°C孵育期间被夹紧过夜。一抗的浓度应比单层或3D类器官染色的推荐浓度高2-5倍(补充图S1)。 - 如步骤2.4-2.11所述,通过将100μLPBS注入上微通道和下微通道来冲洗细胞。
- 注入 20 μL 用 2% BSA 稀释的二抗溶液,并将其置于室温下 1 小时。
注意: 确保所有管子都夹紧在孵育过程中。从这一步开始,有必要用铝箔屏蔽设备设置以防止光漂白。 - 如步骤2.4-2.11所述,通过将100μLPBS注入上微通道和下微通道来冲洗细胞。
- 制备用于 F-肌动蛋白和 DAPI(二脒基-2-苯基吲哚)复染的组合溶液。如步骤2.4-2.11所述,将20 μL组合溶液注入上微通道和下微通道中。
- 如步骤2.4-2.11所述,将100μL的PBS注入上微通道和下微通道,冲洗细胞。
使用荧光显微镜或共聚焦显微镜对3D上皮细胞的结构进行荧光成像。
7.上皮屏障功能
- 使用注射泵轻轻流动介质,去除 Gut-on-a-Chip 中的任何气泡。确保在测量过程中所有管道都处于打开状态。
- 从注射泵中取出 Gut-on-a-Chip 并将其置于室温下至少 10 分钟。
- 从70%EtOH溶液中去除Ag / AgCl电极。
- 将两个 Ag/AgCl 电极分别放入上部入口和下部出口中,以使用万用表测量上皮层的电阻。
- 将两个 Ag/AgCl 电极分别放入下部入口和上部出口中。将这两个值的平均值报告为 Gut-on-a-Chip 的电阻值。
注意:空白 TEER 应在仅具有 ECM 涂层而没有上皮的 Gut-on-a-Chip 上测量。 - 计算跨上皮电阻(TEER)值(kΩ×cm2)可以使用公式(1)计算。
TEER = (Ωt - Ω空白) × A (1)
其中 Ωt 是在实验开始后的特定时间点测量的电阻值,空白Ω是在没有上皮的情况下测量的电阻值,A 是细胞层覆盖的表面面积(对于此 Gut-on-a-Chip 设计29,约为 0.11 cm2)。- 使用公式(2)计算归一化TEER。
TEER =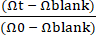 (2)
(2)
其中Ω0 是实验初始读数时间点的电阻值,如之前报告的 30 (图 4C)。
- 使用公式(2)计算归一化TEER。
结果
该协议可靠地促进了Gut-on-a-Chip系统中3D肠道形态发生的自发发展。这种方法利用从受炎症性肠病(IBD)影响的狗的肠道类器官中获得的犬肠上皮细胞(图1B)。在培养基流动6-9天后,在整个微通道中可以观察到犬肠上皮细胞的3D形态发生的偶尔聚集(图3C)。这些形态变化可以使用相衬技术进行监测。在这项研究中,我们利用了来自两只被诊断患有IBD的狗的类器官。值得注意的是,在两个生物学重复中观察到成功的 3D 形态发生,每个重复都通过两个技术重复进行。这项研究的结果为未来涉及来自其他犬类供体的肠道类器官的研究奠定了基础。这些结果证明了我们的实验方法的潜在适用性和可重复性,该方法之前已在人类样本中报道过。这些发现进一步证实了 Gut-on-a-Chip 技术适用于犬肠上皮细胞,正如之前使用人肠上皮细胞的研究所报道的那样2.
该方案表明,免疫荧光染色可用于使用常规荧光显微镜评估在微流控芯片中形成绒毛样结构的类器官衍生单层的3D结构(图4 A,B)。该方案可用于通过免疫荧光染色验证分化和空间组织的细胞表型。Gut-on-a-Chip 中 3D 形态发生的可视化为研究各种病理相互作用期间的宿主反应提供了绝佳的机会 14,23,31。当与来自患者供体的上皮细胞相结合时,如先前在人类中描述的那样,该技术可用于构建肠道疾病的个性化模型13。通过将免疫荧光成像与靶向RNA可视化技术(如荧光原位杂交)相结合,可以在Gut-on-a-Chip系统中直观地分析宿主的转录组和蛋白质组。
保持肠膜的完整性对于维持肠道稳态至关重要,而 Gut-on-a-Chip 平台通过对这一关键功能进行精确监测和量化,提供了宝贵的优势。使用Gut-on-a-Chip技术测量TEER具有多种优势。例如,以前的研究已经成功地评估了TEER,同时将肠道细胞与非致病性和益生菌共培养32,以及在肠漏条件下23。这使研究人员能够研究不同条件对肠道屏障功能的影响,并确定促进肠道健康的潜在干预措施。
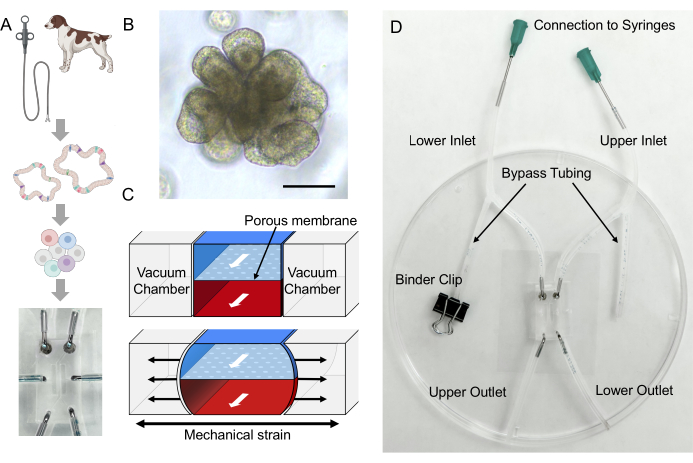
图 1:患者来源的犬 IBD Gut-on-a-Chip 的建立。 (A) 患者来源的肠道类器官和 Gut-on-a-Chip 平台的整合。可以进行内窥镜活检以分离肠隐窝细胞以开发供体特异性肠道类器官。上皮细胞可以从类器官中解离成单个细胞,然后接种到基于PDMS的Gut-on-a-Chip中,并在独特的动态微环境中培养。(B) IBD犬结肠样体的代表性图像。比例尺 = 100 μm。 (C) 该示意图展示了一种 Gut-on-a-Chip 器件,该器件由放置在上微通道和下微通道之间的多孔膜组成。上部微通道由蓝色区域表示,而下部微通道由红色区域表示。真空室存在于微通道的每一侧,它们使多孔膜变形以模拟蠕动24。(D) 犬 Gut-on-a-Chip 的设置包括基于 PDMS 的 Gut-on-a-Chip,该芯片与放置在盖玻片 2,24 上的管子组装在一起。旁路管对于避免在处理过程中(即连接到注射器)在微通道内积聚压力至关重要。粘结夹用于夹紧管道。体积敏感材料可以通过上部或下部出口的开口注入。可以通过将注射器连接到钝端针头和流经上下入口来输注类器官培养基。缩写:IBD = 炎症性肠病;PDMS = 聚二甲基硅氧烷。请点击这里查看此图的较大版本.
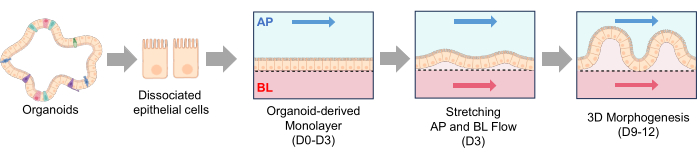
图 2:犬 IBD Gut-on-a-Chip 中绒毛样结构的形成。 将解离的上皮细胞接种在ECM包被的Gut-on-a-Chip中。一旦解离的细胞附着在PDMS膜上,就开始顶端流动3天(D0-D3)。当形成汇合的 2D 单层 (D3) 时,启动具有频繁拉伸的基底外侧流动(拉伸、AP 和 BL 流动)。经过2-3天的双流和膜拉伸,2D单层开始发育3D形态发生,培养9天后形成绒毛样结构(3D形态发生,D9-D12)。缩写:ECM = 细胞外基质;PDMS = 聚二甲基硅氧烷;AP = 顶端;BL = 基底外侧。 请点击这里查看此图的较大版本.
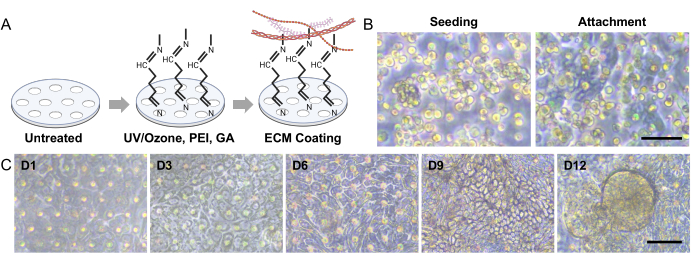
图 3:Gut-on-a-Chip 中的犬肠道类器官播种和 3D 形态发生 。 (A) 在基于PDMS的Gut-on-a-Chip中表面活化多孔膜的实验步骤。结合使用UV/臭氧处理、PEI和GA处理,可促进ECM溶液中存在的胺的交联。该过程导致ECM蛋白稳定地固定在多孔膜上。(B) 相差图像显示了接种后立即(左)和接种后 3-5 小时(右)的细胞形态。接种3小时后的多孔膜显示单个细胞附着的更薄和更暗的区域,突出了附着过程。(C) 相差图像描绘了 Gut-on-a-Chip 系统中肠道单层的 3D 形态发生。这些单层细胞来源于受IBD影响的狗,这些类器官细胞在动态条件下培养了12天,其中包括流体流动和拉伸运动。比例尺 = 50 μm (B,C)。缩写:IBD = 炎症性肠病;ECM = 细胞外基质;PDMS = 聚二甲基硅氧烷;PEI = 聚乙烯亚胺;GA = 戊二醛。 请点击这里查看此图的较大版本.
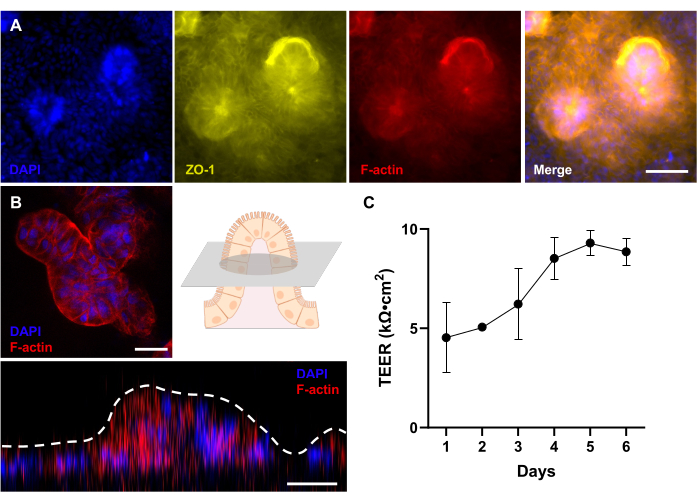
图 4:患者源性犬 Gut-on-a-Chip 的 3D 形态发育评估。 (A) 犬 IBD Gut-on-a-Chip 的免疫荧光成像,展示了培养 12 天后完全发育的 3D 上皮的自上而下的视图,并通过荧光显微镜进行评估。紧密连接蛋白 (ZO-1) 以黄色显示;刷状缘膜(F-肌动蛋白)显示为红色;细胞核被DAPI染色并呈蓝色。(B) 使用带有长距离透镜的共聚焦显微镜对犬 IBD Gut-on-a-Chip 进行免疫荧光成像。如示意图所示,显示了培养 12 天后完全发育的 3D 上皮的绒毛状结构横截面的荧光图像。此外,Z 形堆叠显示了 3D 上皮的侧视图,揭示了绒毛样结构的形成。刷状缘膜(F-肌动蛋白)呈红色,细胞核被DAPI染色并呈蓝色。(C) 通过 TEER 评估和测量患者来源的犬 Gut-on-a-Chips 中的肠道屏障功能。在 Gut-on-a-Chip 培养的第 5 天达到稳定的 TEER 值。误差线表示测量的SEM。TEER值是在两个生物学重复和一个技术重复中测量的。比例尺 = 50 μm (A),25 μm (B)。缩写:IBD = 炎症性肠病;DAPI = 4',6-二脒基-2-苯基吲哚;TEER = 跨上皮电阻。请点击这里查看此图的较大版本.
补充图 S1:抗 ZO-1 多克隆抗体在犬结肠衍生的单层和 Gut-on-a-Chip 设备上的表征。 (A) 黄色 ZO-1 的免疫荧光染色和红色的 F-肌动蛋白及其叠加图像。比例尺 = 25 μm。 (B) 在各种条件下对“肠漏芯片”中黄色的 ZO-1 进行免疫荧光可视化,包括益生菌(LGG + 细胞因子或 VSL#3 + 细胞因子)刺激和无益生菌刺激的无菌对照(细胞因子)。比例尺 = 50 μm。该图转载自 Min et al.23。 请点击这里下载此文件。
附表S1:组织捐献者信息摘要。 供体年龄、性别、品种、组织病理学评估和犬 IBD 活动指数 (CIBDAI) 评分的汇总表。CIBDAI 是一种数字评分系统,用于推断犬 IBD33 的临床严重程度。 请点击这里下载此文件。
讨论
这项研究标志着犬肠道类器官与犬IBD Gut-on-a-Chip模型开发的兼容性的开创性证明。将肠道类器官和类器官衍生的单层培养物整合到微流体系统(即 Gut-on-a-Chip 系统)中进一步发展了该技术,从而能够创建与生理动力学密切相关且更能代表生物条件的 体外 肠道模型。特别是,由于很少有关于在人类中使用 IBD 衍生类器官进行 Gut-on-a-Chip 培养的报道,因此目前使用犬 IBD 衍生的 Gut-on-a-Chip 的研究可能为人类 IBD 的研究提供领先的见解。
在 Gut-on-a-Chip 上成功开发犬肠上皮 3D 形态发生需要仔细注意几个关键步骤。首先,PDMS微流体通道的疏水表面可能会阻碍ECM粘附和随后的细胞附着,因此在ECM包被和细胞接种之前需要PDMS的表面活化(参见方案第1节)。为了实现稳定的单层培养,在细胞附着后去除多余的未附着细胞至关重要(方案步骤4.6-4.7)。此外,动态刺激,如恒定的介质流量和蠕动样的真空运动,对于肠上皮的 3D 形态发生是必要的(方案步骤 5.2)。在芯片上肠道培养的任何步骤中,小心处理对于避免微通道中出现气泡至关重要。
如果在Gut-on-a-Chip中遇到不良的细胞接种,可能是由于细胞数量少或细胞附着不良。为了解决细胞数量低的问题,重要的是通过观察它们在基质胶中的生长来检查准备好的肠道类器官的健康状况。细胞解离后可通过台盼蓝染色来评估细胞活力,以确保不超过 20% 的细胞死亡。如果活细胞数量不足,可以尝试优化类器官培养基条件。另一种可能性是类器官解离不完全,导致过量大于 70 μm 的细胞团块被过滤器捕获。为了解决这个问题,一种选择是延长细胞解离期间的移液时间。或者,15 mL 锥形管可以每分钟轻轻搅拌一次,同时用胰蛋白酶样蛋白酶处理。电池与芯片上的附着不良可能是由于 ECM 涂层不当造成的。在涂布过程中,建议仔细检查是否存在气泡,并根据需要轻轻添加更多涂布溶液来防止气泡的形成。细胞过度拥挤和无法洗掉未附着的细胞会导致初始单层不足。在这种情况下,在推动注射器柱塞时可以施加轻微的脉冲。这些故障排除步骤有助于识别和解决 Gut-on-a-Chip 培养过程中的问题。
虽然这种Gut-on-a-Chip平台能够创建起伏的3D上皮层,但我们认识到需要额外的生物学复杂性来完全复制肠道微环境。考虑上皮细胞和间充质细胞之间的相互作用、用于 3D 再生的 ECM 沉积以及建立合适干细胞生态位的隐窝绒毛特征的存在至关重要。基质细胞,如成纤维细胞,在ECM蛋白的产生和肠道形态发生的调节中起着至关重要的作用34,35,36。在该模型中加入间充质细胞有可能增强形态发生和细胞附着效率。内皮层包括毛细血管系统和淋巴管,在控制分子转运和免疫细胞募集方面起着至关重要的作用37,38。患者来源的免疫细胞的加入对于肠道疾病建模至关重要,因为它可以证明先天免疫和适应性免疫之间的相互作用以及组织特异性免疫的建立39。在Gut-on-a-Chip上完成3D形态发生后,可以将类器官培养基修饰为类器官分化培养基。这可能是诱导额外细胞分化的可行方法,具体取决于实验目标。
由于需要较长的工作距离,因此对3D微架构进行 原位 成像具有挑战性,而长距离物镜可以克服这一点。此外,逐层的微纳加工和键合方法使得很难进入上层进行SEM检查。对于当前的 Gut-on-a-Chip 设计,每个 Gut-on-a-Chip 微器件需要一个注射泵,占用 CO2 培养箱空间并防止大规模实验。需要创新来提高用户友好型平台和高通量筛选的可扩展性。
这些目前的方案允许在体外自发开发 3D 上皮层,超越了传统 3D 类器官、2D 单层和静态微器件培养系统的局限性。这种动态的体外肠道微环境可以通过引入不同细胞类型的共培养来控制。先前的研究已经探索了操纵肠道芯片微环境的方法,包括共培养肠道微生物组14,23 和外周单核细胞30。这种重构的微环境具有许多潜在的应用,包括药物测试、基础机制研究和疾病建模。重建的微环境具有广泛的应用潜力,例如药物测试23,40,41和疾病建模12,13,14,30,以及肠道形态发生的基本机制研究42。可以通过收集上清液以评估代谢物43,通过收集细胞进行基因组检查2,32,或通过使用活细胞染料或固定物目视检查细胞以进行随后的免疫荧光成像23,44来进行各种测定。
本研究提出了一种可重复的方案,用于在 Gut-on-a-Chip 平台中开发犬肠上皮层的 3D 形态发生。由此产生的 3D 上皮结构提供了更逼真的肠道微环境表示,这在各种生物医学研究中具有巨大的应用潜力。通过利用这种肠道结构,我们可以进行更多的转化研究,并有可能产生有希望的结果。
披露声明
作者没有任何利益冲突需要声明。
致谢
我们要感谢 WSU 小动物内科服务(Jillian Haines 博士、Sarah Guess 博士、Shelley Ensign LVT 博士)和 WSU VTH 临床研究协调员 Valorie Wiss 在病例招募和公民科学家(患者捐赠者)样本采集方面的支持。这项工作得到了美国国立卫生研究院(K01OD030515和R21OD031903到YMA)主任办公室和日本科学促进会青年研究人员海外挑战计划(202280196到I.N.)的部分支持。 图 1A 和 图 3A 是使用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| Organoid basal medium | |||
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| GlutaMAX | Gibco | 35050-061 | 2 mM, glutamine substitute |
| 1 M HEPES | VWR Life Science | J848-500ML | 10 mM |
| 100x penicillin–streptomycin | Corning | MT30009CI | 1x |
| Organoids and organoid medium | |||
| A-83-01 | PeproTech | 9094360 | 500 nM |
| B27 supplement | Gibco | 17504-044 | 1x |
| CHIR99021 | Reprocell | 04-0004-base | 2.5 µM |
| HEK293 cells engineered to secrete Noggin | Baylor College of Medicine | ||
| Murine EGF | PeproTech | 315-09-1MG | 50 ng/mL |
| Murine Wnt-3a | PeproTech | 315-20-10UG | 100 ng/mL |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | 1 mM |
| N2 MAX Media supplement | Gibco | 17502-048 | 1x |
| Nicotinamide | Sigma | N0636-100G | 10 mM |
| Noggin Conditioned Medium | NA | NA | 10% vol/vol |
| Primocin | InvivoGen | ant-pm-1 | 100 µg/ml |
| R-spondin1 (Rspo1) cells | Trevigen | 3710-001-01 | Rspo1 cells |
| R-Spondin-1 Conditioned Medium | NA | NA | 20% vol/vol |
| SB202190 | Sigma-Aldrich | S7067-25MG | 10 µM |
| Y-27632 | StemCellTechnologies | 72308 | 10 µM |
| [Leu15 ]-Gastrin I human | Sigma-Aldrich | G9145-.5MG | 10 nM |
| Reagents | |||
| 4% Paraformaldehyde solution | Fisher Scientific | AAJ19943K2 | |
| Alexa Fluor 647 Phalloidin | Thermo Fisher Scientific | A22287 | x250 dilution |
| Anti-Rabbit IgG H&L labeled with Alexa Fluor 555 | Abcam | ab150078 | x1,000 dilution |
| Anti-ZO-1 polyclonal antibody | Thermo Fisher Scientific | 61-7300 | x50 dilution |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen I, Rat Tail 3 mg/mL | Gibco | A10483-01 | |
| Diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | 62248 | x1,000 dilution |
| EMS Glutaraldehyde Aqueous 50% | Electron Microscopy Sciences | 16320 | |
| Matrigel Matrix | Corning | 356255 | |
| Poly(ethyleneimine) solution | Sigma | 408700-250ML | |
| TrypLE Express | Gibco | 12604-021 | |
| Materials and Equipment | |||
| 24-well culture plates | Corning | 3524 | |
| 87V Industrial Multimeter | Fluke Corporation | ||
| Centrifuge | Eppendorf | 5910R | |
| CO2 incubator | Eppendorf | C170i | |
| DMi8 fluorescence microscope | Leica microsystems | DMi8 | |
| Dry oven | Fisher Scientific | 15-103-0519 | |
| FlexCell FX-5000 Tension system | Flexcell International Corporation | ||
| Inverted phase-contrast microscope | Leica microsystems | DMi1 | |
| SP8-X inverted confocal microscope | Leica microsystems | SP8-X | |
| Syringe pump | Braintree Scientific | model no. BS-8000 120V | |
| Syringe, 3 mL sterile | BD Biosciences | 14-823-435 | |
| Syringes, 1 mL sterile | BD Biosciences | 14-823-434 | |
| UV/ozone generator | Jelight Company | model no. 30 | |
| Software | |||
| LAS X imaging software | Leica microsystems |
参考文献
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, ethics, and humanities in medicine: PEHM. 4, 2 (2009).
- Shin, W., Kim, H. J. 3D in vitro morphogenesis of human intestinal epithelium in a gut-on-a-chip or a hybrid chip with a cell culture insert. Nature protocols. 17 (3), 910-939 (2022).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. BMC Biome. 6 (72), 1-11 (2018).
- German, A. J. The growing problem of obesity in dogs and cats. The Journal of Nutrition. 136, 1940-1946 (1940).
- Patronek, G. J., Waters, D. J., Glickman, L. T. Comparative longevity of pet dogs and humans: Implications for gerontology research. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 52 (3), B171-B178 (1997).
- Lutz, T. A. Mammalian models of diabetes mellitus, with a focus on type 2 diabetes mellitus. Nature reviews. Endocrinology. 19 (6), 350-360 (2023).
- Allenspach, K., Culverwell, C., Chan, D. Long-term outcome in dogs with chronic enteropathies: 203 cases. Veterinary Record. 178 (15), 368 (2016).
- Patnaik, A. K., Hurvitz, A. I., Johnson, G. F. Canine gastrointestinal neoplasms. Veterinary Pathology. 14 (6), 547-555 (1977).
- Saito, T., et al. Immunohistochemical analysis of beta-catenin, e-cadherin and p53 in canine gastrointestinal epithelial tumors. Journal of Veterinary Medical Science. 82 (9), 1277-1286 (2020).
- Kopper, J. J., et al. Harnessing the biology of canine intestinal organoids to heighten understanding of inflammatory bowel disease pathogenesis and accelerate drug discovery: A One Health approach. Frontiers in Toxicology. 3, 1-13 (2021).
- Jalili-firoozinezhad, S., et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nature Biomedical Engineering. 3 (7), 520-531 (2019).
- Shin, W., et al. Robust formation of an epithelial layer of human intestinal organoids in a polydimethylsiloxane-based Gut-on-a-Chip microdevice. Frontiers in Medical Technology. 2, (2020).
- Shin, Y. C., et al. Three-dimensional regeneration of patient-derived intestinal organoid epithelium in a physiodynamic mucosal Interface-on-a-Chip. Micromachines. 11 (7), 663 (2020).
- Tovaglieri, A., et al. Species-specific enhancement of enterohemorrhagic E. coli pathogenesis mediated by microbiome metabolites. Microbiome. 7 (1), 43 (2019).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 1-21 (2019).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunology. 8 (2), 352-361 (2015).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 1-17 (2020).
- Gabriel, V., et al. Canine intestinal organoids in a dual-chamber permeable support system. Journal of Visualized Experiments. 2 (181), 1-24 (2022).
- Yamada, A., et al. Confronting emerging zoonoses: the one health paradigm. Confronting Emerging Zoonoses: The One Health Paradigm. , 1 (2014).
- Lerner, H., Berg, C. The concept of health in One Health and some practical implications for research and education: what is One Health. Infection Ecology & Epidemiology. 5 (1), 25300 (2015).
- Garcia, S. N., Osburn, B. I., Jay-Russell, M. T. One Health for food safety, food security, and sustainable food production. Frontiers in Sustainable Food Systems. 4, 1-9 (2020).
- Min, S., et al. Live probiotic bacteria administered in a pathomimetic Leaky Gut Chip ameliorate impaired epithelial barrier and mucosal inflammation. Scientific Reports. 12 (1), 22641 (2022).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Qu, M., et al. Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research. 31 (3), 259-271 (2021).
- Sahoo, D. K., et al. Differential transcriptomic profiles following stimulation with lipopolysaccharide in intestinal organoids from dogs with inflammatory bowel disease and intestinal mast cell tumor. Cancers. 14 (14), 3525 (2022).
- Gabriel, V., et al. Standardization and maintenance of 3D canine hepatic and intestinal organoid cultures for use in biomedical research. Journal of Visualized Experiments. (179), 1-28 (2022).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell reports. 3 (4), 1128-1139 (2013).
- Shin, W., et al. A robust longitudinal co-culture of obligate anaerobic gut microbiome with human intestinal epithelium in an anoxic-oxic interface-on-a-chip. Frontiers in Bioengineering and Biotechnology. 7, 1-13 (2019).
- Shin, W., Kim, H. J. Intestinal barrier dysfunction orchestrates the onset of inflammatory host-microbiome cross-talk in a human gut inflammation-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 115 (45), E10539-E10547 (2018).
- Park, G. S., et al. Emulating host-microbiome ecosystem of human gastrointestinal tract in vitro. Stem Cell Reviews and Reports. 13 (3), 321-334 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Jergens, A. E., et al. A scoring index for disease activity in canine inflammatory bowel disease. Journal of Veterinary Internal Medicine. 17 (3), 291-297 (2003).
- Roulis, M., Flavell, R. A. Fibroblasts and myofibroblasts of the intestinal lamina propria in physiology and disease. Differentiation; research in biological diversity. 92 (3), 116-131 (2016).
- Göke, M., Kanai, M., Podolsky, D. K. Intestinal fibroblasts regulate intestinal epithelial cell proliferation via hepatocyte growth factor. The American Journal of Physiology. 274 (5), G809-G818 (1998).
- Powell, D. W., Pinchuk, I. V., Saada, J. I., Chen, X., Mifflin, R. C. Mesenchymal cells of the intestinal lamina propria. Annual Review of Physiology. 73, 213-237 (2011).
- Pappenheimer, J. R., Michel, C. C. Role of villus microcirculation in intestinal absorption of glucose: coupling of epithelial with endothelial transport. The Journal of Physiology. 553, 561-574 (2003).
- Agace, W. W. T-cell recruitment to the intestinal mucosa. Trends in Immunology. 29 (11), 514-522 (2008).
- Ambrosini, Y. M., Shin, W., Min, S., Kim, H. J. Microphysiological engineering of immune responses in intestinal inflammation. Immune Network. 20 (2), 13 (2020).
- Kasendra, M., et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Scientific Reports. 8 (1), 1-14 (2018).
- Sontheimer-Phelps, A., et al. Human Colon-on-a-Chip enables continuous in vitro analysis of colon mucus layer accumulation and physiology. Cellular and Molecular Gastroenterology and Hepatology. 9 (3), 507-526 (2020).
- Shin, W., et al. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow- dependent physical cues in a microengineered Gut-on-a-Chip. iScience. 15, 391-406 (2019).
- Gijzen, L., et al. An Intestine-on-a-Chip model of plug-and-play modularity to study inflammatory processes. SLAS Technology. 25 (6), 585-597 (2020).
- Kim, H. J., Lee, J., Choi, J. H., Bahinski, A., Ingber, D. E. Co-culture of living microbiome with microengineered human intestinal villi in a gut-on-a-chip microfluidic device. Journal of Visualized Experiments. (114), 3-9 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。