Method Article
İnflamatuar Bağırsak Hastalığı Hastalarından Türetilen Bağırsak Organoidleri Kullanılarak Çip Üzerinde Köpek Bağırsağında Üç Boyutlu Morfogenez
Bu Makalede
Özet
Köpek bağırsak organoidlerinin ve bir Çip Üzerinde Bağırsak mikroakışkan sisteminin entegrasyonu, insan bağırsak hastalıkları için ilgili translasyonel modeller sunar. Sunulan protokoller, bağırsağın 3D morfogenezine ve dinamik in vitro modellemesine izin vererek, köpeklerde ve insanlarda Tek Sağlık ile bağırsak hastalıkları için etkili tedavilerin geliştirilmesine yardımcı olur.
Özet
Köpek bağırsakları anatomi, mikrobiyoloji ve fizyoloji açısından insanlarınkiyle benzerliklere sahiptir ve köpekler doğal olarak insanlara benzer kendiliğinden bağırsak bozuklukları geliştirir. Bağırsak epitelinin apikal yüzeyine erişimde üç boyutlu (3D) organoidlerin doğal sınırlamasının üstesinden gelmek, organoidlerden türetilen hücreleri kullanarak erişilebilir luminal yüzeyi ortaya çıkaran iki boyutlu (2D) tek katmanlı kültürlerin üretilmesine yol açmıştır. Bu organoidlerin ve organoid türevli tek tabakalı kültürlerin mikroakışkan bir Çip Üzerinde Bağırsak sistemine entegrasyonu, teknolojiyi daha da geliştirerek, fizyolojik olarak daha ilgili dinamik in vitro bağırsak modellerinin geliştirilmesine izin verdi.
Bu çalışmada, inflamatuar bağırsak hastalığından (IBD) etkilenen köpeklerden elde edilen primer bağırsak dokusu örneklerini kullanarak köpek bağırsak epitelinin 3D morfogenezini oluşturmak için bir protokol sunuyoruz. Ayrıca, 3D bağırsak organoidlerinden türetilen hücreleri kullanarak 2D tek katmanlı kültürler ve çip üzerinde bağırsak sistemleri oluşturmak ve sürdürmek için bir protokol özetliyoruz. Bu çalışmada sunulan protokoller, köpekler için özel olarak tasarlanmış mikroakışkan bir Çip Üzerinde Bağırsak sistemi oluşturmak için temel bir çerçeve görevi görür. Bu yenilikçi yaklaşımın temelini atarak, Tek Sağlık Girişimi ilkeleriyle uyumlu olarak bu tekniklerin biyomedikal ve translasyonel araştırmalarda uygulanmasını genişletmeyi amaçlıyoruz. Bu yaklaşımı kullanarak, hem köpeklerde hem de insanlarda bağırsak fizyolojisini incelemek için fizyolojik olarak daha ilgili dinamik in vitro modeller geliştirebiliriz. Bu, her iki türde de bağırsak hastalıkları için daha etkili tedavilerin geliştirilmesine yardımcı olabileceğinden, biyomedikal ve farmasötik uygulamalar için önemli etkilere sahiptir.
Giriş
Bağırsak epitelyal morfogenezi büyük ölçüde maliyetli, zaman alıcı ve insan gelişim süreçlerini doğru bir şekilde temsil etmeyen laboratuvar hayvanı modelleri aracılığıyla incelenmiştir1. Ayrıca, geleneksel statik 2D hücre kültürü modelleri, bir 3D epitel mimarisinin karmaşık uzamsal organizasyonunu taklit etme yeteneğinden yoksundur2. Sonuç olarak, bağırsak epitel mimarisi anlayışımızı ilerletmek için insanla ilgili hayvan modellerinden bağırsak epitel hücrelerini kullanarak in vitro 3D morfogenezi indüklemek için bir protokole ihtiyaç vardır.
Refakatçi köpekler, evcilleştirme sırasında ortak ortamları ve diyetleri nedeniyle insanlara oldukça benzeyen bağırsak anatomisi ve mikrobiyom bileşimleri geliştirmiştir3. Bu benzerliğe ek olarak, hem insanlar hem de köpekler, bağırsak sağlığına atfedildiği düşünülen çeşitli kronik morbiditeleri paylaşırlar. Köpekler, insanlar gibi, obezite, bilişsel işlev bozukluğu, diabetes mellitus, inflamatuar bağırsak hastalığı (IBD) ve kolorektal adenokarsinom 4,5,6,7,8,9,10 gibi kronik durumlar geliştirebilir. Önceki Gut-on-a-Chip çalışmalarında insan ve fare epitel hücrelerinin geliştirilmesine ve kullanılmasına rağmen 2,11,12,13,14, köpek bağırsak epiteli şimdiye kadar kullanılmamıştır. 3D epitelyal morfogeneze sahip dinamik bir kültür sisteminde köpek bağırsak organoid epitelini kullanan yeni yaklaşımımız, hem köpek hem de insan tıbbı için önemli etkilere sahiptir.
Bağırsak organoid kültüründeki son gelişmeler, köpek bağırsak organoid kültürünün kurulmasına yol açmıştır15. Bu kültür sistemi, tanımlanmış morfojen koşullandırma altında bağırsak kök hücrelerinin kültürlenmesini içerir ve yetişkin kök hücrelerden türetilen kendi kendini yenileme özelliklerine sahip bir 3D modelile sonuçlanır 16. Bununla birlikte, taşıma tahlilleri veya konakçı-mikrobiyom kokültürlerinin yürütülmesi, bağırsak lümeninin kapalı doğası nedeniyle bu 3D modelle zorluklar ortaya çıkarmaktadır17. Bunu ele almak için araştırmacılar, bağırsak organoidlerinden türetilen ve luminal yüzeyin18,19 açığa çıkmasına izin veren bir 2D tek tabaka oluşturdular. Bununla birlikte, hem 3D organoidler hem de 2D tek tabakalar, bağırsak mikroçevresinin in vivo biyomekaniğini doğru bir şekilde yansıtmayan statik koşullar altında tutulur. Hasta kaynaklı köpek organoidleri teknolojisinin in vitro 3D morfogenez ile birleştirilmesi, kronik multifaktöriyel hastalıklara yönelik translasyonel araştırmalar için bir fırsat sunar. Bu yaklaşım, araştırmacıların hem insanlara hem de köpeklere fayda sağlayan daha etkili tedaviler geliştirmelerine ve insan, hayvan ve çevre sağlığının birbirine bağlılığını tanıyan işbirlikçi bir yaklaşım olan Tek Sağlık Girişimi ile uyumlu olarak çeviri araştırmalarını daha da ilerletmelerine olanak tanır. Karmaşık sağlık sorunlarını ele almak ve herkes için en iyi sağlık sonuçlarını elde etmek için disiplinler arası işbirliğini teşvik eder. Girişim, insanlar, hayvanlar ve ekosistemler arasındaki karşılıklı bağımlılıkları anlayarak, ortaya çıkan bulaşıcı hastalıklardan, çevresel bozulmadan ve diğer ortak sağlık sorunlarından kaynaklanan riskleri azaltmayı amaçlamaktadır20,21,22.
Bu protokol, polidimetilsiloksan (PDMS) bazlı gözenekli membrana sahip bir Gut-on-a-Chip mikro cihazında hasta organoidlerinden elde edilen köpek bağırsak epitel hücrelerinin kültürlenmesi için kapsamlı yöntemleri özetlemektedir. Köpek bağırsak organoidlerini ve bu Gut-on-a-Chip teknolojisini entegre ederek 3D epitelyal morfogenezin oluşturulması, bağırsağın hücresel organizasyonunu ve kök hücre nişini nasıl geliştirdiğini ve koruduğunu incelememizi sağlar. Bu platform, mikrobiyom topluluklarının bağırsak sağlığı üzerindeki etkisini araştırmak ve bu toplulukların bağırsak patofizyolojisine katkıda bulunan mikrobiyal metabolitleri nasıl ürettiğini anlamak için değerli bir fırsat sunmaktadır14,23. Bu gelişmeler artık köpek bağırsak örneklerine genişletilebilir ve araştırmacılara bağırsak mikrobiyomu ile konakçı fizyolojisi arasındaki karmaşık ilişkiyi keşfetme fırsatları sunar. Bu, bağırsak patofizyolojisinin altında yatan mekanizmalar hakkında değerli bilgiler edinmek ve mikrobiyal metabolitlerin hem köpek hem de insan sağlığında ve ayrıca çeşitli hastalık durumlarında potansiyel rolünü anlamak için yollar açar. Köpek Gut-on-a-Chip için kullanılan protokol tekrarlanabilir, bu da onu karşılaştırmalı tıp için uygun bir deneysel model haline getirir, çünkü bu yaklaşım hem köpeklerde hem de insanlarda konak-mikrobiyom etkileşimlerinin, patojen enfeksiyonlarının ve probiyotik bazlı terapötik etkilerin araştırılmasını sağlar.
Protokol
Çalışma, Washington Eyalet Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'ne (ASAF# 6993) uygun olarak onaylanmış ve yürütülmüştür. Bu protokolde, şirket içinde üretilen PDMS'den yapılmış köklü bir Çip Üzerinde Bağırsakmikroakışkan cihazı kullandık 2 (Şekil 1D). Gut-on-a-Chip mikro cihazının üretiminin ayrıntılı yöntemleri önceki raporlardabulunabilir 2,24. Bu protokol, bağırsak organoidlerinin ve bir mikroakışkan sistemin benzersiz bir entegrasyonunu gösterir (Şekil 2).
1. PDMS'den yapılmış bir Çip Üzerinde Gut-on-Chip'in yüzey aktivasyonu
- 50 mL'lik konik bir tüpte 49 mL damıtılmış (DI) suya 1 mL %50 PEI çözeltisi ekleyerek %1 polietilenimin (PEI) çözeltisi hazırlayın. Çözeltiyi iyice karıştırmak için tüpü iki ila üç kez ters çevirin, ardından çözeltiyi 0.2 μm'lik bir şırınga filtresi kullanarak filtreleyin.
NOT: 4 °C'de saklayın. - 50 mL'lik konik bir tüpte 49,9 mL DI içine 100 μL %50 GA çözeltisi ekleyerek %0,1 glutaraldehit (GA) çözeltisi hazırlayın. Çözeltiyi iyice karıştırmak için tüpü iki ila üç kez ters çevirin, ardından çözeltiyi 0.2 μm'lik bir şırınga filtresi kullanarak filtreleyin.
NOT: 4 °C'de saklayın ve doğrudan ışığa maruz kalmaktan koruduğunuzdan emin olun. - Gut-on-a-Chip cihazını 60 °C'ye ayarlanmış kuru bir fırına yerleştirin ve kalan nemi gidermek için en az 30 dakika inkübe edin.
- Gut-on-a-Chip cihazını bir UV/Ozon jeneratörü kullanarak 60 dakika boyunca UV ve Ozon tedavisine maruz bırakın.
NOT: İşlem sırasında PDMS yüzeylerinin optimum aktivasyonunu sağlamak için UV lambası ile cihaz arasında yaklaşık 3 cm veya daha az bir mesafe bırakın. Verimli yüzey aktivasyonu gerçekleştirmek için jeneratördeki cihazların aşırı kalabalıklaşmasını önleyin. - Üst mikro kanalın giriş, baypas ve çıkış borularını cl kullanarak sabitleyin.amp bunlar. Ayrıca alt mikro kanal için giriş borusunu da sıkıştırın.
- Alt mikro kanal için çıkış borusunu ayırın. Alt mikro kanalın baypas borusunun açık kaldığından emin olun.
- Bir P100 mikropipet kullanarak, alt mikrokanalın çıkış deliğinden 100 μL% 1 PEI çözeltisi verin.
NOT: Bu işlemin, cihaz UV/Ozon maruziyetinden dolayı hala sıcakken yapılması önerilir. Mikrokanaldan akan PEI çözeltisini ve PEI çözeltisinin alt mikro kanal için baypas borusundan dışarı çıktığını gözlemleyin. - Alt mikro kanal için çıkış borusunu yeniden bağlayın.
- Alt mikro kanalın giriş, baypas ve çıkış borularını cl kullanarak sabitleyin.amp bunlar. Ayrıca üst mikro kanal için giriş borusunu da sıkıştırın.
- Üst mikro kanalın çıkış borusunu ayırın. Üst mikro kanalın baypas borusunun açık kaldığından emin olun.
- Bir P100 mikropipet kullanarak, üst mikrokanalın çıkış deliğinden 100 μL% 1 PEI çözeltisi verin.
NOT: Mikrokanaldan akan PEI solüsyonunu ve PEI solüsyonunun üst mikrokanal için baypas borusundan dışarı çıktığını gözlemleyin. - Üst mikro kanalın çıkış borusunu yeniden takın.
- Hem üst hem de alt mikrokanallar %1 PEI çözeltisi ile doldurulduktan sonra, cihazın oda sıcaklığında (RT) 10 dakika inkübe etmesine izin verin.
- %0,1 GA çözeltisi ile 1.5-1.12 adımlarını gerçekleştirin.
- Hem üst hem de alt mikrokanallar %0.1 GA çözeltisi ile doldurulduktan sonra, cihazın RT'de 20 dakika inkübe etmesine izin verin.
- Fazla yüzey aktivasyon solüsyonunu çıkarmak için 1.5-1.12 adımlarını DI suyuyla gerçekleştirin.
- Çipi 60 °C'de kuru bir fırına koyun ve gece boyunca kurumasını bekleyin.
NOT: Borunun herhangi bir şekilde çarpmasını önlemek için bağlayıcı klipsleri tüm borulardan çıkardığınızdan emin olun. Bu kurutma işlemi, Gut-on-a-Chip12 içindeki mikrokanalın eşit yüzey aktivasyonu için kritik öneme sahiptir.
2. Gut-on-a-Chip kültürü için hücre dışı matris (ECM) kaplama ve kültür ortamı hazırlama
- Kollajen I ve Matrigel'in nihai konsantrasyonu sırasıyla 60 μg/mL ve %2 (hacim/hacim) olacak şekilde organoid bazal besiyeri ile bir ECM karışımı hazırlayın.
NOT: Bağırsak çipi başına 50 μL ECM karışımı hazırlayın (yani, her üst ve alt mikrokanal için 20 μL ECM karışımı ve 10 μL ekstra). Bunu kullanım gününde hazırlayın ve bu solüsyonu 4 °C'de saklayın veya kullanıma hazır olana kadar buzun üzerine koyun. - UV/Ozon, PEI ve GA ile işlenmiş Gut-on-a-Chip'i kuru fırından çıkarın.
NOT: Nem kalıntısı olup olmadığını görmek için faz kontrast mikroskobu altında inceleyin. - Gut-on-a-Chip'in bir biyogüvenlik kabininde 10 dakika soğumasını bekleyin.
- Üst mikro kanalın giriş, baypas ve çıkış borularını cl kullanarak sabitleyin.amp bunlar. Ayrıca alt mikro kanal için giriş borusunu da sıkıştırın.
- Alt mikro kanal için çıkış borusunu ayırın.
- Bir P100 mikropipet kullanarak, alt mikrokanalın çıkış deliğinden 20 μL ECM karışımı verin.
NOT: Herhangi bir hava kabarcığı sıkışması olmadan mikrokanaldan akan ECM karışımını gözlemleyin. Herhangi bir hava kabarcığı varsa, kabarcık gidene kadar alt mikro kanala ek ECM karışımı ekleyin. - Alt mikro kanal için çıkış borusunu yeniden takın.
- Alt mikro kanalın giriş, baypas ve çıkış borularını cl kullanarak sabitleyin.amp bunlar. Ayrıca üst mikro kanal için giriş borusunu da sıkıştırın.
- Üst mikro kanalın çıkış borusunu ayırın.
- Bir P100 mikropipet kullanarak, üst mikrokanalın çıkış deliğinden 20 μL ECM karışımı verin.
- Üst mikro kanalın çıkış borusunu yeniden takın.
- Çipi, PEI ve GA ile muamele edilmiş PDMS membranı üzerinde ECM katmanını oluşturmak için 1 saat boyunca 37 °C'de %5 CO 2 içeren nemlendirilmiş bir CO2 inkübatöre yerleştirin (Şekil 3A).
NOT: Tüm boruların cl olduğundan emin olun.amp inkübasyon sırasında. - ECM kaplamasının inkübasyonu sırasında, daha önce insan organoidlerinden türetilen Gut-on-a-Chip 2'de bildirildiği gibi, A8301'den yoksun ancak 10 μM Y-27632 ve2.5 μM CHIR99021 içeren organoid kültür ortamı olan soğuk tohumlama ortamı içeren iki adet 1 mL şırınga hazırlayın.
NOT: A8301, daha önce bildirildiği gibi hücrelerin kaplanmış ECM'ye bağlanmasını geliştirmek için ortamdan çıkarılmıştır2. Gut-on-a-Chip kültürünün 0. günü yalnızca üst mikrokanal akışı gerektirir. Bu nedenle, üst kanal için tam bir şırınga hazırlayın, alt kanal için minimum 0,2 mL hazırlayın. - ECM kaplaması tamamlandıktan sonra, Çipi inkübatörden çıkarın ve cl'yi serbest bırakınamp alt mikro kanala bağlı baypas borusuna.
- Tohumlama ortamıyla dolu 1 mL'lik bir şırıngayı, Gut-on-a-Chip'in alt mikro kanalına bağlı olan künt uçlu iğneye bağlayın. Tohumlama ortamını (~50 μL) baypas borusuna dikkatlice yerleştirin. Boru sokulan ortamla doldurulduktan sonra, alt mikro kanala bağlı baypas borusunu bir bağlayıcı klipsle sabitleyin.
- cl'yi serbest bırakınamp alt mikro kanala bağlı çıkış borusunun. Tohumlama ortamını dikkatlice alt mikro kanala sokun ve sistemden sorunsuz bir şekilde akmasını sağlayın. Perfüzyondan sonra alt mikro kanala bağlı çıkış borusunu bir bağlayıcı klipsle sabitleyin.
- Ardından, üst mikro kanala bağlı baypas borusunu açın.
- Tohumlama ortamıyla dolu 1 mL'lik bir şırıngayı, Gut-on-a-Chip'in üst mikro kanalına bağlı olan künt uçlu iğneye bağlayın. Tohumlama ortamını (~50 μL) baypas borusuna dikkatlice yerleştirin. Boru sokulan ortamla doldurulduktan sonra, üst mikro kanala bağlı baypas borusunu bir bağlayıcı klipsle sabitleyin.
- Alt mikro kanala bağlı çıkış borusunu serbest bırakın. Tohumlama ortamını dikkatlice üst mikro kanala sokun ve sistemden düzgün bir şekilde akmasını sağlayın. Perfüzyondan sonra üst mikrokanala bağlı çıkış borusunu bir bağlayıcı klipsle sabitleyin.
3. Tohumlama için köpek bağırsak organoid hücre hazırlığı
NOT: Çip üzerinde Bağırsak modelini oluşturmak için, bu protokolde IBD hasta köpeklerinden türetilen köpek kolon organoidleri (kolonoidler olarak adlandırılır) kullanılmıştır. Bu kolonoidler, daha önce bildirilen bir yöntem15,18 izlenerek, biyopsi yapılan kolon dokusunun üç ila beş küçük parçasından türetilmiştir. En iyi sonuçlar için, in vitro uygulamalara uygun stabil organoidler oluşturmak için en az üç kültür geçişinden geçmiş köpek kolonoidlerinin kullanılması çok önemlidir. Organoidler içindeki çok soylu hücrelerin yeterli farklılaşmasını kolaylaştırmak, fonksiyonel olgunluklarını ve Gut-on-a-Chip modelinde sonraki deneyler için uygunluklarını sağlamak için köpek kolonoidlerinin en az 3-4 günlük bir süre boyunca kültürlenmesi önerilir. Bu çalışma için pasajın maksimum sınırı, 20 ardışık pasaj25 boyunca değiştirilmemiş fenotip ve karyotipi gösteren önceki bir çalışmada belirtildiği gibi, 20'den azdır. Bu donörlerin sinyalleri Ek Tablo S1'de sunulmuştur.
- Köpek kolonoidlerini, 30 μL Matrigel 15,18 içine gömülü 24 oyuklu plakalarda, daha önce bildirilen ortam 15,26,27'den modifiye edilmiş Malzeme Tablosunda listelenen organoid kültür ortamı ile kültürleyin. Şartlandırılmış besiyeri, Noggin 28'i salgılamak üzere tasarlanmış Rspo1 hücreleri veHEK293 hücrelerinin yetiştirilmesiyle elde edildi.
- Organoid kültür ortamını vakum emme yoluyla atın ve her bir oyuğa buz gibi soğuk bir sıcaklıkta 500 μL Hücre Geri Kazanım Çözeltisi ekleyin. 4 °C'de 30 dakika inkübe edin.
NOT: Tipik olarak, 24 kuyulu bir olgun köpek bağırsak organoidi plakasından üç oyuk, x10 büyütmede 40-50 organoid / bir görüş alanına sahip tek bir Çip Üzerinde Bağırsak cihazını tohumlamak için yeterli miktarda ayrışmış hücre sağlar. - Bir P1000 mikropipet kullanarak Matrigel kubbelerini 5 saniye boyunca mekanik olarak bozun. Daha sonra, organoid süspansiyonu 15 mL'lik konik bir tüpte toplayın.
- Konik tüpü 200 × g ve 4 °C'de 5 dakika santrifüjleyin, ardından süpernatantın çıkarılması.
- Oda sıcaklığında 10 μM Y-27632 ile desteklenmiş 1 mL tripsin benzeri proteaz ekleyin ve bir P1000 mikropipet kullanarak pipetleyerek hücre peletini yeniden süspanse edin.
- Hücre süspansiyonunu 37 °C'ye ayarlanmış bir su banyosuna yerleştirin ve karışımı periyodik olarak çalkalarken 10 dakika inkübe edin.
- 5 mL ılık organoid bazal ortam ekleyin ve herhangi bir görünür hücre kümesi olmadan bulanıklaşana kadar bir P1000 mikropipet kullanarak hücre süspansiyonunu kuvvetlice pipetleyin.
- Matrigel kalıntılarını ve büyük hücre kümelerini ortadan kaldırmak için hücre süspansiyonunu 70 μm'lik bir kesikli bir hücre süzgecinden geçirin.
- Konik boruyu 200 × g ve 4 °C'de 5 dakika santrifüjleyin, ardından peletin tohumlama ortamında yeniden süspansiyonunu uygulayın. Bir köpek Çip Üzerinde Bağırsak cihazının tohumlanması için, hücre peletini yeniden süspanse etmek için 20 μL tohumlama ortamı kullanın (yani, bir Çip Üzerinde Bağırsak cihazını tohumlarken 20 μL tohumlama ortamı kullanın).
- Canlı hücrelerin konsantrasyonunu, daha önce bildirildiği gibi tohumlama ortamı ile 1 × 107 hücre / mL'ye değiştirin2. 10 μL hücre süspansiyonunu 10 μL Tripan mavisi ile birleştirerek bir hemositometre kullanarak canlılık değerlendirmesi yapın ve ardından hücreleri mikroskop altında gözlemleyin.
NOT: Optimum hücre bağlanmasını ve çip zarı üzerinde tek tip bir tek tabaka oluşumunu sağlamak için hücre konsantrasyonunu uygun şekilde ayarlamak çok önemlidir. İlk hücre sayısı yetersizse, birleşik bir tek tabakanın gecikmeli veya başarısız bir şekilde kurulmasına neden olabilir. Tersine, hücre sayısı fazlaysa, yapışık olmayan hücreler kanal içinde kümeler halinde toplanabilir ve bu da istenmeyen konsantrasyon etkilerine yol açabilir.
4. 2D hücre tek tabakasının tohumlanması ve oluşumu
- Üst mikro kanalın çıkış borusunu ayırın. Üst mikro kanalın baypas borusunun açık kaldığından emin olun. Alt mikro kanalın hem girişini hem de çıkışını, cl için bağlayıcı klipsler kullanarak sabitleyin.amp bunlar.
- Bir P100 veya P20 mikropipet kullanarak, Protokol 3'ten 20 μL hücre süspansiyonunu üst mikrokanalın çıkış deliğine sokun (Şekil 3B Tohumlama).
- Üst mikro kanalın baypas ve giriş borusunu cl kullanarak sabitleyin.amp için. Ardından, çıkış borusunu üst mikro kanalın çıkış deliğine yeniden takın ve üst mikro kanala herhangi bir basınç uygulanmasını önlemek için borunun işlem boyunca açık kalmasını sağlayın. Bu adımdan sonra, üst kanalın çıkış borusunu kelepçelemek için bir bağlayıcı klips kullanarak yavaşça sabitleyin.
- Hücrelerin üst mikrokanal boyunca eşit olarak dağıldığını bir mikroskop kullanarak doğrulayın.
NOT: İstenen hücre bağlantısı tamamlanana kadar kararlı statik koşullara izin vermek için ortamın kanal içindeki hareketini durdurmak için boruyu kelepçelemek önemlidir. - Çipi 37 °C'de nemlendirilmiş bir CO2 inkübatöre yerleştirin.
NOT: Köpek bağırsak organoid hücrelerinin ECM kaplamasına yapışması yaklaşık 3 saat sürer (Şekil 3B Eki). - Gut-on-a-Chip'in üst mikro kanalına bağlı şırıngayı bir CO2 inkübatörü içine yerleştirilmiş bir şırınga pompasına bağlayın.
NOT: Şırınga pompasının düğmesini kullanarak ortamı dikkatlice mikrokanala yıkayın ve bağlanmamış hücreleri çıkarın. Bağlanmamış hücrelerin etkili bir şekilde yıkandığından emin olmak için çipi mikroskop altında inceleyin. - Tohumlama ortamı ile 30 μL / s'de kültür ortamının akışını başlatın. Bu sürekli akış, başlangıçta bir Gut-on-a-Chip üzerinde 2D tek katmanlı kuruluma kadar yalnızca üst mikro kanal içindir. Alt mikro kanal için, mikro kanalları kenetlenmiş ve ortamı yıkamadan bırakın.
- Hücrelerin tohumlanmasından sonraki günden itibaren, kültür ortamını, tohumlama ortamından A8301 içeren ve 10 μM Y-27632 ve 2.5 μM CHIR99021 içermeyen organoid kültür ortamına değiştirin.
- Tek katman oluşturulduktan sonra, alt mikro kanala da sürekli ortam akışını başlatın. Köpek bağırsak organoid epitel hücrelerinin epitelyal tek tabakalar oluşturması genellikle 2 ila 3 gün sürer (Şekil 3C).
5. Köpek Gut-on-a-Chip'te 3D morfogenezin kurulması
NOT: Gut-on-a-Chip'te birleşik tek tabakalar oluşturulduktan sonra, Şekil 2'de gösterildiği gibi 3D morfogenezi 2D tek tabakaya başlatmak için hem üst kanalın hem de alt kanalın ve hücre suşunun orta akışı sokuldu.
- Bir Gut-on-a-Chip sisteminde 3D morfogenezin gelişimini başlatmak için organoid kültür ortamını hem üst hem de alt mikrokanallara sokun. Mevcut Gut-on-a-Chip tasarımında (yani 500 μm yüksekliğindeki mikrokanal) 0,02 dyne/cm2'lik kesme gerilimi elde etmek için akış hızını 50 μL/sa29'a yükseltin.
- İn vitro kültürlenmiş hücrelere döngüsel suş uygulayan bilgisayar tarafından düzenlenen bir biyoreaktör kullanarak, 10'den önce önerildiği gibi hücre suşunun %0.15'unu ve 2 Hz frekansı başlatın. Bu işlem, Gut-on-a-Chip cihazına vakum emişi uygulayacaktır.
- Bu kültür koşullarını en az 2 ila 3 gün sürdürün. Köpek bağırsak tek tabakasının 3D morfogenezi genellikle Dural kanal akışı ve vakum emişi başlatıldıktan 2 ila 3 gün sonra ortaya çıkar (Şekil 3C).
6. Köpek Gut-on-a-Chip'in karakterizasyonu
- Canlı hücre görüntüleme
- Şırınga pompasını kullanarak ortamı hafifçe akıtarak Gut-on-a-Chip'teki hava kabarcıklarını giderin.
- Gut-on-a-Chip cihazını şırınga pompasından ayırın.
NOT: Çip Üzerinde Bağırsak içinde basınç uygulayabilecek herhangi bir manevradan kaçının. - Yerleşik 3D epitelin görüntülerini yakalamak için cihazı bir mikroskop üzerine yerleştirin. Faz kontrastı kullanarak 3B epitel katmanlarının yapısını görselleştirmek için 10x ve 20x objektifler kullanın (Şekil 3C).
- İmmünofloresan boyama
- % 2 BSA yapmak için 1 g BSA'yı 50 mL Fosfat tampon salin (PBS) içinde çözerek bloke edici çözeltiyi hazırlayın. Çözeltiyi filtrasyon için 0,2 μm'lik bir şırınga filtresinden geçirin. Bu çözeltiyi 4 °C'de saklayın.
- 150 μL Triton X-100'ü 50 mL bloke edici çözelti ile birleştirerek geçirgenleştirici çözeltiyi hazırlayın, bu da %0.3'lük bir nihai konsantrasyon elde edilmesini sağlar. Çözeltiyi filtrasyon için 0,2 μm'lik bir şırınga filtresinden geçirin. Bu çözeltiyi 4 °C'de saklayın.
- Adım 2.4-2.11'de açıklandığı gibi hem üst hem de alt mikro kanallara 100 μL% 4 PFA enjekte ederek hücrelerin fiksasyonunu gerçekleştirin.
- Adım 2.4-2.11'de açıklandığı gibi hem üst hem de alt mikro kanallara 100 μL PBS enjekte ederek hücreleri durulayın.
- Adım 2.4-2.11'de açıklandığı gibi hem üst hem de alt mikrokanallara 100 μL% 0.3 Triton enjekte ederek hücrelerin geçirgenliğini gerçekleştirin. Cihazı 30 dakika boyunca RT'ye yerleştirin.
- Adım 2.4-2.11'de açıklandığı gibi hem üst hem de alt mikro kanallara 100 μL PBS enjekte ederek hücreleri durulayın.
- Adım 2.4-2.11'de açıklandığı gibi hem üst hem de alt mikro kanallara 100 μL% 2 BSA enjekte ederek spesifik olmayan bağlanmayı önlemek için hücrelerin bloke edilmesini sağlayın. Cihazı 1 saat boyunca RT'ye yerleştirin.
- % 2 BSA içinde seyreltilmiş 20 μL primer antikor çözeltisi enjekte edin ve 3 saat boyunca RT'ye yerleştirin, ardından 4 ° C'de gece boyunca inkübasyon yapın.
NOT: Tüm boruların cl olduğundan emin olun.ampgece boyunca 4 ° C'de inkübasyon sırasında. Bir primer antikorun konsantrasyonu, tek tabakalı veya 3D organoid boyama için önerilen konsantrasyondan 2-5 kat daha yüksek olmalıdır (Ek Şekil S1). - Adım 2.4-2.11'de açıklandığı gibi hem üst hem de alt mikrokanallara 100 μL PBS enjekte ederek hücreleri durulayın.
- % 2 BSA içinde seyreltilmiş 20 μL ikincil antikor çözeltisi enjekte edin ve 1 saat boyunca RT'ye yerleştirin.
NOT: Tüm boruların cl olduğundan emin olun.amp inkübasyon sırasında. Bu adımdan başlayarak, foto ağartmayı önlemek için cihaz kurulumunu alüminyum folyo ile korumak gerekir. - Adım 2.4-2.11'de açıklandığı gibi hem üst hem de alt mikrokanallara 100 μL PBS enjekte ederek hücreleri durulayın.
- F-aktin ve DAPI (diamidino-2-fenilindol) karşı boyama için kombine bir çözelti hazırlayın. 20-2.4-2.11 adımlarında açıklandığı gibi hem üst hem de alt mikro kanallara 20 μL kombine çözelti enjekte edin.
- Adım 2.4-2.11'de açıklandığı gibi hem üst hem de alt mikro kanallara 100 μL PBS enjekte ederek hücreleri durulayın.
Bir floresan mikroskobu veya konfokal mikroskop kullanarak 3D epitel hücrelerinin mimarisinin floresan görüntülemesini gerçekleştirin.
7. Epitelyal bariyer fonksiyonu
- Şırınga pompasını kullanarak ortamı hafifçe akıtarak Gut-on-a-Chip'teki hava kabarcıklarını giderin. Ölçüm sırasında tüm boruların açık olduğundan emin olun.
- Gut-on-a-Chip'i şırınga pompasından çıkarın ve en az 10 dakika RT'ye yerleştirin.
- Ag / AgCl elektrotlarını% 70 EtOH çözeltisinden çıkarın.
- Bir multimetre kullanarak epitel tabakasının direncini ölçmek için sırasıyla üst girişe ve alt çıkışa iki Ag / AgCl elektrotu yerleştirin.
- Sırasıyla alt girişe ve üst çıkışa iki Ag/AgCl elektrodu yerleştirin. Bu iki değerin ortalamasını Gut-on-a-Chip için bir direnç değeri olarak bildirin.
NOT: Boş TEER, epitel olmadan yalnızca ECM kaplamalı bir Çip üzerinde Gut-on-a-Chip üzerinde ölçülmelidir. - Transepitelyal elektrik direncinin hesaplanması (TEER) değeri (kΩ ×cm2) denklem (1) kullanılarak hesaplanabilir.
TEER = (Ωt - Ωboş) × A (1)
Ωt , deneyin başlangıcından bu yana belirli bir zaman noktasında ölçülen bir direnç değeridir, Ωboşluk , epitel olmadan ölçülen bir direnç değeridir ve A, bir hücre tabakası tarafından kaplanan yüzeyin alanıdır (bu Gut-on-a-Chip tasarımı için yaklaşık 0.11cm2 29).- Denklem (2)'yi kullanarak normalleştirilmiş TEER'i hesaplayın.
TEER =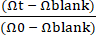 (2)
(2)
BuradaΩ 0 , daha önce30 bildirildiği gibi deneyin ilk okuma zaman noktasında bir direnç değeridir (Şekil 4C).
- Denklem (2)'yi kullanarak normalleştirilmiş TEER'i hesaplayın.
Sonuçlar
Bu protokol, bir Çip Üzerinde Bağırsak sisteminde 3D bağırsak morfogenezinin spontan gelişimini güvenilir bir şekilde kolaylaştırır. Bu yaklaşım, inflamatuar bağırsak hastalığından (IBD) etkilenen köpeklerden elde edilen bağırsak organoidlerinden elde edilen köpek bağırsak epitel hücrelerini kullanır (Şekil 1B). Köpek bağırsak epitel hücrelerinin 3D morfogenezinin ara sıra kümelenmesi, 6-9 günlük orta akışı takiben mikrokanal boyunca gözlenebilir (Şekil 3C). Bu morfolojik değişiklikler faz kontrast teknikleri kullanılarak izlenebilir. Bu çalışmada, İBH tanısı konan iki köpekten elde edilen organoidler kullanıldı. Özellikle, her biri iki teknik kopya ile gerçekleştirilen iki biyolojik kopyada başarılı 3D morfogenez gözlendi. Bu çalışmadan elde edilen bulgular, diğer köpek donörlerinden elde edilen bağırsak organoidlerini içeren gelecekteki araştırmalar için bir temel oluşturmaktadır. Bu sonuçlar, daha önce insan örneklerinde rapor edilmiş olan deneysel yaklaşımımızın potansiyel uygulanabilirliğini ve tekrarlanabilirliğini göstermektedir. Bu bulgular, Çip Üzerinde Bağırsak teknolojisinin, insan bağırsak epitel hücrelerini kullanan çalışmalarda daha önce bildirildiği gibi köpek bağırsak epitel hücrelerine uygulanabilir olduğuna dair daha fazla doğrulama sağlar2.
Bu protokol, immünofloresan boyamanın, geleneksel floresan mikroskobu kullanılarak mikroakışkan çiplerde villus benzeri yapılar oluşturan organoid türevli tek tabakaların 3 boyutlu yapısını değerlendirmek için kullanılabileceğini göstermiştir (Şekil 4 A,B). Bu protokol, immünofloresan boyama yoluyla farklılaşmış ve uzamsal olarak organize edilmiş hücresel fenotipleri doğrulamak için uyarlanabilir. Bir Çip üzerinde Bağırsak içindeki bir 3D morfogenezin görselleştirilmesi, çeşitli patolojik etkileşimler sırasında konakçı yanıtını araştırmak için mükemmel bir fırsat sağlar 14,23,31. Daha önce insanlarda tarif edildiği gibi, hasta donörlerinden elde edilen epitel hücreleri ile birleştirildiğinde, bu teknoloji bağırsak hastalıklarının kişiselleştirilmiş modellerini oluşturmak için kullanılabilir13. İmmünofloresan görüntülemenin floresan in situ hibridizasyon gibi hedeflenen RNA görselleştirme teknikleriyle entegrasyonu sayesinde, bir Gut-on-a-Chip sistemi içinde konakçının transkriptomlarını ve proteomlarını görsel olarak analiz etmek mümkün olabilir.
Bağırsak zarının bütünlüğünün korunması, bağırsak homeostazının sürdürülmesi için hayati önem taşır ve Gut-on-a-Chip platformu, bu önemli işlevin hassas bir şekilde izlenmesine ve ölçülmesine izin vererek değerli bir avantaj sağlar. Gut-on-a-Chip teknolojisi kullanılarak TEER ölçümü çeşitli avantajlar sunar. Örneğin, önceki çalışmalar, bağırsak hücrelerini patojenik olmayan ve probiyotik bakterilerle birlikte kültürlerken TEER'i başarılı bir şekilde değerlendirmiştir32 ve ayrıca sızdıran bağırsak koşullarıaltında 23. Bu, araştırmacıların farklı koşulların bağırsak bariyer fonksiyonu üzerindeki etkisini incelemelerine ve bağırsak sağlığını geliştirmek için potansiyel müdahaleleri belirlemelerine olanak tanır.
Şekil 1: Hasta kaynaklı köpek IBD Gut-on-a-Chip'in kurulması. (A) Hastadan türetilen bağırsak organoidlerinin ve Gut-on-a-Chip platformunun entegrasyonu. Donöre özgü bağırsak organoidleri geliştirmek için bağırsak kript hücrelerini izole etmek için endoskopi biyopsisi yapılabilir. Epitel hücreleri, organoidlerden tek hücrelere ayrılabilir, daha sonra PDMS tabanlı bir Çip Üzerinde Gut-on-A-Chip'e tohumlanabilir ve benzersiz bir dinamik mikro ortamda kültürlenebilir. (B) Bir IBD köpeğinden alınan kolonoidlerin temsili görüntüleri. Ölçek çubuğu = 100 μm. (C) Bu şema, üst ve alt mikro kanallar arasına yerleştirilmiş gözenekli bir zardan oluşan bir Çip Üzerinde Bağırsak cihazını göstermektedir. Üst mikro kanal mavi alanla, alt mikro kanal ise kırmızı alanla gösterilir. Mikrokanalın her iki tarafında, peristaltik hareketi taklit etmek için gözenekli zarı deforme edenvakum odaları bulunur 24. (D) Bir köpek Çip Üzerinde Bağırsak kurulumu, bir kapak fişi 2,24 üzerine yerleştirilmiş boru ile monte edilmiş PDMS tabanlı bir Çip Üzerinde Bağırsak içerir. Baypas hortumu, taşıma sırasında (yani şırıngalara bağlanma) mikrokanal içinde basınç oluşmasını önlemek için kritik öneme sahiptir. Boruyu sıkıştırmak için bağlayıcı klipsler kullanılır. Hacme duyarlı malzemeler, üst veya alt çıkışın açık deliklerinden infüze edilebilir. Organoid kültür ortamı, şırıngaların kör uçlu iğnelere ve üst ve alt girişten akışa bağlanmasıyla infüze edilebilir. Kısaltmalar: IBD = inflamatuar bağırsak hastalığı; PDMS = polidimetilsiloksan. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
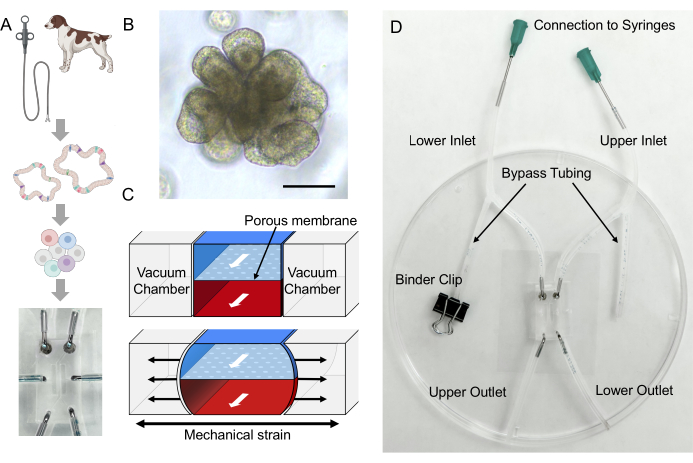
Şekil 2: Köpek IBD Gut-on-a-Chip'te villus benzeri yapıların oluşumu. Ayrışmış epitel hücreleri, ECM kaplı bir Çip Üzerinde Gut-on-A-Chip'e ekildi. Ayrışan hücreler PDMS membranına bağlandıktan sonra 3 gün boyunca apikal akış başlatıldı (D0-D3). Birleşen bir 2D tek tabaka oluştuğunda (D3), sık esneme ile bazolateral akış başlatılır (Germe, AP ve BL Akışı). 2-3 günlük ikili akış ve membran gerilmesinden sonra, 2D tek tabaka 3D morfogenez geliştirmeye başlar ve 9 günlük kültürden sonra villus benzeri yapılar oluşur (3D morfogenez, D9-D12). Kısaltmalar: ECM = hücre dışı matris; PDMS = polidimetilsiloksan; AP = apikal; BL = bazolateral. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
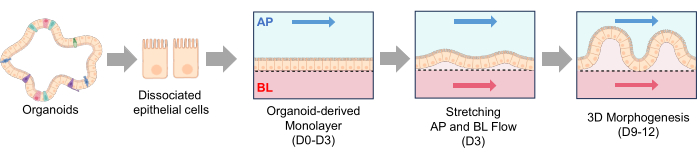
Şekil 3: Çip üzerinde Bağırsakta köpek bağırsak organoid tohumlaması ve 3D morfogenez . (A) PDMS tabanlı bir Gut-on-a-Chip'te gözenekli bir zarın yüzey aktivasyonu için deneysel adımlar. UV/Ozon tedavisi, PEI ve GA işleminin birlikte kullanılması, ECM çözeltilerinde bulunan aminlerin çapraz bağlanmasını kolaylaştırır. Bu işlem, ECM proteinlerinin gözenekli membran üzerinde stabil bir şekilde hareketsiz hale getirilmesine yol açar. (B) Faz kontrast görüntüleri, tohumlamadan hemen sonra (solda) ve tohumlamadan 3-5 saat sonra (sağda) hücrelerin morfolojilerini gösterir. 3 saatlik tohumlamadan sonra gözenekli zar, tek hücrelerin bağlandığı daha ince ve daha koyu alanlar göstererek bağlanma sürecini vurgular. (C) Faz kontrast görüntüleri, bir Çip Üzerinde Bağırsak sistemi içindeki bağırsak tek katmanlarının 3D morfogenezini gösterir. Bu tek tabakalar, IBD'den etkilenen köpeklerden türetilmiştir ve bu organoid hücreler, sıvı akışı ve gerilme hareketlerini içeren dinamik koşullar altında 12 günlük bir süre boyunca kültürlenmiştir. Ölçek çubukları = 50 μm (B,C). Kısaltmalar: IBD = inflamatuar bağırsak hastalığı; ECM = hücre dışı matris; PDMS = polidimetilsiloksan; PEI = polietilenimin; GA = glutaraldehit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
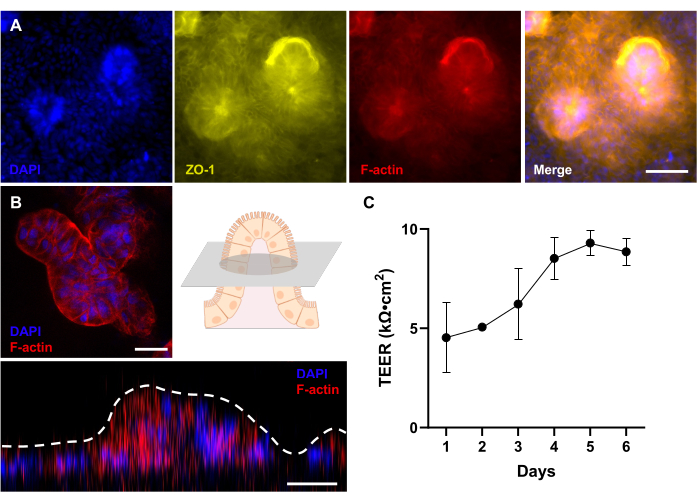
Şekil 4: Hasta kaynaklı köpek Gut-on-a-Chip'te 3D morfolojik gelişimin değerlendirilmesi. (A) Bir floresan mikroskobu ile değerlendirilen, 12 günlük kültürden sonra tam gelişmiş bir 3D epitelin yukarıdan aşağıya bir görünümünü sergileyen bir köpek IBD Gut-on-a-Chip'in immünofloresan görüntülemesi. Sıkı bağlantı proteini (ZO-1) sarı renkte görselleştirilir; fırça kenarlığı zarı (F-aktin) kırmızı renkte görünür; ve çekirdekler DAPI ile boyanır ve mavi görünür. (B) Uzun mesafeli lensli konfokal mikroskop kullanılarak bir köpek IBD Çip üzerinde Gut-on-a-Chip'in immünofloresan görüntülemesi. Şemada gösterildiği gibi, 12 günlük kültürden sonra tam gelişmiş bir 3D epitelin villus benzeri bir yapısının enine kesitinin floresan görüntüsü gösterilmektedir. Ek olarak, Z-istifleme, villus benzeri yapıların oluşumunu ortaya çıkaran 3D epitelin yandan görünümünü gösterir. Fırça kenarlığı zarı (F-aktin) kırmızı renkte görünür ve çekirdekler DAPI ile boyanır ve mavi görünür. (C) Bağırsak bariyer fonksiyonu, hastadan türetilen köpek Gut-on-a-Chips'te TEER ile değerlendirildi ve ölçüldü. Gut-on-a-Chip'te kültürün 5. gününde stabil TEER değerlerine ulaşıldı. Hata çubukları, ölçümlerin SEM'ini ifade eder. TEER değeri, bir teknik kopya ile iki biyolojik kopya arasında ölçüldü. Ölçek çubukları = 50 μm (A), 25 μm (B). Kısaltmalar: IBD = inflamatuar bağırsak hastalığı; DAPI = 4',6-diamidino-2-fenilindol; TEER = transepitelyal elektrik direnci. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil S1: Köpek kolonoid türevli tek katmanlarda ve Gut-on-a-Chip cihazlarında anti-ZO-1 poliklonal antikorun karakterizasyonu. (A) ZO-1'in kırmızı F-aktin ile sarı renkte immünofloresan boyanması ve bindirme görüntüleri. Ölçek çubuğu = 25 μm. (B) 'Sızdıran Bağırsak Cipslerinde' sarı renkte ZO-1'in immünofloresan görselleştirmesi, probiyotik bakterilerle stimülasyon (LGG + Sitokinler veya VSL # 3 + Sitokinler) ve probiyotik stimülasyon olmadan mikropsuz kontroller (Sitokinler) dahil olmak üzere çeşitli koşullar altında gerçekleştirildi. Ölçek çubuğu = 50 μm. Bu rakam Min ve ark.23'ten alınmıştır. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo S1: Doku bağışçılarının bilgilerinin bir özeti. Donörlerin yaşı, cinsiyeti, cinsi, histopatolojik değerlendirmesi ve köpek IBD aktivite indeksi (CIBDAI) skorunun özet tablosu. CIBDAI, köpek IBD33'te klinik şiddeti anlamak için kullanılan sayısal bir puanlama sistemidir. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışma, köpek bağırsak organoidlerinin bir köpek IBD Çip Üzerinde Bağırsak modelinin geliştirilmesiyle uyumluluğunun öncü gösterimini işaret etmektedir. Bağırsak organoidlerinin ve organoid türevli tek tabakalı kültürlerin bir mikroakışkan sisteme (yani, Çip Üzerinde Bağırsak sistemi) entegrasyonu, fizyolojik dinamikleri yakından taklit eden ve biyolojik koşulları daha iyi temsil eden in vitro bağırsak modellerinin oluşturulmasını sağlayan teknolojiyi daha da geliştirmiştir. Özellikle, insanlarda IBD'den türetilmiş organoidleri kullanan Çip Üzerinde Bağırsak kültürüne ilişkin çok az rapor bulunduğundan, köpek IBD'sinden türetilen Çip Üzerinde Bağırsak kullanan mevcut çalışma, insanlarda IBD çalışmasına ilişkin öncü bilgiler sağlayabilir.
Bir Çip Üzerinde Bağırsak üzerinde köpek bağırsak epitelyal 3D morfogenezinin başarılı bir şekilde geliştirilmesi, birkaç kritik adıma dikkat edilmesini gerektirir. İlk olarak, PDMS mikroakışkan kanallarının hidrofobik yüzeyi, ECM adezyonunu ve müteakip hücre bağlanmasını engelleyebilir, bu da ECM kaplaması ve hücre tohumlamasından önce PDMS'nin yüzey aktivasyonunu gerektirebilir (bkz. protokol bölüm 1). Stabil bir tek tabakalı kültür elde etmek için, hücre bağlanmasını takiben fazla bağlanmamış hücrelerin çıkarılması çok önemlidir (protokol adımları 4.6-4.7). Ek olarak, bağırsak epitelinin 3D morfogenezi için sabit ortam akışı ve peristaltik benzeri vakum hareketi gibi dinamik stimülasyon gereklidir (protokol adımı 5.2). Gut-on-a-Chip kültürünün herhangi bir adımında mikrokanaldaki hava kabarcıklarını önlemek için dikkatli kullanım şarttır.
Çip Üzerinde Bağırsak'a zayıf hücre tohumlaması ile karşılaşırsanız, bunun nedeni düşük hücre sayısı veya zayıf hücre bağlantısı olabilir. Düşük hücre sayılarını gidermek için, Matrigel'deki büyümelerini gözlemleyerek hazırlanmış bağırsak organoidlerinin sağlığını incelemek önemlidir. Hücre canlılığı, hücrelerin %20'sinden fazlasının ölmediğinden emin olmak için hücre ayrışmasından sonra Tripan mavisi boyama ile değerlendirilebilir. Canlı hücre sayıları yetersizse, organoid ortam koşullarının optimize edilmesi denenebilir. Diğer bir olasılık, eksik organoid ayrışmadır, bu da filtre tarafından sıkışan 70 μm'den daha büyük hücre kümelerinin fazlalığına neden olur. Bu sorunu çözmek için seçeneklerden biri, hücre ayrışması sırasında pipetleme süresini uzatmaktır. Alternatif olarak, 15 mL'lik konik tüp, tripsin benzeri bir proteaz ile tedavi edilirken her dakika hafifçe çalkalanabilir. Gut-on-a-Chip'e zayıf hücre bağlanması, uygun olmayan ECM kaplamasından kaynaklanıyor olabilir. Kaplama işlemi sırasında, hava kabarcıklarının varlığının dikkatlice kontrol edilmesi ve gerektiğinde nazikçe daha fazla kaplama çözeltisi eklenerek oluşumlarının önlenmesi tavsiye edilir. Hücrelerin aşırı kalabalıklaşması ve bağlanmamış hücrelerin yıkanamaması, yetersiz bir başlangıç tek katmanına neden olabilir. Böyle bir durumda, şırınga pistonunu iterken hafif bir darbe uygulanabilir. Bu sorun giderme adımları, Gut-on-a-Chip kültürü işlemi sırasındaki sorunları tanımlamaya ve gidermeye yardımcı olabilir.
Bu Çip Üzerinde Bağırsak platformu, dalgalı 3D epitel katmanlarının oluşturulmasını sağlarken, bağırsak mikro ortamını tam olarak çoğaltmak için ek biyolojik karmaşıklığa ihtiyaç duyulduğunun farkındayız. Epitelyal ve mezenkimal hücreler arasındaki etkileşimleri, 3D rejenerasyon için ECM birikimini ve uygun bir kök hücre nişi oluşturan kript-villus özelliklerinin varlığını dikkate almak çok önemlidir. Fibroblastlar gibi stromal hücreler, ECM proteinlerinin üretiminde ve bağırsak morfogenezinin düzenlenmesinde hayati bir rol oynar34,35,36. Mezenkimal hücrelerin bu modele dahil edilmesi, hem morfogenezi hem de hücre bağlanmasının verimliliğini artırma potansiyeline sahiptir. Kılcal damar sistemini ve lenfatik damarları kapsayan endotel tabakaları, moleküler taşımayı ve bağışıklık hücrelerinin işe alımını yönetmede çok önemli bir rol oynar37,38. Hasta kaynaklı bağışıklık hücrelerinin dahil edilmesi, doğuştan gelen ve adaptif bağışıklık arasındaki etkileşimin gösterilmesine ve dokuya özgü bağışıklığın kurulmasına izin verdiği için bağırsak hastalıklarının modellenmesinde gerekli olabilir39. Gut-on-a-Chip'te 3D morfogenezin tamamlanmasının ardından, organoid kültür ortamı bir organoid farklılaşma ortamına değiştirilebilir. Bu, deneysel hedeflere bağlı olarak ek hücresel farklılaşmayı indüklemek için uygun bir yaklaşım olabilir.
3D mikro mimariyi yerinde görüntülemek, uzun mesafeli bir hedefle üstesinden gelinebilecek uzun çalışma mesafesi nedeniyle zordur. Ek olarak, katman katman mikrofabrikasyon ve yapıştırma yöntemleri, SEM ile inceleme için üst katmanlara erişimi zorlaştırmaktadır. Mevcut Gut-on-a-Chip tasarımı için, Gut-on-a-Chip mikro cihazı başına bir şırınga pompasına ihtiyaç vardır, bu da CO2 inkübatör alanını kaplar ve büyük ölçekli deneyleri önler. Kullanıcı dostu bir platform ve yüksek verimli tarama için ölçeklenebilirliği artırmak için yeniliklere ihtiyaç vardır.
Bu mevcut protokoller, geleneksel 3D organoidlerin, 2D tek tabakaların ve statik mikrocihaz kültür sistemlerinin sınırlamalarını aşarak, in vitro olarak 3D epitel katmanlarının kendiliğinden gelişmesine izin verir. Bu dinamik in vitro bağırsak mikroçevresi, çeşitli hücre tiplerinin ko-kültürü eklenerek kontrol edilebilir. Önceki çalışmalar, bağırsak mikrobiyomunun14,23 ve periferik mononükleer hücrelerin30 birlikte kültürlenmesi de dahil olmak üzere Çip Üzerinde Bağırsak mikro ortamını manipüle etme yöntemlerini araştırmıştır. Bu yeniden yapılandırılmış mikro çevre, ilaç testi, temel mekanik çalışmalar ve hastalık modellemesi dahil olmak üzere çok sayıda potansiyel uygulamaya sahiptir. Yeniden yapılandırılmış mikro çevre, ilaç testi 23,40,41 ve hastalık modellemesi 12,13,14,30 gibi çok çeşitli uygulamalar için önemli bir potansiyele sahiptir ve ayrıca bağırsak morfogenezinin temel mekanik araştırmaları 42. Metabolitlerin değerlendirilmesi için süpernatanlar toplanarak 43, genomik inceleme için hücreler toplanarak 2,32 veya canlı hücre boyaları kullanılarak hücrelerin görsel olarak incelenmesi veya sonraki immünofloresan görüntülemeiçin fiksasyon23,44 ile çeşitli testler yapılabilir.
Bu çalışma, bir Gut-on-a-Chip platformunda köpek bağırsak epitel katmanlarının 3D morfogenezini geliştirmek için tekrarlanabilir bir protokol sunmaktadır. Ortaya çıkan 3D epitel yapısı, çeşitli biyomedikal çalışmalarda uygulamalar için muazzam bir potansiyele sahip olan bağırsak mikro ortamının daha gerçekçi bir temsilini sağlar. Bu bağırsak mimarisini kullanarak, daha fazla translasyonel araştırma yapabilir ve potansiyel olarak umut verici sonuçlar verebiliriz.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
WSU Küçük Hayvan İç Hastalıkları servisine (Dr. Jillian Haines, Dr. Sarah Guess, Shelley Ensign LVT) ve WSU VTH Klinik Çalışmalar Koordinatörü Valorie Wiss'e vaka alımı ve vatandaş bilim adamlarından (hasta bağışçıları) numune toplama konusundaki destekleri için teşekkür ederiz. Bu çalışma kısmen Direktörlük Ofisi, Ulusal Sağlık Enstitüleri (K01OD030515 ve Y.M.A.'ya R21OD031903) ve Japonya Genç Araştırmacılar için Denizaşırı Bilim Mücadele Programını Teşvik Derneği (202280196'den I.N.'ye) tarafından desteklenmiştir. Şekil 1A ve Şekil 3A , BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Organoid basal medium | |||
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| GlutaMAX | Gibco | 35050-061 | 2 mM, glutamine substitute |
| 1 M HEPES | VWR Life Science | J848-500ML | 10 mM |
| 100x penicillin–streptomycin | Corning | MT30009CI | 1x |
| Organoids and organoid medium | |||
| A-83-01 | PeproTech | 9094360 | 500 nM |
| B27 supplement | Gibco | 17504-044 | 1x |
| CHIR99021 | Reprocell | 04-0004-base | 2.5 µM |
| HEK293 cells engineered to secrete Noggin | Baylor College of Medicine | ||
| Murine EGF | PeproTech | 315-09-1MG | 50 ng/mL |
| Murine Wnt-3a | PeproTech | 315-20-10UG | 100 ng/mL |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | 1 mM |
| N2 MAX Media supplement | Gibco | 17502-048 | 1x |
| Nicotinamide | Sigma | N0636-100G | 10 mM |
| Noggin Conditioned Medium | NA | NA | 10% vol/vol |
| Primocin | InvivoGen | ant-pm-1 | 100 µg/ml |
| R-spondin1 (Rspo1) cells | Trevigen | 3710-001-01 | Rspo1 cells |
| R-Spondin-1 Conditioned Medium | NA | NA | 20% vol/vol |
| SB202190 | Sigma-Aldrich | S7067-25MG | 10 µM |
| Y-27632 | StemCellTechnologies | 72308 | 10 µM |
| [Leu15 ]-Gastrin I human | Sigma-Aldrich | G9145-.5MG | 10 nM |
| Reagents | |||
| 4% Paraformaldehyde solution | Fisher Scientific | AAJ19943K2 | |
| Alexa Fluor 647 Phalloidin | Thermo Fisher Scientific | A22287 | x250 dilution |
| Anti-Rabbit IgG H&L labeled with Alexa Fluor 555 | Abcam | ab150078 | x1,000 dilution |
| Anti-ZO-1 polyclonal antibody | Thermo Fisher Scientific | 61-7300 | x50 dilution |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen I, Rat Tail 3 mg/mL | Gibco | A10483-01 | |
| Diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | 62248 | x1,000 dilution |
| EMS Glutaraldehyde Aqueous 50% | Electron Microscopy Sciences | 16320 | |
| Matrigel Matrix | Corning | 356255 | |
| Poly(ethyleneimine) solution | Sigma | 408700-250ML | |
| TrypLE Express | Gibco | 12604-021 | |
| Materials and Equipment | |||
| 24-well culture plates | Corning | 3524 | |
| 87V Industrial Multimeter | Fluke Corporation | ||
| Centrifuge | Eppendorf | 5910R | |
| CO2 incubator | Eppendorf | C170i | |
| DMi8 fluorescence microscope | Leica microsystems | DMi8 | |
| Dry oven | Fisher Scientific | 15-103-0519 | |
| FlexCell FX-5000 Tension system | Flexcell International Corporation | ||
| Inverted phase-contrast microscope | Leica microsystems | DMi1 | |
| SP8-X inverted confocal microscope | Leica microsystems | SP8-X | |
| Syringe pump | Braintree Scientific | model no. BS-8000 120V | |
| Syringe, 3 mL sterile | BD Biosciences | 14-823-435 | |
| Syringes, 1 mL sterile | BD Biosciences | 14-823-434 | |
| UV/ozone generator | Jelight Company | model no. 30 | |
| Software | |||
| LAS X imaging software | Leica microsystems |
Referanslar
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, ethics, and humanities in medicine: PEHM. 4, 2 (2009).
- Shin, W., Kim, H. J. 3D in vitro morphogenesis of human intestinal epithelium in a gut-on-a-chip or a hybrid chip with a cell culture insert. Nature protocols. 17 (3), 910-939 (2022).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. BMC Biome. 6 (72), 1-11 (2018).
- German, A. J. The growing problem of obesity in dogs and cats. The Journal of Nutrition. 136, 1940-1946 (1940).
- Patronek, G. J., Waters, D. J., Glickman, L. T. Comparative longevity of pet dogs and humans: Implications for gerontology research. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 52 (3), B171-B178 (1997).
- Lutz, T. A. Mammalian models of diabetes mellitus, with a focus on type 2 diabetes mellitus. Nature reviews. Endocrinology. 19 (6), 350-360 (2023).
- Allenspach, K., Culverwell, C., Chan, D. Long-term outcome in dogs with chronic enteropathies: 203 cases. Veterinary Record. 178 (15), 368 (2016).
- Patnaik, A. K., Hurvitz, A. I., Johnson, G. F. Canine gastrointestinal neoplasms. Veterinary Pathology. 14 (6), 547-555 (1977).
- Saito, T., et al. Immunohistochemical analysis of beta-catenin, e-cadherin and p53 in canine gastrointestinal epithelial tumors. Journal of Veterinary Medical Science. 82 (9), 1277-1286 (2020).
- Kopper, J. J., et al. Harnessing the biology of canine intestinal organoids to heighten understanding of inflammatory bowel disease pathogenesis and accelerate drug discovery: A One Health approach. Frontiers in Toxicology. 3, 1-13 (2021).
- Jalili-firoozinezhad, S., et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nature Biomedical Engineering. 3 (7), 520-531 (2019).
- Shin, W., et al. Robust formation of an epithelial layer of human intestinal organoids in a polydimethylsiloxane-based Gut-on-a-Chip microdevice. Frontiers in Medical Technology. 2, (2020).
- Shin, Y. C., et al. Three-dimensional regeneration of patient-derived intestinal organoid epithelium in a physiodynamic mucosal Interface-on-a-Chip. Micromachines. 11 (7), 663 (2020).
- Tovaglieri, A., et al. Species-specific enhancement of enterohemorrhagic E. coli pathogenesis mediated by microbiome metabolites. Microbiome. 7 (1), 43 (2019).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 1-21 (2019).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunology. 8 (2), 352-361 (2015).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 1-17 (2020).
- Gabriel, V., et al. Canine intestinal organoids in a dual-chamber permeable support system. Journal of Visualized Experiments. 2 (181), 1-24 (2022).
- Yamada, A., et al. Confronting emerging zoonoses: the one health paradigm. Confronting Emerging Zoonoses: The One Health Paradigm. , 1 (2014).
- Lerner, H., Berg, C. The concept of health in One Health and some practical implications for research and education: what is One Health. Infection Ecology & Epidemiology. 5 (1), 25300 (2015).
- Garcia, S. N., Osburn, B. I., Jay-Russell, M. T. One Health for food safety, food security, and sustainable food production. Frontiers in Sustainable Food Systems. 4, 1-9 (2020).
- Min, S., et al. Live probiotic bacteria administered in a pathomimetic Leaky Gut Chip ameliorate impaired epithelial barrier and mucosal inflammation. Scientific Reports. 12 (1), 22641 (2022).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Qu, M., et al. Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research. 31 (3), 259-271 (2021).
- Sahoo, D. K., et al. Differential transcriptomic profiles following stimulation with lipopolysaccharide in intestinal organoids from dogs with inflammatory bowel disease and intestinal mast cell tumor. Cancers. 14 (14), 3525 (2022).
- Gabriel, V., et al. Standardization and maintenance of 3D canine hepatic and intestinal organoid cultures for use in biomedical research. Journal of Visualized Experiments. (179), 1-28 (2022).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell reports. 3 (4), 1128-1139 (2013).
- Shin, W., et al. A robust longitudinal co-culture of obligate anaerobic gut microbiome with human intestinal epithelium in an anoxic-oxic interface-on-a-chip. Frontiers in Bioengineering and Biotechnology. 7, 1-13 (2019).
- Shin, W., Kim, H. J. Intestinal barrier dysfunction orchestrates the onset of inflammatory host-microbiome cross-talk in a human gut inflammation-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 115 (45), E10539-E10547 (2018).
- Park, G. S., et al. Emulating host-microbiome ecosystem of human gastrointestinal tract in vitro. Stem Cell Reviews and Reports. 13 (3), 321-334 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Jergens, A. E., et al. A scoring index for disease activity in canine inflammatory bowel disease. Journal of Veterinary Internal Medicine. 17 (3), 291-297 (2003).
- Roulis, M., Flavell, R. A. Fibroblasts and myofibroblasts of the intestinal lamina propria in physiology and disease. Differentiation; research in biological diversity. 92 (3), 116-131 (2016).
- Göke, M., Kanai, M., Podolsky, D. K. Intestinal fibroblasts regulate intestinal epithelial cell proliferation via hepatocyte growth factor. The American Journal of Physiology. 274 (5), G809-G818 (1998).
- Powell, D. W., Pinchuk, I. V., Saada, J. I., Chen, X., Mifflin, R. C. Mesenchymal cells of the intestinal lamina propria. Annual Review of Physiology. 73, 213-237 (2011).
- Pappenheimer, J. R., Michel, C. C. Role of villus microcirculation in intestinal absorption of glucose: coupling of epithelial with endothelial transport. The Journal of Physiology. 553, 561-574 (2003).
- Agace, W. W. T-cell recruitment to the intestinal mucosa. Trends in Immunology. 29 (11), 514-522 (2008).
- Ambrosini, Y. M., Shin, W., Min, S., Kim, H. J. Microphysiological engineering of immune responses in intestinal inflammation. Immune Network. 20 (2), 13 (2020).
- Kasendra, M., et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Scientific Reports. 8 (1), 1-14 (2018).
- Sontheimer-Phelps, A., et al. Human Colon-on-a-Chip enables continuous in vitro analysis of colon mucus layer accumulation and physiology. Cellular and Molecular Gastroenterology and Hepatology. 9 (3), 507-526 (2020).
- Shin, W., et al. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow- dependent physical cues in a microengineered Gut-on-a-Chip. iScience. 15, 391-406 (2019).
- Gijzen, L., et al. An Intestine-on-a-Chip model of plug-and-play modularity to study inflammatory processes. SLAS Technology. 25 (6), 585-597 (2020).
- Kim, H. J., Lee, J., Choi, J. H., Bahinski, A., Ingber, D. E. Co-culture of living microbiome with microengineered human intestinal villi in a gut-on-a-chip microfluidic device. Journal of Visualized Experiments. (114), 3-9 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır