Method Article
التقسيم الاهتزازي الآلي لأنسجة الرئة المضمنة في الأغاروز للتصوير الفلوري المتعدد
In This Article
Summary
لقد طورنا تقنية معالجة الأنسجة باستخدام أنسجة الرئة الاهتزازية والأغاروز المدمجة لتوليد أقسام الرئة ، مما يسمح بالحصول على صور عالية الدقة لبنية الرئة. استخدمنا تلطيخ التألق المناعي لمراقبة تعبير البروتين المكاني باستخدام علامات هيكلية محددة للرئة.
Abstract
نظرا لهشاشتها الهيكلية المتأصلة ، تعتبر الرئة واحدة من أكثر الأنسجة صعوبة في معالجة القراءات المجهرية. لإضافة الدعم الهيكلي للتقسيم ، عادة ما يتم تضمين قطع من أنسجة الرئة في مركب البارافين أو OCT وتقطع باستخدام ميكروتوم أو كريوستات ، على التوالي. تضيف تقنية أحدث ، تعرف باسم شرائح الرئة المقطوعة بدقة ، دعما هيكليا لأنسجة الرئة الطازجة من خلال تسلل الأغاروز وتوفر منصة للحفاظ على أنسجة الرئة الأولية في الثقافة. ومع ذلك ، بسبب إخفاء الخاتمة وتشويه الأنسجة ، لا تصلح أي من هذه التقنيات بشكل كاف لتطوير قراءات تصوير ضوئي متقدمة قابلة للتكرار تكون متوافقة عبر العديد من الأجسام المضادة والأنواع.
تحقيقا لهذه الغاية ، قمنا بتطوير خط أنابيب لمعالجة الأنسجة ، والذي يستخدم تضمين الأغاروز لأنسجة الرئة الثابتة ، إلى جانب التقسيم الآلي بالاهتزاز. سهل ذلك توليد أقسام الرئة من 200 ميكرومتر إلى 70 ميكرومتر ، في رئتي الفئران والخنازير والإنسان ، والتي لا تتطلب استرجاع المستضد ، وتمثل النسخة الأقل "معالجة" من الأنسجة المعزولة الأصلية. باستخدام هذه الشرائح ، نكشف عن قراءات تصوير متعددة قادرة على توليد صور عالية الدقة يمكن استخدام تعبيرها البروتيني المكاني لتحديد وفهم الآليات الكامنة وراء إصابة الرئة وتجديدها بشكل أفضل.
Introduction
تستخدم شرائح أنسجة الرئة خارج الجسم الحي على نطاق واسع في دراسة أمراض الرئة1. تستخدم معايير الذهب الحالية ، لا سيما في الدراسات السريرية والانتقالية على الكبيرة ، تلطيخ الهيماتوكسيلين والإيوزين إلى جانب الفحص المجهري برايت فيلد والتسجيل القائم على المراقب لتقييم وتصنيف الخلل الوظيفي في الرئة 2,3. على الرغم من أنها لا تزال تقنية قيمة ، إلا أنها تظهر قيودا من حيث الدقة المكانية وعدد العلامات التي يمكن تصويرها في وقت واحد. علاوة على ذلك ، يلزم أن تخضع أنسجة الرئة لغسيل مكثف قائم على المذيبات ، مما يؤدي إلى الجفاف والانكماش والإماهة للأنسجة قبل التصوير النهائي4. هذه العملية ليست مضيعة للوقت فحسب ، بل إنها أيضا غير صديقة للبيئة ، وتخفي حواجز البروتين ، وقد تستدعي تغييرات الأنسجة الهيكلية5،6،7،8. ومع ذلك ، بالنسبة لأنسجة الرئة ، كان التضمين في البارافين قبل التقسيم ضروريا بسبب الهشاشة الهيكلية للرئة. في المقابل ، يمكن قطع الأعضاء الصلبة مثل الدماغ باستخدام ميكروتوم مهتز (اهتزاز) ، سواء في الأنسجة الثابتة أو الطازجة9،10،11،12.
لتمكين تقسيم الاهتزاز في أنسجة الرئة ، تم إنشاء طريقة تسمى شرائح الرئة المقطوعة بدقة (PCLS) حيث يتم حقن الأغاروز ذو نقطة الانصهار المنخفضة في أنسجة الرئة الطازجة عبر الشعب الهوائية أو الأوعية الدموية ويترك ليتصلب13،14. يوفر الأغاروز في الشعب الهوائية دعما هيكليا كافيا للسماح بعد ذلك بتقسيم الاهتزاز 9,14. في القوارض ، من السهل تحقيق ذلك حيث يمكن حقن الأغاروز عن طريق القصبة الهوائية. ومع ذلك ، في الخنازير والأنسجة البشرية ، قد يكون من الصعب تحديد موقع مجرى الهواء / الوعاء المناسب داخل خزعة معينة15,16. علاوة على ذلك ، حتى لو كان هذا المجرى / الوعاء موجودا ، فعادة ما تكون هناك حاجة إلى قوة كبيرة لحقن الأغاروز ، مما قد يؤثر على مورفولوجيا الرئة اللاحقة17.
للتغلب على التحديات التي واجهتها في تضمين / تقسيم / تلطيخ البارافين وسير عمل PCLS ، أنشأنا خط أنابيب معالجة جديد لأنسجة الرئة الثابتة. يسمح سير العمل هذا باستخدام اهتزاز للتقسيم ، ويمكن أن ينتج شرائح أرق من PCLS ، وينتج شرائح لا تتطلب استرجاع المستضد للتصوير الفلوري المتعدد. توفر هذه الطريقة وسيلة "أقل معالجة" لتوليد أقسام الرئة التي يمكن استخدامها في الفحص المجهري الضوئي المتقدم. علاوة على ذلك ، يمكن استخدام قراءات التصوير لتوضيح العلاقات المكانية للخلايا والهياكل التشريحية داخل أنسجة الرئة من خلال التقاط البنية الحجمية للأنسجة18،19،20،21. تصف هذه الورقة بروتوكول توليد أقسام الرئة هذه وتوضح البقع المتعددة المطبقة على كل من هذه الأنسجة وكيف يمكن استخدام بيانات التصوير المتقدمة هذه للقياس الكمي.
Protocol
تم التبرع برئتي الفأر من قبل الباحثين باستخدام أنظمة أعضاء أخرى في محاولة لدعم 3Rs. تم تنفيذ جميع الإجراءات في الخنازير وفقا للتوجيه الأوروبي 2010/63 / EU وتمت الموافقة عليها من قبل لجنة مالمو لوند الأخلاقية للبحوث الحيوانية (Dnr 5.8.18-05527/2019) وأجريت وفقا لإرشادات CODEX لمجلس البحوث السويدي. تم منح الموافقة على استخدام العينات البشرية من قبل لجنة الأخلاقيات الوطنية السويدية (Dnr 2020-07115 و Dnr 2020-01864). انظر جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والأدوات المستخدمة في هذا البروتوكول.
1. إعداد الحلول والمواد
- إصلاح أنسجة الرئة في 4 ٪ بارافورمالدهيد في درجة حرارة الغرفة لمدة 48 ساعة. بعد ذلك ، انقل أنسجة الرئة إلى أنبوب مخروطي سعة 50 مل مملوء بمحلول ملحي مخزن بالفوسفات (PBS) يحتوي على 0.01٪ أزيد الصوديوم.
- تحضير محلول أغاروز 3٪ (وزن / حجم) عن طريق إذابة 1.5 جم من الأغاروز منخفض نقطة الانصهار في 50 مل من PBS المعقم. جهز كوبا بلاستيكيا وملقط ناعما ومقصا معقما.
- سخني الأغاروز في الميكروويف حتى يغلي ، ثم قم بتبريده إلى 42 درجة مئوية في حمام مائي. الحفاظ على الأغاروز في شكله السائل عن طريق تخزينه في حمام مائي حتى يصبح جاهزا للاستخدام.
ملاحظة: أثناء تسخين الأغاروز ، راقب الميكروويف حتى يبدأ في الغليان حتى لا يفيض. يستغرق هذا عادة حوالي 1.5 دقيقة.
2. أنسجة الرئة جزءا لا يتجزأ من الأغاروز
- ارفع خزعة الرئة من PBS-azide وقم بتشريح فصوص الرئة بعناية باستخدام ملقط دقيق ومقص معقم. قطع الفص الرئة إلى كتل أصغر.
ملاحظة: في حين أن التقسيم باستخدام غشاء الجنب ممكن ، إلا أن حزم الإيلاستين السميكة يمكن أن تعيق القطع بشفرة الاهتزاز. وبالتالي ، نوصي بإزالته إذا لم يكن ذلك ضروريا. - قطع كوب من البلاستيك من خلال منتصف وإضافة كمية صغيرة من agarose إلى قاعها. ضع الغطاء من أنبوب مخروطي سعة 50 مل (تمت إزالة الحافة) على سطح الأغاروز وقم بتخزين الكوب على حرارة 4 درجات مئوية لمدة 5 دقائق للسماح للأغاروز بالتصلب لاستخدامه لاحقا.
- استرجع الكوب البلاستيكي من الثلاجة على حرارة 4 درجات مئوية ، وأضف حوالي 1 مل من الأغاروز السائل على الغطاء ، ثم ضع كتلة أنسجة الرئة برفق على الغطاء. اترك الأغاروز لمدة 2-3 دقائق حتى يتجمد في درجة حرارة الغرفة. ثم ، صب ببطء agarose السائل على أنسجة الرئة حتى يتم غمرها بالكامل.
- ضعه في الثلاجة على حرارة 4 درجات مئوية لمدة 15 دقيقة تقريبا حتى يصلب الأغاروز. بعد ذلك ، استخدم بعناية شفرة حادة لإزالة الأغاروز الزائد المحيط بأنسجة الرئة ، تاركا طبقة موحدة بسمك 5 مم تقريبا حول الأنسجة (الشكل 1).
3. قطع أقسام أنسجة الرئة
- لتحضير أنسجة الرئة للتقسيم ، قم بتوصيل كل كتلة أنسجة بقرص عينة الاهتزاز باستخدام الغراء الفائق. بعد ذلك ، املأ صينية العازلة الاهتزازية ب PBS وضع الثلج في حمام الثلج المحيط. أخيرا ، قم بتثبيت قرص العينة بعناية في درج المخزن المؤقت.
- قم بتقطيع أنسجة الرئة بالاهتزاز بالإعدادات التالية: السماكة: 200 ميكرومتر ، التردد: 100 هرتز ، سعة الشفرة: 1.3 مم ، والسرعة الأمامية للشفرة من 0.02-0.03 مم / ثانية ، والتي تعتمد على صلابة الأنسجة.
ملاحظة: يمكن القطع حتى سمك 70 ميكرومتر إذا تم تقليل سرعة الشفرة إلى 0.01 مم / ثانية. تسمح بعض الاهتزازات (على سبيل المثال ، Leica V1200s) بأتمتة التقسيم عن طريق تعيين نافذة قطع. - لجمع الأقسام ، انقل شريحة الأنسجة برفق عن طريق غسلها بفرشاة من صينية الاهتزاز إلى لوحة مكونة من 24 بئرا مملوءة بنسبة 0.01٪ أزيد في برنامج تلفزيوني. أخيرا ، حافظ على شرائح الرئة عند 4 درجات مئوية.
4. التلوين المناعي للإيلاستين ، CD31 ، HTII-280 ، و SMA
- يتخلل ويحجب (1٪ ألبومين مصل بقري + 0.5٪ تريتون + 5٪ مصل ماعز عادي) الأنسجة عند 4 درجات مئوية تحت رج لطيف لمدة 45 دقيقة.
- تمييع الأجسام المضادة الأولية (SMA 1: 500 ؛ الإيلاستين 1: 250 ؛ CD31 1:250; HTII-280 1: 250) في PBS ، أضف 300 ميكرولتر لكل بئر ، واحتضن طوال الليل عند 4 درجات مئوية تحت الهز اللطيف.
- دون لمس الشريحة وإزالة الأجسام المضادة الأولية بطرف ماصة ، اغسل 3 × 20 دقيقة (400 ميكرولتر) باستخدام PBS.
- قم بتخفيف الأجسام المضادة الثانوية (1: 1000) في PBS ، وأضف 300 ميكرولتر لكل بئر ، واحتضانها عند 4 درجات مئوية تحت الهز اللطيف لمدة 90 دقيقة.
- قم بإزالة الأجسام المضادة الثانوية بطرف ماصة ، وأضف 4 '، 6-diamidino-2-phenylindole (DAPI) (1: 1000) و tomato lectin-488 (1: 500) لمدة 30 دقيقة حضانة ، واغسلها لمدة 3 × 10 دقائق باستخدام PBS.
- ضع ثلاث قطرات من وسيط التثبيت على الشريحة ، وقم بتركيب غطاء ، وتابع التصوير.
النتائج
تتضمن عملية توليد شرائح أنسجة الرئة عدة خطوات رئيسية ، بما في ذلك التحضير والتضمين والتقسيم. يتكون محلول الأغاروز (3٪ (وزن / حجم) عن طريق إذابة 1.5 جم من الأغاروز منخفض نقطة الانصهار في 50 مل من برنامج تلفزيوني معقم. تشمل المواد الاستهلاكية اللازمة كوبا بلاستيكيا وغطاء من أنبوب مخروطي سعة 50 مل (تمت إزالة الحافة) وملقط ومقص. يتم استئصال أنسجة الرئة بعناية إلى كتل أصغر باستخدام ملقط دقيق ومقص معقم (الشكل 1 أ ، ب). بعد ذلك ، لتضمين كتل أنسجة الرئة ، يتم ملء الجزء السفلي من الكوب بكمية صغيرة من الأغاروز ، ويتم وضع غطاء على سطح الأغاروز ، ويتم تخزين الكوب عند 4 درجات مئوية لمدة 5 دقائق (الشكل 1C). يضاف ما يقرب من 1 مل من الأغاروز السائل إلى الغطاء ، ويتم وضع كتلة أنسجة الرئة على الغطاء. يترك الأغاروز لمدة 2-3 دقائق ليتصلب بشكل شبه في درجة حرارة الغرفة (الشكل 1 د). بمجرد تثبيت كتلة الرئة في مكانها بواسطة الأغاروز شبه المتصلب ، يتم سكب الأغاروز السائل في الكوب حتى يتم غمر كتلة أنسجة الرئة بالكامل. يتم تخزين هذا في 4 درجات مئوية لمدة 15 دقيقة (الشكل 1E ، F). يوفر تضمين الأغاروز منخفض نقطة الانصهار الدعم والصلابة اللازمين لأنسجة الرئة ، مما يساعد في الحفاظ على بنيتها الأصلية أثناء عملية التقطيع. يتم استخدام شفرة حادة لإزالة الأغاروز الزائد المحيط بأنسجة الرئة. يتم ترك طبقة موحدة بسمك 5 مم تقريبا حول الأنسجة (الشكل 1G). ثم يتم لصق كتلة أنسجة الرئة المستأصلة بعناية على حامل الأنسجة (الشكل 1H). تمتلئ صينية العازلة الاهتزازية ب PBS ، ويتم وضع الثلج في حمام الجليد المحيط ، ويتم تثبيت قرص العينة في درج المخزن المؤقت (الشكل 1I). كانت معلمات القطع بالاهتزاز المحددة على اللوحة هي: سمك الشريحة: 200 ميكرومتر. التردد: 100 هرتز ؛ سعة الشفرة: 1.3 مم ؛ السرعة الأمامية للشفرة: 0.02-0.03 مم / ثانية ، والتي تعتمد على صلابة الأنسجة (الشكل 1J). أخيرا ، يتم التلوين على شرائح عائمة حرة (الشكل 1K-M).
تم إجراء تلطيخ التألق المناعي في أقسام 200 ميكرومتر من كل نوع للأكتين العضلي الأملس (SMA ، خلية عضلية ملساء وعلامة الخلايا الليفية العضلية) ، الإيلاستين (بروتين مصفوفة خارج الخلية) و Lycopersicon Esculentum lectin (LEA) ، الذي يرتبط بالخلايا الظهارية القصبية السنخية. الرئة هي نسيج غير متجانس هيكليا ، وعلى هذا النحو ، لوحظ توزيع SMA والإيلاستين التفاضلي عبر الهياكل ، بما في ذلك القنوات السنخية والأوعية الدموية والقصيبات داخل الرئة والحويصلات الهوائية من الفئران والخنازير والبشر (الشكل 2A-L). يظهر العرض عالي الدقة لحجم 20 ميكرومتر من القصيبات الهوائية كيف يمكن فحص الهياكل الدقيقة داخل الرئة على مستوى شبه ثلاثي الأبعاد (الفيديو التكميلي S1). كمثال كمي ، باستخدام تتبع الصور ، نوضح كيف يختلف حجم الحويصلات الهوائية بين العينات (n = 20 الحويصلات الهوائية) (الشكل 2L ، M).
لإظهار كيف يمكن الاستفادة كميا من بيانات التصوير المتقدمة هذه ، قمنا بمقارنة توزيعات خلايا الخلايا الرئوية من النوع 2 (TII) في أنسجة الرئة البشرية من شخص بالغ ورضيع. الجسم المضاد للخلايا السنخية من النوع 2 الخاص بالإنسان ، HTII-280 ، له تقارب قوي مع سطح الخلايا البشرية من النوع 2 (الشكل 3A-F). يمكن أيضا رؤية هذه الخلايا في الفضاء ثلاثي الأبعاد لحويصلات واحدة باستخدام التصوير الحجمي (الفيديو التكميلي S2). لتحديد رقم TII بين عينات البالغين والرضع ، قمنا بمعالجة عدد HTII-280 عبر 10 مجالات رؤية عشوائية (fov). بين هذه العينات ، أسفرت عينة الرضع عن عدد خلايا TII أعلى بكثير (الشكل 3G). ومع ذلك ، أظهرت عينة الرضع أيضا تغطية سقالة أعلى بكثير من البالغين ، مما قد يفسر ارتفاع عدد الخلايا (الشكل 3H). ولتفسير ذلك، قمنا بعد ذلك بتقييم عدد مؤشرات الابتكار البخاري بناء على تغطية السقالة، كخلايا لكل مم2 من الأنسجة، والتي لا تزال تحافظ على عدد أكبر بكثير من مؤشرات الابتكار الاستخراجية في عينة الرضع (الشكل 3I). وبالتالي ، فإن ارتفاع عدد TII في عينة الرضع لا يرجع إلى زيادة تغطية السقالة ويسلط الضوء على أهمية تقييم توزيعات الخلايا في الرئة بناء على مساحة السقالة ، وليس مجال الرؤية العام.

الشكل 1: بروتوكول لقطع شرائح أنسجة الرئة. (أ) المحاليل والمواد: محلول أغاروز 3٪ (وزن / حجم) تم الحصول عليه عن طريق إذابة 1.5 غرام من الأغاروز منخفض درجة الانصهار في 50 مل من محلول ملحي معقم مخزن بالفوسفات. كوب بلاستيكي غطاء من أنبوب مخروطي 50 مل ؛ ملقط ومقص. (ب) تشريح أنسجة الرئة باستخدام ملقط دقيق ومقص معقم. (ج) املأ قاع الكوب بكمية صغيرة من الأغاروز وضع الغطاء على سطح الأغاروز ؛ ثم قم بتخزينه في 4 درجات مئوية لمدة 5 دقائق. (د) أضف 1-2 مل من الأغاروز السائل إلى الغطاء ببطء ، ضع قطعة أنسجة الرئة على الغطاء بعناية ، وقم بتخزينها في درجة حرارة 4 درجات مئوية لمدة دقيقتين. (E ، F) صب الأغاروز السائل في الكوب حتى يتم غمر قطعة أنسجة الرئة بالكامل ، وتخزينها في 4 درجات مئوية لمدة 15 دقيقة ، ثم كسر الكوب البلاستيكي برفق. (ز) استخدم شفرة حادة لإزالة الأغاروز الزائد المحيط بأنسجة الرئة ، تاركا طبقة موحدة بسمك 5 مم تقريبا حول الأنسجة. (ح) ثم يتم لصق كتلة أنسجة الرئة المستأصلة بعناية على حامل الأنسجة. (I) املأ صينية المخزن المؤقت للاهتزاز ب PBS ، وضع الثلج في حمام الثلج المحيط ، وقم بتثبيت قرص العينة في الدرج العازل. (ي) تعيين معلمات القطع على لوحة الاهتزاز ؛ سمك الشريحة: 200 ميكرومتر ، التردد: 100 هرتز ، سعة السكين: 1.3 مم ، والسرعة الأمامية للشفرة 0.02-0.04 مم / ثانية. (K-M) صور تمثيلية لشريحة عائمة لا تزال مدمجة في الأغاروز وجاهزة للتلطيخ المناعي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
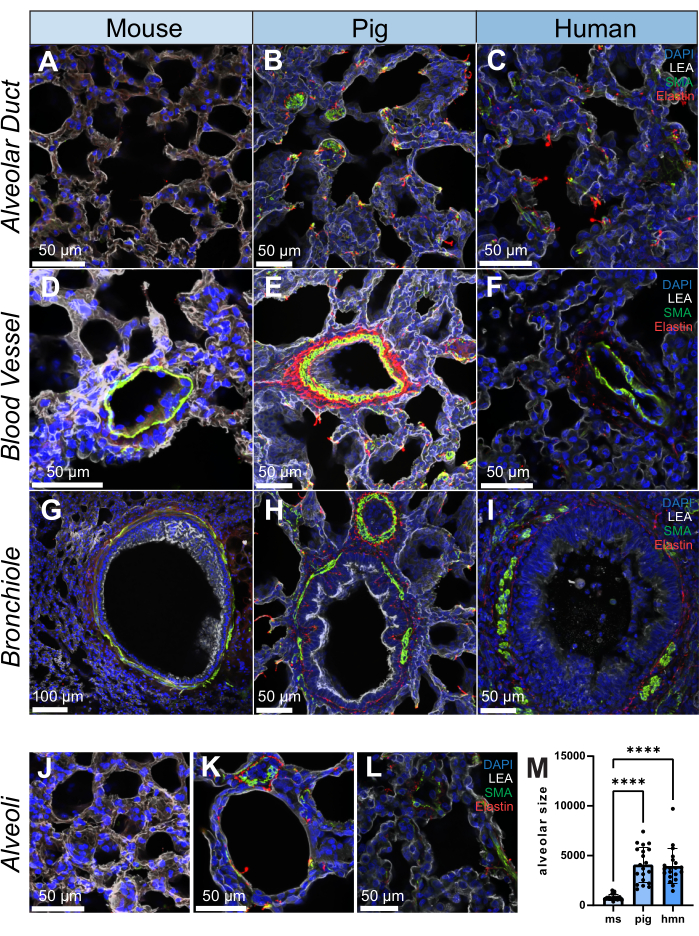
الشكل 2: صور التألق المناعي لتركيب الرئة في الإنسان والخنزير والفأر. (أ-ل) صور تمثيلية للقناة السنخية والأوعية الدموية والقصيبات والحويصلات الهوائية في شرائح أنسجة الرئة من الفأر والخنزير والإنسان على الترتيب. ضمور العضلات الشوكي (كما هو موضح باللون الأخضر) هو علامة لخلايا العضلات الملساء ويلاحظ في جدران الأوعية الدموية والشعب الهوائية لأنسجة الرئة. يشكل الإيلاستين (الموضح باللون الأحمر) جزءا من المصفوفة خارج الخلوية للرئتين. (M) تحديد حجم السنخية عن طريق اختيار 20 وضعا عشوائيا على كل شريحة من أنسجة الرئة لكل من عينات الإنسان والخنزير والفئران. تم استخدام الرسوم البيانية لتوضيح توزيع الحجم السنخي داخل كل مجموعة. قضبان المقياس = 50 ميكرومتر (A-F ، H-L) ، 100 ميكرومتر (G). اختبار كروسكال-واليس. * p < 0.05 ، ** p < 0.01 ، ***p < 0.001 ، **** p < 0.0001. الاختصارات: DAPI = 4′,6-دياميدينو-2-فينيليندول; LEA = ليكوبيرسيكون إسكولنتوم ليكتين. SMA = أكتين العضلات الملساء ؛ مللي ثانية = ماوس ؛ hmn = الإنسان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
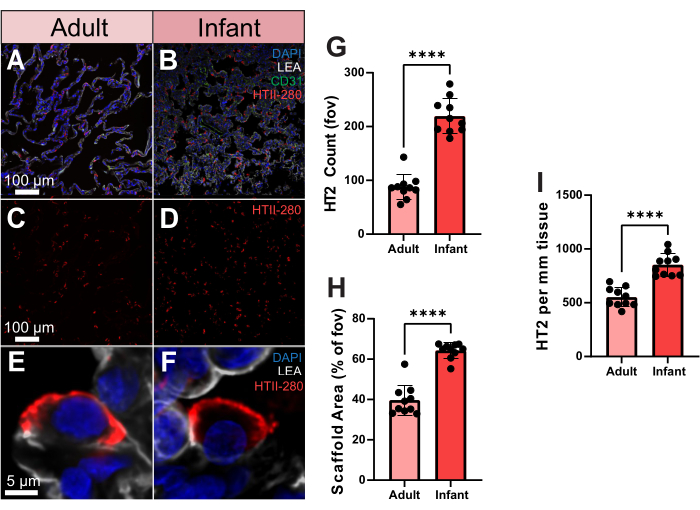
الشكل 3. توزيع الخلايا الرئوية من النوع 2 في عينات البالغين والرضع من البشر. (أ، ب) صور تمثيلية لأنسجة الرئة البشرية للبالغين والرضع ملطخة ب HTII-280 (كما هو موضح باللون الأحمر) و CD31 (كما هو موضح باللون الأخضر) و LEA (كما هو موضح باللون الرمادي). (ج، د) صور تمثيلية للإنسان البالغ والرضيع تظهر توزيع الخلايا الرئوية من النوع 2 وحده. (ه، و) صور تمثيلية ذات دقة خلية واحدة لخلية رئوية فردية من النوع 2 من عينات الرئة البشرية للبالغين والرضع. (ز) التحديد الكمي لعدد الخلايا الرئوية من النمط 2 بين عينات البالغين والرضع. (ح) القياس الكمي لتغطية منطقة سقالة أنسجة الرئة (٪ مقابل الهواء) في عينات البالغين والرضع. (ط) التحديد الكمي للخلايا الرئوية من النوع 2 لكل مم2 من الأنسجة في عينات البالغين والرضع. قضبان المقياس = 5 ميكرومتر (E ، F) ، 100 ميكرومتر (A-D). ن = 10 مجال الرؤية لكل عينة. اختبار t غير المزاوج أو اختبار مان ويتني. * p < 0.05 ، ** p < 0.01 ، ***p < 0.001 ، ****p < 0.0001. الاختصارات: DAPI = 4 '، 6-دياميدينو -2-فينيليندول ؛ LEA = ليكوبيرسيكون إسكولنتوم ليكتين. HTII = خلايا النوع الثاني البشري ؛ CD31 = جزيء التصاق الخلايا البطانية للصفائح الدموية -1 / مجموعة التمايز 31 ؛ FOV = مجال الرؤية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الفيديو التكميلي S1: فيديو بحجم تصوير 20 ميكرومتر لمجرى هوائي خنزير واحد ملطخ باستخدام DAPI و LEA و SMA والإيلاستين يظهر عرضا عالي الدقة لهيكل عناصر جدار مجرى الهواء. الاختصارات: DAPI = 4′,6-دياميدينو-2-فينيليندول; LEA = ليكوبيرسيكون إسكولنتوم ليكتين. SMA = أكتين العضلات الملساء. الرجاء الضغط هنا لتنزيل هذا الملف.
الفيديو التكميلي S2: فيديو لحجم تصوير 30 ميكرومتر لحويصلات هوائية واحدة ملطخة باستخدام DAPI و LEA و HTII-280 يوضح توزيع الخلايا الرئوية من النوع 2 عبر الهيكل. الاختصارات: DAPI = 4′,6-دياميدينو-2-فينيليندول; LEA = ليكوبيرسيكون إسكولنتوم ليكتين. SMA = أكتين العضلات الملساء. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
في هذا البروتوكول ، نقدم طريقة محسنة قائمة على الاهتزاز لتوليد أقسام الرئة. بالمقارنة مع تقنيات المعالجة القائمة على البارافين ، فإن هذه الطريقة أكثر فعالية من حيث التكلفة وكفاءة من حيث الوقت وأفضل للبيئة22. علاوة على ذلك ، تساعد هذه الطريقة في الحفاظ على السلامة الهيكلية لشرائح الأنسجة الرئوية وتسمح بالتصوير المناعي المتقدم دون الحاجة إلى استرجاع المستضد. ومع ذلك ، خلال تجاربنا ، وجدنا أيضا قيودا معينة على سير العمل هذا. يمكن أن تتداخل الرئتان المريضتان مع عملية القطع بسبب تدمير الأنسجة الناجم عن التغيرات المرضية. أثناء استخدام الاهتزاز للتقسيم ، يمكن أن تؤدي عوائق مجرى الهواء وأنسجة الرئة الليفية الشديدة إلى إعاقة الشفرة ، مما يجعل عملية تقطيع هذه الأنسجة أكثر صعوبة. ومع ذلك ، يمكن التغلب على ذلك عن طريق تقليل سرعة الشفرة ودعم الأنسجة بفرشاة طلاء دقيقة. تنشأ تحديات مماثلة من سماكة غشاء الجنب ، وهي نتيجة شائعة في ذات الجنب ، ومرض الانسداد الرئوي المزمن (COPD) ، والتليف الرئوي مجهول السبب (IPF) 23،24،25. إذا لم يكن غشاء الجنب ذا أهمية للتجربة ، فإننا نوصي بإزالته قبل تقسيم أو عزل حجم الرئة بعيدا عن غشاء الجنب. إذا كان غشاء الجنب ضروريا ، فيمكن تقطيعه باستخدام معالجة مماثلة على النحو الوارد أعلاه ، بما في ذلك سرعات شفرة أبطأ ودعم شرائح من فرشاة دقيقة.
في حين أن شرائح الرئة المقطوعة بدقة يمكن أن تحافظ على البنية ثلاثية الأبعاد والبيئة الأصلية للرئة26 ، فمن المهم ملاحظة أن إنشاء PCLS عملية معقدة وتستغرق وقتا طويلا. يعتمد نجاح توليد شرائح أنسجة الرئة بشكل كبير على كفاءة ملء الأغاروز ، والذي بدوره يتأثر بوجود غشاء الجنب السليم ومواقع الحقن القابلة للحياة في الأنسجة التي تم الحصول عليها. من السهل تحقيق ذلك في القوارض حيث يمكن بسهولة إدخال الأغاروز من خلال القصبة الهوائية إلى الرئتين السليمتين27،28،29. ومع ذلك ، في الأبحاث الحيوانية الكبيرة ، عادة ما تكون الخزعات المأخوذة عبر التجربة من أجزاء الرئة البعيدة ، والتي تفتقر إلى مجرى هوائي كبير بما يكفي لقنية30,31. وبالتالي ، بدلا من حقن الأغاروز في الشعب الهوائية أو الأوعية الدموية ، نعتمد هذه الطريقة حيث يتم تضمين أنسجة الرئة ، بغض النظر عن نوع المنشأ أو حجم العينة ، في أغاروز منخفض درجة الانصهار لتوليد شرائح أنسجة الرئة. هذا النهج أسهل تقنيا ويهدف إلى تقليل تلف الأنسجة قدر الإمكان. بناء على تجربتنا ، أظهرت هذه الطريقة كفاءة وسهولة أعلى في توليد أقسام أنسجة الرئة. إنه يحافظ بشكل فعال على مورفولوجيا الحويصلات الهوائية وهو مناسب بشكل خاص لقطع أنسجة الرئة ، مما يتيح توليد تصوير مضان متعدد الدقة قابل للتكرار.
في هذه الدراسة ، نوضح كذلك اثنين من التقديرات الكمية القائمة على العينات لبيانات التصوير التي تم إنشاؤها. استخدم أول تتبع للصور لتقييم الاختلافات في الحجم السنخي عبر عينات الأنواع. مما لا يثير الدهشة ، كانت الحويصلات الهوائية الفأرية هي الأصغر ، في حين كانت الحويصلات الهوائية الخنازير والحويصلات الهوائية البشرية متشابهة في الحجم ، مما يسلط الضوء على الخنازير كنموذج متعدي مثير للاهتمام لأبحاث الرئة.
بالنسبة للقياس الكمي الثاني ، قارنا توزيع HTII بين عينة رئة البالغين والرضع. تلعب الخلايا الرئوية من النوع 2 دورا حيويا في بنية ظهارة الرئة البعيدة. وتساهم هذه القدرة الفريدة لمؤسسات الابتكار التكنولوجي في إصلاح وتجديد الظهارة السنخية32. في الرئة البشرية البالغة السليمة ، تمثل TIIs حوالي 15٪ من إجمالي عدد الخلايا ، في حين تقدر تغطيتها لمساحة السطح السنخية بحوالي 5٪ 33. HTII-280 هو علامة خاصة بالرئة معترف بها على نطاق واسع لدراسة تطور واستجابة الخلايا الظهارية السنخية للإصابة ، وهو موضعي على وجه التحديد لأغشية البلازما القمية ل TIIs. في التجربة ، تم الحصول على أنسجة البالغين من مريض متبرع توفي بسبب نزيف داخل المخ وكان يعاني من إصابة متزامنة في الرئة ، بينما جاءت عينة الرضيع من وفيات مرتبطة بالاختناق. تشير النتائج التي توصلنا إليها إلى أن التعبير عن HTII-280 كان أقل بكثير في عينة الرئة البالغة منه في عينة الرضع. ومن المثير للاهتمام ، أنه في حين يتم التعبير عن HTII-280 في غالبية HTIIs ، يمكن أن يتأثر تعبيره أيضا بجودة الأنسجة ، ويتم تقليله بشكل كبير في أنسجة الرئة البشرية المصابة34. تظهر أنسجة الرئة المسنة انخفاضا كبيرا في عدد ونشاط إفراز TIIs مقارنة بالأنسجة الشابة ، ويظهر الأفراد المسنون انتشارا وإفرازا ونشاطا مضادا لموت الخلايا المبرمج أقل بكثير من TIIs مقارنة بتلك الأنسجة الشابة35. وتمشيا مع ذلك، فإن تحديد واكتشاف بروتين سطح الخلية الخاص بمؤشرات الابتكار التكنولوجي البشرية يمكن أن يساعد في تقييم شدة إصابة الرئة وتقييم أساليب العلاج التي تهدف إلى تعزيز إصلاح الرئة36،37. وبالتالي ، باستخدام خط الأنابيب هذا ، سيكون من المهم للغاية إجراء دراسات TII السنخية في مجموعات بشرية أكبر من الصحة والمرض.
في الختام ، يقدم هذا البروتوكول نهجا أسرع وأسهل لقطع أنسجة الرئة. توفر هذه الطريقة تعليمات مفصلة لإعداد أنسجة الرئة وقطعها وتلطيخها ، مما يضمن الحفاظ على بنية أنسجة الرئة سليمة. إنه يحسن النموذج لدراسة كل من بنية الرئة الصحية والمريضة ، مما يؤدي إلى تحسين الكفاءة التجريبية. بشكل عام ، تقدم هذه الدراسة نهجا واعدا للتحقيق في البيولوجيا المكانية المعقدة في الفيزيولوجيا المرضية لأنسجة الرئة عبر الأنواع ، والتي يمكن أن تساعد في فهم الآليات الجزيئية التي تلعب دورا في المرض والإصلاح بشكل أفضل.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
يقر المؤلفون بامتنان بالتمويل الذي تلقوه من مؤسسة والنبرغ للطب الجزيئي ومركز الخلايا الجذعية بجامعة لوند ويقرون بمركز التصوير الحيوي بجامعة لوند (LBIC) للوصول إلى نيكون A1RHD.
Materials
| Name | Company | Catalog Number | Comments |
| 24 well tissue culture inserts | SARSTEDT | 83.3932.300 | |
| 4% paraformaldehyde | SOLVECO | 6095714 | |
| 4’, 6-diamidino-2-phenylindole (DAPI) | Thermo Fisher scientific | D1306 | |
| 50 mL Falcon tube | SARSTEDT | 2045221 | |
| Cluster of differentiation 31 (CD31) | Abcam | ab28364 | |
| Confocal microscope | Nikon | A1R HD25 | |
| Elastin | Abcam | ab23747 | |
| Epredia X1000 Coverslip | Thermo Fisher scientific | 10318963 | |
| Epredia SuperFrost Plus Adhesion slides | Thermo Fisher scientific | 10149870 | |
| Forceps | AESCULAP | FB395R | |
| Goat anti-mouse 647 | Invitrogen | A21235 | |
| Goat anti-rabbit 568 | Invitrogen | A11011 | |
| Human type II cells | Terrace Biotech | TB-27AHT2-280 | |
| Invitrogen Fluoromount-G Mounting Medium | Thermo Fisher scientific | E41473 | |
| Low gelling temperature Agarose | Sigma-Aldrich | 1003467046 | |
| Lycopersicon Esculentum lectin | Thermo Fisher scientific | 2531965 | |
| Phosphate-buffered saline (PBS) | Thermo Fisher scientific | 50-100-8798 | |
| Plastic cup | kontorsgiganten | 885221 | |
| Scissors | STILLE | 101-8380-18 | |
| Smooth muscle actin | Abcam | ab5694 | |
| Sodium azide | Sigma-Aldrich | K54329188239 | |
| Super glue | LOCTITE | 2721643 | |
| Vibrating microtome | Leica | VT1200S |
References
- Morin, J. P., et al. Precision cut lung slices as an efficient tool for in vitro lung physio-pharmacotoxicology studies. Xenobiotica. 43 (1), 63-72 (2013).
- Kawasaki, H., et al. The NanoSuit method: a novel histological approach for examining paraffin sections in a nondestructive manner by correlative light and electron microscopy. Laboratory Investigation. 100 (1), 161-173 (2020).
- Silva, I., et al. A Semi-quantitative scoring system for green histopathological evaluation of large animal models of acute lung injury. BIO-PROTOCOL. 12 (16), e4493 (2022).
- Kim, J. H., et al. Optimizing tissue-clearing conditions based on analysis of the critical factors affecting tissue-clearing procedures. Scientific Reports. 8 (1), 12815 (2018).
- Jain, D., et al. Immunocytochemistry for predictive biomarker testing in lung cancer cytology. Cancer Cytopathology. 127 (5), 325-339 (2019).
- Alturkistani, H. A., Tashkandi, F. M., Mohammedsaleh, Z. M. Histological stains: a literature review and case study. Global Journal of Health Science. 8 (3), 72-79 (2015).
- Morrison, L. E., Lefever, M. R., Lewis, H. N., Kapadia, M. J., Bauer, D. R. Conventional histological and cytological staining with simultaneous immunohistochemistry enabled by invisible chromogens. Laboratory Investigation. 102 (5), 545-553 (2022).
- Dineshshankar, J., et al. Kerosene as an alternative to xylene in histopathological tissue processing and staining: An experimental study. Journal of Pharmacy and Bioallied Sciences. 11 (6), 376 (2019).
- Abdelaal, H. M., et al. Comparison of vibratome and compresstome sectioning of fresh primate lymphoid and genital tissues for in situ MHC-tetramer and immunofluorescence staining. Biological Procedures Online. 17 (1), 2 (2015).
- Siwczak, F., Hiller, C., Pfannkuche, H., Schneider, M. R. Culture of vibrating microtome tissue slices as a 3D model in biomedical research. Journal of Biological Engineering. 17 (1), 36 (2023).
- Bèchet, N. B., Shanbhag, N. C., Lundgaard, I. Glymphatic pathways in the gyrencephalic brain. Journal of Cerebral Blood Flow & Metabolism. 41 (9), 2264-2279 (2021).
- Bèchet, N. B., Kylkilahti, T. M., Mattsson, B., Petrasova, M., Shanbhag, N. C., Lundgaard, I. Light sheet fluorescence microscopy of optically cleared brains for studying the glymphatic system. Journal of Cerebral Blood Flow and Metabolism. 40 (10), 1975-1986 (2020).
- Bai, Y., Ai, X. Utilizing the precision-cut lung slice to study the contractile regulation of airway and intrapulmonary arterial smooth muscle. Journal of Visualized Experiments. (183), (2022).
- Gerckens, M., et al. Generation of human 3D lung tissue cultures (3D-LTCs) for disease modeling. Journal of Visualized Experiments. (144), (2019).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulmonary Pharmacology & Therapeutics. 24 (5), 452-465 (2011).
- Lam, M., Lamanna, E., Organ, L., Donovan, C., Bourke, J. E. Perspectives on precision cut lung slices—powerful tools for investigation of mechanisms and therapeutic targets in lung diseases. Frontiers in Pharmacology. 14, 1162889 (2023).
- Liu, G., et al. Use of precision cut lung slices as a translational model for the study of lung biology. Respiratory Research. 20 (1), 162 (2019).
- Cooper, P. R., et al. Formoterol and salmeterol induce a similar degree of β 2- adrenoceptor tolerance in human small airways but via different mechanisms. British Journal of Pharmacology. 163 (3), 521-532 (2011).
- Ochoa, L. F., et al. Imaging of murine whole lung fibrosis by large scale 3D microscopy aided by tissue optical clearing. Scientific Reports. 8 (1), 13348 (2018).
- Tehrani, K. F., Park, J., Chaney, E. J., Tu, H., Boppart, S. A. Nonlinear imaging histopathology: a pipeline to correlate gold-standard hematoxylin and eosin staining with modern nonlinear microscopy. IEEE Journal of Selected Topics in Quantum Electronics. 29 (4), (2023).
- Branchfield, K., et al. A three-dimensional study of alveologenesis in mouse lung. Developmental Biology. 409 (2), 429-441 (2016).
- Li, Y., et al. Precision vibratome for high-speed ultrathin biotissue cutting and organ-wide imaging. iScience. 24 (9), 103016 (2021).
- Qian, G., et al. DOCK2 promotes pleural fibrosis by modulating mesothelial to mesenchymal transition. American Journal of Respiratory Cell and Molecular Biology. 66 (2), 171-182 (2022).
- Cagle, P. T., Allen, T. C. Pathology of the pleura: What the pulmonologists need to know. Respirology. 16 (3), 430-438 (2011).
- Jantz, M. A., Antony, V. B. Pleural fibrosis. Clinics in Chest Medicine. 27 (2), 181-191 (2006).
- Viana, F., O’Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Molecular Microbiology. 117 (3), 578-588 (2022).
- Paddenberg, R., Mermer, P., Goldenberg, A., Kummer, W. Videomorphometric analysis of hypoxic pulmonary vasoconstriction of intra-pulmonary arteries using murine precision cut lung slices. Journal of Visualized Experiments. (83), e50970 (2014).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465 (2017).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. Journal of Visualized Experiments. (171), e62392 (2021).
- Ghaidan, H., et al. Reduction of primary graft dysfunction using cytokine adsorption during organ preservation and after lung transplantation. Nature Communications. 13 (1), 1-15 (2022).
- Guenthart, B. A., et al. Regeneration of severely damaged lungs using an interventional cross-circulation platform. Nature Communications. 10 (1), 1985 (1985).
- Ruaro, B., et al. The history and mystery of alveolar epithelial type II cells: focus on their physiologic and pathologic role in lung. International Journal of Molecular Sciences. 22 (5), 2566 (2021).
- Crapo, J. D., Barry, B. E., Gehr, P., Bachofen, M., Weibel, E. R. Cell number and cell characteristics of the normal human lung. The American Review of Respiratory Disease. 126 (2), 332-337 (1982).
- Evans, K. V., Lee, J. -. H. Alveolar wars: The rise of in vitro models to understand human lung alveolar maintenance, regeneration, and disease. Stem Cells Translational Medicine. 9 (8), 867-881 (2020).
- Chen, J. -. X., et al. Sirtuin 3 ameliorates lung senescence and improves type II alveolar epithelial cell function by enhancing the FoxO3a-dependent antioxidant defense mechanism. Stem Cells and Development. 30 (17), 843-855 (2021).
- Zacharias, W. J., et al. Regeneration of the lung alveolus by an evolutionarily conserved epithelial progenitor. Nature. 555 (7695), 251-255 (2018).
- Gonzalez, R. F., Allen, L., Gonzales, L., Ballard, P. L., Dobbs, L. G. HTII-280, a biomarker specific to the apical plasma membrane of human lung alveolar type II cells. Journal of Histochemistry & Cytochemistry. 58 (10), 891-901 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved