Method Article
Seccionamiento automatizado de vibratomo de tejido pulmonar incluido en agarosa para obtener imágenes de fluorescencia multiplex
En este artículo
Resumen
Hemos desarrollado una técnica de procesamiento tisular que utiliza un vibratomo y tejido pulmonar incluido en agarosa para generar secciones pulmonares, lo que permite la adquisición de imágenes de alta resolución de la arquitectura pulmonar. Empleamos la tinción de inmunofluorescencia para observar la expresión espacial de proteínas utilizando marcadores estructurales pulmonares específicos.
Resumen
Debido a su fragilidad estructural inherente, el pulmón se considera uno de los tejidos más difíciles de procesar para las lecturas microscópicas. Para agregar soporte estructural para el corte, los trozos de tejido pulmonar se incrustan comúnmente en parafina o compuesto OCT y se cortan con un micrótomo o criostato, respectivamente. Una técnica más reciente, conocida como cortes de pulmón cortados con precisión, agrega soporte estructural al tejido pulmonar fresco a través de la infiltración de agarosa y proporciona una plataforma para mantener el tejido pulmonar primario en cultivo. Sin embargo, debido al enmascaramiento de epítopos y a la distorsión tisular, ninguna de estas técnicas se presta adecuadamente al desarrollo de lecturas avanzadas de imágenes de luz reproducibles que sean compatibles con múltiples anticuerpos y especies.
Con este fin, hemos desarrollado una línea de procesamiento de tejidos, que utiliza la inclusión de agarosa en tejido pulmonar fijo, junto con el corte automatizado de vibratomos. Esto facilitó la generación de secciones pulmonares de 200 μm a 70 μm de espesor, en pulmones de ratón, cerdo y humano, que no requieren recuperación de antígenos y representan la versión menos "procesada" del tejido aislado nativo. Utilizando estos cortes, revelamos una lectura de imágenes multiplexadas capaz de generar imágenes de alta resolución cuya expresión espacial de proteínas se puede utilizar para cuantificar y comprender mejor los mecanismos subyacentes a la lesión y regeneración pulmonar.
Introducción
Los cortes de tejido pulmonar ex vivo se utilizan ampliamente en el estudio de la enfermedad pulmonar1. Los estándares de oro actuales, particularmente en estudios clínicos y traslacionales con animales grandes, emplean la tinción de hematoxilina y eosina junto con la microscopía de campo claro y la puntuación basada en observadores para evaluar y clasificar la disfunción pulmonar 2,3. Si bien sigue siendo una técnica valiosa, presenta limitaciones en términos de resolución espacial y el número de marcadores que se pueden fotografiar simultáneamente. Además, se requiere que el tejido pulmonar se someta a extensos lavados a base de solventes, lo que resulta en deshidratación, contracción y rehidratación del tejido antes de su imagen final4. Este proceso no solo requiere mucho tiempo, sino que también es perjudicial para el medio ambiente, enmascara los epítopos de las proteínas y puede provocar cambios estructurales en los tejidos 5,6,7,8. Sin embargo, en el caso del tejido pulmonar, la inclusión en parafina antes de la sección ha sido una necesidad debido a la fragilidad estructural del pulmón. Por el contrario, los órganos sólidos, como el cerebro, pueden ser cortados utilizando un micrótomo vibratorio (vibrátomo), tanto en tejido fijo como fresco 9,10,11,12.
Para permitir el corte de vibratomos en el tejido pulmonar, se estableció un método denominado cortes de pulmón cortados con precisión (PCLS, por sus siglas en inglés) en el que se inyecta agarosa de bajo punto de fusión en el tejido pulmonar fresco a través de las vías respiratorias o los vasos sanguíneos y se deja solidificar13,14. La agarosa en las vías respiratorias proporciona suficiente soporte estructural para permitir el seccionamiento del vibratomo 9,14. En roedores, esto es fácil de lograr, ya que la agarosa se puede inyectar a través de la tráquea; Sin embargo, en el tejido porcino y humano, puede ser difícil localizar una vía aérea/vaso adecuado dentro de una biopsia determinada15,16. Además, incluso si se localiza una vía aérea/vaso de este tipo, generalmente se requiere una fuerza sustancial para inyectar la agarosa, lo que puede influir en la morfología pulmonar posterior17.
Para superar los desafíos experimentados en la inclusión/sección/tinción de parafina y el flujo de trabajo de PCLS, hemos establecido una nueva línea de procesamiento para tejido pulmonar fijo. Este flujo de trabajo permite el uso de un vibrátomo para el seccionamiento, puede producir cortes más delgados que en PCLS y produce cortes que no requieren recuperación de antígenos para imágenes de fluorescencia múltiples. Este método ofrece un medio de "procesamiento mínimo" para generar secciones pulmonares que se pueden utilizar en microscopía óptica avanzada. Además, las lecturas de imágenes se pueden utilizar para demostrar las relaciones espaciales de las células y las estructuras anatómicas dentro del tejido pulmonar mediante la captura de la arquitectura volumétrica del tejido 18,19,20,21. En este artículo se describe el protocolo para generar estas secciones pulmonares y se muestran las tinciones multiplex aplicadas a cada uno de estos tejidos y cómo se pueden utilizar estos datos de imagen avanzados para la cuantificación.
Protocolo
Los pulmones de ratón fueron donados por investigadores que utilizaron otros sistemas de órganos en un esfuerzo por mantener las 3R. Todos los procedimientos en cerdos se llevaron a cabo de acuerdo con la directiva europea 2010/63/UE y fueron aprobados por el Comité de Ética de Investigación Animal de Malmö-Lund (Dnr 5.8.18-05527/2019) y se llevaron a cabo de acuerdo con las directrices CODEX del Consejo Sueco de Investigación. La aprobación para el uso de muestras humanas fue otorgada por el Comité Nacional de Ética de Suecia (Dnr 2020-07115 y Dnr 2020-01864). Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales e instrumentos utilizados en este protocolo.
1. Preparación de soluciones y materiales
- Fijar el tejido pulmonar en paraformaldehído al 4% a temperatura ambiente durante 48 h. Posteriormente, transfiera el tejido pulmonar a un tubo cónico de 50 ml lleno de solución salina tamponada con fosfato (PBS) que contiene azida sódica al 0,01%.
- Preparar una solución de agarosa al 3% (p/v) disolviendo 1,5 g de agarosa de bajo punto de fusión en 50 ml de PBS estéril. Prepara un vaso de plástico, unas pinzas finas y unas tijeras estériles.
- Calentar la agarosa en el microondas hasta que hierva, luego enfriarla a 42 °C al baño maría. Mantenga la agarosa en su forma líquida almacenándola en el baño de agua hasta que esté lista para usar.
NOTA: Mientras calienta la agarosa, observe el microondas hasta que comience a hervir para que no se desborde. Esto suele tardar alrededor de 1,5 minutos.
2. Tejido pulmonar incrustado en agarosa
- Levante la biopsia de pulmón de la azida PBS y diseccione cuidadosamente los lóbulos pulmonares con pinzas finas y tijeras estériles. Corta el lóbulo pulmonar en bloques más pequeños.
NOTA: Si bien es posible seccionar con pleura, sus gruesos haces de elastina pueden impedir el corte con la cuchilla del vibrátomo. Por lo tanto, recomendamos su eliminación si no es necesario. - Corta un vaso de plástico por la mitad y agrega una pequeña cantidad de agarosa en su fondo. Coloque la tapa de un tubo cónico de 50 ml (sin borde) en la superficie de la agarosa y guarde la taza a 4 °C durante 5 minutos para permitir que la agarosa se solidifique para su uso posterior.
- Saca el vaso de plástico del frigorífico a 4 °C, añade aproximadamente 1 ml de agarosa líquida sobre la tapa y, a continuación, coloca suavemente el bloque de tejido pulmonar sobre la tapa. Deje que la agarosa durante 2-3 minutos se solidifique a temperatura ambiente. Luego, vierta lentamente la agarosa líquida sobre el tejido pulmonar hasta que esté completamente sumergido.
- Refrigerar a 4 °C durante aproximadamente 15 min hasta que la agarosa se solidifique. A continuación, utilice con cuidado una cuchilla afilada para eliminar el exceso de agarosa que rodea el tejido pulmonar, dejando una capa uniforme de aproximadamente 5 mm de espesor alrededor del tejido (Figura 1).
3. Cortar secciones de tejido pulmonar
- Para preparar el tejido pulmonar para la sección, fije cada bloque de tejido en el disco de muestra del vibratomo con superpegamento. A continuación, llene la bandeja tampón del vibratomo con PBS y coloque hielo en el baño de hielo circundante. Por último, instale con cuidado el disco de muestra en la bandeja del búfer.
- Cortar el tejido pulmonar con el vibratomo con los siguientes ajustes: grosor: 200 μm, frecuencia: 100 Hz, amplitud de la hoja: 1,3 mm y velocidad de avance de la cuchilla de 0,02-0,03 mm/s, que depende de la rigidez del tejido.
NOTA: El corte es posible hasta un espesor de 70 μm si la velocidad de la cuchilla se reduce a 0,01 mm/s. Ciertos vibrátomos (por ejemplo, Leica V1200s) permiten la automatización del seccionamiento mediante el ajuste de una ventana de corte. - Para recolectar secciones, transfiera suavemente el corte de tejido sacándolo con un cepillo de la bandeja del vibrátomo a una placa de 24 pocillos llena con azida al 0,01% en PBS. Por último, conservar los cortes de pulmón a 4 °C.
4. Inmunotinción de elastina, CD31, HTII-280 y AME
- Permeabilizar y bloquear (1% albúmina sérica bovina + 0,5% Tritón + 5% suero normal de cabra) el tejido a 4 °C bajo agitación suave durante 45 min.
- Diluir los anticuerpos primarios (SMA 1:500; elastina 1:250; CD31 1:250; HTII-280 1:250) en PBS, añadir 300 μL por pocillo e incubar durante la noche a 4 °C bajo una suave agitación.
- Sin tocar el corte y eliminar los anticuerpos primarios con la punta de una pipeta, lavar 3 x 20 min (400 μL) con PBS.
- Diluir los anticuerpos secundarios (1:1000) en PBS, añadir 300 μL por pocillo e incubar a 4 °C bajo una suave agitación durante 90 min.
- Retirar los anticuerpos secundarios con la punta de una pipeta, añadir 4',6-diamidino-2-fenilindol (DAPI)(1:1000) y lectina-488 de tomate (1:500) durante una incubación de 30 minutos, y lavar durante 3 x 10 min con PBS.
- Coloque tres gotas de medio de montaje en el portaobjetos, monte un cubreobjetos y proceda a la obtención de imágenes.
Resultados
El proceso de generación de cortes de tejido pulmonar implica varios pasos clave, que incluyen la preparación, la inclusión y la sección. La solución de agarosa (3% (p/v) se obtiene disolviendo 1,5 g de agarosa de bajo punto de fusión en 50 ml de PBS estéril. Los consumibles necesarios incluyen un vaso de plástico, la tapa de un tubo cónico de 50 ml (sin borde), pinzas y tijeras. El tejido pulmonar se reseca cuidadosamente en bloques más pequeños con pinzas finas y tijeras estériles (Figura 1A, B). A continuación, para incrustar los bloques de tejido pulmonar, se llena el fondo de la copa con una pequeña cantidad de agarosa, se coloca una tapa en la superficie de la agarosa y se almacena la copa a 4 °C durante 5 min (Figura 1C). Se agrega aproximadamente 1 ml de agarosa líquida al párpado y se coloca el bloque de tejido pulmonar sobre el párpado. La agarosa se deja durante 2-3 minutos para que se semisolidifique a temperatura ambiente (Figura 1D). Una vez que un bloqueo pulmonar se mantiene en su lugar por la agarosa semisolidificada, se vierte agarosa líquida en la copa hasta que el bloqueo de tejido pulmonar esté completamente sumergido. Se almacena a 4 °C durante 15 min (Figura 1E,F). La inclusión de agarosa de bajo punto de fusión proporciona el soporte y la rigidez necesarios al tejido pulmonar, lo que ayuda a mantener su arquitectura original durante el proceso de corte. Se utiliza una cuchilla afilada para eliminar el exceso de agarosa que rodea el tejido pulmonar. Se deja una capa uniforme de aproximadamente 5 mm de espesor alrededor del tejido (Figura 1G). A continuación, el bloque de tejido pulmonar extirpado se pega cuidadosamente al soporte de tejido (Figura 1H). La bandeja tampón del vibratomo se llena con PBS, se coloca hielo en el baño de hielo circundante y el disco de muestra se instala en la bandeja tampón (Figura 1I). Los parámetros de corte del vibratomo establecidos en el panel fueron: espesor de la rebanada: 200 μm; frecuencia: 100 Hz; amplitud de la hoja: 1,3 mm; velocidad de avance de la hoja: 0,02-0,03 mm/s, que depende de la rigidez del tejido (Figura 1J). Finalmente, la tinción se lleva a cabo en rodajas flotantes (Figura 1K-M).
La tinción de inmunofluorescencia se llevó a cabo en secciones de 200 μm de cada especie para la actina del músculo liso (AME, una célula del músculo liso y marcador de miofibroblastos), la elastina (proteína de la matriz extracelular) y la lectina de Lycopersicon Esculentum (LEA), que se une a las células epiteliales broncoalveolares. El pulmón es un tejido estructuralmente heterogéneo y, como tal, se observa una distribución diferencial de AME y elastina en todas las estructuras, incluidos los conductos alveolares, los vasos sanguíneos, los bronquiolos intrapulmonares y los alvéolos de ratones, cerdos y humanos (Figura 2A-L). Una representación de alta resolución de un volumen de 20 μm de un bronquiolo muestra cómo se pueden examinar las estructuras finas dentro del pulmón a un nivel semitridimensional (Video suplementario S1). Como ejemplo cuantitativo, utilizando el trazado de imágenes, mostramos cómo el tamaño de los alvéolos difiere entre las muestras (n = 20 alvéolos) (Figura 2L,M).
Para mostrar cómo es posible utilizar cuantitativamente estos datos de imágenes avanzadas, comparamos las distribuciones de células de neumocitos tipo 2 (TII) en tejido pulmonar humano de un adulto y un bebé. El anticuerpo de células alveolares tipo 2 específico para humanos, HTII-280, tiene una fuerte afinidad con la superficie de las células humanas tipo 2 (Figura 3A-F). Además, estas células se pueden ver en el espacio tridimensional de un solo alvéolo mediante imágenes volumétricas (Video suplementario S2). Para cuantificar el número de TII entre las muestras de adultos y bebés, procesamos el recuento de HTII-280 en 10 campos de visión aleatorios (fov). Entre estas muestras, la muestra infantil arrojó un recuento de células TII significativamente mayor (Figura 3G). Sin embargo, la muestra infantil también mostró una cobertura de andamio significativamente mayor que la del adulto, lo que podría explicar el mayor número de células (Figura 3H). Para tener esto en cuenta, evaluamos el número de ITI en función de la cobertura del andamio, como células pormm2 de tejido, que aún mantenía un número significativamente mayor de ITI en la muestra infantil (Figura 3I). Por lo tanto, el mayor recuento de TII en la muestra infantil no se debe a una mayor cobertura del andamio y destaca la importancia de evaluar la distribución celular en el pulmón en función del área del andamio, no del campo de visión general.

Figura 1: Protocolo para cortar cortes de tejido pulmonar. A) Las soluciones y los materiales: una solución de agarosa al 3 % (p/v) obtenida disolviendo 1,5 g de agarosa de bajo punto de fusión en 50 ml de solución salina estéril tamponada con fosfato; un vaso de plástico; una tapa de tubo cónico de 50 mL; fórceps y tijeras. (B) Los tejidos pulmonares se diseccionaron con pinzas finas y tijeras estériles. (C) Llene el fondo de la taza con una pequeña cantidad de agarosa y coloque la tapa sobre la superficie de la agarosa; luego, guárdelo a 4 °C durante 5 min. (D) Agregue 1-2 ml de agarosa líquida a la tapa lentamente, coloque el trozo de tejido pulmonar en la tapa con cuidado y guárdelo a 4 °C durante 2 min. (E,F) Vierta la agarosa líquida en la taza hasta que el trozo de tejido pulmonar esté completamente sumergido, guárdelo a 4 °C durante 15 min, y luego rompe el vaso de plástico suavemente. (G) Utilice una cuchilla afilada para eliminar el exceso de agarosa que rodea el tejido pulmonar, dejando una capa uniforme de aproximadamente 5 mm de espesor alrededor del tejido. (H) A continuación, el bloque de tejido pulmonar extirpado se pega cuidadosamente en el soporte del tejido. (I) Llene la bandeja tampón del vibratomo con PBS, coloque hielo en el baño de hielo circundante e instale el disco de muestra en la bandeja tampón. (J) Establezca los parámetros de corte en el panel del vibrátomo; espesor de la cuchilla: 200 μm, frecuencia: 100 Hz, amplitud de la cuchilla: 1,3 mm y velocidad de avance de la hoja de 0,02-0,04 mm/s. (K-M) Imágenes representativas de una rodaja flotante aún incrustada en agarosa y lista para la tinción por inmunofluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
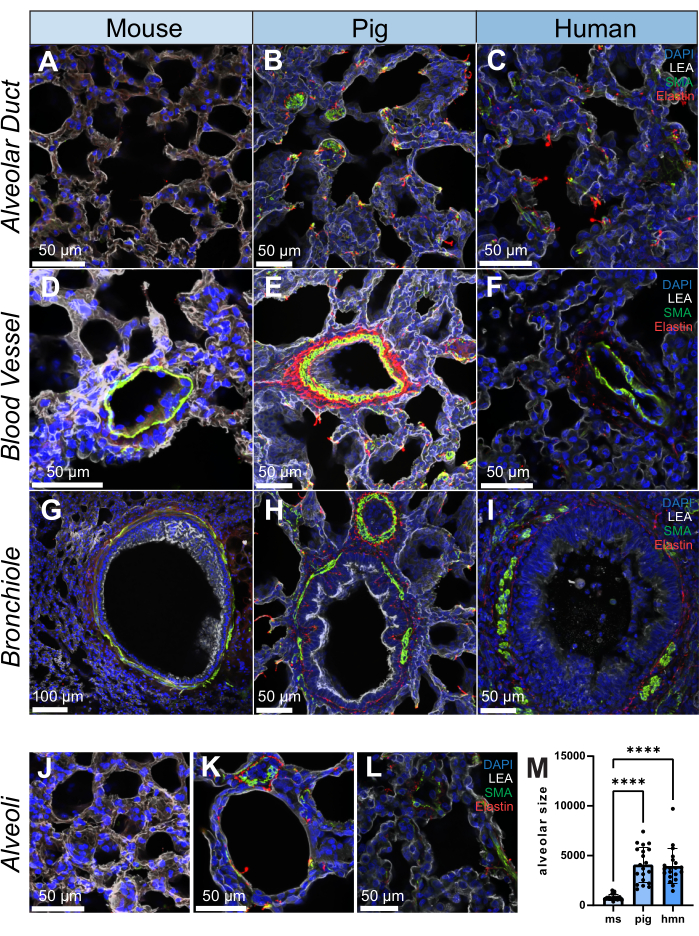
Figura 2: Imágenes de inmunofluorescencia de la estructura pulmonar en humanos, cerdos y ratones. (A-L) Imágenes representativas de un conducto alveolar, un vaso sanguíneo, bronquiolos y alvéolos en cortes de tejido pulmonar de ratón, cerdo y humano, respectivamente. La AME (que se muestra en verde) es un marcador de las células del músculo liso y se observa en las paredes vasculares y bronquiales del tejido pulmonar. La elastina (que se muestra en rojo) forma parte de la matriz extracelular de los pulmones. (M) Cuantificación del tamaño alveolar mediante la selección de 20 posiciones aleatorias en cada corte de tejido pulmonar para muestras humanas, de cerdo y de ratón. Se utilizaron histogramas para ilustrar la distribución del tamaño alveolar dentro de cada grupo. Barras de escala = 50 μm (A-F, H-L), 100 μm (G). Prueba de Kruskall-Wallis. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001. Abreviaturas: DAPI = 4′,6-diamidino-2-fenilindol; LEA = lectina de Lycopersicon Esculentum; AME = actina del músculo liso; ms = ratón; hmn = humano. Haga clic aquí para ver una versión más grande de esta figura.
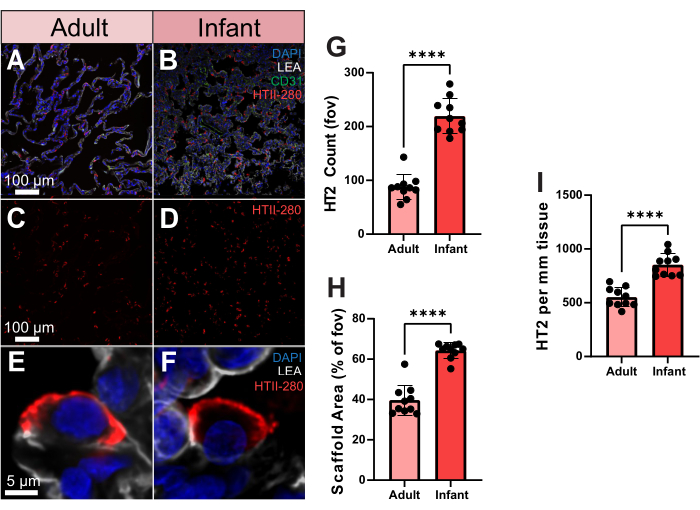
Figura 3. Distribución de neumocitos tipo 2 en muestras humanas adultas y lactantes. (A,B) Imágenes representativas de tejido pulmonar humano adulto y infantil teñido para HTII-280 (mostrado en rojo), CD31 (mostrado en verde) y LEA (mostrado en gris). (C,D) Imágenes representativas de adultos y bebés humanos que muestran la distribución de neumocitos tipo 2 solamente. (E,F) Imágenes representativas de resolución de una sola célula de un neumocito tipo 2 individual a partir de muestras de pulmón humano adulto y lactante. (G) Cuantificación del número de neumocitos tipo 2 entre muestras de adultos y lactantes. (H) Cuantificación de la cobertura del área del andamio del tejido pulmonar (% frente al aire) en muestras de adultos y bebés. (I) Cuantificación de neumocitos tipo 2 pormm2 de tejido en muestras de adultos y lactantes. Barras de escala = 5 μm (E,F), 100 μm (A-D). n = 10 fov por muestra. Prueba t no apareada o prueba de Mann-Whitney. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001. Abreviaturas: DAPI = 4', 6-diamidino-2-fenilindol; LEA = lectina de Lycopersicon Esculentum; HTII = células humanas tipo II; CD31 = molécula de adhesión de células endoteliales plaquetarias-1/grupo de diferenciación 31; FOV = campo de visión. Haga clic aquí para ver una versión más grande de esta figura.
Video complementario S1: Video de un volumen de imagen de 20 μm de una sola vía aérea porcina teñida con DAPI, LEA, SMA y elastina que muestra una vista de alta resolución de la estructura de los elementos de la pared de la vía aérea. Abreviaturas: DAPI = 4′,6-diamidino-2-fenilindol; LEA = lectina de Lycopersicon Esculentum; AME = actina del músculo liso. Haga clic aquí para descargar este archivo.
Video complementario S2: Video de un volumen de imagen de 30 μm de un solo alvéolo teñido con DAPI, LEA y HTII-280 que muestra la distribución de neumocitos tipo 2 a través de la estructura. Abreviaturas: DAPI = 4′,6-diamidino-2-fenilindol; LEA = lectina de Lycopersicon Esculentum; AME = actina del músculo liso. Haga clic aquí para descargar este archivo.
Discusión
En este protocolo, presentamos un método mejorado basado en el vibratomo para generar secciones pulmonares. En comparación con las técnicas de procesamiento basadas en parafina, este método es más rentable, eficiente en el tiempo y mejor para el medio ambiente22. Además, este método ayuda a mantener la integridad estructural de los cortes de tejido pulmonar y permite obtener imágenes avanzadas de inmunofluorescencia sin necesidad de recuperar antígenos. Sin embargo, durante nuestros experimentos, también encontramos ciertas limitaciones en este flujo de trabajo. Los pulmones enfermos pueden interferir con el proceso de corte debido a la destrucción del tejido causada por cambios patológicos. Al usar el vibratomo para seccionar, las obstrucciones de las vías respiratorias y el tejido pulmonar fibrótico severo pueden impedir la hoja, lo que hace que el proceso de cortar estos tejidos sea más desafiante. Sin embargo, esto se puede superar reduciendo la velocidad de la cuchilla y sosteniendo el tejido con un pincel fino. Desafíos similares surgen del engrosamiento de la pleura, que es un resultado común en la pleuresía, la enfermedad pulmonar obstructiva crónica (EPOC) y la fibrosis pulmonar idiopática (FPI)23,24,25. Si la pleura no es de interés para un experimento, recomendamos extirparla antes de seccionarla o aislarla a una distancia de un volumen pulmonar de la pleura. Si la pleura es necesaria, se puede cortar con una manipulación similar a la anterior, que implica velocidades de cuchilla más lentas y soporte de corte con un cepillo fino.
Si bien los cortes pulmonares cortados con precisión pueden preservar la arquitectura tridimensional y el entorno nativo del pulmón26, es importante tener en cuenta que la generación de PCLS es un proceso complejo y que requiere mucho tiempo. El éxito de la generación de cortes de tejido pulmonar depende en gran medida de la eficiencia del relleno de agarosa, que, a su vez, está influenciada por la presencia de pleura intacta y sitios de inyección viables en el tejido obtenido. Esto es fácil de lograr en roedores, ya que la agarosa puede introducirse fácilmente a través de la tráquea en los pulmones intactos27,28,29. Sin embargo, en la investigación con animales grandes, las biopsias tomadas a través de un experimento son típicamente de segmentos pulmonares distales, que carecen de una vía aérea lo suficientemente grande como para canular30,31. Por lo tanto, en lugar de inyectar agarosa en los bronquios o los vasos sanguíneos, adoptamos este método en el que el tejido pulmonar, independientemente de la especie de origen o el volumen de la muestra, se incrusta en agarosa de bajo punto de fusión para generar cortes de tejido pulmonar. Este enfoque es técnicamente más fácil y tiene como objetivo minimizar el daño tisular tanto como sea posible. Según nuestra experiencia, este método ha demostrado una mayor eficiencia y facilidad en la generación de secciones de tejido pulmonar. Preserva eficazmente la morfología de los alvéolos y es especialmente adecuado para cortar el tejido pulmonar, lo que permite la generación de imágenes de fluorescencia multiplex de alta resolución repetibles.
En este estudio, demostramos además dos cuantificaciones basadas en muestras para los datos de imágenes generados. El primero utilizó el rastreo de imágenes para evaluar las diferencias en el tamaño alveolar entre las muestras de especies. Como era de esperar, los alvéolos de ratón fueron los más pequeños, mientras que los alvéolos de cerdo y humanos fueron similares en tamaño, lo que destaca a los cerdos como un modelo traslacional interesante para la investigación pulmonar.
Para la segunda cuantificación, comparamos la distribución de HTII entre una muestra pulmonar de adulto y de lactante. Los neumocitos de tipo 2 desempeñan un papel vital en la estructura del epitelio pulmonar distal. Esta capacidad única de las TIIs contribuye a la reparación y regeneración del epitelio alveolar32. En el pulmón humano adulto sano, las ITI representan aproximadamente el 15% de la población celular total, mientras que su cobertura de la superficie alveolar se estima en torno al 5%33. HTII-280 es un marcador pulmonar específico ampliamente reconocido para estudiar el desarrollo y la respuesta de las células epiteliales alveolares a la lesión, y se localiza específicamente en las membranas plasmáticas apicales de las ITI. En el experimento, se obtuvo tejido adulto de un paciente donante que falleció debido a una hemorragia intracerebral y tuvo una lesión pulmonar concurrente, mientras que la muestra infantil provino de una mortalidad relacionada con la asfixia. Nuestros hallazgos indican que la expresión de HTII-280 fue significativamente menor en la muestra de pulmón adulto que en la muestra infantil. Curiosamente, mientras que HTII-280 se expresa en la mayoría de los HTII, su expresión también puede estar influenciada por la calidad del tejido, y se reduce significativamente en el tejido pulmonar humano lesionado34. Los tejidos pulmonares envejecidos exhiben una disminución significativa en el número y la actividad secretora de las ITI en comparación con los tejidos jóvenes, y los individuos de edad avanzada muestran una proliferación, secreción y actividad antiapoptótica considerablemente menor de las ITI en comparación con los tejidos jóvenes35. De acuerdo con esto, la identificación y detección de una proteína de la superficie celular específica para las ITI humanas podría ayudar a evaluar la gravedad de la lesión pulmonar y evaluar los enfoques de tratamiento destinados a mejorar la reparación pulmonar36,37. Por lo tanto, utilizando esta tubería, sería de gran interés realizar estudios de TII alveolares en cohortes humanas más grandes de salud y enfermedad.
En conclusión, este protocolo presenta un enfoque más rápido y fácil para cortar el tejido pulmonar. Este método proporciona instrucciones detalladas para la preparación, el corte y la tinción del tejido pulmonar, lo que garantiza la preservación de la estructura intacta del tejido pulmonar. Optimiza el modelo para estudiar la arquitectura pulmonar sana y enferma, lo que conduce a una mayor eficiencia experimental. En general, este estudio presenta un enfoque prometedor para investigar la biología espacial compleja en la fisiopatología del tejido pulmonar en todas las especies, lo que puede ayudar a comprender mejor los mecanismos moleculares que intervienen en la enfermedad y la reparación.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los autores agradecen la financiación recibida de la Fundación Wallenberg de Medicina Molecular y el Centro de Células Madre de la Universidad de Lund y agradecen al Centro de Bioimágenes de la Universidad de Lund (LBIC) por el acceso a la Nikon A1RHD.
Materiales
| Name | Company | Catalog Number | Comments |
| 24 well tissue culture inserts | SARSTEDT | 83.3932.300 | |
| 4% paraformaldehyde | SOLVECO | 6095714 | |
| 4’, 6-diamidino-2-phenylindole (DAPI) | Thermo Fisher scientific | D1306 | |
| 50 mL Falcon tube | SARSTEDT | 2045221 | |
| Cluster of differentiation 31 (CD31) | Abcam | ab28364 | |
| Confocal microscope | Nikon | A1R HD25 | |
| Elastin | Abcam | ab23747 | |
| Epredia X1000 Coverslip | Thermo Fisher scientific | 10318963 | |
| Epredia SuperFrost Plus Adhesion slides | Thermo Fisher scientific | 10149870 | |
| Forceps | AESCULAP | FB395R | |
| Goat anti-mouse 647 | Invitrogen | A21235 | |
| Goat anti-rabbit 568 | Invitrogen | A11011 | |
| Human type II cells | Terrace Biotech | TB-27AHT2-280 | |
| Invitrogen Fluoromount-G Mounting Medium | Thermo Fisher scientific | E41473 | |
| Low gelling temperature Agarose | Sigma-Aldrich | 1003467046 | |
| Lycopersicon Esculentum lectin | Thermo Fisher scientific | 2531965 | |
| Phosphate-buffered saline (PBS) | Thermo Fisher scientific | 50-100-8798 | |
| Plastic cup | kontorsgiganten | 885221 | |
| Scissors | STILLE | 101-8380-18 | |
| Smooth muscle actin | Abcam | ab5694 | |
| Sodium azide | Sigma-Aldrich | K54329188239 | |
| Super glue | LOCTITE | 2721643 | |
| Vibrating microtome | Leica | VT1200S |
Referencias
- Morin, J. P., et al. Precision cut lung slices as an efficient tool for in vitro lung physio-pharmacotoxicology studies. Xenobiotica. 43 (1), 63-72 (2013).
- Kawasaki, H., et al. The NanoSuit method: a novel histological approach for examining paraffin sections in a nondestructive manner by correlative light and electron microscopy. Laboratory Investigation. 100 (1), 161-173 (2020).
- Silva, I., et al. A Semi-quantitative scoring system for green histopathological evaluation of large animal models of acute lung injury. BIO-PROTOCOL. 12 (16), e4493 (2022).
- Kim, J. H., et al. Optimizing tissue-clearing conditions based on analysis of the critical factors affecting tissue-clearing procedures. Scientific Reports. 8 (1), 12815 (2018).
- Jain, D., et al. Immunocytochemistry for predictive biomarker testing in lung cancer cytology. Cancer Cytopathology. 127 (5), 325-339 (2019).
- Alturkistani, H. A., Tashkandi, F. M., Mohammedsaleh, Z. M. Histological stains: a literature review and case study. Global Journal of Health Science. 8 (3), 72-79 (2015).
- Morrison, L. E., Lefever, M. R., Lewis, H. N., Kapadia, M. J., Bauer, D. R. Conventional histological and cytological staining with simultaneous immunohistochemistry enabled by invisible chromogens. Laboratory Investigation. 102 (5), 545-553 (2022).
- Dineshshankar, J., et al. Kerosene as an alternative to xylene in histopathological tissue processing and staining: An experimental study. Journal of Pharmacy and Bioallied Sciences. 11 (6), 376 (2019).
- Abdelaal, H. M., et al. Comparison of vibratome and compresstome sectioning of fresh primate lymphoid and genital tissues for in situ MHC-tetramer and immunofluorescence staining. Biological Procedures Online. 17 (1), 2 (2015).
- Siwczak, F., Hiller, C., Pfannkuche, H., Schneider, M. R. Culture of vibrating microtome tissue slices as a 3D model in biomedical research. Journal of Biological Engineering. 17 (1), 36 (2023).
- Bèchet, N. B., Shanbhag, N. C., Lundgaard, I. Glymphatic pathways in the gyrencephalic brain. Journal of Cerebral Blood Flow & Metabolism. 41 (9), 2264-2279 (2021).
- Bèchet, N. B., Kylkilahti, T. M., Mattsson, B., Petrasova, M., Shanbhag, N. C., Lundgaard, I. Light sheet fluorescence microscopy of optically cleared brains for studying the glymphatic system. Journal of Cerebral Blood Flow and Metabolism. 40 (10), 1975-1986 (2020).
- Bai, Y., Ai, X. Utilizing the precision-cut lung slice to study the contractile regulation of airway and intrapulmonary arterial smooth muscle. Journal of Visualized Experiments. (183), (2022).
- Gerckens, M., et al. Generation of human 3D lung tissue cultures (3D-LTCs) for disease modeling. Journal of Visualized Experiments. (144), (2019).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulmonary Pharmacology & Therapeutics. 24 (5), 452-465 (2011).
- Lam, M., Lamanna, E., Organ, L., Donovan, C., Bourke, J. E. Perspectives on precision cut lung slices—powerful tools for investigation of mechanisms and therapeutic targets in lung diseases. Frontiers in Pharmacology. 14, 1162889 (2023).
- Liu, G., et al. Use of precision cut lung slices as a translational model for the study of lung biology. Respiratory Research. 20 (1), 162 (2019).
- Cooper, P. R., et al. Formoterol and salmeterol induce a similar degree of β 2- adrenoceptor tolerance in human small airways but via different mechanisms. British Journal of Pharmacology. 163 (3), 521-532 (2011).
- Ochoa, L. F., et al. Imaging of murine whole lung fibrosis by large scale 3D microscopy aided by tissue optical clearing. Scientific Reports. 8 (1), 13348 (2018).
- Tehrani, K. F., Park, J., Chaney, E. J., Tu, H., Boppart, S. A. Nonlinear imaging histopathology: a pipeline to correlate gold-standard hematoxylin and eosin staining with modern nonlinear microscopy. IEEE Journal of Selected Topics in Quantum Electronics. 29 (4), (2023).
- Branchfield, K., et al. A three-dimensional study of alveologenesis in mouse lung. Developmental Biology. 409 (2), 429-441 (2016).
- Li, Y., et al. Precision vibratome for high-speed ultrathin biotissue cutting and organ-wide imaging. iScience. 24 (9), 103016 (2021).
- Qian, G., et al. DOCK2 promotes pleural fibrosis by modulating mesothelial to mesenchymal transition. American Journal of Respiratory Cell and Molecular Biology. 66 (2), 171-182 (2022).
- Cagle, P. T., Allen, T. C. Pathology of the pleura: What the pulmonologists need to know. Respirology. 16 (3), 430-438 (2011).
- Jantz, M. A., Antony, V. B. Pleural fibrosis. Clinics in Chest Medicine. 27 (2), 181-191 (2006).
- Viana, F., O’Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Molecular Microbiology. 117 (3), 578-588 (2022).
- Paddenberg, R., Mermer, P., Goldenberg, A., Kummer, W. Videomorphometric analysis of hypoxic pulmonary vasoconstriction of intra-pulmonary arteries using murine precision cut lung slices. Journal of Visualized Experiments. (83), e50970 (2014).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465 (2017).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. Journal of Visualized Experiments. (171), e62392 (2021).
- Ghaidan, H., et al. Reduction of primary graft dysfunction using cytokine adsorption during organ preservation and after lung transplantation. Nature Communications. 13 (1), 1-15 (2022).
- Guenthart, B. A., et al. Regeneration of severely damaged lungs using an interventional cross-circulation platform. Nature Communications. 10 (1), 1985 (1985).
- Ruaro, B., et al. The history and mystery of alveolar epithelial type II cells: focus on their physiologic and pathologic role in lung. International Journal of Molecular Sciences. 22 (5), 2566 (2021).
- Crapo, J. D., Barry, B. E., Gehr, P., Bachofen, M., Weibel, E. R. Cell number and cell characteristics of the normal human lung. The American Review of Respiratory Disease. 126 (2), 332-337 (1982).
- Evans, K. V., Lee, J. -. H. Alveolar wars: The rise of in vitro models to understand human lung alveolar maintenance, regeneration, and disease. Stem Cells Translational Medicine. 9 (8), 867-881 (2020).
- Chen, J. -. X., et al. Sirtuin 3 ameliorates lung senescence and improves type II alveolar epithelial cell function by enhancing the FoxO3a-dependent antioxidant defense mechanism. Stem Cells and Development. 30 (17), 843-855 (2021).
- Zacharias, W. J., et al. Regeneration of the lung alveolus by an evolutionarily conserved epithelial progenitor. Nature. 555 (7695), 251-255 (2018).
- Gonzalez, R. F., Allen, L., Gonzales, L., Ballard, P. L., Dobbs, L. G. HTII-280, a biomarker specific to the apical plasma membrane of human lung alveolar type II cells. Journal of Histochemistry & Cytochemistry. 58 (10), 891-901 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados