Method Article
用于多重荧光成像的琼脂糖包埋肺组织的自动振动切片机切片
摘要
我们开发了一种组织处理技术,利用振动切片机和琼脂糖包埋的肺组织来生成肺切片,从而可以获取肺结构的高分辨率图像。我们采用免疫荧光染色来观察使用特定肺结构标志物的空间蛋白表达。
摘要
由于其固有的结构脆弱性,肺被认为是更难处理的显微读数组织之一。为了增加切片的结构支持,通常将肺组织碎片包埋在石蜡或OCT化合物中,并分别用切片机或低温恒温器切割。一种较新的技术,称为精确切割肺切片,通过琼脂糖浸润为新鲜肺组织增加结构支持,并提供了一个平台来维持培养中的原发性肺组织。然而,由于表位掩蔽和组织畸变,这些技术都不足以开发可重复的先进光成像读数,这些读数在多种抗体和物种之间兼容。
为此,我们开发了一种组织处理管道,该管道利用固定肺组织的琼脂糖包埋,并结合自动振动切片机切片。这有助于在小鼠、猪和人肺中生成厚度为 200 μm 至 70 μm 的肺切片,这些切片不需要抗原检索,并且是天然分离组织的"加工"最少的版本。使用这些切片,我们揭示了一种能够生成高分辨率图像的多重成像读数,其空间蛋白表达可用于量化和更好地了解肺损伤和再生的潜在机制。
引言
离体肺组织切片广泛用于肺部疾病的研究1.目前的金标准,特别是在临床和转化大型动物研究中,采用苏木精和伊红染色,结合明场显微镜和基于观察者的评分来评估和分级肺功能障碍 2,3。虽然它仍然是一种有价值的技术,但它在空间分辨率和可以同时成像的标记数量方面表现出局限性。此外,肺组织需要进行大量的溶剂型洗涤,这会导致组织在最终成像前脱水、收缩和再水化4.这个过程不仅耗时,而且对环境不友好,掩盖蛋白质表位,并可能引起结构组织变化5,6,7,8。然而,对于肺组织,由于肺的结构脆弱性,在切片前包埋石蜡是必要的。相反,实体器官(如大脑)可以使用振动切片机(vibratome)切割,无论是在固定组织还是新鲜组织9,10,11,12中。
为了在肺组织中进行振动切片机切片,建立了一种称为精确切割肺切片 (PCLS) 的方法,其中低熔点琼脂糖通过气道或血管注射到新鲜肺组织中并使其固化13,14。气道中的琼脂糖提供了足够的结构支撑,然后允许振动切片机切片 9,14。在啮齿动物中,这很容易实现,因为琼脂糖可以通过气管注射;然而,在猪和人体组织中,在给定的活检中定位合适的气道/血管可能具有挑战性15,16。此外,即使定位了这样的气道/血管,通常也需要很大的力来注射琼脂糖,这可能会影响随后的肺形态17.
为了克服石蜡包埋/切片/染色和 PCLS 工作流程中遇到的挑战,我们建立了用于固定肺组织的新处理管道。该工作流程允许使用振动切片机进行切片,可以产生比 PCLS 更薄的切片,并且产生的切片不需要抗原检索即可进行多重荧光成像。这种方法提供了一种"最少处理"的方法,可以生成可用于高级光学显微镜的肺切片。此外,成像读数可用于通过捕获组织的体积结构来证明肺组织内细胞和解剖结构的空间关系18,19,20,21。本文描述了生成这些肺切片的方案,并演示了应用于每个组织的多重染色,以及如何将这些先进的成像数据用于定量。
研究方案
小鼠肺是由研究人员使用其他器官系统捐赠的,以维护3R。猪的所有程序均按照欧洲指令 2010/63/EU 进行,并得到马尔默-隆德动物研究伦理委员会 (Dnr 5.8.18-05527/2019) 的批准,并根据瑞典研究委员会的 CODEX 指南进行。瑞典国家伦理委员会(Dnr 2020-07115 和 Dnr 2020-01864)批准了使用人体样本。有关本协议中使用的所有材料和仪器的详细信息,请参阅 材料表 。
1. 溶液和材料的准备
- 将肺组织在室温下固定在4%多聚甲醛中48小时。随后,将肺组织转移到装有含有 0.01% 叠氮化钠的磷酸盐缓冲盐水 (PBS) 的 50 mL 锥形管中。
- 通过将 1.5 g 低熔点琼脂糖溶解在 50 mL 无菌 PBS 中来制备 3% (w/v) 琼脂糖溶液。准备好一个塑料杯、细镊子和无菌剪刀。
- 在微波炉中加热琼脂糖至沸腾,然后在水浴中冷却至42°C。将琼脂糖储存在水浴中,直到准备好使用,以保持其液体形式。
注意: 加热琼脂糖时,观察微波炉直到它开始沸腾,以免溢出。这通常需要大约 1.5 分钟。
2.嵌入琼脂糖的肺组织
- 从PBS-叠氮化物中取出肺活检,并使用细镊子和无菌剪刀仔细解剖肺叶。将肺叶切成小块。
注意:虽然可以用胸膜切片,但其厚的弹性蛋白束会阻碍使用振动切片机刀片进行切割。因此,如果没有必要,我们建议将其删除。 - 将一个塑料杯切开,并在其底部加入少量琼脂糖。将50mL锥形管(边缘去除)的盖子放在琼脂糖的表面上,并将杯子在4°C下储存5分钟,以使琼脂糖凝固以备后用。
- 从4°C冰箱中取出塑料杯,在盖子上加入约1mL液体琼脂糖,然后轻轻地将肺组织块放在盖子上。将琼脂糖放置2-3分钟,使其在室温下半固化。然后,慢慢地将液体琼脂糖倒在肺组织上,直到它完全浸没。
- 在4°C下冷藏约15分钟,直到琼脂糖凝固。接下来,小心地使用锋利的刀片去除肺组织周围多余的琼脂糖,在组织周围留下约5毫米厚的均匀层(图1)。
3.切开肺组织切片
- 为了准备肺组织进行切片,使用强力胶将每个组织块附着在振动切片机的标本盘上。接下来,用PBS填充振动切片机缓冲托盘,并将冰块放入周围的冰浴中。最后,小心地将样品盘安装到缓冲托盘中。
- 用振动切片机切片肺组织,设置如下: 厚度:200μm,频率:100Hz,刀片振幅:1.3mm,刀片的前进速度为0.02-0.03mm/s,这取决于组织刚度。
注意: 如果刀片速度降低到 70 mm/s,则可以切割到 0.01 μm 的厚度。某些振动切片机(例如徕卡 V1200)允许通过设置切割窗口来自动切片。 - 要收集切片,用刷子将组织切片从振动切片机托盘中舀入装有 0.01% 叠氮化物 PBS 的 24 孔板中,轻轻地转移组织切片。最后,将肺切片保存在4°C。
4. 弹性蛋白、CD31、HTII-280和SMA的免疫染色
- 在4°C下轻轻摇动45分钟,通透并封闭(1%牛血清白蛋白+ 0.5%Triton + 5%正常山羊血清)组织。
- 稀释一抗(SMA 1:500;弹性蛋白1:250;CD31 1:250;HTII-280 1:250)在PBS中,每孔中加入300μL,并在4°C下轻轻摇动孵育过夜。
- 在不接触切片并用移液器吸头去除一抗的情况下,用PBS洗涤3 x 20分钟(400μL)。
- 在PBS中稀释二抗(1:1000),每孔中加入300μL,并在4°C下轻轻摇动孵育90分钟。
- 用移液器吸头除去二抗,加入 4',6-二脒基-2-苯基吲哚 (DAPI)(1:1000) 和番茄凝集素-488 (1:500) 孵育 30 分钟,并用 PBS 洗涤 3 x 10 分钟。
- 在载玻片上滴三滴封片剂,装上盖玻片,然后进行成像。
结果
生成肺组织切片的过程涉及几个关键步骤,包括制备、包埋和切片。琼脂糖溶液(3%(w / v)是通过将1.5g低熔点琼脂糖溶解在50mL无菌PBS中制成的。所需的耗材包括塑料杯、50 mL 锥形管盖(边缘取下)、镊子和剪刀。用细镊子和无菌剪刀小心地将肺组织切除成更小的块(图1A,B)。接下来,为了嵌入肺组织块,在杯的底部填充少量琼脂糖,在琼脂糖的表面上盖上盖子,并将杯子在4°C下储存5分钟(图1C)。将约1mL液体琼脂糖加入盖子中,并将肺组织块放在盖子上。将琼脂糖放置2-3分钟,在室温下半固化(图1D)。一旦肺阻滞被半固化的琼脂糖固定到位,然后将液体琼脂糖倒入杯中,直到肺组织阻滞完全浸没。将其储存在4°C下15分钟(图1E,F)。低熔点琼脂糖包埋为肺组织提供必要的支撑和刚度,有助于在切片过程中保持其原始结构。锋利的刀片用于去除肺组织周围多余的琼脂糖。在组织周围留下约5mm厚的均匀层(图1G)。然后将切除的肺组织块小心地粘在组织支架上(图1H)。振动切片机缓冲托盘充满PBS,将冰置于周围的冰浴中,并将样品盘安装在缓冲托盘中(图1I)。面板上设置的振动切片机切割参数为:切片厚度:200 μm;频率:100赫兹;刀片振幅:1.3mm;刀片的前进速度:0.02-0.03 mm/s,这取决于组织刚度(图1J)。最后,在自由浮动的切片上进行染色(图1K-M)。
对每个物种的 200 μm 切片进行免疫荧光染色,以检测平滑肌肌动蛋白(SMA,平滑肌细胞和肌成纤维细胞标志物)、弹性蛋白(细胞外基质蛋白)和与支气管肺泡上皮细胞结合的 Lycopersicon Esculentum 凝集素 (LEA)。肺是一种结构异质的组织,因此,在小鼠、猪和人类的肺泡管、血管、肺内细支气管和肺泡等结构中观察到不同的 SMA 和弹性蛋白分布(图 2A-L)。20 μm 毛细支气管体积的高分辨率渲染显示了如何在半三维水平上检查肺内的精细结构(补充视频 S1)。作为一个定量的例子,利用图像追踪,我们展示了样本之间肺泡的大小如何不同(n = 20个肺泡)(图2L,M)。
为了展示如何定量利用这些先进的成像数据,我们比较了成人和婴儿在人肺组织中的2型肺细胞(TII)细胞分布。人类特异性 2 型肺泡细胞抗体 HTII-280 对人 2 型细胞表面具有很强的亲和力(图 3A-F)。可以使用体积成像在单个肺泡的三维空间中进一步观察这些细胞(补充视频S2)。为了量化成人和婴儿样本之间的 TII 数,我们在 10 个随机视野 (fov) 中处理了 HTII-280 计数。在这些样本之间,婴儿样本产生的TII细胞计数明显更高(图3G)。然而,婴儿样本的支架覆盖率也明显高于成人,这可以解释更高的细胞数量(图3H)。为了解决这个问题,我们随后根据支架覆盖率评估了 TII 的数量,即每 mm2 组织的细胞,这些细胞在婴儿样本中仍然保持显着更高的 TII 数量(图 3I)。因此,婴儿样本中较高的 TII 计数不是由于支架覆盖率增加,而是强调了根据支架面积而不是整体 fov 评估肺细胞分布的重要性。

图1:切割肺组织切片的方案。 (A) 溶液和材料:将 1.5 g 低熔点琼脂糖溶解在 50 mL 无菌磷酸盐缓冲盐水中获得的 3% (w/v) 琼脂糖溶液;一个塑料杯;50 mL 锥形管的盖子;镊子和剪刀。(B)用细镊子和无菌剪刀解剖肺组织。(C)在杯底装满少量琼脂糖,盖子放在琼脂糖表面;然后,将其在4°C下储存5分钟。 (D)将1-2mL液体琼脂糖缓慢加入盖子中,小心地将肺组织块放在盖子上,并在4°C下储存2分钟。 (E,F)将液体琼脂糖倒入杯中,直到肺组织块完全浸没,将其在4°C下储存15分钟, 然后轻轻地打碎塑料杯。(G) 使用锋利的刀片去除肺组织周围多余的琼脂糖,在组织周围留下一层约 5 毫米厚的均匀层。(H) 然后将切除的肺组织块小心地粘在组织支架上。(I) 用PBS填充振动切片机缓冲托盘,将冰块放入周围的冰浴中,并将标本盘安装到缓冲托盘中。(J)在振动切片机面板上设置切割参数;切片厚度:200 μm,频率:100 Hz,刀的振幅:1.3 mm,刀片的前进速度为 0.02-0.04 mm/s。 (K-M) 自由漂浮切片的代表性图像,该切片仍包埋在琼脂糖中并准备进行免疫荧光染色。请点击这里查看此图的较大版本.
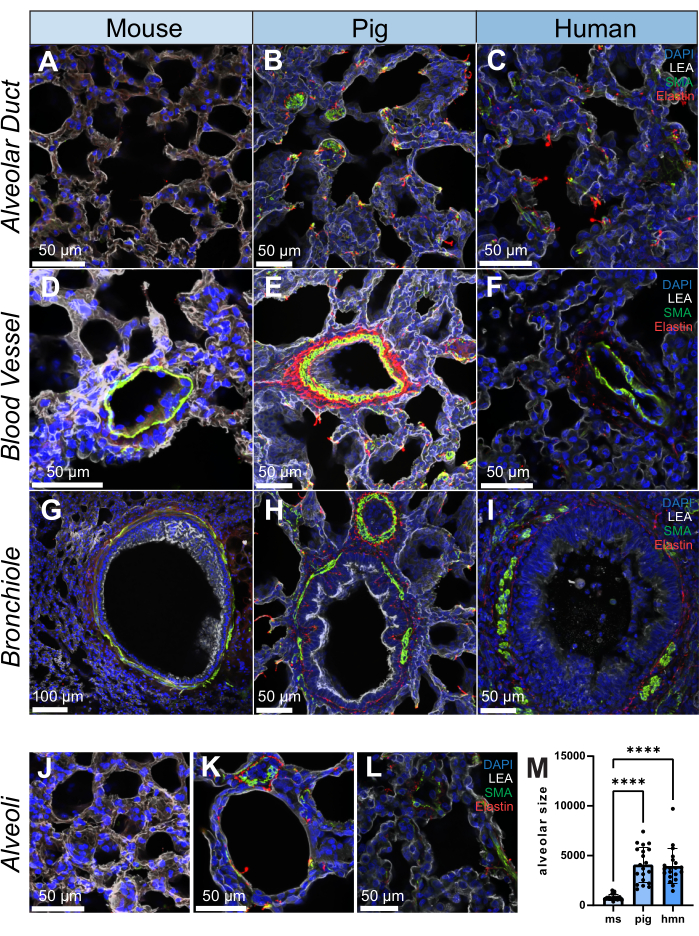
图2:人、猪和小鼠肺结构的免疫荧光图像。 (A-L) 分别来自小鼠、猪和人的肺组织切片中肺泡管、血管、细支气管和肺泡的代表性图像。SMA(以绿色显示)是平滑肌细胞的标志物,在肺组织的血管和支气管壁中观察到。弹性蛋白(以红色显示)是肺细胞外基质的一部分。(M) 通过在人、猪和小鼠样本的每个肺组织切片上选择 20 个随机位置来定量肺泡大小。使用直方图来说明每组内肺泡大小的分布。比例尺 = 50 μm(AF、H-L)、100 μm(G)。Kruskall-Wallis 检验 *p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001。缩写:DAPI = 4′,6-二脒基-2-苯基吲哚;LEA = Lycopersicon Esculentum 凝集素;SMA = 平滑肌肌动蛋白;ms = 鼠标;HMN = 人类。请点击这里查看此图的较大版本.
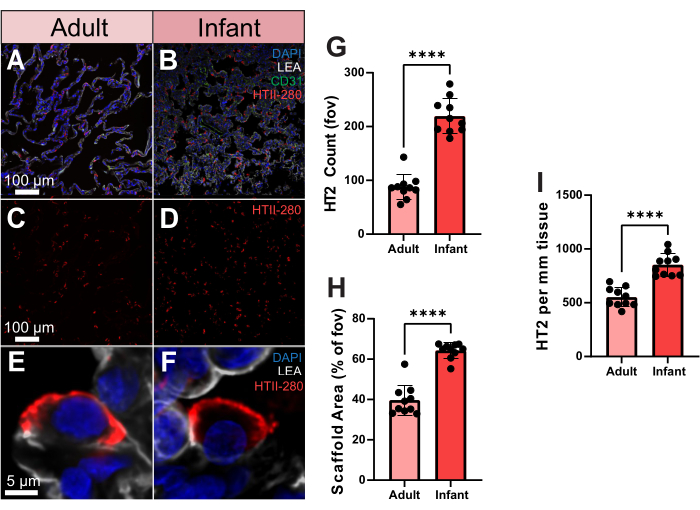
图3.2 型肺细胞在人类、成人和婴儿样本中的分布。(甲,乙)HTII-280(红色显示)、CD31(绿色显示)和 LEA(灰色显示)染色的成人和婴儿人类肺组织的代表性图像。(三、四) 成人和婴儿的代表性图像,仅显示 2 型肺细胞分布。(E,F)来自成人和婴儿人类肺部样本的单个 2 型肺细胞的单细胞分辨率代表性图像。(G) 定量成人和婴儿样本中 2 型肺细胞的数量。(H) 成人和婴儿样本中肺组织支架面积覆盖率(% 与空气)的量化。(I) 成人和婴儿样本中每 mm 2 组织中2 型肺细胞的定量。比例尺 = 5 μm (E,F), 100 μm (A-D)。n = 每个样本 10 个 FOV。未配对 t 检验或 Mann-Whitney 检验。 *p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001。缩写:DAPI = 4',6-二脒基-2-苯基吲哚;LEA = Lycopersicon Esculentum 凝集素;HTII = 人 II 型细胞;CD31 = 血小板内皮细胞粘附分子-1/分化簇 31;FOV = 视野。请点击这里查看此图的较大版本.
补充视频S1: 使用 DAPI、LEA、SMA 和弹性蛋白染色的单个猪气道的 20 μm 成像体积的视频显示了气道壁元件结构的高分辨率视图。缩写:DAPI = 4′,6-二脒基-2-苯基吲哚;LEA = Lycopersicon Esculentum 凝集素;SMA = 平滑肌肌动蛋白。 请点击这里下载此文件。
补充视频 S2: 使用 DAPI、LEA 和 HTII-280 染色的单个肺泡的 30 μm 成像体积的视频显示 2 型肺细胞在整个结构中的分布。缩写:DAPI = 4′,6-二脒基-2-苯基吲哚;LEA = Lycopersicon Esculentum 凝集素;SMA = 平滑肌肌动蛋白。 请点击这里下载此文件。
讨论
在该协议中,我们提出了一种改进的基于振动切片机的肺切片生成方法。与基于石蜡的加工技术相比,这种方法更具成本效益、更省时、更环保22。此外,这种方法有助于保持肺组织切片的结构完整性,并允许在不需要抗原检索的情况下进行先进的免疫荧光成像。然而,在我们的实验中,我们也发现这个工作流程存在一些局限性。病变的肺部会由于病理变化引起的组织破坏而干扰切割过程。在使用振动切片机进行切片时,气道阻塞和严重的纤维化肺组织会阻碍刀片,使切片这些组织的过程更具挑战性。然而,这可以通过降低刀片速度和用细画笔支撑组织来克服。胸膜增厚也带来了类似的挑战,这是胸膜炎、慢性阻塞性肺疾病 (COPD) 和特发性肺纤维化 (IPF) 的常见结果23,24,25。如果对实验不感兴趣,我们建议在切片前将其切除,或通过隔离远离胸膜的肺容积将其切除。如果胸膜是必要的,那么可以使用与上述类似的操作对其进行切片,包括较慢的刀片速度和细刷的切片支撑。
虽然精确切割的肺切片可以保留肺的三维结构和天然环境26,但重要的是要注意,生成 PCLS 是一个复杂且耗时的过程。生成肺组织切片的成功很大程度上取决于琼脂糖填充的效率,而琼脂糖填充的效率又受到所获得组织中完整胸膜和活注射部位的影响。这在啮齿动物中很容易实现,因为琼脂糖可以很容易地通过气管进入完整的肺部27,28,29。然而,在大型动物研究中,在整个实验中进行的活检通常来自远端肺段,这些肺段缺乏足够大的气道来插管30,31。因此,我们不是将琼脂糖注射到支气管或血管中,而是采用这种方法,将肺组织(无论来源或样本量如何)嵌入低熔点琼脂糖中以产生肺组织切片。这种方法在技术上更容易,旨在尽可能减少组织损伤。根据我们的经验,这种方法在生成肺组织切片方面表现出更高的效率和便利性。它有效地保留了肺泡的形态,特别适用于切割肺组织,能够产生可重复的高分辨率多重荧光成像。
在这项研究中,我们进一步展示了两种基于样本的定量方法。第一个利用图像追踪来评估不同物种样本的肺泡大小差异。不出所料,小鼠肺泡最小,而猪和人肺泡的大小相似,这突出了猪作为肺部研究的有趣转化模型。
对于第二次定量,我们比较了成人和婴儿肺样本之间的HTII分布。2 型肺细胞在远端肺上皮的结构中起着至关重要的作用。TII 的这种独特能力有助于肺泡上皮32 的修复和再生。在健康的成人肺中,TII约占总细胞群的15%,而它们对肺泡表面积的覆盖率估计约为5%33。HTII-280 是一种被广泛认可的肺特异性标志物,用于研究肺泡上皮细胞对损伤的发育和反应,它特异性定位于 TII 的顶端质膜。在实验中,成人组织来自一名因脑出血死亡并发肺损伤的供体患者,而婴儿样本来自与窒息相关的死亡率。我们的研究结果表明,HTII-280在成人肺样本中的表达明显低于婴儿样本。有趣的是,虽然HTII-280在大多数HTII中表达,但其表达也会受到组织质量的影响,并且在受伤的人肺组织中显着降低34。与年轻组织相比,老年肺组织表现出 TII 的数量和分泌活性显着降低,与这些年轻组织相比,老年人表现出 TII 的增殖、分泌和抗凋亡活性要低得多35。与此一致,对人类 TII 特异性的细胞表面蛋白的鉴定和检测可能有助于评估肺损伤的严重程度并评估旨在增强肺修复的治疗方法36,37。因此,利用这一管道,在更大的人类健康和疾病队列中进行肺泡 TII 研究将非常有趣。
总之,该协议提供了一种更快,更简单的切割肺组织的方法。该方法为肺组织的制备、切割和染色提供了详细的说明,确保了完整的肺组织结构的保存。它优化了研究健康和患病肺结构的模型,从而提高了实验效率。综上所述,本研究为跨物种肺组织病理生理学的复杂空间生物学研究提供了一种很有前途的方法,有助于更好地理解在疾病和修复中起作用的分子机制。
披露声明
作者没有利益冲突需要披露。
致谢
作者非常感谢瓦伦堡分子医学基金会和隆德大学干细胞中心提供的资助,并感谢隆德大学生物成像中心(LBIC)获得尼康A1RHD。
材料
| Name | Company | Catalog Number | Comments |
| 24 well tissue culture inserts | SARSTEDT | 83.3932.300 | |
| 4% paraformaldehyde | SOLVECO | 6095714 | |
| 4’, 6-diamidino-2-phenylindole (DAPI) | Thermo Fisher scientific | D1306 | |
| 50 mL Falcon tube | SARSTEDT | 2045221 | |
| Cluster of differentiation 31 (CD31) | Abcam | ab28364 | |
| Confocal microscope | Nikon | A1R HD25 | |
| Elastin | Abcam | ab23747 | |
| Epredia X1000 Coverslip | Thermo Fisher scientific | 10318963 | |
| Epredia SuperFrost Plus Adhesion slides | Thermo Fisher scientific | 10149870 | |
| Forceps | AESCULAP | FB395R | |
| Goat anti-mouse 647 | Invitrogen | A21235 | |
| Goat anti-rabbit 568 | Invitrogen | A11011 | |
| Human type II cells | Terrace Biotech | TB-27AHT2-280 | |
| Invitrogen Fluoromount-G Mounting Medium | Thermo Fisher scientific | E41473 | |
| Low gelling temperature Agarose | Sigma-Aldrich | 1003467046 | |
| Lycopersicon Esculentum lectin | Thermo Fisher scientific | 2531965 | |
| Phosphate-buffered saline (PBS) | Thermo Fisher scientific | 50-100-8798 | |
| Plastic cup | kontorsgiganten | 885221 | |
| Scissors | STILLE | 101-8380-18 | |
| Smooth muscle actin | Abcam | ab5694 | |
| Sodium azide | Sigma-Aldrich | K54329188239 | |
| Super glue | LOCTITE | 2721643 | |
| Vibrating microtome | Leica | VT1200S |
参考文献
- Morin, J. P., et al. Precision cut lung slices as an efficient tool for in vitro lung physio-pharmacotoxicology studies. Xenobiotica. 43 (1), 63-72 (2013).
- Kawasaki, H., et al. The NanoSuit method: a novel histological approach for examining paraffin sections in a nondestructive manner by correlative light and electron microscopy. Laboratory Investigation. 100 (1), 161-173 (2020).
- Silva, I., et al. A Semi-quantitative scoring system for green histopathological evaluation of large animal models of acute lung injury. BIO-PROTOCOL. 12 (16), e4493 (2022).
- Kim, J. H., et al. Optimizing tissue-clearing conditions based on analysis of the critical factors affecting tissue-clearing procedures. Scientific Reports. 8 (1), 12815 (2018).
- Jain, D., et al. Immunocytochemistry for predictive biomarker testing in lung cancer cytology. Cancer Cytopathology. 127 (5), 325-339 (2019).
- Alturkistani, H. A., Tashkandi, F. M., Mohammedsaleh, Z. M. Histological stains: a literature review and case study. Global Journal of Health Science. 8 (3), 72-79 (2015).
- Morrison, L. E., Lefever, M. R., Lewis, H. N., Kapadia, M. J., Bauer, D. R. Conventional histological and cytological staining with simultaneous immunohistochemistry enabled by invisible chromogens. Laboratory Investigation. 102 (5), 545-553 (2022).
- Dineshshankar, J., et al. Kerosene as an alternative to xylene in histopathological tissue processing and staining: An experimental study. Journal of Pharmacy and Bioallied Sciences. 11 (6), 376 (2019).
- Abdelaal, H. M., et al. Comparison of vibratome and compresstome sectioning of fresh primate lymphoid and genital tissues for in situ MHC-tetramer and immunofluorescence staining. Biological Procedures Online. 17 (1), 2 (2015).
- Siwczak, F., Hiller, C., Pfannkuche, H., Schneider, M. R. Culture of vibrating microtome tissue slices as a 3D model in biomedical research. Journal of Biological Engineering. 17 (1), 36 (2023).
- Bèchet, N. B., Shanbhag, N. C., Lundgaard, I. Glymphatic pathways in the gyrencephalic brain. Journal of Cerebral Blood Flow & Metabolism. 41 (9), 2264-2279 (2021).
- Bèchet, N. B., Kylkilahti, T. M., Mattsson, B., Petrasova, M., Shanbhag, N. C., Lundgaard, I. Light sheet fluorescence microscopy of optically cleared brains for studying the glymphatic system. Journal of Cerebral Blood Flow and Metabolism. 40 (10), 1975-1986 (2020).
- Bai, Y., Ai, X. Utilizing the precision-cut lung slice to study the contractile regulation of airway and intrapulmonary arterial smooth muscle. Journal of Visualized Experiments. (183), (2022).
- Gerckens, M., et al. Generation of human 3D lung tissue cultures (3D-LTCs) for disease modeling. Journal of Visualized Experiments. (144), (2019).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulmonary Pharmacology & Therapeutics. 24 (5), 452-465 (2011).
- Lam, M., Lamanna, E., Organ, L., Donovan, C., Bourke, J. E. Perspectives on precision cut lung slices—powerful tools for investigation of mechanisms and therapeutic targets in lung diseases. Frontiers in Pharmacology. 14, 1162889 (2023).
- Liu, G., et al. Use of precision cut lung slices as a translational model for the study of lung biology. Respiratory Research. 20 (1), 162 (2019).
- Cooper, P. R., et al. Formoterol and salmeterol induce a similar degree of β 2- adrenoceptor tolerance in human small airways but via different mechanisms. British Journal of Pharmacology. 163 (3), 521-532 (2011).
- Ochoa, L. F., et al. Imaging of murine whole lung fibrosis by large scale 3D microscopy aided by tissue optical clearing. Scientific Reports. 8 (1), 13348 (2018).
- Tehrani, K. F., Park, J., Chaney, E. J., Tu, H., Boppart, S. A. Nonlinear imaging histopathology: a pipeline to correlate gold-standard hematoxylin and eosin staining with modern nonlinear microscopy. IEEE Journal of Selected Topics in Quantum Electronics. 29 (4), (2023).
- Branchfield, K., et al. A three-dimensional study of alveologenesis in mouse lung. Developmental Biology. 409 (2), 429-441 (2016).
- Li, Y., et al. Precision vibratome for high-speed ultrathin biotissue cutting and organ-wide imaging. iScience. 24 (9), 103016 (2021).
- Qian, G., et al. DOCK2 promotes pleural fibrosis by modulating mesothelial to mesenchymal transition. American Journal of Respiratory Cell and Molecular Biology. 66 (2), 171-182 (2022).
- Cagle, P. T., Allen, T. C. Pathology of the pleura: What the pulmonologists need to know. Respirology. 16 (3), 430-438 (2011).
- Jantz, M. A., Antony, V. B. Pleural fibrosis. Clinics in Chest Medicine. 27 (2), 181-191 (2006).
- Viana, F., O’Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Molecular Microbiology. 117 (3), 578-588 (2022).
- Paddenberg, R., Mermer, P., Goldenberg, A., Kummer, W. Videomorphometric analysis of hypoxic pulmonary vasoconstriction of intra-pulmonary arteries using murine precision cut lung slices. Journal of Visualized Experiments. (83), e50970 (2014).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465 (2017).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. Journal of Visualized Experiments. (171), e62392 (2021).
- Ghaidan, H., et al. Reduction of primary graft dysfunction using cytokine adsorption during organ preservation and after lung transplantation. Nature Communications. 13 (1), 1-15 (2022).
- Guenthart, B. A., et al. Regeneration of severely damaged lungs using an interventional cross-circulation platform. Nature Communications. 10 (1), 1985 (1985).
- Ruaro, B., et al. The history and mystery of alveolar epithelial type II cells: focus on their physiologic and pathologic role in lung. International Journal of Molecular Sciences. 22 (5), 2566 (2021).
- Crapo, J. D., Barry, B. E., Gehr, P., Bachofen, M., Weibel, E. R. Cell number and cell characteristics of the normal human lung. The American Review of Respiratory Disease. 126 (2), 332-337 (1982).
- Evans, K. V., Lee, J. -. H. Alveolar wars: The rise of in vitro models to understand human lung alveolar maintenance, regeneration, and disease. Stem Cells Translational Medicine. 9 (8), 867-881 (2020).
- Chen, J. -. X., et al. Sirtuin 3 ameliorates lung senescence and improves type II alveolar epithelial cell function by enhancing the FoxO3a-dependent antioxidant defense mechanism. Stem Cells and Development. 30 (17), 843-855 (2021).
- Zacharias, W. J., et al. Regeneration of the lung alveolus by an evolutionarily conserved epithelial progenitor. Nature. 555 (7695), 251-255 (2018).
- Gonzalez, R. F., Allen, L., Gonzales, L., Ballard, P. L., Dobbs, L. G. HTII-280, a biomarker specific to the apical plasma membrane of human lung alveolar type II cells. Journal of Histochemistry & Cytochemistry. 58 (10), 891-901 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。