Method Article
Multipleks Floresan Görüntüleme için Agaroz Gömülü Akciğer Dokusunun Otomatik Vibratom Kesiti
Bu Makalede
Özet
Akciğer kesitleri oluşturmak için vibratom ve agaroza gömülü akciğer dokusu kullanan bir doku işleme tekniği geliştirdik, böylece akciğer mimarisinin yüksek çözünürlüklü görüntülerinin elde edilmesine izin verdik. Spesifik akciğer yapısal belirteçleri kullanarak uzamsal protein ekspresyonunu gözlemlemek için immünofloresan boyama kullandık.
Özet
Doğal yapısal kırılganlığı nedeniyle akciğer, mikroskobik okumalar için işlenmesi en zor dokulardan biri olarak kabul edilir. Kesit için yapısal destek eklemek için, akciğer dokusu parçaları genellikle parafin veya OCT bileşiğine gömülür ve sırasıyla bir mikrotom veya kriyostat ile kesilir. Hassas kesilmiş akciğer dilimleri olarak bilinen daha yeni bir teknik, agaroz infiltrasyonu yoluyla taze akciğer dokusuna yapısal destek ekler ve kültürde birincil akciğer dokusunu korumak için bir platform sağlar. Bununla birlikte, epitop maskeleme ve doku distorsiyonu nedeniyle, bu tekniklerin hiçbiri, çoklu antikor ve türler arasında uyumlu olacak tekrarlanabilir gelişmiş ışık görüntüleme okumalarının geliştirilmesine yeterince katkıda bulunmaz.
Bu amaçla, otomatik vibratom kesitine bağlı olarak sabit akciğer dokusunun agaroz gömülmesini kullanan bir doku işleme boru hattı geliştirdik. Bu, fare, domuz ve insan akciğerlerinde 200 μm ila 70 μm kalınlığında, antijen alımı gerektirmeyen ve doğal izole dokunun en az "işlenmiş" versiyonunu temsil eden akciğer bölümlerinin oluşturulmasını kolaylaştırdı. Bu dilimleri kullanarak, uzamsal protein ekspresyonu akciğer hasarı ve rejenerasyonunun altında yatan mekanizmaları ölçmek ve daha iyi anlamak için kullanılabilecek yüksek çözünürlüklü görüntüler üretebilen bir multipleks görüntüleme okuması ortaya koyuyoruz.
Giriş
Ex vivo akciğer dokusu dilimleri, akciğer hastalığınınincelenmesinde yaygın olarak kullanılmaktadır 1. Mevcut altın standartlar, özellikle klinik ve translasyonel büyük hayvan çalışmalarında, akciğer disfonksiyonunu değerlendirmek ve derecelendirmek için parlak alan mikroskobu ve gözlemci tabanlı puanlama ile birlikte hematoksilen ve eozin boyamayı kullanır 2,3. Hala değerli bir teknik olsa da, uzamsal çözünürlük ve aynı anda görüntülenebilen işaretleyici sayısı açısından sınırlamalar sergiler. Ayrıca, akciğer dokusunun kapsamlı solvent bazlı yıkamalara tabi tutulması gerekir, bu da son görüntülemeden önce dokunun dehidrasyonu, büzülmesi ve rehidrasyonu ile sonuçlanır4. Bu süreç sadece zaman alıcı olmakla kalmaz, aynı zamanda çevre dostu değildir, protein epitoplarını maskeler ve yapısal doku değişikliklerineneden olabilir 5,6,7,8. Bununla birlikte, akciğer dokusu için, akciğerin yapısal kırılganlığı nedeniyle kesit almadan önce parafine gömülmesi bir zorunluluk olmuştur. Buna karşılık, beyin gibi katı organlar, hem sabit hem de taze dokudatitreşen bir mikrotom (vibratom) kullanılarak kesilebilir 9,10,11,12.
Akciğer dokusunda vibratom kesitini mümkün kılmak için, düşük erime noktalı agarozun hava yolları veya kan damarları yoluyla taze akciğer dokusuna enjekte edildiği ve katılaşmaya bırakıldığı hassas kesilmiş akciğer dilimleri (PCLS) olarak adlandırılan bir yöntem oluşturulmuştur13,14. Hava yollarındaki agaroz, daha sonra vibratom kesitine izin vermek için yeterli yapısal destek sağlar 9,14. Kemirgenlerde, agaroz trakea yoluyla enjekte edilebildiği için bunu başarmak kolaydır; Bununla birlikte, domuz ve insan dokusunda, belirli bir biyopsi içinde uygun bir hava yolu/damar bulmak zor olabilir15,16. Ayrıca, böyle bir hava yolu/damar bulunsa bile, agarozu enjekte etmek için genellikle önemli bir kuvvet gerekir ve bu da sonraki akciğer morfolojisinietkileyebilir 17.
Parafin gömme/kesitleme/boyama ve PCLS iş akışında yaşanan zorlukların üstesinden gelmek için, sabit akciğer dokusu için yeni bir işleme hattı oluşturduk. Bu iş akışı, kesit alma için vibratom kullanımına izin verir, PCLS'den daha ince dilimler üretebilir ve multipleks floresan görüntüleme için antijen alımı gerektirmeyen dilimler verir. Bu yöntem, gelişmiş ışık mikroskobunda kullanılabilecek akciğer kesitleri oluşturmak için "en az işleme" aracı sunar. Ayrıca, görüntüleme okumaları, dokunun hacimsel mimarisini yakalayarak akciğer dokusu içindeki hücrelerin ve anatomik yapıların uzamsal ilişkilerini göstermek için kullanılabilir 18,19,20,21. Bu makale, bu akciğer kesitlerini oluşturmak için protokolü açıklar ve bu dokuların her birine uygulanan multipleks boyaları ve bu gelişmiş görüntüleme verilerinin miktar tayini için nasıl kullanılabileceğini gösterir.
Protokol
Fare akciğerleri, 3R'yi desteklemek için diğer organ sistemlerini kullanan araştırmacılar tarafından bağışlandı. Domuzlardaki tüm prosedürler 2010/63/EU sayılı Avrupa direktifine uygun olarak gerçekleştirilmiş ve Malmö-Lund Hayvan Araştırmaları Etik Komitesi (Dnr 5.8.18-05527/2019) tarafından onaylanmış ve İsveç Araştırma Konseyi'nin CODEX yönergelerine göre yürütülmüştür. İnsan örneklerinin kullanımı için onay İsveç Ulusal Etik Komitesi tarafından verilmiştir (Dnr 2020-07115 ve Dnr 2020-01864). Bu protokolde kullanılan tüm malzeme ve aletlerle ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. Çözelti ve malzemelerin hazırlanması
- Akciğer dokusunu 48 saat boyunca oda sıcaklığında% 4 paraformaldehit içinde sabitleyin. Daha sonra, akciğer dokusunu% 0.01 sodyum azid içeren Fosfat tamponlu salin (PBS) ile doldurulmuş 50 mL'lik konik bir tüpe aktarın.
- 1.5 g düşük erime noktalı agarozu 50 mL steril PBS içinde çözerek% 3 (a / h) agaroz çözeltisi hazırlayın. Plastik bir bardak, ince forseps ve steril makas hazırlayın.
- Agarozu kaynayana kadar mikrodalgada ısıtın, ardından bir su banyosunda 42 °C'ye soğutun. Agarozu kullanıma hazır olana kadar su banyosunda saklayarak sıvı halde tutun.
NOT: Agarozu ısıtırken, taşmaması için mikrodalgayı kaynamaya başlayana kadar izleyin. Bu genellikle yaklaşık 1,5 dakika sürer.
2. Agaroz içine gömülü akciğer dokusu
- Akciğer biyopsisini PBS-azidden kaldırın ve ince forseps ve steril makas kullanarak akciğer loblarını dikkatlice inceleyin. Akciğer lobunu daha küçük bloklar halinde kesin.
NOT: Plevra ile kesit almak mümkün olsa da, kalın elastin demetleri vibratom bıçağıyla kesmeyi engelleyebilir. Bu nedenle, gerekli değilse kaldırılmasını öneririz. - Ortasından plastik bir kap kesin ve dibine az miktarda agaroz ekleyin. Kapağı 50 mL'lik konik bir tüpten (kenarı çıkarılmış) agarozun yüzeyine yerleştirin ve agarozun daha sonra kullanmak üzere katılaşmasını sağlamak için kabı 4 °C'de 5 dakika saklayın.
- Plastik kabı 4 °C buzdolabından alın, kapağa yaklaşık 1 mL sıvı agaroz ekleyin, ardından akciğer dokusu bloğunu yavaşça kapağa yerleştirin. Agarozu oda sıcaklığında yarı katılaşması için 2-3 dakika bekletin. Ardından, sıvı agarozu tamamen suya batırılıncaya kadar akciğer dokusuna yavaşça dökün.
- Agaroz katılaşana kadar yaklaşık 15 dakika 4 °C'de soğutun. Daha sonra, akciğer dokusunu çevreleyen ekstra agarozu çıkarmak için dikkatlice keskin bir bıçak kullanın ve doku etrafında yaklaşık 5 mm kalınlığında düzgün bir tabaka bırakın (Şekil 1).
3. Akciğer dokusu bölümlerinin kesilmesi
- Akciğer dokusunu kesit almaya hazırlamak için, her bir doku bloğunu süper yapıştırıcı kullanarak vibratomun numune diskine yapıştırın. Ardından, vibratom tampon tepsisini PBS ile doldurun ve buzu çevreleyen buz banyosuna yerleştirin. Son olarak, numune diskini dikkatlice tampon tepsisine yerleştirin.
- Akciğer dokusunu vibratom ile aşağıdaki ayarlarla dilimleyin: kalınlık: 200 μm, frekans: 100 Hz, bıçağın genliği: 1,3 mm ve bıçağın ileri hızı doku sertliğine bağlı olarak 0,02-0,03 mm/sn.
NOT: Bıçak hızı 0,01 mm/sn'ye düşürülürse 70 μm kalınlığa kadar kesme mümkündür. Bazı vibratomlar (örneğin, Leica V1200'ler) bir kesme penceresi ayarlayarak kesit alma otomasyonuna izin verir. - Bölümleri toplamak için, doku dilimini vibratom tepsisinden bir fırça ile kepçeleyerek PBS'de% 0.01 azid ile doldurulmuş 24 oyuklu bir plakaya yavaşça aktarın. Son olarak, akciğer dilimlerini 4 °C'de muhafaza edin.
4. Elastin, CD31, HTII-280 ve SMA'nın immün boyaması
- Dokuyu 4 ° C'de 45 dakika hafifçe çalkalayarak geçirin ve bloke edin (% 1 sığır serum albümini +% 0.5 Triton +% 5 normal keçi serumu).
- Primer antikorları seyreltin (SMA 1:500; elastin 1:250; CD31 1:250; HTII-280 1:250) PBS'de, oyuk başına 300 μL ekleyin ve hafifçe çalkalayarak gece boyunca 4 ° C'de inkübe edin.
- Dilime dokunmadan ve primer antikorları pipet ucuyla çıkarmadan, PBS ile 3 x 20 dakika (400 μL) yıkayın.
- İkincil antikorları (1:1000) PBS'de seyreltin, kuyucuk başına 300 μL ekleyin ve 90 dakika boyunca hafifçe çalkalayarak 4 ° C'de inkübe edin.
- İkincil antikorları bir pipet ucuyla çıkarın, 30 dakikalık bir inkübasyon için 4', 6-diamidino-2-fenilindol (DAPI) (1: 1000) ve domates lektin-488 (1: 500) ekleyin ve PBS ile 3 x 10 dakika yıkayın.
- Kızak üzerine üç damla montaj ortamı yerleştirin, bir lamel takın ve görüntülemeye devam edin.
Sonuçlar
Akciğer dokusu dilimleri oluşturma süreci, hazırlama, gömme ve kesit alma dahil olmak üzere birkaç önemli adımı içerir. Agaroz çözeltisi (% 3 (a / h), 1.5 g düşük erime noktalı agarozun 50 mL steril PBS içinde çözülmesiyle yapılır. İhtiyaç duyulan sarf malzemeleri arasında plastik bir kap, 50 mL'lik konik bir borudan kapak (kenarı çıkarılmış), forseps ve makas bulunur. Akciğer dokusu ince forseps ve steril makas ile dikkatlice daha küçük bloklar halinde rezeke edilir (Şekil 1A,B). Daha sonra, akciğer doku bloklarını gömmek için, kabın tabanı az miktarda agaroz ile doldurulur, agarozun yüzeyine bir kapak yerleştirilir ve kap 4 °C'de 5 dakika saklanır (Şekil 1C). Kapağa yaklaşık 1 mL sıvı agaroz eklenir ve akciğer dokusu bloğu kapağa yerleştirilir. Agaroz, oda sıcaklığında yarı katılaşması için 2-3 dakika bekletilir (Şekil 1D). Yarı katılaşmış agaroz tarafından bir akciğer bloğu yerinde tutulduktan sonra, akciğer dokusu bloğu tamamen suya batırılıncaya kadar sıvı agaroz bardağa dökülür. Bu, 4 ° C'de 15 dakika saklanır (Şekil 1E, F). Düşük erime noktalı agaroz gömme, akciğer dokusuna gerekli desteği ve sertliği sağlar, bu da dilimleme işlemi sırasında orijinal mimarisinin korunmasına yardımcı olur. Akciğer dokusunu çevreleyen fazla agarozu çıkarmak için keskin bir bıçak kullanılır. Doku etrafında yaklaşık 5 mm kalınlığında homojen bir tabaka bırakılır (Şekil 1G). Eksize edilen akciğer dokusu bloğu daha sonra doku tutucuya dikkatlice yapıştırılır (Şekil 1H). Vibratom tampon tepsisi PBS ile doldurulur, buz çevredeki buz banyosuna yerleştirilir ve numune diski tampon tepsisine yerleştirilir (Şekil 1I). Panelde ayarlanan vibratom kesme parametreleri şunlardı: dilim kalınlığı: 200 μm; frekans: 100 Hz; bıçağın genliği: 1.3mm; bıçağın ileri hızı: doku sertliğine bağlı olarak 0,02-0,03 mm/sn (Şekil 1J). Son olarak, serbest yüzen dilimler üzerinde boyama yapılır (Şekil 1K-M).
Düz kas aktini (SMA, düz kas hücresi ve miyofibroblast belirteci), elastin (hücre dışı matriks proteini) ve bronkoalveoler epitel hücrelerine bağlanan Lycopersicon Esculentum lektin (LEA) için her türden 200 μm'lik kesitlerde immünofloresan boyama yapıldı. Akciğer yapısal olarak heterojen bir dokudur ve bu nedenle, farelerden, domuzlardan ve insanlardan alveolar kanallar, kan damarları, intrapulmoner bronşiyoller ve alveoller dahil olmak üzere yapılar arasında diferansiyel SMA ve elastin dağılımı gözlenir (Şekil 2A-L). Bir bronşiolün 20 μm hacminin yüksek çözünürlüklü bir görüntüsü, akciğerdeki ince yapıların yarı üç boyutlu bir seviyede nasıl incelenebileceğini gösterir (Ek Video S1). Nicel bir örnek olarak, görüntü izlemeyi kullanarak, alveollerin boyutunun numuneler arasında nasıl farklılık gösterdiğini gösteriyoruz (n = 20 alveol) (Şekil 2L,M).
Bu gelişmiş görüntüleme verilerini kantitatif olarak kullanmanın nasıl mümkün olduğunu göstermek için, bir yetişkin ve bir bebekten alınan insan akciğer dokusundaki tip 2 pnömosit (TII) hücre dağılımlarını karşılaştırdık. İnsana özgü tip 2 alveolar hücre antikoru, HTII-280, insan tip 2 hücrelerinin yüzeyine güçlü bir afiniteye sahiptir (Şekil 3A-F). Bu hücreler ayrıca hacimsel görüntüleme kullanılarak tek bir alveolün üç boyutlu uzayında görüntülenebilir (Ek Video S2). Yetişkin ve bebek numuneleri arasındaki TII sayısını ölçmek için, HTII-280 sayımını 10 rastgele görüş alanında (fov) işledik. Bu örnekler arasında, bebek örneği önemli ölçüde daha yüksek bir TII hücre sayısı verdi (Şekil 3G). Bununla birlikte, bebek numunesi ayrıca yetişkinlerden önemli ölçüde daha yüksek bir iskele kapsamı sergiledi ve bu da daha yüksek hücre sayısını açıklayabilir (Şekil 3H). Bunu hesaba katmak için, daha sonra bebek örneğinde hala önemli ölçüde daha yüksek sayıda TII'yi koruyan doku2 mm'si başına hücreler olarak iskele kapsamına dayalı olarak TII sayısını değerlendirdik (Şekil 3I). Bu nedenle, bebek örneğindeki daha yüksek TII sayısı, iskele kapsamının artmasından kaynaklanmamaktadır ve akciğerdeki hücre dağılımlarının genel bakış açısına değil, iskele alanına göre değerlendirilmesinin önemini vurgulamaktadır.

Şekil 1: Akciğer dokusu dilimlerini kesmek için protokol. (A) Çözeltiler ve malzemeler: 1.5 g düşük erime noktalı agarozun 50 mL steril fosfat tamponlu salin içinde çözülmesiyle elde edilen% 3 (a/h) agaroz çözeltisi; plastik bir bardak; 50 mL konik tüpten bir kapak; forseps ve makas. (B) Akciğer dokuları ince forseps ve steril makas kullanılarak diseke edildi. (C) Bardağın dibini az miktarda agarozla doldurun ve kapağı agarozun yüzeyine yerleştirin; daha sonra 4 °C'de 5 dakika saklayın. (D) Kapağa yavaşça 1-2 mL sıvı agaroz ekleyin, akciğer dokusu parçasını dikkatlice kapağın üzerine yerleştirin ve 4 °C'de 2 dakika saklayın. (E,F) Akciğer dokusu tamamen suya batırılıncaya kadar sıvı agarozu bardağa dökün, 4 °C'de 15 dakika saklayın, Ve sonra plastik bardağı yavaşça kırın. (G) Akciğer dokusunu çevreleyen fazla agarozu çıkarmak için keskin bir bıçak kullanın ve doku çevresinde yaklaşık 5 mm kalınlığında düzgün bir tabaka bırakın. (H) Eksize edilen akciğer dokusu bloğu daha sonra doku tutucuya dikkatlice yapıştırılır. (I) Vibratom tampon tepsisini PBS ile doldurun, çevreleyen buz banyosuna buz yerleştirin ve numune diskini tampon tepsisine yerleştirin. (J) Vibratom panelinde kesme parametrelerini ayarlayın; dilim kalınlığı: 200 μm, frekans: 100 Hz, bıçağın genliği: 1,3 mm ve bıçağın ileri hızı 0,02-0,04 mm/sn. (K-M) Hala agaroz içine gömülü ve immünofloresan boyamaya hazır, serbest yüzen bir dilimin temsili görüntüleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
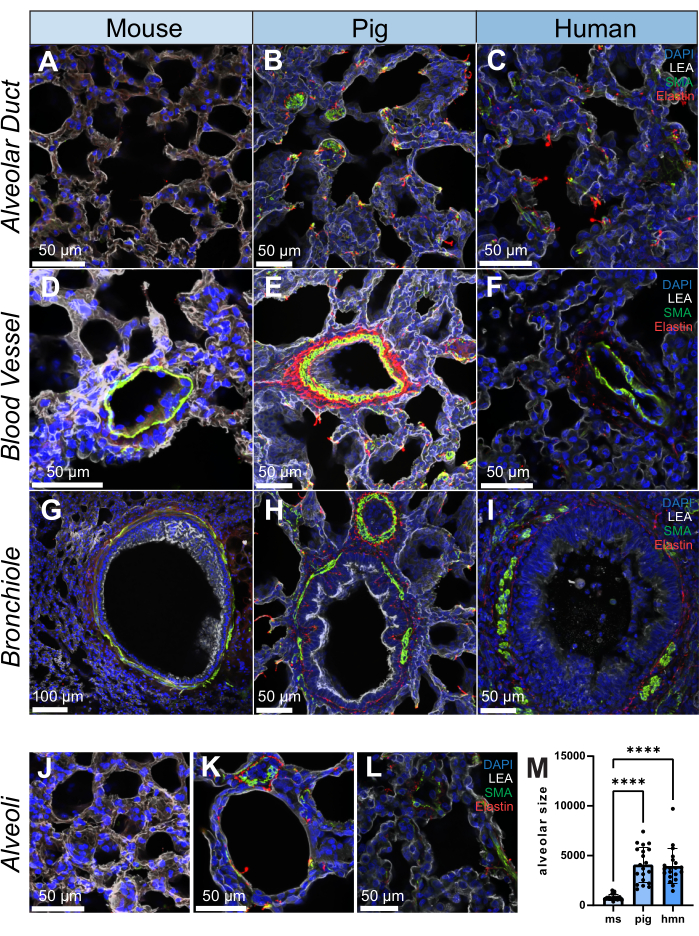
Şekil 2: İnsan, domuz ve farede akciğer yapısının immünofloresan görüntüleri. (A-L) Sırasıyla fare, domuz ve insandan alınan akciğer dokusu dilimlerinde alveolar kanal, kan damarı, bronşiyol ve alveollerin temsili görüntüleri. SMA (yeşil renkle gösterilmiştir) düz kas hücreleri için bir belirteçtir ve akciğer dokusunun vasküler ve bronşiyal duvarlarında gözlenir. Elastin (kırmızı ile gösterilmiştir) akciğerlerin hücre dışı matrisinin bir parçasını oluşturur. (M) Hem insan, hem domuz hem de fare örnekleri için her akciğer dokusu diliminde 20 rastgele pozisyon seçerek alveolar boyutun ölçülmesi. Her gruptaki alveolar boyutun dağılımını göstermek için histogramlar kullanıldı. Ölçek çubukları = 50 μm (AF, HL), 100 μm (G). *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001. Kısaltmalar: DAPI = 4′,6-diamidino-2-fenilindol; LEA = Lycopersicon Esculentum lektin; SMA = düz kas aktini; ms = fare; hmn = insan. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
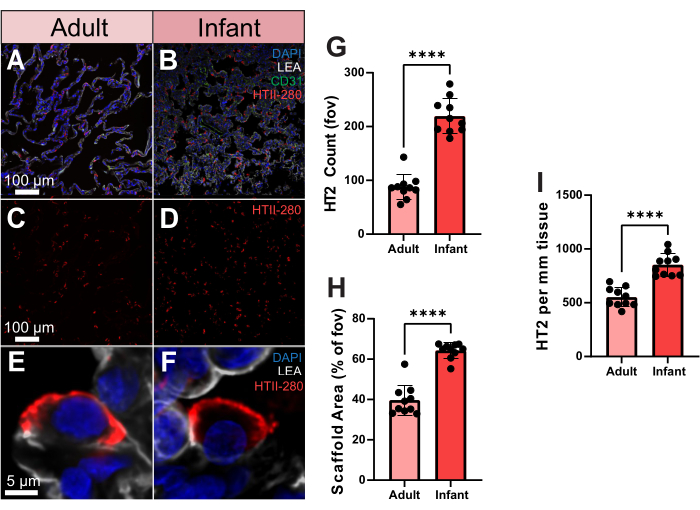
Şekil 3. İnsan yetişkin ve bebek örneklerinde tip 2 pnömosit dağılımı. (A,B) HTII-280 (kırmızı ile gösterilmiştir), CD31 (yeşil ile gösterilmiştir) ve LEA (gri ile gösterilmiştir) için boyanmış yetişkin ve bebek insan akciğer dokusunun temsili görüntüleri. (C,D) Sadece tip 2 pnömosit dağılımını gösteren yetişkin ve bebek insanın temsili görüntüleri. (E,F) Yetişkin ve bebek insan akciğer örneklerinden alınan bireysel tip 2 pnömositin tek hücreli çözünürlüklü temsili görüntüleri. (G) Yetişkin ve bebek numuneleri arasındaki tip 2 pnömosit sayısının miktarının belirlenmesi. (H) Yetişkin ve bebek örneklerinde akciğer dokusu iskele alanı kapsamının (% vs hava) miktarının belirlenmesi. (I) Yetişkin ve bebek örneklerinde doku 2mm2 başına tip 2 pnömosit miktarının belirlenmesi. Ölçek çubukları = 5 μm (E,F), 100 μm (AD). N = Örnek başına 10 FOV. *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001. Kısaltmalar: DAPI = 4', 6-diamidino-2-fenilindol; LEA = Lycopersicon Esculentum lektin; HTII = insan tip II hücreleri; CD31 = Trombosit endotel hücresi adezyon molekülü-1/farklılaşma kümesi 31; FOV = görüş alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Video S1: DAPI, LEA, SMA ve elastin kullanılarak boyanmış tek bir domuz hava yolunun 20 μm görüntüleme hacminin videosu, hava yolu duvar elemanlarının yapısının yüksek çözünürlüklü bir görünümünü gösteriyor. Kısaltmalar: DAPI = 4′,6-diamidino-2-fenilindol; LEA = Lycopersicon Esculentum lektin; SMA = düz kas aktini. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Video S2: DAPI, LEA ve HTII-280 kullanılarak boyanmış tek bir alveolün 30 μm görüntüleme hacminin yapı boyunca tip 2 pnömosit dağılımını gösteren videosu. Kısaltmalar: DAPI = 4′,6-diamidino-2-fenilindol; LEA = Lycopersicon Esculentum lektin; SMA = düz kas aktini. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde, akciğer kesitleri oluşturmak için geliştirilmiş vibratom tabanlı bir yöntem sunuyoruz. Parafin bazlı işleme teknikleriyle karşılaştırıldığında, bu yöntem daha uygun maliyetli, zaman açısından verimli ve çevre için daha iyidir22. Ayrıca, bu yöntem pulmoner doku dilimlerinin yapısal bütünlüğünün korunmasına yardımcı olur ve antijen alımına gerek kalmadan gelişmiş immünofloresan görüntülemeye izin verir. Ancak, denemelerimiz sırasında bu iş akışında bazı sınırlamalar da bulduk. Hastalıklı akciğerler, patolojik değişikliklerin neden olduğu doku tahribatı nedeniyle kesme işlemine müdahale edebilir. Vibratomu kesit için kullanırken, hava yolu tıkanıklıkları ve şiddetli fibrotik akciğer dokusu bıçağı engelleyebilir ve bu dokuları dilimleme işlemini daha zor hale getirebilir. Bununla birlikte, bıçak hızını azaltarak ve dokuyu ince bir boya fırçası ile destekleyerek bunun üstesinden gelinebilir. Benzer zorluklar, plörezi, kronik obstrüktif akciğer hastalığı (KOAH) ve idiyopatik pulmoner fibrozda (İPF) yaygın bir sonuç olan plevranın kalınlaşmasından kaynaklanmaktadır23,24,25. Plevra bir deney için ilgi çekici değilse, kesit almadan önce veya plevradan bir akciğer hacmini izole ederek çıkarmanızı öneririz. Plevra gerekliyse, daha yavaş bıçak hızları ve ince bir fırçadan dilim desteği içeren yukarıdakine benzer bir manipülasyon kullanılarak dilimlenebilir.
Hassas kesilmiş akciğer dilimleri, akciğerinüç boyutlu mimarisini ve doğal ortamını koruyabilirken, PCLS oluşturmanın karmaşık ve zaman alıcı bir süreç olduğuna dikkat etmek önemlidir. Akciğer dokusu dilimleri üretmenin başarısı büyük ölçüde agaroz dolgusunun etkinliğine bağlıdır ve bu da elde edilen dokuda sağlam plevra ve canlı enjeksiyon bölgelerinin varlığından etkilenir. Agaroz trakea yoluyla sağlam akciğerlere kolayca sokulabildiğinden, kemirgenlerde bunu başarmak kolaydır27,28,29. Bununla birlikte, büyük hayvan araştırmalarında, bir deney boyunca alınan biyopsiler tipik olarak,kanül 30,31 için yeterince büyük bir hava yolu olmayan distal akciğer segmentlerinden alınır. Bu nedenle, agarozu bronşlara veya kan damarlarına enjekte etmek yerine, akciğer dokusunun, menşe türü veya numune hacmi ne olursa olsun, akciğer dokusu dilimleri oluşturmak için düşük erime noktalı agaroza gömüldüğü bu yöntemi benimsiyoruz. Bu yaklaşım teknik olarak daha kolaydır ve doku hasarını mümkün olduğunca en aza indirmeyi amaçlar. Deneyimlerimize dayanarak, bu yöntem akciğer dokusu kesitlerinin oluşturulmasında daha yüksek verimlilik ve kolaylık göstermiştir. Alveollerin morfolojisini etkili bir şekilde korur ve özellikle akciğer dokusunu kesmek için uygundur ve tekrarlanabilir yüksek çözünürlüklü multipleks floresan görüntülemenin oluşturulmasını sağlar.
Bu çalışmada, üretilen görüntüleme verileri için iki örneklem tabanlı niceleme daha da gösteriyoruz. İlki, tür örnekleri arasında alveolar boyuttaki farklılıkları değerlendirmek için görüntü izlemeyi kullandı. Şaşırtıcı olmayan bir şekilde, fare alveolleri en küçüğüydü, domuz ve insan alveolleri ise benzer boyuttaydı, bu da domuzları akciğer araştırmaları için ilginç bir translasyonel model olarak vurguladı.
İkinci miktar tayini için, yetişkin ve bebek akciğer örneği arasındaki HTII dağılımını karşılaştırdık. Tip 2 pnömositler, distal akciğer epitelinin yapısında hayati bir rol oynar. TII'lerin bu eşsiz yeteneği, alveolar epitelin32 onarımına ve yenilenmesine katkıda bulunur. Sağlıklı yetişkin insan akciğerinde, TII'ler toplam hücre popülasyonunun yaklaşık %15'ini oluştururken, alveolar yüzey alanını kapsama alanlarının yaklaşık %5 olduğu tahmin edilmektedir33. HTII-280, alveolar epitel hücrelerinin gelişimini ve yaralanmaya tepkisini incelemek için yaygın olarak tanınan akciğere özgü bir belirteçtir ve özellikle TII'lerin apikal plazma membranlarına lokalizedir. Deneyde, intraserebral kanama nedeniyle ölen ve eş zamanlı akciğer hasarı olan bir donör hastadan yetişkin dokusu elde edilirken, bebek örneği boğulmaya bağlı bir mortaliteden geldi. Bulgularımız, yetişkin akciğer örneğinde HTII-280 ekspresyonunun bebek örneğine göre anlamlı derecede düşük olduğunu göstermektedir. İlginç bir şekilde, HTII-280, HTII'lerin çoğunda eksprese edilirken, ekspresyonu doku kalitesinden de etkilenebilir ve yaralı insan akciğer dokusunda önemli ölçüde azalır34. Yaşlı akciğer dokuları, genç dokulara kıyasla TII'lerin sayısında ve salgı aktivitesinde önemli bir azalma sergiler ve yaşlı bireyler, bu genç dokulara kıyasla TII'lerin önemli ölçüde daha düşük proliferasyonu, sekresyonu ve anti-apoptotik aktivitesi gösterir35. Buna uygun olarak, insan TII'lerine özgü bir hücre yüzeyi proteininin tanımlanması ve saptanması, akciğer hasarının ciddiyetinin değerlendirilmesine ve akciğer onarımını arttırmayı amaçlayan tedavi yaklaşımlarının değerlendirilmesine yardımcı olabilir36,37. Bu nedenle, bu boru hattını kullanarak, daha geniş insan sağlık ve hastalık kohortlarında alveolar TII çalışmaları yapmak büyük ilgi görecektir.
Sonuç olarak, bu protokol akciğer dokusunun kesilmesi için daha hızlı ve kolay bir yaklaşım sunar. Bu yöntem, sağlam akciğer dokusu yapısının korunmasını sağlayarak akciğer dokusunun hazırlanması, kesilmesi ve boyanması için ayrıntılı talimatlar sağlar. Hem sağlıklı hem de hastalıklı akciğer mimarisini incelemek için modeli optimize ederek deneysel verimliliğin artmasına yol açar. Genel olarak, bu çalışma, türler arasında akciğer dokusu patofizyolojisinde karmaşık uzamsal biyolojiyi araştırmak için umut verici bir yaklaşım ortaya koymaktadır ve bu, hastalık ve onarımda rol oynayan moleküler mekanizmaların daha iyi anlaşılmasına yardımcı olabilir.
Açıklamalar
Yazarların ifşa edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, Wallenberg Moleküler Tıp Vakfı ve Lund Üniversitesi Kök Hücre Merkezi'nden alınan fonları minnetle kabul eder ve Nikon A1RHD'ye erişim için Lund Üniversitesi Biyogörüntüleme Merkezi'ne (LBIC) teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24 well tissue culture inserts | SARSTEDT | 83.3932.300 | |
| 4% paraformaldehyde | SOLVECO | 6095714 | |
| 4’, 6-diamidino-2-phenylindole (DAPI) | Thermo Fisher scientific | D1306 | |
| 50 mL Falcon tube | SARSTEDT | 2045221 | |
| Cluster of differentiation 31 (CD31) | Abcam | ab28364 | |
| Confocal microscope | Nikon | A1R HD25 | |
| Elastin | Abcam | ab23747 | |
| Epredia X1000 Coverslip | Thermo Fisher scientific | 10318963 | |
| Epredia SuperFrost Plus Adhesion slides | Thermo Fisher scientific | 10149870 | |
| Forceps | AESCULAP | FB395R | |
| Goat anti-mouse 647 | Invitrogen | A21235 | |
| Goat anti-rabbit 568 | Invitrogen | A11011 | |
| Human type II cells | Terrace Biotech | TB-27AHT2-280 | |
| Invitrogen Fluoromount-G Mounting Medium | Thermo Fisher scientific | E41473 | |
| Low gelling temperature Agarose | Sigma-Aldrich | 1003467046 | |
| Lycopersicon Esculentum lectin | Thermo Fisher scientific | 2531965 | |
| Phosphate-buffered saline (PBS) | Thermo Fisher scientific | 50-100-8798 | |
| Plastic cup | kontorsgiganten | 885221 | |
| Scissors | STILLE | 101-8380-18 | |
| Smooth muscle actin | Abcam | ab5694 | |
| Sodium azide | Sigma-Aldrich | K54329188239 | |
| Super glue | LOCTITE | 2721643 | |
| Vibrating microtome | Leica | VT1200S |
Referanslar
- Morin, J. P., et al. Precision cut lung slices as an efficient tool for in vitro lung physio-pharmacotoxicology studies. Xenobiotica. 43 (1), 63-72 (2013).
- Kawasaki, H., et al. The NanoSuit method: a novel histological approach for examining paraffin sections in a nondestructive manner by correlative light and electron microscopy. Laboratory Investigation. 100 (1), 161-173 (2020).
- Silva, I., et al. A Semi-quantitative scoring system for green histopathological evaluation of large animal models of acute lung injury. BIO-PROTOCOL. 12 (16), e4493 (2022).
- Kim, J. H., et al. Optimizing tissue-clearing conditions based on analysis of the critical factors affecting tissue-clearing procedures. Scientific Reports. 8 (1), 12815 (2018).
- Jain, D., et al. Immunocytochemistry for predictive biomarker testing in lung cancer cytology. Cancer Cytopathology. 127 (5), 325-339 (2019).
- Alturkistani, H. A., Tashkandi, F. M., Mohammedsaleh, Z. M. Histological stains: a literature review and case study. Global Journal of Health Science. 8 (3), 72-79 (2015).
- Morrison, L. E., Lefever, M. R., Lewis, H. N., Kapadia, M. J., Bauer, D. R. Conventional histological and cytological staining with simultaneous immunohistochemistry enabled by invisible chromogens. Laboratory Investigation. 102 (5), 545-553 (2022).
- Dineshshankar, J., et al. Kerosene as an alternative to xylene in histopathological tissue processing and staining: An experimental study. Journal of Pharmacy and Bioallied Sciences. 11 (6), 376 (2019).
- Abdelaal, H. M., et al. Comparison of vibratome and compresstome sectioning of fresh primate lymphoid and genital tissues for in situ MHC-tetramer and immunofluorescence staining. Biological Procedures Online. 17 (1), 2 (2015).
- Siwczak, F., Hiller, C., Pfannkuche, H., Schneider, M. R. Culture of vibrating microtome tissue slices as a 3D model in biomedical research. Journal of Biological Engineering. 17 (1), 36 (2023).
- Bèchet, N. B., Shanbhag, N. C., Lundgaard, I. Glymphatic pathways in the gyrencephalic brain. Journal of Cerebral Blood Flow & Metabolism. 41 (9), 2264-2279 (2021).
- Bèchet, N. B., Kylkilahti, T. M., Mattsson, B., Petrasova, M., Shanbhag, N. C., Lundgaard, I. Light sheet fluorescence microscopy of optically cleared brains for studying the glymphatic system. Journal of Cerebral Blood Flow and Metabolism. 40 (10), 1975-1986 (2020).
- Bai, Y., Ai, X. Utilizing the precision-cut lung slice to study the contractile regulation of airway and intrapulmonary arterial smooth muscle. Journal of Visualized Experiments. (183), (2022).
- Gerckens, M., et al. Generation of human 3D lung tissue cultures (3D-LTCs) for disease modeling. Journal of Visualized Experiments. (144), (2019).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulmonary Pharmacology & Therapeutics. 24 (5), 452-465 (2011).
- Lam, M., Lamanna, E., Organ, L., Donovan, C., Bourke, J. E. Perspectives on precision cut lung slices—powerful tools for investigation of mechanisms and therapeutic targets in lung diseases. Frontiers in Pharmacology. 14, 1162889 (2023).
- Liu, G., et al. Use of precision cut lung slices as a translational model for the study of lung biology. Respiratory Research. 20 (1), 162 (2019).
- Cooper, P. R., et al. Formoterol and salmeterol induce a similar degree of β 2- adrenoceptor tolerance in human small airways but via different mechanisms. British Journal of Pharmacology. 163 (3), 521-532 (2011).
- Ochoa, L. F., et al. Imaging of murine whole lung fibrosis by large scale 3D microscopy aided by tissue optical clearing. Scientific Reports. 8 (1), 13348 (2018).
- Tehrani, K. F., Park, J., Chaney, E. J., Tu, H., Boppart, S. A. Nonlinear imaging histopathology: a pipeline to correlate gold-standard hematoxylin and eosin staining with modern nonlinear microscopy. IEEE Journal of Selected Topics in Quantum Electronics. 29 (4), (2023).
- Branchfield, K., et al. A three-dimensional study of alveologenesis in mouse lung. Developmental Biology. 409 (2), 429-441 (2016).
- Li, Y., et al. Precision vibratome for high-speed ultrathin biotissue cutting and organ-wide imaging. iScience. 24 (9), 103016 (2021).
- Qian, G., et al. DOCK2 promotes pleural fibrosis by modulating mesothelial to mesenchymal transition. American Journal of Respiratory Cell and Molecular Biology. 66 (2), 171-182 (2022).
- Cagle, P. T., Allen, T. C. Pathology of the pleura: What the pulmonologists need to know. Respirology. 16 (3), 430-438 (2011).
- Jantz, M. A., Antony, V. B. Pleural fibrosis. Clinics in Chest Medicine. 27 (2), 181-191 (2006).
- Viana, F., O’Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Molecular Microbiology. 117 (3), 578-588 (2022).
- Paddenberg, R., Mermer, P., Goldenberg, A., Kummer, W. Videomorphometric analysis of hypoxic pulmonary vasoconstriction of intra-pulmonary arteries using murine precision cut lung slices. Journal of Visualized Experiments. (83), e50970 (2014).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465 (2017).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. Journal of Visualized Experiments. (171), e62392 (2021).
- Ghaidan, H., et al. Reduction of primary graft dysfunction using cytokine adsorption during organ preservation and after lung transplantation. Nature Communications. 13 (1), 1-15 (2022).
- Guenthart, B. A., et al. Regeneration of severely damaged lungs using an interventional cross-circulation platform. Nature Communications. 10 (1), 1985 (1985).
- Ruaro, B., et al. The history and mystery of alveolar epithelial type II cells: focus on their physiologic and pathologic role in lung. International Journal of Molecular Sciences. 22 (5), 2566 (2021).
- Crapo, J. D., Barry, B. E., Gehr, P., Bachofen, M., Weibel, E. R. Cell number and cell characteristics of the normal human lung. The American Review of Respiratory Disease. 126 (2), 332-337 (1982).
- Evans, K. V., Lee, J. -. H. Alveolar wars: The rise of in vitro models to understand human lung alveolar maintenance, regeneration, and disease. Stem Cells Translational Medicine. 9 (8), 867-881 (2020).
- Chen, J. -. X., et al. Sirtuin 3 ameliorates lung senescence and improves type II alveolar epithelial cell function by enhancing the FoxO3a-dependent antioxidant defense mechanism. Stem Cells and Development. 30 (17), 843-855 (2021).
- Zacharias, W. J., et al. Regeneration of the lung alveolus by an evolutionarily conserved epithelial progenitor. Nature. 555 (7695), 251-255 (2018).
- Gonzalez, R. F., Allen, L., Gonzales, L., Ballard, P. L., Dobbs, L. G. HTII-280, a biomarker specific to the apical plasma membrane of human lung alveolar type II cells. Journal of Histochemistry & Cytochemistry. 58 (10), 891-901 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır