Method Article
マルチプレックス蛍光イメージングのためのアガロース包埋肺組織の自動ビブラトーム切片化
要約
私たちは、ビブラトームとアガロース包埋肺組織を利用して肺切片を生成し、肺構造の高解像度画像を取得する組織処理技術を開発しました。免疫蛍光染色法を用いて、特定の肺構造マーカーを用いて空間的なタンパク質発現を観察しました。
要約
肺は、その固有の構造的脆弱性により、顕微鏡による読み取りのために処理するのがより困難な組織の1つと見なされています。切片形成のための構造的支持を追加するために、肺組織片は通常、パラフィンまたはOCT化合物に包埋され、それぞれミクロトームまたはクライオスタットで切断されます。精密切断肺スライスとして知られる最近の技術は、アガロース浸潤によって新鮮な肺組織に構造的支持を追加し、培養中の初代肺組織を維持するためのプラットフォームを提供します。しかし、エピトープマスキングと組織の歪みにより、これらの技術はいずれも、複数の抗体や種に適合する再現性のある高度な光イメージング読み出しの開発には適していません。
この目的のために、固定肺組織のアガロース包埋と自動ビブラトーム切片を組み合わせた組織処理パイプラインを開発しました。これにより、マウス、ブタ、ヒトの肺において、抗原賦活化を必要とせず、天然の単離組織の中で最も「処理」されていない200μmから70μmの肺切片の作製が容易になりました。これらのスライスを用いて、肺の損傷と再生の根底にあるメカニズムを定量化し、よりよく理解するために空間タンパク質発現を使用できる高解像度画像を生成できるマルチプレックスイメージング読み出しを明らかにします。
概要
Ex vivo肺組織切片は、肺疾患の研究に広く使用されています1。現在のゴールドスタンダード、特に臨床およびトランスレーショナル大動物試験では、ヘマトキシリンとエオシンの染色を明視野顕微鏡と観察者ベースのスコアリングと組み合わせて、肺機能障害を評価および等級付けします2,3。この手法は依然として価値ある技術ですが、空間分解能と同時に画像化できるマーカーの数の点で制限があります。さらに、肺組織は広範囲の溶媒ベースの洗浄を受ける必要があり、その結果、最終的なイメージングの前に組織の脱水、収縮、および再水和が発生します4。このプロセスは時間がかかるだけでなく、環境に優しくなく、タンパク質エピトープをマスクし、構造組織の変化を引き起こす可能性があります5,6,7,8。しかし、肺組織の場合、肺の構造的脆弱性のために、切片化の前にパラフィンに包埋することが必要でした。対照的に、脳などの固形臓器は、固定組織と新鮮組織の両方で、振動ミクロトーム(ビブラトーム)を使用して切断することができます9,10,11,12。
肺組織におけるビブラトーム切片形成を可能にするために、低融点アガロースを気道または血管を介して新鮮な肺組織に注入し、そのまま固化させる精密切断肺スライス(PCLS)と呼ばれる方法が確立されました13,14。気道のアガロースは、ビブラトームの切片化を可能にするのに十分な構造的支持を提供する9,14。げっ歯類では、アガロースを気管から注入できるため、これは簡単に達成できます。しかし、ブタやヒトの組織では、特定の生検15,16内で適切な気道/血管を見つけるのが難しい場合があります。さらに、そのような気道/血管が位置している場合でも、通常、アガロースを注入するにはかなりの力が必要であり、その後の肺の形態に影響を与える可能性があります17。
パラフィン包埋/切片化/染色およびPCLSワークフローで経験した課題を克服するために、固定肺組織の新しい処理パイプラインを確立しました。このワークフローでは、切片化にビブラトームを使用することができ、PCLSよりも薄いスライスを作製でき、マルチプレックス蛍光イメージングのために抗原賦活化を必要としないスライスが得られます。この方法は、高度な光学顕微鏡で使用できる肺切片を生成するための「最小処理」の手段を提供します。さらに、イメージング読み出しは、組織の体積構造を捕捉することによって、肺組織内の細胞および解剖学的構造の空間的関係を実証するために使用され得る18,19,20,21。この論文では、これらの肺切片を生成するためのプロトコルについて説明し、これらの各組織に適用されるマルチプレックス染色と、これらの高度なイメージングデータを定量に使用する方法を示します。
プロトコル
マウスの肺は、3Rを維持するために、他の臓器系を使用している研究者によって提供されました。豚のすべての手順は、欧州指令2010/63 / EUに従って実施され、動物研究に関するマルメ・ルンド倫理委員会(Dnr 5.8.18-05527/2019)によって承認され、スウェーデン研究評議会のCODEXガイドラインに従って実施されました。スウェーデン国家倫理委員会(Dnr 2020-07115およびDnr 2020-01864)により、ヒトサンプルの使用が承認されました。このプロトコルで使用されるすべての材料と機器に関連する詳細については、 材料表 を参照してください。
1. 溶液と材料の調製
- 肺組織を室温で4%パラホルムアルデヒドに48時間固定します。続いて、0.01%アジ化ナトリウムを含むリン酸緩衝生理食塩水(PBS)で満たされた50 mLのコニカルチューブに肺組織を移します。
- 1.5 gの低融点アガロースを50 mLの滅菌PBSに溶解して、3%(w/v)アガロース溶液を調製します。プラスチックカップ、細かい鉗子、滅菌ハサミを用意します。
- アガロースを電子レンジで沸騰するまで加熱し、ウォーターバスで42°Cまで冷却します。アガロースは、使用する準備ができるまでウォーターバスに保管して、液体の形で保管してください。
注意: アガロースを加熱しながら、沸騰し始めるまで電子レンジを監視して、あふれないようにします。通常、これには約1.5分かかります。
2.アガロースに埋め込まれた肺組織
- 肺生検をPBSアジドから持ち上げ、細かい鉗子と滅菌ハサミを使用して肺葉を慎重に解剖します。肺葉を小さなブロックに切ります。
注:胸膜による切片形成は可能ですが、エラスチンの束が厚いため、ビブラトームブレードでの切断が妨げられる可能性があります。したがって、不要な場合は削除することをお勧めします。 - プラスチックカップを真ん中に切り、その底に少量のアガロースを加えます。50 mLのコニカルチューブ(縁を取り外した状態)の蓋をアガロースの表面に置き、カップを4°Cで5分間保存して、アガロースが凝固して後で使用するようにします。
- 4°Cの冷蔵庫からプラスチックカップを取り出し、約1 mLの液体アガロースを蓋に加え、肺組織ブロックを蓋の上に静かに置きます。アガロースを2〜3分間放置し、室温で半固化させます。次に、液体アガロースを肺組織に完全に沈めるまでゆっくりと注ぎます。
- アガロースが固まるまで4°Cで約15分間冷蔵します。次に、鋭利な刃を慎重に使用して肺組織を取り囲む余分なアガロースを除去し、組織の周囲に約5mmの厚さの均一な層を残します(図1)。
3. 肺組織切片の切開
- 切片作成のために肺組織を準備するには、瞬間接着剤を使用して各組織ブロックをビブラトームの標本ディスクに取り付けます。次に、ビブラトームバッファートレイにPBSを充填し、周囲のアイスバスに氷を入れます。最後に、試料ディスクをバッファートレイに慎重に取り付けます。
- ビブラトームで肺組織をスライスし、 厚さ:200 μm、周波数:100 Hz、ブレードの振幅:1.3 mm、ブレードの前進速度は0.02〜0.03 mm / s(組織の硬さによって異なります)に設定します。
注:刃速を0.01mm/sに下げれば、70μmの厚さまで切断可能です。特定のビブラトーム(Leica V1200など)では、切断ウィンドウを設定することで切断を自動化できます。 - 切片を採取するには、ビブラトームトレイから0.01%アジ化物PBSで満たされた24ウェルプレートにブラシですくい取り、組織スライスを静かに移します。最後に、肺切片を4°Cで保存します。
4. エラスチン、CD31、HTII-280、SMAの免疫染色
- 4°Cで45分間穏やかに振とうし、組織を透過処理してブロッキングします(1%ウシ血清アルブミン+0.5%トリトン+5%正常ヤギ血清)。
- 一次抗体を希釈します(SMA 1:500; エラスチン 1:250;CD31の1:250;HTII-280 1:250)をPBSに含み、ウェルあたり300 μLを添加し、穏やかに振とうしながら4°Cで一晩インキュベートします。
- スライスに触れず、ピペットチップで一次抗体を除去することなく、PBSで3 x 20分(400 μL)で洗浄します。
- 二次抗体(1:1000)をPBSで希釈し、1ウェルあたり300 μLを添加し、4°Cで90分間穏やかに振とうしながらインキュベートします。
- ピペットチップで二次抗体を除去し、4',6-ジアミジノ-2-フェニルインドール(DAPI)(1:1000)とトマトレクチン-488(1:500)を添加して30分間インキュベートし、PBSで3 x 10分間洗浄します。
- スライドに封入剤を3滴垂らし、カバーガラスを載せてイメージングに進みます。
結果
肺組織切片を生成するプロセスには、準備、包埋、切片化など、いくつかの重要なステップが含まれます。アガロース溶液(3%(w/v))は、1.5gの低融点アガロースを50mLの滅菌PBSに溶解して作られます。必要な消耗品は、プラスチックカップ、50 mLのコニカルチューブの蓋(縁を取り外した状態)、鉗子、はさみです。肺組織は、細かい鉗子と滅菌ハサミで慎重に小さなブロックに切除されます(図1A、B)。次に、肺組織ブロックを埋め込むために、カップの底に少量のアガロースを充填し、アガロースの表面に蓋をして、カップを4°Cで5分間保存します(図1C)。約1mLの液体アガロースを蓋に加え、肺組織ブロックを蓋の上に置きます。アガロースを2〜3分間放置し、室温で半固化させます(図1D)。肺ブロックが半固化アガロースによって所定の位置に保持されると、肺組織ブロックが完全に沈むまで液体アガロースがカップに注がれます。これを4°Cで15分間保存します(図1E、F)。低融点アガロース包埋は、肺組織に必要なサポートと剛性を提供し、スライスプロセス中に元の構造を維持するのに役立ちます。鋭利な刃を使用して、肺組織を取り巻く過剰なアガロースを除去します。組織の周囲に約5mmの厚さの均一な層が残されています(図1G)。次に、切除した肺組織ブロックを組織ホルダーに慎重に接着します(図1H)。ビブラトームバッファートレイにPBSを充填し、周囲のアイスバスに氷を入れ、バッファートレイに検体ディスクを取り付けます(図1I)。パネルに設定されたビブラトーム切断パラメータは、スライスの厚さ:200μm;周波数:100 Hz;ブレードの振幅:1.3mm;ブレードの前進速度:0.02〜0.03 mm / s、これは組織の剛性に依存します(図1J)。最後に、自由浮遊スライスで染色を行います(図1K-M)。
平滑筋アクチン(SMA、平滑筋細胞および筋線維芽細胞マーカー)、エラスチン(細胞外マトリックスタンパク質)、および気管支肺胞上皮細胞に結合するLycopersicon Esculentum lectin(LEA)について、各種から200 μmの切片で免疫蛍光染色を行いました。肺は構造的に不均一な組織であるため、マウス、ブタ、ヒトの肺胞管、血管、肺内細気管支、肺胞などの構造全体でSMAとエラスチンの分布の違いが観察されます(図2A-L)。20μmの体積の細気管支を高解像度でレンダリングすると、肺内の微細構造を半3次元レベルで調べることができることがわかります(補足ビデオS1)。定量的な例として、画像トレーシングを利用して、サンプル(n = 20肺胞)間で肺胞のサイズがどのように異なるかを示します(図2L、M)。
これらの高度なイメージングデータを定量的に利用する方法を示すために、成人と乳児のヒト肺組織における2型肺細胞(TII)細胞分布を比較しました。ヒト特異的な2型肺胞細胞抗体であるHTII-280は、ヒト2型細胞の表面に強い親和性を示します(図3A-F)。これらの細胞は、さらに、体積イメージングを用いて単一の肺胞の3次元空間で観察することができる(補足ビデオS2)。成人と乳児のサンプル間のTII数を定量化するために、10のランダムな視野(fov)でHTII-280カウントを処理しました。これらのサンプル間で、乳児サンプルは有意に高いTII細胞数をもたらしました(図3G)。しかし、乳児サンプルは成人よりも有意に高い足場被覆率を示しており、細胞数が多いことを説明できる可能性があります(図3H)。これを説明するために、次に、足場の被覆率に基づいて、組織のmm2あたりの細胞数としてTIIの数を評価しましたが、乳児サンプルでは有意に高いTII数を維持していました(図3I)。したがって、乳児サンプルのTII数が多いのは、足場の被覆率の増加によるものではなく、全体的なFOVではなく、足場の面積に基づいて肺の細胞分布を評価することの重要性を強調しています。

図1: 肺ティッシュの切片を切るためのプロトコル。 (A)溶液および材料:1.5gの低融点アガロースを50mLの滅菌リン酸緩衝生理食塩水に溶解して得られる3%(w / v)アガロース溶液。プラスチックカップ;50mLのコニカルチューブの蓋。鉗子、ハサミ。(B)肺組織を細かい鉗子と滅菌ハサミを用いて解剖した。(C)カップの底に少量のアガロースを入れ、アガロースの表面に蓋をします。次に、4°Cで5分間保管します。 (D)1〜2 mLの液体アガロースを蓋にゆっくりと加え、肺組織の塊を蓋に注意深く置き、4°Cで2分間保管します。 (E、F)肺組織の塊が完全に沈むまで液体アガロースをカップに注ぎ、4°Cで15分間保管します。 次に、プラスチックカップをそっと壊します。(G)鋭利な刃を使用して、肺組織を囲む余分なアガロースを除去し、組織の周囲に約5mmの厚さの均一な層を残します。(H)切除された肺組織ブロックは、組織ホルダーに慎重に接着されます。(I)ビブラトームバッファートレイにPBSを充填し、周囲のアイスバスに氷を入れ、検体ディスクをバッファートレイに取り付けます。(J)ビブラトームのパネルで切断パラメータを設定します。スライスの厚さ:200 μm、周波数:100 Hz、ナイフの振幅:1.3 mm、ブレードの前進速度は0.02-0.04 mm / sです。 (K-M) アガロースに埋め込まれたままで、免疫蛍光染色の準備ができている自由浮遊スライスの代表的な画像。この図の拡大版をご覧になるには、ここをクリックしてください。
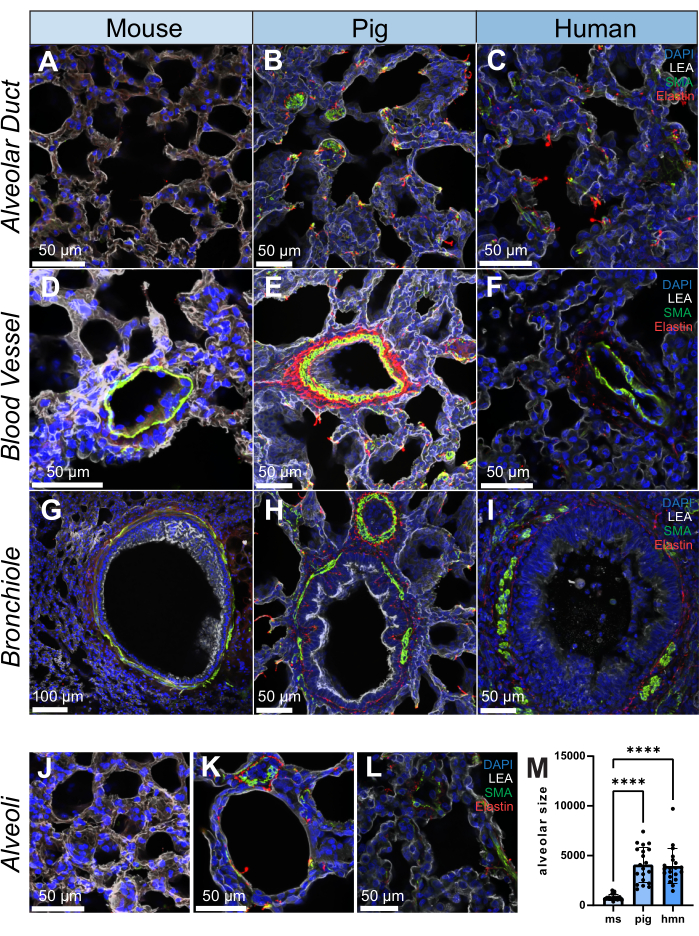
図2:ヒト、ブタ、マウスの肺構造の免疫蛍光画像。 (A-L)マウス、ブタ、ヒトの肺組織切片における肺胞管、血管、細気管支、肺胞の代表的な画像。SMA(緑色で表示)は平滑筋細胞のマーカーであり、肺組織の血管壁と気管支壁に観察されます。エラスチン(赤で表示)は、肺の細胞外マトリックスの一部を形成します。(M)ヒト、ブタ、マウスの両方のサンプルについて、各肺組織スライスのランダムな位置を20個選択することによる肺胞サイズの定量化。ヒストグラムは、各グループ内の歯槽の大きさの分布を示すために利用されました。スケールバー = 50 μm (A-F, H-L), 100 μm (G).Kruskall-Wallis 検定 *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001.略語:DAPI = 4',6-ジアミジノ-2-フェニルインドール;LEA = Lycopersicon Esculentum レクチン;SMA = 平滑筋アクチン;ms = マウス;hmn = 人間。この図の拡大版をご覧になるには、ここをクリックしてください。
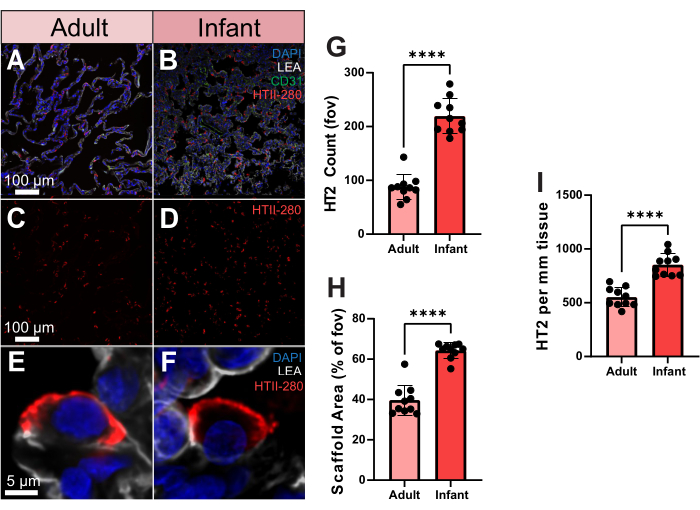
図 3.ヒト成人および乳児サンプルにおける2型肺細胞分布。(A,B)HTII-280(赤色)、CD31(緑色)、LEA(灰色)で染色した成人および乳児のヒト肺組織の代表的な画像。(C、D) 2型肺細胞の分布のみを示す成人および乳児の代表的な画像。(E、F)成人および乳児のヒト肺サンプルから採取した個々の2型肺細胞の単一細胞分解能の代表的な画像。(G)成人と乳児のサンプル間の2型肺細胞数の定量化。(H)成人および乳児サンプルにおける肺組織足場面積の被覆率(%対空気)の定量化。(I)成人および乳児サンプル中の組織mm2あたりの2型肺細胞の定量。スケールバー = 5 μm (E,F)、100 μm (A-D)。n = 10 FOV/サンプル。対応のないt検定またはMann-Whitney検定。 *p < 0.05、**p < 0.01、***p < 0.001、****p < 0.0001。略語:DAPI = 4'、6-ジアミジノ-2-フェニルインドール;LEA = Lycopersicon Esculentum レクチン;HTII = ヒトII型細胞;CD31 = 血小板内皮細胞接着分子-1/分化クラスター31;FOV = 視野角。この図の拡大版をご覧になるには、ここをクリックしてください。
補足動画 S1: DAPI、LEA、SMA、およびエラスチンを使用して染色した単一のブタ気道の20 μmイメージングボリュームのビデオは、気道壁要素の構造の高解像度ビューを示しています。略語:DAPI = 4',6-ジアミジノ-2-フェニルインドール;LEA = Lycopersicon Esculentum レクチン;SMA = 平滑筋アクチン。 このファイルをダウンロードするには、ここをクリックしてください。
補足動画 S2: DAPI、LEA、およびHTII-280を使用して染色した単一肺胞の30 μmイメージングボリュームのビデオで、構造全体にわたる2型肺細胞の分布を示しています。略語:DAPI = 4',6-ジアミジノ-2-フェニルインドール;LEA = Lycopersicon Esculentum レクチン;SMA = 平滑筋アクチン。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルでは、肺切片を生成するための改良されたビブラトームベースの方法を紹介します。パラフィンベースの処理技術と比較して、この方法は費用対効果が高く、時間効率が高く、環境にも優しい22。さらに、この方法は、肺組織切片の構造的完全性を維持するのに役立ち、抗原賦活化を必要とせずに高度な免疫蛍光イメージングを可能にします。しかし、実験中に、このワークフローにはいくつかの制限があることもわかりました。罹患した肺は、病理学的変化によって引き起こされる組織破壊のために切断プロセスを妨げる可能性があります。切片作成にビブラトームを使用している間、気道閉塞や重度の線維性肺組織がブレードを妨げ、これらの組織をスライスするプロセスをより困難にすることがあります。ただし、これはブレード速度を下げ、細い絵筆で組織を支えることで克服できます。同様の課題は、胸膜炎、慢性閉塞性肺疾患(COPD)、および特発性肺線維症(IPF)の一般的な結果である胸膜の肥厚から生じます23,24,25。胸膜が実験に興味がない場合は、切片化する前に胸膜を切除するか、胸膜から肺容積を分離して摘出することをお勧めします。胸膜が必要な場合は、上記と同様の操作を使用してスライスできますが、ブレード速度を遅くし、細いブラシからスライスサポートを使用します。
精密に切断された肺切片は、肺26の3次元構造および天然環境を維持できるが、PCLSの生成は複雑で時間のかかるプロセスであることに注意することが重要である。肺組織切片の生成の成功は、アガロース充填の効率に大きく依存し、アガロース充填は、得られた組織における無傷の胸膜および生存可能な注射部位の存在によって影響を受ける。げっ歯類では、アガロースが気管から無傷の肺に容易に導入できるため、これは簡単に達成できます27,28,29。しかし、大動物の研究では、実験全体で行われる生検は、通常、カニューレをカニューレ化するのに十分な大きさの気道を欠いている遠位肺セグメントから行われます31。そこで、気管支や血管にアガロースを注入するのではなく、原産種や検体量を問わず、低融点のアガロースに肺組織を包埋し、肺組織切片を作製する方法を採用しています。このアプローチは技術的に簡単で、組織の損傷を可能な限り最小限に抑えることを目的としています。私たちの経験に基づいて、この方法は、肺組織切片の生成においてより高い効率と容易さを実証しています。肺胞の形態を効果的に保存し、特に肺組織の切断に適しており、再現性のある高解像度のマルチプレックス蛍光イメージングを可能にします。
この研究では、生成されたイメージングデータに対する2つのサンプルベースの定量化をさらに実証します。1つ目は、種サンプル間の歯槽の大きさの違いを評価するために画像トレーシングを利用しました。当然のことながら、マウスの肺胞は最も小さく、ブタとヒトの肺胞はほぼ同じ大きさであり、ブタは肺研究の興味深いトランスレーショナルモデルであることが強調されました。
2番目の定量では、成人と乳児の肺サンプル間のHTII分布を比較しました。2型肺細胞は、遠位肺上皮の構造において重要な役割を果たします。TIIのこのユニークな能力は、肺胞上皮32の修復と再生に寄与する。健康な成人の肺では、TIIは全細胞集団の約15%を占め、肺胞表面積のカバー率は約5%と推定されています33。HTII-280は、肺胞上皮細胞の損傷に対する発生と応答を研究するための広く認識されている肺特異的マーカーであり、TIIの頂端原形質膜に特異的に局在しています。実験では、脳内出血と肺損傷を併発したドナー患者から成人組織を採取し、乳児サンプルは窒息関連死亡率から採取しました。我々の知見は、HTII-280の発現が乳児サンプルよりも成人の肺サンプルで有意に低かったことを示している。興味深いことに、HTII-280は大部分のHTIIで発現しているが、その発現は組織の質によっても影響を受ける可能性があり、損傷したヒト肺組織では有意に減少している34。老化した肺組織は、若い組織と比較してTIIの数と分泌活性が有意に低下し、高齢者はそれらの若い組織と比較してTIIの増殖、分泌、および抗アポトーシス活性がかなり低いことを示しています35。これに沿って、ヒトTIIに特異的な細胞表面タンパク質の同定と検出は、肺損傷の重症度を評価し、肺修復を促進することを目的とした治療アプローチを評価するのに役立つ可能性があります36,37。したがって、このパイプラインを利用して、健康と病気のより大きなヒトコホートで肺胞TII研究を実施することは非常に興味深いことです。
結論として、このプロトコルは、肺組織を切断するためのより速く、より簡単なアプローチを提示します。この方法では、肺組織の準備、切断、および染色の詳細な指示が得られ、無傷の肺組織構造を確実に保存できます。健康な肺と病気の肺の両方の構造を研究するためにモデルを最適化し、実験効率を向上させます。全体として、この研究は、種を超えた肺組織の病態生理学における複雑な空間生物学を調査するための有望なアプローチを導入し、疾患と修復に関与する分子メカニズムをよりよく理解するのに役立ちます。
開示事項
著者には開示すべき利益相反はありません。
謝辞
著者らは、Wallenberg Molecular Medicine FoundationとStem Cell Center of Lund Universityから資金提供を受けたことに感謝し、Nikon A1RHDへのアクセスについてルンド大学バイオイメージングセンター(LBIC)に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 24 well tissue culture inserts | SARSTEDT | 83.3932.300 | |
| 4% paraformaldehyde | SOLVECO | 6095714 | |
| 4’, 6-diamidino-2-phenylindole (DAPI) | Thermo Fisher scientific | D1306 | |
| 50 mL Falcon tube | SARSTEDT | 2045221 | |
| Cluster of differentiation 31 (CD31) | Abcam | ab28364 | |
| Confocal microscope | Nikon | A1R HD25 | |
| Elastin | Abcam | ab23747 | |
| Epredia X1000 Coverslip | Thermo Fisher scientific | 10318963 | |
| Epredia SuperFrost Plus Adhesion slides | Thermo Fisher scientific | 10149870 | |
| Forceps | AESCULAP | FB395R | |
| Goat anti-mouse 647 | Invitrogen | A21235 | |
| Goat anti-rabbit 568 | Invitrogen | A11011 | |
| Human type II cells | Terrace Biotech | TB-27AHT2-280 | |
| Invitrogen Fluoromount-G Mounting Medium | Thermo Fisher scientific | E41473 | |
| Low gelling temperature Agarose | Sigma-Aldrich | 1003467046 | |
| Lycopersicon Esculentum lectin | Thermo Fisher scientific | 2531965 | |
| Phosphate-buffered saline (PBS) | Thermo Fisher scientific | 50-100-8798 | |
| Plastic cup | kontorsgiganten | 885221 | |
| Scissors | STILLE | 101-8380-18 | |
| Smooth muscle actin | Abcam | ab5694 | |
| Sodium azide | Sigma-Aldrich | K54329188239 | |
| Super glue | LOCTITE | 2721643 | |
| Vibrating microtome | Leica | VT1200S |
参考文献
- Morin, J. P., et al. Precision cut lung slices as an efficient tool for in vitro lung physio-pharmacotoxicology studies. Xenobiotica. 43 (1), 63-72 (2013).
- Kawasaki, H., et al. The NanoSuit method: a novel histological approach for examining paraffin sections in a nondestructive manner by correlative light and electron microscopy. Laboratory Investigation. 100 (1), 161-173 (2020).
- Silva, I., et al. A Semi-quantitative scoring system for green histopathological evaluation of large animal models of acute lung injury. BIO-PROTOCOL. 12 (16), e4493 (2022).
- Kim, J. H., et al. Optimizing tissue-clearing conditions based on analysis of the critical factors affecting tissue-clearing procedures. Scientific Reports. 8 (1), 12815 (2018).
- Jain, D., et al. Immunocytochemistry for predictive biomarker testing in lung cancer cytology. Cancer Cytopathology. 127 (5), 325-339 (2019).
- Alturkistani, H. A., Tashkandi, F. M., Mohammedsaleh, Z. M. Histological stains: a literature review and case study. Global Journal of Health Science. 8 (3), 72-79 (2015).
- Morrison, L. E., Lefever, M. R., Lewis, H. N., Kapadia, M. J., Bauer, D. R. Conventional histological and cytological staining with simultaneous immunohistochemistry enabled by invisible chromogens. Laboratory Investigation. 102 (5), 545-553 (2022).
- Dineshshankar, J., et al. Kerosene as an alternative to xylene in histopathological tissue processing and staining: An experimental study. Journal of Pharmacy and Bioallied Sciences. 11 (6), 376 (2019).
- Abdelaal, H. M., et al. Comparison of vibratome and compresstome sectioning of fresh primate lymphoid and genital tissues for in situ MHC-tetramer and immunofluorescence staining. Biological Procedures Online. 17 (1), 2 (2015).
- Siwczak, F., Hiller, C., Pfannkuche, H., Schneider, M. R. Culture of vibrating microtome tissue slices as a 3D model in biomedical research. Journal of Biological Engineering. 17 (1), 36 (2023).
- Bèchet, N. B., Shanbhag, N. C., Lundgaard, I. Glymphatic pathways in the gyrencephalic brain. Journal of Cerebral Blood Flow & Metabolism. 41 (9), 2264-2279 (2021).
- Bèchet, N. B., Kylkilahti, T. M., Mattsson, B., Petrasova, M., Shanbhag, N. C., Lundgaard, I. Light sheet fluorescence microscopy of optically cleared brains for studying the glymphatic system. Journal of Cerebral Blood Flow and Metabolism. 40 (10), 1975-1986 (2020).
- Bai, Y., Ai, X. Utilizing the precision-cut lung slice to study the contractile regulation of airway and intrapulmonary arterial smooth muscle. Journal of Visualized Experiments. (183), (2022).
- Gerckens, M., et al. Generation of human 3D lung tissue cultures (3D-LTCs) for disease modeling. Journal of Visualized Experiments. (144), (2019).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulmonary Pharmacology & Therapeutics. 24 (5), 452-465 (2011).
- Lam, M., Lamanna, E., Organ, L., Donovan, C., Bourke, J. E. Perspectives on precision cut lung slices—powerful tools for investigation of mechanisms and therapeutic targets in lung diseases. Frontiers in Pharmacology. 14, 1162889 (2023).
- Liu, G., et al. Use of precision cut lung slices as a translational model for the study of lung biology. Respiratory Research. 20 (1), 162 (2019).
- Cooper, P. R., et al. Formoterol and salmeterol induce a similar degree of β 2- adrenoceptor tolerance in human small airways but via different mechanisms. British Journal of Pharmacology. 163 (3), 521-532 (2011).
- Ochoa, L. F., et al. Imaging of murine whole lung fibrosis by large scale 3D microscopy aided by tissue optical clearing. Scientific Reports. 8 (1), 13348 (2018).
- Tehrani, K. F., Park, J., Chaney, E. J., Tu, H., Boppart, S. A. Nonlinear imaging histopathology: a pipeline to correlate gold-standard hematoxylin and eosin staining with modern nonlinear microscopy. IEEE Journal of Selected Topics in Quantum Electronics. 29 (4), (2023).
- Branchfield, K., et al. A three-dimensional study of alveologenesis in mouse lung. Developmental Biology. 409 (2), 429-441 (2016).
- Li, Y., et al. Precision vibratome for high-speed ultrathin biotissue cutting and organ-wide imaging. iScience. 24 (9), 103016 (2021).
- Qian, G., et al. DOCK2 promotes pleural fibrosis by modulating mesothelial to mesenchymal transition. American Journal of Respiratory Cell and Molecular Biology. 66 (2), 171-182 (2022).
- Cagle, P. T., Allen, T. C. Pathology of the pleura: What the pulmonologists need to know. Respirology. 16 (3), 430-438 (2011).
- Jantz, M. A., Antony, V. B. Pleural fibrosis. Clinics in Chest Medicine. 27 (2), 181-191 (2006).
- Viana, F., O’Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Molecular Microbiology. 117 (3), 578-588 (2022).
- Paddenberg, R., Mermer, P., Goldenberg, A., Kummer, W. Videomorphometric analysis of hypoxic pulmonary vasoconstriction of intra-pulmonary arteries using murine precision cut lung slices. Journal of Visualized Experiments. (83), e50970 (2014).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465 (2017).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. Journal of Visualized Experiments. (171), e62392 (2021).
- Ghaidan, H., et al. Reduction of primary graft dysfunction using cytokine adsorption during organ preservation and after lung transplantation. Nature Communications. 13 (1), 1-15 (2022).
- Guenthart, B. A., et al. Regeneration of severely damaged lungs using an interventional cross-circulation platform. Nature Communications. 10 (1), 1985 (1985).
- Ruaro, B., et al. The history and mystery of alveolar epithelial type II cells: focus on their physiologic and pathologic role in lung. International Journal of Molecular Sciences. 22 (5), 2566 (2021).
- Crapo, J. D., Barry, B. E., Gehr, P., Bachofen, M., Weibel, E. R. Cell number and cell characteristics of the normal human lung. The American Review of Respiratory Disease. 126 (2), 332-337 (1982).
- Evans, K. V., Lee, J. -. H. Alveolar wars: The rise of in vitro models to understand human lung alveolar maintenance, regeneration, and disease. Stem Cells Translational Medicine. 9 (8), 867-881 (2020).
- Chen, J. -. X., et al. Sirtuin 3 ameliorates lung senescence and improves type II alveolar epithelial cell function by enhancing the FoxO3a-dependent antioxidant defense mechanism. Stem Cells and Development. 30 (17), 843-855 (2021).
- Zacharias, W. J., et al. Regeneration of the lung alveolus by an evolutionarily conserved epithelial progenitor. Nature. 555 (7695), 251-255 (2018).
- Gonzalez, R. F., Allen, L., Gonzales, L., Ballard, P. L., Dobbs, L. G. HTII-280, a biomarker specific to the apical plasma membrane of human lung alveolar type II cells. Journal of Histochemistry & Cytochemistry. 58 (10), 891-901 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved