Method Article
توليد شرائح أنسجة البنكرياس البشرية لدراسة فسيولوجيا البنكرياس الغدد الصماء والخارجية الإفراز
In This Article
Summary
يصف هذا البروتوكول كيفية توليد شرائح البنكرياس البشري من المتبرعين بالأعضاء المتوفين لدراسة وظيفة الخلية في ظل ظروف شبه فسيولوجية. يتيح هذا النهج المبتكر التحقيق في الجزر العادية والمتضررة هيكليا والتفاعل المعقد بين مقصورات الغدد الصماء والخارجية الإفراز.
Abstract
من الأهمية بمكان دراسة البنكرياس البشري لفهم الآليات الفيزيولوجية المرضية المرتبطة بمرض السكري من النوع 1 (T1D) و 2 (T2D) بالإضافة إلى فسيولوجيا البنكرياس والغدد الصماء والخارجية الإفراز والتفاعل. لقد تم تعلم الكثير من دراسة جزر البنكرياس المعزولة ، ولكن هذا يمنع فحص وظيفتها وتفاعلاتها في سياق الأنسجة بأكملها. توفر شرائح البنكرياس فرصة فريدة لاستكشاف فسيولوجيا الجزر الطبيعية والملتهبة والتالفة هيكليا داخل بيئتها الأصلية ، مما يسمح بدوره بدراسة التفاعلات بين مقصورات الغدد الصماء والخارجية الإفراز للتحقيق بشكل أفضل في الديناميات المعقدة لأنسجة البنكرياس. وبالتالي ، فإن اعتماد منصة شريحة البنكرياس الحية يمثل تقدما كبيرا في هذا المجال. يصف هذا البروتوكول كيفية توليد شرائح الأنسجة الحية من المتبرعين بالأعضاء المتوفين عن طريق تضمين الأنسجة في تقطيع الأغاروز والاهتزاز بالإضافة إلى استخدامها لتقييم القراءات الوظيفية مثل الإفراز الديناميكي وتصوير الخلايا الحية.
Introduction
تعتبر الدراسات حول فسيولوجيا الجزر أساسية لفهم التسبب في مرض السكري وتطوير أساليب علاجية جديدة. حتى الآن ، اعتمدت الأبحاث على الجزر المعزولة ، والتي تعرض الجزر لضغوط ميكانيكية وإنزيمية ، مما يتسبب على الأرجح في حدوث تغييرات في فسيولوجيا الخلية. علاوة على ذلك ، لا يمكن تقييم وظيفة الجزيرة في سياق بيئة الأنسجة الطبيعية ، والتي من المحتمل أن تتأثر بالخلايا الخارجية الإفراز والأوعية الدموية من بين أمور أخرى1. عند دراسة البنكرياس من المتبرعين المصابين ب T1D ، هناك تحد يتمثل في صعوبة عزل جزرها وقد تصبح مجزأة أثناء العزلة ، مما قد ينتج عنه تأثير انتقاء على الجزر الصغيرة التي قد لا تمثل السكان في الجسم الحي2. علاوة على ذلك ، سيتم فصل الجزر عن بيئتها المعقدة واتصالاتها الخلوية ، خاصة من الخلايا المناعية المتسللة الموجودة في الجزر الملتهبة والتي تكون أكثر وفرة في محيط الجزيرة. وبالتالي ، في حين أن الجزر المعزولة هي أداة أساسية في أبحاث مرض السكري ، إلا أن هناك قيودا. استجابة لذلك ، نقدم بروتوكولا رائدا لتوليد شرائح البنكرياس الحية ، وتقديم حل لهذه التحديات.
يعتبر التطور الأخير واعتماد تقنيات تقطيع أنسجة البنكرياس اختراقا لقدرتنا على استكشاف البيولوجيا المعقدة ووظائف البنكرياس. فتح هذا الابتكار آفاقا جديدة للدراسات الديناميكية لفسيولوجيا الجزر والتفاعلات بين خلايا الغدد الصماء والخارجية الإفراز والخلايا العصبية والأوعية الدموية والمناعية في سياقها التشريحي الطبيعي. على عكس الأساليب التقليدية ، يحافظ هذا الإعداد في المختبر على الكثير من الهندسة الخلوية للعضو ، مما يسمح بتقريب أقرب إلى بيولوجيته الأصلية. تم تطوير هذه الطريقة في البداية على الفئران بواسطة Speier و Rupnik في عام 20033 ، وقد أثبتت هذه الطريقة فائدتها في تقييم تصوير الكالسيوم والفيزيولوجيا الكهربية وإفراز الهرمونات لكل من الإشارات داخل الخلايا وبين الخلايا4،5،6،7،8،9. ثم تم تطبيق منصة شريحة البنكرياس لدراسة أنسجة البنكرياس البشرية التي تم الحصول عليها عن طريق الخزعة الجراحية4،10،11،12. أظهرت مجموعتنا جدوى الحصول على شرائح البنكرياس واستخدامها من المتبرعين بالأعضاء الجثة من خلال نشاط شبكة المتبرعين بأعضاء البنكرياس المصابين بداء السكري (nPOD)13. يوفر nPOD أنسجة البنكرياس للمحققين المعتمدين الذين يجرون أبحاثا حول مرض السكري من النوع 1 البشري ، ومنذ اعتماد منصة شريحة البنكرياس ، يقوم nPOD بشكل روتيني بإنشاء وتوزيع شرائح البنكرياس الحية14،15،16،17. منذ تنفيذ منصة شرائح البنكرياس في عام 2020 ، نجحت nPOD في توزيع شرائح الأنسجة من 43 متبرعا (بما في ذلك 12 متبرعا مصابا ب T1D) على العديد من المحققين. باستخدام هذه الشرائح ، أجرى الباحثون أبحاثا رائدة حول الجوانب الحرجة لوظيفة الجزيرة واستكشفوا التفاعل بين الجزر والأوعية الدموية والجهاز العصبي والخلايا المناعية في سياق T1D13،18،19،20،21،22،23،24. سلطت العديد من الدراسات الضوء على قيود الأساليب التقليدية وأكدت على أهمية التقنيات التي يمكنها التقاط التفاعل الديناميكي داخل البنكرياس25،26،27. إن القدرة على التكيف مع تقنيات التقطيع من الفأر إلى البنكرياس البشري ، إلى جانب دمجها في برامج مثل شبكة المتبرعين بأعضاء البنكرياس المصابين بداء السكري (nPOD) ، تجسد الاعتراف المتزايد بقدرة الطريقة على إطلاق رؤى قيمة حول أمراض مثل مرض السكري من النوع 1.
Protocol
تم الحصول على أقسام البنكرياس البشرية من المتبرعين بالأنسجة من كلا الجنسين عبر شبكة المتبرعين بأعضاء البنكرياس المصابين بداء السكري (nPOD) بنك الأنسجة ، جامعة فلوريدا. تم تحديد أنسجة الأعضاء من الأفراد المتوفين دون معرفات على أنها أبحاث غير بشرية وفقا لقوانين ولوائح التبرع بالأعضاء وتصنيفها على أنها مواضيع غير بشرية من قبل مجلس المراجعة المؤسسية بجامعة فلوريدا (IRB; IRB رقم 392-2008) ، متنازلا عن الحاجة إلى الموافقة. تمت الموافقة على أنسجة nPOD المستخدمة خصيصا لهذا المشروع على أنها غير بشرية من قبل جامعة فلوريدا IRB (IRB20140093).
ملاحظة: بالنسبة للقراء الجدد تماما على تقنية الشرائح وتطبيقاتها ، مثل الانتشار وتصوير الكالسيوم ، قد يكون من المستحسن اكتساب الخبرة العملية وتطوير المهارات الأساسية باستخدام شرائح الفئرانأو الفئران 3،28 قبل العمل مع العينات البشرية.
1. الاستعدادات
ملاحظة: يجب إجراء هذه الاستعدادات قبل وصول الأنسجة.
- تحضير المخزن المؤقت HEPES عن طريق خلط 125 مللي مول كلوريد الصوديوم ، 5.9 مللي مول KCl ، 2.56 مللي مول CaCl2 ، 1 مللي مول MgCl2 ، 25 مللي مول HEPES ، 0.1٪ BSA ، 2 مللي مول L-ألانين ، L- أرجينين ، و L- الجلوتامين. ضبط درجة الحموضة إلى 7.4 وتعقيم الفلتر.
- أضف الجلوكوز و / أو المحفزات الأخرى إلى المخزن المؤقت لإعداد حلول لتجربة perifusion. بالنسبة للمخزن المؤقت الأساسي ، أضف 5.5 مللي مول من الجلوكوز. سيتم استخدام هذا المخزن المؤقت لإجراءات التقطيع وجمع الشرائح ومستحضرات التموين.
- قم بإعداد طبقين على الأقل لجمع الشرائح عن طريق إضافة أبروتينين (10 ميكروغرام / مل) إلى المخزن المؤقت الأساسي.
- قم بإعداد محلول أغاروز منخفض درجة انصهار بنسبة 3.8٪ في محلول HEPES بدون BSA والأحماض الأمينية (125 mM NaCl ، 5.9 mM KCl ، 2.56 mM CaCl2 ، 1 mM MgCl2 ، 25 mM HEPES) واحتفظ به عند 37 درجة مئوية.
- قم بتجميع الاهتزاز ، عن طريق وضع شفرة جديدة في الحامل. إذا أمكن ، اضبط زاوية الشفرة على 15 درجة (في حالة استخدام Leica VT1200S). قم بمعايرة الاهتزاز إن أمكن.
- قم بتشغيل آلة perifusion ، وحدد عدد الغرف وبروتوكول البرنامج.
- ضع جميع المحاليل اللازمة في آلة perifusion ، وقم بتجهيز النظام والحفاظ على تسخين المحاليل. تقوم الآلة بحساب الأحجام اللازمة لكل حل مستخدم للبروتوكول.
2. معالجة الأنسجة
ملاحظة: يجب إنشاء الشرائح فور استلامها. أي تأخير قد يسبب صعوبات في الإجراء ويؤدي إلى تدهور الأنسجة.
- ضع أنسجة البنكرياس في طبق به مخزن مؤقت أساسي تحت مجهر ستيريو (الشكل 1 أ). قم بإزالة الأنسجة الضامة والليفية والدهنية برفق باستخدام الملقط والمقص.
- قطع الأنسجة إلى عدة قطع صغيرة بحوالي 0.5 سم3 (الشكل 1 ب) باستخدام مقص أو مشرط. لطخة قطع البنكرياس الجافة على المناديل الورقية.
- انقلي 4 قطع إلى طبق بتري 35 مم واملأ الطبق بمحلول الأغاروز حتى تغمر جميع القطع بالكامل. السماح للأغاروز لتصلب تماما.
- قطع بعناية من agarose. قم بتشغيل المشرط على طول حافة الطبق لإزالة الأغاروز وفصل كتل الأنسجة بعناية. تأكد من أن القطع محاطة بطبقة رقيقة من الأغاروز.
3. التقطيع
- قطع الأنسجة الغراء على اللوحة المعدنية للاهتزاز عن طريق وضعها رأسا على عقب.
- قم بتركيب اللوحة في الدرج واملأ الدرج بمخزن مؤقت أساسي (HEPES يحتوي على 5.5 مللي متر من الجلوكوز الأساسي).
- اضبط الاهتزاز على التقطيع الآلي عند 120 ميكرومتر واضبط موضع البداية والنهاية.
- حرك الشفرة فوق المنديل بفترة وجيزة وابدأ في التقطيع بسرعة بطيئة (0.1 مم / ثانية) وسعة عند 0.8 مم. يمكن زيادة السرعة إذا سمحت الأنسجة (الشكل 1C).
- اجمع الشرائح باستخدام ملقط منحني أو فرشاة صغيرة. تراكم الشرائح في المخزن المؤقت الأساسي الذي يحتوي على الأبروتينين (الشكل 1 د).
- اترك الشرائح ترتاح لمدة 1 ساعة على الأقل في المخزن المؤقت الأساسي مع الأبروتينين. ضع شرائح على شاكر مداري بطيء للسماح بطرد الإنزيمات المنبعثة من إجراء القطع.
4. مقايسة حية / ميتة
ملاحظة: هذا اختبار اختياري سيظهر صلاحية شرائح الأنسجة بعد الإجراء. ومع ذلك ، لا يمكن إعادة استخدام الشرائح بمجرد تلطيخها.
- انقل شريحة واحدة في بئر مملوءة بالمخزن المؤقت الأساسي.
- أضف ثنائي أسيتات الفلوريسئين (FDA ، 50 ميكروغرام / مل) ، واحتضانه لمدة 1 دقيقة في درجة حرارة الغرفة وحفظه بعيدا عن الضوء.
- أضف يوديد البروبيديوم (PI ، 50 ميكروغرام / مل) ، واحتضانه لمدة 1 دقيقة في درجة حرارة الغرفة وحفظه بعيدا عن الضوء.
- نقل شريحة إلى بئر أخرى مليئة PBS لغسل لمدة 1 دقيقة.
- انقل الشرائح إلى طبق بتري أو قم بتركيبها على شريحة زجاجية مع قسيمة غطاء للتصوير (الشكل 2 أ ، ب).
5. الفيوح
ملاحظة: يصف هذا البروتوكول كيفية إجراء عملية الانتشار الديناميكي لشرائح الأنسجة ، ولكنه مناسب للجزر المعزولة أيضا. ستحتاج غرف الجزر إلى التحضير باستخدام ورق الترشيح ومحلول الخرز قبل تحميل الجزر كما هو موضح في دليل المستخدم الخاص بالماكينة. ومع ذلك ، يمكن استخدام غرفة الجزيرة والشريحة معا في نفس التجربة.
- اختر 3 شرائح وقم بقص الأغاروز إلى الحد الأدنى تحت المجهر المجسم باستخدام الفرشاة والمشرط.
- أضف قطرة من المخزن المؤقت الأساسي (HEPES يحتوي على 5.5 مللي متر من الجلوكوز الأساسي) على شبكة حجرة الشريحة وضع شريحة واحدة برفق على الشبكة. كرر لكل شريحة من الشرائح الثلاث (الشكل 3 أ). إذا كانت الشرائح صغيرة جدا ، فقم بتكديس أكثر من 3 غرف لزيادة عدد الجزر. لا تضع أكثر من شريحة واحدة لكل غرفة.
ملاحظة: يختلف عدد الجزر لكل شريحة اختلافا كبيرا بين المتبرعين ويعتمد على حجم الشريحة (10-100 جزيرة / شريحة). ثبت أن ما مجموعه 3 شرائح كافية لقياس إفراز الأنسولين والجلوكاجون. - بالنسبة للجزر المعزولة ، استخدم ما لا يقل عن 30 جزيرة لكل عمود لإفراز الأنسولين. يوصى باستخدام 100 جزيرة للكشف عن الجلوكاجون. قم بتجميع أجزاء حجرة الشرائح الفردية من أعلى إلى أسفل.
- قم بتوصيل غرفة الشريحة بأنابيب التدفق الداخل والخارج في الجهاز وابدأ البروتوكول (الشكل 3C).
- استخدم تسخين الغرفة ومضخة تبريد الدرج أثناء البروتوكول. قم بتغيير لوحات التجميع أثناء البروتوكول وتخزينها في درجة حرارة 4 درجات مئوية إذا تم إجراء القياس الكمي في نفس اليوم أو تخزينها في -80 درجة مئوية حتى ذلك الحين.
- عند الانتهاء من البروتوكول ، قم بإزالة الغرف وتفكيكها وجمع شرائح للتحلل (3٪ حمض الهيدروكلوريك في الإيثانول المطلق) أو التثبيت (في 4٪ بارافورمالدهيد).
- نظف الماكينة عن طريق شطفها بالماء و 10٪ مبيض وماء وهواء.
- تحديد إفراز الهرمونات باستخدام مجموعات الكشف المتاحة تجاريا.
ملاحظة: يوضح الشكل 4 المستويات المطلقة لإفراز الأنسولين والجلوكاجون ل 3 شرائح لتقدير نطاقات التركيز.
6. تصوير الكالسيوم
- قم بإعداد محلول صبغة الكالسيوم (على سبيل المثال ، Fluo4-AM ، Calbryte) وفقا لتعليمات الشركة المصنعة.
- خفف الصبغة في محلول HEPES العازل الأساسي وأضف الأبروتينين (10 ميكروغرام / مل).
- نقل شريحة واحدة واحتضانها لمدة 30-60 دقيقة على شاكر المداري في درجة حرارة الغرفة وحمايتها من الضوء.
- أثناء وقت الحضانة ، قم بإعداد إعداد تصوير الشرائح عن طريق ملء محاقن perifusion وتحضير الأنابيب (الشكل 5A ، B).
- قم بتوصيل جميع الأجهزة ، وقم بتشغيل السخان ، وابدأ تدفق المضخة. يوصى باستخدام كل من التسخين المتدفق وسخان المنصة ومعدل التدفق 0.5 مل / دقيقة.
- ضع شريحة واحدة برفق في حجرة التصوير وقم بتثبيتها باستخدام القيثارة.
- استخدم هدف تكبير منخفض لتحديد منطقة التصوير. يساعد استخدام الانعكاس في تحديد منطقة الجزيرة (الشكل 5C).
- قم بالتبديل إلى هدف تكبير أعلى (على سبيل المثال ، 20x أو 40x) واضبط الموضع وفقا للإعداد التجريبي.
ملاحظة: لضمان الصلاحية المثلى للخلية وسلامة الجزيرة ، يوصى بأن تكون المقاطع البصرية 1-2 طبقة خلية تحت سطح القطع. - اضبط موضع z-stack و/أو موضع مسح التجانب. اضبط الفاصل الزمني للتصوير ومدة التسجيل. هنا ، تم استخدام دقة لا تقل عن 256 × 256 للسماح بتمييز الخلايا الفردية ، وفاصل تصوير من 5-10 ثوان ونطاق z-stack (إن أمكن) من 30-60 ميكرومتر مع فاصل 10 ميكرومتر بين المستويات (طبقة خلية واحدة). انظر الشكل 6 للحصول على إعدادات التصوير التفصيلية.
ملاحظة: اضبط معلمة التصوير للحصول على أفضل دقة وأقصى مساحة مع تجنب تبييض العينة. - ابدأ التصوير وقم بتبديل تدفق المحلول وفقا للتجربة. بمجرد الانتهاء من ذلك ، اجمع الشرائح وقم بإصلاحها للكيمياء المناعية.
النتائج
عندما يتم تنفيذ البروتوكول بنجاح ، ينتج 1 غرام من أنسجة البنكرياس حوالي 100-200 شريحة. بعد ذلك ، يجب أن تخضع هذه الشرائح لفحص المجهر المجسم لتحديد تلك الغنية بالجزر قبل الشروع في التقييمات الوظيفية. من المتوقع أن تصل الصلاحية ، التي يتم تحديدها عن طريق وضع العلامات باستخدام Fluorescein Diacetate (FDA) و Propidium Iodide (PI) ، إلى 80٪ -90٪ (الشكل 2 أ). قد تكون الصلاحية أقل بشكل ملحوظ على سطح القطع بسبب تلف الخلايا أثناء عملية التقطيع. في شرائح قابلة للحياة ، لوحظ إفراز هرمون ديناميكي (الشكل 2 ب) ، مما يؤدي إلى إطلاق الأنسولين بقوة عند التعرض لارتفاع الجلوكوز وإزالة استقطاب الغشاء مع كلوريد البوتاسيوم (KCl).
على العكس من ذلك ، عندما يكون هناك تأخير أثناء إجراء التقطيع أو تكون جودة الأنسجة دون المستوى الأمثل ، تختلف النتائج بشكل كبير. قد ينخفض عدد الشرائح التي تم الحصول عليها ، وقد يشير تقييم الجدوى إلى نسبة أعلى من الخلايا غير القابلة للحياة الموسومة ب PI (الشكل 2C). في هذه الحالات ، يشير التقييم الوظيفي إلى استجابة متناقصة أو حتى غائبة لارتفاع استقطاب الجلوكوز والأغشية (الشكل 2 د). توضح البيانات المستمدة من التجارب دون المستوى الأمثل أهمية التنفيذ الدقيق في الوقت المناسب وجودة الأنسجة ، حيث يمكن أن تؤدي إلى انخفاض صلاحية الأنسجة وضعف وظائفها. هذه النتائج السلبية بمثابة تذكير قيم بالعوامل الحاسمة التي يجب مراعاتها في نجاح هذه الطريقة.
يتم تصور النتائج الشائعة في تصوير الكالسيوم كخريطة حرارية ، كما هو موضح في الشكل 5D ، أو كآثار منفصلة للخلايا الفردية ، كما هو موضح في الشكل 5E. من المهم التأكيد على أن الصبغة تصنف جميع أنواع الخلايا بشكل عشوائي ، وبالتالي فإن المحفزات المحددة ضرورية لتمييز الخلايا بناء على استجاباتها. لتحديد الخلايا القابلة للحياة ، نستخدم KCl ونفرز الخلايا بناء على الاستجابات التي تتجاوز متوسط استجابة خط الأساس بأكثر من خطأين قياسيين. علاوة على ذلك ، يمكن تثبيت الشرائح وتلطيخها ، مما يتيح تحديد أنواع الخلايا.
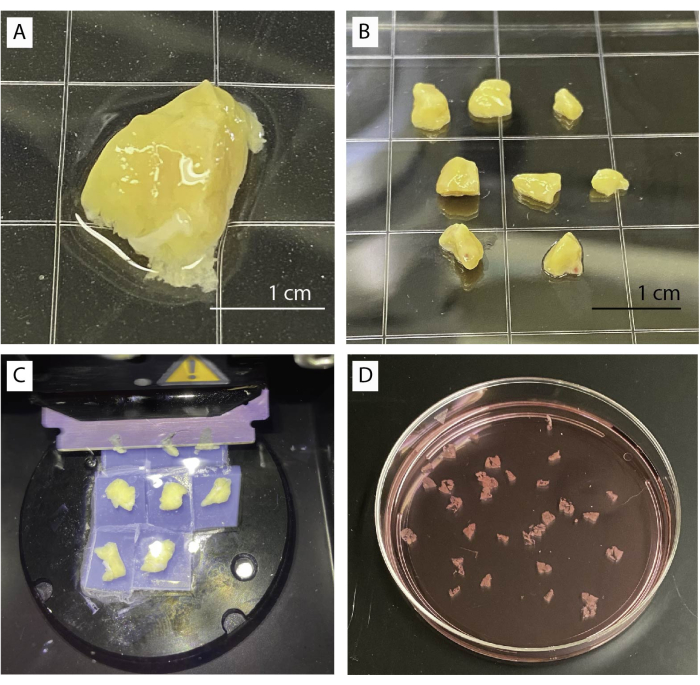
الشكل 1: معالجة الأنسجة وتقطيعها. أ: 1 غرام من أنسجة البنكرياس غير المعالجة. (ب) قطع بنكرياس نظيفة جاهزة لدمج الأغاروز. ج: إجراء التقطيع باستخدام الاهتزاز. د: شرائح البنكرياس البشري المقطعة حديثا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
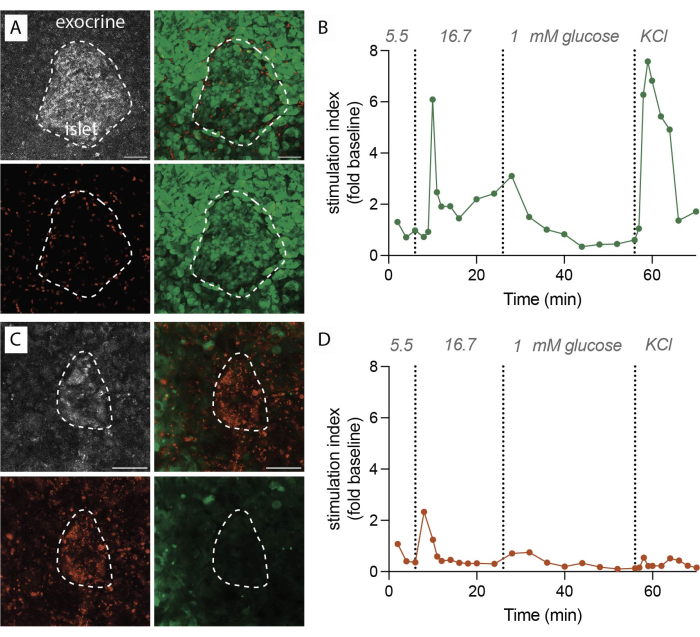
الشكل 2: بيانات صلاحية الأنسجة وإفراز الأنسولين. (أ) صور تمثيلية لشرائح الأنسجة القابلة للحياة. أقصى كثافة إسقاط لضوء الليزر المنعكس (رمادي ، أعلى اليسار) ، PI للخلايا الميتة (أحمر ، أسفل اليسار) ، FDA للخلايا الحية (أخضر ، أسفل اليمين) ، والصور المدمجة للخلايا الحية والميتة (أعلى اليمين). يشير الخط المنقط إلى جزيرة. شريط مقياس 50 ميكرومتر. ب: إفراز الأنسولين الديناميكي لشرائح أنسجة البنكرياس البشرية من متبرع واحد غير مصاب بالسكري. تظهر حركية الأنسولين استجابة ذروة المرحلة الأولى بعد 6 دقائق من تحفيز الجلوكوز العالي ، تليها المرحلة الثانية من الهضبة. يتم تطبيع البيانات إلى متوسط إفراز خط الأساس عند 5.5 مللي مول من الجلوكوز (مؤشر التحفيز ، تغيير الطي). تم إجراء الإفراز على شرائح من نفس المتبرع كما هو موضح في (أ). ج: صور تمثيلية لشرائح الأنسجة غير القابلة للحياة. أقصى كثافة إسقاط لضوء الليزر المنعكس (رمادي ، أعلى اليسار) ، PI للخلايا الميتة (أحمر ، أسفل اليسار) ، FDA للخلايا الحية (أخضر ، أسفل اليمين) ، والصور المدمجة للخلايا الحية والميتة (أعلى اليمين). يشير الخط المنقط إلى جزيرة. شريط مقياس 50 ميكرومتر. د: إفراز الأنسولين الديناميكي لشرائح أنسجة البنكرياس البشرية من متبرع واحد غير مصاب بالسكري. تظهر حركية الأنسولين فقدانا واضحا لكل من إفراز الأنسولين المحفز للجلوكوز وإزالة استقطاب الغشاء باستخدام KCl. يتم تطبيع البيانات إلى متوسط إفراز خط الأساس عند 5.5 مللي مول من الجلوكوز (مؤشر التحفيز ، تغيير الطي). تم إجراء الإفراز على شرائح من نفس المتبرع كما هو موضح في (ج). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تحميل الأنسجة من أجل الانتشار الديناميكي. (أ) غرف شرائح مكدسة. يتم تحميل الشرائح الفردية على شبكة معدنية كما هو موضح في الملحق. (ب) تحميل الجزر المعزولة في غرف الجزر. غرف الشرائح والجزر متصلة بآلة الانتشار. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
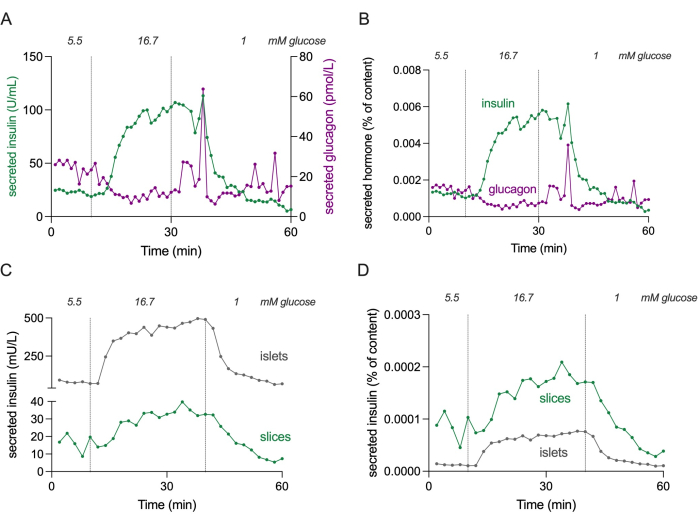
الشكل 4: إفراز الهرمونات في شرائح وجزر معزولة. تنشأ البيانات الموضحة في اللوحتين (أ) و (ب) من جهة مانحة مختلفة مقارنة باللوحتين (جيم) و (دال). أ: إفراز هرمون مطلق من 3 شرائح من أنسجة البنكرياس من متبرع واحد غير مصاب بالسكري. يظهر إفراز الأنسولين باللون الأخضر وإفراز الجلوكاجون باللون الأرجواني. (ب) إفراز الهرمونات الموضح في (أ) طبيعي إلى إجمالي محتوى الهرمون (٪ من المحتوى). يتم قياس المحتوى من جميع الشرائح ال 3 المستخدمة في التجربة. ج: إفراز الأنسولين الديناميكي للجزر المعزولة (100 جزيرة) وشرائح أنسجة البنكرياس (3 شرائح) من نفس المتبرع غير المصاب بالسكري. تظهر البيانات بالأعداد المطلقة (mU / L). (د) إفراز الإنسولين الموضح في (ج) طبيعي إلى إجمالي محتوى الأنسولين (٪ من المحتوى). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
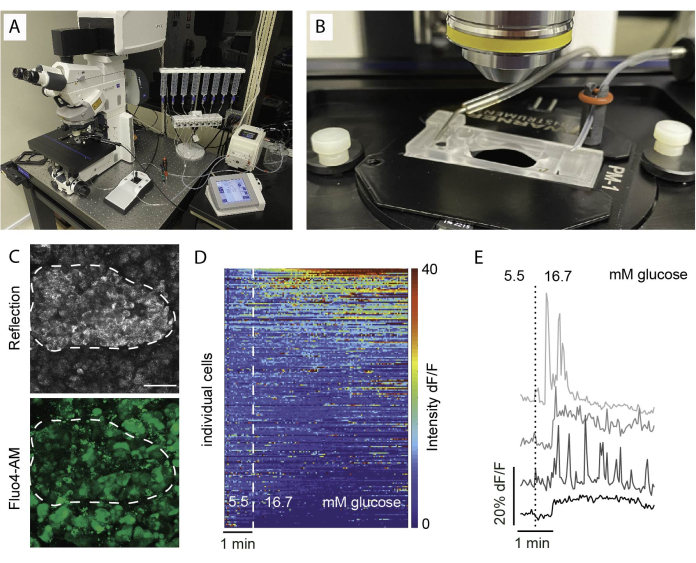
الشكل 5: إعداد التصوير والنتائج المتوقعة. (أ) الإعداد للتصوير الوظيفي باستخدام مجهر متحد البؤر قائم وإعداد محيط الاندماج. (ب) غرفة تصوير متصلة بالتدفق الداخل والخارج. (C) مجموعة Z من الصور متحدة البؤر لجزيرة صغيرة داخل شريحة نسيج من متبرع بشري سليم تظهر الضوء المنعكس (أعلى) وإشارة Fluo4 (أسفل). يستخدم الانعكاس لتحديد الجزر داخل الشريحة (الخط المنقط). (د) خريطة حرارية تظهر في المختبر ديناميكيات Ca2+ للخلايا الجزرية معبرا عنها بكثافة الفلورسنت ل Fluo4 طبيعية لشدة الإشارة القاعدية عند 5.5 mM الجلوكوز والتحفيز مع ارتفاع الجلوكوز (16.7 mM). يمثل كل صف خلية واحدة متبوعة بمرور الوقت في المحور السيني واستجابتها في تغير الحجم (٪) من شدة الفلورسنت على خط الأساس (dF / F) الموضحة في مقياس الألوان من الأزرق (كثافة منخفضة) إلى الأحمر (كثافة عالية). ه: آثار تمثيلية ل 4 خلايا فردية تظهر استجابة لارتفاع الجلوكوز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
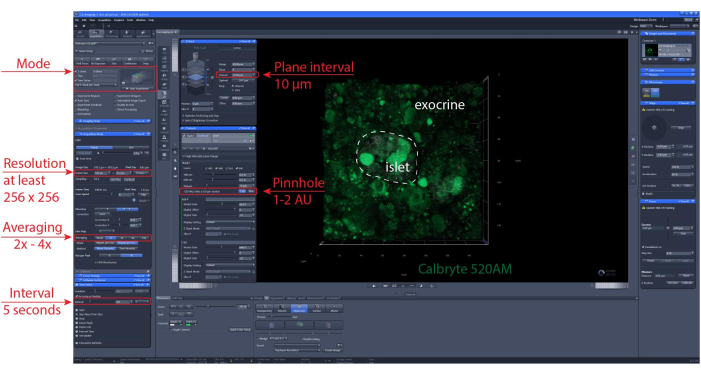
الشكل 6: إعدادات تصوير الكالسيوم. لقطة شاشة لبرنامج الإعدادات التمثيلية المختارة لإجراء تسجيلات الفاصل الزمني ل 40 ميكرومتر (تصوير XYZT). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
نقدم هنا بروتوكولا لتوليد شرائح أنسجة البنكرياس القابلة للحياة واستخدامها في القراءات الوظيفية مثل إفراز الهرمونات الديناميكي والتصوير الوظيفي. على غرار عزل الجزر البشرية ، يتأثر نجاح إجراء الشريحة بعوامل مختلفة ، بما في ذلك خصائص المتبرع ، ووقت شحن الأنسجة ، وجودة الأنسجة25,29. لذلك ، من الأهمية بمكان اختيار عينات الأنسجة بعناية للتجربة والحفاظ على أوقات نقص التروية إلى الحد الأدنى. في هذا السياق ، ينبغي النظر بعناية في المصادر المحتملة الأخرى للأنسجة البشرية إلى جانب المتبرعين بالجثث. يوفر تضمين المتبرعين الجراحيين خيار الجمع بين بيانات الشرائح الوظيفية والمعلومات ذات الصلة في الجسم الحي من نفس المريض ، مما يعزز الصلة الانتقالية11. ومع ذلك ، فإن مصدر الأنسجة هذا يجلب عوامل أخرى لأن الخزعات عادة ما تكون من المرضى الأكبر سنا الذين يخضعون لاستئصال البنكرياس في الغالب بسبب ورم موضعي. والجدير بالذكر أن خزعات البنكرياس لا يتم إجراؤها في سياق مرض السكري.
عند إجراء عملية التقطيع الفعلية ، تعد معالجة الأنسجة في الوقت المناسب أمرا بالغ الأهمية. يمكن تخزين الشرائح لعدة ساعات ، كما هو موضح في هذا البروتوكول ، أو استزراعها لفترات طويلة ، كما وصفها قادر وآخرون 19. في الوقت الحاضر ، يقف هذا البروتوكول كطريقة وحيدة للحفاظ على صلاحية الشريحة على مدى فترات طويلة ، ومع ذلك ، يجب أن تقوم الجهود المستقبلية بتقييم التغيرات الوظيفية عبر أوقات الثقافة المتنوعة وإجراء مقارنات مع الجزر المعزولة ، من نفس الجهة المانحة.
الخطوة الأكثر أهمية في العملية هي التحضير الدقيق للأنسجة قبل تضمينها في الأغاروز. يمكن أن تؤدي القنوات الكبيرة والأنسجة الليفية إلى تعقيد عملية التقطيع ومن المحتمل أن تؤدي إلى خروج كتل الأنسجة من الأغاروز. إذا حدث هذا وظلت القطع بحجم معقول ، فيمكن إعادة معالجتها وتضمينها للتقطيع. إن الحفاظ على جودة الأنسجة الجيدة والمعالجة الدقيقة يعزز بشكل كبير من كفاءة إجراء التقطيع وينتج أقصى كمية ونوعية من الشرائح. يجب ألا يتجاوز الوقت المنقضي من تحضير الأنسجة إلى توليد الشرائح 2-3 ساعات ، حيث تؤثر الفترات الأطول بشكل كبير على صلاحية الأنسجة.
أثناء عملية فحص الشرائح، تتمثل الخطوة البسيطة والحاسمة في التشذيب الدقيق للشريحة لضمان ملاءمة مثالية للحجرة. هذا يسمح للاستحمام السليم للأنسجة والتدفق دون انقطاع. بمجرد بدء البروتوكول ، من الضروري تجنب المزيد من التلاعب بالغرف لمنع الطفرات غير المرغوب فيها في إفراز الهرمونات. يجب إعداد عازل كاف ، ويجب أن تصل الأنابيب إلى قاع المحلول لمنع شفط الهواء وجفاف الغرف.
بالنسبة لتصوير الكالسيوم ، من المهم اختيار مجال الاهتمام بعناية ، اعتمادا على الاحتياجات التجريبية والتصميم. من المهم تقليل التبييض الضوئي عن طريق اختيار معلمات التصوير التي تقلل من التعرض للضوء أو تقصر وقت البروتوكول الإجمالي. مثل إفراز الهرمونات الديناميكي ، يعد الحفاظ على تدفق المحلول المناسب والإعداد الساخن أمرا بالغ الأهمية ، حيث تتطلب الشرائح ظروفا شبه فسيولوجية للحصول على الوظيفة المثلى (على سبيل المثال ، 37 درجة مئوية).
تحافظ شرائح أنسجة البنكرياس بشكل فعال على السلامة الهيكلية للبنكرياس ، مما يحافظ على روابط الخلايا الخلوية بين أنواع الخلايا المتنوعة. وبالتالي ، فإنها توفر بديلا للعمل مع الجزر المعزولة ، مما يسهل الاستكشاف المتزامن لكل من وظائف الغدد الصماء والخارجية الإفراز وتفاعلها. لتقييم التفاعل بين أنواع الخلايا الفردية ، من الأهمية بمكان التمييز بينها. يعد التلوين بعد ذلك أحد الخيارات ، ولكن له قيود من حيث مجسات الفلورسنت المتاحة والتحدي المتمثل في تحديد طبقات الخلايا الدقيقة. لذلك ، ينصح بدمج المحفزات الخاصة بالخلية في البروتوكول لتمكين تمييز الخلايا بناء على الاستجابات. للتمييز بين أنواع الخلايا في شرائح الفئران أو البشر ، تشمل المحفزات الفعالة الأدرينالين لخلايا ألفا21,30 ، والجريلين لخلايا دلتا31 ، والسيرولين للخلايا الأسينية 5,32 ، والأحماض الصفراوية للخلايا الأقنية33 ، والنورادرينالين لخلايا الأوعية الدموية22. يمكن استخدام محفزات مماثلة لقياس الاستجابات الإفرازية. بينما تركز دراسات التصوير على الخلايا الفردية ، تحلل دراسات الإفراز الاستجابة الجماعية. وبالتالي ، من الأهمية بمكان تضمين عدد كبير من الشرائح لاكتشاف النتائج المرجوة. قد تختلف الكمية المثلى بين أنواع الخلايا ، مع ثلاث شرائح تثبت أنها كافية لخلايا الغدد الصماء. ومع ذلك ، فمن المستحسن استخدام المزيد من الشرائح لضمان إمكانية الكشف بدلا من المخاطرة بفقدان المعلومات القيمة.
مثل أي طريقة أخرى ، فإن شرائح الأنسجة لها قيود يجب مراعاتها عند تفسير النتائج. قد يؤدي تطبيق التحفيز الذي يستهدف أنواعا معينة من الخلايا إلى تأثيرات على أنواع الخلايا الأخرى في الشريحة ، مما قد يؤدي إلى حلقات التغذية الراجعة. ومع ذلك ، من المهم أيضا دراستها ، وبالتالي يمكن أن تكون الاستجابات المقاسة أكثر تمثيلا للاستجابة الفسيولوجية. لاستهداف الخلايا الانتقائي ، يمكن استخدام البروتوكولات التقليدية في المختبر . الأهم من ذلك أن الخلايا العنيبية تحتوي على إنزيمات البنكرياس التي يمكنها تكسير البروتينات وهضم شريحة الأنسجة ، مما يؤدي إلى تدهور الخلايا في غضون ساعات. للحفاظ على الصلاحية ، يعد الاستخدام المتسق لمثبطات التربسين ضروريا عندما تكون الشرائح في حالة ثابتة ، على الرغم من أن تطبيقها قد يتداخل مع النقل الناجح للفيروسات المستخدمة لأغراض وضع العلامات.
بالمقارنة مع عزل الجزيرة ، يمكن أن يؤثر تباين المانحين وجودة الأنسجة على كل من كمية وصلاحية الشرائح التي تم الحصول عليها. قد يؤدي عدم كفاية الجدوى بعد التقطيع إلى عمر قصير ويعيق القدرة على استزراع الشرائح. علاوة على ذلك ، يمكن أن يختلف عدد الجزر بشكل كبير بين الجهات المانحة ، مما يجعل من الصعب تقدير محتوى الجزر قبل إجراء التجارب. وبالتالي ، فإن الاختيار الدقيق لمعايير قبول المانحين وتنفيذ طرق التطبيع المناسبة ، مثل النسبة المئوية لمحتوى الهرمون للإفراز أو تغيير الطيات إلى خط الأساس ، أمر بالغ الأهمية. للحصول على نتائج متسقة ، ينصح بتقييم صلاحية شريحة الأنسجة قبل التجربة. علاوة على ذلك ، يوصى بدمج محفزات التحكم ذات الصلة (على سبيل المثال ، KCl) في التجربة. في حالات تحليل الخلايا الفردية ، مثل التصوير ، يمكن تنفيذ فرز الخلايا مسبقا بناء على استجابتها لمحفزات التحكم هذه. على الرغم من التحديات المذكورة ، تقدم الشرائح زيادة قيمة لطرق البحث الحالية.
يمكن استخدام البروتوكول الموصوف كنقطة انطلاق للعديد من التطبيقات ، ويمكن التلاعب بشرائح البنكرياس ، وفحص الاستجابات بعد مجموعة متنوعة من المحفزات. كما نوجه القراء إلى العديد من الدراسات البحثية باستخدام شرائح البنكرياس الفأر أو الإنسان ، مما يوفر رؤى قيمة لأولئك الذين يخططون لتجاربهم. في المستقبل ، من الممكن أن يتم التحقيق في العلاجات المحتملة باستخدام شرائح البنكرياس أو أن آليات المرض قد يتم نمذجتها.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم إجراء هذا البحث بدعم من شبكة المتبرعين بأعضاء البنكرياس المصابين بداء السكري (nPOD; RRID: SCR_014641) ، وهو مشروع بحثي تعاوني لمرض السكري من النوع 1 مدعوم من JDRF (nPOD: 5-SRA-2018-557-Q-R) وصندوق Leona M. and Harry B. Helmsley الخيري (Grant # 2018PG-T1D053 ، G-2108-04793). المحتوى والآراء المعبر عنها هي مسؤولية المؤلفين ولا تعكس بالضرورة وجهة النظر الرسمية ل nPOD. يتم سرد منظمات شراء الأعضاء (OPO) التي تشارك مع nPOD لتوفير موارد البحث في http://www.jdrfnpod.org/for-partners/npod-partners/. ويعرب المؤلفون عن امتنانهم للمتبرعين وأسرهم على مساهمتهم القيمة. تم دعم هذا العمل من قبل جمعية السكري الأمريكية 4-22-PDFPM (J.K.P.) وصندوق Leona M. and Harry B. Helmsley الخيري (منحة 2015-PG-T1D-052).
Materials
| Name | Company | Catalog Number | Comments |
| Alanine | Sigma | A7627 | amino acid |
| AlexaFluor 488 goat anti-guineapig | Invitrogen | A11073 | secondary antibody |
| AlexaFluor 546 goat anti-rat | Thermo Fisher | A11077 | secondary antibody |
| AlexaFluor 647 goat anti-mouse | Thermo Fisher | A21235 | secondary antibody |
| Aprotinin | Sigma | A1153 | inhibitor |
| Arginine | Sigma | A5006 | amino acid |
| Calbryte 520 AM | AAT Bioquest | 20651 | Calcium dye |
| Fluo4-AM | Invitrogen | F14201 | Calcium dye |
| Fluorescein diacetat | Sigma | F7378 | viability marker |
| Glucagon | Sigma | G2654 | primary antibody |
| Glucagon ELISA (human kit) | Mercodia | 10-1271-01 | ELISA for hormone detection |
| Glutamine | Sigma | G3126 | amino acid |
| Insulin | Dako | A-0546 | primary antibody |
| Insulin ELISA (human) | Mercodia | 10-1113-01 | ELISA for hormone detection |
| Low melting point agarose | Sigma | A9414 | |
| LSM 900 | Zeiss | confocal microscope | |
| Pancreas Slice Chamber | Biorep Technologies | PERI-PSC-001 | slice chamber for perifucion |
| Pancreas Slice Chamber Extender Kit | Biorep Technologies | PERI-PSC-EXT | slice chamber for perifucion |
| Pancreas Slice Chamber Perforated Plate | Biorep Technologies | PERI-PSC-PP | slice chamber for perifucion |
| Perifusion system with automated tray handling | Biorep Technologies | PERI4-02-230-FA | |
| Propidium iodide | Life technologies | P1304MP | dead marker |
| Semi-automatic vibratome VT1200S | Leica | 14048142066 | |
| Somatostatin | Millipore | MAB354 | primary antibody |
References
- Abdelli, S., et al. Intracellular stress signaling pathways activated during human islet preparation and following acute cytokine exposure. Diabetes. 53 (11), 2815-2823 (2004).
- Lyon, J., et al. Research-focused isolation of human islets from donors with and without diabetes at the alberta diabetes institute isletcore. Endocrinology. 157 (2), 560-569 (2016).
- Speier, S., Rupnik, M. A novel approach to in situ characterization of pancreatic beta-cells. Pflugers Arch. 446 (5), 553-558 (2003).
- Cohrs, C. M., et al. Vessel network architecture of adult human islets promotes distinct cell-cell interactions in situ and is altered after transplantation. Endocrinology. 158 (5), 1373-1385 (2017).
- Marolt, U., et al. Calcium imaging in intact mouse acinar cells in acute pancreas tissue slices. PLoS One. 17 (6), 0268644(2022).
- Stozer, A., et al. Confocal laser scanning microscopy of calcium dynamics in acute mouse pancreatic tissue slices. J Vis Exp. (170), e62293(2021).
- Stozer, A., Dolensek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of langerhans in acute mouse pancreas tissue slices. PLoS One. 8 (1), e54638(2013).
- Weitz, J. R., et al. Mouse pancreatic islet macrophages use locally released atp to monitor beta cell activity. Diabetologia. 61 (1), 182-192 (2018).
- Speier, S., Yang, S. B., Sroka, K., Rose, T., Rupnik, M. Katp-channels in beta-cells in tissue slices are directly modulated by millimolar atp. Mol Cell Endocrinol. 230 (1-2), 51-58 (2005).
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Mol Metab. 6 (9), 943-957 (2017).
- Cohrs, C. M., et al. Dysfunction of persisting beta cells is a key feature of early type 2 diabetes pathogenesis. Cell Rep. 31 (1), 107469(2020).
- Marciniak, A., et al. Using pancreas tissue slices for in situ studies of islet of langerhans and acinar cell biology. Nat Protoc. 9 (12), 2809-2822 (2014).
- Panzer, J. K., et al. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. JCI Insight. 5 (8), e134525(2020).
- Campbell-Thompson, M., et al. Network for pancreatic organ donors with diabetes (npod): Developing a tissue biobank for type 1 diabetes. Diabetes Metab Res Rev. 28 (7), 608-617 (2012).
- Kaddis, J. S., Pugliese, A., Atkinson, M. A. A run on the biobank: What have we learned about type 1 diabetes from the npod tissue repository. Curr Opin Endocrinol Diabetes Obes. 22 (4), 290-295 (2015).
- Pugliese, A., et al. New insight on human type 1 diabetes biology: Npod and npod-transplantation. Curr Diab Rep. 14 (10), 530(2014).
- Pugliese, A., et al. The juvenile diabetes research foundation network for pancreatic organ donors with diabetes (npod) program: Goals, operational model and emerging findings. Pediatr Diabetes. 15 (1), 1-9 (2014).
- Liang, T., et al. Ex vivo human pancreatic slice preparations offer a valuable model for studying pancreatic exocrine biology. J Biol Chem. 292 (14), 5957-5969 (2017).
- Qadir, M. M. F., et al. Long-term culture of human pancreatic slices as a model to study real-time islet regeneration. Nat Commun. 11 (1), 3265(2020).
- Huber, M. K., et al. Observing islet function and islet-immune cell interactions in live pancreatic tissue slices. J Vis Exp. (170), e62207(2021).
- Panzer, J. K., Tamayo, A., Caicedo, A. Restoring glutamate receptor signaling in pancreatic alpha cells rescues glucagon responses in type 1 diabetes. Cell Rep. 41 (11), 111792(2022).
- Mateus Goncalves, L., Almaca, J. Functional characterization of the human islet microvasculature using living pancreas slices. Front Endocrinol (Lausanne). 11, 602519(2020).
- Doke, M., et al. Dynamic scrna-seq of live human pancreatic slices reveals functional endocrine cell neogenesis through an intermediate ducto-acinar stage. Cell Metab. 35 (11), 1944-1960 (2023).
- Mateus Goncalves, L., et al. Pericyte dysfunction and impaired vasomotion are hallmarks of islets during the pathogenesis of type 1 diabetes. Cell Rep. 42 (8), 112913(2023).
- Hanley, S. C., Paraskevas, S., Rosenberg, L. Donor and isolation variables predicting human islet isolation success. Transplantation. 85 (7), 950-955 (2008).
- Hart, N. J., Powers, A. C. Use of human islets to understand islet biology and diabetes: Progress, challenges and suggestions. Diabetologia. 62 (2), 212-222 (2019).
- Henquin, J. C. The challenge of correctly reporting hormones content and secretion in isolated human islets. Mol Metab. 30, 230-239 (2019).
- Panzer, J. K., Caicedo, A. Protocol to generate and utilize pancreatic tissue slices to study endocrine and exocrine physiology in situ from mouse and human tissue. STAR Protoc. 4 (3), 102399(2023).
- Toso, C., et al. Factors affecting human islet of langerhans isolation yields. Transplant Proc. 34 (3), 826-827 (2002).
- Hamilton, A., et al. Adrenaline stimulates glucagon secretion by tpc2-dependent ca(2+) mobilization from acidic stores in pancreatic alpha-cells. Diabetes. 67 (6), 1128-1139 (2018).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- Marciniak, A., Selck, C., Friedrich, B., Speier, S. Mouse pancreas tissue slice culture facilitates long-term studies of exocrine and endocrine cell physiology in situ. PLoS One. 8 (11), e78706(2013).
- Gal, E., et al. A novel in situ approach to studying pancreatic ducts in mice. Front Physiol. 10, 938(2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved