Method Article
Generazione di fette di tessuto pancreatico umano per studiare la fisiologia del pancreas endocrino ed esocrino
In questo articolo
Riepilogo
Questo protocollo descrive come generare fette di pancreas umano da donatori di organi deceduti per studiare la funzione cellulare in condizioni quasi fisiologiche. Questo approccio innovativo consente lo studio di isole normali e strutturalmente danneggiate e l'intricata interazione tra compartimenti endocrini ed esocrini.
Abstract
È fondamentale studiare il pancreas umano per comprendere i meccanismi fisiopatologici associati al diabete di tipo 1 (T1D) e 2 (T2D), nonché la fisiologia e l'interazione endocrina ed esocrina del pancreas. Molto è stato appreso dallo studio delle isole pancreatiche isolate, ma questo impedisce di esaminare la loro funzione e le loro interazioni nel contesto dell'intero tessuto. Le fette di pancreas offrono un'opportunità unica per esplorare la fisiologia delle isole normali, infiammate e strutturalmente danneggiate all'interno del loro ambiente nativo, consentendo a sua volta lo studio delle interazioni tra compartimenti endocrini ed esocrini per indagare meglio le complesse dinamiche del tessuto pancreatico. Pertanto, l'adozione della piattaforma di fette di pancreas vivente rappresenta un progresso significativo nel campo. Questo protocollo descrive come generare fette di tessuto vivente da donatori di organi deceduti mediante incorporamento di tessuto nell'agarosio e nel vibratomo slicing, nonché il loro utilizzo per valutare letture funzionali come la secrezione dinamica e l'imaging di cellule vive.
Introduzione
Gli studi sulla fisiologia delle isole sono fondamentali per comprendere la patogenesi del diabete e sviluppare nuovi approcci terapeutici. Finora, la ricerca si è basata su isole isolate, che espongono le isole a stress meccanici ed enzimatici, causando probabilmente cambiamenti nella fisiologia cellulare; Inoltre, non è possibile valutare la funzione delle isole nel contesto del loro ambiente tissutale naturale, che è probabilmente influenzato da cellule esocrine e vascolari tra le altre1. Quando si studia il pancreas di donatori con T1D, c'è la sfida che le loro isole sono difficili da isolare e potrebbero frammentarsi durante l'isolamento, il che potrebbe produrre un effetto di selezione sulle isole che potrebbero non rappresentare la popolazione in vivo2. Inoltre, le isole saranno separate dal loro ambiente complesso e dalle connessioni cellulari, in particolare dalle cellule immunitarie infiltranti che si trovano nelle isole infiammate e sono più abbondanti nella periferia delle isole. Pertanto, mentre le isole isolate sono uno strumento fondamentale nella ricerca sul diabete, ci sono dei limiti. In risposta, introduciamo un protocollo innovativo per la generazione di fette di pancreas vivente, offrendo una soluzione a queste sfide.
Il recente sviluppo e l'adozione di tecniche di taglio del tessuto pancreatico è considerato una svolta per la nostra capacità di esplorare l'intricata biologia e le funzioni del pancreas. Questa innovazione ha aperto nuove strade per studi dinamici sulla fisiologia delle isole e sulle interazioni tra cellule endocrine, esocrine, neurali, vascolari e immunitarie nel loro contesto anatomico naturale. A differenza degli approcci convenzionali, questo ambiente in vitro preserva gran parte della citoarchitettura dell'organo, consentendo un'approssimazione più vicina alla sua biologia nativa. Inizialmente sviluppato nei topi da Speier e Rupnik nel 20033, questo metodo ha dimostrato la sua utilità per valutare l'imaging del calcio, l'elettrofisiologia e la secrezione ormonale per la segnalazione intra e intercellulare 4,5,6,7,8,9. La piattaforma della fetta di pancreas è stata quindi applicata allo studio del tessuto pancreatico umano ottenuto tramite biopsia chirurgica 4,10,11,12. Il nostro gruppo ha dimostrato la fattibilità di ottenere e utilizzare fette di pancreas da donatori di organi cadaverici attraverso l'attività della Rete per i donatori di organi pancreatici con diabete (nPOD)13. nPOD fornisce tessuti pancreatici a ricercatori approvati che conducono ricerche sul diabete umano di tipo 1 e, poiché ha adottato la piattaforma di fette di pancreas, nPOD genera e distribuisce regolarmente fette di pancreas viventi 14,15,16,17. Dall'implementazione della piattaforma di fette di pancreas nel 2020, nPOD ha distribuito con successo fette di tessuto da 43 donatori (inclusi 12 donatori con T1D) a numerosi ricercatori. Utilizzando queste fette, i ricercatori hanno eseguito ricerche innovative sugli aspetti critici della funzione delle isole e hanno esplorato l'interazione tra le isole e il sistema vascolare, il sistema nervoso e le cellule immunitarie nel contesto del T1D 13,18,19,20,21,22,23,24 . Numerosi studi hanno evidenziato i limiti degli approcci tradizionali e hanno sottolineato l'importanza delle tecniche in grado di catturare l'interazione dinamica all'interno del pancreas 25,26,27. L'adattabilità delle tecniche di affettatura dal topo al pancreas umano, unita alla loro integrazione in programmi come la Rete per i donatori di organi pancreatici con diabete (nPOD), esemplifica il crescente riconoscimento del potenziale del metodo per sbloccare preziose informazioni su malattie come il diabete di tipo 1.
Protocollo
Le sezioni pancreatiche umane da donatori di tessuti di entrambi i sessi sono state ottenute tramite la banca dei tessuti Network for Pancreatic Organ Donors with Diabetes (nPOD), Università della Florida. I tessuti di organi di individui deceduti senza identificatori sono stati determinati come soggetti non umani in conformità con le leggi e i regolamenti sulla donazione di organi e classificati come soggetti non umani dall'Institutional Review Board (IRB; IRB n. 392-2008), rinunciando alla necessità del consenso. I tessuti nPOD specificamente utilizzati per questo progetto sono stati approvati come non umani dall'IRB (IRB20140093 dell'Università della Florida.
NOTA: Per i lettori che non conoscono la tecnica della fetta e le sue applicazioni, come la perifusione e l'imaging del calcio, potrebbe essere consigliabile acquisire esperienza pratica e sviluppare abilità di base utilizzando fette di topo o ratto 3,28 prima di lavorare con campioni umani.
1. Preparativi
NOTA: Questi preparativi devono essere eseguiti prima dell'arrivo dei tessuti.
- Preparare il tampone HEPES mescolando 125 mM di NaCl, 5,9 mM di KCl, 2,56 mM di CaCl2, 1 mM di MgCl2, 25 mM di HEPES, 0,1% di BSA, 2 mM di L-alanina, L-arginina e L-glutammina. Regolare il pH a 7,4 e sterilizzare con filtro.
- Aggiungere glucosio e/o altri stimoli al tampone per preparare soluzioni per l'esperimento di perifusione. Per il tampone basale aggiungere 5,5 mM di glucosio. Questo tampone verrà utilizzato per le procedure di affettatura, la raccolta delle fette e le preparazioni di perifusione.
- Preparare almeno due piatti per la raccolta delle fette aggiungendo aprotinina (10 μg/mL) al tampone basale.
- Preparare una soluzione di agarosio a basso punto di fusione al 3,8% in tampone HEPES senza BSA e aminoacidi (125 mM NaCl, 5,9 mM KCl, 2,56 mM CaCl2, 1 mM MgCl2, 25 mM HEPES) e mantenerla a 37 °C.
- Assemblare il vibratomo, inserendo una lama nuova nel supporto. Se applicabile, impostare l'angolo della lama a 15° (se si utilizza Leica VT1200S). Se applicabile, calibrare il vibratomo.
- Accendere la macchina per la perifusione, selezionare il numero di camere e il protocollo del programma.
- Posizionare tutte le soluzioni necessarie nella macchina perifusionale, adescare il sistema e mantenere le soluzioni riscaldate. La macchina calcola i volumi necessari di ciascuna soluzione utilizzata per il protocollo.
2. Lavorazione dei tessuti
NOTA: le sezioni devono essere generate immediatamente dopo la ricezione. Qualsiasi ritardo potrebbe causare difficoltà nella procedura e portare alla degradazione dei tessuti.
- Posizionare il tessuto pancreatico in un piatto con tampone basale sotto uno stereomicroscopio (Figura 1A). Rimuovere delicatamente i tessuti connettivi, fibrotici e adiposi utilizzando pinze e forbici.
- Tagliare il tessuto in più piccoli pezzi di circa 0,5 cm3 (Figura 1B) usando le forbici o un bisturi. Asciugare i pezzi di pancreas su carta velina.
- Trasferire 4 pezzi in una capsula di Petri da 35 mm e riempire la capsula con una soluzione di agarosio fino a quando tutti i pezzi sono completamente sommersi. Lasciare che l'agarosio si solidifichi completamente.
- Tagliare con cura dei pezzi dall'agarosio. Passare il bisturi lungo il bordo del piatto per rimuovere l'agarosio e separare accuratamente i blocchi di tessuto. Assicurati che i pezzi siano circondati da un sottile strato di agarosio.
3. Affettare
- Incollare pezzi di tessuto sulla piastra metallica del vibratomo posizionandoli capovolti.
- Montare la piastra nel vassoio e riempirla con il tampone di base (HEPES contenente 5,5 mM di glucosio basale).
- Impostare il vibratomo sullo slicing automatico a 120 μm e regolare la posizione iniziale e finale.
- Spostare la lama poco sopra il tessuto e iniziare ad affettare a bassa velocità (0,1 mm/s) e ampiezza a 0,8 mm. La velocità può essere aumentata se il tessuto lo consente (Figura 1C).
- Raccogli le fette usando una pinza curva o un pennellino. Accumulare fette nel tampone basale contenente aprotinina (Figura 1D).
- Lasciare riposare le fette per almeno 1 ora nel tampone basale con aprotinina. Posizionare le fette su uno shaker orbitale lento per consentire l'eliminazione degli enzimi rilasciati dalla procedura di taglio.
4. Saggio vivo/morto
NOTA: Questo è un test opzionale che mostrerà la vitalità delle fette di tessuto dopo la procedura. Tuttavia, le fette non possono essere riutilizzate una volta colorate.
- Trasferire una singola sezione in un pozzetto riempito con buffer di base.
- Aggiungere il diacetato di fluoresceina (FDA, 50 μg/mL), incubare per 1 minuto a temperatura ambiente e proteggere dalla luce.
- Aggiungere ioduro di propidio (PI,50 μg/mL), incubare per 1 minuto a temperatura ambiente e proteggere dalla luce.
- Trasferire la fetta in un'altra fontana riempita di PBS per lavare per 1 minuto.
- Trasferire le fette in una piastra di Petri o montarle su un vetrino con vetrino coprioggetto per l'imaging (Figura 2A, B).
5. Perifusione
NOTA: Questo protocollo descrive come eseguire la perifusione dinamica per fette di tessuto, tuttavia è adatto anche per isole isolate. Le camere delle isole dovranno essere preparate con carta da filtro e soluzione di perline prima di caricare le isole come descritto nel manuale utente della macchina. Tuttavia, l'isolotto e la camera a fette possono essere utilizzati insieme nello stesso esperimento.
- Scegli 3 fette e taglia l'agarosio al minimo sotto uno stereomicroscopio usando pennello e bisturi.
- Aggiungere una goccia di tampone basale (HEPES contenente 5,5 mM di glucosio basale) sulla griglia della camera a fette e posizionare delicatamente una fetta sulla griglia. Ripetere per ciascuna delle 3 fette (Figura 3A). Se le fette sono molto piccole, impilare più di 3 camere per aumentare il numero di isolotti. Non posizionare più di una fetta per camera.
NOTA: Il numero di isole per fetta varia notevolmente tra i donatori e dipende dalle dimensioni della fetta (10-100 isole/fetta). Un totale di 3 fette si è dimostrato sufficiente per misurare sia la secrezione di insulina che quella di glucagone. - Per le isole isolate, utilizzare un minimo di 30 isole per colonna per la secrezione di insulina. Si consiglia di utilizzare 100 isolotti per il rilevamento del glucagone. Assemblare le singole parti della camera di taglio dall'alto verso il basso.
- Collegare la camera di taglio ai tubi di afflusso e di uscita nella macchina e avviare il protocollo (Figura 3C).
- Utilizzare il riscaldamento della camera e la pompa di raffreddamento del vassoio durante il protocollo. Cambiare le piastre di raccolta durante il protocollo e conservare a 4 °C se la quantificazione viene eseguita lo stesso giorno o conservare a -80 °C fino a quel momento.
- Al termine del protocollo, rimuovere le camere, smontare e raccogliere le fette per la lisi (3% di HCl in etanolo assoluto) o la fissazione (in paraformaldeide al 4%).
- Pulire la macchina sciacquandola con acqua, candeggina al 10%, acqua e aria.
- Quantificare la secrezione ormonale utilizzando kit di rilevamento disponibili in commercio.
NOTA: La Figura 4 mostra i livelli assoluti di secrezione di insulina e glucagone di 3 fette per stimare gli intervalli di concentrazione.
6. Imaging del calcio
- Preparare la soluzione di colorante di calcio (ad es. Fluo4-AM, Calbryte) secondo le istruzioni del produttore.
- Diluire il colorante nella soluzione tampone HEPES basale e aggiungere aprotinina (10 μg/mL).
- Trasferire una singola fetta e incubare per 30-60 minuti su un agitatore orbitale a temperatura ambiente e proteggere dalla luce.
- Durante il tempo di incubazione, preparare l'impostazione dell'imaging della fetta riempiendo le siringhe di perifusione e adescando i tubi (Figura 5A, B).
- Collegare tutti i dispositivi, accendere il riscaldatore e avviare il flusso della pompa. Si consiglia di utilizzare sia il riscaldamento a flusso che il riscaldatore della piattaforma e una portata di 0,5 mL/min.
- Posizionare delicatamente una singola fetta nella camera di imaging e fissarla con un'arpa.
- Utilizzare un obiettivo a basso ingrandimento per identificare l'area di imaging. L'uso della riflessione aiuta a identificare l'area delle isole (Figura 5C).
- Passa a un obiettivo con ingrandimento più elevato (ad es. 20x o 40x) e regola la posizione in base alla configurazione sperimentale.
NOTA: Per garantire una vitalità cellulare ottimale e l'integrità delle isole, si consiglia che le sezioni ottiche si trovino 1-2 strati di celle sotto la superficie di taglio. - Imposta la posizione di scansione z-stack e/o tile. Imposta l'intervallo di imaging e la durata della registrazione. Qui, è stata utilizzata una risoluzione di almeno 256 x 256 per consentire la discriminazione delle singole cellule, un intervallo di imaging di 5-10 s e un intervallo z-stack (se applicabile) di 30-60 μm con un intervallo di 10 μm tra i piani (uno strato cellulare). Vedere la Figura 6 per le impostazioni di imaging dettagliate.
NOTA: Impostare i parametri di imaging per ottenere la migliore risoluzione e l'area massima, ma evitare lo sbiancamento del campione. - Avviare l'imaging e cambiare l'afflusso della soluzione in base all'esperimento. Una volta fatto, raccogli le fette e fissale per l'immunoistochimica.
Risultati
Quando il protocollo viene eseguito con successo, 1 g di tessuto pancreatico produce circa 100-200 fette. Successivamente, queste fette dovrebbero essere sottoposte a ispezione al microscopio per identificare quelle ricche di isole prima di procedere con le valutazioni funzionali. La vitalità, determinata mediante marcatura con fluoresceina diacetato (FDA) e ioduro di propidio (PI), dovrebbe raggiungere l'80%-90% (Figura 2A). La vitalità può essere notevolmente inferiore sulla superficie di taglio a causa del danno cellulare durante il processo di affettatura. Nelle fette vitali si osserva una secrezione ormonale dinamica (Figura 2B), con conseguente robusto rilascio di insulina dopo l'esposizione a glucosio elevato e depolarizzazione della membrana con cloruro di potassio (KCl).
Al contrario, quando ci sono ritardi durante la procedura di affettamento o la qualità del tessuto non è ottimale, i risultati differiscono in modo significativo. Il numero di fette ottenute può diminuire e la valutazione della vitalità può indicare una percentuale maggiore di cellule non vitali marcate con PI (Figura 2C). In questi casi, la valutazione funzionale indica una risposta ridotta o addirittura assente all'alto glucosio e alla depolarizzazione della membrana (Figura 2D). I dati provenienti da esperimenti non ottimali illustrano l'importanza di un'esecuzione precisa in modo tempestivo e della qualità dei tessuti, in quanto possono portare a una ridotta vitalità dei tessuti e a una funzionalità compromessa. Questi esiti negativi servono come prezioso promemoria dei fattori critici da considerare per il successo di questo metodo.
I risultati comuni nell'imaging del calcio sono visualizzati come una mappa di calore, come illustrato nella Figura 5D, o come tracce separate per le singole cellule, come presentato nella Figura 5E. È importante sottolineare che il colorante etichetta tutti i tipi di cellule indiscriminatamente, quindi stimoli specifici sono essenziali per distinguere le cellule in base alle loro risposte. Per identificare le cellule vitali, impieghiamo KCl e ordiniamo le cellule in base alle risposte che superano la risposta media di base di più di due errori standard. Inoltre, le fette possono essere fissate e colorate, consentendo l'identificazione dei tipi di cellule.
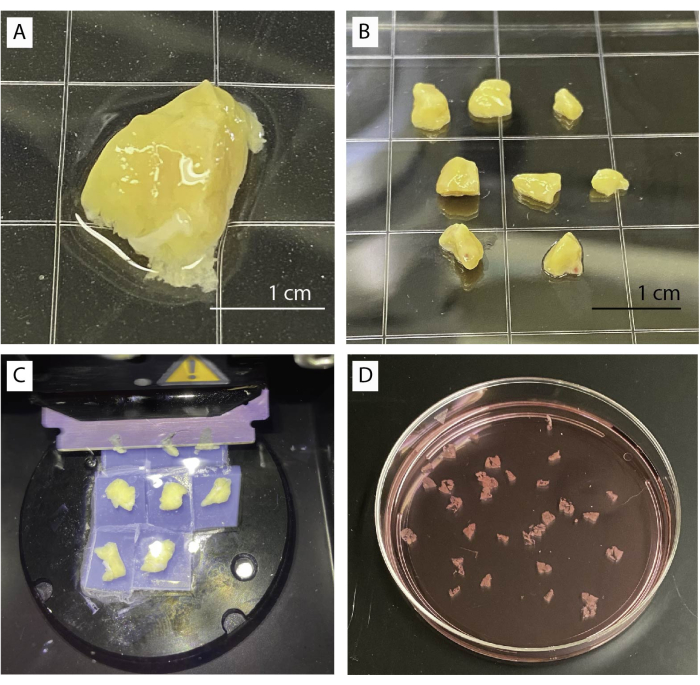
Figura 1: Trattamento e affettamento dei tessuti. (A) 1 g di tessuto pancreatico non trasformato. (B) Pezzi di pancreas puliti pronti per l'inclusione dell'agarosio. (C) Procedura di affettatura utilizzando un vibratomo. (D) Fette di pancreas umano appena tagliate. Fare clic qui per visualizzare una versione più grande di questa figura.
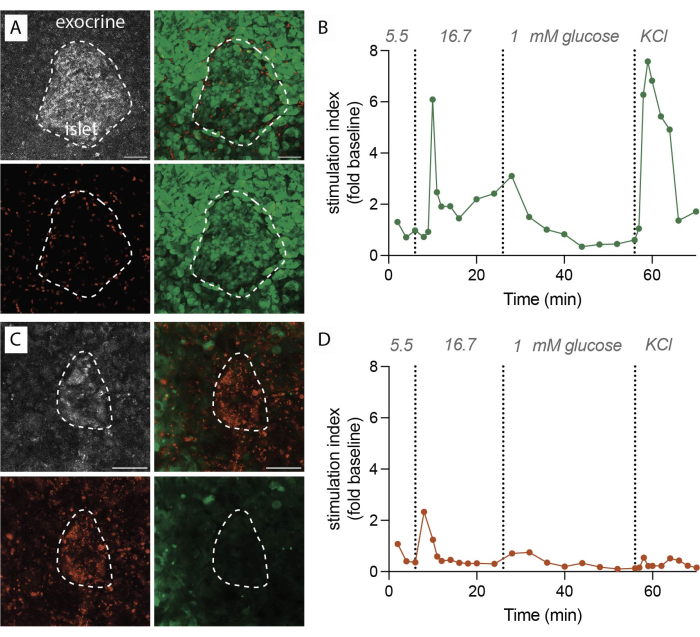
Figura 2: Dati sulla vitalità tissutale e sulla secrezione di insulina. (A) Immagini rappresentative per fette di tessuto vitali. Proiezione della massima intensità della luce laser riflessa (grigio, in alto a sinistra), PI per le cellule morte (rosso, in basso a sinistra), FDA per le cellule viventi (verde, in basso a destra) e immagini unite per cellule vive e morte (in alto a destra). La linea tratteggiata indica un isolotto. Barra della scala 50 μm. (B) Secrezione dinamica di insulina di fette di tessuto pancreatico umano da un singolo donatore non diabetico. La cinetica dell'insulina mostra una risposta di picco della prima fase dopo 6 minuti di stimolazione glicemica elevata, seguita da una seconda fase di plateau. I dati sono normalizzati alla secrezione media basale a 5,5 mM di glucosio (indice di stimolazione, variazione di piega). La secrezione è stata eseguita su fette dello stesso donatore come mostrato in (A). (C) Immagini rappresentative per fette di tessuto non vitali. Proiezione della massima intensità della luce laser riflessa (grigio, in alto a sinistra), PI per le cellule morte (rosso, in basso a sinistra), FDA per le cellule viventi (verde, in basso a destra) e immagini unite per cellule vive e morte (in alto a destra). La linea tratteggiata indica un isolotto. Barra della scala 50 μm. (D) Secrezione dinamica di insulina di fette di tessuto pancreatico umano da un singolo donatore non diabetico. La cinetica dell'insulina dimostra una chiara perdita sia della secrezione di insulina stimolata dal glucosio che della depolarizzazione della membrana con KCl. I dati sono normalizzati alla secrezione media basale a 5,5 mM di glucosio (indice di stimolazione, variazione di piega). La secrezione è stata eseguita su fette dello stesso donatore come mostrato in (C). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Caricamento tissutale per perifusione dinamica. (A) Camere a fette impilate. Le singole sezioni vengono caricate su una griglia metallica, come mostrato nell'inserto. (B) Carico di isolotti isolati in camere isolotti. Camere di taglio e isole collegate alla macchina perifusionale. Fare clic qui per visualizzare una versione più grande di questa figura.
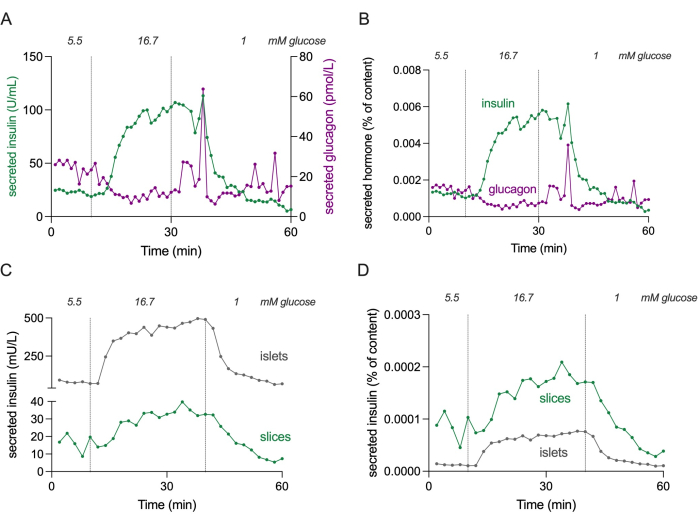
Figura 4: Secrezione ormonale in fette e isole isolate. I dati mostrati nei pannelli (A) e (B) provengono da un donatore diverso rispetto ai pannelli (C) e (D). (A) Secrezione ormonale assoluta da 3 fette di tessuto pancreatico da un singolo donatore non diabetico. La secrezione di insulina è mostrata in verde e la secrezione di glucagone in magenta. (B) La secrezione ormonale mostrata in (A) è normalizzata al contenuto ormonale totale (% del contenuto). Il contenuto viene misurato da tutte e 3 le sezioni utilizzate nell'esperimento. (C) Secrezione dinamica di insulina di isole isolate (100 isole) e fette di tessuto pancreatico (3 fette) dallo stesso donatore non diabetico. I dati sono mostrati in numeri assoluti (mU/L). (D) La secrezione di insulina mostrata in (C) è normalizzata al contenuto totale di insulina (% del contenuto). Fare clic qui per visualizzare una versione più grande di questa figura.
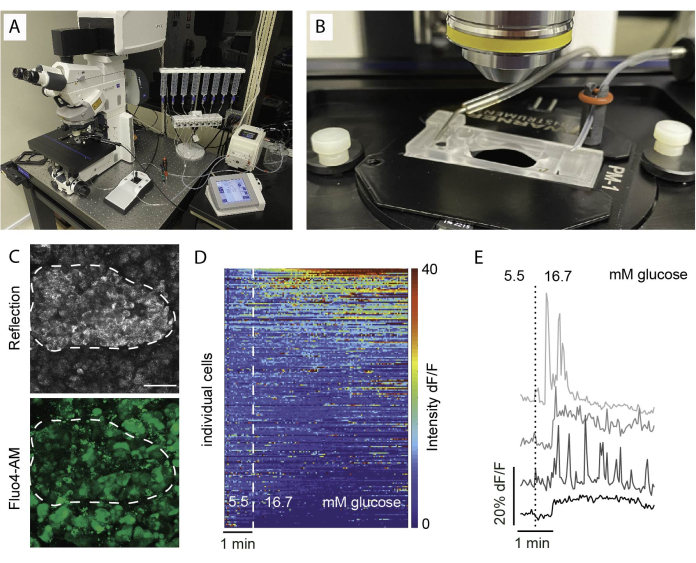
Figura 5: Configurazione dell'imaging e risultati attesi. (A) Configurazione per l'imaging funzionale con un microscopio confocale verticale e una configurazione perifusionale. (B) Camera di imaging collegata all'afflusso e al deflusso. (C) Pila Z di immagini confocali di un'isola all'interno di una fetta di tessuto da un donatore umano sano che mostra la luce riflessa (in alto) e il segnale Fluo4 (in basso). La riflessione viene utilizzata per identificare le isole all'interno della sezione (linea tratteggiata). (D) Heatmap che mostra in vitro la dinamica del Ca2+ delle cellule insulari espressa come intensità fluorescente di Fluo4 normalizzata all'intensità del segnale basale a 5,5 mM di glucosio e stimolazione con glucosio alto (16,7 mM). Ogni riga rappresenta una singola cella seguita nel tempo sull'asse x e la loro risposta alla variazione di grandezza (%) dell'intensità fluorescente rispetto al basale (dF/F) mostrata nella scala di colori dal blu (bassa intensità) al rosso (alta intensità). (E) Tracce rappresentative di 4 singole cellule che mostrano una risposta al glucosio elevato. Fare clic qui per visualizzare una versione più grande di questa figura.
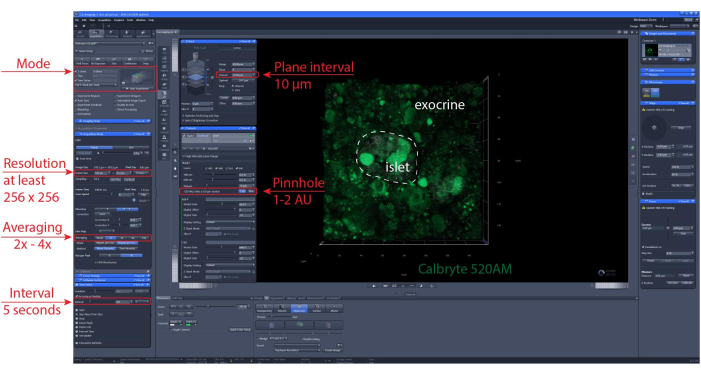
Figura 6: Impostazioni di imaging del calcio. Screenshot del software di impostazioni rappresentative scelto per eseguire registrazioni time-lapse di 40 μm (imaging XYZT). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Qui presentiamo un protocollo per generare fette di tessuto pancreatico vitali e il loro utilizzo per letture funzionali come la secrezione ormonale dinamica e l'imaging funzionale. Analogamente all'isolamento delle isole umane, il successo della procedura di taglio è influenzato da vari fattori, tra cui le caratteristiche del donatore, il tempo di spedizione del tessuto e la qualità del tessuto25,29. Pertanto, è fondamentale selezionare attentamente i campioni di tessuto per l'esperimento e ridurre al minimo i tempi di ischemia. In questo contesto, altre potenziali fonti di tessuto umano oltre ai donatori cadaverici dovrebbero essere attentamente considerate. L'inclusione di donatori chirurgici offre la possibilità di combinare i dati funzionali della fetta con informazioni rilevanti in vivo dello stesso paziente, rafforzando la rilevanza traslazionale11. Tuttavia, questa fonte di tessuto porta altri fattori poiché le biopsie provengono solitamente da pazienti anziani sottoposti a pancreatectomia principalmente a causa di un tumore localizzato. In particolare, le biopsie del pancreas non vengono eseguite nel contesto del diabete.
Quando si esegue l'effettiva procedura di affettatura, è fondamentale un'elaborazione tempestiva dei tessuti. Le fette possono essere conservate per diverse ore, come indicato in questo protocollo, o coltivate per periodi prolungati, come descritto da Qadir et al.19. Al momento, questo protocollo rappresenta l'unico metodo per sostenere la vitalità della fetta per periodi prolungati, tuttavia, gli sforzi futuri dovrebbero valutare i cambiamenti funzionali in diversi periodi di coltura e fare confronti con isole isolate, dallo stesso donatore.
La fase più critica del processo è un'attenta preparazione del tessuto prima dell'incorporazione nell'agarosio. Dotti di grandi dimensioni e tessuto fibrotico possono complicare il processo di affettatura e potenzialmente portare alla rottura di blocchi di tessuto dall'agarosio. Se ciò si verifica e i pezzi rimangono di dimensioni ragionevoli, possono essere rielaborati e incorporati per l'affettatura. Il mantenimento di una buona qualità del tessuto e di un'attenta lavorazione migliora notevolmente l'efficienza della procedura di affettatura e consente di ottenere la massima quantità e qualità delle fette. Il tempo trascorso dalla preparazione del tessuto alla generazione della fetta non deve superare le 2-3 ore, poiché intervalli più lunghi hanno un impatto significativo sulla vitalità dei tessuti.
Durante la perifusione della fetta, una fase semplice ma fondamentale è la rifilatura precisa della fetta per garantire un perfetto adattamento alla camera. Ciò consente il corretto bagno del tessuto e il flusso ininterrotto. Una volta avviato il protocollo, è essenziale evitare ulteriori manipolazioni delle camere per prevenire picchi indesiderati nel rilascio di ormoni. Dovrebbe essere preparato un tampone sufficiente e il tubo dovrebbe raggiungere il fondo della soluzione per evitare l'aspirazione dell'aria e l'esaurimento delle camere.
Per l'imaging del calcio è importante scegliere con cura l'area di interesse, a seconda delle esigenze sperimentali e del disegno. È importante ridurre al minimo il fotobleaching scegliendo parametri di imaging che riducano l'esposizione alla luce o riducano il tempo complessivo del protocollo. Come la secrezione ormonale dinamica, è fondamentale mantenere un flusso di soluzione adeguato e un ambiente riscaldato, poiché le fette richiedono condizioni quasi fisiologiche per un funzionamento ottimale (ad esempio, 37 °C).
Le fette di tessuto pancreatico mantengono efficacemente l'integrità strutturale del pancreas, preservando le connessioni cellula-cellula tra i suoi diversi tipi di cellule. Di conseguenza, forniscono un'alternativa al lavoro con isole isolate, facilitando l'esplorazione simultanea delle funzioni endocrine ed esocrine e la loro interazione. Per valutare l'interazione dei singoli tipi di cellule, è fondamentale discriminarli. La colorazione successiva è un'opzione, ma presenta limitazioni in termini di sonde fluorescenti disponibili e la sfida di individuare gli strati cellulari esatti. Pertanto, è consigliabile incorporare stimoli specifici della cellula nel protocollo per consentire la discriminazione cellulare in base alle risposte. Per discriminare tra i tipi di cellule in fette di topo o umane, gli stimoli efficaci includono adrenalina per le cellule alfa21,30, grelina per le cellule delta31, ceruleina per le cellule acinose 5,32, acidi biliari per le cellule duttali33 e noradrenalina per le cellule vascolari22. Stimoli simili possono essere impiegati per misurare le risposte secretorie. Mentre gli studi di imaging si concentrano sulle singole cellule, gli studi sulla secrezione analizzano la risposta collettiva. Pertanto, è fondamentale includere un ampio numero di sezioni per rilevare i risultati desiderati. La quantità ottimale può variare a seconda dei tipi di cellule, con tre fette che si rivelano sufficienti per le cellule endocrine; tuttavia, è consigliabile utilizzare più sezioni per garantire la rilevabilità piuttosto che rischiare di perdere informazioni preziose.
Come qualsiasi altro metodo, le fette di tessuto hanno limitazioni che dovrebbero essere considerate quando si interpretano i risultati. L'applicazione di stimoli mirata a tipi cellulari specifici può portare a effetti su altri tipi di cellule nella fetta, innescando potenzialmente cicli di feedback. Tuttavia, anche questi sono importanti da studiare e quindi le risposte misurate possono essere più rappresentative di una risposta fisiologica. Per il targeting cellulare selettivo, possono essere utilizzati protocolli tradizionali in vitro . È importante sottolineare che le cellule acinose contengono enzimi pancreatici in grado di scomporre le proteine e digerire la fetta di tessuto, con conseguente degradazione cellulare nel giro di poche ore. Per mantenere la vitalità, l'uso costante di inibitori della tripsina è essenziale quando le fette sono in uno stato statico, anche se la loro applicazione può interferire con il successo del trasferimento dei virus impiegati per scopi di etichettatura.
Rispetto all'isolamento delle isole, la variabilità del donatore e la qualità dei tessuti possono influire sia sulla quantità che sulla vitalità delle fette ottenute. Una vitalità insufficiente dopo l'affettatura può comportare una breve durata e ostacolare la capacità di coltivare le fette. Inoltre, il numero di isole può variare in modo significativo tra i donatori, rendendo difficile stimare il contenuto delle isole prima di condurre esperimenti. Di conseguenza, un'attenta selezione dei criteri di accettazione del donatore e l'implementazione di metodi di normalizzazione appropriati, come la percentuale di contenuto ormonale per la secrezione o il cambiamento di piega rispetto al basale, sono cruciali. Per risultati coerenti, si consiglia di valutare la vitalità della fetta di tessuto prima dell'esperimento. Inoltre, si raccomanda di incorporare stimoli di controllo rilevanti (ad es. KCl) nell'esperimento. Nei casi di analisi di singole cellule, come l'imaging, è possibile implementare il pre-smistamento delle cellule in base alla loro risposta a queste stimolazioni di controllo. Nonostante le sfide menzionate, le fette offrono un prezioso aumento agli attuali metodi di ricerca.
Il protocollo descritto può essere utilizzato come punto di partenza per diverse applicazioni e le fette di pancreas possono essere manipolate e le risposte esaminate dopo una varietà di stimoli. Indirizziamo inoltre i lettori a numerosi studi di ricerca che utilizzano fette di pancreas di topo o umano, fornendo preziose informazioni per coloro che pianificano i loro esperimenti. In futuro, è possibile che potenziali terapie possano essere studiate utilizzando fette pancreatiche o che i meccanismi della malattia possano essere modellati.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata eseguita con il supporto della Rete per i donatori di organi pancreatici con diabete (nPOD; RRID: SCR_014641), un progetto di ricerca collaborativo sul diabete di tipo 1 supportato da JDRF (nPOD: 5-SRA-2018-557-Q-R) e The Leona M. & Harry B. Helmsley Charitable Trust (Grant # 2018PG-T1D053, G-2108-04793). Il contenuto e le opinioni espresse sono responsabilità degli autori e non riflettono necessariamente la visione ufficiale di nPOD. Le organizzazioni di approvvigionamento di organi (OPO) che collaborano con nPOD per fornire risorse di ricerca sono elencate in http://www.jdrfnpod.org/for-partners/npod-partners/. Gli autori sono grati ai donatori e alle loro famiglie per il loro inestimabile contributo. Questo lavoro è stato supportato dall'American Diabetes Association 4-22-PDFPM (J.K.P.) e dal Leona M. e Harry B. Helmsley Charitable Trust (sovvenzione 2015-PG-T1D-052).
Materiali
| Name | Company | Catalog Number | Comments |
| Alanine | Sigma | A7627 | amino acid |
| AlexaFluor 488 goat anti-guineapig | Invitrogen | A11073 | secondary antibody |
| AlexaFluor 546 goat anti-rat | Thermo Fisher | A11077 | secondary antibody |
| AlexaFluor 647 goat anti-mouse | Thermo Fisher | A21235 | secondary antibody |
| Aprotinin | Sigma | A1153 | inhibitor |
| Arginine | Sigma | A5006 | amino acid |
| Calbryte 520 AM | AAT Bioquest | 20651 | Calcium dye |
| Fluo4-AM | Invitrogen | F14201 | Calcium dye |
| Fluorescein diacetat | Sigma | F7378 | viability marker |
| Glucagon | Sigma | G2654 | primary antibody |
| Glucagon ELISA (human kit) | Mercodia | 10-1271-01 | ELISA for hormone detection |
| Glutamine | Sigma | G3126 | amino acid |
| Insulin | Dako | A-0546 | primary antibody |
| Insulin ELISA (human) | Mercodia | 10-1113-01 | ELISA for hormone detection |
| Low melting point agarose | Sigma | A9414 | |
| LSM 900 | Zeiss | confocal microscope | |
| Pancreas Slice Chamber | Biorep Technologies | PERI-PSC-001 | slice chamber for perifucion |
| Pancreas Slice Chamber Extender Kit | Biorep Technologies | PERI-PSC-EXT | slice chamber for perifucion |
| Pancreas Slice Chamber Perforated Plate | Biorep Technologies | PERI-PSC-PP | slice chamber for perifucion |
| Perifusion system with automated tray handling | Biorep Technologies | PERI4-02-230-FA | |
| Propidium iodide | Life technologies | P1304MP | dead marker |
| Semi-automatic vibratome VT1200S | Leica | 14048142066 | |
| Somatostatin | Millipore | MAB354 | primary antibody |
Riferimenti
- Abdelli, S., et al. Intracellular stress signaling pathways activated during human islet preparation and following acute cytokine exposure. Diabetes. 53 (11), 2815-2823 (2004).
- Lyon, J., et al. Research-focused isolation of human islets from donors with and without diabetes at the alberta diabetes institute isletcore. Endocrinology. 157 (2), 560-569 (2016).
- Speier, S., Rupnik, M. A novel approach to in situ characterization of pancreatic beta-cells. Pflugers Arch. 446 (5), 553-558 (2003).
- Cohrs, C. M., et al. Vessel network architecture of adult human islets promotes distinct cell-cell interactions in situ and is altered after transplantation. Endocrinology. 158 (5), 1373-1385 (2017).
- Marolt, U., et al. Calcium imaging in intact mouse acinar cells in acute pancreas tissue slices. PLoS One. 17 (6), 0268644(2022).
- Stozer, A., et al. Confocal laser scanning microscopy of calcium dynamics in acute mouse pancreatic tissue slices. J Vis Exp. (170), e62293(2021).
- Stozer, A., Dolensek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of langerhans in acute mouse pancreas tissue slices. PLoS One. 8 (1), e54638(2013).
- Weitz, J. R., et al. Mouse pancreatic islet macrophages use locally released atp to monitor beta cell activity. Diabetologia. 61 (1), 182-192 (2018).
- Speier, S., Yang, S. B., Sroka, K., Rose, T., Rupnik, M. Katp-channels in beta-cells in tissue slices are directly modulated by millimolar atp. Mol Cell Endocrinol. 230 (1-2), 51-58 (2005).
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Mol Metab. 6 (9), 943-957 (2017).
- Cohrs, C. M., et al. Dysfunction of persisting beta cells is a key feature of early type 2 diabetes pathogenesis. Cell Rep. 31 (1), 107469(2020).
- Marciniak, A., et al. Using pancreas tissue slices for in situ studies of islet of langerhans and acinar cell biology. Nat Protoc. 9 (12), 2809-2822 (2014).
- Panzer, J. K., et al. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. JCI Insight. 5 (8), e134525(2020).
- Campbell-Thompson, M., et al. Network for pancreatic organ donors with diabetes (npod): Developing a tissue biobank for type 1 diabetes. Diabetes Metab Res Rev. 28 (7), 608-617 (2012).
- Kaddis, J. S., Pugliese, A., Atkinson, M. A. A run on the biobank: What have we learned about type 1 diabetes from the npod tissue repository. Curr Opin Endocrinol Diabetes Obes. 22 (4), 290-295 (2015).
- Pugliese, A., et al. New insight on human type 1 diabetes biology: Npod and npod-transplantation. Curr Diab Rep. 14 (10), 530(2014).
- Pugliese, A., et al. The juvenile diabetes research foundation network for pancreatic organ donors with diabetes (npod) program: Goals, operational model and emerging findings. Pediatr Diabetes. 15 (1), 1-9 (2014).
- Liang, T., et al. Ex vivo human pancreatic slice preparations offer a valuable model for studying pancreatic exocrine biology. J Biol Chem. 292 (14), 5957-5969 (2017).
- Qadir, M. M. F., et al. Long-term culture of human pancreatic slices as a model to study real-time islet regeneration. Nat Commun. 11 (1), 3265(2020).
- Huber, M. K., et al. Observing islet function and islet-immune cell interactions in live pancreatic tissue slices. J Vis Exp. (170), e62207(2021).
- Panzer, J. K., Tamayo, A., Caicedo, A. Restoring glutamate receptor signaling in pancreatic alpha cells rescues glucagon responses in type 1 diabetes. Cell Rep. 41 (11), 111792(2022).
- Mateus Goncalves, L., Almaca, J. Functional characterization of the human islet microvasculature using living pancreas slices. Front Endocrinol (Lausanne). 11, 602519(2020).
- Doke, M., et al. Dynamic scrna-seq of live human pancreatic slices reveals functional endocrine cell neogenesis through an intermediate ducto-acinar stage. Cell Metab. 35 (11), 1944-1960 (2023).
- Mateus Goncalves, L., et al. Pericyte dysfunction and impaired vasomotion are hallmarks of islets during the pathogenesis of type 1 diabetes. Cell Rep. 42 (8), 112913(2023).
- Hanley, S. C., Paraskevas, S., Rosenberg, L. Donor and isolation variables predicting human islet isolation success. Transplantation. 85 (7), 950-955 (2008).
- Hart, N. J., Powers, A. C. Use of human islets to understand islet biology and diabetes: Progress, challenges and suggestions. Diabetologia. 62 (2), 212-222 (2019).
- Henquin, J. C. The challenge of correctly reporting hormones content and secretion in isolated human islets. Mol Metab. 30, 230-239 (2019).
- Panzer, J. K., Caicedo, A. Protocol to generate and utilize pancreatic tissue slices to study endocrine and exocrine physiology in situ from mouse and human tissue. STAR Protoc. 4 (3), 102399(2023).
- Toso, C., et al. Factors affecting human islet of langerhans isolation yields. Transplant Proc. 34 (3), 826-827 (2002).
- Hamilton, A., et al. Adrenaline stimulates glucagon secretion by tpc2-dependent ca(2+) mobilization from acidic stores in pancreatic alpha-cells. Diabetes. 67 (6), 1128-1139 (2018).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- Marciniak, A., Selck, C., Friedrich, B., Speier, S. Mouse pancreas tissue slice culture facilitates long-term studies of exocrine and endocrine cell physiology in situ. PLoS One. 8 (11), e78706(2013).
- Gal, E., et al. A novel in situ approach to studying pancreatic ducts in mice. Front Physiol. 10, 938(2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon