Method Article
Endokrin ve Ekzokrin Pankreas Fizyolojisini İncelemek için İnsan Pankreas Dokusu Dilimlerinin Oluşturulması
Bu Makalede
Özet
Bu protokol, yakın fizyolojik koşullar altında hücre fonksiyonunu incelemek için ölen organ bağışçılarından insan pankreas dilimlerinin nasıl oluşturulacağını açıklar. Bu yenilikçi yaklaşım, normal ve yapısal olarak hasar görmüş adacıkların araştırılmasını ve endokrin ve ekzokrin kompartmanlar arasındaki karmaşık etkileşimi sağlar.
Özet
Tip 1 (T1D) ve 2 diyabet (T2D) ile ilişkili patofizyolojik mekanizmaların yanı sıra pankreas endokrin ve ekzokrin fizyolojisi ve etkileşimini anlamak için insan pankreasını incelemek çok önemlidir. İzole pankreas adacıklarının incelenmesinden çok şey öğrenilmiştir, ancak bu, işlevlerini ve etkileşimlerini tüm doku bağlamında incelemeyi engellemektedir. Pankreas dilimleri, normal, iltihaplı ve yapısal olarak hasar görmüş adacıkların fizyolojisini kendi doğal ortamlarında keşfetmek için eşsiz bir fırsat sunar ve pankreas dokusunun karmaşık dinamiklerini daha iyi araştırmak için endokrin ve ekzokrin bölmeler arasındaki etkileşimlerin incelenmesine olanak tanır. Bu nedenle, canlı pankreas dilimi platformunun benimsenmesi, bu alanda önemli bir ilerlemeyi temsil etmektedir. Bu protokol, agaroz ve vibratom dilimlemeye doku gömülerek ölen organ bağışçılarından canlı doku dilimlerinin nasıl oluşturulacağını ve bunların dinamik sekresyon ve canlı hücre görüntüleme gibi fonksiyonel okumaları değerlendirmek için nasıl kullanılacağını açıklar.
Giriş
Adacık fizyolojisi ile ilgili çalışmalar, diyabetin patogenezinin anlaşılması ve yeni tedavi yaklaşımlarının geliştirilmesi için temel öneme sahiptir. Şimdiye kadar araştırmalar, adacıkları mekanik ve enzimatik streslere maruz bırakan ve muhtemelen hücre fizyolojisinde değişikliklere neden olan izole adacıklara dayanıyordu; Ayrıca, adacık fonksiyonunu, diğerlerinin yanı sıra ekzokrin ve vasküler hücrelerden etkilenmesi muhtemel olan doğal doku ortamları bağlamında değerlendirmek mümkün değildir1. T1D'li donörlerden pankreas incelenirken, adacıklarının izole edilmesinin zor olması ve izolasyon sırasında parçalanması gibi bir zorluk vardır, bu da in vivo2 popülasyonunu temsil etmeyebilecek adacıklar üzerinde bir seçim etkisi yaratabilir. Ayrıca, adacıklar karmaşık çevrelerinden ve hücresel bağlantılarından, özellikle iltihaplı adacıklarda bulunan ve adacık çevresinde daha bol bulunan sızan bağışıklık hücrelerinden ayrılacaktır. Bu nedenle, izole adacıklar diyabet araştırmalarında temel bir araç olsa da, sınırlamalar vardır. Buna yanıt olarak, bu zorluklara bir çözüm sunan canlı pankreas dilimleri oluşturmak için çığır açan bir protokol sunuyoruz.
Pankreas dokusu dilimleme tekniklerinin son zamanlarda geliştirilmesi ve benimsenmesi, pankreasın karmaşık biyolojisini ve işlevlerini keşfetme yeteneğimiz için bir atılım olarak kabul edilmektedir. Bu yenilik, adacık fizyolojisi ve endokrin, ekzokrin, nöral, vasküler ve bağışıklık hücreleri arasındaki etkileşimlerin doğal anatomik bağlamları içinde dinamik çalışmaları için yeni yollar açmıştır. Geleneksel yaklaşımların aksine, bu in vitro ortam, organın sitomimarisinin çoğunu koruyarak doğal biyolojisine daha yakın bir yaklaşım sağlar. İlk olarak 2003 yılında Speier ve Rupnik tarafından farelerdegeliştirilen 3 bu yöntem, hem hücre içi hem de hücreler arası sinyalleme için kalsiyum görüntüleme, elektrofizyoloji ve hormon salgılanmasını değerlendirmek için faydasını göstermiştir 4,5,6,7,8,9. Pankreas dilim platformu daha sonra cerrahi biyopsi 4,10,11,12 ile elde edilen insan pankreas dokusunun çalışmasına uygulandı. Grubumuz, Diyabetli Pankreas Organ Bağışçıları Ağı'nın (nPOD) 13 faaliyeti yoluyla kadavra organ bağışçılarından pankreas dilimleri elde etmenin ve kullanmanın fizibilitesini gösterdi. nPOD, insan tip 1 diyabet hakkında araştırma yapan onaylı araştırmacılara pankreas dokuları sağlar ve pankreas dilimi platformunu benimsediğinden beri nPOD rutin olarak canlı pankreas dilimleri üretir ve dağıtır 14,15,16,17. 2020'de pankreas dilimi platformunun uygulanmasından bu yana nPOD, 43 bağışçıdan (T1D'li 12 bağışçı dahil) doku dilimlerini çok sayıda araştırmacıya başarıyla dağıttı. Araştırmacılar bu dilimleri kullanarak adacık fonksiyonunun kritik yönleri hakkında çığır açan araştırmalar yaptılar ve T1D 13,18,19,20,21,22,23,24 bağlamında adacıklar ile damar sistemi, sinir sistemi ve bağışıklık hücreleri arasındaki etkileşimi araştırdılar. Çok sayıda çalışma, geleneksel yaklaşımların sınırlamalarını vurgulamış ve pankreas içindeki dinamik etkileşimi yakalayabilen tekniklerin önemini vurgulamıştır 25,26,27. Dilimleme tekniklerinin fareden insan pankreasına uyarlanabilirliği, Diyabetli Pankreas Organ Bağışçıları Ağı (nPOD) gibi programlara entegrasyonlarıyla birleştiğinde, yöntemin Tip 1 diyabet gibi hastalıklara ilişkin değerli içgörüleri ortaya çıkarma potansiyelinin giderek daha fazla kabul görmesini örneklemektedir.
Protokol
Her iki cinsiyetten doku bağışçılarından alınan insan pankreas kesitleri, Florida Üniversitesi Diyabetli Pankreas Organ Bağışçıları Ağı (nPOD) doku bankası aracılığıyla elde edildi. Tanımlayıcılar olmadan ölen bireylerden alınan organ dokusu, organ bağışı yasa ve yönetmeliklerine uygun olarak insan dışı denek araştırması olarak belirlenmiş ve Florida Üniversitesi Kurumsal İnceleme Kurulu (IRB; IRB no. 392-2008), rıza ihtiyacından feragat etmek. Bu proje için özel olarak kullanılan nPOD dokuları, Florida Üniversitesi IRB (IRB20140093) tarafından insan dışı olarak onaylandı.
NOT: Dilim tekniğine ve perifüzyon ve kalsiyum görüntüleme gibi uygulamalarına tamamen yeni olan okuyucular için, insan örnekleriyle çalışmadan önce fare veya sıçan dilimlerini 3,28 kullanarak pratik deneyim kazanmaları ve temel beceriler geliştirmeleri tavsiye edilebilir.
1. Hazırlıklar
NOT: Bu hazırlıklar doku gelmeden önce yapılmalıdır.
- 125 mM NaCl, 5.9 mM KCl, 2.56 mM CaCl2, 1 mM MgCl2, 25 mM HEPES, %0.1 BSA, 2 mM L-alanin, L-arginin ve L-glutamini karıştırarak HEPES tamponu hazırlayın. PH'ı 7.4'e ayarlayın ve filtre ile sterilize edin.
- Perifüzyon deneyi için çözeltiler hazırlamak için tampona glikoz ve/veya diğer uyaranları ekleyin. Baz tamponu için 5.5 mM glikoz ekleyin. Bu tampon, dilimleme prosedürleri, dilim toplama ve perifüzyon hazırlıkları için kullanılacaktır.
- Taban çizgisi tamponuna aprotinin (10 μg/mL) ekleyerek dilim toplama için en az iki tabak hazırlayın.
- BSA ve amino asitler (125 mM NaCl, 5.9 mM KCl, 2.56 mM CaCl2, 1 mM MgCl2, 25 mM HEPES) içermeyen HEPES tamponunda % 3.8 düşük erime noktalı agaroz çözeltisi hazırlayın ve 37 ° C'de tutun.
- Tutucuya yeni bir bıçak yerleştirerek vibratomu monte edin. Mümkünse, bıçak açısını 15°'ye ayarlayın (Leica VT1200S kullanıyorsanız). Varsa, vibratomu kalibre edin.
- Perifüzyon makinesini açın, oda sayısını ve program protokolünü seçin.
- Gerekli tüm solüsyonları perifüzyon makinesine yerleştirin, sistemi astarlayın ve solüsyonları sıcak tutun. Makine, protokol için kullanılan her çözümün gerekli hacimlerini hesaplar.
2. Doku işleme
NOT: Dilimler alındıktan hemen sonra oluşturulmalıdır. Herhangi bir gecikme işlemde zorluklara neden olabilir ve doku bozulmasına neden olabilir.
- Pankreas dokusunu stereo mikroskop altında taban tamponu olan bir tabağa yerleştirin (Şekil 1A). Forseps ve makas kullanarak bağ, fibrotik ve yağ dokularını nazikçe çıkarın.
- Makas veya neşter kullanarak dokuyu yaklaşık 0,5cm3 (Şekil 1B) boyutunda çok sayıda küçük parçaya kesin. Kuru pankreas parçalarını kağıt mendil üzerine kurulayın.
- 4 parçayı 35 mm'lik bir petri kabına aktarın ve tüm parçalar tamamen suya batırılana kadar kabı agaroz solüsyonu ile doldurun. Agarozun tamamen katılaşmasına izin verin.
- Agarozdan dikkatlice parçalar kesin. Agarozu çıkarmak ve doku bloklarını dikkatlice ayırmak için neşteri tabağın kenarı boyunca gezdirin. Parçaların ince bir agaroz tabakası ile çevrili olduğundan emin olun.
3. Dilimleme
- Doku parçalarını baş aşağı yerleştirerek vibratomun metal plakasına yapıştırın.
- Plakayı tepsiye monte edin ve tepsiyi taban çizgisi tamponu (5.5 mM temel glikoz içeren HEPES) ile doldurun.
- Vibratomu 120 μm'de otomatik dilimlemeye ayarlayın ve başlangıç ve bitiş konumunu ayarlayın.
- Bıçağı dokunun kısa bir süre üzerinde hareket ettirin ve yavaş hızda (0,1 mm/sn) ve 0,8 mm'lik genlikte dilimlemeye başlayın. Doku izin verirse hız arttırılabilir (Şekil 1C).
- Kavisli forseps veya küçük bir fırça kullanarak dilimleri toplayın. Aprotinin içeren temel tamponda dilimler biriktirin (Şekil 1D).
- Dilimlerin aprotinin içeren temel tamponda en az 1 saat dinlenmesine izin verin. Kesme prosedürü tarafından salınan enzimlerin dışarı atılmasını sağlamak için dilimleri yavaş bir orbital çalkalayıcı üzerine yerleştirin.
4. Canlı / ölü tahlil
NOT: Bu, işlem sonrası doku dilimlerinin canlılığını gösterecek isteğe bağlı bir testtir. Ancak dilimler lekelendikten sonra tekrar kullanılamaz.
- Tek bir dilimi temel tamponla doldurulmuş bir kuyuya aktarın.
- Floresein diasetat (FDA, 50 μg/mL) ekleyin, oda sıcaklığında 1 dakika inkübe edin ve ışıktan koruyun.
- Propidium iyodür (PI, 50 μg / mL) ekleyin, oda sıcaklığında 1 dakika inkübe edin ve ışıktan koruyun.
- Dilimi 1 dakika yıkamak için PBS ile doldurulmuş başka bir kuyuya aktarın.
- Dilimleri bir Petri kabına aktarın veya görüntüleme için kapak kızağı ile bir cam slayt üzerine monte edin (Şekil 2A,B).
5. Perifüzyon
NOT: Bu protokol, doku dilimleri için dinamik perifüzyonun nasıl gerçekleştirileceğini açıklar, ancak izole adacıklar için de uygundur. Adacık odalarının, makinenin kullanım kılavuzunda açıklandığı gibi adacıkları yüklemeden önce filtre kağıdı ve boncuk çözeltisi ile hazırlanması gerekecektir. Ancak aynı deneyde adacık ve dilim haznesi birlikte kullanılabilir.
- 3 dilim seçin ve agarozu fırça ve neşter kullanarak stereomikroskop altında en aza indirin.
- Dilim haznesinin ızgarasına bir damla taban çizgisi tamponu (5,5 mM temel glikoz içeren HEPES) ekleyin ve ızgaraya yavaşça bir dilim yerleştirin. 3 dilimin her biri için tekrarlayın (Şekil 3A). Dilimler çok küçükse, adacık sayısını artırmak için 3'ten fazla odacıklı istifleyin. Hazne başına birden fazla dilim koymayın.
NOT: Dilim başına adacık sayısı donörler arasında büyük farklılıklar gösterir ve dilim boyutuna bağlıdır (10-100 adacık/dilim). Hem insülin hem de glukagon sekresyonunu ölçmek için toplam 3 dilimin yeterli olduğu kanıtlanmıştır. - İzole adacıklar için, insülin sekresyonu için sütun başına en az 30 adacık kullanın. Glukagon tespiti için 100 adacık kullanılması önerilir. Tek tek dilim haznesi parçalarını yukarıdan aşağıya doğru birleştirin.
- Dilim haznesini makinedeki giriş ve çıkış borularına bağlayın ve protokolü başlatın (Şekil 3C).
- Protokol sırasında hazne ısıtma ve tepsi soğutma pompası kullanın. Protokol sırasında toplama plakalarını değiştirin ve miktar tayini aynı gün yapılırsa 4 °C'de saklayın veya o zamana kadar -80 °C'de saklayın.
- Protokol tamamlandığında, odaları çıkarın, sökün ve lizis (mutlak Etanol'de %3 HCl) veya fiksasyon (%4 Paraformaldehit'te) için dilimleri toplayın.
- Makineyi su, %10 çamaşır suyu, su ve hava ile yıkayarak temizleyin.
- Piyasada bulunan tespit kitlerini kullanarak hormon salgılanmasını ölçün.
NOT: Şekil 4 , konsantrasyon aralıklarını tahmin etmek için 3 dilimin mutlak insülin ve glukagon sekresyon seviyelerini göstermektedir.
6. Kalsiyum görüntüleme
- Kalsiyum boya (örneğin, Fluo4-, Calbryte) çözeltisini üretici talimatına göre hazırlayın.
- Boyayı bazal HEPES tampon çözeltisinde seyreltin ve aprotinin (10 μg/mL) ekleyin.
- Tek bir dilimi aktarın ve oda sıcaklığında bir orbital çalkalayıcı üzerinde 30-60 dakika inkübe edin ve ışıktan koruyun.
- İnkübasyon süresi boyunca, perifüzyon şırıngalarını doldurarak ve tüpleri astarlayarak dilim görüntüleme kurulumunu hazırlayın (Şekil 5A,B).
- Tüm cihazları bağlayın, ısıtıcıyı açın ve pompa akışını başlatın. Hem akışlı ısıtma hem de platform ısıtıcısı ve 0,5 mL/dk akış hızı kullanılması önerilir.
- Görüntüleme odasına tek bir dilimi nazikçe yerleştirin ve bir arp kullanarak sabitleyin.
- Görüntüleme alanını tanımlamak için düşük büyütme hedefi kullanın. Yansımanın kullanılması adacık alanını tanımlamaya yardımcı olur (Şekil 5C).
- Daha yüksek bir büyütme hedefine (örneğin, 20x veya 40x) geçin ve konumu deney düzeneğine göre ayarlayın.
NOT: Optimum hücre canlılığını ve adacık bütünlüğünü sağlamak için, optik bölümlerin kesme yüzeyinin 1-2 hücre tabakası altında olması önerilir. - z-stack ve/veya döşeme tarama konumunu ayarlayın. Görüntüleme aralığını ve kayıt süresini ayarlayın. Burada, tek tek hücrelerin ayrımına izin vermek için en az 256 x 256'lık bir çözünürlük, 5-10 s'lik bir görüntüleme aralığı ve düzlemler arasında 10 μm'lik bir aralıkla 30-60 μm'lik bir z-yığın aralığı (varsa) kullanıldı (bir hücre katmanı). Ayrıntılı görüntüleme ayarları için Şekil 6'ya bakın.
NOT: En iyi çözünürlüğü ve maksimum alanı elde etmek için görüntüleme parametresini ayarlayın, ancak numunenin ağartılmasını önleyin. - Görüntülemeyi başlatın ve deneye göre çözelti akışını değiştirin. Bittiğinde, dilimleri toplayın ve immünohistokimya için sabitleyin.
Sonuçlar
Protokol başarılı bir şekilde uygulandığında, 1 g pankreas dokusu yaklaşık 100-200 dilim verir. Daha sonra, fonksiyonel değerlendirmelere geçmeden önce bu dilimler adacıklar açısından zengin olanları belirlemek için stereomikroskop incelemesine tabi tutulmalıdır. Floresein Diasetat (FDA) ve Propidyum İyodür (PI) ile etiketlenerek belirlenen canlılığın %80-90'a ulaşması beklenmektedir (Şekil 2A). Dilimleme işlemi sırasında hücre hasarı nedeniyle kesme yüzeyinde canlılık önemli ölçüde daha düşük olabilir. Canlı dilimlerde, dinamik hormon sekresyonu (Şekil 2B) gözlenir, bu da yüksek glikoza maruz kaldığında sağlam insülin salınımı ve Potasyum klorür (KCl) ile membran depolarizasyonu ile sonuçlanır.
Tersine, dilimleme prosedürü sırasında gecikmeler olduğunda veya doku kalitesi yetersiz olduğunda, sonuçlar önemli ölçüde farklılık gösterir. Elde edilen dilimlerin sayısı azalabilir ve canlılık değerlendirmesi, PI ile etiketlenmiş canlı olmayan hücrelerin daha yüksek bir oranını gösterebilir (Şekil 2C). Bu durumlarda, fonksiyonel değerlendirme, yüksek glukoz ve membran depolarizasyonuna karşı azalmış veya hatta hiç olmayan bir yanıtı gösterir (Şekil 2D). Optimal olmayan deneylerden elde edilen veriler, doku canlılığının azalmasına ve işlevselliğin bozulmasına yol açabileceğinden, zamanında hassas uygulamanın ve doku kalitesinin önemini göstermektedir. Bu olumsuz sonuçlar, bu yöntemin başarısında göz önünde bulundurulması gereken kritik faktörlerin değerli bir hatırlatıcısı olarak hizmet eder.
Kalsiyum görüntülemedeki yaygın bulgular, Şekil 5D'de gösterildiği gibi bir ısı haritası olarak veya Şekil 5E'de gösterildiği gibi tek tek hücreler için ayrı izler olarak görselleştirilir. Boyanın tüm hücre tiplerini ayrım gözetmeksizin etiketlediğini vurgulamak önemlidir, bu nedenle hücreleri tepkilerine göre ayırt etmek için spesifik uyaranlar gereklidir. Canlı hücreleri tanımlamak için KCl'yi kullanırız ve hücreleri, ortalama temel yanıtı ikiden fazla standart hatayla aşan yanıtlara göre sıralarız. Ayrıca, dilimler sabitlenebilir ve boyanabilir, bu da hücre tiplerinin tanımlanmasını sağlar.
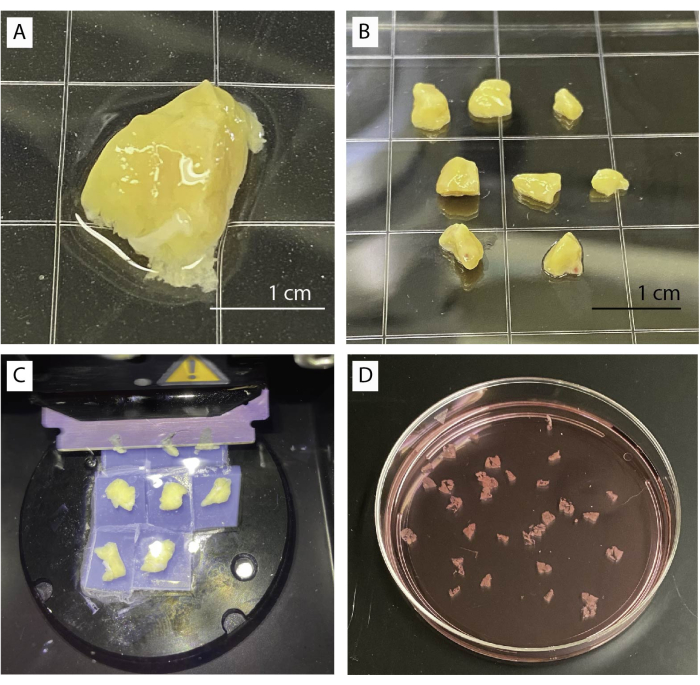
Şekil 1: Doku işleme ve dilimleme. (A) 1 g işlenmemiş pankreas dokusu. (B) Agaroz gömülmesi için hazır temizlenmiş pankreas parçaları. (C) Vibratom kullanarak dilimleme prosedürü. (D) Taze kesilmiş insan pankreas dilimleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
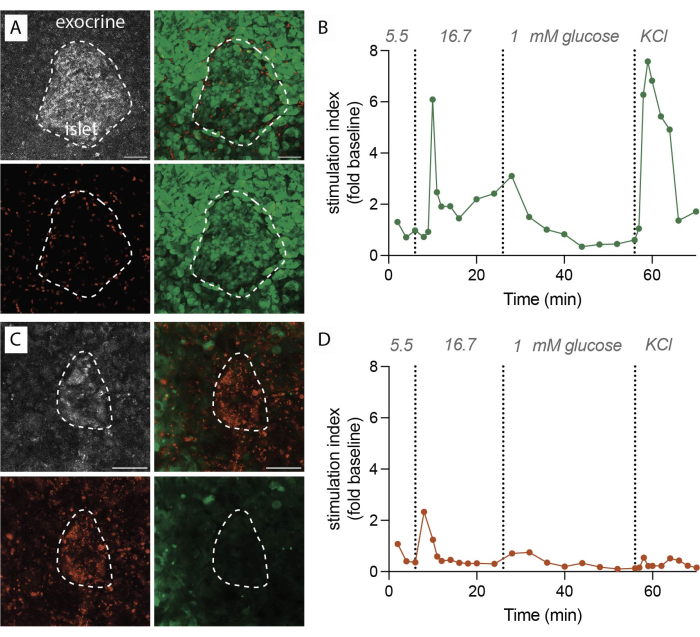
Şekil 2: Doku canlılığı ve insülin sekresyonu verileri. (A) Canlı doku dilimleri için temsili görüntüler. Yansıyan lazer ışığının maksimum yoğunluk projeksiyonu (gri, sol üst), ölü hücreler için PI (kırmızı, sol alt), canlı hücreler için FDA (yeşil, sağ alt) ve canlı ve ölü hücreler için birleştirilmiş görüntüler (sağ üst). Noktalı çizgi bir adacığı gösterir. Ölçek çubuğu 50 μm. (B) İnsan pankreas dokusunun dinamik insülin salgılanması, diyabetik olmayan tek bir donörden dilimler. İnsülin kinetiği, 6 dakikalık yüksek glikoz stimülasyonundan sonra bir birinci faz tepe tepkisi ve ardından bir plato ikinci faz gösterir. Veriler, 5.5 mM glikozda (stimülasyon indeksi, kat değişimi) ortalama başlangıç sekresyonuna normalleştirilir. Sekresyon, (A)'da gösterildiği gibi aynı donörden alınan dilimler üzerinde gerçekleştirilmiştir. (C) Canlı olmayan doku dilimleri için temsili görüntüler. Yansıyan lazer ışığının maksimum yoğunluk projeksiyonu (gri, sol üst), ölü hücreler için PI (kırmızı, sol alt), canlı hücreler için FDA (yeşil, sağ alt) ve canlı ve ölü hücreler için birleştirilmiş görüntüler (sağ üst). Noktalı çizgi bir adacığı gösterir. Ölçek çubuğu 50 μm. (D) İnsan pankreas dokusunun dinamik insülin sekresyonu, diyabetik olmayan tek bir donörden dilimler. İnsülin kinetiği, hem glikoz ile uyarılmış insülin sekresyonunun hem de KCl ile membran depolarizasyonunun açık bir kaybını gösterir. Veriler, 5.5 mM glikozda (stimülasyon indeksi, kat değişikliği) ortalama başlangıç sekresyonuna normalleştirilir. Sekresyon, (C)'de gösterildiği gibi aynı donörden alınan dilimler üzerinde gerçekleştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Dinamik perifüzyon için doku yüklemesi. (A) Yığılmış dilim odaları. Tek tek dilimler, ekte gösterildiği gibi metal bir ızgaraya yüklenir. (B) İzole edilmiş adacıkların adacık odalarına yüklenmesi. Perifüzyon makinesine bağlı dilim ve adacık odaları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
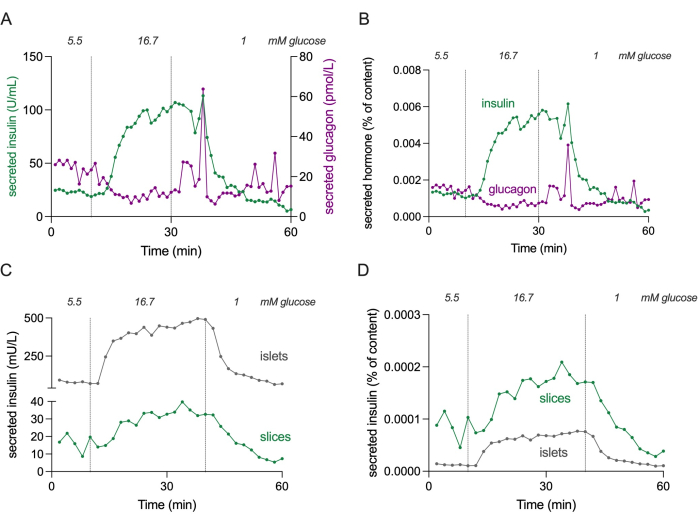
Şekil 4: Dilimler ve izole adacıklarda hormon salgılanması. Panel (A) ve (B)'de gösterilen veriler, panel (C) ve (D)'ye kıyasla farklı bir donörden gelmektedir. (A) Diyabetik olmayan tek bir donörden 3 pankreas dokusu diliminden mutlak hormon salgılanması. İnsülin sekresyonu yeşil renkte, glukagon sekresyonu ise macenta renkte gösterilir. (B) (A)'da gösterilen hormon salgılanması, toplam hormon içeriğine (içeriğin% 'si) normalize edilmiştir. İçerik, deneyde kullanılan 3 dilimin hepsinden ölçülür. (C) Aynı diyabetik olmayan donörden izole edilmiş adacıkların (100 adacık) ve pankreas dokusu dilimlerinin (3 dilim) dinamik insülin sekresyonu. Veriler mutlak sayılarla (mU/L) gösterilir. (D) (C)'de gösterilen insülin sekresyonu, toplam insülin içeriğine (içeriğin% 'si) normalize edilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
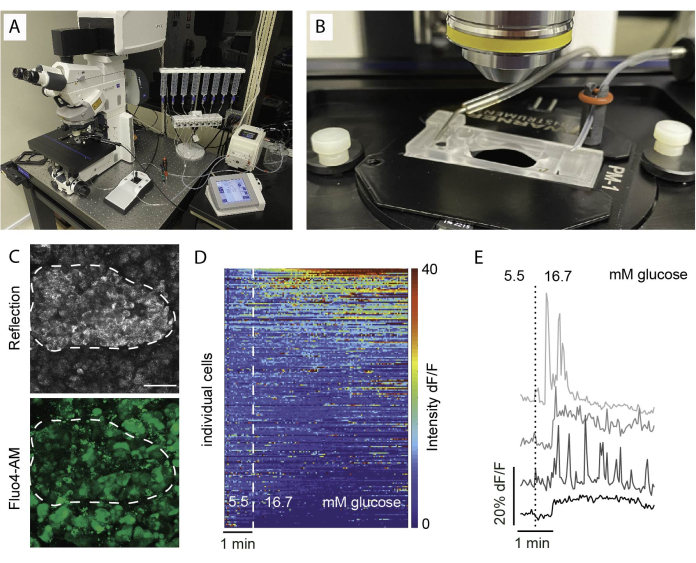
Şekil 5: Görüntüleme kurulumu ve beklenen sonuçlar. (A) Dik konfokal mikroskop ve perifüzyon kurulumu ile fonksiyonel görüntüleme için kurulum. (B) Giriş ve çıkışa bağlı görüntüleme odası. (C) Yansıyan ışığı (üstte) ve Fluo4 sinyalini (altta) gösteren sağlıklı bir insan donörden alınan bir doku dilimi içindeki bir adacığın Z konfokal görüntüleri yığını. Yansıma, dilim içindeki adacıkları (noktalı çizgi) tanımlamak için kullanılır. (D) 5.5 mM glikozda bazal sinyal yoğunluğuna normalize edilmiş Fluo4'ün floresan yoğunluğu ve yüksek glikoz (16.7 mM) ile stimülasyon olarak ifade edilen adacık hücrelerinin in vitro Ca2+ dinamiklerini gösteren ısı haritası. Her satır, x ekseninde zaman içinde izlenen tek bir hücreyi ve renk skalasında maviden (düşük yoğunluklu) kırmızıya (yüksek yoğunluklu) gösterilen taban çizgisi (dF/F) üzerindeki floresan yoğunluğunun büyüklük değişimindeki (%) tepkisini temsil eder. (E) Yüksek glikoza yanıt gösteren 4 ayrı hücrenin temsili izleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
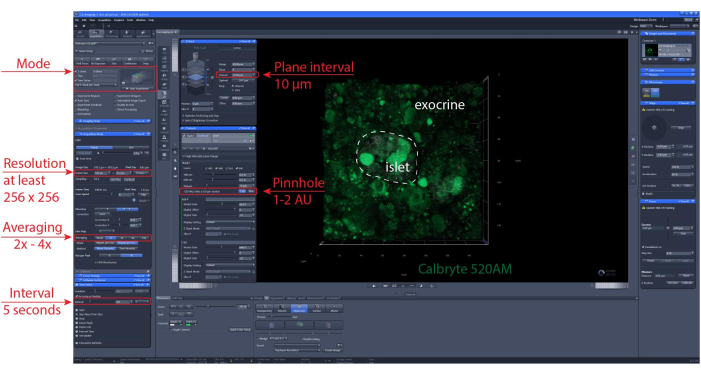
Şekil 6: Kalsiyum görüntüleme ayarları. 40 μm'lik hızlandırılmış kayıtlar (XYZT görüntüleme) gerçekleştirmek için seçilen temsili ayarların yazılımının ekran görüntüsü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada, canlı pankreas dokusu dilimleri oluşturmak için bir protokol ve bunların dinamik hormon sekresyonu ve fonksiyonel görüntüleme gibi fonksiyonel okumalar için kullanımını sunuyoruz. İnsan adacık izolasyonuna benzer şekilde, dilim prosedürünün başarısı donör özellikleri, doku sevkiyat süresi ve doku kalitesi gibi çeşitli faktörlerden etkilenir25,29. Bu nedenle, deney için doku örneklerini dikkatli bir şekilde seçmek ve iskemi sürelerini minimumda tutmak çok önemlidir. Bu bağlamda, kadavra vericileri dışında diğer potansiyel insan dokusu kaynakları da dikkatle düşünülmelidir. Cerrahi donörlerin dahil edilmesi, fonksiyonel dilim verilerini aynı hastadan alınan ilgili in vivo bilgilerle birleştirme seçeneği sunarak translasyonel alaka düzeyini güçlendirir11. Bununla birlikte, biyopsiler genellikle çoğunlukla lokalize bir tümör nedeniyle pankreatektomi geçiren yaşlı hastalardan alındığından, bu doku kaynağı başka faktörleri de beraberinde getirir. Özellikle, pankreas biyopsileri diyabet bağlamında yapılmamaktadır.
Gerçek dilimleme prosedürünü gerçekleştirirken, zamanında doku işleme kritik öneme sahiptir. Dilimler, bu protokolde belirtildiği gibi birkaç saat saklanabilir veya Qadir ve ark.19 tarafından tarif edildiği gibi uzun süreler boyunca kültürlenebilir. Şu anda, bu protokol dilim canlılığını uzun süreler boyunca sürdürmek için tek yöntem olarak durmaktadır, ancak gelecekteki çabalar, çeşitli kültür zamanlarındaki fonksiyonel değişiklikleri değerlendirmeli ve aynı donörden izole edilmiş adacıklarla karşılaştırmalar yapmalıdır.
İşlemdeki en kritik adım, agaroza gömülmeden önce dikkatli bir doku hazırlığıdır. Büyük kanallar ve fibrotik doku, dilimleme işlemini zorlaştırabilir ve potansiyel olarak agarozdan kopan doku bloklarına yol açabilir. Bu meydana gelirse ve parçalar makul boyutta kalırsa, dilimleme için yeniden işlenebilir ve gömülebilirler. İyi doku kalitesinin korunması ve dikkatli işleme, dilimleme prosedürünün verimliliğini büyük ölçüde artırır ve maksimum miktar ve kalitede dilim sağlar. Doku hazırlığından dilim oluşumuna kadar geçen süre 2-3 saati geçmemelidir, çünkü daha uzun aralıklar doku canlılığını önemli ölçüde etkiler.
Dilim perifüzyonu sırasında, basit ama kritik bir adım, hazneye mükemmel bir uyum sağlamak için dilimin hassas bir şekilde kesilmesidir. Bu, dokunun uygun şekilde yıkanmasına ve kesintisiz akışa izin verir. Protokol başlatıldıktan sonra, hormon salınımında istenmeyen ani yükselmeleri önlemek için odaların daha fazla manipüle edilmesinden kaçınmak önemlidir. Yeterli tampon hazırlanmalı ve hava emişini ve odaların kurumasını önlemek için borular çözeltinin dibine ulaşmalıdır.
Kalsiyum görüntüleme için, deneysel ihtiyaçlara ve tasarıma bağlı olarak ilgi alanını dikkatli bir şekilde seçmek önemlidir. Işığa maruz kalmayı azaltan veya genel protokol süresini kısaltan görüntüleme parametrelerini seçerek foto ağartmayı en aza indirmek önemlidir. Dinamik hormon salgılanması gibi, dilimler optimal işlev için neredeyse fizyolojik koşullar gerektirdiğinden (örneğin, 37 °C) uygun çözelti akışını ve ısıtılmış bir ayarı korumak çok önemlidir.
Pankreas dokusu dilimleri, çeşitli hücre tipleri arasındaki hücre-hücre bağlantılarını koruyarak pankreasın yapısal bütünlüğünü etkili bir şekilde korur. Sonuç olarak, hem endokrin hem de ekzokrin fonksiyonların ve bunların etkileşimlerinin eşzamanlı olarak araştırılmasını kolaylaştırarak, izole adacıklarla çalışmaya bir alternatif sunarlar. Bireysel hücre tiplerinin etkileşimini değerlendirmek için, aralarında ayrım yapmak çok önemlidir. Daha sonra boyama bir seçenektir, ancak mevcut floresan problar ve tam hücre katmanlarını bulma zorluğu açısından sınırlamaları vardır. Bu nedenle, yanıtlara dayalı hücre ayrımını sağlamak için hücreye özgü uyaranların protokole dahil edilmesi tavsiye edilir. Fare veya insan dilimlerindeki hücre tipleri arasında ayrım yapmak için etkili uyaranlar arasında alfahücreleri için adrenalin 21,30, delta hücreleri için ghrelin31, asiner hücreleriçin serulein 5,32, duktal hücreler içinsafra asitleri 33 ve vasküler hücreler için norepinefrin22 bulunur. Salgı tepkilerini ölçmek için de benzer uyaranlar kullanılabilir. Görüntüleme çalışmaları tek tek hücrelere odaklanırken, sekresyon çalışmaları kolektif yanıtı analiz eder. Bu nedenle, istenen sonuçları tespit etmek için bol miktarda dilim eklemek çok önemlidir. En uygun miktar, hücre tipleri arasında değişebilir ve endokrin hücreler için yeterli olan üç dilim vardır; Bununla birlikte, değerli bilgileri kaçırma riskinden ziyade tespit edilebilirliği sağlamak için daha fazla dilim kullanılması tavsiye edilir.
Diğer tüm yöntemler gibi, doku dilimlerinin de sonuçları yorumlarken göz önünde bulundurulması gereken sınırlamaları vardır. Belirli hücre tiplerini hedefleyen uyaran uygulaması, dilimdeki diğer hücre tipleri üzerinde etkilere yol açarak potansiyel olarak geri bildirim döngülerini tetikleyebilir. Bununla birlikte, bunlar da çalışmak için önemlidir ve bu nedenle ölçülen yanıtlar fizyolojik bir tepkiyi daha iyi temsil edebilir. Seçici hücre hedefleme için geleneksel in vitro protokoller kullanılabilir. Daha da önemlisi, asiner hücreler, proteinleri parçalayabilen ve doku dilimini sindirebilen pankreas enzimleri içerir ve bu da birkaç saat içinde hücresel bozulmaya neden olur. Canlılığı korumak için, tripsin inhibitörlerinin tutarlı kullanımı, dilimler statik bir durumdayken, uygulamaları etiketleme amacıyla kullanılan virüslerin başarılı bir şekilde aktarılmasını engelleyebilse bile önemlidir.
Adacık izolasyonu ile karşılaştırıldığında, donör değişkenliği ve doku kalitesi, elde edilen dilimlerin hem miktarını hem de canlılığını etkileyebilir. Dilimleme sonrası yetersiz canlılık, kısa bir ömre neden olabilir ve dilimlerin kültürlenme yeteneğini engelleyebilir. Ayrıca, adacık sayıları donörler arasında önemli ölçüde değişebilir ve bu da deneyler yapmadan önce adacık içeriğini tahmin etmeyi zorlaştırır. Sonuç olarak, donör kabul kriterlerinin dikkatli bir şekilde seçilmesi ve salgı için hormon içeriğinin yüzdesi veya taban çizgisine kıvrım değişikliği gibi uygun normalizasyon yöntemlerinin uygulanması çok önemlidir. Tutarlı sonuçlar için, deneyden önce doku dilimi canlılığının değerlendirilmesi tavsiye edilir. Ayrıca, ilgili kontrol uyaranlarının (örneğin, KCl) deneye dahil edilmesi önerilir. Görüntüleme gibi bireysel hücre analizi durumlarında, hücrelerin bu kontrol stimülasyonlarına verdikleri yanıtlara göre önceden sınıflandırılması uygulanabilir. Bahsedilen zorluklara rağmen, dilimler mevcut araştırma yöntemlerine değerli bir katkı sunmaktadır.
Açıklanan protokol, çeşitli uygulamalar için başlangıç noktası olarak kullanılabilir ve pankreas dilimleri manipüle edilebilir ve çeşitli uyaranlardan sonra yanıtlar incelenebilir. Ayrıca okuyucuları, deneylerini planlayanlar için değerli bilgiler sağlayarak, fare veya insan pankreas dilimlerini kullanan çok sayıda araştırma çalışmasına yönlendiriyoruz. Gelecekte, pankreas dilimleri kullanılarak potansiyel tedavilerin araştırılması veya hastalık mekanizmalarının modellenmesi mümkündür.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu araştırma, Diyabetli Pankreas Organ Bağışçıları Ağı'nın (nPOD; RRID:SCR_014641), JDRF (nPOD: 5-SRA-2018-557-Q-R) ve The Leona M. & Harry B. Helmsley Charitable Trust (Grant # 2018PG-T1D053, G-2108-04793) tarafından desteklenen ortak bir tip 1 diyabet araştırma projesi. İfade edilen içerik ve görüşler yazarların sorumluluğundadır ve nPOD'un resmi görüşünü yansıtmak zorunda değildir. Araştırma kaynakları sağlamak için nPOD ile ortaklık yapan Organ Tedarik Kuruluşları (OPO) http://www.jdrfnpod.org/for-partners/npod-partners/'da listelenmiştir. Yazarlar, paha biçilmez katkıları için bağışçılara ve ailelerine minnettardır. Bu çalışma Amerikan Diyabet Derneği 4-22-PDFPM (J.K.P.) ve Leona M. ve Harry B. Helmsley Charitable Trust (hibe 2015-PG-T1D-052) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alanine | Sigma | A7627 | amino acid |
| AlexaFluor 488 goat anti-guineapig | Invitrogen | A11073 | secondary antibody |
| AlexaFluor 546 goat anti-rat | Thermo Fisher | A11077 | secondary antibody |
| AlexaFluor 647 goat anti-mouse | Thermo Fisher | A21235 | secondary antibody |
| Aprotinin | Sigma | A1153 | inhibitor |
| Arginine | Sigma | A5006 | amino acid |
| Calbryte 520 AM | AAT Bioquest | 20651 | Calcium dye |
| Fluo4-AM | Invitrogen | F14201 | Calcium dye |
| Fluorescein diacetat | Sigma | F7378 | viability marker |
| Glucagon | Sigma | G2654 | primary antibody |
| Glucagon ELISA (human kit) | Mercodia | 10-1271-01 | ELISA for hormone detection |
| Glutamine | Sigma | G3126 | amino acid |
| Insulin | Dako | A-0546 | primary antibody |
| Insulin ELISA (human) | Mercodia | 10-1113-01 | ELISA for hormone detection |
| Low melting point agarose | Sigma | A9414 | |
| LSM 900 | Zeiss | confocal microscope | |
| Pancreas Slice Chamber | Biorep Technologies | PERI-PSC-001 | slice chamber for perifucion |
| Pancreas Slice Chamber Extender Kit | Biorep Technologies | PERI-PSC-EXT | slice chamber for perifucion |
| Pancreas Slice Chamber Perforated Plate | Biorep Technologies | PERI-PSC-PP | slice chamber for perifucion |
| Perifusion system with automated tray handling | Biorep Technologies | PERI4-02-230-FA | |
| Propidium iodide | Life technologies | P1304MP | dead marker |
| Semi-automatic vibratome VT1200S | Leica | 14048142066 | |
| Somatostatin | Millipore | MAB354 | primary antibody |
Referanslar
- Abdelli, S., et al. Intracellular stress signaling pathways activated during human islet preparation and following acute cytokine exposure. Diabetes. 53 (11), 2815-2823 (2004).
- Lyon, J., et al. Research-focused isolation of human islets from donors with and without diabetes at the alberta diabetes institute isletcore. Endocrinology. 157 (2), 560-569 (2016).
- Speier, S., Rupnik, M. A novel approach to in situ characterization of pancreatic beta-cells. Pflugers Arch. 446 (5), 553-558 (2003).
- Cohrs, C. M., et al. Vessel network architecture of adult human islets promotes distinct cell-cell interactions in situ and is altered after transplantation. Endocrinology. 158 (5), 1373-1385 (2017).
- Marolt, U., et al. Calcium imaging in intact mouse acinar cells in acute pancreas tissue slices. PLoS One. 17 (6), 0268644 (2022).
- Stozer, A., et al. Confocal laser scanning microscopy of calcium dynamics in acute mouse pancreatic tissue slices. J Vis Exp. (170), e62293 (2021).
- Stozer, A., Dolensek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of langerhans in acute mouse pancreas tissue slices. PLoS One. 8 (1), e54638 (2013).
- Weitz, J. R., et al. Mouse pancreatic islet macrophages use locally released atp to monitor beta cell activity. Diabetologia. 61 (1), 182-192 (2018).
- Speier, S., Yang, S. B., Sroka, K., Rose, T., Rupnik, M. Katp-channels in beta-cells in tissue slices are directly modulated by millimolar atp. Mol Cell Endocrinol. 230 (1-2), 51-58 (2005).
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Mol Metab. 6 (9), 943-957 (2017).
- Cohrs, C. M., et al. Dysfunction of persisting beta cells is a key feature of early type 2 diabetes pathogenesis. Cell Rep. 31 (1), 107469 (2020).
- Marciniak, A., et al. Using pancreas tissue slices for in situ studies of islet of langerhans and acinar cell biology. Nat Protoc. 9 (12), 2809-2822 (2014).
- Panzer, J. K., et al. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. JCI Insight. 5 (8), e134525 (2020).
- Campbell-Thompson, M., et al. Network for pancreatic organ donors with diabetes (npod): Developing a tissue biobank for type 1 diabetes. Diabetes Metab Res Rev. 28 (7), 608-617 (2012).
- Kaddis, J. S., Pugliese, A., Atkinson, M. A. A run on the biobank: What have we learned about type 1 diabetes from the npod tissue repository. Curr Opin Endocrinol Diabetes Obes. 22 (4), 290-295 (2015).
- Pugliese, A., et al. New insight on human type 1 diabetes biology: Npod and npod-transplantation. Curr Diab Rep. 14 (10), 530 (2014).
- Pugliese, A., et al. The juvenile diabetes research foundation network for pancreatic organ donors with diabetes (npod) program: Goals, operational model and emerging findings. Pediatr Diabetes. 15 (1), 1-9 (2014).
- Liang, T., et al. Ex vivo human pancreatic slice preparations offer a valuable model for studying pancreatic exocrine biology. J Biol Chem. 292 (14), 5957-5969 (2017).
- Qadir, M. M. F., et al. Long-term culture of human pancreatic slices as a model to study real-time islet regeneration. Nat Commun. 11 (1), 3265 (2020).
- Huber, M. K., et al. Observing islet function and islet-immune cell interactions in live pancreatic tissue slices. J Vis Exp. (170), e62207 (2021).
- Panzer, J. K., Tamayo, A., Caicedo, A. Restoring glutamate receptor signaling in pancreatic alpha cells rescues glucagon responses in type 1 diabetes. Cell Rep. 41 (11), 111792 (2022).
- Mateus Goncalves, L., Almaca, J. Functional characterization of the human islet microvasculature using living pancreas slices. Front Endocrinol (Lausanne). 11, 602519 (2020).
- Doke, M., et al. Dynamic scrna-seq of live human pancreatic slices reveals functional endocrine cell neogenesis through an intermediate ducto-acinar stage. Cell Metab. 35 (11), 1944-1960 (2023).
- Mateus Goncalves, L., et al. Pericyte dysfunction and impaired vasomotion are hallmarks of islets during the pathogenesis of type 1 diabetes. Cell Rep. 42 (8), 112913 (2023).
- Hanley, S. C., Paraskevas, S., Rosenberg, L. Donor and isolation variables predicting human islet isolation success. Transplantation. 85 (7), 950-955 (2008).
- Hart, N. J., Powers, A. C. Use of human islets to understand islet biology and diabetes: Progress, challenges and suggestions. Diabetologia. 62 (2), 212-222 (2019).
- Henquin, J. C. The challenge of correctly reporting hormones content and secretion in isolated human islets. Mol Metab. 30, 230-239 (2019).
- Panzer, J. K., Caicedo, A. Protocol to generate and utilize pancreatic tissue slices to study endocrine and exocrine physiology in situ from mouse and human tissue. STAR Protoc. 4 (3), 102399 (2023).
- Toso, C., et al. Factors affecting human islet of langerhans isolation yields. Transplant Proc. 34 (3), 826-827 (2002).
- Hamilton, A., et al. Adrenaline stimulates glucagon secretion by tpc2-dependent ca(2+) mobilization from acidic stores in pancreatic alpha-cells. Diabetes. 67 (6), 1128-1139 (2018).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- Marciniak, A., Selck, C., Friedrich, B., Speier, S. Mouse pancreas tissue slice culture facilitates long-term studies of exocrine and endocrine cell physiology in situ. PLoS One. 8 (11), e78706 (2013).
- Gal, E., et al. A novel in situ approach to studying pancreatic ducts in mice. Front Physiol. 10, 938 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır