Method Article
内分泌および外分泌膵臓生理学を研究するためのヒト膵臓組織スライスの生成
要約
このプロトコルは、死亡した臓器提供者からヒトの膵臓スライスを生成して、生理学的に近い条件下で細胞機能を研究する方法を説明しています。この革新的なアプローチにより、正常および構造的に損傷した膵島と、内分泌コンパートメントと外分泌コンパートメント間の複雑な相互作用の調査が可能になります。
要約
ヒトの膵臓を研究することは、1型糖尿病(T1D)および2型糖尿病(T2D)に関連する病態生理学的メカニズム、ならびに膵臓の内分泌および外分泌の生理学と相互作用を理解するために重要です。孤立した膵島の研究から多くのことが学ばれましたが、これは組織全体の文脈でそれらの機能と相互作用を調べることを妨げます。膵臓スライスは、本来の環境内の正常、炎症、および構造的に損傷した膵島の生理学を探求するユニークな機会を提供し、内分泌コンパートメントと外分泌コンパートメント間の相互作用の研究を可能にし、膵臓組織の複雑なダイナミクスをよりよく調査します。したがって、生きている膵臓スライスプラットフォームの採用は、この分野における重要な進歩を表しています。このプロトコルでは、アガロースおよびビブラトームスライスに組織を埋め込むことによって、死亡した臓器提供者から生体組織スライスを生成する方法と、動的分泌および生細胞イメージングなどの機能的読み出しを評価するためのそれらの利用について説明します。
概要
膵島の生理学の研究は、糖尿病の病態を理解し、新しい治療法を開発するための基本です。これまでのところ、研究は孤立した膵島に依存しており、膵島を機械的および酵素的ストレスにさらし、細胞生理学に変化をもたらす可能性があります。さらに、膵島の機能を自然の組織環境の文脈で評価することは不可能であり、外分泌細胞や血管細胞などの影響を受ける可能性があります1。T1Dのドナーからの膵臓を研究する場合、それらの膵島は単離が困難であり、単離中に断片化される可能性があり、 in vivo2の集団を代表していない可能性のある膵島に選択効果をもたらす可能性があるという課題があります。さらに、膵島は、複雑な環境や細胞のつながり、特に炎症を起こした膵島に見られ、膵島の周辺に豊富に存在する浸潤免疫細胞から分離されます。したがって、孤立した島は糖尿病研究の基礎となるツールですが、制限があります。これに対応して、生きた膵臓スライスを作成するための画期的なプロトコルを導入し、これらの課題に対するソリューションを提供します。
膵臓組織スライス技術の最近の開発と採用は、膵臓の複雑な生物学と機能を探求する私たちの能力にとって画期的なものと考えられています。この革新は、膵島の生理学と、自然の解剖学的文脈における内分泌細胞、外分泌細胞、神経細胞、血管細胞、免疫細胞間の相互作用の動的研究のための新しい道を開きました。従来のアプローチとは異なり、このin vitro環境は臓器の細胞構造の多くを保存し、その天然の生物学により近い近似を可能にします。2003年にSpeierとRupnikによってマウスで最初に開発されたこの方法は、細胞内および細胞間シグナル伝達4,5,6,7,8,9のカルシウムイメージング、電気生理学、およびホルモン分泌を評価するための有用性を実証しました。次に、膵臓スライスプラットフォームを、外科的生検4,10,11,12によって得られたヒト膵臓組織の研究に適用しました。私たちのグループは、糖尿病の膵臓臓器提供者ネットワーク(nPOD)の活動を通じて、死体臓器提供者から膵臓切片を入手して利用することの実現可能性を実証しました13。nPODは、ヒト1型糖尿病に関する研究を行っている承認された研究者に膵臓組織を提供し、膵臓スライスプラットフォームを採用して以来、nPODは日常的に生きている膵臓スライス14、15、16、17を生成して配布しています。2020年に膵臓スライスプラットフォームを実装して以来、nPODは43人のドナー(T1Dの12人のドナーを含む)からの組織スライスを多数の研究者に配布することに成功しました。これらのスライスを使用して、研究者は膵島の機能の重要な側面に関する画期的な研究を行い、T1D13、18、19、20、21、22、23、24のコンテキストで膵島と血管系、神経系、および免疫細胞の間の相互作用を調査しました.多くの研究が従来のアプローチの限界を強調し、膵臓内の動的な相互作用を捉えることができる技術の重要性を強調しています25,26,27。マウスからヒトの膵臓へのスライス技術の適応性と、糖尿病の膵臓臓器提供者ネットワーク(nPOD)などのプログラムへの統合は、1型糖尿病などの疾患に対する貴重な洞察を解き放つこの方法の可能性に対する認識の高まりを実証しています。
プロトコル
男女の組織ドナーからのヒト膵臓切片は、フロリダ大学の糖尿病を伴う膵臓臓器ドナーのネットワーク(nPOD)組織バンクを介して取得されました。識別子のない死亡者の臓器組織は、臓器提供に関する法律および規制に従って非ヒト被験者研究であると判断され、フロリダ大学治験審査委員会(IRB;IRB no. 392-2008)、同意の必要性を放棄した。このプロジェクトに特に使用されたnPOD組織は、フロリダ大学IRB(IRB20140093)によって非ヒトとして承認されました。
注:スライス技術とその応用(周融血やカルシウムイメージングなど)に全く慣れていない読者は、ヒトサンプルを扱う前に、マウスまたはラットのスライス3,28を使用して実践的な経験を積み、基本的なスキルを身に付けることをお勧めします。
1.事前準備
注:これらの準備は、組織が到着する前に実行する必要があります。
- 125 mM NaCl、5.9 mM KCl、2.56 mM CaCl2、1 mM MgCl2、25 mM HEPES、0.1% BSA、2 mM L-アラニン、L-アルギニン、およびL-グルタミンを混合してHEPES緩衝液を調製します。pHを7.4に調整し、フィルター滅菌します。
- グルコースやその他の刺激をバッファーに添加して、ペリフュージョン実験用の溶液を調製します。ベースライン緩衝液に5.5 mMグルコースを加えます。このバッファーは、スライス手順、スライス収集、およびペリフュージョン調製に使用されます。
- ベースラインバッファーにアプロチニン(10 μg/mL)を添加して、スライス回収用のディッシュを少なくとも 2 皿調製します。
- BSAおよびアミノ酸を含まないHEPES緩衝液(125 mM NaCl、5.9 mM KCl、2.56 mM CaCl2、1 mM MgCl2、25 mM HEPES)に3.8%低融点アガロース溶液を調製し、37°Cに保ちます。
- 新しいブレードをホルダーに入れて、ビブラトームを組み立てます。必要に応じて、ブレードの角度を15°に設定します(Leica VT1200Sを使用している場合)。必要に応じて、ビブラトームを調整します。
- ペリフュージョンマシンの電源を入れ、チャンバー数とプログラムプロトコルを選択します。
- 必要なすべての溶液をペリフュージョンマシンに入れ、システムをプライミングし、溶液を加熱し続けます。マシンは、プロトコルに使用される各ソリューションの必要な量を計算します。
2. 組織処理
注:スライスは受領後すぐに生成する必要があります。遅れると、手順が困難になり、組織の劣化につながる可能性があります。
- 実体顕微鏡下でベースラインバッファーを入れた皿に膵臓組織を置きます(図1A)。結合組織、線維組織、脂肪組織を鉗子やハサミでやさしく取り除きます。
- ハサミやメスなどを用いて、組織を約0.5cm3(図1B)の複数の小片に切断します。乾いた膵臓片をティッシュペーパーで拭き取ります。
- 4個を35mmのペトリ皿に移し、すべての破片が完全に沈むまで皿にアガロース溶液を入れます。アガロースが完全に固まるまで待ちます。
- アガロースから慎重に切り取ります。皿の端に沿ってメスを走らせてアガロースを取り除き、組織ブロックを慎重に分離します。破片がアガロースの薄い層で囲まれていることを確認してください。
3.スライス
- ビブラトームの金属板に組織片を逆さまに置いて接着します。
- プレートをトレイに取り付け、ベースラインバッファー(ベースライングルコース5.5 mMを含むHEPES)をトレイに充填します。
- ビブラトームを120μmの自動スライスにセットし、開始位置と終了位置を調整します。
- ブレードを組織のすぐ上に動かし、低速(0.1 mm / s)と0.8mmの振幅でスライスを開始します。組織が許せば、速度を上げることができます(図1C)。
- 湾曲した鉗子または小さなブラシを使用してスライスを収集します。アプロチニンを含むベースラインバッファーにスライスを蓄積します(図1D)。
- スライスをアプロチニンを含むベースラインバッファーで少なくとも1時間休ませます。スライスを低速オービタルシェーカーに置き、切断手順によって放出された酵素を洗い流します。
4.生死アッセイ
注:これは、手順後に組織スライスの実行可能性を示すオプションのアッセイです。ただし、一度染色したスライスは再利用できません。
- ベースラインバッファーで満たされたウェルに1つのスライスを移します。
- フルオレセインジアセテート(FDA、50 μg/mL)を添加し、室温で1分間インキュベートし、光から保護します。
- ヨウ化プロピジウム(PI,50 μg/mL)を添加し、室温で1分間インキュベートし、光から保護します。
- スライスをPBSで満たされた別のウェルに移し、1分間洗浄します。
- スライスをペトリ皿に移すか、イメージング用のカバースリップを使用してスライドガラスに取り付けます(図2A、B)。
5.ペリフュージョン
注:このプロトコルは、組織スライスの動的周灌融合を実行する方法を説明していますが、単離された膵島にも適しています。膵島チャンバーは、機械のユーザーマニュアルに記載されているように、膵島を装填する前に、濾紙とビーズ溶液で準備する必要があります。ただし、膵島とスライスチャンバーは同じ実験で一緒に使用できます。
- 3つのスライスを選択し、ブラシとメスを使用して実体顕微鏡でアガロースを最小限にトリミングします。
- ベースラインバッファー(5.5 mMベースライングルコースを含むHEPES)をスライスチャンバーのグリッドに一滴加え、グリッド上に1つのスライスを静かに置きます。3つのスライスのそれぞれについて繰り返します(図3A)。スライスが非常に小さい場合は、3つ以上のチャンバーを積み重ねて、島の数を増やします。チャンバーごとに複数のスライスを配置しないでください。
注:スライスあたりの膵島の数はドナーによって大きく異なり、スライスサイズ(10〜100膵島/スライス)によって異なります。合計3スライスは、インスリンとグルカゴンの両方の分泌を測定するのに十分であることが証明されています。 - 孤立した膵島の場合、インスリン分泌のためにカラムあたり最低30の膵島を使用します。グルカゴン検出には100個の膵島を使用することをお勧めします。個々のスライスチャンバー部品を上から下に組み立てます。
- スライスチャンバーをマシンの流入チューブと流出チューブに接続し、プロトコルを開始します(図3C)。
- プロトコル中は、チャンバー加熱ポンプとトレイ冷却ポンプを使用してください。プロトコル中にコレクションプレートを交換し、同日に定量を行う場合は4°Cで保存するか、それまでは-80°Cで保存してください。
- プロトコールが完了したら、チャンバーを取り外し、分解し、溶解(無水エタノール中の3%HCl)または固定(4%パラホルムアルデヒド中)のためにスライスを回収します。
- 水、10%漂白剤、水、空気で洗い流して機械を洗浄します。
- 市販の検出キットを使用してホルモン分泌を定量化します。
注: 図4 は、濃度範囲を推定するための3スライスのインスリンおよびグルカゴン分泌の絶対レベルを示しています。
6. カルシウムイメージング
- カルシウム染料(例:.、Fluo4-AM、カルブライト)溶液は、製造元の指示に従って調製します。
- ベースラインのHEPES緩衝液で色素を希釈し、アプロチニン(10 μg/mL)を加えます。
- 1つのスライスを移し、室温でオービタルシェーカーで30〜60分間インキュベートし、光から保護します。
- インキュベーション時間中に、ペリフュージョンシリンジを充填し、チューブをプライミングして、スライスイメージングセットアップを準備します(図5A、B)。
- すべての機器を接続し、ヒーターのスイッチを入れて、ポンプの流れを始動します。インフロー加熱とプラットフォームヒーターの両方を使用し、流量は0.5mL/minを推奨します。
- イメージングチャンバーに1つのスライスをそっと置き、ハープを使用して固定します。
- 低倍率の対物レンズを使用して、イメージング領域を特定します。反射を使用すると、膵島の領域を特定するのに役立ちます(図5C)。
- より高い倍率の対物レンズ(20倍や40倍など)に切り替え、実験の設定に従って位置を調整します。
注:最適な細胞生存率と膵島の完全性を確保するために、光学セクションは切断面の1〜2セル層下にあることをお勧めします。 - zスタックまたはタイルスキャン位置を設定します。撮影間隔と録画時間を設定します。ここでは、個々の細胞の識別を可能にするために、少なくとも256×256の解像度を使用し、5〜10秒のイメージング間隔および30〜60μmのzスタック範囲(該当する場合)を、平面間(1つの細胞層)の間隔で30〜60μmとした。詳細なイメージング設定については、 図6 を参照してください。
注意: イメージングパラメータを設定して、最高の解像度と最大面積を取得しますが、サンプルの漂白は避けてください。 - イメージングを開始し、実験に応じて溶液の流入を切り替えます。完了したら、スライスを収集し、免疫組織化学のためにそれらを修正します。
結果
プロトコールが首尾よく実行されると、1gの膵臓組織は約100〜200スライスを得る。その後、これらのスライスは、機能評価に進む前に、膵島が豊富なものを特定するために実体顕微鏡検査を受ける必要があります。フルオレセインジアセテート(FDA)およびヨウ化プロピジウム(PI)による標識によって決定される生存率は、80%〜90%に達すると予想されます(図2A)。切断面では、スライスプロセス中の細胞の損傷により、生存率が著しく低下する可能性があります。生存可能なスライスでは、動的なホルモン分泌が観察され(図2B)、高グルコースへの曝露と塩化カリウム(KCl)による膜脱分極により、強力なインスリン放出がもたらされます。
逆に、スライス手順中に遅延がある場合、または組織の質が最適でない場合、結果は大きく異なります。得られたスライスの数は減少する可能性があり、生存率評価は、PIで標識された非生菌細胞の割合が高いことを示している可能性があります(図2C)。これらの場合、機能評価は、高グルコースおよび膜の脱分極に対する反応の低下または不在さえ示しています(図2D)。最適ではない実験のデータは、組織の生存率の低下や機能性の低下につながる可能性があるため、タイムリーに正確に実行することと組織の質の重要性を示しています。これらの否定的な結果は、この方法の成功において考慮すべき重要な要素を思い出させる貴重なものです。
カルシウムイメージングにおける一般的な所見は、 図5Dに示すようにヒートマップとして、または 図5Eに示すように個々の細胞の個別の痕跡として視覚化されます。色素はすべての細胞タイプを無差別に標識するため、応答に基づいて細胞を区別するために特異的刺激が不可欠であることを強調することが重要です。生細胞を特定するために、KClを使用し、平均ベースライン応答を2標準誤差以上超える応答に基づいて細胞をソートします。さらに、スライスは固定して染色できるため、細胞の種類を識別できます。
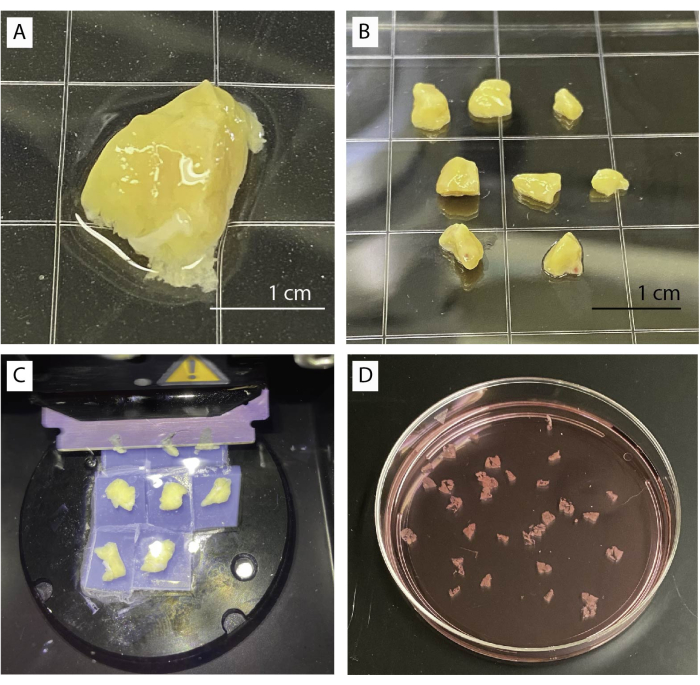
図1:組織処理とスライス(A)未処理の膵臓組織1g。(B)アガロース埋設の準備ができている洗浄された膵臓片。(C)ビブラトームを使用したスライス手順。(D)切りたての人間の膵臓スライス。この図の拡大版を見るには、ここをクリックしてください。
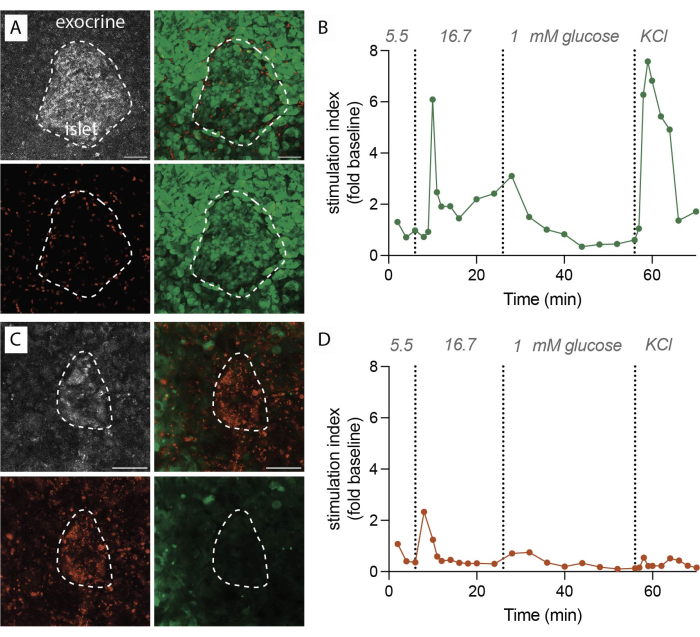
図2:組織の生存率とインスリン分泌データ(A)生存組織切片の代表的な画像。反射レーザー光の最大強度投影(灰色、左上)、死細胞のPI(赤、左下)、生細胞のFDA(緑、右下)、および生細胞と死細胞のマージ画像(右上)。点線は島を示します。スケールバー 50 μm. (B) 単一の非糖尿病ドナーからのヒト膵臓組織切片の動的インスリン分泌。インスリン動態は、6分間の高グルコース刺激後に第1相のピーク応答を示し、その後、プラトー第2相が続きます。データは、5.5 mM グルコースでの平均ベースライン分泌量(刺激指数、倍率変化)に正規化されています。(A)に示すように、同じドナーからのスライスに対して分泌が行われました。(C)生存不能な組織切片の代表的な画像。反射レーザー光の最大強度投影(灰色、左上)、死細胞のPI(赤、左下)、生細胞のFDA(緑、右下)、および生細胞と死細胞のマージ画像(右上)。点線は島を示します。スケールバー 50 μm. (D) 単一の非糖尿病ドナーからのヒト膵臓組織切片の動的インスリン分泌。インスリン動態は、グルコース刺激によるインスリン分泌とKClによる膜脱分極の両方の明らかな喪失を示しています。(C)に示すように、同じドナーからのスライスに対して分泌が行われました。この図の拡大版を見るには、ここをクリックしてください。

図3:動的ペリフュージョンのための組織負荷(A)積層スライスチャンバー。個々のスライスは、インサートに示されているように、金属グリッドにロードされます。(B)膵島チャンバー内の孤立した膵島の積み込み。スライスチャンバーとアイレットチャンバーは、ペリフュージョンマシンに接続されています。この図の拡大版を見るには、ここをクリックしてください。
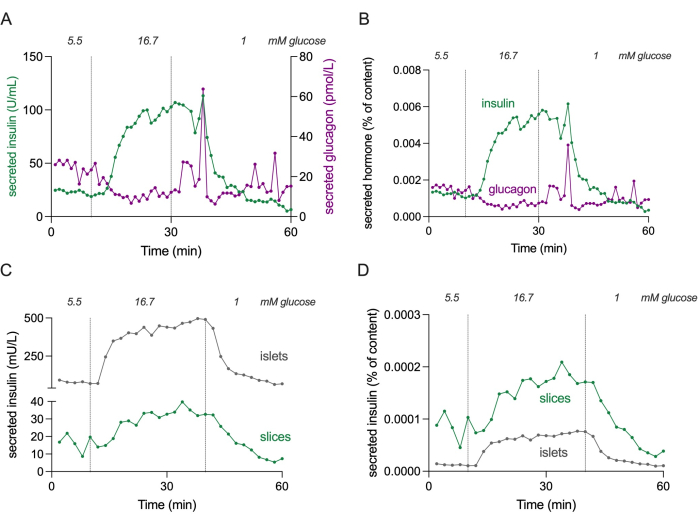
図4:スライスおよび孤立した膵島におけるホルモン分泌。 パネル(A)と(B)に示されているデータは、パネル(C)と(D)とは異なるドナーに由来しています。(A)単一の非糖尿病ドナーからの3つの膵臓組織切片からの絶対ホルモン分泌。インスリン分泌は緑色で、グルカゴン分泌はマゼンタで示されています。(B)(A)に示すホルモン分泌量を総ホルモン含有量(含有量の%)に正規化したもの。コンテンツは、実験で使用した3つのスライスすべてから測定されます。(C)同じ非糖尿病ドナーからの孤立した膵島(100の膵島)と膵臓組織スライス(3スライス)の動的インスリン分泌。データは絶対数(mU/L)で表示されています。(D)(C)に示すインスリン分泌は、総インスリン含量(含量の割合)に正規化されます。 この図の拡大版を見るには、ここをクリックしてください。
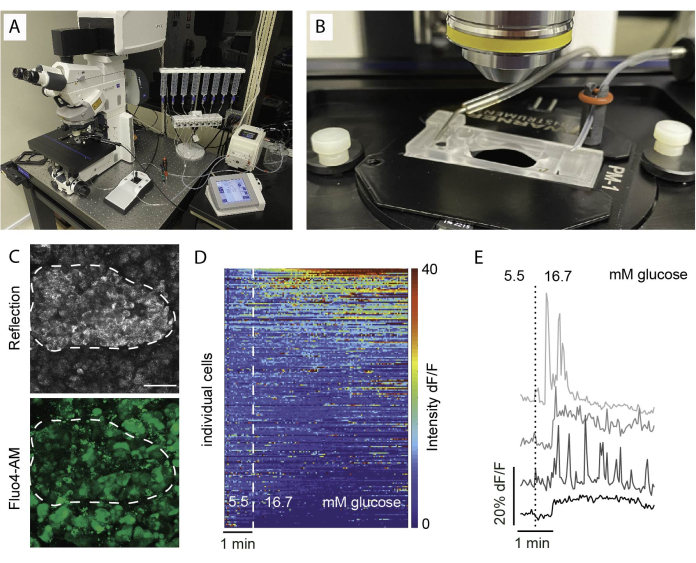
図5:イメージングのセットアップと期待される結果(A)正立共焦点顕微鏡とペリフュージョンセットアップによる機能イメージングのセットアップ。(B)流入と流出に接続されたイメージングチャンバー。(C)健康なヒトドナーからの組織スライス内の膵島のZスタックは、反射光(上)とFluo4シグナル(下)を示しています。反射は、スライス内の小島 (点線) を識別するために使用されます。(D)Fluo4の蛍光強度を5.5 mMグルコースで基底シグナル強度に正規化し、高グルコース(16.7 mM)で刺激した膵島細胞のin vitro Ca2+動態を示すヒートマップ。各行は、x軸で経時的に追跡された単一の細胞と、青(低強度)から赤(高強度)までのカラースケールで示されたベースライン(dF / F)に対する蛍光強度の大きさ変化(%)での応答を表します。(E)高グルコースに対する応答を示す4つの個々の細胞の代表的な微量。この図の拡大版を見るには、ここをクリックしてください。
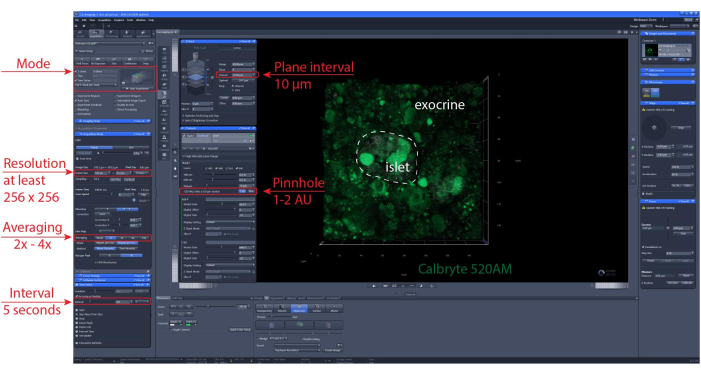
図6:カルシウムイメージング設定。 40μmのタイムラプス記録(XYZTイメージング)を実行するために選択された代表的な設定のソフトウェアのスクリーンショット。 この図の拡大版を見るには、ここをクリックしてください。
ディスカッション
ここでは、実行可能な膵臓組織スライスを生成するためのプロトコルと、動的ホルモン分泌や機能イメージングなどの機能的読み出しへの使用を紹介します。ヒトの膵島分離と同様に、スライス手順の成功は、ドナーの特性、組織輸送時間、および組織品質25,29を含む様々な要因によって影響を受ける。したがって、実験用の組織サンプルを慎重に選択し、虚血時間を最小限に抑えることが重要です。これに関連して、死体ドナー以外のヒト組織の他の潜在的な供給源を慎重に検討する必要があります。外科的ドナーを含めることで、機能スライスデータを同じ患者からの関連するin vivo情報と組み合わせるオプションが提供され、翻訳関連性が強化されます11。ただし、生検は通常、主に限局性腫瘍のために膵臓切除術を受けている高齢の患者からのものであるため、この組織源は他の要因をもたらします。特に、膵臓生検は糖尿病の状況では行われません。
実際のスライス手順を実行するときは、タイムリーな組織処理が重要です。スライスは、このプロトコルで概説されているように、数時間保存することも、Qadirら19に記載されているように、長期間培養することもできます。現在、このプロトコルは、長期間にわたってスライスの生存率を維持するための唯一の方法であるが、将来の取り組みでは、多様な培養時間にわたる機能的変化を評価し、同じドナーからの孤立した島との比較を引き出す必要がある。
このプロセスで最も重要なステップは、アガロースに包埋する前に慎重に組織を準備することです。大きな管や線維性組織は、スライスプロセスを複雑にし、組織ブロックがアガロースから抜け出す可能性があります。これが発生し、ピースが適度なサイズのままである場合は、スライスのために再処理して埋め込むことができます。良好な組織品質と慎重な処理を維持することで、スライス手順の効率が大幅に向上し、スライスの量と品質を最大限に高めることができます。組織調製からスライス生成までの経過時間は、間隔が長いほど組織の生存率に大きく影響するため、2〜3時間を超えてはなりません。
スライスのペリフュージョンでは、シンプルでありながら重要なステップは、チャンバーに完全にフィットするようにスライスを正確にトリミングすることです。これにより、組織の適切な入浴と途切れることのない流れが可能になります。プロトコルが開始されたら、ホルモン放出の不要なスパイクを防ぐために、チャンバーをさらに操作しないようにすることが不可欠です。十分な緩衝液を準備し、チューブが溶液の底に到達して、空気が吸い込まれてチャンバーが乾くのを防ぐ必要があります。
カルシウムイメージングでは、実験の必要性とデザインに応じて、関心のある領域を慎重に選択することが重要です。光の露光を減らすか、全体的なプロトコル時間を短縮するイメージングパラメータを選択することにより、光退色を最小限に抑えることが重要です。動的ホルモン分泌と同様に、スライスが最適な機能を得るには生理学的に近い条件(37°Cなど)を必要とするため、適切な溶液の流れと加熱設定を維持することが重要です。
膵臓組織切片は、膵臓の構造的完全性を効果的に維持し、その多様な細胞タイプ間の細胞間接続を維持します。その結果、孤立した島での作業に代わるものとなり、内分泌機能と外分泌機能の両方、およびそれらの相互作用を同時に探索することが容易になります。個々の細胞タイプの相互作用を評価するには、それらを区別することが重要です。その後の染色も選択肢の1つですが、利用可能な蛍光プローブに限界があり、正確な細胞層を見つけるという課題があります。したがって、応答に基づく細胞識別を可能にするために、細胞特異的刺激をプロトコルに組み込むことが賢明である。マウスまたはヒトのスライスにおける細胞型を区別するために、有効な刺激としては、アルファ細胞21,30に対するアドレナリン、デルタ細胞31に対するグレリン、腺房細胞5,32に対するセルレイン、管細胞33に対する胆汁酸、および脈管細胞22に対するノルエピネフリンが挙げられる。同様の刺激は、分泌反応の測定に使用できます。イメージング研究は個々の細胞に焦点を当てていますが、分泌研究は集団反応を分析します。したがって、望ましい結果を検出するために、十分な数のスライスを含めることが重要です。最適な量は細胞の種類によって異なる場合があり、内分泌細胞には3つのスライスで十分であることが証明されています。ただし、貴重な情報を見逃すリスクを冒すよりも、検出可能性を確保するために、より多くのスライスを使用することをお勧めします。
他の方法と同様に、組織スライスには結果を解釈する際に考慮すべき制限があります。特定の細胞タイプを標的とする刺激の適用は、スライス内の他の細胞タイプに影響を与え、フィードバックループを引き起こす可能性があります。ただし、これらも研究にとって重要であるため、測定された反応は生理学的反応をより表す可能性があります。選択的細胞ターゲティングには、従来の in vitro プロトコルを使用できます。重要なことに、腺房細胞には、タンパク質を分解して組織切片を消化できる膵臓酵素が含まれており、数時間以内に細胞が分解されます。生存率を維持するためには、スライスが静止状態にあるときにトリプシン阻害剤を一貫して使用することが不可欠ですが、その適用は標識目的で使用されるウイルスの正常な転写を妨げる可能性があります。
膵島単離と比較して、ドナーのばらつきと組織の質は、得られたスライスの量と生存率の両方に影響を与える可能性があります。スライス後の生存率が不十分な場合、寿命が短くなり、スライスの培養能力が妨げられる可能性があります。さらに、膵島の数はドナーによって大きく異なる可能性があるため、実験を行う前に膵島の含有量を推定することは困難です。したがって、ドナーの受け入れ基準を慎重に選択し、分泌に対するホルモン含有量の割合やベースラインへの倍率の変化など、適切な標準化方法を実施することが重要です。一貫した結果を得るには、実験前に組織スライスの生存率を評価することをお勧めします。さらに、関連する制御刺激(例えば、KCl)を実験に組み込むことが推奨される。イメージングなどの個々の細胞解析の場合、これらの制御刺激に対する応答に基づいて細胞を事前に選別することができます。言及された課題にもかかわらず、スライスは現在の研究方法に貴重な補強を提供します。
記載されているプロトコルは、いくつかの適用の開始点として使用でき、膵臓切片を操作し、さまざまな刺激の後に応答を調べることができます。また、マウスやヒトの膵臓スライスを利用した数多くの調査研究に読者を誘導し、実験を計画している人に貴重な洞察を提供します。将来的には、膵臓切片を用いて治療法の可能性が検討されたり、疾患メカニズムがモデル化されたりする可能性があります。
開示事項
著者らは何も開示していない。
謝辞
この研究は、糖尿病の膵臓臓器提供者のためのネットワーク(nPOD;RRID:SCR_014641)は、JDRF(nPOD:5-SRA-2018-557-Q-R)およびThe Leona M. & Harry B. Helmsley Charitable Trust(Grant#2018PG-T1D053、G-2108-04793)が支援する共同1型糖尿病研究プロジェクトです。表明された内容と見解は著者の責任であり、必ずしもnPODの公式見解を反映するものではありません。nPODと提携して研究リソースを提供している臓器調達機関(OPO)は、http://www.jdrfnpod.org/for-partners/npod-partners/ に記載されています。著者らは、寄付者とその家族の計り知れない貢献に感謝しています。この研究は、米国糖尿病協会4-22-PDFPM(J.K.P.)およびレオナ・M・アンド・ハリー・B・ヘルムズリー慈善信託(助成金2015-PG-T1D-052)の支援を受けた。
資料
| Name | Company | Catalog Number | Comments |
| Alanine | Sigma | A7627 | amino acid |
| AlexaFluor 488 goat anti-guineapig | Invitrogen | A11073 | secondary antibody |
| AlexaFluor 546 goat anti-rat | Thermo Fisher | A11077 | secondary antibody |
| AlexaFluor 647 goat anti-mouse | Thermo Fisher | A21235 | secondary antibody |
| Aprotinin | Sigma | A1153 | inhibitor |
| Arginine | Sigma | A5006 | amino acid |
| Calbryte 520 AM | AAT Bioquest | 20651 | Calcium dye |
| Fluo4-AM | Invitrogen | F14201 | Calcium dye |
| Fluorescein diacetat | Sigma | F7378 | viability marker |
| Glucagon | Sigma | G2654 | primary antibody |
| Glucagon ELISA (human kit) | Mercodia | 10-1271-01 | ELISA for hormone detection |
| Glutamine | Sigma | G3126 | amino acid |
| Insulin | Dako | A-0546 | primary antibody |
| Insulin ELISA (human) | Mercodia | 10-1113-01 | ELISA for hormone detection |
| Low melting point agarose | Sigma | A9414 | |
| LSM 900 | Zeiss | confocal microscope | |
| Pancreas Slice Chamber | Biorep Technologies | PERI-PSC-001 | slice chamber for perifucion |
| Pancreas Slice Chamber Extender Kit | Biorep Technologies | PERI-PSC-EXT | slice chamber for perifucion |
| Pancreas Slice Chamber Perforated Plate | Biorep Technologies | PERI-PSC-PP | slice chamber for perifucion |
| Perifusion system with automated tray handling | Biorep Technologies | PERI4-02-230-FA | |
| Propidium iodide | Life technologies | P1304MP | dead marker |
| Semi-automatic vibratome VT1200S | Leica | 14048142066 | |
| Somatostatin | Millipore | MAB354 | primary antibody |
参考文献
- Abdelli, S., et al. Intracellular stress signaling pathways activated during human islet preparation and following acute cytokine exposure. Diabetes. 53 (11), 2815-2823 (2004).
- Lyon, J., et al. Research-focused isolation of human islets from donors with and without diabetes at the alberta diabetes institute isletcore. Endocrinology. 157 (2), 560-569 (2016).
- Speier, S., Rupnik, M. A novel approach to in situ characterization of pancreatic beta-cells. Pflugers Arch. 446 (5), 553-558 (2003).
- Cohrs, C. M., et al. Vessel network architecture of adult human islets promotes distinct cell-cell interactions in situ and is altered after transplantation. Endocrinology. 158 (5), 1373-1385 (2017).
- Marolt, U., et al. Calcium imaging in intact mouse acinar cells in acute pancreas tissue slices. PLoS One. 17 (6), 0268644(2022).
- Stozer, A., et al. Confocal laser scanning microscopy of calcium dynamics in acute mouse pancreatic tissue slices. J Vis Exp. (170), e62293(2021).
- Stozer, A., Dolensek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of langerhans in acute mouse pancreas tissue slices. PLoS One. 8 (1), e54638(2013).
- Weitz, J. R., et al. Mouse pancreatic islet macrophages use locally released atp to monitor beta cell activity. Diabetologia. 61 (1), 182-192 (2018).
- Speier, S., Yang, S. B., Sroka, K., Rose, T., Rupnik, M. Katp-channels in beta-cells in tissue slices are directly modulated by millimolar atp. Mol Cell Endocrinol. 230 (1-2), 51-58 (2005).
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Mol Metab. 6 (9), 943-957 (2017).
- Cohrs, C. M., et al. Dysfunction of persisting beta cells is a key feature of early type 2 diabetes pathogenesis. Cell Rep. 31 (1), 107469(2020).
- Marciniak, A., et al. Using pancreas tissue slices for in situ studies of islet of langerhans and acinar cell biology. Nat Protoc. 9 (12), 2809-2822 (2014).
- Panzer, J. K., et al. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. JCI Insight. 5 (8), e134525(2020).
- Campbell-Thompson, M., et al. Network for pancreatic organ donors with diabetes (npod): Developing a tissue biobank for type 1 diabetes. Diabetes Metab Res Rev. 28 (7), 608-617 (2012).
- Kaddis, J. S., Pugliese, A., Atkinson, M. A. A run on the biobank: What have we learned about type 1 diabetes from the npod tissue repository. Curr Opin Endocrinol Diabetes Obes. 22 (4), 290-295 (2015).
- Pugliese, A., et al. New insight on human type 1 diabetes biology: Npod and npod-transplantation. Curr Diab Rep. 14 (10), 530(2014).
- Pugliese, A., et al. The juvenile diabetes research foundation network for pancreatic organ donors with diabetes (npod) program: Goals, operational model and emerging findings. Pediatr Diabetes. 15 (1), 1-9 (2014).
- Liang, T., et al. Ex vivo human pancreatic slice preparations offer a valuable model for studying pancreatic exocrine biology. J Biol Chem. 292 (14), 5957-5969 (2017).
- Qadir, M. M. F., et al. Long-term culture of human pancreatic slices as a model to study real-time islet regeneration. Nat Commun. 11 (1), 3265(2020).
- Huber, M. K., et al. Observing islet function and islet-immune cell interactions in live pancreatic tissue slices. J Vis Exp. (170), e62207(2021).
- Panzer, J. K., Tamayo, A., Caicedo, A. Restoring glutamate receptor signaling in pancreatic alpha cells rescues glucagon responses in type 1 diabetes. Cell Rep. 41 (11), 111792(2022).
- Mateus Goncalves, L., Almaca, J. Functional characterization of the human islet microvasculature using living pancreas slices. Front Endocrinol (Lausanne). 11, 602519(2020).
- Doke, M., et al. Dynamic scrna-seq of live human pancreatic slices reveals functional endocrine cell neogenesis through an intermediate ducto-acinar stage. Cell Metab. 35 (11), 1944-1960 (2023).
- Mateus Goncalves, L., et al. Pericyte dysfunction and impaired vasomotion are hallmarks of islets during the pathogenesis of type 1 diabetes. Cell Rep. 42 (8), 112913(2023).
- Hanley, S. C., Paraskevas, S., Rosenberg, L. Donor and isolation variables predicting human islet isolation success. Transplantation. 85 (7), 950-955 (2008).
- Hart, N. J., Powers, A. C. Use of human islets to understand islet biology and diabetes: Progress, challenges and suggestions. Diabetologia. 62 (2), 212-222 (2019).
- Henquin, J. C. The challenge of correctly reporting hormones content and secretion in isolated human islets. Mol Metab. 30, 230-239 (2019).
- Panzer, J. K., Caicedo, A. Protocol to generate and utilize pancreatic tissue slices to study endocrine and exocrine physiology in situ from mouse and human tissue. STAR Protoc. 4 (3), 102399(2023).
- Toso, C., et al. Factors affecting human islet of langerhans isolation yields. Transplant Proc. 34 (3), 826-827 (2002).
- Hamilton, A., et al. Adrenaline stimulates glucagon secretion by tpc2-dependent ca(2+) mobilization from acidic stores in pancreatic alpha-cells. Diabetes. 67 (6), 1128-1139 (2018).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- Marciniak, A., Selck, C., Friedrich, B., Speier, S. Mouse pancreas tissue slice culture facilitates long-term studies of exocrine and endocrine cell physiology in situ. PLoS One. 8 (11), e78706(2013).
- Gal, E., et al. A novel in situ approach to studying pancreatic ducts in mice. Front Physiol. 10, 938(2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved