Method Article
Generierung von menschlichen Pankreasgewebeschnitten zur Untersuchung der endokrinen und exokrinen Pankreasphysiologie
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt, wie menschliche Bauchspeicheldrüsenschnitte von verstorbenen Organspendern erzeugt werden, um die Zellfunktion unter nahezu physiologischen Bedingungen zu untersuchen. Dieser innovative Ansatz ermöglicht die Untersuchung normaler und strukturell geschädigter Inselzellen und des komplexen Zusammenspiels zwischen endokrinen und exokrinen Kompartimenten.
Zusammenfassung
Es ist von entscheidender Bedeutung, die menschliche Bauchspeicheldrüse zu untersuchen, um die pathophysiologischen Mechanismen zu verstehen, die mit Typ-1- (T1D) und Typ-2-Diabetes (T2D) verbunden sind, sowie die endokrine und exokrine Physiologie und das Zusammenspiel der Bauchspeicheldrüse. Aus der Untersuchung isolierter Pankreasinseln wurde viel gelernt, aber dies verhindert eine Untersuchung ihrer Funktion und Wechselwirkungen im Kontext des gesamten Gewebes. Pankreasschnitte bieten eine einzigartige Gelegenheit, die Physiologie normaler, entzündeter und strukturell geschädigter Inselzellen in ihrer natürlichen Umgebung zu erforschen, was wiederum die Untersuchung der Wechselwirkungen zwischen endokrinen und exokrinen Kompartimenten ermöglicht, um die komplexe Dynamik des Pankreasgewebes besser untersuchen zu können. Daher stellt die Einführung der Plattform für lebende Pankreasscheiben einen bedeutenden Fortschritt auf diesem Gebiet dar. Dieses Protokoll beschreibt, wie lebende Gewebeschnitte von verstorbenen Organspendern durch Gewebeeinbettung in Agarose- und Vibratomschnitte erzeugt werden und wie sie zur Beurteilung funktioneller Messwerte wie dynamischer Sekretion und Lebendzellbildgebung verwendet werden.
Einleitung
Studien zur Inselphysiologie sind grundlegend, um die Pathogenese von Diabetes zu verstehen und neue Therapieansätze zu entwickeln. Bisher hat sich die Forschung auf isolierte Inselzellen gestützt, die die Inselzellen mechanischen und enzymatischen Belastungen aussetzen, was wahrscheinlich zu Veränderungen in der Zellphysiologie führt. Darüber hinaus ist es nicht möglich, die Funktion der Inselzellen im Kontext ihrer natürlichen Gewebeumgebung zu bewerten, die wahrscheinlich unter anderem von exokrinen und vaskulären Zellen beeinflusst wird1. Bei der Untersuchung von Bauchspeicheldrüse von Spendern mit T1D besteht die Herausforderung, dass ihre Inseln schwer zu isolieren sind und während der Isolierung fragmentiert werden können, was zu einem Selektionseffekt auf Inseln führen könnte, die möglicherweise nicht die Population in vivorepräsentieren 2. Darüber hinaus werden die Inselzellen von ihrer komplexen Umgebung und ihren zellulären Verbindungen getrennt, insbesondere von den infiltrierenden Immunzellen, die in entzündeten Inselzellen zu finden sind und in der Inselperipherie häufiger vorkommen. Obwohl isolierte Inselzellen ein Eckpfeiler der Diabetesforschung sind, gibt es also Einschränkungen. Als Reaktion darauf stellen wir ein bahnbrechendes Protokoll zur Erzeugung lebender Bauchspeicheldrüsenschnitte vor, das eine Lösung für diese Herausforderungen bietet.
Die jüngste Entwicklung und Einführung von Techniken zum Schneiden von Pankreasgewebe gilt als Durchbruch für unsere Fähigkeit, die komplizierte Biologie und Funktionen der Bauchspeicheldrüse zu erforschen. Diese Innovation hat neue Wege für dynamische Studien der Inselphysiologie und der Wechselwirkungen zwischen endokrinen, exokrinen, neuronalen, vaskulären und Immunzellen in ihrem natürlichen anatomischen Kontext eröffnet. Im Gegensatz zu herkömmlichen Ansätzen bleibt bei dieser In-vitro-Umgebung ein Großteil der Zytoarchitektur des Organs erhalten, was eine Annäherung an die ursprüngliche Biologie ermöglicht. Diese Methode wurde ursprünglich 2003 von Speier und Rupnik an Mäusen entwickelt3 und hat ihren Nutzen bei der Beurteilung der Kalziumbildgebung, der Elektrophysiologie und der Hormonsekretion sowohl für die intra- als auch für die interzelluläre Signalübertragung bewiesen 4,5,6,7,8,9. Die Pankreasschnittplattform wurde dann für die Untersuchung von menschlichem Pankreasgewebe verwendet, das durch chirurgische Biopsie gewonnen wurde 4,10,11,12. Unsere Gruppe demonstrierte die Machbarkeit der Gewinnung und Verwendung von Bauchspeicheldrüsenschnitten von Leichenorganspendern durch die Aktivität des Netzwerks für Pankreasorganspender mit Diabetes (nPOD)13. nPOD stellt zugelassenen Forschern, die Forschung über Typ-1-Diabetes beim Menschen betreiben, Pankreasgewebe zur Verfügung, und seit der Einführung der Pankreasschnittplattform erzeugt und verteilt nPOD routinemäßig lebende Bauchspeicheldrüsenschnitte 14,15,16,17. Seit der Implementierung der Pankreasschnitt-Plattform im Jahr 2020 hat nPOD erfolgreich Gewebeschnitte von 43 Spendern (darunter 12 Spender mit T1D) an zahlreiche Prüfärzte verteilt. Mit diesen Schnitten führten die Forscher bahnbrechende Forschungen zu kritischen Aspekten der Inselfunktion durch und untersuchten das Zusammenspiel zwischen Inselzellen und dem Gefäßsystem, dem Nervensystem und den Immunzellen im Zusammenhang mit T1D 13,18,19,20,21,22,23,24. Zahlreiche Studien haben die Grenzen traditioneller Ansätze hervorgehoben und die Bedeutung von Techniken unterstrichen, die das dynamische Zusammenspiel innerhalb der Bauchspeicheldrüse erfassen können 25,26,27. Die Anpassungsfähigkeit von Schneidetechniken von der Maus in die menschliche Bauchspeicheldrüse, gepaart mit ihrer Integration in Programme wie das Network for Pancreatic Organ Donors with Diabetes (nPOD), ist ein Beispiel für die wachsende Anerkennung des Potenzials der Methode, wertvolle Erkenntnisse über Krankheiten wie Typ-1-Diabetes zu gewinnen.
Protokoll
Humane Pankreasschnitte von Gewebespendern beiderlei Geschlechts wurden über die Gewebebank des Network for Pancreatic Organ Donors with Diabetes (nPOD) der University of Florida entnommen. Organgewebe von verstorbenen Personen ohne Identifikatoren wurde gemäß den Gesetzen und Vorschriften zur Organspende als nicht-menschliche Probanden eingestuft und vom Institutional Review Board (IRB) der University of Florida als nicht-menschliche Probanden eingestuft; IRB Nr. 392-2008) und verzichtet auf das Erfordernis einer Zustimmung. nPOD-Gewebe, die speziell für dieses Projekt verwendet wurden, wurden von der University of Florida IRB (IRB20140093) als nichtmenschlich zugelassen.
HINWEIS: Für Leser, die mit der Schichttechnik und ihren Anwendungen, wie z. B. Perifusion und Kalziumbildgebung, noch nicht vertraut sind, kann es ratsam sein, praktische Erfahrungen zu sammeln und grundlegende Fähigkeiten mit Maus- oder Rattenscheibenzu entwickeln 3,28, bevor sie mit menschlichen Proben arbeiten.
1. Vorbereitungen
HINWEIS: Diese Vorbereitungen sollten vor dem Eintreffen des Gewebes durchgeführt werden.
- Bereiten Sie HEPES-Puffer vor, indem Sie 125 mM NaCl, 5,9 mM KCl, 2,56 mM CaCl2, 1 mM MgCl2, 25 mM HEPES, 0,1 % BSA, 2 mM L-Alanin, L-Arginin und L-Glutamin mischen. Stellen Sie den pH-Wert auf 7,4 ein und sterilisieren Sie den Filter.
- Fügen Sie dem Puffer Glukose und/oder andere Stimuli hinzu, um Lösungen für das Perifusionsexperiment vorzubereiten. Als Ausgangspuffer fügen Sie 5,5 mM Glukose hinzu. Dieser Puffer wird für das Schneiden, die Scheibenentnahme und die Perifusionsvorbereitung verwendet.
- Bereiten Sie mindestens zwei Gerichte für die Scheibenentnahme vor, indem Sie Aprotinin (10 μg/ml) zum Basispuffer hinzufügen.
- Bereiten Sie eine 3,8 %ige Agaroselösung mit niedrigem Schmelzpunkt in HEPES-Puffer ohne BSA und Aminosäuren (125 mM NaCl, 5,9 mM KCl, 2,56 mM CaCl2, 1 mM MgCl2, 25 mM HEPES) vor und halten Sie sie bei 37 °C.
- Montieren Sie das Vibratom, indem Sie eine frische Klinge in den Halter einsetzen. Stellen Sie ggf. den Klingenwinkel auf 15° ein (bei Verwendung von Leica VT1200S). Kalibrieren Sie ggf. das Vibratom.
- Schalten Sie das Perifusionsgerät ein, wählen Sie die Anzahl der Kammern und das Programmprotokoll.
- Geben Sie alle notwendigen Lösungen in die Perifusionsmaschine, grundieren Sie das System und halten Sie die Lösungen erhitzt. Die Maschine berechnet die erforderlichen Volumina jeder Lösung, die für das Protokoll verwendet wird.
2. Verarbeitung von Gewebe
HINWEIS: Slices sollten sofort nach Erhalt generiert werden. Jede Verzögerung kann zu Schwierigkeiten beim Eingriff führen und zum Abbau des Gewebes führen.
- Legen Sie das Pankreasgewebe in eine Schale mit Baseline-Puffer unter einem Stereomikroskop (Abbildung 1A). Entfernen Sie vorsichtig Bindegewebe, fibrotisches Gewebe und Fettgewebe mit Pinzette und Schere.
- Schneiden Sie das Gewebe mit einer Schere oder einem Skalpell in mehrere kleine Stücke von ca. 0,5 cm3 (Abbildung 1B). Tupfen Sie trockene Bauchspeicheldrüsenstücke auf Seidenpapier ab.
- 4 Stücke in eine 35 mm Petrischale geben und die Schale mit Agaroselösung füllen, bis alle Stücke vollständig untergetaucht sind. Lassen Sie Agarose vollständig erstarren.
- Aus der Agarose vorsichtig Stücke herausschneiden. Führen Sie das Skalpell am Rand der Schale entlang, um die Agarose zu entfernen und die Gewebeblöcke vorsichtig zu trennen. Stellen Sie sicher, dass die Stücke von einer dünnen Schicht Agarose umgeben sind.
3. Schneiden
- Kleben Sie Gewebestücke auf die Metallplatte des Vibratoms, indem Sie sie auf den Kopf stellen.
- Setzen Sie die Platte in das Tablett ein und füllen Sie das Tablett mit Baseline-Puffer (HEPES mit 5,5 mM Baseline-Glukose).
- Stellen Sie das Vibratom auf automatisches Schneiden bei 120 μm ein und passen Sie die Start- und Endposition an.
- Bewegen Sie die Klinge kurz über das Gewebe und beginnen Sie mit dem Schneiden mit langsamer Geschwindigkeit (0,1 mm/s) und einer Amplitude von 0,8 mm. Die Geschwindigkeit kann erhöht werden, wenn das Gewebe dies zulässt (Abbildung 1C).
- Sammeln Sie die Scheiben mit einer gebogenen Pinzette oder einer kleinen Bürste. Die Scheiben werden in einem Aprotinin-haltigen Basispuffer akkumuliert (Abbildung 1D).
- Lassen Sie die Scheiben mindestens 1 h in einem Baseline-Puffer mit Aprotinin ruhen. Legen Sie die Scheiben auf einen langsamen Orbitalschüttler, um das Ausspülen der durch den Schneidvorgang freigesetzten Enzyme zu ermöglichen.
4. Lebend-/Tot-Assay
HINWEIS: Hierbei handelt es sich um einen optionalen Assay, der die Lebensfähigkeit der Gewebeschnitte nach dem Eingriff zeigt. Einmal gebeizte Scheiben können jedoch nicht wiederverwendet werden.
- Übertragen Sie eine einzelne Scheibe in eine Vertiefung, die mit Baseline-Puffer gefüllt ist.
- Fluoresceindiacetat (FDA, 50 μg/ml) zugeben, 1 min bei Raumtemperatur inkubieren und vor Licht schützen.
- Propidiumiodid (PI,50 μg/ml) zugeben, 1 min bei Raumtemperatur inkubieren und vor Licht schützen.
- Übertragen Sie die Scheibe in eine andere mit PBS gefüllte Mulde, um sie 1 Minute lang zu waschen.
- Übertragen Sie die Scheiben in eine Petrischale oder montieren Sie sie auf einen Objektträger mit Deckglas für die Bildgebung (Abbildung 2A,B).
5. Perifusion
HINWEIS: Dieses Protokoll beschreibt, wie eine dynamische Perifusion für Gewebeschnitte durchgeführt wird, ist jedoch auch für isolierte Inselzellen geeignet. Die Inselkammern müssen vor dem Laden der Inselzellen mit Filterpapier und Raupenlösung vorbereitet werden, wie in der Bedienungsanleitung der Maschine beschrieben. Insel- und Scheibenkammer können jedoch zusammen im selben Experiment verwendet werden.
- Wählen Sie 3 Scheiben und schneiden Sie die Agarose unter einem Stereomikroskop mit Pinsel und Skalpell auf ein Minimum ab.
- Geben Sie einen Tropfen Baseline-Puffer (HEPES mit 5,5 mM Baseline-Glukose) auf das Gitter der Scheibenkammer und legen Sie vorsichtig eine Scheibe auf das Gitter. Wiederholen Sie den Vorgang für jede der 3 Scheiben (Abbildung 3A). Wenn die Scheiben sehr klein sind, stapeln Sie mehr als 3 Kammern, um die Anzahl der Inselzellen zu erhöhen. Legen Sie nicht mehr als eine Scheibe pro Kammer ein.
HINWEIS: Die Anzahl der Inselzellen pro Scheibe variiert stark zwischen den Spendern und hängt von der Scheibengröße ab (10-100 Inseln/Scheibe). Insgesamt haben sich 3 Scheiben als ausreichend erwiesen, um sowohl die Insulin- als auch die Glukagonsekretion zu messen. - Verwenden Sie für isolierte Inselzellen mindestens 30 Inselzellen pro Säule für die Insulinsekretion. Es wird empfohlen, 100 Inselzellen für den Glukagonnachweis zu verwenden. Montieren Sie einzelne Scheibenkammerteile von oben nach unten.
- Verbinden Sie die Schichtkammer mit den Zu- und Abflussschläuchen in der Maschine und starten Sie das Protokoll (Abbildung 3C).
- Verwenden Sie während des Protokolls eine Kammerheizung und eine Tablettkühlpumpe. Wechseln Sie die Auffangplatten während des Protokolls und lagern Sie sie bei 4 °C, wenn die Quantifizierung am selben Tag durchgeführt wird, oder lagern Sie sie bis dahin bei -80 °C.
- Wenn das Protokoll abgeschlossen ist, entfernen Sie die Kammern, zerlegen Sie sie und sammeln Sie Scheiben für die Lyse (3 % HCl in absolutem Ethanol) oder die Fixierung (in 4 % Paraformaldehyd).
- Reinigen Sie die Maschine, indem Sie sie mit Wasser, 10 % Bleichmittel, Wasser und Luft spülen.
- Quantifizieren Sie die Hormonsekretion mit kommerziell erhältlichen Nachweiskits.
HINWEIS: Abbildung 4 zeigt die absoluten Insulin- und Glukagonsekretionswerte von 3 Scheiben zur Schätzung der Konzentrationsbereiche.
6. Kalzium-Bildgebung
- Bereiten Sie die Calciumfarbstofflösung (z. B. Fluo4-AM, Calbryte) gemäß den Anweisungen des Herstellers vor.
- Verdünnen Sie den Farbstoff in der HEPES-Pufferlösung zu Studienbeginn und fügen Sie Aprotinin (10 μg/ml) hinzu.
- Eine einzelne Scheibe umfüllen und 30-60 Minuten auf einem Orbitalschüttler bei Raumtemperatur inkubieren und vor Licht schützen.
- Bereiten Sie während der Inkubationszeit die Einrichtung der Schichtbildgebung vor, indem Sie die Perifusionsspritzen füllen und die Schläuche grundieren (Abbildung 5A, B).
- Schließen Sie alle Geräte an, schalten Sie die Heizung ein und starten Sie den Pumpenfluss. Es wird empfohlen, sowohl eine Zulaufheizung als auch eine Plattformheizung mit einer Durchflussrate von 0,5 mL/min zu verwenden.
- Legen Sie eine einzelne Scheibe vorsichtig in die Bildgebungskammer und befestigen Sie sie mit einer Harfe.
- Verwenden Sie ein Objektiv mit geringer Vergrößerung, um den Bildbereich zu identifizieren. Die Verwendung von Reflexion hilft bei der Identifizierung von Inselbereichen (Abbildung 5C).
- Wechseln Sie zu einem Objektiv mit höherer Vergrößerung (z. B. 20x oder 40x) und passen Sie die Position entsprechend dem Versuchsaufbau an.
HINWEIS: Um eine optimale Zellviabilität und Inselintegrität zu gewährleisten, wird empfohlen, dass die optischen Abschnitte 1-2 Zellschichten unter der Schnittfläche liegen sollten. - Legen Sie die Position des Z-Stapels und/oder des Kachelscans fest. Legen Sie das Bildgebungsintervall und die Aufnahmedauer fest. Hier wurde eine Auflösung von mindestens 256 x 256 verwendet, um die Unterscheidung einzelner Zellen zu ermöglichen, ein Bildgebungsintervall von 5-10 s und ein Z-Stack-Bereich (falls zutreffend) von 30-60 μm mit einem Abstand von 10 μm zwischen den Ebenen (eine Zellschicht). Detaillierte Imaging-Einstellungen finden Sie in Abbildung 6 .
HINWEIS: Stellen Sie den Bildgebungsparameter so ein, dass die beste Auflösung und maximale Fläche erzielt wird, aber vermeiden Sie ein Ausbleichen der Probe. - Starten Sie die Bildgebung und schalten Sie den Lösungszufluss je nach Experiment um. Wenn Sie fertig sind, sammeln Sie die Scheiben und fixieren Sie sie für die Immunhistochemie.
Ergebnisse
Wenn das Protokoll erfolgreich ausgeführt wird, ergibt 1 g Pankreasgewebe etwa 100-200 Scheiben. Anschließend sollten diese Scheiben einer stereomikroskopischen Inspektion unterzogen werden, um diejenigen zu identifizieren, die reich an Inselzellen sind, bevor mit der Funktionsbewertung fortgefahren wird. Die Lebensfähigkeit, die durch Markierung mit Fluoresceindiacetat (FDA) und Propidiumiodid (PI) bestimmt wird, wird voraussichtlich 80 % bis 90 % erreichen (Abbildung 2A). Die Lebensfähigkeit kann an der Schnittfläche aufgrund von Zellschäden während des Schneideprozesses deutlich geringer sein. In lebensfähigen Schnitten wird eine dynamische Hormonsekretion (Abbildung 2B) beobachtet, die zu einer robusten Insulinfreisetzung bei Exposition gegenüber hoher Glukose und Membrandepolarisation mit Kaliumchlorid (KCl) führt.
Kommt es hingegen zu Verzögerungen beim Schneiden oder ist die Gewebequalität suboptimal, unterscheiden sich die Ergebnisse erheblich. Die Anzahl der erhaltenen Scheiben kann abnehmen, und die Viabilitätsbewertung kann auf einen höheren Anteil nicht lebensfähiger Zellen hinweisen, die mit PI markiert sind (Abbildung 2C). In diesen Fällen deutet die funktionelle Bewertung auf eine verminderte oder sogar fehlende Reaktion auf eine hohe Glukose- und Membrandepolarisation hin (Abbildung 2D). Die Daten aus suboptimalen Experimenten verdeutlichen, wie wichtig eine präzise und zeitnahe Ausführung und Gewebequalität sind, da sie zu einer verminderten Lebensfähigkeit des Gewebes und einer beeinträchtigten Funktionalität führen können. Diese negativen Ergebnisse dienen als wertvolle Erinnerung an die kritischen Faktoren, die für den Erfolg dieser Methode zu berücksichtigen sind.
Häufige Befunde in der Kalziumbildgebung werden als Heatmap visualisiert, wie in Abbildung 5D dargestellt, oder als separate Spuren für einzelne Zellen, wie in Abbildung 5E dargestellt. Es ist wichtig zu betonen, dass der Farbstoff alle Zelltypen unterschiedslos markiert, daher sind spezifische Reize für die Unterscheidung von Zellen anhand ihrer Reaktionen unerlässlich. Um lebensfähige Zellen zu identifizieren, verwenden wir KCl und sortieren die Zellen basierend auf Reaktionen, die die durchschnittliche Ausgangsreaktion um mehr als zwei Standardfehler übertreffen. Darüber hinaus können die Scheiben fixiert und gefärbt werden, was die Identifizierung von Zelltypen ermöglicht.
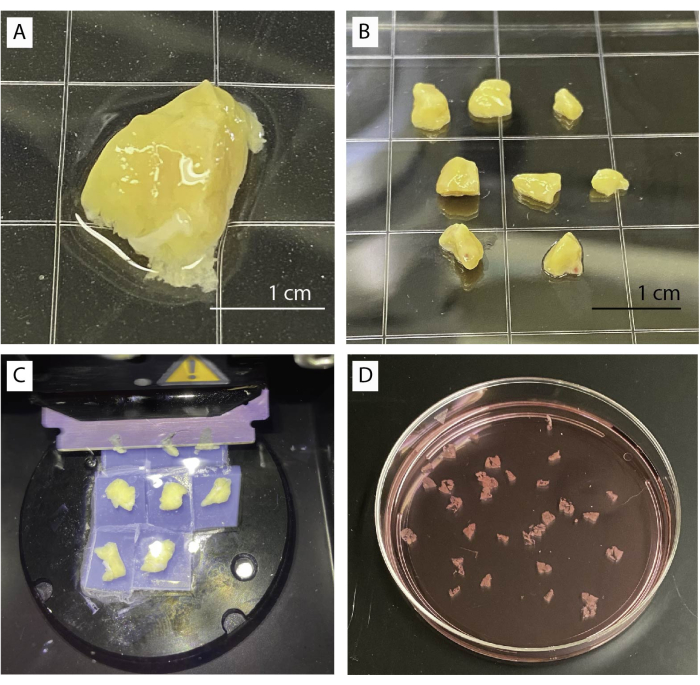
Abbildung 1: Gewebeaufbereitung und Schneiden. (A) 1 g unverarbeitetes Bauchspeicheldrüsengewebe. (B) Gereinigte Pankreasstücke, die für die Agarose-Einbettung bereit sind. (C) Schneideverfahren mit einem Vibratom. (D) Frisch geschnittene Scheiben der menschlichen Bauchspeicheldrüse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
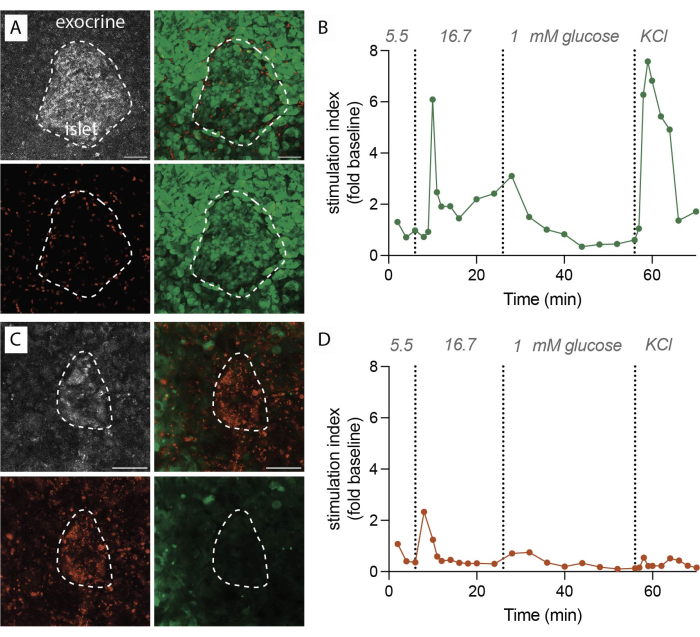
Abbildung 2: Daten zur Gewebeviabilität und Insulinsekretion. (A) Repräsentative Bilder für lebensfähige Gewebeschnitte. Projektion von reflektiertem Laserlicht mit maximaler Intensität (grau, oben links), PI für tote Zellen (rot, unten links), FDA für lebende Zellen (grün, unten rechts) und zusammengeführte Bilder für lebende und tote Zellen (oben rechts). Die gestrichelte Linie zeigt eine kleine Insel. Maßstabsbalken 50 μm. (B) Dynamische Insulinsekretion von menschlichen Pankreasgewebeschnitten von einem einzigen nichtdiabetischen Spender. Die Insulinkinetik zeigt eine Spitzenreaktion in der ersten Phase nach 6 Minuten hoher Glukosestimulation, gefolgt von einer Plateau-Phase in der zweiten Phase. Die Daten sind auf die durchschnittliche Ausgangssekretion bei 5,5 mM Glukose normalisiert (Stimulationsindex, Faltungsänderung). Die Sekretion wurde an Scheiben desselben Spenders durchgeführt, wie in (A) gezeigt. (C) Repräsentative Bilder für nicht lebensfähige Gewebeschnitte. Projektion von reflektiertem Laserlicht mit maximaler Intensität (grau, oben links), PI für tote Zellen (rot, unten links), FDA für lebende Zellen (grün, unten rechts) und zusammengeführte Bilder für lebende und tote Zellen (oben rechts). Die gestrichelte Linie zeigt eine kleine Insel. Maßstabsbalken 50 μm. (D) Dynamische Insulinsekretion von menschlichen Pankreasgewebeschnitten von einem einzigen nichtdiabetischen Spender. Die Insulinkinetik zeigt einen deutlichen Verlust sowohl der glukosestimulierten Insulinsekretion als auch der Membrandepolarisation mit KCl. Die Daten sind auf die durchschnittliche Ausgangssekretion bei 5,5 mM Glukose normiert (Stimulationsindex, Faltungsänderung). Die Sekretion wurde an Scheiben desselben Spenders durchgeführt, wie in (C) gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Gewebebelastung für die dynamische Perifusion. (A) Gestapelte Schnittkammern. Einzelne Schichten werden auf ein Metallgitter geladen, wie in der Einlage gezeigt. (B) Verladung isolierter Inselzellen in Inselkammern. Schicht- und Inselkammern, die mit der Perifusionsmaschine verbunden sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
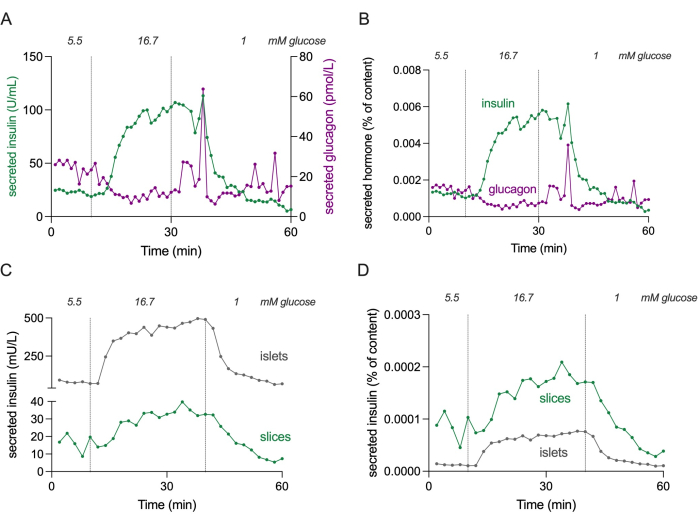
Abbildung 4: Hormonsekretion in Schnitten und isolierten Inseln. Die in den Panels (A) und (B) gezeigten Daten stammen von einem anderen Spender als die Panels (C) und (D). (A) Absolute Hormonsekretion aus 3 Pankreasgewebeschnitten von einem einzigen nichtdiabetischen Spender. Die Insulinsekretion ist in grün und die Glukagonsekretion in magenta dargestellt. (B) Die unter (A) gezeigte Hormonsekretion normiert auf den Gesamthormongehalt (% des Gehalts). Der Inhalt wird von allen 3 Slices gemessen, die im Experiment verwendet wurden. (C) Dynamische Insulinsekretion von isolierten Inselzellen (100 Inseln) und Pankreasgewebeschnitten (3 Schnitte) desselben nichtdiabetischen Spenders. Die Daten werden in absoluten Zahlen (mU/L) angezeigt. (D) Die unter (C) gezeigte Insulinsekretion ist auf den Gesamtinsulingehalt (% des Gehalts) normalisiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
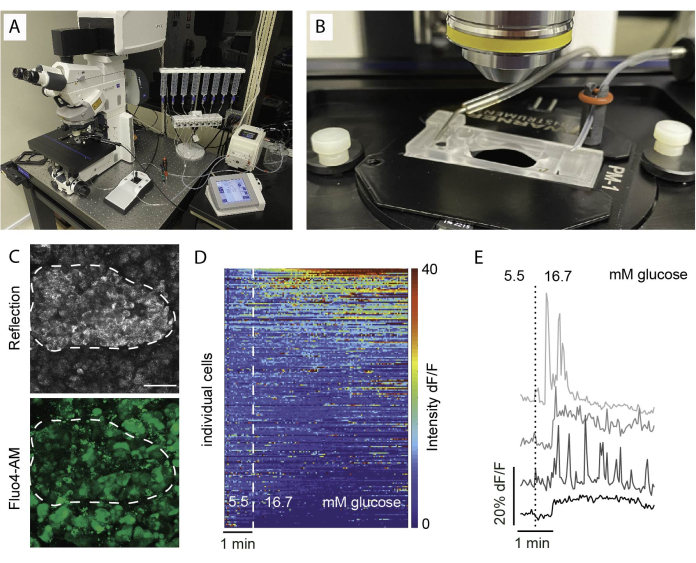
Abbildung 5: Aufbau der Bildgebung und erwartete Ergebnisse. (A) Aufbau für die funktionelle Bildgebung mit einem aufrechten konfokalen Mikroskop und einem Perifusionsaufbau. (B) Bildgebungskammer, die mit dem Zu- und Abfluss verbunden ist. (C) Z-Stapel von konfokalen Bildern einer Insel innerhalb eines Gewebeschnitts eines gesunden menschlichen Spenders, der reflektiertes Licht (oben) und Fluo4-Signal (unten) zeigt. Die Spiegelung wird verwendet, um Inselzellen innerhalb des Ausschnitts (gestrichelte Linie) zu identifizieren. (D) Heatmap, die die in vitro Ca2+ -Dynamik von Inselzellen zeigt, ausgedrückt als Fluoreszenzintensität von Fluo4, normiert auf die basale Signalintensität bei 5,5 mM Glukose und Stimulation mit hoher Glukose (16,7 mM). Jede Zeile stellt eine einzelne Zelle dar, die im Zeitverlauf auf der x-Achse verfolgt wird, und ihre Reaktion in der Größenänderung (%) der Fluoreszenzintensität gegenüber der Grundlinie (dF/F), die in der Farbskala von Blau (niedrige Intensität) bis Rot (hohe Intensität) dargestellt ist. (E) Repräsentative Spuren von 4 einzelnen Zellen, die eine Reaktion auf hohen Glukosespiegel zeigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
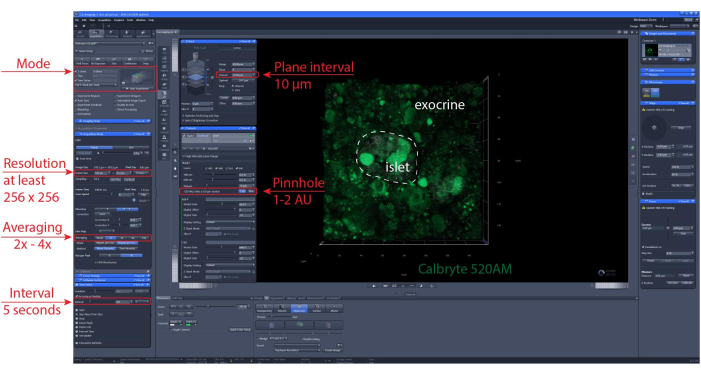
Abbildung 6: Einstellungen für die Kalzium-Bildgebung. Screenshot der Software mit repräsentativen Einstellungen, die für die Durchführung von Zeitrafferaufnahmen von 40 μm (XYZT-Bildgebung) ausgewählt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier stellen wir ein Protokoll zur Generierung lebensfähiger Gewebeschnitte aus der Bauchspeicheldrüse vor und deren Verwendung für funktionelle Messwerte wie dynamische Hormonsekretion und funktionelle Bildgebung. Ähnlich wie bei der Isolierung menschlicher Inselzellen wird der Erfolg des Slice-Verfahrens von verschiedenen Faktoren beeinflusst, darunter die Eigenschaften des Spenders, die Zeit des Gewebetransports und die Gewebequalität25,29. Daher ist es entscheidend, die Gewebeproben für das Experiment sorgfältig auszuwählen und die Ischämiezeiten so gering wie möglich zu halten. In diesem Zusammenhang sollten neben Leichenspendern auch andere potenzielle Quellen für menschliches Gewebe sorgfältig in Betracht gezogen werden. Die Einbeziehung chirurgischer Spender bietet die Möglichkeit, funktionelle Schichtdaten mit relevanten In-vivo-Informationen desselben Patienten zu kombinieren, wodurch die translationale Relevanz erhöhtwird 11. Diese Gewebequelle bringt jedoch andere Faktoren mit sich, da die Biopsien in der Regel von älteren Patienten stammen, die sich einer Pankreektomie unterziehen, meist aufgrund eines lokalisierten Tumors. Bemerkenswert ist, dass Pankreasbiopsien im Zusammenhang mit Diabetes nicht durchgeführt werden.
Bei der Durchführung des eigentlichen Schneidevorgangs ist die rechtzeitige Gewebeverarbeitung von entscheidender Bedeutung. Die Scheiben können mehrere Stunden gelagert werden, wie in diesem Protokoll beschrieben, oder über längere Zeiträume kultiviert werden, wie von Qadir et al.19 beschrieben. Gegenwärtig ist dieses Protokoll die einzige Methode zur Aufrechterhaltung der Lebensfähigkeit von Scheiben über längere Zeiträume, jedoch sollten zukünftige Bemühungen funktionelle Veränderungen über verschiedene Kulturzeiten hinweg bewerten und Vergleiche mit isolierten Inselzellen desselben Spenders anstellen.
Der kritischste Schritt in diesem Prozess ist die sorgfältige Vorbereitung des Gewebes vor der Einbettung in Agarose. Große Kanäle und fibrotisches Gewebe können den Schneideprozess erschweren und möglicherweise dazu führen, dass Gewebeblöcke aus der Agarose ausbrechen. Wenn dies der Fall ist und die Teile in angemessener Größe bleiben, können sie erneut verarbeitet und für das Schneiden eingebettet werden. Die Aufrechterhaltung einer guten Gewebequalität und eine sorgfältige Verarbeitung erhöhen die Effizienz des Schneideverfahrens erheblich und erzielen ein Maximum an Quantität und Qualität der Scheiben. Die Zeit, die von der Gewebevorbereitung bis zur Schnitterzeugung vergeht, sollte 2-3 Stunden nicht überschreiten, da längere Intervalle die Lebensfähigkeit des Gewebes erheblich beeinträchtigen.
Während der Scheibenperifusion ist ein einfacher, aber entscheidender Schritt das präzise Trimmen der Scheibe, um einen perfekten Sitz in der Kammer zu gewährleisten. Dies ermöglicht das richtige Baden des Gewebes und einen ununterbrochenen Fluss. Sobald das Protokoll eingeleitet ist, ist es wichtig, weitere Manipulationen an den Kammern zu vermeiden, um unerwünschte Spitzen in der Hormonfreisetzung zu verhindern. Es sollte ein ausreichender Puffer vorbereitet werden, und die Schläuche sollten bis zum Boden der Lösung reichen, um zu verhindern, dass Luft ansaugt und die Kammern trocken laufen.
Für die Kalziumbildgebung ist es wichtig, das interessierende Gebiet sorgfältig auszuwählen, abhängig von den experimentellen Anforderungen und dem Design. Es ist wichtig, das Photobleaching zu minimieren, indem Bildgebungsparameter gewählt werden, die die Lichtexposition reduzieren oder die Gesamtprotokollzeit verkürzen. Wie bei der dynamischen Hormonsekretion ist die Aufrechterhaltung eines ordnungsgemäßen Lösungsflusses und einer beheizten Einstellung von entscheidender Bedeutung, da die Scheiben für eine optimale Funktion nahezu physiologische Bedingungen benötigen (z. B. 37 °C).
Pankreasgewebeschnitte erhalten effektiv die strukturelle Integrität der Bauchspeicheldrüse und bewahren die Zell-Zell-Verbindungen zwischen ihren verschiedenen Zelltypen. Folglich bieten sie eine Alternative zur Arbeit mit isolierten Inselzellen und erleichtern die gleichzeitige Erforschung sowohl endokriner als auch exokriner Funktionen und ihres Zusammenspiels. Um das Zusammenspiel der einzelnen Zelltypen beurteilen zu können, ist es entscheidend, zwischen ihnen zu unterscheiden. Die nachträgliche Färbung ist eine Option, die jedoch Einschränkungen in Bezug auf die verfügbaren Fluoreszenzsonden und die Herausforderung hat, genaue Zellschichten zu lokalisieren. Daher ist es ratsam, zellspezifische Stimuli in das Protokoll einzubauen, um eine Zellunterscheidung anhand von Reaktionen zu ermöglichen. Zur Unterscheidung zwischen Zelltypen in Maus- oder Menschenschnitten umfassen wirksame Stimuli Adrenalin für Alpha-Zellen21,30, Ghrelin für Delta-Zellen31, Cerulein für Azinuszellen 5,32, Gallensäuren für duktale Zellen33 und Noradrenalin für Gefäßzellen22. Ähnliche Stimuli können zur Messung sekretorischer Reaktionen eingesetzt werden. Während sich bildgebende Untersuchungen auf einzelne Zellen konzentrieren, analysieren Sekretionsstudien die kollektive Reaktion. Daher ist es wichtig, eine ausreichende Anzahl von Scheiben einzubeziehen, um die gewünschten Ergebnisse zu erzielen. Die optimale Menge kann je nach Zelltyp variieren, wobei sich drei Scheiben für endokrine Zellen als ausreichend erweisen; Es ist jedoch ratsam, mehr Slices zu verwenden, um die Erkennbarkeit zu gewährleisten, anstatt zu riskieren, wertvolle Informationen zu verpassen.
Wie jede andere Methode weisen auch Gewebeschnitte Einschränkungen auf, die bei der Interpretation der Ergebnisse berücksichtigt werden sollten. Die Anwendung von Reizen, die auf bestimmte Zelltypen abzielen, kann zu Auswirkungen auf andere Zelltypen in der Scheibe führen und möglicherweise Rückkopplungsschleifen auslösen. Diese sind jedoch auch wichtig zu untersuchen, und daher können die gemessenen Reaktionen repräsentativer für eine physiologische Reaktion sein. Für das selektive Zell-Targeting können traditionelle In-vitro-Protokolle verwendet werden. Wichtig ist, dass Azinuszellen Pankreasenzyme enthalten, die Proteine abbauen und die Gewebescheibe verdauen können, was innerhalb weniger Stunden zu einem zellulären Abbau führt. Um die Lebensfähigkeit zu erhalten, ist die konsequente Verwendung von Trypsin-Inhibitoren unerlässlich, wenn sich die Scheiben in einem statischen Zustand befinden, auch wenn ihre Anwendung die erfolgreiche Übertragung von Viren, die für Markierungszwecke verwendet werden, beeinträchtigen kann.
Im Vergleich zur Inselisolierung können sich die Variabilität der Spender und die Gewebequalität sowohl auf die Menge als auch auf die Lebensfähigkeit der erhaltenen Scheiben auswirken. Eine unzureichende Lebensfähigkeit nach dem Schneiden kann zu einer kurzen Lebensdauer führen und die Fähigkeit beeinträchtigen, die Scheiben zu kultivieren. Darüber hinaus kann die Anzahl der Inselzellen zwischen den Spendern erheblich variieren, was es schwierig macht, den Inselinhalt vor der Durchführung von Experimenten zu schätzen. Daher sind eine sorgfältige Auswahl der Akzeptanzkriterien für die Spende und die Implementierung geeigneter Normalisierungsmethoden, wie z. B. der prozentuale Anteil des Hormongehalts für die Sekretion oder die Faltenänderung zum Ausgangswert, von entscheidender Bedeutung. Für konsistente Ergebnisse wird empfohlen, die Lebensfähigkeit von Gewebescheiben vor dem Experiment zu beurteilen. Darüber hinaus wird empfohlen, relevante Kontrollreize (z.B. KCl) in das Experiment einzubeziehen. Bei der Analyse einzelner Zellen, wie z. B. der Bildgebung, kann eine Vorsortierung der Zellen auf der Grundlage ihrer Reaktion auf diese Kontrollstimulationen implementiert werden. Trotz der genannten Herausforderungen bieten Schnitte eine wertvolle Ergänzung zu aktuellen Forschungsmethoden.
Das beschriebene Protokoll kann als Ausgangspunkt für mehrere Anwendungen verwendet werden, und Pankreasschnitte können manipuliert und Reaktionen nach einer Vielzahl von Reizen untersucht werden. Wir verweisen die Leser auch auf zahlreiche Forschungsstudien, in denen Bauchspeicheldrüsenschnitte von Mäusen oder Menschen verwendet werden, die wertvolle Erkenntnisse für diejenigen liefern, die ihre Experimente planen. In Zukunft ist es möglich, dass mögliche Therapien anhand von Pankreasschnitten untersucht oder Krankheitsmechanismen modelliert werden.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Studie wurde mit Unterstützung des Netzwerks für Pankreasorganspender mit Diabetes (nPOD; RRID:SCR_014641), ein kollaboratives Forschungsprojekt zu Typ-1-Diabetes, das von JDRF (nPOD: 5-SRA-2018-557-Q-R) und dem Leona M. & Harry B. Helmsley Charitable Trust (Grant#2018PG-T1D053, G-2108-04793) unterstützt wird. Der Inhalt und die geäußerten Ansichten liegen in der Verantwortung der Autoren und spiegeln nicht unbedingt die offizielle Meinung von nPOD wider. Organbeschaffungsorganisationen (OPO), die mit nPOD zusammenarbeiten, um Forschungsressourcen bereitzustellen, sind unter http://www.jdrfnpod.org/for-partners/npod-partners/ aufgeführt. Die Autoren danken den Spendern und ihren Familien für ihren unschätzbaren Beitrag. Diese Arbeit wurde unterstützt von der American Diabetes Association 4-22-PDFPM (J.K.P.) und dem Leona M. and Harry B. Helmsley Charitable Trust (grant 2015-PG-T1D-052).
Materialien
| Name | Company | Catalog Number | Comments |
| Alanine | Sigma | A7627 | amino acid |
| AlexaFluor 488 goat anti-guineapig | Invitrogen | A11073 | secondary antibody |
| AlexaFluor 546 goat anti-rat | Thermo Fisher | A11077 | secondary antibody |
| AlexaFluor 647 goat anti-mouse | Thermo Fisher | A21235 | secondary antibody |
| Aprotinin | Sigma | A1153 | inhibitor |
| Arginine | Sigma | A5006 | amino acid |
| Calbryte 520 AM | AAT Bioquest | 20651 | Calcium dye |
| Fluo4-AM | Invitrogen | F14201 | Calcium dye |
| Fluorescein diacetat | Sigma | F7378 | viability marker |
| Glucagon | Sigma | G2654 | primary antibody |
| Glucagon ELISA (human kit) | Mercodia | 10-1271-01 | ELISA for hormone detection |
| Glutamine | Sigma | G3126 | amino acid |
| Insulin | Dako | A-0546 | primary antibody |
| Insulin ELISA (human) | Mercodia | 10-1113-01 | ELISA for hormone detection |
| Low melting point agarose | Sigma | A9414 | |
| LSM 900 | Zeiss | confocal microscope | |
| Pancreas Slice Chamber | Biorep Technologies | PERI-PSC-001 | slice chamber for perifucion |
| Pancreas Slice Chamber Extender Kit | Biorep Technologies | PERI-PSC-EXT | slice chamber for perifucion |
| Pancreas Slice Chamber Perforated Plate | Biorep Technologies | PERI-PSC-PP | slice chamber for perifucion |
| Perifusion system with automated tray handling | Biorep Technologies | PERI4-02-230-FA | |
| Propidium iodide | Life technologies | P1304MP | dead marker |
| Semi-automatic vibratome VT1200S | Leica | 14048142066 | |
| Somatostatin | Millipore | MAB354 | primary antibody |
Referenzen
- Abdelli, S., et al. Intracellular stress signaling pathways activated during human islet preparation and following acute cytokine exposure. Diabetes. 53 (11), 2815-2823 (2004).
- Lyon, J., et al. Research-focused isolation of human islets from donors with and without diabetes at the alberta diabetes institute isletcore. Endocrinology. 157 (2), 560-569 (2016).
- Speier, S., Rupnik, M. A novel approach to in situ characterization of pancreatic beta-cells. Pflugers Arch. 446 (5), 553-558 (2003).
- Cohrs, C. M., et al. Vessel network architecture of adult human islets promotes distinct cell-cell interactions in situ and is altered after transplantation. Endocrinology. 158 (5), 1373-1385 (2017).
- Marolt, U., et al. Calcium imaging in intact mouse acinar cells in acute pancreas tissue slices. PLoS One. 17 (6), 0268644(2022).
- Stozer, A., et al. Confocal laser scanning microscopy of calcium dynamics in acute mouse pancreatic tissue slices. J Vis Exp. (170), e62293(2021).
- Stozer, A., Dolensek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of langerhans in acute mouse pancreas tissue slices. PLoS One. 8 (1), e54638(2013).
- Weitz, J. R., et al. Mouse pancreatic islet macrophages use locally released atp to monitor beta cell activity. Diabetologia. 61 (1), 182-192 (2018).
- Speier, S., Yang, S. B., Sroka, K., Rose, T., Rupnik, M. Katp-channels in beta-cells in tissue slices are directly modulated by millimolar atp. Mol Cell Endocrinol. 230 (1-2), 51-58 (2005).
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Mol Metab. 6 (9), 943-957 (2017).
- Cohrs, C. M., et al. Dysfunction of persisting beta cells is a key feature of early type 2 diabetes pathogenesis. Cell Rep. 31 (1), 107469(2020).
- Marciniak, A., et al. Using pancreas tissue slices for in situ studies of islet of langerhans and acinar cell biology. Nat Protoc. 9 (12), 2809-2822 (2014).
- Panzer, J. K., et al. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. JCI Insight. 5 (8), e134525(2020).
- Campbell-Thompson, M., et al. Network for pancreatic organ donors with diabetes (npod): Developing a tissue biobank for type 1 diabetes. Diabetes Metab Res Rev. 28 (7), 608-617 (2012).
- Kaddis, J. S., Pugliese, A., Atkinson, M. A. A run on the biobank: What have we learned about type 1 diabetes from the npod tissue repository. Curr Opin Endocrinol Diabetes Obes. 22 (4), 290-295 (2015).
- Pugliese, A., et al. New insight on human type 1 diabetes biology: Npod and npod-transplantation. Curr Diab Rep. 14 (10), 530(2014).
- Pugliese, A., et al. The juvenile diabetes research foundation network for pancreatic organ donors with diabetes (npod) program: Goals, operational model and emerging findings. Pediatr Diabetes. 15 (1), 1-9 (2014).
- Liang, T., et al. Ex vivo human pancreatic slice preparations offer a valuable model for studying pancreatic exocrine biology. J Biol Chem. 292 (14), 5957-5969 (2017).
- Qadir, M. M. F., et al. Long-term culture of human pancreatic slices as a model to study real-time islet regeneration. Nat Commun. 11 (1), 3265(2020).
- Huber, M. K., et al. Observing islet function and islet-immune cell interactions in live pancreatic tissue slices. J Vis Exp. (170), e62207(2021).
- Panzer, J. K., Tamayo, A., Caicedo, A. Restoring glutamate receptor signaling in pancreatic alpha cells rescues glucagon responses in type 1 diabetes. Cell Rep. 41 (11), 111792(2022).
- Mateus Goncalves, L., Almaca, J. Functional characterization of the human islet microvasculature using living pancreas slices. Front Endocrinol (Lausanne). 11, 602519(2020).
- Doke, M., et al. Dynamic scrna-seq of live human pancreatic slices reveals functional endocrine cell neogenesis through an intermediate ducto-acinar stage. Cell Metab. 35 (11), 1944-1960 (2023).
- Mateus Goncalves, L., et al. Pericyte dysfunction and impaired vasomotion are hallmarks of islets during the pathogenesis of type 1 diabetes. Cell Rep. 42 (8), 112913(2023).
- Hanley, S. C., Paraskevas, S., Rosenberg, L. Donor and isolation variables predicting human islet isolation success. Transplantation. 85 (7), 950-955 (2008).
- Hart, N. J., Powers, A. C. Use of human islets to understand islet biology and diabetes: Progress, challenges and suggestions. Diabetologia. 62 (2), 212-222 (2019).
- Henquin, J. C. The challenge of correctly reporting hormones content and secretion in isolated human islets. Mol Metab. 30, 230-239 (2019).
- Panzer, J. K., Caicedo, A. Protocol to generate and utilize pancreatic tissue slices to study endocrine and exocrine physiology in situ from mouse and human tissue. STAR Protoc. 4 (3), 102399(2023).
- Toso, C., et al. Factors affecting human islet of langerhans isolation yields. Transplant Proc. 34 (3), 826-827 (2002).
- Hamilton, A., et al. Adrenaline stimulates glucagon secretion by tpc2-dependent ca(2+) mobilization from acidic stores in pancreatic alpha-cells. Diabetes. 67 (6), 1128-1139 (2018).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- Marciniak, A., Selck, C., Friedrich, B., Speier, S. Mouse pancreas tissue slice culture facilitates long-term studies of exocrine and endocrine cell physiology in situ. PLoS One. 8 (11), e78706(2013).
- Gal, E., et al. A novel in situ approach to studying pancreatic ducts in mice. Front Physiol. 10, 938(2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten