Method Article
القياس الكمي للابتلاع الدبقي الصغير للمواد المتشابكة باستخدام قياس التدفق الخلوي
In This Article
Summary
نقدم هنا بروتوكولين لتحديد ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية الإيجابية vGLUT1 والمشابك العصبية الخام ذات العلامات الحمراء pHRodo باستخدام قياس التدفق الخلوي.
Abstract
تلعب الخلايا الدبقية الصغيرة دورا محوريا في الصقل المشبكي في الدماغ. تحليل ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية ضروري لفهم هذه العملية. ومع ذلك ، فإن الطرق المتاحة حاليا لتحديد ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية ، مثل الكيمياء الهيستولوجية المناعية (IHC) والتصوير ، شاقة وتستغرق وقتا طويلا. لمواجهة هذا التحدي ، نقدم هنا مقايسات في المختبر وفي الجسم الحي * تسمح بالقياس الكمي السريع والعالي الإنتاجية لابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية باستخدام قياس التدفق الخلوي.
في نهج الجسم الحي * ، أجرينا تلطيخ vGLUT1 داخل الخلايا بعد عزل الخلايا الطازجة من أدمغة الفئران البالغة لتحديد ابتلاع نقاط الاشتباك العصبي vGLUT1 + بواسطة الخلايا الدبقية الصغيرة. في مقايسة ابتلاع المشبك العصبي في المختبر ، استخدمنا خلايا معزولة حديثا من دماغ الفأر البالغ لتحديد ابتلاع المشابك العصبية ذات العلامات الحمراء pHrodo بواسطة الخلايا الدبقية الصغيرة. توفر هذه البروتوكولات معا نهجا فعالا من حيث الوقت لقياس ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية وتمثل بدائل واعدة للطرق القائمة على تحليل الصور كثيفة العمالة. من خلال تبسيط التحليل ، يمكن أن تساهم هذه المقايسات في فهم أفضل لدور الخلايا الدبقية الصغيرة في الصقل المشبكي في نماذج الأمراض المختلفة.
Introduction
الخلايا الدبقية الصغيرة هي الخلايا المناعية المقيمة في الجهاز العصبي المركزي (CNS)1. يقومون باستمرار بمسح بيئتهم المكروية وتوفير المراقبة 1,2. علاوة على ذلك ، فإنها تتفاعل بشكل متكرر مع نقاط الاشتباك العصبي وتتوسط في ضبط النشاط المشبكي3. وهكذا ، فقد برزوا كلاعب رئيسي في عملية الصقل المشبكي.
تم عرض دور الخلايا الدبقية الصغيرة في الصقل المشبكي من خلال ابتلاع نقاط الاشتباك العصبي من قبل مجموعات بحثيةمختلفة 3،4،5،6،7. يمكن أن تسهم الاضطرابات في هذه العملية في أمراض اضطرابات النمو العصبي والتنكس العصبي مثل الفصام ومرض الزهايمر8. تم بالفعل اكتشاف الصقل المشبكي الشاذ بواسطة الخلايا الدبقية الصغيرة في نماذج الفئران المختلفة للاضطرابات العصبية5،9،10. لذلك ، فإن تحديد الآليات المتميزة الكامنة وراء ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية أمر بالغ الأهمية لفهم الفيزيولوجيا المرضية لاضطرابات النمو العصبي والتنكس العصبي8.
إن استهداف ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية يحمل إمكانات كبيرة للتدخل في تطور المرض واكتساب نظرة ثاقبة للآليات الأساسية لاضطرابات النمو العصبي والتنكس العصبي. ولتيسير هذه التحقيقات، هناك حاجة إلى نهج سريعة وعالية الإنتاجية. تشمل الأساليب المنهجية الحالية في الجسم الحي ، خارج الجسم الحي ، وفي المقايسات المختبرية التي تمكن من الكشف عن المواد المشبكية داخل الخلايا الدبقية الصغيرة. بشكل عام ، يعتمد الكشف عن ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية بشكل كبير على الكيمياء الهيستولوجية المناعية (IHC) والنهج القائمة على الفحص المجهري5،6،11 ، والتي تتطلب عمالة كثيفة وتظهر قيودا في تحليل عدد كبير من الخلايا الدبقية الصغيرة.
وبالنظر إلى هذه القيود التقنية، فإن استكشاف منهجيات بديلة أمر حتمي. للتغلب على هذا ، قمنا بتحسين نهج قائم على قياس التدفق الخلوي ، والذي يتيح تحليلا فعالا وغير متحيز وعالي الإنتاجية لابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية. لقد اخترنا الحصين كمنطقة الاهتمام الرئيسية نظرا لدرجة عالية من إعادة تشكيل متشابك واللدونة12 ، ولكن يمكن تكييف البروتوكول مع مناطق الدماغ المختلفة. بينما تم بالفعل استخدام قياس التدفق الخلوي في الدراسات السابقة للكشف عن ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية13،14،15 ، فإننا نقدم هنا منهجية خطوة بخطوة تستخدم جسما مضادا vGLUT1 مترافقا بالفلوروفور متاحا تجاريا حاليا. علاوة على ذلك ، نحن نقدم نهجا تكميليا في المختبر للفحص عالي الإنتاجية للابتلاع الدبقي الصغير للمواد المشبكية باستخدام المشابك الخام.
Protocol
يتم توضيح منظر عام للإجراء التجريبي بيانيا في الشكل 1 أ. تم إجراء جميع التجارب التي تنطوي على التعامل مع الحية المستخدمة بما يتفق بدقة مع قانون حماية الألماني وتمت الموافقة عليها من قبل المكتب الإقليمي للخدمات الصحية والاجتماعية في برلين (Landesamt für Gesundheit und Soziales ، برلين ، ألمانيا). تم إيواء الفئران في أقفاص جيدة التهوية في ظل ظروف معملية قياسية مع دورة ضوء / ظلام 12:12 ساعة في منشأة الأساسية لمركز ماكس ديلبروك للطب الجزيئي (MDC). تم توفير الطعام والماء حسب الطلب. انظر الجدول 1 لمعرفة تكوين المخازن المؤقتة والكواشف وجدول المواد للحصول على التفاصيل المتعلقة بجميع الكواشف والأدوات والمواد المستخدمة في هذا البروتوكول. بالنسبة للمقايسة الخاصة ب vGLUT1 ، استخدمنا المصطلح في الجسم الحي * في جميع أنحاء المخطوطة للاعتراف بأن قياس التدفق الخلوي يتطلب تجانس الأنسجة وعزل الخلايا ، وتظهر الخلايا الدبقية الصغيرة ما يقرب من 95٪ من الصلاحية بعد إجراء العزل (الشكل 1B والشكل التكميلي S1). لذلك ، فإنها تحتفظ بقدرتها على ابتلاع المواد المشبكية خارج الجسم الحي ، لفترة قصيرة ، حتى التثبيت. وبالتالي ، فإن القياس الكمي للخلايا الدبقية الصغيرة vGLUT1 + يشمل كلا من الابتلاع خارج الجسم الحي على حد سواء في الجسم الحي وقصير الأجل حتى خطوة التثبيت.
1. تلطيخ vGLUT1 داخل الخلايا للكشف عن ابتلاع المشابك العصبية glutamatergic في الجسم الحي بواسطة الخلايا الدبقية الصغيرة
ملاحظة: تم تكييف إجراء عزل الخلايا التالي من16. يجب تنفيذ جميع خطوات عزل الخلايا على الجليد.
- تخدير الفئران باستخدام الحقن داخل الصفاق من بنتوباربيتال. قم بتغذية الفئران داخل القلب ب 10 مل من محلول ملحي Dulbecco المخزن بالفوسفات (DPBS) لمدة ~ 2 دقيقة.
ملاحظة: يتم استخدام ماوس واحد لكل عينة (n). - أخرج الدماغ من الجمجمة واحتفظ به في 1 مل من وسط الخلايا العصبية.
ملاحظة: يستخدم وسط الخلايا العصبية ، مثل وسيط Hibernate-A ، لضمان قابلية عالية للبقاء للخلايا بعد عملية تفكك الأنسجة. - نقل الدماغ إلى طبق بتري مملوء 1 مل من وسط الخلايا العصبية الباردة الجليد وتشريح الحصين كما هو موضح سابقا17.
- نقل الحصين إلى الخالط Dounce مليئة 1 مل من وسط الخلايا العصبية وفصل الأنسجة باستخدام مدقة فضفاضة مع ما يقرب من ~ 25 السكتات الدماغية لطيف.
- ضع مصفاة 70 ميكرومتر على أنبوب بولي بروبيلين سعة 5 مل وأضف 500 ميكرولتر من وسط الخلية العصبية. انقل تجانس الأنسجة إلى أنبوب البولي بروبلين سعة 5 مل من خلال المصفاة.
- شطف الخالط Dounce 2x مع 1 مل من وسط الخلايا العصبية الباردة والطرد المركزي العينات في 400 × غرام لمدة 8 دقائق.
- نضح المادة الطافية وأعد تعليق الحبيبات في 500 ميكرولتر من DPBS المثلج عن طريق ماصة لطيفة. تأكد من تعليق متجانس وأكمل الحجم النهائي إلى 1.5 مل باستخدام DPBS.
- أضف 500 ميكرولتر من محلول Percoll متساوي التوتر إلى العينة ، وأعد تعليقه برفق ، وقم بتراكبه مع 2 مل أخرى من DPBS البارد.
- أجهزة الطرد المركزي العينات في 3000 × غرام لمدة 10 دقائق مع تسارع كامل وبدون فرامل. نضح الطبقة العليا وكذلك قرص المايلين في المرحلة الوسطى.
ملاحظة: يتم تنفيذ جميع خطوات الطرد المركزي التالية عند 4 درجةمئوية إذا لم يتم تحديد خلاف ذلك. - أضف 4 مل من DPBS البارد وأجهزة الطرد المركزي العينات عند 400 × جم لمدة 10 دقائق. نضح المادة الطافية وإعادة تعليق الخلايا في 100 ميكرولتر من محلول تلطيخ الجدوى القابل للتثبيت واحتضان العينات لمدة 30 دقيقة عند 4 درجات مئوية.
- أضف 1 مل من DPBS البارد إلى العينة وطرد مركزي العينات عند 300 × جم لمدة 5 دقائق. تخلص من المادة الطافية وأضف 100 ميكرولتر من محلول تلطيخ CD16 / CD32 (1/200 في المخزن المؤقت FACS). دوامة لمدة ~ 5 ثوان واحتضانها لمدة 10 دقائق عند 4 درجات مئوية.
ملاحظة: تلطيخ CD16 / CD32 هو معالجة مسبقة لتقليل الارتباط غير المحدد للأجسام المضادة بالخلايا الحاملة ل FcR ، مثل الخلايا الدبقية الصغيرة ، قبل تطبيقات مثل قياس التدفق الخلوي. - أضف 1 مل من المخزن المؤقت FACS إلى العينة وأجهزة الطرد المركزي عند 300 × جم لمدة 5 دقائق. نضح المادة الطافية وأضف 100 ميكرولتر من مزيج التلوين الرئيسي I (1/100 مضاد CD11b / مضاد CD45 + 1/200 مضاد Ly6C / مضاد Ly6G في 1x FACS Buffer). احتضان العينات لمدة 20 دقيقة عند 4 درجات مئوية في الظلام.
- أضف 1 مل من المخزن المؤقت FACS إلى العينة وأجهزة الطرد المركزي عند 300 × جم لمدة 5 دقائق.
- أعد تعليق الحبيبات في 250 ميكرولتر من المخزن المؤقت للتثبيت. احتضان على حرارة 4 درجة مئوية لمدة 25 دقيقة.
- أضف 2 مل من 1x نفاذية (PERM) عازلة وأجهزة طرد مركزي 300 × جم لمدة 5 دقائق.
- تخلص من المادة الطافية وأضف 100 ميكرولتر من vGLUT1 أو محلول تلطيخ التحكم في النمط المتساوي. دوامة لمدة ~ 5 ثوان واحتضان العينات عند 4 درجات مئوية لمدة 50 دقيقة.
- أضف 2 مل من 1x PERM Buffer وأجهزة الطرد المركزي 300 × جم لمدة 5 دقائق. تخلص من المادة الطافية وأضف 2 مل من المخزن المؤقت FACS إلى العينات.
- أجهزة الطرد المركزي في 300 × غرام لمدة 5 دقائق والتخلص من المادة الطافية. أعد تعليق الخلايا في 250 ميكرولتر من المخزن المؤقت FACS وقم بتمرير العينات من خلال مرشح مصفاة 40 ميكرومتر.
- تحليل شدة مضان vGLUT1 من الخلايا الدبقية الصغيرة المفردة / القابلة للحياة / CD11b + + / CD45 + باستخدام قياس التدفق الخلوي. استخدم بلاعم الطحال كعنصر تحكم سلبي لكل تجربة.
- عزل الخلايا الطحالية عن طريق ضغط أنسجة الطحال المفروم برفق من خلال مرشح مصفاة 70 ميكرومتر مرتين. شطف المرشحات مع 40 مل من DPBS وجمع التعليق في أنبوب مخروطي 50 مل.
- جهاز طرد مركزي 350 × جم لمدة 10 دقائق وأعد تعليق الحبيبات الناتجة في محلول 1 مل من محلول تحلل خلايا الدم الحمراء. احتضان لمدة 10 دقائق على الجليد.
- أضف 10 مل من DPBS إلى العينة بعد الحضانة وأجهزة الطرد المركزي عند 350 × جم لمدة 10 دقائق.
- تابع خطوات التلوين الموضحة بين الخطوتين 1.11 و 1.17.
ملاحظة: يتم توفير استراتيجية البوابات في الشكل التكميلي S2 لتعريف بلاعم الطحال على أنها CD11b ++ / CD45 ++ / عدد الخلايا القابلة للحياة. - استراتيجية البوابات (الشكل 1)
- البوابة الأساسية: اضبط منطقة التشتت الأمامية (FSC-A) [المحور x] ومنطقة التشتت الجانبية (SSC-A) [المحور y] لتشمل مجموعة الخلايا الدبقية الصغيرة في المنطقة المسورة واستبعاد الحطام الخلوي.
- اضبط منطقة التشتت الأمامية (FSC-A) [المحور x] وارتفاع التشتت الأمامي (FSC-H) [المحور y] لاستبعاد الثنائيات. تظهر المفردات كقطري على مخطط النقاط هذا.
- اضبط CD11b-PECy7 [المحور الصادي] و CD45-APC [المحور السيني] وقم ببوابة السكان بمستوى سطح مرتفع من CD11b ومستوى متوسط من CD45 كخلايا دبقية صغيرة.
- استبعاد الخلايا الميتة في البوابة السالبة FITC [المحور ص]. اختياري: استبعد أيضا الخلايا الموجبة ل Ly6C- و Ly6G-FITC في البوابة السالبة FITC لاستبعاد البلاعم المرتبطة بالجهاز العصبي المركزي من التحليل.
ملاحظة: على عكس الخلايا الحية ، تسمح الخلايا الميتة ذات الأغشية المعرضة للخطر لصبغة الصلاحية القابلة للتثبيت بدخول السيتوبلازم ، مما يزيد من كمية وسم البروتين18. وبالتالي ، ستكون الخلايا الميتة أكثر إشراقا من الخلايا الحية ، والتي يتم تضمينها في البوابة المحددة. - ضبط CD45-APC [المحور السيني] و vGLUT1-PE [المحور الصادي] ؛ يعتبر السكان الذين هم فوق بوابة العتبة ، حيث لا توجد أحداث إيجابية تم اكتشافها في عينة الطحال (التحكم السلبي البيولوجي الداخلي ، الشكل 1E) على أنه الجزء الإيجابي vGLUT1 في العينة.
2. الكشف عن ابتلاع المشابك العصبية الخام في المختبر بواسطة الخلايا الدبقية الصغيرة
- تحضير المشبك العصبي الخام ووضع العلامات الحمراء على درجة الحموضة
ملاحظة: يجب أن تتم جميع الخطوات التالية على الجليد.- اتبع الخطوات من 1.1 إلى 1.2.
- نقل الدماغ إلى طبق بتري مليئة 1 مل من وسط الخلايا العصبية الجليد الباردة وتشريح الحصين بعناية. احتفظ دائما بطبق بتري على الجليد. استخدم الحصين لعزل الخلايا الدبقية الصغيرة في الخطوة التالية.
- نقل بقية الدماغ (باستثناء المخيخ والبصلة الشمية) إلى الخالط Dounce مليئة 1 مل من كاشف استخراج البروتين متشابك وفصل الأنسجة بلطف باستخدام مدقة فضفاضة مع ما يقرب من ~ 30 ضربة. تكملة قرص واحد مثبط الأنزيم البروتيني لكل 10 مل من كاشف الاستخراج وعزل المشابك العصبية وفقا لتعليمات الشركة المصنعة.
ملاحظة: تستخدم كواشف استخراج البروتين المشبكي ، مثل SynPER19 ، لتحضير المشابك العصبية التي تحتوي على بروتينات نشطة بيولوجيا قبل وبعد المشبكي. - قم بإذابة حبيبات المشبك الخام في 500 ميكرولتر من محلول 0.1 M Na2CO3 . تلطيخ عينة المشبك ب 10 ميكرولتر من 0.2 mM pHrodo Red. احتضان عينات المشبك الخام في درجة حرارة الغرفة (24-25 درجة مئوية) لمدة 1.5 ساعة مع التقليب اللطيف.
- أضف 1 مل من DPBS البارد إلى العينة ، وأجهزة الطرد المركزي لمدة دقيقة واحدة بأقصى سرعة (20,815 × جم) ، ونضح المادة الطافية.
- كرر الخطوة 2.1.5 لإجمالي 7x لإزالة pHrodo Red الزائد غير المنضم من العينات.
- بعد آخر جهاز طرد مركزي ، قم بإجراء اختبار BCA قياسي لتحديد تركيزات البروتين في العينة.
- اختياري: تجميد عينات متشابكة في DPBS مع 5٪ DMSO باستخدام النيتروجين السائل والحفاظ عليها لمدة 3 أسابيع عند -80 درجة مئوية. قم بتغطية الأنابيب بورق الألمنيوم للحفاظ على الحد الأدنى من التعرض للضوء.
- In vitro مقايسة ابتلاع المشبك الخام باستخدام الخلايا الدبقية الصغيرة البالغة المعزولة حديثا
- تحضير aCSF وموازنته مع 95٪ O2: 5٪ CO2 لمدة 30 دقيقة.
ملاحظة: بالنسبة للخطوات 2.2.2-2.2.4 ، اتبع تعليمات الشركة المصنعة لإعداد محلول الهضم القائم على غراء. - أضف 4 مل من السائل الدماغي الشوكي إلى القارورة 2 في مجموعة غراء. ضع القارورة في حمام مائي 37 درجة مئوية لمدة ~ 10 دقائق حتى يبدو محلول غراء واضحا.
- أضف 400 ميكرولتر من السائل الدماغي الشوكي إلى القارورة 3 في مجموعة غراء. تخلط بلطف لمدة ~ 10 مرات عن طريق سحب بطيء.
- أضف 200 ميكرولتر من القارورة 3 إلى القارورة 2 (أعيد بناؤها في الخطوة 2.2.3). احفظ بقية القارورة 3.
- خذ الحصين الذي تم تشريحه في الخطوة 2.1.2 وفرم الحصين المشريح باستخدام مشرط.
- انقل الحصين المفروم إلى أنبوب مفكك الأنسجة مملوء ب 2 مل من محلول الإنزيم المحضر في الخطوة 2.2.5. ضع الأنبوب في مفكك الأنسجة وقم بتشغيل البرنامج: 37C_ABDK_01 (يستغرق ~ 30 دقيقة).
- ضع العينات في حمام مائي على حرارة 37 درجة مئوية لمدة ~ 20 دقيقة وسحن الخليط كل 5 دقائق باستخدام ماصة 1 مل دون عمل أي فقاعات.
ملاحظة: يجب أن تستمر هذه العملية حتى يتم فصل الأنسجة تماما وتبدو متجانسة تماما لضمان تفكك فعال. يتم تنفيذ جميع خطوات الطرد المركزي التالية عند 4 درجةمئوية إذا لم يتم تحديد خلاف ذلك. - قم بإزالة تعليق الخلية الغائمة بعناية إلى أنبوب جديد سعة 15 مل وأجهزة طرد مركزي عند 300 × جم لمدة 5 دقائق.
- خلال فترة 5 دقائق هذه ، قم بإعداد مزيج الغسيل التالي (5 مل) لكل عينة ؛ أضف 500 ميكرولتر من محلول مثبطات الألبومين والبيضاوي المعاد تكوينه والمقدم في مجموعة غراء إلى 4.5 مل من السائل الدماغي الشوكي. أضف المحلول المتبقي في القارورة 3 من الخطوة 2.2.5 إلى مزيج الغسيل.
- تخلص من المادة الطافية من الخطوة 2.2.8 وأعد تعليق حبيبات الخلية على الفور في محلول مزيج الغسيل.
- مرر العينة من خلال مرشح 70 ميكرومتر إلى أنبوب طرد مركزي جديد سعة 5 مل. أجهزة الطرد المركزي العينات في 300 × غرام لمدة 5 دقائق.
- تابع خطوة الطرد المركزي المتدرج Percoll الموضحة سابقا في الخطوات 1.7-1.9.
- أعد تعليق الخلايا بعناية في المخزن المؤقت لتلطيخ MACS عن طريق السحب ببطء لأعلى ولأسفل. احتضان العينات لمدة 15 دقيقة عند 4 درجات مئوية.
- أضف 1 مل من المخزن المؤقت MACS إلى كل عينة وأجهزة طرد مركزي عند 300 × جم لمدة 8 دقائق.
- أعد تعليق الخلايا في 500 ميكرولتر من المخزن المؤقت MACS.
- ضع أعمدة التحديد الموجبة في الفاصل المغناطيسي. قم بموازنة الأعمدة عن طريق شطفها ب 3 مل من MACS Buffer.
- امزج بلطف وضع 500 ميكرولتر من تعليق الخلية على العمود. اغسل الأعمدة 3x باستخدام 3 مل من MACS Buffer.
- قم بإزالة الأعمدة من الفاصل المغناطيسي وضعها على أنابيب مخروطية سعة 15 مل. أضف 5 مل من المخزن المؤقت MACS على العمود وامسح الخلايا على الفور باستخدام ممتلئ. أجهزة الطرد المركزي العينات في 300 × غرام لمدة 10 دقائق.
- خلال هذه الفترة ، قم بإعداد 20 مل من 40٪ FBS في DPBS. قم بتسخين 1 مل من DMEM لكل عينة حتى 37 درجة مئوية في حمام مائي.
- قم بإذابة حبيبات الخلية النهائية في 1 مل من DMEM المسخن مسبقا. قم بزرع حوالي ~ 150,000-200,000 خلية في 500 ميكرولتر من DMEM المسخن مسبقا لكل بئر في لوحة 24 بئرا. كعنصر تحكم ، قم بزرع عدد مماثل من الخلايا في 1-2 آبار إضافية. تحقق من التقاء الخلايا في جميع الآبار باستخدام المجهر الضوئي.
ملاحظة: إذا كانت منطقة الدماغ المستهدفة هي الحصين أو مناطق الدماغ الصغيرة نسبيا ، فيمكن تجميع 5 فئران لكل عينة (n) لعزل ~ 150000 microglia. بالنسبة للدماغ بأكمله ، يكفي 1 ماوس لكل n للحصول على أعداد مماثلة من الخلايا باستخدام كلا بروتوكولي العزل. بدلا من ذلك ، يمكن طلاء ~ 40000 خلية في 96 لوحة بئر في الحجم النهائي 100 ميكرولتر لبدء فحص الابتلاع. هذا يقلل من عدد الخلايا التي تم تحليلها ولكنه يقلل أيضا من عدد الفئران المستخدمة لكل n. سيؤدي الحرمان من البروتين بسبب نقص FCS في DMEM إلى حدوث البلعمة. - احتضان اللوحة لمدة 1-2 ساعة في الحاضنة (37 درجة مئوية و 5٪ CO2).
ملاحظة: تهدف هذه الخطوة إلى تعافي الخلايا من التأثيرات المعرضة للإجهاد لإجراء العزل قبل بدء فحص الابتلاع الوظيفي. - خذ 250 ميكرولتر من الوسط من كل بئر ببطء شديد ، وأضف 250 ميكرولتر من DMEM الطازج المسخن مسبقا إلى كل بئر ، وأضف 3 ميكروغرام من المشابك العصبية ذات العلامات الحمراء pHRodo في الأعلى. تحقق من التقاء الخلايا في جميع الآبار باستخدام مجهر ضوئي.
- بالنسبة لآبار التحكم السلبية ، أضف نفس الكمية من المشابك العصبية غير المسماة إلى البئر الإضافية المزروعة بالخلايا.
- بالنسبة لآبار الاختبار ، تأكد من أن البئر 1 يحتوي على خلايا فقط ؛ حسنا 2 يحتوي على خلايا + مشابك عصبية غير مسماة ؛ يحتوي البئر 3 على خلايا + 3 ميكروغرام من pHrodo Red ؛ يحتوي البئر 4 على DMEM + 3 ميكروغرام من pHrodo Red.
- احتضان الخلايا مع المشابك لمدة 2 ساعة في الحاضنة (37 درجة مئوية و 5 ٪ CO2).
- أخرج الوسط واغسل الآبار باستخدام DPBS البارد. أضف 200 ميكرولتر من محلول التربسين / EDTA لكل بئر لفصل الخلايا لمدة 35 ثانية.
- أضف 1 مل من 40٪ FBS في DPBS لكل بئر وانقل الخلايا إلى أنبوب بولي بروبيلين سعة 5 مل من خلال المصفاة. احتفظ بكل من اللوحة والأنبوب على الجليد أثناء هذه العملية لتسهيل انفصال الخلايا.
- اغسل كل بئر 2x باستخدام 500 ميكرولتر من DPBS المثلج. أجهزة الطرد المركزي العينات التي تم جمعها في 500 × غرام لمدة 5 دقائق.
- أعد تعليق الخلايا في محلول التلوين الذي يحتوي على 1/200 CD16 / CD32 في 100 ميكرولتر من المخزن المؤقت FACS واحتضانها لمدة 10 دقائق على الجليد.
- بعد الحضانة ، أضف CD11b و CD45 إلى محلول التلوين بتركيز نهائي قدره 1/100 من كل منهما. احتضان العينات لمدة 20 دقيقة عند 4 درجات مئوية في الظلام.
- اغسل العينات ب 1 مل من المخزن المؤقت FACS وطردها مركزيا على حرارة 300 × جم لمدة 10 دقائق.
- أعد تعليق الحبيبات في 250 ميكرولتر من المخزن المؤقت FACS وسجل ما لا يقل عن 100000 حدث إجمالي باستخدام قياس التدفق الخلوي. تحليل شدة مضان الحموضة الحمراء من الخلايا الدبقية الصغيرة CD11b ++ / CD45 + .
- استراتيجية البوابات (الشكل 2 ج)
- اضبط البوابة الأساسية: منطقة التشتت الأمامية (FSC-A) [المحور x] ومنطقة التشتت الجانبي (SSC-A) [المحور x] لتضمين مجموعة الخلايا الدبقية الصغيرة في المنطقة المسورة واستبعاد الحطام الخلوي.
- اضبط منطقة التشتت الأمامية (FSC-A) [المحور x] وارتفاع التشتت الأمامي (FSC-H) [المحور y] لاستبعاد الثنائيات. تظهر المفردات كقطري على مخطط النقاط هذا.
- اضبط CD11b-PECy7 [المحور الصادي] و CD45-APC [المحور السيني] وقم ببوابة السكان بمستوى سطح مرتفع CD11b ومستوى متوسط من CD45 كخلايا دبقية صغيرة.
- احسب متوسط شدة مضان pHrodo-PE من هذه المجموعة. استخدم نفس الخلايا المحتضنة بمشابك عصبية غير مسماة مثل عنصر التحكم السلبي.
- تحضير aCSF وموازنته مع 95٪ O2: 5٪ CO2 لمدة 30 دقيقة.
النتائج
في هذا المشروع ، قمنا بتحسين وتقديم بروتوكولين لقياس في الجسم الحي * وفي المختبر ابتلاع نقاط الاشتباك العصبي بواسطة الخلايا الدبقية الصغيرة. في البروتوكول الأول ، ركزنا على ابتلاع نقاط الاشتباك العصبي الإيجابية vGLUT1 في الجسم الحي. كنقطة انطلاق ، استخدمنا البروتوكول14 المنشور مسبقا. ومع ذلك ، تم إيقاف الأجسام المضادة FACS المستخدمة في هذا البروتوكول وأضفنا العديد من خطوات التحسين بالإضافة إلى طريقة جديدة لعزل الخلايا الدبقية الصغيرة16. هذا هو السبب في أن البروتوكول المقدم هنا يستحق المشاركة مع المجتمع العلمي كتحديث شامل للبروتوكولات التي تم نشرها بالفعل.
لتحديد ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية ، استخدمنا الفئران الذكور C57BL / 6N الذين تتراوح أعمارهم بين 11-14 أسبوعا. تم اختيار الحصين كمنطقة الاهتمام الرئيسية بسبب درجة عالية من إعادة تشكيل متشابك واللدونة12. قمنا بتحليل الخلايا الدبقية الصغيرة الإيجابية vGLUT1٪ وكذلك شدة مضان vGLUT1-PE الخاصة بالخلايا الدبقية الصغيرة (MFI) في الحصين للفئران C57BL / 6N. تم استخدام بلاعم الطحال المشتقة من نفس كعنصر تحكم سلبي بيولوجي لكل تجربة. اختبرنا الجسم المضاد vGLUT1 من خلال إظهار إشارة مضان vGLUT1-PE أعلى من الخلايا الدبقية الصغيرة الحصين مقارنة بالتحكم في النمط المتماثل والبلاعم الطحال (الشكل 1B-E)
علاوة على ذلك ، قارنا الابتلاع الدبقي الصغير للمشابك العصبية في المخيخ وكذلك في البصلة الشمية (كمرجع آخر للدونة المشبكية العالية)20. وجدنا إشارة مضان vGLUT1 أعلى في الخلايا الدبقية الصغيرة من البصلة الشمية وإشارة أقل في المخيخ مقارنة بالحصين (الشكل 1F). تم الكشف عن أدنى شدة إشارة في الضامة الطحالية ، بمثابة التحكم السلبي الداخلي (الشكل 1E). بالإضافة إلى ذلك ، استخدمنا الفئران Vglut-IRES-Cre / ChR2-YFP لاختبار النشاط المناعي للجسم المضاد vGLUT1. يتم التعبير عن YFP بواسطة الخلايا العصبية glutamatergic لهذه الفئران ، مما يشير إلى أن السكان الإيجابيين ل YFP يجب أن يشملوا أيضا جزءا إيجابيا من vGLUT1. باستخدام بروتوكول التلوين هذا ، اكتشفنا 98.7٪ من السكان الإيجابيين ل YFP على أنهم إيجابيون ل vGLUT1 ، مما يؤكد كفاءة الجسم المضاد لدينا (الشكل التكميلي S3).
بشكل عام ، تتحقق هذه النتائج من كفاءة الجسم المضاد vGLUT1 وبروتوكول التلوين المقدم. لقد أثبتنا أنه يمكن استخدام هذا البروتوكول والجسم المضاد بثقة لتحديد ابتلاع نقاط الاشتباك العصبي في الجسم الحي بطريقة عالية الإنتاجية وسريعة مقارنة بالأساليب التجريبية الأخرى.
بالانتقال إلى الطريقة في المختبر ، قمنا بعزل الخلايا الدبقية الصغيرة البالغة وحضنتها بمشابك عصبية معزولة حديثا من نفس لتحديد ابتلاعها في المختبر (الشكل 2 أ). قمنا بتسمية المشابك العصبية ب pHrodo Red ، مما يزيد بشكل طبيعي من إشارة التألق في الأس الهيدروجيني المحيط الحمضي21. قمنا بعزل المشابك العصبية حديثا وعرضناها لقيم أس هيدروجيني مختلفة (الرقم الهيدروجيني = 4 والرقم الهيدروجيني = 11). بعد التأكد من الزيادة في إشارة التألق في انخفاض درجة الحموضة كتجربة إثبات المبدأ (الشكل 2B) ، قمنا بحضن هذه المشابك العصبية مع الخلايا الدبقية الصغيرة المعزولة حديثا لمدة 1.5-2 ساعة. كعنصر تحكم ، قمنا باحتضان الخلايا الدبقية الصغيرة مع المشابك غير المصنفة. بعد ذلك ، قمنا بتحليل إشارة مضان pHrodo Red-PE من الخلايا الدبقية الصغيرة CD11b ++ / CD45 + ولاحظنا مضان PE إيجابي ، والذي كان مشابها لتلك التي تم الحصول عليها من المشابك العصبية عند الرقم الهيدروجيني = 4 (الشكل 2C). وبالتالي ، توفر هذه الطريقة تحليلا سريعا وعالي الإنتاجية لابتلاع المشابك العصبية في المختبر ويمكن تمديدها إلى لويحات الأميلويد أو ابتلاع الأهداف المحتملة الأخرى باتباع خطوات التحسين اللازمة. في الواقع ، قام Rangaraju et al. بقياس ابتلاع بيتا أميلويد بواسطة الخلايا الدبقية الصغيرة باستخدام نهج مماثل قائم على قياس التدفقالخلوي 22. في الختام ، توفر هاتان الطريقتان تقديرا كميا قويا وفعالا وعالي الإنتاجية للابتلاع الدبقي الصغير للمشابك العصبية في كل من الجسم الحي * وفي المختبر.
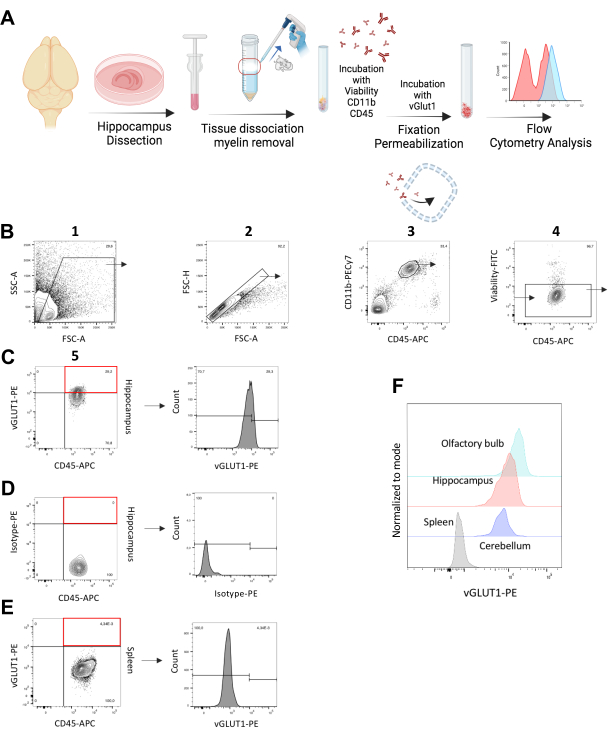
الشكل 1: تحليل ابتلاع الخلايا الدبقية الصغيرة لنقاط الاشتباك العصبي vGLUT1+ في الجسم الحي *. (أ) رسم توضيحي لسير العمل التجريبي يصور خطوات تلطيخ vGLUT1 داخل الخلايا. (ب) استراتيجية البوابات لتحديد مجموعة الخلايا المفردة / CD11b ++ / CD45 + / القابلة للحياة من الحصين. تم استخدام هذه المجموعة لتحليل vGLUT1-MFI وكذلك لتحديد النسبة المئوية للخلايا الدبقية الصغيرة vGLUT1 + في الحصين. تشير البوابة الموضحة بالمستطيل الأحمر إلى كسر خلية vGLUT1+ في العينة الإجمالية. (ج) يشير الرسم البياني إلى شدة مضان vGLUT1-PE. (د) تشير البوابة الموضحة بالمستطيل الأحمر إلى عدم وجود جزء خلوي موجب يوضح النشاط المناعي للنمط المتماثل-PE. يشير الرسم البياني إلى شدة مضان Isotype-PE. (ه) تشير البوابة الموضحة بالمستطيل الأحمر إلى عدم وجود جزء خلوي موجب يظهر النشاط المناعي vGLUT1-PE في بلاعم الطحال. يشير الرسم البياني إلى شدة مضان vGLUT1-PE. تبدأ البوابة المشار إليها في الرسم البياني من المستوى ، حيث ينتهي vGLUT1-MFI من الطحال (~ 104) ويستخدم لتحليل الكسر الإيجابي vGLUT1 في عينات الدماغ. (F) يوضح الرسم البياني المتراكب مقارنة شدة مضان PE لبلاعم الطحال (الرمادية) والخلايا الدبقية الصغيرة من الحصين (الأحمر) والمخيخ (الأرجواني) والبصلة الشمية (الأزرق الفاتح). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
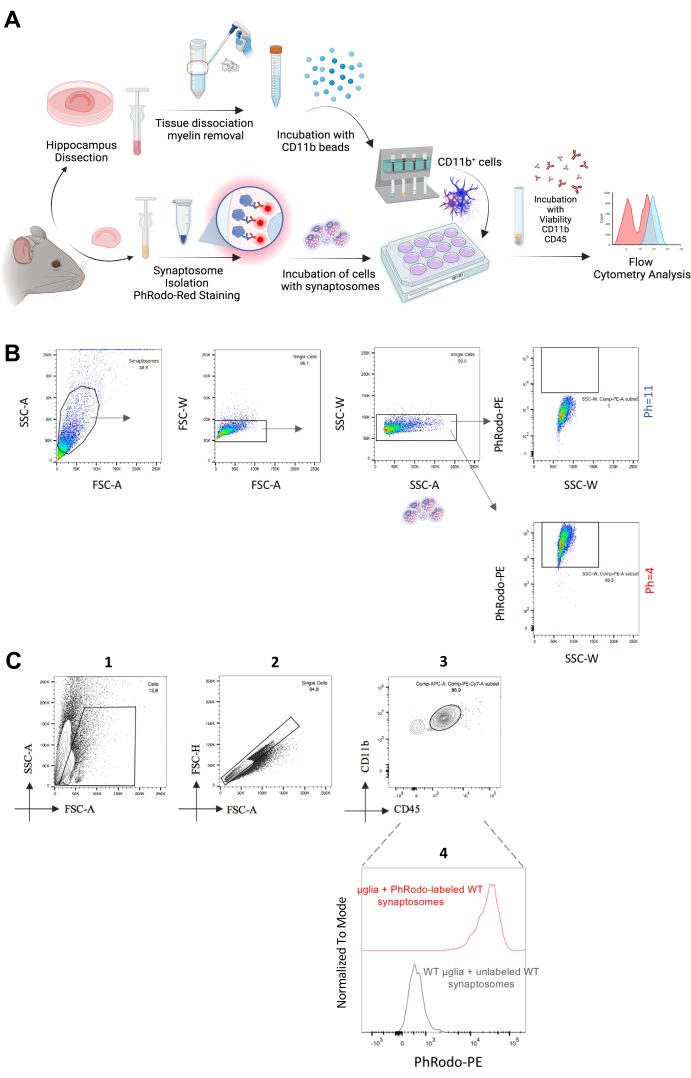
الشكل 2: تحليل ابتلاع الخلايا الدبقية الصغيرة لمشابك المشابك العصبية في المختبر. (أ) رسم بياني لسير العمل التجريبي يصور خطوات مقايسة ابتلاع المشبك العصبي في المختبر. (ب) تظهر الجسيمات المتشابكة المحتضنة عند قيمتين مختلفتين من الأس الهيدروجيني إشارة مضان منخفضة من pHrodo Red-PE عند الرقم الهيدروجيني = 11 ومضان pHrodoRed-PE مرتفع عند الرقم الهيدروجيني = 4. (ج) تم استخدام مجموعة خلايا مفردة / CD11b ++ / CD45 + لتحليل شدة مضان pHrodo Red-PE. تم استخدام الخلايا الدبقية الصغيرة المحتضنة بالمشابك غير الملوثة كعنصر تحكم سلبي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: قائمة المخازن المؤقتة والكواشف المستخدمة في هذا البروتوكول. الرجاء الضغط هنا لتنزيل هذا الجدول.
الشكل التكميلي S1: صورة تمثيلية للخلايا الدبقية الصغيرة البالغة المعزولة حديثا. تم الحصول على الصورة باستخدام مجهر ضوئي بهدف 20x بعد بروتوكول تفكك الأنسجة القائم على غراء والعزل القائم على MACS للخلايا الدبقية الصغيرة CD11b +. شريط المقياس = 50 ميكرومتر. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S2: مخططات FACS التمثيلية التي توضح استراتيجية البوابات لتحديد بلاعم الطحال. تم استخدام الطحال كعنصر تحكم سلبي في التجارب لكل تشغيل تجريبي أثناء اختبار ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية في الحصين. تعرف مخططات FACS المذكورة أعلاه بلاعم الطحال على أنها CD11b ++ / CD45 ++ / مجموعة قابلة للحياة. تم استخدام هذه المجموعة السكانية لتحديد عتبة لتحديد الخلايا الدبقية الصغيرة vGLUT1 + في عينات الدماغ الموجودة فوق بوابة العتبة هذه. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي S3: مخططات FACS التمثيلية التي توضح استراتيجية البوابة لاختبار كفاءة الجسم المضاد vGLUT1. (أ) رسم بياني لسير العمل التجريبي يصور خطوات تلطيخ vGLUT1. تم استخدام الخلايا العصبية YFP + glutamatergic لاختبار النشاط المناعي للجسم المضاد vGLUT1. (ب) استراتيجية البوابات لتحديد مجموعة YFP + من الحصين لفئران Vglut-IRES-Cre / / ChR2-YFP التي تم استخدامها كعنصر تحكم إيجابي لاختبار كفاءة الجسم المضاد vGLUT1 FACS. تم إغلاق جزء YFP + لتحديد نقاط الاشتباك العصبي glutamatergic. في هذه الفئة من السكان ، تم تحليل النشاط المناعي للجسم المضاد vGLUT1 لاختبار النشاط المناعي للجسم المضاد. مقارنة بعنصر التحكم في النمط المتماثل (C) ؛ تم الكشف عن 97.9٪ من جزء الخلية الإيجابية YFP على أنه (D) vGLUT1 إيجابي. (ه) يشير الرسم البياني المتراكب إلى مقارنة مضان PE بين النمط المتماثل والجسم المضاد vGLUT1. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يعد التحسين المتشابك من خلال تفاعل الخلايا الدبقية الصغيرة والمشبك العصبي مجالا مثيرا للاهتمام للدراسة في مجال علم المناعة العصبية ، حيث يقدم رؤى واعدة حول دور الخلايا الدبقية الصغيرة في الاضطرابات التنكسية العصبية والنمو العصبي. في عام 2011 ؛ قدم باوليسيلي وآخرون دليلا على وجود مادة متشابكة داخل الخلايا الدبقية الصغيرة ، ملقين الضوء على مشاركتهم في عملية الابتلاع المشبكي4. استخدمت دراسة أخرى مثيرة للاهتمام التصوير بفاصل زمني ونموذج ثقافة شريحة الدماغ ذات النمط العضوي خارج الجسم الحي وذكرت أن الخلايا الدبقية الصغيرة تنخرط في عملية البلعمة المعروفة باسم كثرة الخلايا ، حيث تبتلع الهياكل قبل المشبكية بدلا من البنية المشبكية بأكملها23. أظهر منشور حديث جدا باستخدام نموذج فأر معدل وراثيا جديد يتيح قياس البلعمة في الأنسجة السليمة تقليما بواسطة Bergmann-glia في الجسم الحي عند التعلم الحركي24. وبالتالي ، هناك أدلة كافية تشير إلى تورط الخلايا الدبقية في الابتلاع المشبكي ، بما في ذلك الخلايا الدبقية الصغيرة. ومع ذلك ، فإن مدى تأثير هذه الوظيفة الدبقية الصغيرة على العملية الديناميكية والانتقائية للتقليم المشبكي يتطلب مزيدا من الأدلة.
ومع ذلك ، فإن القياس الكمي لابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية بمثابة مؤشر قيم ويوفر نظرة جزئية على الديناميات المعقدة لتفاعلات الخلايا الدبقية الصغيرة والمشابك العصبية ، وخاصة الصقل المشبكي. لخصت مراجعة شاملة البروتوكولات الحالية المستخدمة للتحقيق في ابتلاع الخلايا الدبقية الصغيرة للمشابكالعصبية 25. نود التأكيد على أن بروتوكولاتنا محسنة بناء على البروتوكولات الحالية المستخدمة بالفعل. توفر الطرق المقدمة في هذه الدراسة ابتلاعا سريعا وعالي الإنتاجية للخلايا الدبقية الصغيرة للمشابك العصبية في مناطق الدماغ المختلفة التي تم تشريحها. اعتمادا على منطقة الدماغ ، يمكن تحليل ما لا يقل عن 10000 خلية دبقية صغيرة في يومين كحد أقصى لكلتا المنهجيتين ، مما يجعلها ذات قيمة لاختبار نماذج الفئران المتعددة بالتوازي.
نحن نقر بأن القياس الكمي للخلايا الدبقية الصغيرة vGLUT1 + يشمل كلا من الابتلاع خارج الجسم الحي وقصير الأجل خارج الجسم الحي حتى خطوة التثبيت. لذلك ، نقترح أن مقايستنا تقدم طريقة سريعة وموثوقة لتحديد كمية المواد المشبكية داخل الخلايا الدبقية الصغيرة كخطوة أولية قبل التحقق من الصحة في الجسم الحي باستخدام مناهج مثل IHC.
عيب آخر لتحليل قياس التدفق الخلوي هو التوافر المحدود للأجسام المضادة للعلامات المشبكية ، خاصة بالنسبة للمشابك المثبطة. من الصعب العثور على أجسام مضادة مترافقة مباشرة متاحة تجاريا تظهر إشارة ساطعة لهذه العلامات. نظرا لوقت التحسين المكثف المطلوب لاختبار الأجسام المضادة المختلفة التي تستهدف العلامات المشبكية ، من المهم مشاركة الإجراءات المحسنة جيدا مع المجتمع العلمي للتلطيخ داخل الخلايا بأجسام مضادة مختلفة كما نفعل هنا مع هذه الدراسة.
فيما يتعلق بتحليل البيانات في هذه الدراسة ، استخدمنا عناصر تحكم Isotype كضوابط سلبية تقنية لحساب الروابط غير المحددة للجسم المضاد vGLUT1 ، لأنها توفر تقديرا للارتباط غير المحدد للجسم المضاد في عينة مع تحسين المقايسات القائمة على قياس التدفقالخلوي 26. ومع ذلك ، فقد تم تحسين عناصر التحكم في النمط المتماثل في الغالب للكشف عن إشارة الخلفية غير المحددة من إجراءات تلطيخ السطح وليست مثالية للتحكم في التلوين داخل الخلايا27,28. لذلك ، لا ينبغي الاعتماد عليها للتمييز بين المجموعات السلبية والإيجابية عند إجراء التلوين داخل الخلايا ، والذي يتضمن خطوات التثبيت والنفاذية التي يمكن أن تؤثر على اكتشاف المستضد ، والتألق الذاتي ، وسطوع الفلوروفور29. تتطلب إجراءات التلوين داخل الخلايا هذه استخدام الضوابط الداخلية البيولوجية المناسبة لتحديد عدد الخلايا الإيجابية الملطخة بعلامة داخل الخلايا29. وبالتالي ، بالنظر إلى أننا نستخدم بروتوكول تلطيخ داخل الخلايا ، فقد استخدمنا تحكما بيولوجيا سلبيا داخليا (بلاعم الطحال) وحددنا الحدود بين المجموعات الإيجابية والسلبية وفقا لبلاعم الطحال المعزولة من نفس الفئران. لقد ميزنا السكان الإيجابيين فوق البوابة ، حيث لا توجد أحداث إيجابية vGLUT1 من بلاعم الطحال التي تعمل كتحكم سلبي بيولوجي (الشكل 1).
توفر كلتا الطريقتين المقدمتين في هذه الدراسة إمكانات كبيرة للتحليل الأولي للابتلاع الدبقي الصغير للمشابك العصبية بطريقة سريعة وعالية الإنتاجية ، وتحليل أكثر من 10000 خلية من مناطق الدماغ الصغيرة وهذا لا يمكن تحقيقه باستخدام تقنيات الفحص المجهري القياسية. لذلك ، توفر هذه الطرق ميزة كبيرة على طرق العمل والوقت المكثف ، علاوة على ذلك ، توفر تحليلا أكثر شمولا للابتلاع المشبكي من خلال السماح بتحليل عدد أكبر من الخلايا الدبقية الصغيرة. بالإضافة إلى ذلك ، فإن الطريقة في المختبر المقدمة في هذه الدراسة مفيدة بشكل خاص لاختبار تأثير العلاجات المختلفة على ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية. إنه يتيح القياس الكمي المباشر لتأثير العلاج على الخلايا الدبقية الصغيرة دون العوامل المربكة المرتبطة بأنواع الخلايا الأخرى. بالإضافة إلى ذلك ، فهو بمثابة نهج غير مباشر لإثبات التأثير المحتمل للبيئة المكروية أو أنواع الخلايا الأخرى على عملية الابتلاع المشبكي. لذلك ، نستنتج أن هذه الطرق ، خاصة عند استخدامها بالتوازي ، تقدم بدائل بديهية ومفيدة لتحليل ابتلاع الخلايا الدبقية الصغيرة للمواد المشبكية.
ومع ذلك ، فإن تحليل الخلايا الدبقية الصغيرة المعزولة حديثا بواسطة المقايسات البلعمية القائمة على FACS خارج الجسم الحي قد يشكل بعض العيوب. أولا ، من الأهمية بمكان استخدام بروتوكولات محسنة جيدا تولد الخلايا الدبقية الصغيرة المعزولة حديثا من دماغ البالغين مع تجنب التنشيط خارج الجسم الحي والاستجابة للإجهاد للخلايا الدبقية الصغيرة. قام Dissing-Olesen et al. بدمج استخدام مثبطات النسخ والترجمة للتغلب على هذه المشكلة من خلال استخدام إجراء تفكك الأنسجة عند 37 درجةمئوية30. من ناحية أخرى ، قدم Mattei et al. بروتوكول تفكك الأنسجة الميكانيكية الباردة لتجنب تحفيز التعبير خارج الجسم الحي للجينات المرتبطة بالإجهاد16 وقمنا بتكييف هذا البروتوكول في القسم الأول لتجنب التنشيط خارج الجسم الحي لاستجابة الخلايا الدبقية الصغيرة المرتبطة بالإجهاد قبل تلطيخ vGLUT1 داخل الخلايا. استخدمنا بروتوكول تفكك الأنسجة الأنزيمية في القسم الثاني قبل مقايسة ابتلاع المشبك في المختبر مع الأخذ في الاعتبار العائد الأعلى للخلايا الدبقية الصغيرة بعد تفكك الأنسجة القائم على غراء (البيانات غير معروضة). تبقى الخلايا الدبقية الصغيرة حتما عند 37 درجةمئوية في ظل ظروف الاستزراع عند حضنها بالمشابك العصبية ، ويمكن أن تؤدي الحضانة عند 37 درجةمئوية بالفعل إلى إحداث تغييرات في الخلايا الدبقية الصغيرة كعيوب شائعة لجميع المقايسات في المختبر وإجراءات زراعة الخلايا. لذلك ، نقترح استخدام كلا البروتوكولين المقدمين بالتوازي للوصول إلى استنتاج أوسع من حيث ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية.
علاوة على ذلك ، من المهم تحديد استراتيجية البوابة بعناية لاختيار الخلايا الدبقية الصغيرة CD11b ++ / CD45 + من خلال مراعاة وجود خلايا مناعية أخرى في حمة الدماغ التي تعبر أيضا عن هذه العلامات31. والأهم من ذلك، عند اختيار الواسمات لاستهداف الخلايا الدبقية الصغيرة على وجه التحديد (على سبيل المثال، TMEM119، P2RY12)، من المهم مراعاة أنها يمكن أن تخضع لتغيرات في مستويات تعبيرها أثناء الحالات المرضيةوالالتهابية32، وينبغي النظر في هذه التغييرات قبل إنشاء لوحة FACS لتحديد كمية ابتلاع الخلايا الدبقية الصغيرة للمشابك العصبية. أخيرا ، من الضروري التأكيد على أن أيا من الطرق التي تمت مناقشتها سابقا ، بما في ذلك النهج القائمة على IHC والفحص المجهري في الجسم الحي ، يمكنها وحدها التقاط التقليم النشط والانتقائي للمشابك العصبية بواسطة الخلايا الدبقية الصغيرة. هذه الطرق غير قادرة على التمييز بين التقليم النشط بواسطة الخلايا الدبقية الصغيرة من الكسح السلبي للحطام المشبكي داخل حمة الدماغ. لذلك ، عند تقييم البيانات ومناقشتها ، من الضروري التمييز بوضوح بين هذه المفاهيم المتميزة.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
نشكر ريجينا بيسك على المساعدة الفنية في عزل الخلايا الدبقية الصغيرة والدكتور كايو أندريتا فيغيريدو على مساعدته في الحصول على صور الفحص المجهري في الشكل التكميلي S1. ونشكر مرفق مراقبة الأصول الميدانية التابع لحركة التغيير الديمقراطي على دعمه التقني. تقدم هذه المخطوطة جزئيا الأرقام التمثيلية المقدمة إلى مجلة الدماغ والسلوك والمناعة في عام 2024. تم إنشاء الشكل 1A والشكل 2A والشكل التكميلي S3A باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL Dounce Homogenizer | Active Motif | Cat# 40401 | |
| 5 mL Tubes | Eppendorf | Cat# 0030119452 | |
| Anti-CD11b | ThermoFisher Scientific | Cat# 25-0112-82 | |
| Anti-CD45 | BD | Cat# 559864 | |
| Anti-Ly6C | BD | Cat# 553104 | |
| Anti-Ly6G | BD | Cat# 551460 | |
| BCA Protein Assay Kit | Pierce | Cat# 23227 | |
| C-Tubes | Miltenyi Biotech | Cat# 130-096-334 | |
| CD11b MicroBeads | Miltenyi Biotech | Cat# 130-093-634 | |
| CD16/CD32 Antibody | Thermo Fisher Scientific | Cat#14-0161-82 | |
| Cytofix/Cytoperm Kit | BD | Cat# 554714 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | Cat# 41966029 | |
| Dulbecco´s Phosphate Buffered Saline (DPBS) | Gibco | Cat# 14190144 | |
| Falcon Round-Bottom Polystyrene Test Tubes | Thermo Fisher Scientific | Cat# 08-771-23 | |
| fixable viability dye | Thermo Fisher Scientific | Cat# L34969 | |
| Hibernate A medium | ThermoFisher | Cat# A1247501 | |
| LS-columns | Miltenyi Biotech | Cat# 130-042-401 | |
| Papain Dissociation System | Worthington | Cat# LK003150 | |
| Percoll | Th.Geyer | Cat# 17-0891-02 | |
| Petri dishes | Thermo Fisher Scientific | Cat# 11339283 | |
| pHrodoRed | Thermo Fisher Scientific | Cat# P36600 | |
| Protease inhibitor | Roche | Cat# 5892970001 | |
| Red Blood Cell Lysis Buffer | Sigma | Cat# 11814389001 | |
| Steritop E-GP Sterile Filtration System | Merck | Cat# SEGPT0038 | |
| SynPer Solution | ThermoFisher | Cat# 87793 | |
| vGLUT1 Antibody | Miltenyi Biotech | Cat# 130-120-764 |
References
- Wolf, S. A., Boddeke, H. W., Kettenmann, H. Microglia in physiology and Disease. Annu Rev Physiol. 79, 619-643 (2017).
- Hanisch, U. K., Kettenmann, H. Microglia: active sensor and versatile effector cells in the normal and pathologic brain. Nat Neurosci. 10 (11), 1387-1394 (2007).
- Tremblay, M. &. #. 2. 0. 0. ;., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. PLoS Biol. 8 (11), e1000527 (2010).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Schafer, D. P., et al. Microglia contribute to circuit defects in Mecp2 null mice independent of microglia-specific loss of Mecp2 expression. eLife. 5, e15224 (2016).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent manner. Neuron. 74 (4), 691-705 (2012).
- Filipello, F., et al. The microglial innate immune receptor TREM2 is required for synapse elimination and normal brain connectivity. Immunity. 48 (5), 979-991 (2018).
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nat Med. 23 (9), 1018-1027 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Di Liberto, G., et al. Neurons under T cell attack coordinate phagocyte-mediated synaptic stripping. Cell. 175 (2), 458-471 (2018).
- Bisht, K., et al. Dark microglia: A new phenotype predominantly associated with pathological states. Glia. 64 (5), 826-839 (2016).
- Weerasinghe-Mudiyanselage, P. D. E., et al. Structural plasticity of the hippocampus in neurodegenerative diseases. Int J Mol Sci. 23 (6), 3349 (2022).
- Aw, E., Zhang, Y., Carroll, M. Microglial responses to peripheral type 1 interferon. J Neuroinflammation. 17 (1), 340 (2020).
- Brioschi, S., et al. Detection of synaptic proteins in microglia by flow cytometry. Front Mol Neurosci. 13, 149 (2020).
- Norris, G. T., et al. Neuronal integrity and complement control synaptic material clearance by microglia after CNS injury. JEM. 215 (7), 1789-1801 (2018).
- Mattei, D., et al. Enzymatic dissociation induces transcriptional and proteotype bias in brain cell populations. Int J Mol Sci. 21 (21), 7944 (2020).
- Jaszczyk, A., Stankiewicz, A. M., Juszczak, G. R. Dissection of mouse hippocampus with its dorsal, intermediate and ventral subdivisions combined with molecular validation. Brain Sci. 12 (6), 799 (2022).
- Fixable viability dyes for flow cytometry. Thermo Fisher Scientific Available from: https://www.thermofisher.com/de/de/home/life-science/cell-analysis/flow-cytometry/flow-cytometry-assays-reagents/cell-viability-assays-flow-cytometry/fixable-viability-dyes-flow-cytometry.html (2024)
- SynPER synaptic protein extraction reagent. Thermo Fisher Scientific Available from: https://www.thermofisher.com/order/catalog/product/87793?gclid=CjwKCAiAi6uvBhADE_iwAWiyRdigrNHuDkIAVVsaW8OaC3VJNgrPEm1I64E2P (2024)
- Wu, A., Yu, B., Komiyama, T. Plasticity in olfactory bulb circuits. Curr Opin Neurol. 64, 17-23 (2020).
- pHrodo indicators for pH determination. Thermo Fisher Scientific Available from: https://www.thermofisher.com/de/de/home/brands/molecular-probes/key-molecular-probes-products/phrodo-indicators.html (2024)
- Rangaraju, S., et al. Differential phagocytic properties of CD45low microglia and CD45high brain mononuclear phagocytes-activation and age-related effects. Front Immunol. 9, 405 (2018).
- Weinhard, L., et al. Microglia remodel synapses by presynaptic trogocytosis and spine head filopodia induction. Nat Commun. 9 (1), 1228 (2018).
- Morizawa, Y. M., et al. Synaptic pruning through glial synapse engulfment upon motor learning. Nat Neurosci. 25 (11), 1458-1469 (2022).
- Morini, R., et al. Strategies and tools for studying microglial-mediated synapse elimination and refinement. Front. Immunol. 12, 640937 (2021).
- Maecker, H. T., Trotter, J. Flow cytometry controls, instrument setup, and the determination of positivity. Cytometry. Part A: J. Int Soc Anal Cytol. 69 (9), 1037-1042 (2006).
- . Strategies for intracellular flow cytometry success Available from: https://www.biocompare.com/Editorial-Articles/582159-Strategies-for-Intracellular-Flow-Cytometry-Success/ (2022)
- . Isotype control antibodies, Key points Available from: https://www.antibodies.com/primary-antibodies/isotype-control-antibodies#:~:text=Isotype%20controls%20should%20be%20used (2024)
- Flow cytometry intracellular staining controls. Bio-Rad Available from: https://www.bio-rad-antibodies.com/flow-cytometry-intracellular-controls.html (2024)
- Dissing-Olesen, L., et al. FEAST: A flow cytometry-based toolkit for interrogating microglial engulfment of synaptic and myelin proteins. Nat Commun. 14, 6015 (2023).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of general and discriminating markers of differential microglia phenotypes. Front Cell Neurosci. 14, 198 (2020).
- van Wageningen, T. A., et al. Regulation of microglial TMEM119 and P2RY12 immunoreactivity in multiple sclerosis white and grey matter lesions is dependent on their inflammatory environment. Acta Neuropathol Commun. 7 (1), 206 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved