Method Article
Количественная оценка поглощения микроглии синаптическим материалом с помощью проточной цитометрии
В этой статье
Резюме
В данной работе мы представляем два протокола для количественной оценки поглощения микроглией vGLUT1-положительных синапсов и сырых синаптосом, меченных красным цветом pHRodo, с помощью проточной цитометрии.
Аннотация
Микроглия играет ключевую роль в синаптическом уточнении в мозге. Анализ поглощения синапсов микроглией имеет важное значение для понимания этого процесса; однако доступные в настоящее время методы идентификации поглощения синапсов микроглией, такие как иммуногистохимия (ИГХ) и визуализация, являются трудоемкими и трудоемкими. Для решения этой проблемы в данной работе мы представляем анализы in vitro и in vivo*, которые позволяют быстро и с высокой пропускной способностью количественно оценить поглощение синапсов микроглией с помощью проточной цитометрии.
В рамках подхода in vivo* мы проводили внутриклеточное окрашивание vGLUT1 после выделения свежих клеток из мозга взрослых мышей для количественной оценки поглощения синапсов vGLUT1+ микроглией. В анализе поглощения синаптосом in vitro мы использовали свежевыделенные клетки мозга взрослой мыши для количественной оценки поглощения синаптосом, меченных красным цветом pHrodo, микроглией. Эти протоколы в совокупности обеспечивают эффективный по времени подход к количественной оценке поглощения синапсов микроглией и представляют собой многообещающую альтернативу трудоемким методам, основанным на анализе изображений. Оптимизируя анализ, эти анализы могут способствовать лучшему пониманию роли микроглии в уточнении синапсов в различных моделях заболеваний.
Введение
Микроглия — это резидентные иммунные клетки центральной нервной системы (ЦНС)1. Они постоянно сканируют свое микроокружение и обеспечивают наблюдение 1,2. Более того, они часто взаимодействуют с синапсами и опосредуют тонкую настройку синаптическойактивности. Таким образом, они стали ключевым игроком в процессе синаптического совершенствования.
Роль микроглии в утончении синапсов за счет поглощения синапсов была показана различными исследовательскими группами 3,4,5,6,7. Сбои в этом процессе могут способствовать патологии нейроразвития и нейродегенеративных расстройств, таких как шизофрения и болезнь Альцгеймера8. Аберрантное утончение синапсов с помощью микроглии уже было обнаружено в различных мышиных моделях неврологических расстройств 5,9,10. Таким образом, идентификация различных механизмов, лежащих в основе поглощения синапсов микроглией, имеет первостепенное значение для понимания патофизиологии расстройств нервного развития и нейродегенеративных расстройств8.
Нацеливание на микроглиальное поглощение синапсов обладает большим потенциалом как для вмешательства в прогрессирование заболевания, так и для получения информации об основных механизмах нейроразвития и нейродегенеративных расстройств. Чтобы облегчить проведение таких исследований, необходимы быстрые и высокопроизводительные подходы. Современные методологические подходы включают в себя анализы in vivo, ex vivo и in vitro, которые позволяют обнаруживать синаптический материал в микроглии. Как правило, обнаружение поглощения синапсов микроглией в значительной степени опирается на иммуногистохимию (ИГХ) и микроскопические подходы 5,6,11, которые являются трудоемкими и демонстрируют ограничения в анализе большого количества микроглии.
Учитывая эти технические ограничения, изучение альтернативных методологий является императивом. Чтобы решить эту проблему, мы оптимизировали подход, основанный на проточной цитометрии, который позволяет эффективно, непредвзято и высокопроизводительно анализировать поглощение синапсов микроглией. Мы выбрали гиппокамп в качестве основной области интереса из-за его высокой степени синаптического ремоделирования и пластичности12, но протокол может быть адаптирован к различным областям мозга. В то время как проточная цитометрия уже использовалась в предыдущих исследованиях для обнаружения поглощения микроглией синапсов 13,14,15, в настоящем документе мы предлагаем пошаговую методологию с использованием коммерчески доступного в настоящее время флуорофор-конъюгированного антитела vGLUT1. Кроме того, мы предлагаем дополнительный подход in vitro для высокопроизводительного скрининга микроглиального поглощения синаптического материала с использованием грубых синаптосом.
протокол
Общий вид экспериментальной процедуры графически проиллюстрирован на рисунке 1А. Все эксперименты по обращению с живыми животными проводились в строгом соответствии с Законом о защите животных и были одобрены Региональным управлением здравоохранения и социальных служб в Берлине (Landesamt für Gesundheit und Soziales, Берлин, Германия). Мыши были помещены в вентилируемые клетки в стандартных лабораторных условиях с циклом свет/темнота 12:12 ч в центре животных Центра молекулярной медицины Макса Дельбрюка (MDC). Еда и вода предоставлялись в неограниченном количестве. В Таблице 1 приведен состав буферов и реагентов, а в Таблице материалов приведены подробные сведения обо всех реагентах, приборах и материалах, используемых в данном протоколе. Для анализа, специфичного для vGLUT1, мы использовали термин in vivo* на протяжении всей рукописи, чтобы признать, что проточная цитометрия требует гомогенизации тканей и выделения клеток, а микроглия демонстрирует примерно 95% жизнеспособности после процедуры выделения (рисунок 1B и дополнительный рисунок S1). Таким образом, они сохраняют свою способность поглощать синаптический материал ex vivo в течение короткого периода времени, вплоть до фиксации. Таким образом, количественное определение микроглии vGLUT1+ включает как in vivo , так и кратковременное поглощение ex vivo до стадии фиксации.
1. Внутриклеточное окрашивание vGLUT1 для выявления in vivo* поглощения глутаматергических синапсов микроглией
ПРИМЕЧАНИЕ: Следующая процедура изоляции клеток адаптирована из16. Все этапы изоляции клеток должны проводиться на льду.
- Обезболивайте мышей с помощью внутрибрюшинной инъекции пентобарбитала. Перфузируйте мышей внутрисердечно 10 мл ледяного фосфатного буферного физиологического раствора Дульбекко (DPBS) в течение ~2 мин.
ПРИМЕЧАНИЕ: Для каждого образца используется одна мышь (n). - Извлеките мозг из черепа и сохраните его в 1 мл среды нервных клеток.
Примечание: Среда нервных клеток, такая как среда Hibernate-A, используется для обеспечения высокой жизнеспособности клеток после процесса диссоциации тканей. - Перенесите мозг в чашку Петри, наполненную 1 мл ледяной нервной клеточной среды, и рассеките гиппокамп, как описано ранее17.
- Перенесите гиппокамп в гомогенизатор Dounce, наполненный 1 мл среды нервных клеток, и диссоциируйте ткань с помощью рыхлого пестика примерно ~25 легкими движениями.
- Поместите ситечко 70 мкм на полипропиленовую трубку объемом 5 мл и добавьте 500 мкл среды нервных клеток. Перенесите гомогенат ткани в полипропиленовую трубку объемом 5 мл через ситечко.
- Промойте гомогенизатор Dounce 2 раза 1 мл холодной среды нервных клеток и центрифугируйте образцы при 400 × г в течение 8 минут.
- Аспирируйте надосадочную жидкость и ресуспендируйте гранулу в 500 мкл ледяного DPBS с помощью щадящего пипетирования. Обеспечьте однородную суспензию и доведите конечный объем до 1,5 мл с помощью DPBS.
- Добавьте в образец 500 μL изотонического раствора Перколла, аккуратно ресуспендируйте его и залейте еще 2 мл холодной DPBS.
- Центрифугируйте образцы при давлении 3 000 × g в течение 10 минут с полным ускорением и без торможения. Аспирируйте верхний слой, а также миелиновый диск в средней фазе.
ПРИМЕЧАНИЕ: Все последующие этапы центрифугирования выполняются при температуре 4 °C, если не указано иное. - Добавьте 4 мл холодной DPBS и центрифугируйте образцы при давлении 400 × г в течение 10 минут. Отсадите надосадочную жидкость и ресуспендируйте клетки в 100 мкл раствора для окрашивания на приемлемую жизнеспособность и инкубируйте образцы в течение 30 мин при 4 °С.
- Добавьте к образцу 1 мл холодного DPBS и центрифугируйте образцы при 300 × г в течение 5 минут. Выбросьте надосадочную жидкость и добавьте 100 мкл раствора для окрашивания CD16/CD32 (1/200 в буфере FACS). Вортекс в течение ~5 с и инкубировать в течение 10 мин при 4 °C.
Примечание: Окрашивание CD16/CD32 является предварительной обработкой для минимизации неспецифического связывания антител с FcR-содержащими клетками, такими как микроглия, перед применением, таким как проточная цитометрия. - Добавьте в образец 1 мл буфера FACS и центрифугируйте при давлении 300 × г в течение 5 минут. Аспирируйте надосадочную жидкость и добавьте 100 мкл окрашивающей мастер-смеси-I (1/100 анти-CD11b/ анти-CD45 + 1/200 анти-Ly6C/ анти-Ly6G в 1x буфере FACS). Инкубируйте образцы в течение 20 минут при температуре 4°C в темноте.
- Добавьте в образец 1 мл буфера FACS и центрифугируйте при давлении 300 × г в течение 5 минут.
- Ресуспендируйте гранулу в 250 мкл фиксирующего буфера. Выдерживать при температуре 4 °C в течение 25 минут.
- Добавьте 2 мл буфера для пермеабилизации (PERM) 1x и центрифугируйте 300 × г в течение 5 минут.
- Выбросьте надосадочную жидкость и добавьте 100 мкл vGLUT1 или раствора для контроля изотипа. Ввергните в вихрь в течение ~5 с и инкубируйте образцы при 4 °C в течение 50 минут.
- Добавьте 2 мл 1x PERM Buffer и центрифугируйте 300 × г в течение 5 минут. Выбросьте надосадочную жидкость и добавьте в образцы 2 мл буфера FACS.
- Центрифугируйте при 300 × г в течение 5 мин и выбросьте надосадочную жидкость. Повторно суспендируйте элементы в 250 мкл буфера FACS и пропустите образцы через фильтр с длиной 40 мкм.
- Анализ интенсивности флуоресценции vGLUT1 из одиночной/жизнеспособной/CD11b++/CD45+ микроглии с помощью проточной цитометрии. Используйте макрофаги селезенки в качестве отрицательного контроля для каждого эксперимента.
- Изолируйте спленоциты, дважды мягко сжимая измельченную ткань селезенки через фильтр-фильтр 70 мкм. Промойте фильтры 40 мл DPBS и соберите суспензию в коническую пробирку объемом 50 мл.
- Центрифугировать 350 × г в течение 10 мин и ресуспендировать полученную гранулу в 1 мл раствора буфера для лизиса эритроцитов. Выдерживать 10 минут на льду.
- Добавьте 10 мл DPBS в образец после инкубации и центрифугируйте при 350 × г в течение 10 минут.
- Выполните шаги по окрашиванию, описанные между шагами 1.11 и 1.17.
ПРИМЕЧАНИЕ: Стратегия гейтирования представлена на дополнительном рисунке S2 для определения макрофагов селезенки как популяции жизнеспособных клеток CD11b ++/ CD45 ++/. - Стратегия стробирования (Рисунок 1)
- Первичный вентиль: Отрегулируйте переднюю область рассеяния (FSC-A) [ось x] и боковую зону рассеяния (SSC-A) [ось y], чтобы включить популяцию микроглии в закрытой области и исключить клеточный мусор.
- Отрегулируйте область прямого рассеяния (FSC-A) [ось x] и высоту прямого рассеивания (FSC-H) [ось y], чтобы исключить дублеты. Синглеты отображаются в виде диагонали на этой точечной диаграмме.
- Отрегулируйте CD11b-PECy7 [ось y] и CD45-APC [ось x] и зарегистрируйте популяцию с высоким уровнем поверхности CD11b и средним уровнем CD45 в виде микроглии.
- Исключите мертвые клетки в отрицательном затворе FITC[ось y]. ДОПОЛНИТЕЛЬНО: Также исключите клетки, положительные на Ly6C- и Ly6G-FITC в FITC-негативном затворе, чтобы исключить из анализа макрофаги, связанные с ЦНС.
Примечание: В отличие от живых клеток, мертвые клетки с поврежденными мембранами позволяют корректируемому красителю жизнеспособности проникать в цитоплазму, что увеличивает количество мечения белка18. Таким образом, мертвые клетки будут ярче, чем живые, которые входят в определенный вентиль. - Отрегулируйте CD45-APC [ось x] и vGLUT1-PE [ось y]; популяция, находящаяся выше пороговых ворот, в которой в образце селезенки не обнаружено положительных событий (внутренний биологический отрицательный контроль, рисунок 1E), рассматривается как vGLUT1-положительная фракция в образце.
2. Обнаружение поглощения in vitro сырых синаптосом микроглией
- Препарат сырых синаптосом, маркировка pHrodo Red
ПРИМЕЧАНИЕ: Все следующие шаги должны выполняться на льду.- Выполните шаги с 1.1 по 1.2.
- Перенесите мозг в чашку Петри, наполненную 1 мл ледяной среды нервных клеток, и тщательно препарируйте гиппокамп. Всегда держите чашку Петри на льду. Используйте гиппокамп для выделения микроглии на следующем этапе.
- Перенесите остальную часть мозга (за исключением мозжечка и обонятельной луковицы) в гомогенизатор Dounce, наполненный 1 мл реагента для экстракции синаптического белка, и аккуратно диссоциируйте ткань с помощью рыхлого пестика примерно ~30 ударами. Дополните одну таблетку ингибитора протеазы на 10 мл экстракционного реагента и изолируйте синаптосомы в соответствии с инструкциями производителя.
Реагенты для экстракции синаптических белков, такие как SynPER19, используются для получения синаптосом, содержащих биологически активные пре- и постсинаптические белки. - Растворите неочищенную гранулу синаптосомы в 500 мкл 0,1 М Na2раствора CO3 . Окрасьте образец синаптосомы 10 мкл 0,2 мМ pHrodo Red. Образцы сырых синаптосом инкубировать при комнатной температуре (24-25 °C) в течение 1,5 ч с легким перемешиванием.
- Добавьте в образец 1 мл холодного DPBS, центрифугируйте в течение 1 мин на полной скорости (20,815 × г) и аспирируйте надосадочную жидкость.
- Повторите шаг 2.1.5 в общей сложности 7 раз, чтобы удалить несвязанное избыток pHrodo Red из образцов.
- После последней центрифуги проведите стандартный анализ BCA для количественного определения концентраций белка в образце.
- Опционально: замораживание образцов синаптосомы в DPBS с 5% ДМСО с использованием жидкого азота и их хранение в течение 3 недель при -80 °C. Накройте трубки алюминиевой фольгой, чтобы свести к минимуму воздействие света.
- In vitro Грубый анализ поглощения синаптосомами с использованием свежевыделенной микроглии взрослого человека
- Приготовьте аCSF и уравновесьте его с 95% O2:5% CO2 в течение 30 минут.
ПРИМЕЧАНИЕ: Для выполнения шагов 2.2.2-2.2.4 следуйте инструкциям производителя по приготовлению раствора для варки на основе папаина. - Добавьте 4 мл аКСФ во флакон 2 в папаине. Поместите флакон на водяную баню при температуре 37 °C на ~10 минут, пока раствор папаина не станет прозрачным.
- Добавьте 400 μL aCSF во флакон 3 в наборе папаина. Осторожно перемешайте ~10 раз медленным пипетированием.
- Добавьте 200 мкл из флакона 3 во флакон 2 (восстановлено на шаге 2.2.3). Сохраните оставшуюся часть флакона 3.
- Возьмите рассеченный гиппокамп на шаге 2.1.2 и измельчите рассеченный гиппокамп с помощью скальпеля.
- Переложите измельченный гиппокамп в тканевую диссоциаторную трубку, заполненную 2 мл ферментного раствора, приготовленного на шаге 2.2.5. Поместите трубку в диссоциатор тканей и запустите программу: 37C_ABDK_01 (занимает ~30 минут).
- Поместите образцы на водяную баню при температуре 37 °C на ~20 минут и растирайте смесь каждые 5 минут с помощью пипетки объемом 1 мл без образования пузырьков.
ПРИМЕЧАНИЕ: Этот процесс следует продолжать до тех пор, пока ткань полностью не диссоциирует и не станет полностью однородной, чтобы обеспечить эффективную диссоциацию. Все последующие этапы центрифугирования проводят при температуре 4 °С, если не указано иное. - Осторожно удалите помутневшую клеточную суспензию в новую пробирку объемом 15 мл и центрифугируйте при 300 × г в течение 5 мин.
- В течение этого 5-минутного периода приготовьте следующую смесь для промывки (5 мл) на образец; добавить 500 мкл восстановленного раствора альбумин-овомукоидного ингибитора, входящего в состав папаина, в 4,5 мл аКСФ. Добавьте оставшийся раствор во флаконе 3 с шага 2.2.5 в промывочную смесь.
- Выбросьте надосадочную жидкость с шага 2.2.8 и немедленно повторно суспендируйте клеточную гранулу в растворе промывочной смеси.
- Пропустите образец через фильтр 70 μм в новую микроцентрифужную пробирку объемом 5 мл. Центрифугируйте образцы при давлении 300 × г в течение 5 минут.
- Перейдите к этапу градиентного центрифугирования по методу Перколла, описанному ранее в шагах 1.7-1.9.
- Осторожно ресуспендируйте клетки в буфере для окрашивания MACS, медленно пипетируя вверх и вниз. Инкубируйте образцы в течение 15 минут при 4 °C.
- Добавьте 1 мл буфера MACS в каждый образец и центрифугируйте при давлении 300 × г в течение 8 минут.
- Ресуспендируйте элементы в 500 мкл буфера MACS.
- Поместите столбцы положительного отбора в магнитный сепаратор. Уравновесьте столбцы, промыв их 3 мл буфера MACS.
- Аккуратно перемешайте и нанесите 500 μл клеточной суспензии на колонку. Промойте колонки 3 раза 3 мл буфера MACS.
- Снимите колонки с магнитного сепаратора и поместите их на конические пробирки объемом 15 мл. Добавьте 5 мл буфера MACS в колонку и сразу же промойте ячейки с помощью пуховика. Центрифугируйте образцы при 300 × г в течение 10 минут.
- За этот период приготовьте 20 мл 40% FBS в DPBS. Разогрейте 1 мл DMEM на образец до 37 °C на водяной бане.
- Растворите конечную клеточную гранулу в 1 мл предварительно подогретого DMEM. Засейте около ~150 000-200 000 клеток в 500 мкл предварительно подогретого DMEM на лунку в 24-луночном планшете. В качестве контроля засейте аналогичное количество клеток в 1-2 дополнительные лунки. Проверьте слияние клеток во всех лунках с помощью светового микроскопа.
Примечание: Если целевой областью мозга является гиппокамп или сравнительно небольшие области мозга, можно объединить 5 мышей на образец (n), чтобы выделить ~150 000 микроглии. Для всего мозга 1 мыши на n будет достаточно, чтобы получить одинаковое количество клеток с использованием обоих протоколов выделения. В качестве альтернативы, ~40 000 ячеек могут быть помещены в 96-луночные планшеты с конечным объемом 100 мкл для начала анализа поглощения. Это уменьшает количество анализируемых клеток, но также уменьшает количество мышей, используемых на n. Белковая депривация из-за отсутствия FCS в DMEM спровоцирует фагоцитоз. - Инкубируйте планшет в течение 1-2 ч в инкубаторе (37 °C и 5%CO2).
Примечание: Этот шаг направлен на то, чтобы клетки восстановились от подверженных стрессу эффектов процедуры изоляции до начала анализа функционального поглощения. - Очень медленно выньте 250 μL среды из каждой лунки, добавьте 250 μL свежей предварительно подогретой DMEM в каждую лунку и добавьте 3 μг синаптосом, меченных красным цветом pHRodo сверху. Проверьте слитность клеток во всех лунках с помощью светового микроскопа.
- Для отрицательных контрольных лунок добавьте такое же количество немеченых синаптосом в дополнительную лунку, засеянную клетками.
- Для тестовых лунок убедитесь, что лунка 1 содержит только ячейки; well 2 содержит клетки+ немеченые синаптосомы; well-3 содержит клетки+ 3 мкг pHrodo Red; лунка 4 содержит DMEM + 3 μг pHrodo Red.
- Инкубируйте клетки с синаптосомами в течение 2 ч в инкубаторе (37 °C и 5%CO2).
- Выньте среду и промойте лунки холодной ДПБС. Добавьте 200 мкл раствора трипсина/ЭДТА в лунку, чтобы отсоединить клетки на 35 с.
- Добавьте 1 мл 40% FBS в DPBS на лунку и перенесите элементы в полипропиленовую пробирку объемом 5 мл через сетчатое фильтр. Во время этого процесса держите пластину и трубку на льду, чтобы облегчить отслоение клеток.
- Промойте каждую лунку 2 раза, используя 500 μл ледяного DPBS. Собранные образцы центрифугируют при 500 × г в течение 5 мин.
- Ресуспендировать клетки в окрашивающем растворе, содержащем 1/200 CD16/CD32 в 100 мкл буфера FACS, и инкубировать в течение 10 мин на льду.
- После инкубации добавьте в окрашивающий раствор CD11b и CD45 с конечной концентрацией 1/100 от каждого. Инкубируйте образцы в течение 20 минут при температуре 4 °C в темноте.
- Промойте образцы 1 мл буфера FACS и центрифугируйте их при 300 × г в течение 10 минут.
- Ресуспендируйте гранулу в 250 мкл буфера FACS и зарегистрируйте не менее 100 000 событий с помощью проточной цитометрии. Анализируйте интенсивность флуоресценции pHrodo Red из микроглии CD11b++/CD45+ .
- Стратегия стробирования (Рисунок 2C)
- Отрегулируйте первичный вентиль: Forward Scatter Area (FSC-A) [ось x] и Side Scatter Area (SSC-A) [ось x], чтобы включить популяцию микроглии в зону ворот и исключить клеточный мусор.
- Отрегулируйте область прямого рассеяния (FSC-A) [ось x] и высоту прямого рассеивания (FSC-H) [ось y], чтобы исключить дублеты. Синглеты отображаются в виде диагонали на этой точечной диаграмме.
- Отрегулируйте CD11b-PECy7 [ось y] и CD45-APC [ось x] и затворите популяцию с высоким поверхностным уровнем CD11b и средним уровнем CD45 в виде микроглии.
- Рассчитайте медианную интенсивность флуоресценции pHrodo-PE из этой популяции. Используйте те же клетки, инкубированные с немечеными синаптосомами, в качестве отрицательного контроля.
- Приготовьте аCSF и уравновесьте его с 95% O2:5% CO2 в течение 30 минут.
Результаты
В этом проекте мы оптимизировали и представили два протокола для измерения in vivo* и in vitro поглощения синапсов микроглией. В первом протоколе мы сосредоточились на поглощении in vivo* vGLUT1-положительных синапсов. В качестве отправной точки мы использовали ранее опубликованный протокол14. Тем не менее, использование антител FACS в этом протоколе прекращено, и мы добавили множество этапов оптимизации, а также новый метод выделения микроглии16. Именно поэтому представленный здесь протокол заслуживает того, чтобы поделиться им с научным сообществом в качестве всестороннего обновления уже опубликованных протоколов.
Для количественной оценки поглощения синапсов микроглией мы использовали самцов мышей C57BL/6N в возрасте 11-14 недель. Гиппокамп был выбран в качестве основной области интереса из-за его высокой степени синаптического ремоделирования ипластичности12. Мы проанализировали %vGLUT1-положительную микроглию, а также специфичную для микроглии интенсивность флуоресценции (MFI) vGLUT1-PE в гиппокампе мышей C57BL/6N. Макрофаги селезенки, полученные от тех же животных, использовали в качестве биологического отрицательного контроля для каждого эксперимента. Мы протестировали антитело vGLUT1, продемонстрировав более высокий флуоресцентный сигнал vGLUT1-PE от микроглии гиппокампа по сравнению с контролем изотипа и макрофагами селезенки (рис. 1B-E)
Кроме того, мы сравнили поглощение микроглией синапсов в мозжечке, а также в обонятельной луковице (что является еще одним эталоном высокой синаптической пластичности)20. Мы обнаружили более высокий флуоресцентный сигнал vGLUT1 в микроглии от обонятельной луковицы и более низкий сигнал в мозжечке по сравнению с гиппокампом (рис. 1F). Наименьшая интенсивность сигнала была обнаружена в макрофагах селезенки, выполняющих функции внутреннего негативного контроля (рис. 1Е). Кроме того, мы использовали мышей Vglut-IRES-Cre/ChR2-YFP для тестирования иммунореактивности нашего антитела vGLUT1. YFP экспрессируется глутаматергическими нейронами этих мышей, что указывает на то, что YFP-положительная популяция также должна включать vGLUT1-положительную фракцию. Используя этот протокол окрашивания, мы обнаружили 98,7% YFP-положительной популяции как vGLUT1-положительные, что подтверждает эффективность нашего антитела (дополнительный рисунок S3).
В целом, эти результаты подтверждают эффективность антитела vGLUT1 и представленный протокол окрашивания. Мы демонстрируем, что этот протокол и антитело могут быть с уверенностью использованы для количественной оценки in vivo* поглощения синапсов высокопроизводительным и быстрым способом по сравнению с другими экспериментальными подходами.
Переходя к методу in vitro , мы выделили микроглию взрослых особей и инкубировали их со свежевыделенными синаптосомами pHrodo Red-мечеными, выделенными у тех же животных, чтобы количественно оценить их поглощение in vitro (рис. 2A). Мы пометили синаптосомы с помощью pHrodo Red, который естественным образом увеличивает сигнал флуоресценции в кислотном окружении pH21. Мы только что изолировали синаптосомы и подвергли их воздействию различных значений pH (pH = 4 и pH = 11). После подтверждения увеличения флуоресцентного сигнала при низком pH в качестве эксперимента (рис. 2B) мы инкубировали эти синаптосомы со свежевыделенной микроглией в течение 1,5-2 ч. В качестве контроля мы инкубировали микроглию с немечеными синаптосомами. Затем мы проанализировали флуоресцентный сигнал pHrodo Red-PE от микроглии CD11b++/CD45+ и наблюдали положительную флуоресценцию ПЭ, которая была сопоставима с той, которая была получена из синаптосом при pH = 4 (рис. 2C). Таким образом, этот метод обеспечивает быстрый и высокопроизводительный анализ поглощения синаптосом in vitro и может быть расширен до амилоидных бляшек или поглощения других потенциальных мишеней после необходимых этапов оптимизации. Действительно, Rangaraju et al. количественно оценили поглощение бета-амилоида микроглией, используя аналогичный подход, основанный на проточной цитометрии22. В заключение можно сказать, что эти два метода обеспечивают надежную, эффективную и высокопроизводительную количественную оценку поглощения микроглией синапсов как in vivo*, так и in vitro.
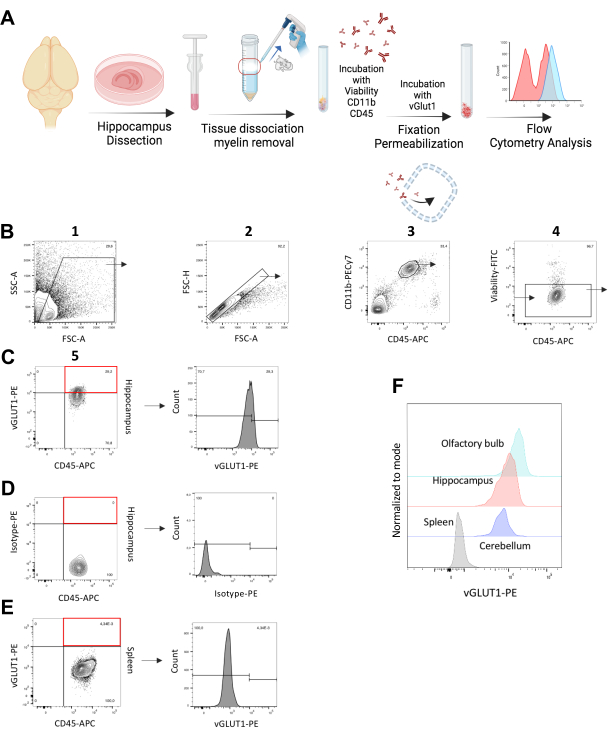
Рисунок 1: Анализ поглощения микроглией синапсов vGLUT1+ in vivo*. (A) Графическая иллюстрация экспериментального рабочего процесса, изображающая этапы внутриклеточного окрашивания vGLUT1. (B) Стратегия гейтирования для определения популяции одиночных / CD11b++/CD45+/ жизнеспособных клеток из гиппокампа. Эта популяция была использована для анализа vGLUT1-MFI, а также для количественной оценки процента микроглии vGLUT1+ в гиппокампе. Вентиль, показанный красным прямоугольником, указывает на клеточную фракцию vGLUT1+ в общем образце. (C) Гистограмма показывает интенсивность флуоресценции vGLUT1-PE. (D) Ворота, показанные красным прямоугольником, указывают на отсутствие положительной клеточной фракции, проявляющей иммунореактивность Isotype-PE. На гистограмме отображается интенсивность флуоресценции Isotype-PE. (E) Ворота, показанные красным прямоугольником, указывают на отсутствие положительной клеточной фракции, проявляющей иммунореактивность vGLUT1-PE в макрофагах селезенки. Гистограмма показывает интенсивность флуоресценции vGLUT1-PE. Ворота, указанные на гистограмме, начинаются на уровне, где заканчивается vGLUT1-MFI из селезенки (~104) и используются для анализа положительной фракции vGLUT1 в образцах мозга. (F) Наложенная гистограмма показывает сравнение интенсивности флуоресценции ПЭ макрофагов селезенки (серый) и микроглии из гиппокампа (красный), мозжечка (фиолетовый) и обонятельной луковицы (светло-голубой). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
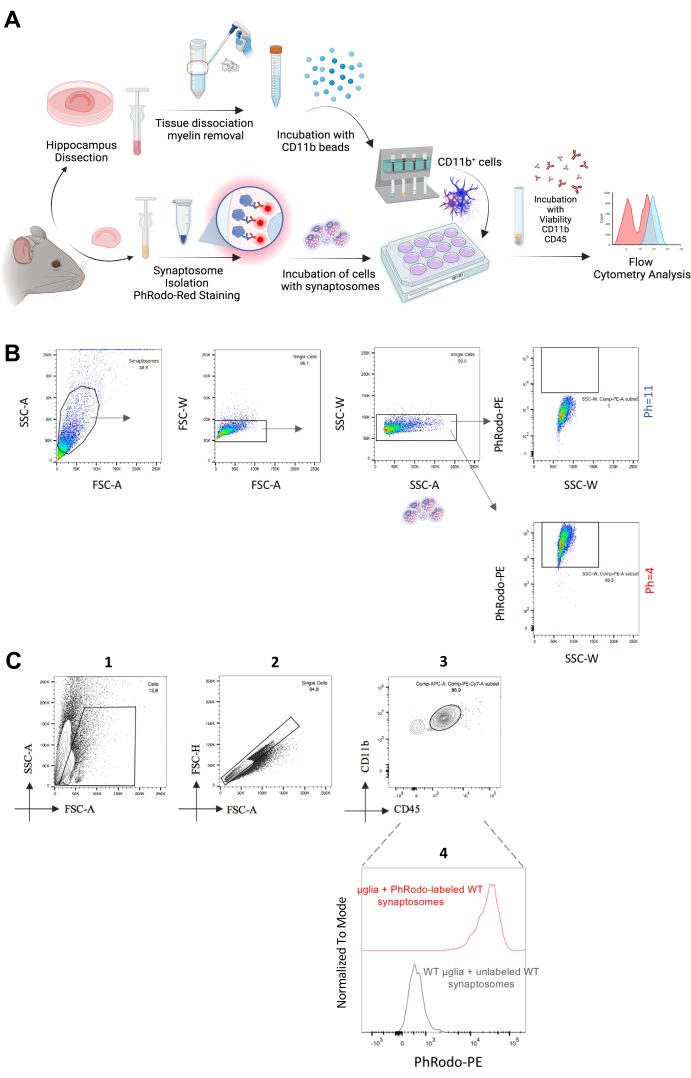
Рисунок 2: Анализ поглощения синаптосомами синаптосомами микроглией in vitro. (A) Графическая иллюстрация экспериментального рабочего процесса, показывающая этапы анализа поглощения синаптосомами in vitro. (B) Синаптосомы, инкубированные при двух различных значениях pH, демонстрируют низкий флуоресцентный сигнал pHrodo Red-PE при pH = 11 и высокий флуоресценцию pHrodo Red-PE при pH = 4. (C) Популяция одиночных клеток/CD11b++/CD45+ была использована для анализа интенсивности флуоресценции pHrodo Red-PE. Микроглию, инкубированную с неокрашенными синаптосомами, использовали в качестве отрицательного контроля. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Список буферов и реагентов, используемых в данном протоколе. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительный рисунок S1: Репрезентативное изображение недавно выделенной взрослой микроглии. Изображение получено с помощью светового микроскопа с 20-кратным объективом в соответствии с протоколом диссоциации тканей на основе папаина и выделения CD11b+ микроглии на основе MACS. Масштабная линейка = 50 μм. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный рисунок S2: Репрезентативные графики FACS, демонстрирующие стратегию стробирования для определения макрофагов селезенки. Селезенка использовалась в качестве отрицательного контроля в экспериментах на один экспериментальный прогон при тестировании поглощения микроглией синапсов в гиппокампе. Приведенные выше графики FACS определяют макрофаги селезенки как CD11b++/CD45++/жизнеспособную популяцию. Эта популяция была использована для установления порога для количественной оценки микроглии vGLUT1+ в образцах мозга, которые находятся выше этого порогового шлюза. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S3: Репрезентативные графики FACS, демонстрирующие стратегию стробирования для проверки эффективности антитела vGLUT1. (A) Графическая иллюстрация экспериментального рабочего процесса, изображающая этапы окрашивания vGLUT1. Глутаматергические нейроны YFP+ использовали для проверки иммунореактивности антитела vGLUT1. (B) Стратегия гейтирования для определения популяции YFP+ из гиппокампа мышей Vglut-IRES-Cre//ChR2-YFP, которые были использованы в качестве положительного контроля для тестирования эффективности антитела vGLUT1 FACS. Фракцию YFP+ забалтировали для уточнения глутаматергических синапсов. В этой популяции иммунореактивность антитела vGLUT1 была проанализирована для проверки иммунореактивности антитела. По сравнению с контрольным изотипом (C); 97,9% YFP-положительной клеточной фракции обнаруживается как (D)vGLUT1-положительная. (E) Наложенная гистограмма показывает сравнение флуоресценции ПЭ между изотипом и антителом vGLUT1. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Утончение синапсов посредством взаимодействия микроглии и синапсов является интригующей областью исследований в области нейроиммунологии, предлагающей многообещающее понимание роли микроглии в нейродегенеративных расстройствах и нарушениях развития нервной системы. В 2011 году; Paolicelli et al. представили доказательства присутствия синаптического материала в микроглии, пролив свет на их участие в процессе синаптического поглощения4. В другом интригующем исследовании использовалась покадровая визуализация и модель культуры органотипических срезов мозга ex vivo , и сообщалось, что микроглия участвует в фагоцитарном процессе, известном как трогоцитоз, когда они поглощают пресинаптические структуры, а не всю синаптическуюструктуру. Совсем недавняя публикация с использованием новой трансгенной мышиной модели, которая позволяет измерить фагоцитоз в интактной ткани, показала обрезку по глии Бергмана in vivo при моторном обучении24. Таким образом, имеется достаточно данных, указывающих на участие глиальных клеток в синаптическом поглощении, в том числе микроглии. Тем не менее, степень, в которой эта микроглиальная функция влияет на динамический и селективный процесс синаптического обрезания, требует дополнительных доказательств.
Тем не менее, количественная оценка поглощения синапсов микроглией служит ценным индикатором и дает частичное представление о сложной динамике взаимодействий микроглии и синапсов, особенно об утончении синапсов. В всестороннем обзоре обобщены современные протоколы, используемые для исследования поглощения микроглией синапсов25. Мы хотели бы подчеркнуть, что наши протоколы оптимизированы на основе существующих протоколов, которые уже используются. Методы, представленные в данном исследовании, обеспечивают быстрое и высокопроизводительное количественное поглощение микроглиями синапсов в различных рассеченных областях мозга. В зависимости от области мозга, для обеих методологий возможен анализ не менее 10 000 клеток микроглии максимум за два дня, что делает их ценными для параллельного тестирования нескольких мышиных моделей.
Мы признаем, что количественное определение микроглии vGLUT1+ включает как in vivo , так и кратковременное поглощение ex vivo до стадии фиксации. Поэтому мы предполагаем, что наш анализ представляет собой быстрый и надежный способ количественного определения синаптического материала внутри микроглии в качестве первого шага перед валидацией in vivo с использованием таких подходов, как ИГХ.
Еще одним недостатком анализа проточной цитометрии является ограниченная доступность антител к синаптическим маркерам, в частности к ингибиторным синапсам. Трудно найти коммерчески доступные, непосредственно конъюгированные антитела, которые демонстрируют яркий сигнал к этим маркерам. Учитывая обширное время оптимизации, необходимое для тестирования различных антител, нацеленных на синаптические маркеры, важно поделиться с научным сообществом хорошо оптимизированными процедурами внутриклеточного окрашивания различными антителами, как мы делаем в этом исследовании.
Что касается анализа данных в этом исследовании, мы использовали контроль Isotype в качестве технического отрицательного контроля для учета неспецифических связываний антитела vGLUT1, поскольку они обеспечивают оценку неспецифического связывания антитела в образце при оптимизации анализов на основе проточной цитометрии26. Тем не менее, контрольные изотипы в основном оптимизированы для обнаружения неспецифического фонового сигнала от процедур поверхностного окрашивания и не являются оптимальными для контроля внутриклеточного окрашивания27,28. Следовательно, не следует полагаться на них для проведения различия между негативными и положительными популяциями при выполнении внутриклеточного окрашивания, которое включает в себя этапы фиксации и пермеабилизации, которые могут повлиять на обнаружение антигена, аутофлуоресценцию и яркость флуорофора29. Такие процедуры внутриклеточного окрашивания требуют использования соответствующего биологического внутреннего контроля для определения положительной клеточной популяции, окрашенной по внутриклеточному маркеру29. Таким образом, учитывая, что мы используем протокол внутриклеточного окрашивания, мы применили внутренний биологический негативный контроль (макрофаги селезенки) и определили границу между положительными и негативными популяциями по макрофагам селезенки, выделенным от тех же мышей. Мы выделили положительную популяцию над воротами, в которой отсутствуют положительные события vGLUT1, от макрофагов селезенки, которые служат биологическим негативным контролем (рис. 1).
Оба метода, представленные в этом исследовании, предлагают большой потенциал для первоначального анализа поглощения синапсов микроглией быстрым и высокопроизводительным способом, анализируя более 10 000 клеток из небольших областей мозга, что не достижимо с помощью стандартных методов микроскопии. Таким образом, эти методы имеют значительное преимущество по сравнению с трудоемкими и трудоемкими методами и, кроме того, обеспечивают более полный анализ синаптического поглощения, позволяя анализировать большее количество микроглии. Кроме того, метод in vitro , представленный в этом исследовании, особенно полезен для проверки влияния различных методов лечения на поглощение синапсов микроглией. Это позволяет напрямую количественно оценить эффект лечения на микроглию без искажающих факторов, связанных с другими типами клеток. Кроме того, он служит косвенным подходом к доказательству потенциального влияния микроокружения или других типов клеток на процесс синаптического поглощения. Таким образом, мы приходим к выводу, что эти методы, особенно при параллельном использовании, предлагают интуитивно понятные и выгодные альтернативы для анализа микроглиального поглощения синаптических материалов.
Тем не менее, анализ свежевыделенной микроглии с помощью фагоцитарных анализов на основе FACS ex vivo может иметь некоторые недостатки. Во-первых, крайне важно использовать хорошо оптимизированные протоколы, которые генерируют свежевыделенную микроглию из мозга взрослого человека, избегая при этом активации ex vivo и стрессовой реакции микроглии. Dissing-Olesen et al. использовали транскрипционные и трансляционные ингибиторы для решения этой проблемы, применяя процедуру диссоциации тканей при 37 °C30. Mattei et al., с другой стороны, представили протокол холодной механической диссоциации тканей, чтобы избежать индуцирования ex vivo экспрессии стресс-ассоциированных генов16 , и мы адаптировали этот протокол в первом разделе, чтобы избежать ex vivo активации стресс-ассоциированной микроглии до внутриклеточного окрашивания vGLUT1. Мы использовали протокол ферментативной диссоциации тканей на втором участке перед анализом поглощения синаптосомами in vitro , учитывая более высокий выход микроглии после диссоциации тканей на основе папаина (данные не показаны). Микроглия неизбежно остается при 37 °C в условиях культивирования при инкубации с синаптосомами, а инкубация при 37 °C действительно может вызвать изменения в микроглии, что является общим недостатком всех анализов in vitro и процедур культивирования клеток. Поэтому мы предлагаем использовать оба представленных протокола параллельно, чтобы прийти к более широкому выводу о поглощении синапсов микроглией.
Кроме того, важно тщательно определить стратегию гейтинга для отбора CD11b++/CD45+ микроглии, принимая во внимание присутствие других иммунных клеток в паренхиме мозга, которые также экспрессируют эти маркеры31. Что еще более важно, при выборе маркеров, специально нацеленных на микроглию (например, TMEM119, P2RY12), важно учитывать, что они могут претерпевать изменения в уровнях их экспрессии во время патологических и воспалительных состояний32, и такие изменения следует учитывать до создания панели FACS для количественной оценки поглощения микроглией синапсов. Наконец, важно подчеркнуть, что ни один из рассмотренных ранее методов, включая подходы in vivo , основанные на ИГХ и микроскопии, не может сам по себе охватить активное и избирательное обрезание синапсов микроглией. Эти методы не в состоянии отличить активную обрезку микроглией от пассивного удаления синаптического мусора в паренхиме мозга. Поэтому при оценке и обсуждении данных крайне важно четко различать эти различные понятия.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Мы благодарим Регину за техническую помощь в выделении микроглии и доктора Кайо Андрета Фигейреду за помощь в получении микроскопических изображений на дополнительном рисунке S1. Мы благодарим механизм СУИМ MDC за их техническую поддержку. В этой рукописи частично представлены репрезентативные цифры, представленные в журнале Brain, Behavior and Immunity Journal в 2024 году. Рисунок 1A, рисунок 2A и дополнительный рисунок S3A были созданы с использованием BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL Dounce Homogenizer | Active Motif | Cat# 40401 | |
| 5 mL Tubes | Eppendorf | Cat# 0030119452 | |
| Anti-CD11b | ThermoFisher Scientific | Cat# 25-0112-82 | |
| Anti-CD45 | BD | Cat# 559864 | |
| Anti-Ly6C | BD | Cat# 553104 | |
| Anti-Ly6G | BD | Cat# 551460 | |
| BCA Protein Assay Kit | Pierce | Cat# 23227 | |
| C-Tubes | Miltenyi Biotech | Cat# 130-096-334 | |
| CD11b MicroBeads | Miltenyi Biotech | Cat# 130-093-634 | |
| CD16/CD32 Antibody | Thermo Fisher Scientific | Cat#14-0161-82 | |
| Cytofix/Cytoperm Kit | BD | Cat# 554714 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | Cat# 41966029 | |
| Dulbecco´s Phosphate Buffered Saline (DPBS) | Gibco | Cat# 14190144 | |
| Falcon Round-Bottom Polystyrene Test Tubes | Thermo Fisher Scientific | Cat# 08-771-23 | |
| fixable viability dye | Thermo Fisher Scientific | Cat# L34969 | |
| Hibernate A medium | ThermoFisher | Cat# A1247501 | |
| LS-columns | Miltenyi Biotech | Cat# 130-042-401 | |
| Papain Dissociation System | Worthington | Cat# LK003150 | |
| Percoll | Th.Geyer | Cat# 17-0891-02 | |
| Petri dishes | Thermo Fisher Scientific | Cat# 11339283 | |
| pHrodoRed | Thermo Fisher Scientific | Cat# P36600 | |
| Protease inhibitor | Roche | Cat# 5892970001 | |
| Red Blood Cell Lysis Buffer | Sigma | Cat# 11814389001 | |
| Steritop E-GP Sterile Filtration System | Merck | Cat# SEGPT0038 | |
| SynPer Solution | ThermoFisher | Cat# 87793 | |
| vGLUT1 Antibody | Miltenyi Biotech | Cat# 130-120-764 |
Ссылки
- Wolf, S. A., Boddeke, H. W., Kettenmann, H. Microglia in physiology and Disease. Annu Rev Physiol. 79, 619-643 (2017).
- Hanisch, U. K., Kettenmann, H. Microglia: active sensor and versatile effector cells in the normal and pathologic brain. Nat Neurosci. 10 (11), 1387-1394 (2007).
- Tremblay, M. È, Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. PLoS Biol. 8 (11), e1000527(2010).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), New York, N.Y. 1456-1458 (2011).
- Schafer, D. P., et al. Microglia contribute to circuit defects in Mecp2 null mice independent of microglia-specific loss of Mecp2 expression. eLife. 5, e15224(2016).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent manner. Neuron. 74 (4), 691-705 (2012).
- Filipello, F., et al. The microglial innate immune receptor TREM2 is required for synapse elimination and normal brain connectivity. Immunity. 48 (5), 979-991 (2018).
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nat Med. 23 (9), 1018-1027 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), New York, N.Y. 712-716 (2016).
- Di Liberto, G., et al. Neurons under T cell attack coordinate phagocyte-mediated synaptic stripping. Cell. 175 (2), e19 458-471 (2018).
- Bisht, K., et al. Dark microglia: A new phenotype predominantly associated with pathological states. Glia. 64 (5), 826-839 (2016).
- Weerasinghe-Mudiyanselage, P. D. E., et al. Structural plasticity of the hippocampus in neurodegenerative diseases. Int J Mol Sci. 23 (6), 3349(2022).
- Aw, E., Zhang, Y., Carroll, M. Microglial responses to peripheral type 1 interferon. J Neuroinflammation. 17 (1), 340(2020).
- Brioschi, S., et al. Detection of synaptic proteins in microglia by flow cytometry. Front Mol Neurosci. 13, 149(2020).
- Norris, G. T., et al. Neuronal integrity and complement control synaptic material clearance by microglia after CNS injury. JEM. 215 (7), 1789-1801 (2018).
- Mattei, D., et al. Enzymatic dissociation induces transcriptional and proteotype bias in brain cell populations. Int J Mol Sci. 21 (21), 7944(2020).
- Jaszczyk, A., Stankiewicz, A. M., Juszczak, G. R. Dissection of mouse hippocampus with its dorsal, intermediate and ventral subdivisions combined with molecular validation. Brain Sci. 12 (6), 799(2022).
- Fixable viability dyes for flow cytometry. Thermo Fisher Scientific. , Available from: https://www.thermofisher.com/de/de/home/life-science/cell-analysis/flow-cytometry/flow-cytometry-assays-reagents/cell-viability-assays-flow-cytometry/fixable-viability-dyes-flow-cytometry.html (2024).
- SynPER synaptic protein extraction reagent. Thermo Fisher Scientific. , Available from: https://www.thermofisher.com/order/catalog/product/87793?gclid=CjwKCAiAi6uvBhADE_iwAWiyRdigrNHuDkIAVVsaW8OaC3VJNgrPEm1I64E2P BZA8X_A_0ipFr_suIxoCDm8QAvD_BwE&ef_id=Cjw KCAiAi6uvBhADEiwAWiyRdigrNHuDkIAVVsaW8OaC 3VJNgrPEm1I64E2PBZA8X_A_0ipFr_suIxoCDm8QA vD_BwE:G:s&s_kwcid=AL!3652!3!606658601747!e!! g!!syn per!13368767883!123500396056&cid=bid_pca _ppf_r01_co_cp1359_pjt0000_bid00000_0se_gaw_bt _pur_con&gad_source=1#/87793 (2024).
- Wu, A., Yu, B., Komiyama, T. Plasticity in olfactory bulb circuits. Curr Opin Neurol. 64, 17-23 (2020).
- pHrodo indicators for pH determination. Thermo Fisher Scientific. , Available from: https://www.thermofisher.com/de/de/home/brands/molecular-probes/key-molecular-probes-products/phrodo-indicators.html (2024).
- Rangaraju, S., et al. Differential phagocytic properties of CD45low microglia and CD45high brain mononuclear phagocytes-activation and age-related effects. Front Immunol. 9, 405(2018).
- Weinhard, L., et al. Microglia remodel synapses by presynaptic trogocytosis and spine head filopodia induction. Nat Commun. 9 (1), 1228(2018).
- Morizawa, Y. M., et al. Synaptic pruning through glial synapse engulfment upon motor learning. Nat Neurosci. 25 (11), 1458-1469 (2022).
- Morini, R., et al. Strategies and tools for studying microglial-mediated synapse elimination and refinement. Front. Immunol. 12, 640937(2021).
- Maecker, H. T., Trotter, J. Flow cytometry controls, instrument setup, and the determination of positivity. Cytometry. Part A: J. Int Soc Anal Cytol. 69 (9), 1037-1042 (2006).
- Easthope, E. Strategies for intracellular flow cytometry success. , Available from: https://www.biocompare.com/Editorial-Articles/582159-Strategies-for-Intracellular-Flow-Cytometry-Success/ (2022).
- Paduano, F. Isotype control antibodies, Key points. , Available from: https://www.antibodies.com/primary-antibodies/isotype-control-antibodies#:~:text=Isotype%20controls%20should%20be%20used,the%20primary%20antibody%20and%20fluorophore (2024).
- Flow cytometry intracellular staining controls. Bio-Rad. , Available from: https://www.bio-rad-antibodies.com/flow-cytometry-intracellular-controls.html (2024).
- Dissing-Olesen, L., et al. FEAST: A flow cytometry-based toolkit for interrogating microglial engulfment of synaptic and myelin proteins. Nat Commun. 14, 6015(2023).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of general and discriminating markers of differential microglia phenotypes. Front Cell Neurosci. 14, 198(2020).
- van Wageningen, T. A., et al. Regulation of microglial TMEM119 and P2RY12 immunoreactivity in multiple sclerosis white and grey matter lesions is dependent on their inflammatory environment. Acta Neuropathol Commun. 7 (1), 206(2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены