A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Hellgrammite كمراقب حيوي غير تقليدي لتقييم المياه السطحية والصحة البيئية
In This Article
Summary
يصف هذا البروتوكول استخدام المؤشرات الحيوية للكشف المبكر عن الآثار الضارة في النظم الإيكولوجية المائية. ترتبط المؤشرات الحيوية ارتباطا وثيقا بالسمات الخافرة ، وتساعد تغييراتها في الكشف عن أضرار الإنذار المبكر.
Abstract
تتميز يرقات ذبابة الدوبسون من جنس Corydalus ، المعروف باسم Hellgrammites ، بحجمها الملحوظ ، ومجموعة واسعة من حدوثها ، وفترة طويلة من عدم النضج ، والتي يمكن أن تستمر حتى عام واحد. من المعروف بوضوح أن Hellgrammites تظهر حساسية تجاه التلوث وتأثيرات بنية الموائل. بالنظر إلى هذه الميزات الفريدة ، فإن استخدام يرقات Corydalus texanus مناسب للغاية كعوامل مراقبة حيوية موثوقة لتقييم السلامة البيئية للنظم البيئية المائية. يهدف هذا البروتوكول إلى توفير الأدوات اللازمة لتقييم C. texanus وإثبات فعاليتها من خلال دراسة حالة. نتائج البحث لها آثار عملية ، تشير إلى أن C. texanus تظهر يرقات استجابات إنذار مبكر لتلوث التعدين ، حيث تتراكم كميات كبيرة من المعادن الثقيلة مثل Zn و Fe و Al. قد يكون وجود أو عدم وجود C. texanus التجمعات بمثابة مؤشر مفيد لتحديد المشكلات المحتملة المتعلقة بصحة النظام البيئي. أظهر النهج غير التقليدي تحذيرات مبكرة من التلوث في المواقع المتأثرة بالتعدين ، مما يسلط الضوء على الحاجة إلى اتخاذ إجراءات في الوقت المناسب لحماية البيئة. نظرا لسماتها الفريدة ، يقترح استخدام C. texanus يرقات كمؤشر حيوي غير تقليدي موثوق.
Introduction
Hellgramites هي يرقات حشرات من رتبة Megaloptera (Latreille ، 1802) ، تسمى dobsonflies أو ذباب السمك في مرحلة البلوغ. تنوع منخفض ولكنه واسع النطاق يميز هذه المجموعة من يرقات الحشرات المفترسة من النظم البيئية المائية1. توجد أنواع هيلغراميت في مناطق بيولوجية جغرافية محددة جيدا. لذلك ، من السهل نسبيا تحديد الأنواع التي ليس لديها معرفة تصنيفية عالية. والجدير بالذكر أن يرقات Corydalidae تمتلك أبرز الأنواع من رتبة Megaloptera (طول الجسم 20-90 مم)2 ، مما يجعل hellgramite مرئيا للعين المجردة.
تلعب Hellgrammites دورا مهما في النظم البيئية المائية كحيوانات مفترسة ، مع وجود قوي بسبب المضغ الكبير الذي يدل على شكلها المفترس المثير للإعجاب. ينضم الجسم المسطح ظهريا البطيني أيضا إلى 7-8 أزواج من الخياشيم الخيوط على طول الجسم ، وكبسولة الرأس التي تحتوي على ستة جذام لكل جانب تجعل الجحيم كائنات رائعة لعلماء الحشرات والمشجعين3. يفاجئ البالغون في Corydalidae ويخلقون صورة انطباع للناس نظرا لحجمهم البارز ؛ ومع ذلك ، فهي غير ضارة تماما. من الجدير بالذكر أن hellgrammites لديها القدرة على الاستمرار في البيئات المائية في مرحلة اليرقات لفترة طويلة.
تسمح السمات المظهرية للhellgrammites بفرصة خاصة لتسليط الضوء على دورها في النظم البيئية المائية. ومع ذلك ، فإن إمكانات المؤشر الخاصة بهم هي الميزة الأكثر طلبا لعلماء البيئة المائية. يتم تسليط الضوء على المعرفة الواسعة بإمكانيات المؤشرات الحيوية في النظم الإيكولوجية المائية لأن حدوثها يتعلق بالظروف الصحية الجيدة في موائلها بسبب عدم تحملها للتلوث العضوي في المياه السطحية4،5،6،7،8.
تعيش معظم Corydalidae megalopterans في مياه جارية عالية السرعة مثل الركائز والركائز التي تهيمن عليها الحصى والحصى ، ولكن hellgrammites تحدث أيضا في تيارات منخفضة التدرج مع عقبات وركائز رملية ، وكذلك في الموائل العدسية مثل البحيرات3،9،10. يعكس نطاقها الواسع من حدوثها السمات الحاسمة لحيوان مفترس كبير وقدرتها على استعمار العديد من الموائل التي تستهدفها استراتيجيات تاريخ حياتهم الفعالة11. ربط Hellgramites سماتهم بديناميكيات النظم البيئية المائية. وبالتالي ، فإن استراتيجيات مثل التكيف مع التنفس الجوي بواسطة الفتحات التنفسية (بالإضافة إلى خصلات خياشيم القصبة الهوائية البطنية) مناسبة لاستراتيجيات Corydalidae10.
تعيش Hellgrammites في أنظمة بيئية معينة وتظهر استجابات سريعة للانحرافات عن الأنماط المعمول بها ، وبالتالي تعمل كنظام إنذار مبكر7. يمكن استخدام تفاعلات هذه الكائنات الحية البرية كأداة قيمة لتقييم تأثير التلوث على النظم الإيكولوجية المائية ، لا سيما في حالة مخاليط الملوثات غير المستهدفة. وقد تم التعرف على بعض الآثار الضارة على الكائنات الحية في النظم الإيكولوجية بسبب السمية الفردية للمواد الكيميائية، ولكن يجب تحديد تأثير مخاليط الملوثات. قد تتيح استجابات الإنذار المبكر من hellgrammites تحديد الآثار الضارة من خلال إعطاء إشارة إلى تأثيرات خليط من الملوثات أو حتى عندما تتعرف التأثيرات الفردية للملوثات على تركيز عدم وجود تأثير ملحوظ (NOEC) 12.
تم استخدام العديد من الكائنات الحية النموذجية للاختبارات التجريبية الحادة والمزمنة. ومع ذلك ، يتم استزراعها وصيانتها في ظل ظروف خاضعة للرقابة13. الظروف الخاضعة للرقابة تجعلهم غير قادرين على تحديد الآثار غير المستهدفة للعديد من الملوثات التي يتعرضون لها. أيضا ، يتم التعرف على NOEC بشكل متكرر بسبب تعقيد خليط الملوث. لهذا السبب ، في العقود الماضية ، تم التعرف على الأنواع المحلية غير النموذجية ذات التأثيرات غير المستهدفة لأنظمة الفحص ، والتي تعتبر ضرورية لإجراء أبحاث السميةالبيئية 14. وبالتالي ، يبدو أن hellgrammites قادرة على تقييم الآثار الضارة للتلوث في النظم البيئية المائية. سمات مثل بيولوجيتها وعلم الوراثة وعلم وظائف الأعضاء ، من بين أمور أخرى ، تجعل الكائنات غير النموذجية مناسبة لتقييم التأثير في النظمالبيئية 14.
يهدف هذا البروتوكول إلى إنشاء أداة جديدة للرصد البيولوجي باستخدام كائن حي غير نموذجي يمكنه اكتشاف إشارات الإنذار المبكر استجابة لمخاليط التلوث غير المستهدفة. لتحقيق أفضل النتائج ، تم النظر بشكل شامل في السمات التي أظهرتها يرقات الأنواع النموذجية ، C. texanus ، ودمجها في التحليل15.
Protocol
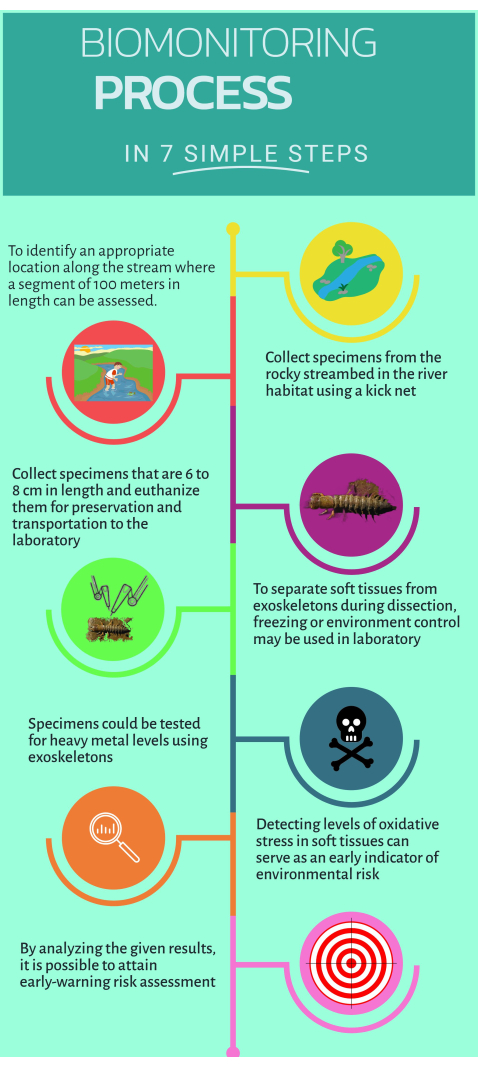
الشكل 1: دليل سريع خطوة بخطوة حول كيفية استخدام المراقبة الحيوية غير التقليدية Corydalus texanus للتنفيذ في النظم البيئية المائية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
1. العمل الميداني
- تحديد مواقع الدراسة الواقعة في أعلى وأسفل مجرى مصدر التلوث حيث يتم التعرف على الآثار المشتبه بها أو الواضحة (أي الانبعاثات المحددة أو المنتشرة).
ملاحظة: شمل البروتوكول الحالي 15 موقعا للدراسة في أربعة أنهار رئيسية: 1) نهر إكستوراز (مواقع PB ، EZ ، RQ ، BC). 2) نهر إسكانيلا جالبان (ES ، EN ، AH ، JL ، PI ، PA) ؛ 3) نهر أيوتلا (AY) ؛ و 4) نهر سانتا ماريا (SM ، AT). - ابحث عن موقع مرجعي واحد على الأقل وحدد موقعه (مكان تحت تأثير طفيف أو غير موجود) وقم بتعريفه كموقع دراسة.
ملاحظة: بالنسبة لمواقع الدراسة الحالية ، اعتبرت BC و ES و SM و AY و AT مواقع مرجعية. - التعرف على سمات معينة للموائل التي تزيد من احتمالية العثور على أفراد من C. texanus. وتشمل هذه الركيزة الحصوية ، والموائل الصخرية ذات التدرجات الأكثر انحدارا ، والتدفقات عالية السرعة ، والمياه المؤكسجة جيدا ، وكثافة المظلة العالية ، والموائل في المرتفعات والأراضي المنخفضة.
- أرفق جزءا بطول 100 متر من التيار لتحديد الموائل المناسبة للمراقبةالبيولوجية 16.
- ادخل إلى البث لجمع العينات.
- عينة ما لا يقل عن ستة أفراد من C. texanus في موائل مثل القطاعات والحصى والمياه الصافية والحطام باستخدام شبكة ركلة بحجم شبكة 500 ميكرومتر.
- قم بإزالة الصخور في اتجاه تدفق المياه ونقل اليرقات إلى الشبكة.
- تعامل مع شبكة الركلة مع اليرقات المأخوذة من العينة وانقلها إلى زجاجات مخصصة للسكن المؤقت. تعامل مع الشبكة بحذر وقم بطي الحواف باتجاه الداخل لمنع أي فقدان لليرقات.
- قم بقياس عرض رأس اليرقات المأخوذة من العينة باستخدام الفرجار لتحديد الأطوار من التاسع إلى الحادي عشر (في حدود 6 مم إلى 10 مم).
- قم بتطهير اليرقات عن طريق غمرها في زجاجة تحتوي على ماء تيار لمدة 30 دقيقة.
- ضع العينات في زجاجات بلاستيكية ذات ملصقات واضحة ثم قم بالقتل الرحيم عن طريق غمرها في النيتروجين السائل (-75 درجة مئوية) في خزان مبرد.
- نقل العينات وتخزينها بشكل آمن عند -45 درجة مئوية في الفريزر الفائق في المختبر.
- باستخدام زجاجة بولي إيثيلين ، خذ عينة من مياه التيار من 200 مل ، وأضف 1 مل من حمض النيتريك ، وقم بتخزين العينة عند 4 درجات مئوية لقياس كمية المعادن الثقيلة اللاحقة في المختبر.
2. تشريح اليرقات المأخوذة بعينات وفصل الأنسجة
- ضع صينية التشريح البلاستيكية على الثلج وانتظر حتى تصل إلى 4 درجات مئوية باستخدام مقياس حرارة للتحقق.
- خذ عينات من الفريزر الفائق وضعها على صينية التشريح لبدء التشريح.
- حدد الأنسجة المستهدفة: العضلات والفروع والأنبوب العصبي والهيكل الخارجي.
- استخدم سكينا خزفيا لإزالة الرأس وفصل الأنسجة بعناية. افتح الجسم طوليا وقم بإزالة الخياشيم من كل جانب.
- افصل الهياكل الخارجية باستخدام سكين خزفي أصغر ونظف الأنسجة الزائدة. ضع الهياكل الخارجية في الفرن وجففها على حرارة 80 درجة مئوية لمدة 48 ساعة.
- بعد اقتراب الوقت ، قم بتخزين الهياكل الخارجية الجافة لمزيد من التحليل.
- استمر في تنظيف الأنسجة الرخوة في الظروف الباردة لمزيد من التحليل بواسطة المقايسات الدقيقة.
- استخدم سكينا خزفيا صغيرا لاستخراج الأنسجة الرخوة من الدهون. افصل كل نسيج مستهدف وقم بتجميعه من الأفراد من نفس نقطة أخذ العينات.
- قم بتخزين كل نوع من أنواع الأنسجة في أنبوب دقيق سعة 2 مل ، مع الحفاظ على الظروف الباردة طوال العملية.
- لتحضير كل نسيج مستهدف ، قم بوزن 100 مجم من الأنسجة وأضف 1 مل من محلول PBS بدرجة حموضة 7.4. استخدم تمزق الأنسجة بيد واحدة لتجانس كل نسيج. عادة ما تتطلب الأنسجة الرخوة ثلاث دورات مدة كل منها 10 ثوان.
- عينة أجهزة الطرد المركزي عند 1,000 × جم لمدة 5 دقائق عند 4 درجات مئوية. انقل المادة الطافية إلى أنبوب دقيق سعة 1 مل.
- إجراء فحوصات دقيقة للمؤشرات الحيوية.
3. القياس الكمي للمعادن الثقيلة
- وزن 250 مجم من الهياكل الخارجية المجففة من ست عينات على الأقل في مرحلة النمو المحددة باستخدام ميزان تحليلي.
- طحن الهياكل الخارجية في هاون زجاجي حتى تصبح مسحوقا ناعما. أضف 250 مل من حمض النيتريك فائق النقاء إلى أوعية تفاعل المسحوق.
- لهضم العينات ، انقلها إلى ميكروويف الهضم عند 180 درجة مئوية لمدة 30-45 دقيقة.
ملاحظة: استخدم الحاوية المناسبة الآمنة للاستخدام في الميكروويف للعلامة التجارية للميكروويف لتسخين العينات بأمان وفعالية. يختلف وقت الهضم لعينات الأنسجة حسب ماركة الميكروويف ، حيث يستغرق 30-45 دقيقة. تقدم بعض العلامات التجارية طرقا موحدة. - قم بإجراء طريقة الهضم بالميكروويف لعينات المياه باتباع طريقة EPA3015A ، باستخدام 45 مل من عينة الماء وإضافة 5 مل من حمض النيتريك.
- قياس المعادن الثقيلة والمعادن في العينات المهضومة (الماء والأنسجة) باستخدام التحليل الطيفي للانبعاث البصري للبلازما المقترن بالحث (ICP-OES) ، بما في ذلك الزئبق والنحاس والرصاص والزنك والحديد والكروم والقرص المضغوط والمنزود والبا والأس.
ملاحظة: استخدم الأرجون من الدرجة 5 والمحاليل القياسية لكل معدن ومعدن لإنشاء منحنى معايرة.
4. المقايسات المجهرية لتقييم الإجهاد التأكسدي والمؤشرات الحيوية
- تحضير الكواشف
- امزج 6 جم من NaH2PO4 مع 1000 مل من الماء فائق النقاء لعمل مخزن فوسفات أحادي القاعدة بسعة 50 ملم. يحفظ في قارورة عند 2-8 درجات مئوية إلى أجل غير مسمى.
- لصنع 8.1٪ SDS ، قم بإذابة 450 مجم من كبريتات دوديسيل الصوديوم (SDS) في 5 مل من الماء فائق النقاء. استعد قبل الاستخدام مباشرة.
- خفف 2 مل من حمض ثلاثي كلورو الإيثانويك (TCA) في 8 مل من الماء عالي النقاء (قم بإعداد كاشف طازج عند الحاجة).
- قم بإذابة 100 مجم من رباعي بوتيلامونيوم (TBA) في 10 مل من الماء فائق النقاء (قم بإعداد كاشف طازج عند الحاجة).
- لصنع 50 ملي مولار PBS الرقم الهيدروجيني 7.8 ، قم بإذابة 97 مجم من NaH2HPO4 و 59 مجم من NaH2PO4 في 10 مل من الماء عالي النقاء. ثم اضبط الرقم الهيدروجيني على 7.8 باستخدام هيدروكسيد الصوديوم للزيادة أو حمض الهيدروكلوريك للانخفاض.
- اصنع محلول 200 ميكروغرام / مل من الكاتلاز البقري عن طريق إذابة 8 مجم منه في 40 ميكرولتر من الماء فائق النقاء (قم بإعداد كاشف طازج عند الحاجة).
- لصنع محلول 50 ملي مولار TRIS / 5 ملي مولار حمض الإيثيلين ديامين تترا أسيتيك (EDTA) ، أضف 6.05 جم من تريس (هيدروكسي ميثيل) أمينوميثان (TRIS) و 0.073 جم من EDTA إلى 45 مل من الماء عالي النقاء. اضبط درجة الحموضة على 7.6 باستخدام حمض الهيدروكلوريك واحفظها على حرارة 4 درجات مئوية حتى الاستخدام.
- بالنسبة ل 0.1 M الجلوتاثيون المختزل (GSH) (ل 45 عينة مكررة) ، تزن 0.0184 جم من GSH وقم بإذابتها في 600 ميكرولتر من 10 ملي حمض الهيدروكلوريك.
- لتحضير 10 ملي مولار حمض الهيدروكلوريك ، أضف 0.5 ميكرولتر من حمض الهيدروكلوريك المركز إلى 599.5 ميكرولتر من الماء عالي النقاء.
- أضف 28.5 ميكرولتر من اختزال الجلوتاثيون إلى 1.4 مل من 0.1 M TRIS / HCl 0.5 ملي EDTA درجة الحموضة 8.0.
- امزج 1.211 جم من TRIS و 0.0146 جم من EDTA مع 90 مل من الماء فائق النقاء لتحضير محلول TRIS / HCl 0.5 mL و 0.5 mM EDTA عند درجة الحموضة 8.0. أضف حمض الهيدروكلوريك لضبط الرقم الهيدروجيني إذا لزم الأمر. يمكن تخزين المحلول إلى أجل غير مسمى عند 2-8 درجة مئوية.
- وزن 0.075 جم من NADPH وأضفه إلى 2.25 مل من 1٪ NaHCO3 1 ملي EDTA.
- امزج 1 جم من NaHCO3 و 0.0282 جم من EDTA في 100 مل من الماء فائق النقاء لتحضير محلول NaHCO3 بنسبة 1٪ و 1 ملي مولار EDTA. قم بتخزين المحلول في درجة حرارة 4-8 درجات مئوية لفترة غير محددة.
- امزج 2 ميكرولتر من تي-بوتيل هيدروبيروكسيد مع 2 مل من الماء فائق النقاء لعمل محلول 7 ملليمتر. تخلط مباشرة قبل الاستخدام.
- امزج 1 جم من ألبومين مصل الأبقار (BSA) مع 1 مل من الماء فائق النقاء لعمل محلول مخزون 1 ميكروغرام / ميكرولتر.
- المواد التفاعلية لحمض الثيوباربيتوريك (TBARS) (بيروكسيد الدهون ، LPO) 17
- أضف 5 ميكرولتر من المادة الطفية للأنسجة إلى أنبوب دقيق سعة 1 مل. أضف 45 ميكرولتر من 50 ملي مولار PBS (محلول طازج ومرق).
- أضف 12.5 ميكرولتر من 8.1٪ SDS (محضر طازجا). أضف 93.5 ميكرولتر من 20٪ TCA pH 3.5 (محضر طازجا).
- أضف 93.5 ميكرولتر من 1٪ TBA (طازج). أكمل الحجم بإضافة 50.5 ميكرولتر من الماء فائق النقاء. أغلق غطاء الأنبوب وقم بتدويره لمدة 30 ثانية.
- ثقب غطاء الأنبوب الدقيق بإبرة واحتضانه في الماء المغلي لمدة 10 دقائق.
- قم بتبريد الأنبوب في درجة حرارة الغرفة (RT) ، ثم قم بطرده عند 1000 × جم لمدة 10 دقائق.
- أضف 150 ميكرولتر من المادة الطافية إلى بئر في صفيحة دقيقة مكونة من 96 بئرا وقم بقياس الامتصاص عند 530 نانومتر باستخدام مقياس الطيف الضوئي الدقيق.
- لتحديد البيروكسيدات الدهنية ، قم بإنشاء منحنى معايرة TBARS من 8 نقاط (0-160 ميكرومتر) باستخدام مالوندي ألدهيد مكرر (ثنائي ميثيل أسيتال) كما هو موضح في الجدول 1. اضبط منحنى مالوندي الديهايد (MDA) وفقا لنوع الأنسجة أو مستوى التلف المشتبه به.
- عبر عن النتائج كبروتين nmol MDA eq·mg−1 .
- المقايسة المجهرية للإنزيم المضاد للأكسدة الفائق ديسموتاز (SOD)18
- استخدم طبق 96 بئر. أضف 147 ميكرولتر من 1 M TRIS / 5 ملي HCl EDTA pH 8 في بئرين كفراغات. أضف 144 ميكرولتر من 1 M TRIS / 5 ملي حمض الهيدروكلوريك EDTA الرقم الهيدروجيني 8 في الآبار الأخرى عن طريق التكرار.
- خذ 3 ميكرولتر من المادة الطافية وأضفها إلى آبار العينة. اخلطي المحتويات برفق على الطبق عدة مرات.
- أضف 3 ميكرولتر من حمض البيروغاليك 10 ملي مولار إلى كل بئر في غضون 30 ثانية. تخلط بلطف على الفور.
- قم بقياس الامتصاص عند T0 (الوقت = 0 ثانية) و T10 (الوقت = 10 ثوان) ، عند 420 نانومتر و 25 درجة مئوية.
- حدد SOD عن طريق حساب النسبة المئوية لتثبيط بيروجالول في العينة باستخدام المعادلة التالية:
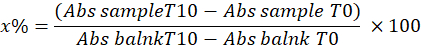
أين
x٪ = النسبة المئوية لأكسدة بيروجالول بواسطة SOD في العينة ؛ لذلك ، فإن أكسدة البيروغالول تساوي 100 - x٪
ملاحظة: حساب نشاط SOD مع الأخذ في الاعتبار 1 وحدة دولية هو الحجم الذي يمنع 50٪ من أكسدة البيروجالول كما هو موضح أدناه:
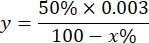
أين
y = حجم العينة على المليلتر (يمنع 50٪ من pyrogallon)
50٪ = النسبة المئوية لتثبيط البيروغالول تساوي 1U من SOD
0.003 = الحجم بالملليلتر من العينة
100 - x٪ = تثبيط بيروجالول بالنسبة المئوية للعينة - أخيرا ، حدد نشاط SOD بالمعادلة:
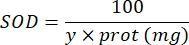
SOD = نشاط SOD بالوحدات الدولية لكل ميكروغرام من البروتين
Y = حجم العينة الذي يمنع 50٪ من بيروجالول
100 = عامل التحويل من ديسيلتر إلى مليلتر.
يتم التعبير عن البروتين = تركيز البروتين الذي تم الحصول عليه من القياس الكمي لبرادفورد بالميكروغرام لكل مليلتر ؛ من الضروري القسمة على 10 للتحويل إلى جرام لكل ديسيلتر
- المقايسة المجهرية لإنزيم الكاتلاز المضاد للأكسدة (CAT)19،20
- استخدم صفيحة دقيقة 96 بئر. أضف 20 ميكرولتر من عينة الطاف إلى الآبار (مكررة).
- أضف 20 ميكرولتر من الكاتلاز الطازج (200 ميكروغرام / مل) في الآبار كمعيار (مكرر). أضف 100 ميكرولتر من 50 ملي مولار PBS الرقم الهيدروجيني 7.8 إلى العينة والآبار الفارغة.
- أضف 100 ميكرولتر من 90 ملي مولار (30٪) H2O2 في الآبار لبدء التفاعل. بعد إضافة H2O2 ، اقرأ الامتصاص كل 15 ثانية لمدة 2.5 دقيقة عند 240 نانومتر.
- احسب النشاط باستخدام المعادلة:
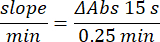
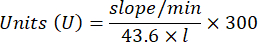
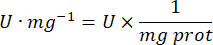
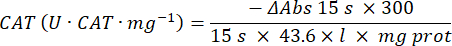
- المقايسة المجهرية لإنزيم الجلوتاثيون بيروكسيداز (GPx)21
- استخدم صفيحة دقيقة 96 بئر.
- امزج 240 ميكرولتر من محلول GSH 0.1 M، و 1 200 ميكرولتر من محلول 10 U/mL GSH-Rd، و 1 200 ميكرولتر من 4 ملي مولار NADPH. احتفظ بالمحلول على الجليد.
- أضف إلى الآبار 100 ميكرولتر من 50 ملي TRIS / HCl 5 ملي مولار EDTA درجة الحموضة 7.6. أضف 1 ميكرولتر من عينة الطاف في نسختين. اضغط على الصفيحة الدقيقة واخلطها برفق.
- أضف 50 ميكرولتر من محلول الخلط (الخطوة 4.5.2) واخلطه برفق.
- أضف 20 ميكرولتر من محلول هيدروبيروكسيد t-butyl سعة 7 ملي مولار في الآبار لبدء التفاعل (يستغرق الأمر حوالي 15 ثانية لبدء التفاعل في 16 عينة مكررة). امزج الميكروبليت بسرعة.
- راقب الامتصاص كل 1 دقيقة لمدة 5 دقائق عند 25 درجة مئوية عند 340 نانومتر.
- احسب نشاط GPx بالمعادلة:
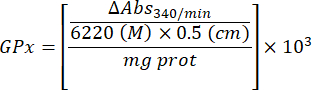
أين
GPx = النشاط بالمللي مولار في الدقيقة لكل ميكروغرام من البروتين
ΔAbs340 / دقيقة = متوسط الامتصاص في الدلتا
103 = التحويل المولي إلى المليمولار
- ملغ بروت = تركيز البروتين من تحديد برادفورد معبرا عنه بالميكروغرام لكل ميكرولتر
- القياس الكمي للبروتين من خلال تحليل برادفورد22
- إجراء منحنى قياسي من محاليل ألبومين مصل الأبقار (BSA) ، تم تعيينه من محلول المخزون 1 ميكروغرام / ميكرولتر كما هو موضح في الجدول 2.
- استخدم صفيحة دقيقة 96 بئر. أضف 190 ميكرولتر من كاشف برادفورد في العينة والآبار القياسية.
- أضف 10 ميكرولتر من BSA في الآبار القياسية بالتكرار. أضف 10 ميكرولتر من المادة الطافية إلى آبار العينة عن طريق التكرار.
- امزج بلطف مع طرف الماصة.
- قراءة الامتصاص عند 595 نانومتر. حدد تركيز البروتين بالمنحنى القياسي.
النتائج
تكشف نتائج الدراسة أن المعادن الثقيلة ، وتحديدا الألومنيوم (Al) والحديد (Fe) والزنك (Zn) ، لها تأثير ضار على البيئة ، كما يتضح من الشكل 2. أدى اكتشاف مستويات عالية من المعادن الثقيلة في عينات الأنسجة والمياه التي تم جمعها من جميع المواقع إلى نتيجة غير مواتية. تم...
Discussion
على الرغم من أن استخدام C. texanus هو الأمثل للتقييم ، إلا أنه من الضروري مراعاة عدة جوانب لاستخدامه وجمعه. أثبتت مواقع الدراسة المختارة أنها تمثل تحديا ، بسبب عدة عوامل مثل الظروف الجوية غير المواتية ، أو عدم إمكانية الوصول الجغرافي ، أو مستويات الجفاف المرتفعة ، أو عدم...
Disclosures
لم يكشف المؤلفون عن أي تضارب في المصالح في عملهم.
Acknowledgements
يود المؤلفون أن يعربوا عن امتنانهم الصادق ل CONAHCyT لتقديم منحة FONINS P 1931 ، والتي سهلت جهودهم البحثية بشكل كبير. كما يشكرون أمانة التحقيقات والبوسغرادو في المعهد السياسي الوطني على الدعم القيم المقدم من خلال منحة مشروع SIP (20200577). بالإضافة إلى ذلك ، يرغب المؤلف الأول في الاعتراف بالمنحة الدراسية السخية للدراسات العليا التي تمنحها CONAHCyT ، والتي مكنت الفريق من إجراء رحلات ميدانية وجمع البيانات الأساسية. أخيرا ، يود المؤلفان الإعراب عن تقديرهم للمساعدة القيمة التي قدمتها ماريا تيريزا غارسيا كاماتشو في المختبر ، والتي لولاها لما كان هذا المشروع ممكنا.
Materials
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
References
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86 (2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474 (2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1 (2017).
- . Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018)
- Cao, C. -. Q., Liu, Z., Chen, S. -. Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. . Stream Ecology: Structure and Function of Running Waters. , (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209 (2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. . Tropical Stream Conservation. Tropical Stream Ecology. , (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved