JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
지표수 및 환경 건강 평가를 위한 비전통적인 바이오모니터인 Hellgrammite(Hellgrammite)
요약
이 프로토콜은 수생 생태계에서 유해한 영향을 조기에 감지하기 위한 바이오마커의 사용을 설명합니다. 바이오마커는 감시자 형질과 밀접한 관련이 있으며, 이들의 변화는 조기 경고 피해를 감지하는 데 도움이 됩니다.
초록
일반적으로 Hellgrammites로 알려진 Corydalus 속의 dobsonflies의 유충은 눈에 띄는 크기, 광범위한 발생 범위 및 최대 1 년 동안 지속될 수있는 연장 된 미성숙 기간이 특징입니다. 헬그램마이트는 오염과 서식지 구조 영향에 민감하게 반응하는 것으로 알려져 있습니다. 이러한 고유한 기능을 감안할 때 Corydalus texanus 유충을 사용하는 것은 수생 생태계의 생태학적 무결성을 평가하기 위한 신뢰할 수 있는 생물 모니터링 에이전트로 매우 적합합니다. 이 프로토콜은 C. texanus 평가에 필요한 도구를 제공하고 사례 연구를 통해 그 효능을 입증하는 것을 목표로 합니다. 연구 결과는 C. texanus 유충이 광산 오염에 대한 조기 경고 반응을 나타내어 Zn, Fe 및 Al과 같은 중금속을 다량 생물 축적한다는 것을 나타내는 실용적인 의미를 가지고 있습니다. C. texanus 개체군의 유무는 생태계 건강과 관련된 잠재적인 문제를 식별하는 데 유용한 지표가 될 수 있습니다. 이 색다른 접근 방식은 광산의 영향을 받는 현장의 오염에 대한 조기 경고를 보여주었으며, 환경을 보호하기 위해 적시에 조치를 취해야 할 필요성을 강조했습니다. 그들의 독특한 특성을 감안할 때, C. texanus 유충의 사용은 신뢰할 수 있는 비전통적 생물 지표로 강력히 제안됩니다.
서문
Hellgramites는 Megaloptera (Latreille, 1802)목의 곤충 유충으로, 성체 단계에서 dobsonflies 또는 fishflies라고 불립니다. 다양성은 낮지만 널리 퍼져 있다는 것은 수생 생태계에서 온 최상위 포식자 곤충 유충 그룹인 이 그룹을 특징짓는다1. Hellgramite 종은 잘 정의 된 생물 지리학 지역에서 발생합니다. 따라서 높은 분류학적 지식 없이도 종을 식별하는 것이 상대적으로 쉽습니다. 특히, Corydalidae 유충은 Megaloptera 목(몸 길이 20-90mm)에서 가장 눈에 띄는 종을 가지고 있어 육안으로 헬그라마이트를 볼 수 있습니다.
헬그램마이트는 포식자로서 수생 생태계에서 중요한 역할을 하며, 인상적인 포식자 형태를 나타내는 큰 씹는 동물로 인해 강력한 존재감을 나타냅니다. 등쪽으로 납작한 몸체는 몸을 따라 7-8쌍의 필라멘트 아가미와 결합하며, 한 면에 6개의 줄기가 있는 머리 캡슐은 곤충학자와 팬들에게 지옥진드기를 매력적인 유기체로 만듭니다3. Corydalidae의 성인은 눈에 띄는 크기로 인해 사람들을 놀라게하고 인상적인 이미지를 만듭니다. 그러나 그들은 완전히 무해합니다. 헬그램마이트가 유충 단계에서 상당한 기간 동안 수생 환경에서 지속할 수 있는 능력을 가지고 있다는 것은 주목할 만합니다.
헬그램마이트의 표현형적 특징은 수생 생태계에서 그들의 역할을 강조할 수 있는 특별한 기회를 제공합니다. 그럼에도 불구하고, 그들의 지표 잠재력은 수생 생태학자들이 가장 원하는 기능입니다. 그들의 생물 지표 잠재력에 대한 방대한 지식은 수생 생태계에서 강조되는데, 그 이유는 그들의 발생이 지표수의 유기 오염에 대한 편협성으로 인해 서식지의 좋은 건강 상태와 관련이 있기 때문입니다 4,5,6,7,8.
대부분의 Corydalidae megalopterans는 자갈과 자갈이 우세한 소용돌이와 기질로 고속 흐르는 물에 살지만, hellgrammites는 호수 3,9,10과 같은 렌틱 서식지뿐만 아니라 걸림돌과 모래 기질이있는 저구배 하천에서도 발생합니다. 이들의 광범위한 발생 범위는 최상위 포식자의 중요한 특성과 효과적인 생활사 전략에 의해 목표로 하는 여러 서식지를 식민지화할 수 있는 능력을 반영합니다11. Hellgramites는 그들의 특성을 수생 생태계의 역학과 연결했습니다. 따라서, spiracles(기관 아가미의 복부 다발에 더하여)에 의한 공중 호흡에 대한 적응(adaptation to aerial respiration)과 같은 전략은 Corydalidae 전략10에 적합하다.
헬그램마이트는 특정 생태계에 서식하며 확립된 패턴에서 벗어난 것에 대해 빠른 반응을 보이기 때문에 조기 경보 시스템7 역할을 합니다. 이러한 야생 생물의 반응은 특히 비표적 오염 물질 혼합물의 경우 수생 생태계에 대한 오염의 영향을 평가하는 귀중한 도구로 사용될 수 있습니다. 화학 물질의 개별적인 독성으로 인해 생태계에서 살아있는 유기체에 대한 일부 유해한 영향이 인식되었지만 오염 물질 혼합물의 영향을 확인해야 합니다. 헬그램마이트의 조기 경고 반응은 오염 물질의 혼합물의 영향에 대한 참조를 제공하거나 오염 물질의 개별 영향이 NOEC(No Observable Effect Concentration)12를 인식하는 경우에도 해로운 영향을 식별할 수 있도록 할 수 있습니다.
여러 모델 유기체가 실험적인 급성 및 만성 테스트에 사용되었습니다. 그러나 그들은 통제된 조건 하에서 배양되고 유지됩니다13. 통제된 조건은 그들이 노출된 여러 오염 물질의 비표적 효과를 식별할 수 없게 만듭니다. 또한 NOEC는 오염 물질 혼합물의 복잡성으로 인해 자주 인식됩니다. 이러한 이유로, 지난 수십 년 동안 비표적 효과를 가진 비모델 토착 종은 생태독성학 연구를 수행하는 데 필수적인 시스템을 스크리닝하는 것으로 인식되었습니다14. 결과적으로, 헬그램마이트는 수생 생태계에 대한 오염의 해로운 영향을 평가할 수 있는 것 같습니다. 무엇보다도 생물학, 유전학, 생리학과 같은 특성으로 인해 비모델 유기체는 생태계의 영향 평가에 적합하다14.
이 프로토콜은 비표적 오염 혼합물에 대한 반응으로 조기 경고 신호를 감지할 수 있는 비모델 유기체를 사용하여 새로운 생물 모니터링 도구를 구축하는 것을 목표로 합니다. 최상의 결과를 얻기 위해, 모델 종인 C. texanus의 유충이 나타내는 형질을 종합적으로 고려하고 분석에 통합하였다15.
프로토콜
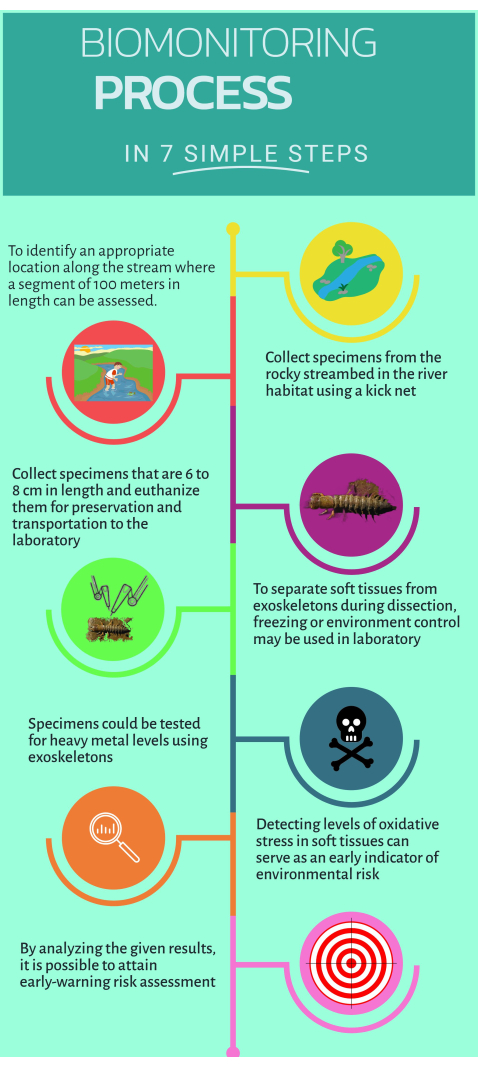
그림 1: 수생 생태계에서 구현하기 위해 비전통적인 바이오모니터 Corydalus texanus를 사용하는 방법에 대한 빠른 단계별 가이드.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 현지조사
- 오염원의 상류 및 하류에 위치한 연구 현장을 식별하여 의심되거나 명백한 영향이 인식되는 곳(즉, 정시 또는 확산 배출)을 식별합니다.
참고: 본 프로토콜에는 4개의 주요 강에 있는 15개의 연구 사이트가 포함되었습니다: 1) 엑스토라즈 강(사이트 PB, EZ, RQ, BC); 2) 에스카넬라-잘판 강 (ES, EN, AH, JL, PI, PA); 3) 아유틀라 강 (AY); 4) 산타 마리아 강 (SM, AT). - 하나 이상의 참조 사이트(경미하거나 영향이 없는 장소)를 검색하고 찾아 연구 사이트로 정의합니다.
참고: 현재 연구 사이트의 경우 BC, ES, SM, AY 및 AT가 참조 사이트로 간주되었습니다. - C. texanus의 개체를 찾을 가능성을 높이는 서식지의 특정 속성을 인식합니다. 여기에는 자갈 기질, 더 가파른 경사를 가진 암석 서식지, 고속 흐름, 산소가 잘 공급되는 물, 높은 캐노피 밀도, 고지대와 저지대의 서식지가 포함됩니다.
- 생물 모니터링을 위한 적절한 서식지를 식별하기 위해 하천의 100m 구역을 둘러싸십시오16.
- 개울 안으로 들어가 샘플을 채취하세요.
- 500μm 크기의 그물을 사용하여 소용돌이, 자갈, 맑은 물, 잔해와 같은 서식지에서 C. texanus 의 개체 6개 이상을 샘플링합니다.
- 물이 흐르는 방향으로 바위를 제거하고 유충을 그물로 옮깁니다.
- 샘플링된 유충으로 킥 그물을 처리하고 임시 주택을 위해 지정된 병으로 옮깁니다. 그물을 조심스럽게 다루고 가장자리를 안쪽으로 접어 유충이 손실되지 않도록 하십시오.
- 캘리퍼를 사용하여 샘플링된 유충의 머리 너비를 측정하여 INSTARS IX에서 XI(6mm에서 10mm 범위 내)를 식별합니다.
- 유충을 개울물이 담긴 병에 30분 동안 담가 제거합니다.
- 명확한 라벨이 붙은 플라스틱 병에 샘플을 넣은 다음 극저온 탱크에서 액체 질소(-75 °C)에 담그면 안락사시킵니다.
- 실험실의 울트라 냉동고에서 -45°C의 온도에서 샘플을 안전하게 운반하고 보관하십시오.
- 폴리에틸렌 병을 사용하여 200mL의 스트림 워터 샘플을 채취하고 1mL의 질산을 첨가한 다음 실험실에서 후속 중금속 정량화를 위해 샘플을 4°C에서 보관합니다.
2. 샘플링된 유충의 해부 및 조직 분리
- 플라스틱 해부 트레이를 얼음 위에 놓고 온도계를 사용하여 4°C가 될 때까지 기다립니다.
- 울트라 프리저에서 샘플을 채취하여 해부 트레이에 올려 놓고 해부를 시작합니다.
- 표적 조직을 선택합니다: 근육, 가지, 신경관, 외골격.
- 세라믹 나이프를 사용하여 머리를 제거하고 조직을 조심스럽게 분리하십시오. 몸을 세로로 열고 양쪽의 아가미를 제거합니다.
- 더 작은 세라믹 나이프를 사용하여 외골격을 분리하고 여분의 조직을 청소합니다. 외골격을 오븐에 넣고 80°C에서 48시간 동안 건조시킵니다.
- 시간이 지나면 추가 분석을 위해 건조 외골격을 보관하십시오.
- 미세분석법(microassay)에 의한 추가 분석을 위해 추운 조건에서 연조직을 계속 세척하십시오.
- 작은 세라믹 나이프를 사용하여 지방에서 연조직을 추출합니다. 동일한 샘플링 포인트의 개체로부터 각 타겟 조직을 분리하고 풀링합니다.
- 각 조직 유형을 2mL 마이크로튜브에 보관하여 공정 내내 저온 상태를 유지합니다.
- 각 타겟 조직을 준비하려면 조직 100mg의 무게를 측정하고 pH가 7.4인 PBS 용액 1mL를 추가합니다. 한 손 조직 티어러를 사용하여 각 조직을 균질화합니다. 일반적으로 연조직은 각각 10초씩 3주기가 필요합니다.
- 1,000 x g 의 원심분리기 시료, 4°C에서 5분 동안 시료 주입. 상층액을 1mL 마이크로튜브로 옮깁니다.
- 바이오마커 미세분석을 수행합니다.
3. 중금속 정량화
- 분석 저울을 사용하여 지정된 발달 단계에서 최소 6개의 표본에서 건조된 외골격 250mg의 무게를 측정합니다.
- 유리 모르타르에서 외골격이 미세하게 가루가 될 때까지 갈아줍니다. 분말 반응 용기에 초순수 질산 250mL를 추가합니다.
- 샘플을 분해하려면 180°C에서 30-45분 동안 분해 마이크로웨이브에 옮깁니다.
알림: 전자레인지 브랜드에 적합한 전자레인지 안전 용기를 사용하여 샘플을 안전하고 효과적으로 가열하십시오. 조직 샘플의 분해 시간은 마이크로파 브랜드에 따라 다르며 30-45분이 소요됩니다. 일부 브랜드는 표준화된 방법을 제공합니다. - 물 시료 45mL를 사용하고 질산 5mL를 첨가하는 EPA3015A 방법에 따라 물 시료에 대한 마이크로파 분해 방법을 수행합니다.
- Hg, Cu, Pb, Zn, Fe, Cr, Cd, Mn, Ba, As를 포함한 유도 결합 플라즈마 발광 분석법(ICP-OES)을 사용하여 분해된 샘플(물 및 조직)의 중금속 및 준금속을 측정합니다.
참고: 아르곤 등급 5와 각 금속 및 준금속의 표준 용액을 사용하여 보정 곡선을 구성합니다.
4. 산화 스트레스 및 바이오마커 평가를 위한 미세분석
- 시약 준비
- 6g의 NaH2PO4 를 1000mL의 초순수와 혼합하여 50mM 일염기성 인산염 완충액을 만듭니다. 2-8 °C의 플라스크에 무기한 보관하십시오.
- 8.1% SDS를 만들려면 450mg의 초순수 5mg에 도데실황산나트륨(SDS)을 녹입니다. 사용 직전에 준비하십시오.
- 초순수 8mL에 트리클로로에탄산(TCA) 2mL를 희석합니다(필요한 경우 새 시약을 준비합니다).
- 100mg의 테트라부틸암모늄(TBA)을 초순수 10mL에 녹입니다(필요한 경우 새 시약을 준비합니다).
- 50 mM PBS pH 7.8을 만들기 위해, 초순수 10 mL에 Na2HPO4 97 mg과 NaH2PO4 59 mg을 용해시킨다. 그런 다음 NaOH를 사용하여 pH를 7.8로 조정하여 증가시키거나 HCl을 감소시킵니다.
- 8mg을 초순수 40μL에 용해시켜 소 카탈라아제 200μg/mL 용액을 만듭니다(필요한 경우 새 시약을 준비합니다).
- 50mM TRIS/5mM 에틸렌디아민테트라아세트산(EDTA) 용액을 만들려면 초순수 45mL에 트리스(하이드록시메틸)아미노메탄(TRIS) 6.05g과 EDTA 0.073g을 추가합니다. HCl로 pH를 7.6으로 조정하고 사용할 때까지 4°C에서 보관하십시오.
- 0.1M 글루타티온 감소(GSH)(45개 중복 샘플의 경우)의 경우 0.0184g의 GSH를 계량하고 10mM HCl 600μL에 용해시킵니다.
- 10mM HCl을 준비하려면 599.5μL의 초순수에 0.5μL의 농축 HCl을 추가합니다.
- 28.5μL의 글루타티온 환원효소를 1.4mL의 0.1M TRIS/HCl 0.5mM EDTA pH 8.0에 추가합니다.
- 1.211g의 TRIS 및 0.0146g의 EDTA를 90mL의 초순수와 혼합하여 pH 8.0에서 0.1M TRIS/HCl 및 0.5mM EDTA 용액을 준비합니다. 필요한 경우 HCl을 추가하여 pH를 조정합니다. 용액은 2-8 °C에서 무기한 저장할 수 있습니다.
- NADPH 0.075g의 무게를 측정하고 1% NaHCO3 1mM EDTA 2.25mL에 첨가합니다.
- 초순수 100mL에 NaHCO3 1g과 EDTA 0.0282g을 혼합하여 1% NaHCO3 및 1mM EDTA 용액을 준비합니다. 용액을 4-8°C에서 결정되지 않은 시간 동안 보관하십시오.
- 2μL의 t-부틸 하이드로퍼옥사이드와 2mL의 초순수를 혼합하여 7mM 용액을 만듭니다. 사용 직전에 혼합하십시오.
- 소 혈청 알부민(BSA) 1g과 초순수 1mL를 혼합하여 1μg/μL 원액을 만듭니다.
- 티오바르비투르산 반응성 물질(TBARS) (지질 과산화, LPO)17
- 1mL 마이크로튜브에 5μL의 조직 상등액을 추가합니다. 45μL의 50mM PBS(신선 및 재고 용액)를 추가합니다.
- 12.5μL의 8.1% SDS(갓 준비)를 추가합니다. 93.5μL의 20% TCA pH 3.5(갓 준비)를 추가합니다.
- 93.5μL의 1% TBA(새로 준비)를 추가합니다. 50.5μL의 초순수를 추가하여 부피를 완성합니다. 튜브의 뚜껑을 닫고 30초 동안 소용돌이칩니다.
- 바늘로 마이크로튜브 뚜껑에 구멍을 뚫고 끓는 물에 10분 동안 배양합니다.
- 튜브를 실온(RT)에서 냉각한 다음 1000 x g 에서 10분 동안 원심분리합니다.
- 96웰 마이크로플레이트의 웰에 150μL의 상등액을 추가하고 마이크로플레이트 분광광도계를 사용하여 530nm에서 흡광도를 측정합니다.
- 과산화물 지질을 정량화하려면 표 1에 설명된 대로 말론디알데히드 bis(디메틸 아세탈)를 사용하여 8점 TBARS 보정 곡선(0-160μM)을 생성합니다. 조직 유형 또는 의심되는 손상 수준에 따라 말론디알데히드(MDA) 곡선을 조정합니다.
- 결과를 nmol MDA eq·mg−1 단백질로 표현합니다.
- 슈퍼옥사이드 디스뮤타제 항산화 효소 미세분석법(SOD)18
- 96웰 플레이트를 사용하십시오. 147μL의 1M TRIS/5mM HCl EDTA pH 8을 두 개의 웰에 블랭크로 추가합니다. 144 μL의 1 M TRIS/5 mM HCl EDTA pH 8을 복제하여 다른 웰에 추가합니다.
- 상층액에서 3μL를 취하여 샘플 웰에 첨가합니다. 접시의 내용물을 여러 번 부드럽게 섞습니다.
- 30초 이내에 각 웰에 3μL의 10mM 피로갈산을 추가합니다. 즉시 부드럽게 섞으십시오.
- 420nm 및 25°C에서 T0(시간 = 0초) 및 T10(시간 = 10초)에서 흡광도를 측정합니다.
- 다음 방정식을 사용하여 샘플에서 피로갈롤 억제 비율을 계산하여 SOD를 결정합니다.
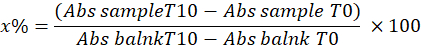
어디
x% = 샘플에서 SOD에 의한 피로갈롤의 산화 비율; 따라서 pyrogallol의 산화는 100 - x%와 같습니다.
참고: 1IU를 고려한 SOD 활성의 계산은 아래와 같이 피로갈롤 산화의 50%를 억제하는 부피입니다.
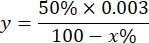
어디
Y = 밀리리터의 시료 부피(파이로갤런의 50% 억제)
50% = 피로갈롤의 억제 비율이 SOD의 1U와 같음
0.003 = 시료의 부피(밀리리터)
100 - x% = 샘플에 의한 피로갈롤의 억제(백분율) - 마지막으로 다음 방정식을 사용하여 SOD 활성을 결정합니다.
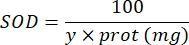
SOD = 단백질 마이크로그램당 국제 단위의 SOD 활성
Y = 파이로갈롤의 50%를 억제하는 시료 부피
100 = 데시리터에서 밀리리터로의 변환 계수.
protein = Bradford의 정량화에서 얻은 단백질 농도는 밀리리터당 마이크로그램으로 표시됩니다. 데시리터당 그램으로 변환하려면 10으로 나누어야 합니다
- 카탈라아제 항산화 효소 미세분석법(CAT)19,20
- 96웰 마이크로플레이트를 사용합니다. 20μL의 샘플 상층액을 웰에 추가합니다(복제 기준).
- 20μL의 신선한 카탈라아제(200μg/mL)를 웰에 표준물질로 추가합니다(복제 기준). 100μL의 50mM PBS pH 7.8을 샘플과 블랭크 웰에 추가합니다.
- 100 μL의 90 mM (30%) H2O2 를 웰에 추가하여 반응을 시작합니다. H2O2 를 첨가 한 후 240 nm에서 2.5 분 동안 15 초마다 흡광도를 읽습니다.
- 다음 방정식을 사용하여 활동을 계산합니다.
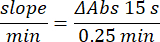
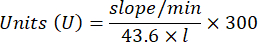
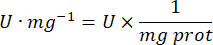
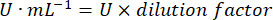
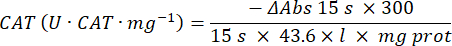
- 글루타티온 과산화효소 미세분석법(GPx)21
- 96웰 마이크로플레이트를 사용합니다.
- 240μL의 0.1M GSH 용액, 1,200μL의 10U/mL GSH-Rd 용액 및 1,200μL의 4mM NADPH를 혼합합니다. 용액을 얼음 위에 보관하십시오.
- 웰에 100μL의 50mM TRIS/HCl 5mM EDTA pH 7.6을 추가합니다. 1 μL의 상등액 샘플을 중복하여 추가합니다. 마이크로플레이트를 두드려 부드럽게 섞습니다.
- 혼합 용액 50μL를 추가하고(단계 4.5.2) 부드럽게 혼합합니다.
- 20 μL의 7 mM t-butyl hydroperoxide 용액을 웰에 추가하여 반응을 시작합니다(16개의 중복된 샘플에서 반응을 시작하는 데 약 15초 소요). 마이크로플레이트를 빠르게 혼합합니다.
- 340nm에서 25°C, 5분 동안 1분 간격으로 흡광도를 모니터링합니다.
- 다음 방정식을 사용하여 GPx 활동을 계산합니다.
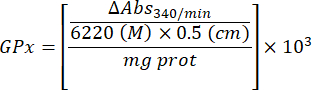
어디
GPx = 단백질 마이크로그램당 분당 밀리몰 단위의 활성
ΔAbs340/min= 델타의 평균 흡광도
103 = 몰에서 밀리몰로 변환
- mg prot = 마이크로리터당 마이크로그램으로 표시되는 Bradford의 결정에서 나온 단백질 농도
- Bradford의 분석에 의한 단백질 정량화22
- 표 2와 같이 원액 1 μg/μL에서 설정된 소 혈청 알부민(BSA) 용액에서 표준 곡선을 수행합니다.
- 96웰 마이크로플레이트를 사용합니다. 시료와 표준물질 웰에 190μL의 Bradford 시약을 추가합니다.
- 중복을 통해 표준 웰에 10μL의 BSA를 추가합니다. 10μL의 상등액을 복제하여 샘플 웰에 추가합니다.
- 피펫 팁과 부드럽게 섞습니다.
- 595nm에서 흡광도를 읽습니다. 표준 곡선으로 단백질 농도를 정량화합니다.
결과
연구 결과에 따르면 그림 2에서 알 수 있듯이 중금속, 특히 알루미늄(Al), 철(Fe) 및 아연(Zn)이 환경에 해로운 영향을 미친다는 사실이 밝혀졌습니다. 모든 현장에서 수집된 조직 및 물 샘플에서 높은 수준의 중금속이 검출된 것은 바람직하지 않은 결과를 초래했습니다. 이상치(Bioaccumulation Factor, BAF)가 600으로 발견되었으며, 특히 엑스토라즈 강(Extoraz Ri...
토론
C. texanus의 사용이 평가에 최적이지만 사용 및 수집의 여러 측면을 고려해야 합니다. 선택한 연구 장소는 불리한 기상 조건, 지리적으로 접근하기 어려운 것, 높은 건조 수준 또는 선택한 지역의 불충분한 보안 프로토콜과 같은 여러 요인으로 인해 어려운 것으로 판명되었습니다. 명시된 제약 조건과 한계는 종종 현장 조사를 수행할 때 문제를 야기할 수 있습니다. ?...
공개
저자들은 그들의 연구에서 어떠한 이해 상충도 드러내지 않았다.
감사의 말
저자는 연구 노력을 크게 촉진한 FONINS P 1931 보조금을 제공한 CONAHCyT에 진심으로 감사를 표하고 싶습니다. 또한 SIP 프로젝트 보조금(20200577)을 통해 귀중한 지원을 제공한 Instituto Politécnico Nacional의 Secretaría de Investigación y Posgrado에 감사를 표했습니다. 또한, 제1저자는 CONAHCyT가 수여한 후한 대학원 장학금을 통해 팀이 현장 학습을 실시하고 필수 데이터를 수집할 수 있었다는 점에 감사를 표하고자 합니다. 마지막으로, 저자는 실험실에서 María Teresa García Camacho의 귀중한 도움에 감사를 표하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
참고문헌
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86 (2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474 (2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1 (2017).
- . Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018)
- Cao, C. -. Q., Liu, Z., Chen, S. -. Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. . Stream Ecology: Structure and Function of Running Waters. , (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209 (2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. . Tropical Stream Conservation. Tropical Stream Ecology. , (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유