需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
Hellgrammite 作为地表水和环境健康评估的非常规生物监测器
摘要
该协议描述了使用生物标志物来及早检测对水生生态系统的有害影响。生物标志物与哨兵性状密切相关,它们的变化有助于检测早期预警损伤。
摘要
来自 Corydalus 属的 dobsonflies 幼虫,通常被称为 Hellgrammites,其特点是体型显著、出现范围广、不成熟期延长,可持续长达一年。众所周知,Hellgrammites 对污染和栖息地结构影响表现出敏感性。鉴于这些独特的特征,使用 Corydalus texanus 幼虫非常适合作为可靠的生物监测剂来评估水生生态系统的生态完整性。该协议旨在为 C. texanus 评估提供必要的工具,并通过案例研究证明其疗效。研究结果具有实际意义,表明 C. texanus 幼虫对采矿污染表现出早期预警反应,生物积累了大量的重金属,如 Zn、Fe 和 Al。 C. texanus 种群的存在与否可以作为识别与生态系统健康相关的潜在问题的有用指标。这种非常规的方法显示了受采矿影响的场地污染的早期预警,凸显了及时采取行动保护环境的必要性。鉴于它们的独特特性,强烈建议使用 C. texanus 幼虫作为可靠的非常规生物指标。
引言
Hellgramites 是来自 Megaloptera 目 (Latreille, 1802) 的昆虫幼虫,在成虫阶段被命名为 dobsonflies 或鱼蝇。这组来自水生生态系统的顶级捕食性昆虫幼虫的多样性较低但分布广泛1.Hellgramite 物种出现在定义明确的生物地理区域;因此,没有高分类学知识的物种相对容易识别。值得注意的是,Corydalidae 幼虫拥有 Megaloptera 目中最突出的物种(体长 20-90 毫米)2,使地狱石肉眼可见。
Hellgrammites 作为捕食者在水生生态系统中发挥着至关重要的作用,由于大咀嚼物表示它们令人印象深刻的捕食性形状,因此具有强大的存在感。背腹扁平的身体也与沿身体的 7-8 对细丝鳃相连,每侧有 6 个茎的头囊使地狱螨成为昆虫学家和粉丝的迷人生物3。Corydalidae 的成虫由于其突出的体型而给人们带来惊喜并给人留下印象;但是,它们是完全无害的。值得注意的是,hellgrammites 有能力在幼虫阶段在水生环境中持续很长时间。
hellgrammites 的表型特征允许一个特殊的机会来突出它们在水生生态系统中的作用;尽管如此,它们的指标潜力是水生生态学家最想要的功能。在水生生态系统中,人们对其生物指示剂潜力的广泛了解得到了强调,因为它们的出现与栖息地的良好健康状况有关,因为它们不耐受地表水中的有机污染 4,5,6,7,8。
大多数 Corydalidae megalopterans 生活在高速流水中,以鹅卵石和鹅卵石为主的溪流和基质,但 hellgrammites 也出现在带有障碍物和沙子基质的低坡度溪流中,以及湖泊3、9、10 等 lentic 栖息地。它们的广泛出现范围反映了顶级捕食者的关键特征以及它们在有效生活史策略所针对的多个栖息地定居的能力11。Hellgramites 将他们的特征与水生生态系统的动态联系起来;因此,诸如适应气孔呼吸(除了它们的气管鳃的腹侧簇)等策略是 Corydalidae 策略的适当10。
Hellgrammites 栖息在特定的生态系统中,对偏离既定模式表现出快速反应,因此可以作为早期预警系统7。这些野生动物生物的反应可以用作评估污染对水生生态系统影响的宝贵工具,特别是在非目标污染物混合物的情况下。由于化学品的个体毒性,生态系统中已经认识到对生物体的一些有害影响,但应确定污染混合物的影响。来自地狱螨虫的早期预警反应可能通过参考污染物混合物的影响,甚至当污染物的个别影响识别无可观察效应浓度 (NOEC) 时,从而有可能识别有害影响12。
几种模式生物已被用于实验性急性和慢性测试;然而,它们是在受控条件下培养和维持的 13。受控条件使他们无法识别他们所接触的几种污染物的非目标影响。此外,由于污染物混合物的复杂性,NOEC 经常得到认可。出于这个原因,在过去的几十年里,具有非目标效应的非模式本地物种被识别为筛选系统,这对进行生态毒理学研究至关重要14。因此,地狱螨似乎能够评估污染对水生生态系统的有害影响。非模式生物的生物学、遗传学和生理学等特征使非模式生物适合对生态系统进行影响评估14.
该协议旨在使用非模式生物建立一种新型生物监测工具,该工具可以检测响应非目标污染混合物的早期预警信号。为了达到最佳结果,模型物种 C. texanus 的幼虫所表现出的性状已被全面考虑并整合到分析中15.
研究方案
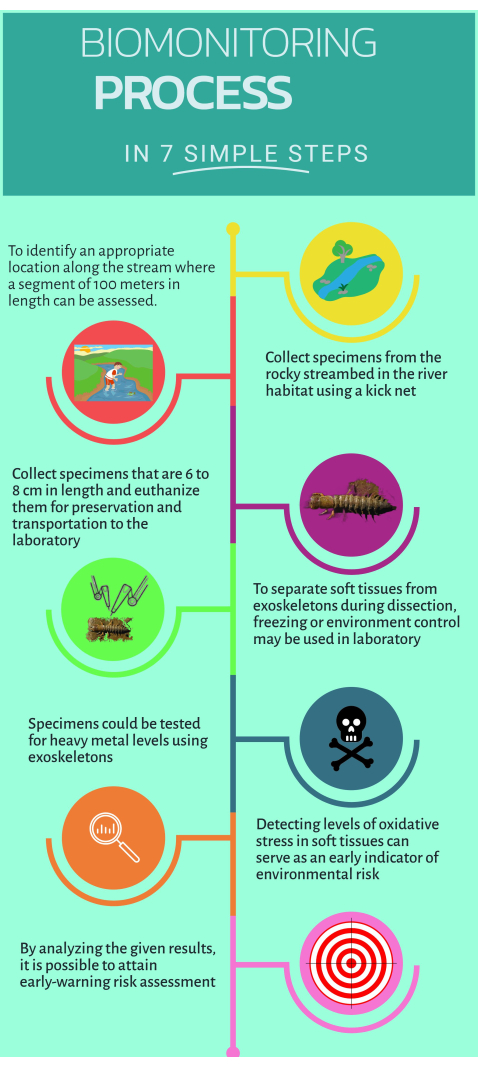
图 1:有关如何使用非常规生物监测器 Corydalus texanus 在水生生态系统中实施的快速分步指南。请单击此处查看此图的较大版本。
1. 实地考察
- 确定位于污染源上游和下游的研究地点,其中已识别出可疑或明显的影响(即准时或分散排放)。
注意:本方案包括四条主要河流的 15 个研究地点:1) Extoraz 河(地点 PB、EZ、RQ、BC);2) 埃斯卡内拉-贾潘河(ES、EN、AH、JL、PI、PA);3) 大城河 (AY);4) 圣玛丽亚河 (SM, AT)。 - 搜索并找到至少一个参考地点(影响较小或没有影响的地方)并将其定义为研究地点。
注:对于当前的研究地点,BC、ES、SM、AY 和 AT 被视为参考位点。 - 识别栖息地的某些属性,这些属性会增加找到 C. texanus 个体的可能性。这些包括砾石基质、坡度更陡峭的岩石栖息地、高速流动、含氧量充足的水域、高树冠密度以及高地和低地的栖息地。
- 封闭溪流的 100 m 部分,以确定适合生物监测的栖息地16.
- 进入溪流中收集样本。
- 使用网孔尺寸为 500 μm 的踢网,在溪流、鹅卵石、清澈的海水和碎屑等栖息地中对至少 6 个 C. texanus 个体进行采样。
- 沿水流方向移走岩石,将幼虫转移到网中。
- 用取样的幼虫处理踢网,并将它们转移到指定的瓶子中作为临时住所。小心处理网,并将边缘向内折叠,以防止幼虫损失。
- 使用卡尺测量采样幼虫的头宽,以识别龄期 IX 至 XI(在 6 毫米至 10 毫米的范围内)。
- 通过将幼虫浸入装有溪水的瓶子中 30 分钟来净化幼虫。
- 将样品放入贴有清晰标签的塑料瓶中,然后通过浸入低温罐中的液氮 (-75 °C) 中对其进行安乐死。
- 将样品在 -45 °C 下安全地运输并储存在实验室的超低温冰箱中。
- 使用聚乙烯瓶,取 200 mL 的溪水样品,加入 1 mL 硝酸,并将样品储存在 4 °C 下,以便随后在实验室中进行重金属定量。
2. 解剖取样幼虫和组织分离
- 将塑料解剖盘放在冰上,等待达到 4 °C,使用温度计检查。
- 从超低温冰箱中取出样品,放在解剖盘上开始解剖。
- 选择目标组织:肌肉、分支、神经管和外骨骼。
- 用陶瓷刀取下头部并小心分离组织。纵向打开主体并去除每侧的鳃。
- 使用较小的陶瓷刀分离外骨骼并清洁多余的组织。将外骨骼放入烤箱中,并在 80 °C 下干燥 48 小时。
- 时间到期后,储存干燥的外骨骼以备进一步分析。
- 在寒冷条件下保持清洁软组织,以便通过微量分析进行进一步分析。
- 使用小陶瓷刀从脂肪中提取软组织。从来自同一采样点的个体中分离和合并每个目标组织。
- 将每种组织类型储存在 2 mL 微管中,在整个过程中保持低温条件。
- 要制备每个靶组织,称取 100 mg 组织并加入 1 mL pH 值为 7.4 的 PBS 溶液。使用单手组织撕裂器对每个组织进行匀浆。通常,软组织需要三个周期,每个周期 10 秒。
- 将样品在 4 °C 下以 1,000 x g 离心 5 分钟。 将上清液转移至 1 mL 微管中。
- 进行生物标志物微量检测。
3. 重金属定量
- 使用分析天平称取来自指定发育阶段的至少 6 个标本的 250 毫克干燥外骨骼。
- 在玻璃砂浆中研磨外骨骼,直到它们变成细粉。向粉末反应容器中加入 250 mL 超纯硝酸。
- 要消化样品,请将它们转移到 180 °C 的消化微波炉中 30-45 分钟。
注:使用适合微波品牌的微波炉安全容器,以安全有效地加热样品。组织样品的消解时间因微波品牌而异,需要 30-45 分钟。一些品牌提供标准化方法。 - 按照 EPA3015A 方法对水样品进行微波消解方法,使用 45 mL 水样并添加 5 mL 硝酸。
- 使用电感耦合等离子体发射光谱 (ICP-OES) 测量消解样品(水和组织)中的重金属和准金属,包括 Hg、Cu、Pb、Zn、Fe、Cr、Cd、Mn、Ba 和 As。
注:使用 5 级氩气以及每种金属和准金属的标准溶液构建校准曲线。
4. 用于评估氧化应激和生物标志物的微量测定
- 制备试剂
- 将 6 g NaH2PO4 与 1000 mL 超纯水混合,制成 50 mM 磷酸二氢盐缓冲液。在 2-8 °C 的培养瓶中无限期储存。
- 要制备 8.1% SDS,请将 450 mg 十二烷基硫酸钠 (SDS) 溶解在 5 mL 超纯水中。使用前准备。
- 在 8 mL 超纯水中稀释 2 mL 三氯乙酸 (TCA)(需要时准备新鲜试剂)。
- 将 100 mg 四丁基铵 (TBA) 溶解在 10 mL 超纯水中(需要时准备新鲜试剂)。
- 要制备 50 mM PBS pH 7.8,将 97 mg Na2HPO4 和 59 mg NaH2PO4 溶解在 10 mL 超纯水中。然后,使用 NaOH 增加 pH 值或降低 HCl 将 pH 值调节至 7.8。
- 将 8 mg 牛过氧化氢酶溶解在 40 μL 超纯水中,制成 200 μg/mL 的牛过氧化氢酶溶液(需要时准备新鲜试剂)。
- 要制备 50 mM TRIS/5 mM 乙二胺四乙酸 (EDTA) 溶液,将 6.05 g 三(羟甲基)氨基甲烷 (TRIS) 和 0.073 g EDTA 添加到 45 mL 超纯水中。用 HCl 将 pH 调节至 7.6 并储存在 4 °C 直至使用。
- 对于 0.1 M 还原型谷胱甘肽 (GSH)(对于 45 个重复样品),称取 0.0184 g GSH 并将其溶解在 600 μL 的 10 mM HCl 中。
- 要制备 10 mM HCl,向 599.5 μL 超纯水中加入 0.5 μL 浓 HCl。
- 将 28.5 μL 谷胱甘肽还原酶加入 1.4 mL 0.1 M TRIS/HCl 0.5 mM EDTA pH 8.0 中。
- 将 1.211 g TRIS 和 0.0146 g EDTA 与 90 mL 超纯水混合,制备 pH 值为 8.0 的 0.1 M TRIS/HCl 和 0.5 mM EDTA 溶液。如果需要,添加 HCl 以调节 pH 值。该溶液可在 2-8 °C 下无限期储存。
- 称量 0.075 g NADPH 并将其加入 2.25 mL 1% NaHCO3 1 mM EDTA 中。
- 将 1 g NaHCO3 和 0.0282 g EDTA 与 100 mL 超纯水混合,制备 1% NaHCO 3 和 1 mM EDTA 溶液。将溶液在 4-8 °C 下储存不确定的时间。
- 将 2 μL 过氧化氢叔丁酯与 2 mL 超纯水混合,制成 7 mM 溶液。使用前立即混合。
- 将 1 g 牛血清白蛋白 (BSA) 与 1 mL 超纯水混合,制成 1 μg/μL 储备液。
- 硫代巴比妥酸反应物质 (TBARS)(脂质过氧化,LPO)17
- 向 1 mL 微管中加入 5 μL 组织上清液。加入 45 μL 50 mM PBS(新鲜和储备溶液)。
- 加入 12.5 μL 8.1% SDS(新鲜制备)。添加 93.5 μL 的 20% TCA pH 3.5(新鲜制备)。
- 添加 93.5 μL 的 1% TBA(新鲜制备)。加入 50.5 μL 超纯水完成体积。盖上管盖并涡旋 30 秒。
- 用针刺穿微管盖,在沸水中孵育 10 分钟。
- 在室温 (RT) 下冷却试管,然后以 1000 x g 离心 10 分钟。
- 将 150 μL 上清液添加到 96 孔微孔板的孔中,并使用微孔板分光光度计测量 530 nm 处的吸光度。
- 为了定量脂质过氧化物,使用丙二醛双(二甲基缩醛)创建一条 8 点 TBARS 校准曲线 (0-160 μM),如 表 1 所述。根据组织类型或可疑损伤程度调整丙二醛 (MDA) 曲线。
- 将结果表示为 nmol MDA eq·mg-1 蛋白。
- 超氧化物歧化酶抗氧化酶微量测定 (SOD)18
- 使用 96 孔板。将 147 μL 的 1 M TRIS/5 mM HCl EDTA pH 8 作为空白加入两个孔中。将 144 μL 的 1 M TRIS/5 mM HCl EDTA pH 8 加入其他孔中,一式两份。
- 从上清液中取 3 μL 并加入样品孔中。轻轻混合盘子上的内容物数次。
- 在 30 秒内向每个孔中加入 3 μL 10 mM 焦没食子酸。立即轻轻混合。
- 在 T0 (时间 = 0 s) 和 T10 (时间 = 10 s)、420 nm 和 25 °C 处测量吸光度。
- 使用以下公式计算样品中邻苯三酚抑制的百分比来确定 SOD:
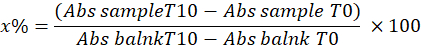
哪里
x% = 样品中 SOD 氧化邻苯三酚的百分比;因此,邻苯三酚的氧化等于 100 - x%
注:考虑 1 IU 的 SOD 活性的计算是抑制 50% 邻苯三酚氧化的体积,如下所述:
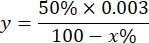
哪里
y = 毫升样品体积(抑制 50% 的焦加仑)
50% = 邻苯三酚的抑制百分比等于 1U 的 SOD
0.003 = 样品的体积(毫升)
100 - x% = 样品对邻苯三酚的抑制百分比 - 最后,用以下公式确定 SOD 活性:
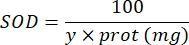
SOD = 每微克蛋白质的 SOD 活性(以国际单位为单位)
Y = 抑制 50% 邻苯三酚的样品体积
100 = 从分升到毫升的转换系数。
蛋白质 = 从 Bradford 定量获得的蛋白质浓度以微克/毫升表示;必须除以 10 才能转换为克/分升
- 过氧化氢酶抗氧化酶微量测定 (CAT)19,20
- 使用 96 孔微孔板。向孔中加入 20 μL 样品上清液(一式两份)。
- 将 20 μL 新鲜过氧化氢酶 (200 μg/mL) 作为标准品加入孔中(一式两份)。向样品和空白孔中加入 100 μL 50 mM PBS pH 7.8。
- 向孔中加入 100 μL 的 90 mM (30%) H2O2 以开始反应。加入 H2O2 后,在 240 nm 处每 15 秒读取一次吸光度 2.5 分钟。
- 使用以下公式计算活动:
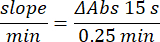
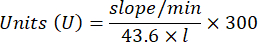
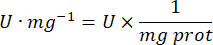
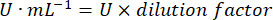
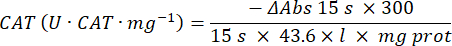
- 谷胱甘肽过氧化物酶微量测定 (GPx)21
- 使用 96 孔微孔板。
- 混合 240 μL 0.1 M GSH 溶液、1 200 μL 10 U/mL GSH-Rd 溶液和 1 200 μL 4 mM NADPH。将溶液放在冰上。
- 向孔中加入 100 μL 50 mM TRIS/HCl 5 mM EDTA,pH 7.6。加入 1 μL 上清液样品,一式两份。轻敲微孔板并轻轻混合。
- 加入 50 μL 混合溶液(步骤 4.5.2)并轻轻混合。
- 将 20 μL 的 7 mM 叔丁基过氧化氢溶液加入孔中以开始反应(在 16 个重复样品中开始反应大约需要 15 秒)。快速混合微孔板。
- 在 25 °C 下,在 340 nm 下每隔 1 分钟监测吸光度 5 分钟。
- 用以下公式计算 GPx 活性:
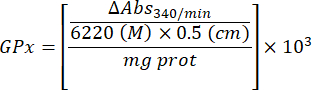
哪里
GPx = 每微克蛋白质每分钟的活性(以毫摩尔为单位)
ΔAbs340/min = 以 delta 为单位的平均吸光度
103 = 摩尔到毫摩尔的转化率
- mg prot = 来自 Bradford 测定的蛋白质浓度,以微克/微升表示
- 通过 Bradford 分析进行蛋白质定量22
- 从牛血清白蛋白 (BSA) 溶液中绘制标准曲线,从 1 μg/μL 储备液中设定,如 表 2 所示。
- 使用 96 孔微孔板。在样品和标准孔中加入 190 μL Bradford 试剂。
- 在标准孔中加入 10 μL BSA,一式两份。向样品孔中加入 10 μL 上清液,一式两份。
- 用移液器吸头轻轻混合。
- 读取 595 nm 处的吸光度。用标准曲线定量蛋白质浓度。
结果
研究结果表明,重金属,特别是铝 (Al)、铁 (Fe) 和锌 (Zn),对环境有不利影响, 如图 2 所示。从所有地点收集的组织和水样本中检测到高水平的重金属,导致了不利的结果。检测到异常值,生物累积因子 (BAF) 为 600,特别是在采矿密集型地区,如 Extoraz 河( 图 3 所示的地点 PB、EP、RQ 和 BC)。值得注意的是,在一些?...
讨论
尽管使用 C. texanus 是评估的最佳选择,但有必要考虑其使用和收集的几个方面。由于不利的天气条件、地理交通不便、高度干旱或选定地区的安全协议不足等多种因素,选定的研究地点被证明具有挑战性。在进行实地考察时,规定的约束和限制通常会带来挑战。在评估特定区域时,尤其是热带溪流中的区域,获取样本可能具有挑战性。尽管为此目的遵守了 Barbour
披露声明
作者披露了他们的工作中不存在利益冲突。
致谢
作者衷心感谢 CONAHCyT 提供 FONINS P 1931 资助,这极大地促进了他们的研究工作。他们还将感谢国家政治研究所 (Instituto Politécnico Nacional) 的 Secretaría de Investigación y Posgrado 通过 SIP 项目赠款 (20200577) 提供的宝贵支持。此外,第一作者希望感谢 CONAHCyT 提供的慷慨研究生奖学金,这使该团队能够进行实地考察并收集重要数据。最后,作者要对 María Teresa García Camacho 在实验室提供的宝贵帮助表示感谢,没有她,这个项目是不可能的。
材料
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
参考文献
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86 (2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474 (2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1 (2017).
- . Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018)
- Cao, C. -. Q., Liu, Z., Chen, S. -. Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. . Stream Ecology: Structure and Function of Running Waters. , (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209 (2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. . Tropical Stream Conservation. Tropical Stream Ecology. , (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。