Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Hellgrammite в качестве нетрадиционного биомонитора для оценки состояния поверхностных вод и окружающей среды
В этой статье
Резюме
В настоящем протоколе описывается использование биомаркеров для раннего выявления вредного воздействия на водные экосистемы. Биомаркеры тесно связаны с сигнальными признаками, и их изменения помогают выявлять раннее предупреждение о повреждениях.
Аннотация
Личинки добсонфлаев из рода Corydalus, широко известные как Hellgrammites, характеризуются заметным размером, широким диапазоном встречаемости и длительным периодом незрелости, который может длиться до одного года. Известно, что хеллграммиты проявляют чувствительность к загрязнению и воздействию на структуру среды обитания. Учитывая эти уникальные особенности, использование личинок Corydalus texanus очень подходит в качестве надежных агентов биомониторинга для оценки экологической целостности водных экосистем. Этот протокол направлен на предоставление необходимых инструментов для оценки C. texanus и демонстрацию их эффективности на примере конкретного случая. Результаты исследований имеют практическое значение, указывая на то, что личинки C. texanus демонстрируют раннюю реакцию на загрязнение горнодобывающей промышленностью, биоаккумулируя большое количество тяжелых металлов, таких как Zn, Fe и Al. Наличие или отсутствие популяций C. texanus может служить полезным индикатором для выявления потенциальных проблем, связанных со здоровьем экосистемы. Нетрадиционный подход показал раннее предупреждение о загрязнении на участках, пострадавших от добычи полезных ископаемых, что подчеркивает необходимость своевременных действий по защите окружающей среды. Учитывая их уникальные особенности, использование личинок C. texanus настоятельно рекомендуется в качестве надежного нетрадиционного биоиндикатора.
Введение
Хеллграмиты — личинки насекомых из отряда Megaloptera (Latreille, 1802), называемые добсонфлаями или рыбными мухами во взрослой стадии. Низкое разнообразие, но широкое распространение характеризует эту группу личинок насекомых-хищников из водных экосистем1. Виды хеллграмитов встречаются в четко определенных биогеографических регионах; Таким образом, относительно легко идентифицировать виды без высоких таксономических знаний. Примечательно, что личинки Corydalidae обладают наиболее заметными видами из отряда Megaloptera (длина тела 20-90 мм)2, что делает хеллграмит видимым невооруженным глазом.
Хеллграммиты играют решающую роль в водных экосистемах в качестве хищников, обладая мощным присутствием благодаря крупным жевательным резинкам, указывающим на их впечатляющую хищную форму. Дорсовентрально уплощенное тело также соединяется с 7-8 парами нитевидных жабр вдоль тела, а головная капсула с шестью стемматами с каждой стороны делает хеллграммитов увлекательными организмами для энтомологов и любителей3. Взрослые особи Corydalidae удивляют и создают впечатление у людей благодаря своим выдающимся размерам; Тем не менее, они совершенно безвредны. Примечательно, что хеллграммиты обладают способностью сохраняться в водной среде в своей личиночной стадии в течение значительного времени.
Фенотипические особенности хеллграммитов дают особый шанс подчеркнуть их роль в водных экосистемах; Тем не менее, их индикаторный потенциал является наиболее востребованным признаком для водных экологов. Обширные знания об их биоиндикаторном потенциале выделяются в водных экосистемах, поскольку их появление связано с хорошими санитарными условиями в их среде обитания из-за их непереносимости органического загрязнения в поверхностных водах 4,5,6,7,8.
Большинство мегалоптерных Corydalidae обитают в скоростных проточных водах в виде перекатов и субстратов с преобладанием булыжника и гальки, но хеллграммиты также встречаются в низкоградиентных ручьях с корягами и песчаными субстратами, а также в лентических местообитаниях, таких как озера 3,9,10. Их широкий диапазон встречаемости отражает важнейшие черты высшего хищника и их способность колонизировать несколько мест обитания, на которые нацелены их эффективные стратегии жизненного цикла. Хеллграмиты связывали свои черты с динамикой водных экосистем; таким образом, такие стратегии, как адаптация к воздушному дыханию со стороны дыхальцев (в дополнение к их вентральным пучкам трахейных жабр), являются правильнымидля стратегий Corydalidae.
Хеллграммиты населяют определенные экосистемы и демонстрируют быструю реакцию на отклонения от установленных шаблонов, тем самым выступая вкачестве системы раннего предупреждения. Реакции этих организмов диких животных могут быть использованы в качестве ценного инструмента для оценки воздействия загрязнения на водные экосистемы, особенно в случае нецелевых смесей загрязнителей. Некоторые вредные воздействия на живые организмы были признаны в экосистемах из-за индивидуальной токсичности химических веществ, но воздействие смесей загрязняющих веществ должно быть определено. Ранние предупреждения от хеллграммитов могут позволить выявить вредные последствия путем ссылки на воздействие смеси загрязнителей или даже в тех случаях, когда отдельные воздействия загрязнителей распознают концентрацию без наблюдаемого воздействия (NOEC)12.
Несколько модельных организмов были использованы для экспериментальных острых и хронических испытаний; Тем не менее, они культивируются и поддерживаются в контролируемых условиях13. Контролируемые условия не позволяют им идентифицировать нецелевые эффекты нескольких загрязнителей, воздействию которых они подвергаются. Кроме того, NOEC часто признается из-за сложности смеси загрязняющих веществ. По этой причине в последние десятилетия были признаны немодельные аборигенные виды с нецелевыми эффектами для скрининговых систем, которые имеют важное значение для проведения экотоксикологическихисследований. Следовательно, хеллграммиты, по-видимому, способны оценивать вредные последствия загрязнения водных экосистем. Такие признаки, как биология, генетика и физиология, среди прочих, делают немодельные организмы пригодными для оценки воздействия наэкосистемы.
Этот протокол направлен на создание нового инструмента биомониторинга с использованием немодельного организма, который может обнаруживать сигналы раннего предупреждения в ответ на нецелевые смеси загрязнения. Для достижения наилучших результатов признаки, проявляемые личинками модельного вида C. texanus, были всесторонне рассмотрены и интегрированыв анализ.
Access restricted. Please log in or start a trial to view this content.
протокол
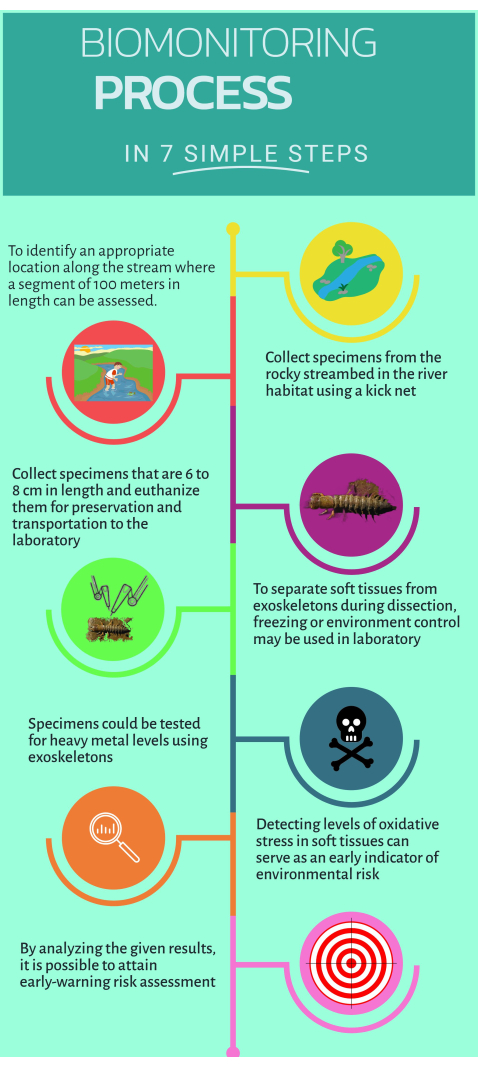
Рисунок 1: Краткое пошаговое руководство по использованию нетрадиционного биомонитора Corydalus texanus для внедрения в водных экосистемах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Полевая работа
- Определите исследуемые участки, расположенные выше и ниже по течению от источника загрязнения, где признаются предполагаемые или очевидные воздействия (т.е. точечные или диффузные выбросы).
ПРИМЕЧАНИЕ: Настоящий протокол включает 15 исследовательских участков на четырех основных реках: 1) река Экстораз (участки PB, EZ, RQ, BC); 2) река Эсканела-Жалпан (ES, EN, AH, JL, PI, PA); 3) река Аютла (AY); и 4) река Санта-Мария (SM, AT). - Найдите и найдите по крайней мере одно опорное место (место с незначительными воздействиями или без них) и определите его как место для исследования.
ПРИМЕЧАНИЕ: Для текущих исследовательских площадок BC, ES, SM, AY и AT рассматривались в качестве эталонных площадок. - Признайте определенные атрибуты местообитаний, повышающие вероятность нахождения особей C. texanus. К ним относятся гравийный субстрат, скалистые места обитания с более крутыми уклонами, высокоскоростные течения, хорошо насыщенные кислородом воды, высокая плотность растительного покрова, а также места обитания в высокогорьях и низменностях.
- Огораживание участка ручья длиной 100 м для определения подходящих мест обитания для биомониторинга16.
- Попадите внутрь потока, чтобы собрать образцы.
- Возьмите образцы не менее шести особей C. texanus в таких местах обитания, как перекаты, галька, прозрачные воды и мусор, используя сачок с размером ячеи 500 мкм.
- Уберите камни по ходу течения воды и перенесите личинок в сетку.
- Возьмите в руки сачок с отобранными личинками и переложите их в предназначенные для этого бутылки для временного размещения. Обращайтесь с сеткой с осторожностью и загибайте края внутрь, чтобы предотвратить потерю личинок.
- Измерьте ширину головы отобранных личинок с помощью штангенциркуля для определения возрастов IX - XI (в диапазоне от 6 мм до 10 мм).
- Очистите личинок, погрузив их в бутылку с водой для струи на 30 минут.
- Поместите образцы в пластиковые бутылки с четкой маркировкой, а затем усыпьте их путем погружения в жидкий азот (-75 °C) в криогенный резервуар.
- Безопасно транспортируйте и храните образцы при температуре -45 °C в ультраморозильной камере в лаборатории.
- С помощью полиэтиленовой бутылки возьмите пробу воды в потоке объемом 200 мл, добавьте 1 мл азотной кислоты и храните образец при температуре 4 °C для последующего количественного определения тяжелых металлов в лаборатории.
2. Вскрытие отобранных личинок и отделение тканей
- Поставьте пластиковый лоток для препарирования на лед и подождите, пока он достигнет 4 °C, используя термометр для проверки.
- Возьмите образцы из ультраморозильной камеры и положите их на лоток для вскрытия, чтобы начать препарирование.
- Выберите целевые ткани: мышцы, ветви, нервную трубку и экзоскелет.
- С помощью керамического ножа удалите головку и аккуратно отделите ткани. Раскройте корпус в продольном направлении и удалите жабры с каждой стороны.
- Отделите экзоскелеты с помощью керамического ножа меньшего размера и очистите лишнюю ткань. Поместите экзоскелеты в духовку и высушите их при температуре 80 °C в течение 48 часов.
- По истечении отведенного времени храните сухие экзоскелеты для дальнейшего анализа.
- Продолжайте очищать мягкие ткани в холодных условиях для дальнейшего анализа с помощью микроанализов.
- С помощью небольшого керамического ножа можно извлечь мягкие ткани из жира. Отделите и объедините каждую целевую ткань у особей из одной и той же точки отбора проб.
- Храните каждый тип ткани в микропробирке объемом 2 мл, поддерживая холодные условия на протяжении всего процесса.
- Для приготовления каждой целевой ткани взвесьте 100 мг ткани и добавьте 1 мл раствора PBS с pH 7,4. Используйте одноручный разрыв тканей для гомогенизации каждой ткани. Как правило, для мягких тканей требуется три цикла по 10 с каждый.
- Центрифуга отбирает пробу при давлении 1 000 x g в течение 5 мин при 4 °C. Перенесите надосадочную жидкость в микропробирку объемом 1 мл.
- Проведение микроанализов на биомаркеры.
3. Количественное определение тяжелых металлов
- Взвесьте 250 мг высушенных экзоскелетов не менее чем из шести образцов на указанной стадии развития с помощью аналитических весов.
- Измельчите экзоскелеты в стеклянной ступке до тех пор, пока они не станут мелко порошкообразными. Добавьте 250 мл сверхчистой азотной кислоты в порошковые реакционные сосуды.
- Чтобы переварить образцы, перенесите их в микроволновую печь для сбраживания при температуре 180 °C на 30-45 минут.
ПРИМЕЧАНИЕ: Используйте подходящий контейнер, пригодный для использования в микроволновой печи, для безопасного и эффективного нагрева образцов. Время разложения образцов тканей варьируется в зависимости от марки микроволновой печи, занимая 30-45 минут. Некоторые бренды предлагают стандартизированные методы. - Выполните метод микроволнового сбраживания проб воды по EPA3015A методу, используя 45 мл пробы воды и добавив 5 мл азотной кислоты.
- Измерение содержания тяжелых металлов и металлоидов в переваренных образцах (воде и тканях) с помощью оптической эмиссионной спектроскопии с индуктивно связанной плазмой (ICP-OES), включая Hg, Cu, Pb, Zn, Fe, Cr, Cd, Mn, Ba и As.
ПРИМЕЧАНИЕ: Используйте аргон класса 5 и стандартные растворы каждого металла и металлоида для построения калибровочной кривой.
4. Микроанализы для оценки окислительного стресса и биомаркеров
- Приготовление реагентов
- Смешайте 6 г2PO4 со 1000 мл сверхчистой воды, чтобы получить 50 мМ одноосновного фосфатного буфера. Хранить в колбе при температуре 2-8 °C неопределенный срок.
- Чтобы получить 8,1% SDS, растворите 450 мг додецилсульфата натрия (SDS) в 5 мл сверхчистой воды. Подготовьте непосредственно перед использованием.
- Разведите 2 мл трихлорэтановой кислоты (ТСА) в 8 мл ультрачистой воды (при необходимости приготовьте свежий реагент).
- Растворите 100 мг тетрабутиламмония (ТБК) в 10 мл ультрачистой воды (при необходимости приготовьте свежий реагент).
- Чтобы получить 50 мМ PBS pH 7,8, растворите 97 мг Na2HPO4 и 59 мг2PO4 в 10 мл сверхчистой воды. Затем отрегулируйте pH до 7,8, используя NaOH для повышения или HCl для снижения.
- Приготовьте 200 г/мл раствора бычьей каталазы, растворив 8 мг в 40 мл сверхчистой воды (при необходимости приготовьте свежий реагент).
- Чтобы приготовить 50 мМ раствор этилендиаминтетрауксусной кислоты (ЭДТА) 50 мМ, добавьте 6,05 г трис (гидроксиметил)аминометана (TRIS) и 0,073 г ЭДТА в 45 мл сверхчистой воды. Отрегулируйте pH до 7,6 с помощью HCl и храните при температуре 4 °C до использования.
- Для 0,1 М глутатиона восстановленного (GSH) (для 45 дублированных образцов) весят 0,0184 г GSH и растворяют его в 600 мкл 10 мМ HCl.
- Для приготовления 10 мМ HCl добавьте 0,5 мкл концентрированной HCl на 599,5 мкл сверхчистой воды.
- Добавьте 28,5 мкл глутатионредуктазы к 1,4 мл 0,1 М TRIS/HCl 0,5 мМ ЭДТА pH 8,0.
- Смешайте 1,211 г TRIS и 0,0146 г ЭДТА с 90 мл сверхчистой воды для приготовления 0,1 М раствора TRIS/HCl и 0,5 мМ ЭДТА при pH 8,0. При необходимости добавьте HCl для регулировки pH. Раствор можно хранить неограниченное время при температуре 2-8 °C.
- Масса 0,075 г NADPH и добавить к нему 2,25 мл 1% NaHCO3 1 mM EDTA.
- Смешайте 1 г NaHCO3 и 0,0282 г ЭДТА в 100 мл сверхчистой воды для приготовления 1% раствора NaHCO3 и 1 мМ ЭДТА. Храните раствор при температуре 4-8 °C в течение неопределенного времени.
- Смешайте 2 мкл гидропероксида т-бутила с 2 мл сверхчистой воды до получения раствора 7 мМ. Перемешайте непосредственно перед использованием.
- Смешайте 1 г бычьего сывороточного альбумина (БСА) с 1 мл сверхчистой воды до получения исходного раствора 1 мкг/мкл.
- Реактивные вещества тиобарбитуровой кислоты (TBARS) (перекисное окисление липидов, LPO)17
- Добавьте 5 мкл тканевой надосадочной жидкости в микропробирку объемом 1 мл. Добавьте 45 мкл 50 мМ PBS (свежий и стоковый раствор).
- Добавьте 12,5 мкл 8,1% SDS (свежеприготовленного). Добавьте 93,5 мкл 20% TCA pH 3,5 (свежеприготовленный).
- Добавьте 93,5 мкл 1% TBA (свежеприготовленный). Дополните объем, добавив 50,5 μл сверхчистой воды. Закройте крышку пробирки и закрутите ее в течение 30 секунд.
- Проколите иголкой крышку микротрубки и выдержите в кипящей воде 10 минут.
- Охладите пробирку при комнатной температуре (RT), а затем центрифугируйте ее при 1000 x g в течение 10 минут.
- Добавьте 150 мкл надосадочной жидкости в лунку в 96-луночном микропланшете и измерьте поглощение на длине волны 530 нм с помощью микропланшетного спектрофотометра.
- Для количественного определения пероксидов липидов необходимо построить калибровочную кривую TBARS по 8 точкам (0-160 мкМ) с использованием малонового диальдегида биса (диметилацеталя), как описано в таблице 1. Отрегулируйте кривую малонового диальдегида (MDA) в соответствии с типом ткани или предполагаемым уровнем повреждения.
- Выразите результаты в виде белка nmol MDA eq·mg−1 .
- Микроанализ антиоксидантного фермента (СОД) супероксиддисмутазы18
- Используйте 96-луночный планшет. Добавьте 147 мкл 1 М TRIS/5 мМ HCl EDTA pH 8 в две лунки в качестве заготовок. Добавьте 144 мкл 1 М TRIS/5 мМ HCl EDTA pH 8 в другие лунки в виде дубликата.
- Возьмите 3 мкл надосадочной жидкости и добавьте ее в лунки для проб. Аккуратно перемешайте содержимое на тарелке несколько раз.
- Добавьте 3 мкл 10 мМ пирогалловой кислоты в каждую лунку в течение 30 с. Сразу же аккуратно перемешайте.
- Измерьте поглощение при T0 (время = 0 с) и T10 (время = 10 с), при 420 нм и 25 °C.
- Определяют СОД, рассчитывая процент ингибирования пирогаллола в образце с помощью следующего уравнения:
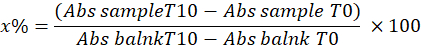
Где
x% = процент окисления пирогаллола СОД в образце; Поэтому окисление пирогаллола равно 100 - х%
ПРИМЕЧАНИЕ: Расчет активности СОД с учетом 1 МЕ представляет собой объем, который ингибирует 50% окисления пирогаллола, как описано ниже:
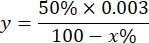
Где
y = объем образца на миллилитр (ингибирует 50% пирогаллона)
50% = процент ингибирования пирогаллола равен 1U СОД
0,003 = объем в миллилитрах образца
100 - x% = ингибирование пирогаллола в процентном соотношении к образцу - Наконец, определите активность СОД с помощью уравнения:
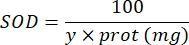
СОД = активность СОД в международных единицах на микрограмм белка
Y = объем образца, в котором ингибируется 50% пирогаллола
100 = коэффициент пересчета из децилитра в миллилитр.
белок = концентрация белка, полученная в результате количественного определения по Брэдфорду, выражается в микрограммах на миллилитр; Необходимо разделить на 10, чтобы перевести в граммы на децилитр
- Микроанализ антиоксидантного фермента каталазы (CAT)19,20
- Используйте 96-луночный микропланшет. Добавьте 20 мкл надосадочной жидкости образца в лунки (по дубликату).
- Добавьте 20 μL свежей каталазы (200 μг/мл) в лунки стандартно (по дубликату). Добавьте в образец 100 мкл 50 мМ PBS pH 7,8 и очистите лунки.
- Добавьте 100 мкл 90 мМ (30%) H2O2 в лунки для начала реакции. После добавления H2O2 считывайте значение поглощения каждые 15 с в течение 2,5 мин при длине волны 240 нм.
- Рассчитайте активность с помощью формулы:
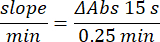
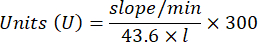
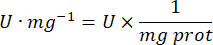
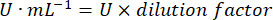
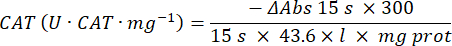
- Микроанализ фермента глутатионпероксидазы (GPx)21
- Используйте 96-луночный микропланшет.
- Смешайте 240 мкл 0,1 М раствора GSH, 1 200 мкл 10 Ед/мл раствора GSH-Rd и 1 200 мкл 4 мМ NADPH. Держите раствор на льду.
- Добавьте в лунки 100 мкл 50 мМ TRIS/HCl 5 мМ ЭДТА pH 7,6. Добавьте 1 мкл надосадочной жидкости в двух экземплярах. Постучите по микропластине и аккуратно перемешайте.
- Добавьте 50 μл раствора смеси (шаг 4.5.2) и аккуратно перемешайте.
- Добавьте 20 мкл 7 мМ раствора т-бутилгидропероксида в лунки для начала реакции (для начала реакции требуется примерно 15 с для начала реакции в 16 дублированных образцах). Быстро перемешиваем микропластину.
- Контролируйте поглощение каждые 1 мин в течение 5 мин при 25 °C при 340 нм.
- Рассчитайте активность GPx с помощью уравнения:
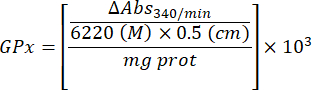
Где
GPx = активность в миллимолярах в минуту на микрограмм белка
ΔAbs340/мин = Среднее поглощение в дельте
103 = молярное преобразование в миллимолярное
- мг прот = концентрация белка по методу Брэдфорда, выраженная в микрограммах на микролитр
- Количественное определение белка по анализу Брэдфорда22
- Выполняют стандартную кривую из растворов бычьего сывороточного альбумина (БСА), задают из исходного раствора 1 мкг/мкл, как показано в таблице 2.
- Используйте 96-луночный микропланшет. Добавьте 190 мкл реагента Брэдфорда в пробу и стандартные лунки.
- Добавьте 10 мкл БСА в стандартные лунки путем дубликата. Добавьте 10 мкл надосадочной жидкости в лунки для проб по дубликату.
- Аккуратно перемешайте с помощью наконечника пипетки.
- Поглощение считывания на длине волны 595 нм. Количественно измерьте концентрацию белка с помощью стандартной кривой.
Access restricted. Please log in or start a trial to view this content.
Результаты
Результаты исследования показывают, что тяжелые металлы, в частности алюминий (Al), железо (Fe) и цинк (Zn), оказывают пагубное воздействие на окружающую среду, о чем свидетельствует рисунок 2. Обнаружение высоких уровней тяжелых металлов как в образцах тка?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Хотя использование C. texanus является оптимальным для оценки, необходимо учитывать несколько аспектов его использования и сбора. Выбор участков для исследования оказался сложным из-за нескольких факторов, таких как неблагоприятные погодные условия, географическа?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не выявили конфликта интересов, присутствующего в их работе.
Благодарности
Авторы выражают искреннюю благодарность компании CONAHCyT за предоставление гранта FONINS P 1931, что значительно облегчило их исследовательскую работу. Они также поблагодарят Секретариат по исследованиям и посградо при Национальном политехническом институте за неоценимую поддержку, оказанную в рамках гранта проекта SIP (20200577). Кроме того, первый автор хотел бы выразить признательность за щедрую стипендию для аспирантов, присужденную CONAHCyT, которая позволила команде провести экскурсии и собрать важные данные. Наконец, авторы хотели бы выразить свою признательность за неоценимую помощь Марии Терезе Гарсиа Камачо в лаборатории, без которой этот проект был бы невозможен.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
Ссылки
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86(2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474(2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1(2017).
- Florida, S., Lindsay, H., Patel, M., Lindsay, P. Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory. , Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018).
- Cao, C. -Q., Liu, Z., Chen, S. -Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , Doctoral dissertation (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , Cambridge. (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. Stream Ecology: Structure and Function of Running Waters. , Springer. Dordrecht. (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , Washington, DC. (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209(2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. Tropical Stream Conservation. Tropical Stream Ecology. , Academic Press, Elsevier. (2008).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены