Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Hellgrammite como biomonitor no convencional para la evaluación de aguas superficiales y salud ambiental
En este artículo
Resumen
Este protocolo describe el uso de biomarcadores para la detección temprana de impactos deletéreos en los ecosistemas acuáticos. Los biomarcadores están estrechamente relacionados con los rasgos centinela y sus cambios ayudan a detectar daños en alerta temprana.
Resumen
Las larvas de moscas dobson del género Corydalus, comúnmente conocidas como Hellgrammites, se caracterizan por su notable tamaño, su amplia gama de presencia y su prolongado período de inmadurez, que puede durar hasta un año. Se sabe claramente que los Hellgrammites exhiben sensibilidad a la contaminación y a los impactos en la estructura del hábitat. Dadas estas características únicas, el uso de larvas de Corydalus texanus es muy adecuado como agentes de biomonitoreo confiables para evaluar la integridad ecológica de los ecosistemas acuáticos. Este protocolo tiene como objetivo proporcionar las herramientas necesarias para la evaluación de C. texanus y demostrar su eficacia a través de un estudio de caso. Los resultados de la investigación tienen implicaciones prácticas, indicando que las larvas de C. texanus exhiben respuestas de alerta temprana a la contaminación minera, bioacumulando altas cantidades de metales pesados como Zn, Fe y Al. La presencia o ausencia de poblaciones de C. texanus puede servir como un indicador útil para identificar posibles problemas relacionados con la salud del ecosistema. El enfoque no convencional ha mostrado alertas tempranas de contaminación en los sitios impactados por la minería, lo que destaca la necesidad de tomar medidas oportunas para proteger el medio ambiente. Dadas sus características únicas, se recomienda encarecidamente el uso de larvas de C. texanus como un bioindicador no convencional confiable.
Introducción
Las Hellgramites son larvas de insectos del orden Megaloptera (Latreille, 1802), llamadas moscas dobson o moscas de los peces en su etapa adulta. Una diversidad baja pero generalizada caracteriza a este grupo de larvas de insectos depredadores superiores de los ecosistemas acuáticos1. Las especies de Hellgramite se encuentran en regiones biogeográficas bien definidas; Por lo tanto, es relativamente fácil identificar especies sin un alto conocimiento taxonómico. En particular, las larvas de Corydalidae poseen las especies más prominentes del orden Megaloptera (20-90 mm de longitud corporal)2, lo que hace que la gramita infernal sea visible a simple vista.
Los Hellgrammites juegan un papel crucial en los ecosistemas acuáticos como depredadores, con una poderosa presencia debido a los grandes masticadores que denotan su impresionante forma depredadora. Un cuerpo aplanado dorsoventralmente también se une con 7-8 pares de branquias de filamento a lo largo del cuerpo, y una cápsula de la cabeza con seis tallos por lado hace que los hellgrammites sean organismos fascinantes para entomólogos y aficionados3. Los adultos de Corydalidae sorprenden y crean una imagen de impresión a las personas debido a su tamaño prominente; sin embargo, son completamente inofensivos. Cabe destacar que las hellgrammitas tienen la capacidad de persistir en ambientes acuáticos en su etapa larvaria durante un tiempo significativo.
Las características fenotípicas de los hellgrammitas permiten una oportunidad particular para resaltar su papel en los ecosistemas acuáticos; Sin embargo, su potencial indicador es la característica más buscada por los ecólogos acuáticos. Se destaca el vasto conocimiento de su potencial bioindicador en los ecosistemas acuáticos debido a que su ocurrencia se relaciona con las buenas condiciones de salud en sus hábitats debido a su intolerancia a la contaminación orgánica en las aguas superficiales 4,5,6,7,8.
La mayoría de los Corydalidae megalopterans viven en aguas corrientes de alta velocidad como arroyos y sustratos predominados por guijarros y guijarros, pero los hellgrammites también ocurren en arroyos de baja pendiente con enganches y sustratos de arena, así como en hábitats lénticos como lagos 3,9,10. Su amplia gama de presencia refleja los rasgos críticos de un depredador superior y su capacidad para colonizar varios hábitats objetivo por sus estrategias efectivas de historia de vida11. Los hellgramitas vincularon sus rasgos con la dinámica de los ecosistemas acuáticos; así, estrategias como la adaptación a la respiración aérea por parte de los espiráculos (además de sus penachos ventrales de branquias traqueales) son propias de las estrategias de Corydalidae10.
Los Hellgrammitas habitan ecosistemas particulares y muestran respuestas rápidas a las desviaciones de los patrones establecidos, sirviendo así como un sistema de alerta temprana7. Las reacciones de estos organismos de la fauna silvestre pueden emplearse como una herramienta valiosa para evaluar el impacto de la contaminación en los ecosistemas acuáticos, particularmente en el caso de mezclas de contaminantes no objetivo. Se han reconocido algunos efectos nocivos sobre los organismos vivos en los ecosistemas debido a la toxicidad individual de los productos químicos, pero se identificará el efecto de las mezclas de contaminantes. Las respuestas de alerta temprana de los hellgrammites pueden permitir identificar los efectos deletéreos dando una referencia a los impactos de una mezcla de contaminantes o incluso cuando los efectos individuales de los contaminantes reconocen una concentración sin efecto observable (NOEC)12.
Se han utilizado varios organismos modelo para pruebas experimentales agudas y crónicas; sin embargo, se cultivan y mantienen en condiciones controladas13. Las condiciones controladas hacen que no puedan identificar los efectos no deseados de varios contaminantes a los que están expuestos. Además, el NOEC se reconoce con frecuencia debido a la complejidad de la mezcla del contaminante. Por esa razón, en las últimas décadas, se reconocieron especies nativas no modelo con efectos no objetivo para los sistemas de tamizaje, que son esenciales para llevar a cabo investigaciones ecotoxicológicas14. En consecuencia, los hellgrammites parecen capaces de evaluar los efectos nocivos de la contaminación en los ecosistemas acuáticos. Rasgos como su biología, genética y fisiología, entre otros, hacen que los organismos no modelo sean adecuados para la evaluación de impacto en los ecosistemas14.
Este protocolo tiene como objetivo establecer una nueva herramienta de biomonitoreo utilizando un organismo no modelo que pueda detectar señales de alerta temprana en respuesta a mezclas de contaminación no objetivo. Para lograr los mejores resultados, se han considerado de manera integral e integrados en el análisis los rasgos exhibidos por las larvas de la especie modelo, C. texanus 15.
Protocolo
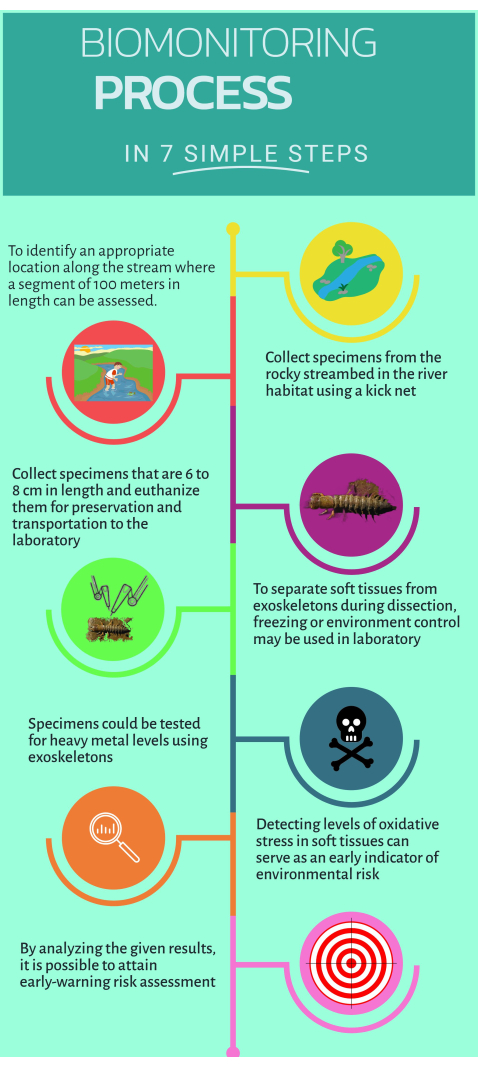
Figura 1: Guía rápida paso a paso sobre cómo utilizar el biomonitor no convencional Corydalus texanus para su implementación en ecosistemas acuáticos. Haga clic aquí para ver una versión más grande de esta figura.
1. Trabajo de campo
- Identificar los sitios de estudio ubicados aguas arriba y aguas abajo de la fuente de contaminación donde se reconocen impactos presuntos o evidentes (es decir, emisiones puntuales o difusas).
NOTA: El presente protocolo incluyó 15 sitios de estudio en cuatro ríos principales: 1) Río Extoraz (sitios PB, EZ, RQ, BC); 2) Río Escanela-Jalpan (ES, EN, AH, JL, PI, PA); 3) Río Ayutla (AY); y 4) Río Santa María (SM, AT). - Buscar y ubicar al menos un sitio de referencia (un lugar con impactos menores o ausentes) y definirlo como un sitio de estudio.
NOTA: Para el presente estudio, se consideraron como sitios de referencia BC, ES, SM, AY y AT. - Reconocer ciertos atributos de los hábitats que aumentan la probabilidad de encontrar individuos de C. texanus. Estos incluyen sustrato de grava, hábitats rocosos con pendientes más pronunciadas, flujos de alta velocidad, aguas bien oxigenadas, alta densidad de dosel y hábitats en tierras altas y bajas.
- Cercar una sección de 100 m del arroyo para identificar hábitats apropiados para el monitoreo biológico16.
- Entra en el arroyo para recoger muestras.
- Muestree al menos seis individuos de C. texanus en hábitats como arroyos, guijarros, aguas cristalinas y escombros utilizando una red de patada con un tamaño de malla de 500 μm.
- Retire las rocas en la dirección del flujo de agua y transfiera las larvas a la red.
- Manipule la red de patada con las larvas muestreadas y transfiéralas a botellas designadas para alojamiento temporal. Manipule la red con precaución y doble los bordes hacia el interior para evitar cualquier pérdida de larvas.
- Mida el ancho de la cabeza de las larvas muestreadas usando un calibrador para identificar los estadios IX a XI (dentro del rango de 6 mm a 10 mm).
- Purgue las larvas sumergiéndolas en una botella que contenga agua de arroyo durante 30 minutos.
- Coloque las muestras en botellas de plástico con etiquetas claras y luego eutanasiélas sumergiéndolas en nitrógeno líquido (-75 °C) en un tanque criogénico.
- Transporte y almacenamiento seguro de las muestras a -45 °C en el ultracongelador del laboratorio.
- Con una botella de polietileno, tome una muestra de agua de corriente de 200 mL, agregue 1 mL de ácido nítrico y almacene la muestra a 4 °C para su posterior cuantificación de metales pesados en el laboratorio.
2. Disección de las larvas muestreadas y separación de tejidos
- Coloque la bandeja de disección de plástico sobre hielo y espere hasta que alcance los 4 °C, utilizando un termómetro para comprobarlo.
- Tome muestras del ultracongelador y colóquelas en la bandeja de disección para comenzar a diseccionar.
- Seleccione los tejidos objetivo: músculo, ramas, tubo neural y exoesqueleto.
- Use un cuchillo de cerámica para quitar la cabeza y separe los tejidos con cuidado. Abre el cuerpo longitudinalmente y retira las branquias de cada lado.
- Separe los exoesqueletos con un cuchillo de cerámica más pequeño y limpie el exceso de tejido. Colocar los exoesqueletos en un horno y secarlos a 80 °C durante 48 h.
- Después de que pase el tiempo, guarde los exoesqueletos secos para un análisis más detallado.
- Siga limpiando los tejidos blandos en condiciones frías para su posterior análisis mediante microensayos.
- Use un pequeño cuchillo de cerámica para extraer los tejidos blandos de la grasa. Separe y agrupe cada tejido objetivo de los individuos del mismo punto de muestreo.
- Almacene cada tipo de tejido en un microtubo de 2 ml, manteniendo las condiciones de frío durante todo el proceso.
- Para preparar cada tejido diana, pese 100 mg de tejido y añada 1 ml de solución de PBS con un pH de 7,4. Utilice un desgarrador de tejido con una sola mano para homogeneizar cada tejido. Por lo general, los tejidos blandos requieren tres ciclos de 10 s cada uno.
- Centrifugar la muestra a 1.000 x g durante 5 min a 4 °C. Transfiera el sobrenadante a un microtubo de 1 mL.
- Realizar microensayos de biomarcadores.
3. Cuantificación de metales pesados
- Pesar 250 mg de exoesqueletos secos de al menos seis especímenes en la etapa de desarrollo especificada utilizando una balanza analítica.
- Muele los exoesqueletos en un mortero de vidrio hasta que se conviertan en polvo fino. Agregue 250 mL de ácido nítrico ultrapuro a los recipientes de reacción del polvo.
- Para digerir las muestras, transfiéralas a un microondas de digestión a 180 °C durante 30-45 min.
NOTA: Utilice el recipiente apto para microondas adecuado para la marca de microondas para calentar las muestras de manera segura y eficaz. El tiempo de digestión de las muestras de tejido varía según la marca del microondas, tardando entre 30 y 45 minutos. Algunas marcas ofrecen métodos estandarizados. - Realice un método de digestión por microondas para muestras de agua siguiendo el método EPA3015A, utilizando 45 mL de la muestra de agua y agregando 5 mL de ácido nítrico.
- Mida metales pesados y metaloides en muestras digeridas (agua y tejidos) utilizando espectroscopia de emisión óptica de plasma acoplado inductivamente (ICP-OES), incluidos Hg, Cu, Pb, Zn, Fe, Cr, Cd, Mn, Ba y As.
NOTA: Utilice argón grado 5 y soluciones estándar de cada metal y metaloide para construir una curva de calibración.
4. Microensayos para la evaluación del estrés oxidativo y biomarcadores
- Preparación de reactivos
- Mezcle 6 g de NaH2PO4 con 1000 mL de agua ultrapura para hacer un tampón de fosfato monobásico de 50 mM. Almacenar en un matraz a 2-8 °C indefinidamente.
- Para obtener una SDS al 8,1%, disuelva 450 mg de dodecil sulfato de sodio (SDS) en 5 ml de agua ultrapura. Prepare justo antes de usar.
- Diluir 2 mL de ácido tricloroetanoico (TCA) en 8 mL de agua ultrapura (prepare reactivo fresco cuando sea necesario).
- Disolver 100 mg de tetrabutilamonio (TBA) en 10 mL de agua ultrapura (preparar el reactivo fresco cuando sea necesario).
- Para hacer 50 mM de PBS pH 7.8, disuelva 97 mg de Na2HPO4 y 59 mg de NaH2PO4 en 10 mL de agua ultrapura. Luego, ajuste el pH a 7.8 usando NaOH para aumentar o HCl para disminuir.
- Preparar una solución de 200 μg/mL de catalasa bovina disolviendo 8 mg de la misma en 40 μL de agua ultrapura (preparar reactivo fresco cuando sea necesario).
- Para hacer una solución de 50 mM de TRIS/5 mM de ácido etilendiaminotetraacético (EDTA), agregue 6,05 g de tris (hidroximetil)aminometano (TRIS) y 0,073 g de EDTA a 45 mL de agua ultrapura. Ajuste el pH a 7,6 con HCl y almacene a 4 °C hasta su uso.
- Para glutatión reducido (GSH) 0,1 M (para 45 muestras duplicadas), pesar 0,0184 g de GSH y disolverlo en 600 μL de HCl 10 mM.
- Para preparar 10 mM de HCl, agregue 0,5 μL de HCl concentrado a 599,5 μL de agua ultrapura.
- Añadir 28,5 μL de glutatión reductasa a 1,4 mL de 0,1 M TRIS/HCl 0,5 mM EDTA pH 8,0.
- Mezclar 1,211 g de TRIS y 0,0146 g de EDTA con 90 mL de agua ultrapura para preparar una solución de 0,1 M de TRIS/HCl y 0,5 mM de EDTA a pH 8,0. Agregue HCl para ajustar el pH si es necesario. La solución puede almacenarse indefinidamente a 2-8 °C.
- Peso 0,075 g de NADPH y añádelo a 2,25 mL de NaHCO3 1% 1 mM EDTA.
- Mezcle 1 g de NaHCO3 y 0,0282 g de EDTA en 100 ml de agua ultrapura para preparar una solución de NaHCO3 al 1% y 1 mM de EDTA. Almacene la solución a 4-8 °C durante un tiempo indeterminado.
- Mezcle 2 μL de hidroperóxido de t-butilo con 2 mL de agua ultrapura para hacer una solución de 7 mM. Mezclar inmediatamente antes de usar.
- Mezclar 1 g de albúmina sérica bovina (BSA) con 1 mL de agua ultrapura para crear una solución madre de 1 μg/μL.
- Sustancias reactivas al ácido tiobarbitúrico (TBARS) (peroxidación lipídica, LPO)17
- Añadir 5 μL de sobrenadante tisular a un microtubo de 1 mL. Añadir 45 μL de 50 mM de PBS (solución fresca y madre).
- Añadir 12,5 μL de SDS al 8,1% (recién preparado). Añadir 93,5 μL de TCA al 20% pH 3,5 (recién preparado).
- Añadir 93,5 μL de 1% TBA (recién preparado). Completa el volumen añadiendo 50,5 μL de agua ultrapura. Cierre la tapa del tubo y vértice durante 30 s.
- Perforar la tapa del microtubo con una aguja e incubar en agua hirviendo durante 10 min.
- Enfríe el tubo a temperatura ambiente (RT) y luego centrifuérrelo a 1000 x g durante 10 min.
- Agregue 150 μL de sobrenadante a un pocillo en una microplaca de 96 pocillos y mida la absorbancia a 530 nm usando un espectrofotómetro de microplacas.
- Para cuantificar los peróxidos lipídicos, cree una curva de calibración TBARS de 8 puntos (0-160 μM) utilizando malondialdehído bis (dimetilacetal) como se describe en la Tabla 1. Ajuste la curva de malondialdehído (MDA) de acuerdo con el tipo de tejido o el nivel de daño sospechado.
- Exprese los resultados como proteína nmol MDA eq·mg-1 .
- Microensayo de enzima antioxidante superóxido dismutasa (SOD)18
- Use una placa de 96 pocillos. Agregue 147 μL de 1 M TRIS/5 mM HCl EDTA pH 8 en dos pocillos como blancos. Agregue 144 μL de 1 M TRIS/5 mM HCl EDTA pH 8 a otros pocillos por duplicado.
- Tome 3 μL del sobrenadante y añádalo a los pocillos de muestra. Mezcle suavemente el contenido en el plato varias veces.
- Añadir 3 μL de ácido pirogálico 10 mM a cada pocillo en un plazo de 30 s. Mezcle suavemente inmediatamente.
- Mida la absorbancia a T0 (tiempo = 0 s) y T10 (tiempo = 10 s), a 420 nm y 25 °C.
- Determine la SOD calculando el porcentaje de inhibición de pirogalol en la muestra utilizando la siguiente ecuación:
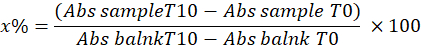
Dónde
x% = porcentaje de oxidación del pirogalol por SOD en la muestra; Por lo tanto, la oxidación del pirogalol es igual a 100 - x%
NOTA: Cálculo de la actividad de SOD considerando 1 UI es el volumen que inhibe el 50% de la oxidación del pirogalol como se describe a continuación:
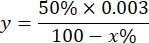
Dónde
y = volumen de la muestra en mililitro (inhibe el 50% del pirogalón)
50% = porcentaje de inhibición de pirogalol igual a 1U de SOD
0,003 = volumen en mililitros de la muestra
100 - x% = inhibición de pirogalol en porcentaje por la muestra - Finalmente, determine la actividad de SOD con la ecuación:
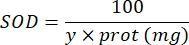
SOD = actividad de SOD en unidades internacionales por microgramo de proteína
Y = volumen de la muestra en el que inhibe el 50% de pirogalol
100 = factor de conversión de decilitro a mililitro.
proteína = la concentración de proteína obtenida de la cuantificación de Bradford se expresa en microgramos por mililitro; Es necesario dividir por 10 para convertir a gramos por decilitro
- Microensayo de enzima antioxidante catalasa (TAC)19,20
- Utilice una microplaca de 96 pocillos. Añadir 20 μL de sobrenadante de muestra en los pocillos (por duplicado).
- Agregue 20 μL de catalasa fresca (200 μg/mL) en los pocillos como estándar (por duplicado). Añada 100 μL de 50 mM de PBS pH 7,8 a la muestra y a los pocillos en blanco.
- Agregue 100 μL de 90 mM (30%) H2O2 en los pocillos para iniciar la reacción. Después de añadir H2O2, lea la absorbancia cada 15 s durante 2,5 min a 240 nm.
- Calcula la actividad usando la ecuación:
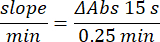
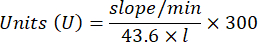
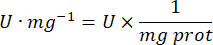
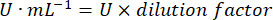
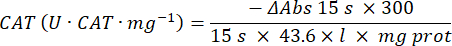
- Microensayo enzimático de glutatión peroxidasa (GPx)21
- Utilice una microplaca de 96 pocillos.
- Mezclar 240 μL de solución de GSH de 0,1 M, 1 200 μL de solución de GSH-Rd de 10 U/mL y 1 200 μL de 4 mM de NADPH. Mantenga la solución en hielo.
- Añadir a los pocillos 100 μL de 50 mM TRIS/HCl 5 mM EDTA pH 7,6. Añadir 1 μL de muestra de sobrenadante por duplicado. Golpee la microplaca y mezcle suavemente.
- Añadir 50 μL de la solución de mezcla (paso 4.5.2) y mezclar suavemente.
- Agregue 20 μL de la solución de hidroperóxido de t-butilo de 7 mM en los pocillos para iniciar la reacción (se necesitan aproximadamente 15 s para iniciar la reacción en 16 muestras duplicadas). Mezcle rápidamente la microplaca.
- Controle la absorbancia en cada intervalo de 1 minuto durante 5 minutos a 25 °C a 340 nm.
- Calcula la actividad de GPx con la ecuación:
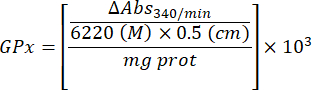
Dónde
GPx = actividad en milimolares por minuto por microgramo de proteína
ΔAbs340/min= Absorbancia media en delta
103 = conversión de molar a milimolar
- mg prot = concentración de proteína de la determinación de Bradford expresada en microgramos por microlitro
- Cuantificación de proteínas mediante el análisis de Bradford22
- Realice una curva estándar a partir de soluciones de albúmina sérica bovina (BSA), establecida a partir de una solución madre de 1 μg/μL como se muestra en la Tabla 2.
- Utilice una microplaca de 96 pocillos. Añadir 190 μL de reactivo de Bradford en la muestra y en los pocillos estándar.
- Agregue 10 μL de BSA en pocillos estándar por duplicado. Añadir 10 μL de sobrenadante en los pocillos de muestra por duplicado.
- Mezclar suavemente con la punta de la pipeta.
- Lectura de absorbancia a 595 nm. Cuantificar la concentración de proteína con la curva estándar.
Resultados
Los resultados del estudio revelan que los metales pesados, específicamente el Aluminio (Al), el Hierro (Fe) y el Zinc (Zn), tienen un impacto perjudicial en el medio ambiente, como se evidencia en la Figura 2. La detección de altos niveles de metales pesados tanto en muestras de tejido como de agua recogidas en todos los sitios ha llevado a un resultado desfavorable. Se detectaron valores atípicos, con un Factor de Bioacumulación (BAF) de 600, especialm...
Discusión
Aunque el uso de C. texanus es óptimo para la evaluación, es necesario considerar varios aspectos de su uso y recolección. Los sitios de estudio elegidos resultan desafiantes, debido a varios factores, como condiciones climáticas desfavorables, inaccesibilidad geográfica, altos niveles de aridez o protocolos de seguridad insuficientes en regiones seleccionadas. Las restricciones y limitaciones establecidas a menudo pueden presentar desafíos al realizar el trabajo de campo....
Divulgaciones
Los autores no revelaron conflictos de intereses presentes en su trabajo.
Agradecimientos
Los autores desean expresar su sincero agradecimiento a CONAHCyT por otorgar la beca FONINS P 1931, que facilitó enormemente sus esfuerzos de investigación. También agradecieron a la Secretaría de Investigación y Posgrado del Instituto Politécnico Nacional por el invaluable apoyo brindado a través de la subvención para proyectos SIP (20200577). Además, el primer autor desea agradecer la generosa beca de posgrado otorgada por CONAHCyT, que permitió al equipo realizar viajes de campo y recopilar datos esenciales. Por último, los autores quieren expresar su agradecimiento por la inestimable ayuda de María Teresa García Camacho en el laboratorio, sin la cual este proyecto no hubiera sido posible.
Materiales
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
Referencias
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86 (2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474 (2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1 (2017).
- . Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018)
- Cao, C. -. Q., Liu, Z., Chen, S. -. Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. . Stream Ecology: Structure and Function of Running Waters. , (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209 (2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. . Tropical Stream Conservation. Tropical Stream Ecology. , (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados