A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد الخلايا الهادئة في نموذج سرطان الدم الليمفاوي الحاد في الخلايا التائية الزرد باستخدام تلطيخ تكاثر الخلايا
In This Article
Summary
استخدمنا تلطيخ تكاثر الخلايا لتحديد الخلايا الهادئة في نموذج سرطان الدم الليمفاوي الحاد T-zebrafish. يتم الاحتفاظ بالبقعة في الخلايا غير المنقسمة وتقليلها أثناء تكاثر الخلايا ، مما يتيح اختيار الخلايا الخاملة لمزيد من الاستجواب. يوفر هذا البروتوكول أداة وظيفية لدراسة التجديد الذاتي في سياق السكون الخلوي.
Abstract
السكون الخلوي هو حالة توقف النمو أو تباطؤ الانتشار الموصوف في الخلايا الجذعية الطبيعية والسرطانية (CSCs). قد يحمي الهدوء الخلايا الجذعية السرطانية من أدوية العلاج الكيميائي المضادة للتكاثر. في نماذج الفئران المصابة بابيضاض الدم الليمفاوي الحاد للخلايا التائية (T-ALL) المشتقة من المريض (PDX) ، ترتبط الخلايا الهادئة بمقاومة العلاج والجذع. أصباغ تكاثر الخلايا هي أدوات شائعة لتتبع انقسام الخلايا. ترتكز صبغة الفلورسنت تساهميا في مجموعات الأمين على الغشاء والجزيئات الكبيرة داخل الخلية. يسمح هذا بتتبع الخلايا المصنفة لما يصل إلى 10 أقسام ، والتي يمكن حلها عن طريق قياس التدفق الخلوي.
في النهاية ، سيكون للخلايا ذات أعلى معدلات الانتشار احتفاظ منخفض بالصبغة ، حيث سيتم تخفيفها مع كل انقسام خلوي ، في حين أن الخلايا الخاملة ذات الانقسام البطيء سيكون لها أعلى احتفاظ. تم تحسين استخدام أصباغ تكاثر الخلايا لعزل الخلايا الخاملة ووصفها في نماذج الماوس T-ALL. استكمالا لنماذج الفئران الحالية ، يوفر نموذج T-ALL المشتق من rag2: Myc مكانا ممتازا لاستجواب التجديد الذاتي في T-ALL بسبب التردد العالي للخلايا الجذعية اللوكيمية (LSCs) وراحة الزرد لتجارب الزرع واسعة النطاق.
هنا ، نصف سير العمل لتلطيخ خلايا الزرد T-ALL بصبغة تكاثر الخلايا ، وتحسين تركيز الصبغة لخلايا الزرد ، وتمرير الخلايا الملطخة بنجاح في الجسم الحي ، وجمع الخلايا بمستويات متفاوتة من الاحتفاظ بالصبغة عن طريق فرز الخلايا الحية من المزروعة. نظرا لعدم وجود صانعي أسطح خلايا راسخين ل LSCs في T-ALL ، يوفر هذا النهج وسيلة وظيفية لاستجواب الخلايا الهادئة في الجسم الحي. للحصول على نتائج تمثيلية ، نصف كفاءة النقش وتردد LSC للخلايا ذات الاحتفاظ بالصبغة العالية والمنخفضة. يمكن أن تساعد هذه الطريقة في التحقق من الخصائص الإضافية للخلايا الهادئة ، بما في ذلك الاستجابة للأدوية ، وملفات تعريف النسخ ، والتشكل.
Introduction
الخلايا الجذعية البالغة هي المسؤولة عن تجديد أنواع الخلايا المتمايزة في عضو معين وهي موجودة في الغالب في حالة نائمة وغير مقسمة 1,2. على سبيل المثال ، تظل الخلايا الجذعية المكونة للدم (HSCs) ، التي تحافظ على الدم ، هادئة إلى حد كبير ، ولا يدخل سوى جزء صغير دورة الخلية للتجديد الذاتي أو التمايز لتوليد مكونات دم ناضجة3. وبالمثل ، في السرطانات ، تمتلك مجموعة فرعية نادرة من الخلايا تسمى الخلايا الجذعية السرطانية (CSCs) القدرة على التجديد الذاتي وهي مسؤولة عن الحفاظ على الورم الخبيث على المدى الطويل4. توجد الخلايا الجذعية السرطانية في الجسم الحي في حالة من السكون أو النمو البطيء ، مما قد يمكنها من الهروب من علاجات السرطان المضادة للتكاثر5 ، والتهرب من التخليص من قبل الجهاز المناعي6 ، وتقليل الإجهاد التأكسدي ، وتعزيز مسارات إصلاح الحمض النووي7. حتى عدد قليل من الخلايا الجذعية السرطانية التي تركت وراءها بعد العلاج يمكن أن تعيد ملء الورم ، مما يؤدي إلى انتكاسة المريض8. وبناء على ذلك ، فإن فهم الهدوء الخلوي يبشر بخير كبير لتحديد نقاط الضعف المحتملة ل CSCs وتطوير طرق جديدة لاستهدافها.
تستخدم أصباغ تكاثر الخلايا ، مثل صبغة كربوكسي فلوريسئين سكسينيميديل إستر (CFSE) ومشتقاتها ، بشكل شائع لتتبع تواتر انقسامات الخلايا9. تتخلل الصبغة غشاء الخلية ، وبمجرد دخولها إلى الخلية ، تخضع للتنشيط بواسطة استرات داخل الخلايا في منتج فلوري. يتم الاحتفاظ بمركب الفلورسنت الناتج داخل الخلية من خلال روابط الأميد التساهمية المتكونة بين مجموعة succinimidyl والمجموعات الوظيفية الأمينية للبروتينات داخل الخلايا10. مع كل انقسام خلوي ، ينقسم مركب الفلورسنت بالتساوي بين الخليتين الناتجتين ، مما يتسبب في تخفيف الإشارة بمضاعفين. تتيح هذه الصبغة اكتشاف ما يصل إلى 10 انقسامات خلوية من خلال تحليل قياس التدفقالخلوي 11.
تم استخدام هذا النهج سابقا لإثراء مجموعات CSC في المختبر من خلال تحديد مجموعات الخلايا البطيئة الدوران مع الاحتفاظ العالي بالصبغة11,12. في T-ALL ، تم استخدام CFSE لتتبع نمو الورم في الجسم الحي في الطعوم الخارجية المشتقة من المريض في الفئران. بعد وضع العلامات على الخلايا وثلاثة أسابيع من الزرع ، أظهر تحليل قياس التدفق الخلوي مجموعة نادرة من الخلايا التي لا تزال تحتفظ بمضان CFSE. ارتبطت هذه الفئة من السكان بالجذع ومقاومة العلاج والتشابه الكبير مع الخلايا المسببة للانتكاس في المرضى13. وفقا لذلك ، توفر هذه الصبغة أداة مفيدة لدراسة الأنماط الظاهرية للخلايا الجذعية لسرطان الدم (LSC) في T-ALL.
الهدف من العمل هو توسيع تطبيق صبغة تكاثر الخلايا لدراسة السكون في الجسم الحي باستخدام نموذج الزرد T-ALL. على وجه الخصوص ، يوفر نموذج T-ALL14 الذي يحركه rag2: myc مكانا ممتازا لدراسة التجديد الذاتي بسبب التكرار العالي ل LSCs مقارنة بنماذج الفئران والأمراض البشرية15. بالإضافة إلى ذلك ، يسمح استخدام الزرد بإجراء دراسات زرع واسعة النطاق ، والتي يمكن إجراؤها بتكلفة أقل بكثير من الرعاية والصيانة مقارنة بنظيراتها في الفئران16. تعتبر أسماك الزرد أيضا ممتازة لتطبيقات التصوير الحي ، حيث يمكن رؤية الخلايا السرطانية ذات العلامات الفلورية بسهولة باستخدام مجهر مضان بسيط لتقدير معدل تطور الورم16.
في هذا البروتوكول ، نصف سير العمل لتلطيخ خلايا الزرد T-ALL بصبغة تكاثر الخلايا متبوعة بالانتشار في الجسم الحي للخلايا الملطخة في الزرد CG1 الجيني. عند تطور سرطان الدم ، وصفنا فرز الخلايا التي احتفظت بالصبغة واستخدامها في تجربة زرع التخفيف المحدود اللاحقة لتحديد معدلات التجديد الذاتي ل LSC. يمكن توسيع هذا البروتوكول ليشمل تطبيقات إضافية ، بما في ذلك فحص الأدوية في الجسم الحي للمركبات المحتملة لاستهداف LSCs الهادئة. بالإضافة إلى ذلك ، يمكن استخدام الخلايا المجمعة لتحليلات المصب المختلفة ، مثل التنميط النسخي ، والبروتينات ، والأيض ، مما يوفر رؤى فريدة حول سلوك LSCs الهادئة في T-ALL.
Protocol
في هذا البروتوكول ، نستخدم خلايا T-ALL التي تحمل علامة GFP والتي تم إنشاؤها مسبقا في سلالة CG1 وبالتالي يمكن حقنها مباشرة في الزرد CG1 المتلقي15. باختصار ، تم إنشاء سرطان الدم عن طريق الحقن المجهري للحمض النووي من rag2: Myc و rag2: GFP في أجنة الزرد CG1 أحادية الخلية. تمت مراقبة لتطور سرطان الدم بدءا من 3 أسابيع بعد الحقن ، باستخدام الفحص المجهري الفلوري. تم عزل خلايا ابيضاض الدم الإيجابية ل GFP FACS وزرعها بشكل متسلسل في سمك الزرد CG1 المتلقي لتوليد استنساخ بتردد عال من LSC. تم وصف تفاصيل البروتوكول بأكمله بواسطة Blackburn et al.15.
بدلا من ذلك ، يمكن إنشاء rag2: T-ALL المشتق من Myc عن طريق الحقن المجهري للحمض النووي لأجنة الزرد17. يمكن أن يؤدي الحقن الدقيق للحمض النووي ل rag2: Myc مع مراسل فلوري يحركه rag2 مثل GFP إلى تطوير الخلايا البائية والخلايا التائية ومختلطة ALL18. تم التحقق سابقا من أن مستنسخات سرطان الدم المستخدمة في هذا البروتوكول هي T-ALL15. تمت مراجعة جميع الإجراءات التجريبية التي تنطوي على الزرد والموافقة عليها من قبل لجنة رعاية واستخدام المؤسسية بجامعة كنتاكي ، البروتوكول 2019-3399.
1. نشر خلايا الزرد T-ALL في الجسم الحي
- قم بإذابة قنينة واحدة تحتوي على 1 مل من خلايا T-ALL المجمدة التي تحمل علامة GFP في حمام مائي بدرجة حرارة 37 درجة مئوية مع رج لطيف ، حتى تذوب. بمجرد إذابته ، انقله إلى الجليد.
- قم بسحب محتويات الأنبوب ببطء في أنبوب مخروطي سعة 15 مل مع 4 مل من وسائط الأسماك (0.9x PBS + 5٪ FBS) لتخفيف وسائط التجميد.
- قم بتدويره لمدة 5 دقائق عند 2500 × جم عند 4 درجات مئوية. قم بإزالة الوسائط من الحبيبات. أعد التعليق في 0.5 مل من وسائط الأسماك واحتفظ بالخلايا على الجليد.
- عد الخلايا وقم بتخفيفها إذا لزم الأمر إلى 100000 خلية / 5 ميكرولتر.
- تخدير الزرد CG1 البالغ بإضافة 200 ميكرولتر من مخدر 4 مجم / مل (MS-222) إلى 25 مل من ماء نظام الأسماك في طبق بتري. امسك سمكة CG1 ، الجانب البطني لأعلى وحقن 5-6 ميكرولتر في الفضاء داخل الصفاق (IP) باستخدام حقنة هاملتون ميكرولتر. انقل مرة أخرى إلى خزاناتها وراقب عودتها إلى السباحة الطبيعية قبل إعادتها إلى النظام.
ملاحظة: تم استخدام أسماك الزرد البالغة ، 60 يوما أو أكثر لدراسات الزرع الموصوفة في هذا البروتوكول. - راقب نمو ابيضاض الدم مرة واحدة في الأسبوع باستخدام مجهر مضان. انظر القسم 2 أدناه للحصول على تفاصيل حول إجراءات الفحص.
2. حصاد خلايا سرطان الدم الفلورية
- بعد حوالي 21-28 يوما من الزرع ، قم بتخدير الزرد CG1 البالغ عن طريق إضافة 200 ميكرولتر (4-5 قطرات) من مخدر 4 مجم / مل إلى 25 مل من ماء نظام الأسماك في طبق بتري.
- افحص سمك الزرد CG1 بحثا عن عبء سرطان الدم من خلال تقييم النسبة المئوية لخلايا ابيضاض الدم الموسومة ب GFP في باستخدام مجهر الفلورسنت ، باستخدام المرشح المناسب للكشف عن مضان GFP. سرطان الدم الإيجابي ل GFP جاهز للحصاد إذا انتشر عبر >70٪ من.
- القتل الرحيم للحيوان عن طريق إضافة 1 مل من مخدر 4 ملغ / مل في طبق بتري يحتوي على 9 مل من ماء نظام الأسماك. السماح لجميع علامات الحياة بالتوقف ؛ على سبيل المثال ، راقب الأسماك لوقف الحركة الدائرية (~ 5 دقائق).
- انقل سمك الزرد إلى طبق بتري جديد وأضف 1 مل من وسائط السمك لتكون بمثابة مخزن مؤقت للخلايا. باستخدام شفرة حلاقة جديدة ، قم أولا بقطع رأس الزرد ، ثم نقع الأنسجة باستخدام نفس شفرة الحلاقة. ماصة صعودا وهبوطا لإزاحة كتل كبيرة من الخلايا.
- مرر الخلايا عبر مصفاة خلية 40 ميكرومتر إلى أنبوب مخروطي سعة 50 مل لتفكك إلى معلق أحادي الخلية. الحفاظ على الخلايا على الجليد.
3. تحسين تركيز صبغة تكاثر الخلايا (CellTrace Far Red) للتلطيخ وصلاحية خلايا الزرد
ملاحظة: بالنسبة لهذا البروتوكول ، وبما أن الخلايا السرطانية تحمل علامة GFP ، فقد استخدمنا صبغة تكاثر الخلايا الحمراء البعيدة (CellTrace Far Red) لتجنب التداخل الطيفي ، والذي سيشار إليه باسم CT-FR.
- قم بإعداد محلول 1 مللي مول من صبغة الفلورسنت مباشرة قبل الاستخدام عن طريق إضافة الحجم المناسب من DMSO وفقا لتوصيات الشركة المصنعة. لديك حلول عمل تبلغ 1 مللي متر و 0.5 مللي متر و 0.1 مللي متر و 0.01 مللي مول ؛ خفف حسب الحاجة في أوساط الأسماك لاختبار صلاحية الخلية بعد تلطيخها.
- عد الخلايا واجمع 1 × 106 خلايا في أنابيب طرد مركزي دقيقة سعة 1.5 مل.
- جهاز طرد مركزي عند 2500 × جم عند 4 درجات مئوية لمدة 5 دقائق. قم بإزالة السائل وإعادة تعليق الخلايا في 1 مل من 0.9x PBS.
- قسم معلق الخلية بين أربعة أنابيب سعة كل منها 250 ميكرولتر للعلاج باستخدام CT-FR.
- أضف 250 ميكرولتر من 0.9x PBS لرفع مستوى الصوت إلى 500 ميكرولتر لكل منها مع ما يقرب من 250000 خلية / أنبوب.
- أضف الكميات المطلوبة من حلول العمل الموضحة أعلاه ، إلى كل أنبوب من الأنابيب الأربعة لتحقيق التركيزات النهائية التالية 1 ميكرومتر ، 0.5 ميكرومتر ، 0.1 ميكرومتر ، و 0.05 ميكرومتر. احتضان لمدة 20 دقيقة عند 37 درجة مئوية ، محمية من الضوء.
- قم بإذابة الخلايا عن طريق الدوران لأسفل عند 2,500 × جم لمدة 5 دقائق في درجة حرارة الغرفة. قم بإزالة السائل وغسل الخلايا ب 500 ميكرولتر من وسائط السمك لإزالة الصبغة الزائدة.
- بيليه مرة أخرى ، وإزالة السائل ، وإعادة تعليق في 25 ميكرولتر من وسائط الأسماك. استخدم 1 ميكرولتر لحساب عدد الخلايا في تخفيف 1:10 في 50٪ Trypan Blue.
- فحص الخلايا تحت المجهر لصلاحية الخلية ؛ لن تحتفظ الخلايا الحية بلون تريبان الأزرق وتظهر ساطعة تحت المجهر ، بينما تمتص الخلايا الميتة الصبغة وتظهر داكنة. افحص الخلايا الموجودة تحت القناة الفلورية المناسبة أولا لتحديد الخلايا السرطانية ثم استخدم قناة برايت فيلد لتقييم صلاحية الخلية.
- حدد التركيز الذي يؤدي إلى تلطيخ ناجح مع الحفاظ على صلاحية الخلية (>90٪ خلايا سالبة زرقاء تريبان).
ملاحظة: بالنسبة لخلايا الزرد T-ALL التي تم اختبارها في هذه التجربة ، تم استخدام تركيز 1 ميكرومتر للتلطيخ الناجح ، و >90٪ من صلاحية الخلية.
4. نشر خلايا الزرد T-ALL الملطخة ب CT-FR في الجسم الحي
- باستخدام تركيز CT-FR الأمثل من القسم 3 ، قم بتلطيخ خلايا الزرد. اترك بعض الخلايا السرطانية غير ملوثة لتوليد ورم T-ALL المسمى GFP ، كعنصر تحكم إيجابي في GFP أثناء فرز FACS. تمييع كل من الخلايا الملطخة وغير الملوثة إلى 50000 خلية / 5 ميكرولتر للزراعة.
- تخدير الزرد CG1 البالغ عن طريق إضافة 200 ميكرولتر من مخدر 4 مجم / مل إلى 25 مل من ماء نظام الأسماك في طبق بتري.
- حقن 5 ميكرولتر من معلق الخلية في تجويف IP لسمك الزرد كما هو موضح في القسم 1 لكل من الخلايا الملطخة وغير الملوثة. حقن 5-6 أسماك الزرد لكل مجموعة لحساب الوفيات المحتملة بعد الحقن.
- فحص عن طريق المجهر الفلوري تحت التخدير 2x أسبوعيا لتطوير سرطان الدم.
ملاحظة: بعد ~ 10-14 يوما ، يجب أن يشغل سرطان الدم حوالي 30-40٪ من هذا الجسم. خطط لحصاد سرطان الدم والفرز اللاحق خلال هذا الإطار الزمني. قد يؤدي انتظار توسع الورم إلى حجم كبير إلى تخفيف أكبر لصبغة الخلية الفلورية وصعوبة في اكتشاف إشارته. ضع في اعتبارك تحسين توقيت حصاد الورم لنموذج الورم المختار. بالإضافة إلى ذلك ، يوصى بمراقبة الورم بشكل متكرر هنا لضمان التقاط حجم الورم المطلوب.
5. التحضير لفرز خلايا الزرد T-ALL الملطخة ب CT-FR
- قم بإعداد عناصر التحكم التالية لفرز الخلايا: لا يوجد تحكم في اللون (تعليق غير ملوث ، غير معدل وراثيا ، أحادي الخلية ، من نوع الزرد البري) ، وخلايا T-ALL المسماة GFP ، وخلايا الزرد CT-FR WT الملطخة حديثا (لتحديد الحد الأقصى لإشارة الأحمر البعيد).
- تحضير عناصر التحكم غير الملوثة و CT-FR
- حصاد خلايا الأسماك من النوع البري (WT) عن طريق القتل الرحيم لسمك الزرد CG1 غير المزروع عن طريق إضافة 1 مل من مخدر 4 مجم / مل في طبق بتري يحتوي على 9 مل من ماء نظام الأسماك.
- انقل سمك الزرد إلى طبق بتري جديد وأضف 1 مل من وسائط السمك لتكون بمثابة مخزن مؤقت للخلايا. استخدم شفرة حلاقة جديدة لقطع رأس الزرد أولا ثم نقع الزرد باستخدام نفس شفرة الحلاقة ؛ ماصة صعودا وهبوطا لإزاحة كتل الخلايا الكبيرة.
- مرر الخلايا عبر مصفاة خلية 40 ميكرومتر إلى أنبوب مخروطي سعة 50 مل لتفكك إلى معلق أحادي الخلية. الحفاظ على الخلايا على الجليد.
- للتحكم في CT-FR ، قم بنقل 250,000 خلية WT إلى أنبوب طرد مركزي دقيق وحبيبات الخلايا عن طريق الطرد المركزي عند 2,500 × جم لمدة 5 دقائق في درجة حرارة الغرفة. قم بإزالة وسائط الأسماك وإضافة 500 ميكرولتر من 0.9x PBS + 1٪ FBS.
- أضف 0.5 ميكرولتر من محلول مخزون الصبغة CT-FR 1 mM للحصول على تركيز نهائي يبلغ 1 ميكرومتر. ماصة بلطف مع ماصة 1000 ميكرولتر للخلط. احتضان في 37 درجة مئوية لمدة 20 دقيقة ، محمية من الضوء.
- قم بإزالة السائل وغسل الخلايا ب 500 ميكرولتر من وسائط السمك لإزالة الصبغة الزائدة.
- قم بتجميع الخلايا عن طريق الطرد المركزي مرة أخرى ، وقم بإزالة السائل ، وأعد تعليق الخلايا في 500 ميكرولتر من 0.9x PBS + 1٪ FBS وتمر عبر غطاء مرشح 35 ميكرومتر في أنبوب FACS. ابق على الجليد.
- تحضير لوحة المتبرع
ملاحظة: الصفيحة المانحة عبارة عن صفيحة ذات قاع V مكونة من 96 بئرا يتم فيها فرز خلايا T-ALL الملطخة ب CT-FR من الزرد المزروع. يحتوي كل بئر من اللوحة على 5000 خلية WT CG1 غير ملوثة في 50 ميكرولتر من وسائط الأسماك لتكون بمثابة حامل للمساعدة في تكوير الخلايا التي تم فرزها في الخطوات اللاحقة.- عد 500000 خلية WT CG1 وانقلها إلى أنبوب مخروطي سعة 15 مل.
- خفف مخزون الخلايا هذا إلى 100 خلية / ميكرولتر بإضافة 5 مل من وسائط الأسماك.
- قم بتوزيع 50 ميكرولتر من تعليق الخلية في كل بئر من لوحة 96 بئرا. امزج أنبوب مخزون تعليق الخلية بعد كل صف للحفاظ على تجانس تعليق الخلية. احتفظ بالطبق عند 4 درجات مئوية حتى الفرز.
- تحضير عينات الأسماك المزروعة
- حدد الأسماك المزروعة بعبء T-ALL بنسبة 30-40٪. اجمع الأسماك المزروعة مع كل من الخلايا الملطخة ب CT-FR وخلايا ورم GFP غير الملوثة.
- حصاد الخلايا كما هو موضح في القسم 2.
ملاحظة: نظرا لأنه من المتوقع أن تكون خلايا الاحتفاظ بالصبغة موجودة بوفرة منخفضة ، فاستعد لفرز عدد كبير من الخلايا من عينة CT-FR GFP. - تمييع إلى تركيز مناسب للفرز ~ 3-5 × 106 خلايا / مل في 0.9x PBS + 1٪ FBS ويمر عبر غطاء مرشح 35 ميكرومتر في أنبوب FACS. أضف DAPI (1 مجم / مل) عند تخفيف 1: 1000 كصبغة حيوية لاستبعاد الخلايا الميتة. ابق على الجليد.
- بالنسبة للخلايا السرطانية GFP غير الملوثة ، انقل 250,000 خلية إلى أنبوب طرد مركزي دقيق وحبيبات عند 2,500 × جم لمدة 5 دقائق في درجة حرارة الغرفة. قم بإزالة وسائط الأسماك ، وأضف 500 ميكرولتر من PBS ، وقم بالمرور عبر غطاء مرشح 35 ميكرومتر في أنبوب FACS. ابق على الجليد.
6. الفرز
ملاحظة: احتفظ بجميع الأنابيب ولوحة المتبرع على الثلج طوال الوقت باستثناء عند استخدامها للفرز.
- لفرز المعلمات والبوابات ، ابدأ بتطبيق بوابة التشتت الأمامية والجانبية لتحديد الخلايا ذات الأهمية بناء على حجمها والقضاء على حطام الخلية. بعد ذلك ، استخدم ارتفاع التشتت الأمامي مقابل منطقة التشتت الأمامية لاستبعاد الخلايا المكررة والاحتفاظ بالمفردات فقط. أخيرا ، استخدم عناصر التحكم بدون لون ولون واحد لرسم الأرباع لتحديد مجموعات الخلايا الإيجابية ل GFP و CT-FR الإيجابية.
ملاحظة: من المتوقع أن يكون التحكم CT-FR أكثر إشراقا من عينات الفرز لأن تلطيخ التحكم تم حديثا بدون انقسامات خلوية. من المتوقع أن تظهر الخلايا من عينات CT-FR GFP في الطرف السفلي من البوابة الإيجابية CT-FR. - قم بفرز عدد الخلايا المراد زرعها في كل سمكة في بئر واحدة من لوحة المتبرع.
ملاحظة: في هذه التجربة ، استخدمنا مقايسة التخفيف المقيدة لتقدير تواتر الخلايا الجذعية لسرطان الدم في CT-FR High و CT-FR Low. استخدم هذا الفحص جرعة من 25 خلية ، مزروعة في 3 ، وجرعة من 10 خلايا ، مزروعة في 10. سيتضمن اختبار التخفيف المحدد النموذجي باستخدام rag2: T-ALL المشتق من الزرد مجموعة بها عدد أكبر من الخلايا (500 أو 1000) نظرا لأن تردد LSC في هذا النموذج يقدر ب 1 LSC في مئات الخلايا. ومع ذلك ، في هذا الفحص ، نستخدم أحد استنساخ T-ALL الذي وصفه بلاكبيرن وآخرون سابقا 15. تردد LSC في العينة المستخدمة هنا هو ~ 1 LSC في عشرات الخلايا ؛ نتوقع اكتشاف سرطان الدم في المزروعة في مجموعة الخلايا ال 25. عند تحسين هذا الفحص لنموذج مرضك ، يجب توخي الحذر أثناء اختيار مجموعة رقم الخلية الأعلى لضمان تطعيم الورم. - بعد الفرز ، احتفظ بالطبق على الجليد حتى يصبح جاهزا للزرع.
ملاحظة: يمكن أن تكون إجراءات الفرز مرهقة وتؤثر على صلاحية الخلية. قبل إجراء تجربة التخفيف المحددة الفعلية ، تم إجراء تجربة فرز تجريبية. تم زرع الخلايا المصنفة ومراقبة تطور سرطان الدم لتحديد ما إذا كان الفرز ضارا بصلاحية الخلية. بدلا من ذلك ، يمكن تقييم صلاحية الخلية عن طريق تلطيخ الخلايا التي تم فرزها باستخدام Trypan blue وفحصها تحت المجهر قبل الزرع.
7. زرع الخلايا المصنفة في الحد من التخفيف وتتبع ظهور الورم
- قم بتدوير اللوحة باستخدام جهاز طرد مركزي كبير على الطاولة عند 2500 × جم عند 4 درجات مئوية.
- قم بإزالة 45 ميكرولتر من المادة الطافية بعناية من كل بئر ، واترك 5 ميكرولتر من السائل خلفك وتأكد من تجنب لمس حبيبات الخلية في قاع البئر.
- أعد تعليق الخلايا باستخدام ماصة 20 ميكرولتر. أعد تعليق 2-3 آبار باستخدام الماصة ثم استخدم حقنة هاملتون ميكرولتر ، وقم بحقن معلقات الخلايا من كل بئر في العدد المطلوب من سمك الزرد CG1 عبر زرع IP. ثم أعد تعليق الخلايا في المجموعة التالية من الآبار لتجنب إعادة توطين الخلايا.
- افحص الزرد عن طريق الفحص المجهري الفلوري تحت التخدير مرة واحدة كل أسبوع لتطوير T-ALL لمدة 6 أسابيع على الأقل.
8. تحديد تردد الخلايا الجذعية لسرطان الدم
- سجل عدد الإيجابية لكل جرعة خلية ومجموعة العلاج في 6 أسابيع بعد الزرع ، مع الأخذ في الاعتبار أن التي تحتوي على أي كمية من إشارة GFP إيجابية. ضع في اعتبارك أن تتحمل عبئا كبيرا من سرطان الدم عندما تشغل إشارة GFP >50٪ من الجسم.
- استخدم البرنامج الإحصائي ELDA (تحليل التخفيف الأقصى للحد) المستند إلى الويب (http://bioinf.wehi.edu.au/software/elda/)19 لحساب تكرار LSCs داخل كل مجموعة خلية.
ملاحظة: يتم توفير رسم تخطيطي لسير العمل في الشكل 1.
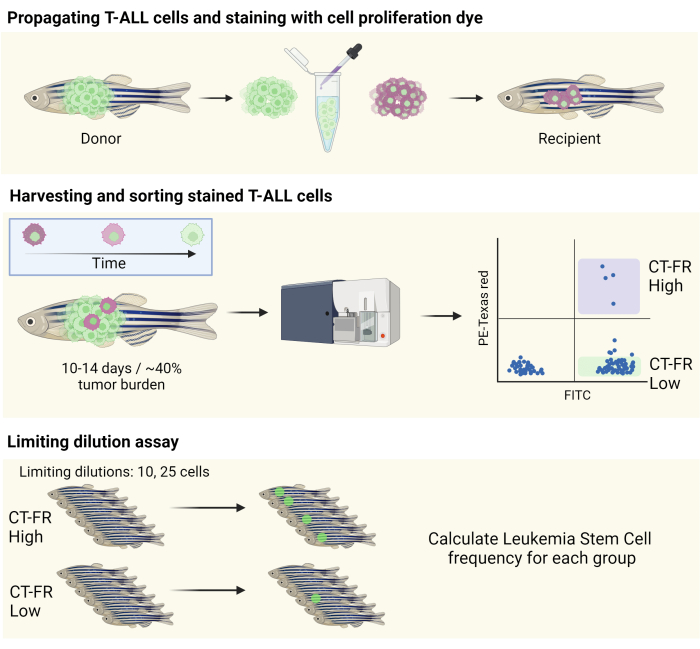
الشكل 1: سير العمل لاستخدام صبغة تتبع الخلية لعزل الخلايا الهادئة في نموذج T-ALL لسمك الزرد. رسم تخطيطي لتلطيخ خلايا الزرد T-ALL بصبغة تكاثر الخلايا ، والانتشار في سمك الزرد CG1 (اللوحة العلوية) ، وفرز الخلايا بناء على الاحتفاظ بصبغة تكاثر الخلايا (اللوحة الوسطى). تم استخدام الخلايا المجمعة لمقايسة التخفيف المحددة لتحديد تواتر LSCs (اللوحة السفلية). الاختصارات: T-ALL = سرطان الدم الليمفاوي الحاد للخلايا التائية. LSCs = الخلايا الجذعية اللوكيميا ؛ CT-FR = تتبع الخلية أحمر أقصى ؛ FITC = فلوريسئين إيزوثيوسيانات ؛ PE = فيكوريثرين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
لقد اتبعنا البروتوكول الموصوف أعلاه لفرز الخلايا التي احتفظت بصبغة تكاثر الخلايا ، CT-FR ، واستخدمناها لمقايسة التخفيف المحدد (LDA) لتقدير تردد LSC في مجموعات CT-FR العالية و CT-FR المنخفضة. لضبط البوابة لتجربة قياس التدفق الخلوي ، استخدمنا عنصر تحكم بدون فلوروفور (بدون لون) بالإض...
Discussion
من المعروف أن LSCs مقاومة للعلاجات الكيميائية التقليدية المضادة للتكاثر ، وإيجاد علاجات مستهدفة ضد هذه الخلايا يحمل وعدا كبيرا في الحد من حدوث الانتكاس وتحسين تشخيص المريض20. وصفت الأبحاث السابقة استخدام بقع تكاثر الخلايا الفلورية لتحديد مجموعة صغيرة من الخ?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم توفير التمويل لهذا البحث من قبل المعهد الوطني للسرطان (R37CA227656 إلى JSB). تم دعم هذا البحث أيضا من قبل الموارد المشتركة لقياس التدفق الخلوي ومراقبة المناعة لمركز السرطان بجامعة كنتاكي ماركي (P30CA177558).
Materials
| Name | Company | Catalog Number | Comments |
| 26 G/2” micro-syringe | Hamilton | 87930 | NA |
| 35 µm filter cap FACS tubes | Falcon | 352235 | NA |
| 40 µm cell strainer | CELLTREAT | 229482 | NA |
| 96-well skirted PCR plate | Thermo Fisher Scientific | AB0800 | NA |
| Cell sorter | Sony Biotechnology | SY3200 | NA |
| CellTrace Far Red | Thermo Fisher Scientific | C34564 | NA |
| Conical tubes | VWR | 10026-078 | NA |
| DAPI | Thermo Fisher Scientific | 62248 | NA |
| DMSO | Sigma-Aldrich | D4818 | NA |
| Dulbecco'sPhosphate-buffered saline (PBS) | Caisson Labs | 22110001 | NA |
| Epifluorescence stereo microscope | Nikon | SMZ25 | NA |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | 12306C | NA |
| Fish system water | N/A | N/A | 0.03-0.05% salinity, pH 6.5-8, buffered with sodium bicarbonate |
| Microcentrifuge tubes | Thermo Fisher Scientific | C2171 | NA |
| MS-222 | Pentaire | TRS-1 | tricaine mesylate, an anesthetic |
| Petri dishes | Corning | 07-202-011 | NA |
| Razor blades | American Line | 66-0089 | NA |
| Trypan Blue | Thermo Fisher Scientific | T10282 | NA |
References
- Reya, T., Morrison, S. J., Clarke, M. F., Weissman, I. L. Stem cells, cancer, and cancer stem cells. Nature. 414 (6859), 105-111 (2001).
- Arai, F., et al. Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell. 118 (2), 149-161 (2004).
- Li, L., Bhatia, R. Stem cell quiescence. Clin. Cancer Res. 17 (15), 4936-4941 (2011).
- Kreso, A., Dick, J. E. Evolution of the cancer stem cell model. Cell Stem Cell. 14 (3), 275-291 (2014).
- Chen, W., Dong, J., Haiech, J., Kilhoffer, M. -. C., Zeniou, M. Cancer stem cell quiescence and plasticity as major challenges in cancer therapy. Stem Cells Int. 2016, 1740936 (2016).
- Kleffel, S., Schatton, T. Tumor dormancy and cancer stem cells: Two sides of the same coin. Adv Exp Med Biol. 734, 145-179 (2013).
- Tuy, K., Rickenbacker, L., Hjelmeland, A. B. Reactive oxygen species produced by altered tumor metabolism impacts cancer stem cell maintenance. Redox Biol. 44, 101953 (2021).
- Zhou, B. -. B. S., et al. Tumour-initiating cells: Challenges and opportunities for anticancer drug discovery. Nat Rev Drug Discov. 8 (10), 806-823 (2009).
- Lyons, A. B., Blake, S. J., Doherty, K. V. Flow cytometric analysis of cell division by dilution of cfse and related dyes. Curr Protoc Cytom. 64 (1), 11-12 (2013).
- Lyons, A. B. Analysing cell division in vivo and in vitro using flow cytometric measurement of cfse dye dilution. J Immunol Methods. 243 (1-2), 147-154 (2000).
- Azari, H., Deleyrolle, L. P., Reynolds, B. A. Using carboxy fluorescein succinimidyl ester (cfse) to identify quiescent glioblastoma stem-like cells. Methods Mol Biol. 1686, 59-67 (2018).
- Deleyrolle, L. P., Rohaus, M. R., Fortin, J. M., Reynolds, B. A., Azari, H. Identification and isolation of slow-dividing cells in human glioblastoma using carboxy fluorescein succinimidyl ester (cfse). J Vis Exp. (62), e3918 (2012).
- Ebinger, S., et al. Characterization of rare, dormant, and therapy-resistant cells in acute lymphoblastic leukemia. Cancer Cell. 30 (6), 849-862 (2016).
- Langenau, D. M., et al. Myc-induced t cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Blackburn, J. S., et al. Clonal evolution enhances leukemia-propagating cell frequency in t cell acute lymphoblastic leukemia through akt/mtorc1 pathway activation. Cancer Cell. 25 (3), 366-378 (2014).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. J Vis Exp. (53), e2790 (2011).
- Borga, C., et al. Simultaneous b and t cell acute lymphoblastic leukemias in zebrafish driven by transgenic myc: Implications for oncogenesis and lymphopoiesis. Leukemia. 33 (2), 333-347 (2019).
- Hu, Y., Smyth, G. K. Elda: Extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Bhojwani, D., Pui, C. -. H. Relapsed childhood acute lymphoblastic leukaemia. Lancet Oncol. 14 (6), e205-e217 (2013).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. 4 (1), 35-44 (2005).
- Al-Hamaly, M. A., et al. Zebrafish drug screening identifies erlotinib as an inhibitor of wnt/β-catenin signaling and self-renewal in t-cell acute lymphoblastic leukemia. Biomed Pharmacother. 170, 116013 (2024).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved