需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用细胞增殖染色鉴定斑马鱼 T 细胞急性淋巴细胞白血病模型中的静止细胞
摘要
我们使用细胞增殖染色来识别斑马鱼 T 急性淋巴细胞白血病模型中的静止细胞。染色保留在非分裂细胞中,并在细胞增殖过程中减少,从而能够选择休眠细胞进行进一步检测。该协议提供了一种功能工具,用于在细胞静止的背景下研究自我更新。
摘要
细胞静止是在正常干细胞和癌症干细胞 (CSC) 中描述的一种生长停滞或增殖缓慢的状态。静止可以保护 CSCs 免受抗增殖化疗药物的影响。在 T 细胞急性淋巴细胞白血病 (T-ALL) 患者来源的异种移植物 (PDX) 小鼠模型中,静止细胞与治疗耐药性和干性相关。细胞增殖染料是追踪细胞分裂的常用工具。荧光染料共价锚定在细胞膜上的胺基和大分子中。这允许追踪标记细胞多达 10 次分裂,这可以通过流式细胞术解决。
最终,增殖率最高的细胞将具有较低的染料保留率,因为它会在每次细胞分裂时被稀释,而休眠、分裂较慢的细胞将具有最高的保留。使用细胞增殖染料分离休眠细胞已在 T-ALL 小鼠模型中得到优化和描述。作为现有小鼠模型的补充, rag2:Myc 衍生的斑马鱼 T-ALL 模型提供了一个极好的场所来询问 T-ALL 中的自我更新,因为白血病干细胞 (LSC) 的频率很高,并且斑马鱼便于进行大规模移植实验。
在这里,我们描述了用细胞增殖染料对斑马鱼 T-ALL 细胞进行染色的工作流程,优化斑马鱼细胞的染料浓度,在 体内成功染色的细胞,以及通过从移植动物中分选活细胞来收集具有不同染料保留水平的细胞。鉴于 T-ALL 中缺乏成熟的 LSC 细胞表面制造器,这种方法提供了一种在 体内询问静止细胞的功能性手段。为了获得代表性结果,我们描述了高和低染料保留细胞的植入效率和 LSC 频率。该方法可以帮助研究静止细胞的其他特性,包括药物反应、转录谱和形态。
引言
成体干细胞负责给定器官中分化细胞类型的再生,并且主要以休眠、非分裂状态存在 1,2。例如,维持血液的造血干细胞 (HSC) 在很大程度上保持静止状态,只有一小部分进入细胞周期进行自我更新或分化以产生成熟血液成分3。同样,在癌症中,一种称为癌症干细胞 (CSC) 的罕见细胞亚群具有自我更新能力,并负责恶性肿瘤的长期维持4。癌症干细胞在体内以静止或缓慢生长的状态存在,这可能使它们能够逃避抗增殖癌症治疗5,逃避免疫系统的清除6,减少氧化应激,并增强其 DNA 修复途径7。即使治疗后留下的少量 CSCs 也有可能使肿瘤重新繁殖,从而导致患者复发8。因此,了解细胞静止对于识别 CSCs 的潜在脆弱性和开发靶向它们的新方法具有很大的希望。
细胞增殖染料,如羧基荧光素琥珀酰亚胺酯 (CFSE) 染料及其衍生物,通常用于跟踪细胞分裂的频率9。染料渗透到细胞膜上,一旦进入细胞,就会被细胞内酯酶激活成荧光产物。所得荧光化合物通过琥珀酰亚胺基团和细胞内蛋白的胺官能团之间形成的共价酰胺键保留在细胞内10。每次细胞分裂时,荧光化合物在两个产生的细胞之间平均分配,导致信号稀释两倍。该染料可通过流式细胞术分析检测多达 10 次细胞分裂11。
这种方法以前已被用于通过识别染料保留率高的慢循环细胞群来丰富体外 CSC 细胞群11,12。在 T-ALL 中,CFSE 已用于跟踪小鼠患者来源的异种移植物体内肿瘤生长。在细胞标记和移植 3 周后,流式细胞术分析显示,罕见的细胞群仍保留 CFSE 荧光。该群体与干性、治疗耐药性以及与患者13 中导致复发的细胞的高度相似性相关。因此,该染料为研究 T-ALL 中的白血病干细胞 (LSC) 表型提供了有用的工具。
这项工作的目的是将细胞增殖染料的应用扩展到使用斑马鱼 T-ALL 模型研究 体内 静止。特别是, rag2:Myc 驱动的斑马鱼 T-ALL 模型14 为研究自我更新提供了极好的场所,因为与小鼠模型和人类疾病相比,LSC 的频率很高15。此外,斑马鱼的使用允许进行大规模的移植研究,与小鼠相比,这可以以低得多的护理和维护成本完成16。斑马鱼也非常适合实时成像应用,因为可以使用简单的荧光显微镜轻松观察荧光标记的肿瘤细胞,以估计肿瘤的发展速度16。
在该方案中,我们描述了用细胞增殖染料对斑马鱼 T-ALL 细胞进行染色,然后在同基因 CG1 斑马鱼中对染色细胞进行体内 繁殖的工作流程。在白血病发展时,我们描述了保留染料的细胞的分选及其用于随后的有限稀释移植实验,以量化 LSC 自我更新的速率。该方案可以扩展到其他应用,包括靶向静态 LSC 的潜在化合物的 体内 药物筛选。此外,收集的细胞可用于不同的下游分析,例如转录组学分析、蛋白质组学和代谢组学,为 T-ALL 中静止 LSC 的行为提供独特的见解。
研究方案
在该方案中,我们使用 GFP 标记的斑马鱼 T-ALL 细胞,这些细胞先前在 CG1 菌株中产生,因此可以直接注射到受体同基因 CG1 斑马鱼15 中。简而言之,通过将 rag2:Myc 和 rag2:GFP 的 DNA 显微注射到单细胞 CG1 斑马鱼胚胎中产生白血病。使用荧光显微镜从注射后 3 周开始监测动物的白血病发展。分离 GFP 阳性白血病细胞 FACS 并连续移植到受体 CG1 斑马鱼中,以产生具有高 LSC 频率的克隆。Blackburn 等人描述了整个协议的细节15。
或者,可以通过斑马鱼胚胎的 DNA 显微注射产生原代 rag2:Myc 衍生的 T-ALL17。用 rag2 驱动的荧光报告基因(如 GFP)显微注射 rag2:Myc 的 DNA 可导致 B 细胞、T 细胞和混合 ALL18 的发育。该方案中使用的白血病克隆先前被验证为 T-ALL15。肯塔基大学机构动物护理和使用委员会(协议 2019-3399)审查和批准了所有涉及斑马鱼的实验程序。
1. 在体内增殖斑马鱼 T-ALL 细胞
- 在 37 °C 水浴中轻轻摇晃,解冻一个含有 1 mL 冷冻 GFP 标记的斑马鱼 T-ALL 细胞的小瓶,直至解冻。解冻后,转移到冰上。
- 将试管内容物缓慢移液到装有 4 mL 鱼培养基(0.9x PBS + 5% FBS)的 15 mL 锥形管中,以稀释冷冻培养基。
- 在 4 °C 下以 2,500 × g 旋转 5 分钟。 从沉淀中取出培养基。重悬于 0.5 mL 鱼培养基中,并将细胞置于冰上。
- 计数细胞,必要时将其稀释至 100,000 个细胞/5 μL。
- 通过在培养皿中的 25 mL 鱼系统水中加入 200 μL 4 mg/mL 麻醉剂 (MS-222) 来麻醉成年 CG1 斑马鱼。握住 CG1 鱼,腹侧朝上,使用 Hamilton 微升注射器将 5-6 μL 注射到腹膜内 (IP) 空间。将动物移回它们的水箱中,并监测它们是否恢复正常游泳,然后再将它们放回系统。
注意:60 天或以上的成年斑马鱼用于本协议中描述的移植研究。 - 使用荧光显微镜每周监测一次白血病生长情况。有关筛选程序的详细信息,请参阅下面的第 2 节。
2. 收获荧光标记的白血病细胞
- 移植后约 21-28 天,在培养皿中向 25 mL 鱼系统水中加入 200 μL(4-5 滴)4 mg/mL 麻醉剂,麻醉成年 CG1 斑马鱼。
- 通过使用落射荧光显微镜评估动物中 GFP 标记的白血病细胞的百分比,使用适当的滤光片检测 GFP 荧光,检查 CG1 斑马鱼的白血病负荷。如果 GFP 阳性白血病已经扩散到 >70% 的动物,就可以收获它。
- 通过在含有 9 mL 鱼系统水的培养皿中加入 1 mL 4 mg/mL 麻醉剂对动物实施安乐死。让所有生命的迹象停止;例如,观察鱼的鳃盖运动是否停止 (~5 min)。
- 将斑马鱼移至新的培养皿中,加入 1 mL 鱼培养基作为细胞的缓冲液。使用新的剃须刀片,首先将斑马鱼斩首,然后使用相同的剃须刀片浸渍组织。上下吹打以去除大块细胞。
- 将细胞通过 40 μm 细胞过滤器放入 50 mL 锥形管中,以解离成单细胞悬液。将细胞放在冰上。
3. 优化细胞增殖染料 (CellTrace Far Red) 浓度,用于染色和斑马鱼细胞活力
注:对于该方案,由于肿瘤细胞是 GFP 标记的,我们使用了远红细胞增殖染料 (CellTrace Far Red) 来避免光谱重叠,这将被称为 CT-FR。
- 根据制造商的建议,在临用前加入适当体积的 DMSO 制备 1 mM 荧光染料溶液。具有 1 mM、0.5 mM、0.1 mM 和 0.01 mM 的工作溶液;根据需要在鱼培养基中稀释,以测试染色后的细胞活力。
- 对细胞进行计数,并在 1.5 mL 微量离心管中收集 1 ×10、6 个 细胞。
- 在 4 °C 下以 2,500 × g 离心 5 分钟。取出液体并将细胞重悬于 1 mL 的 0.9x PBS 中。
- 将细胞悬液分装在四管中,每管 250 μL,用于 CT-FR 处理。
- 加入 250 μL 的 0.9x PBS,使体积达到 500 μL,每个细胞约为 250,000 个细胞/管。
- 向四个试管中的每一个试管中加入所需量的上述工作溶液,以达到以下最终浓度 1 μM、0.5 μM、0.1 μM 和 0.05 μM。在 37 °C 下避光孵育 20 分钟。
- 通过在室温下以 2,500 × g 旋转 5 分钟来沉淀细胞。取出液体并用 500 μL 鱼培养基洗涤细胞以去除多余的染料。
- 再次沉淀,去除液体,并重悬于 25 μL 鱼培养基中。使用 1 μL 在 50% 台盼蓝中以 1:10 稀释的比例对细胞进行计数。
- 在显微镜下检查细胞的细胞活力;活细胞不会保留台盼蓝,在显微镜下显得明亮,而死细胞会吸收染料并显得暗。首先检查适当荧光通道下的细胞以识别肿瘤细胞,然后使用明场通道评估细胞活力。
- 选择在保持细胞活力的同时成功染色的浓度(>90% 台盼蓝阴性细胞)。
注:对于本实验中测试的斑马鱼 T-ALL 细胞,使用 1 μM 浓度成功染色,细胞活力为 >90%。
4. 在体内增殖 CT-FR 染色的 T-ALL 斑马鱼细胞
- 使用第 3 部分优化的 CT-FR 浓度,对斑马鱼细胞进行染色。在FACS分选过程中,保留一些未染色的肿瘤细胞以产生GFP标记的T-ALL肿瘤,作为GFP阳性对照。将染色和未染色的细胞稀释至 50,000 个细胞/5 μL 用于移植。
- 通过在培养皿中的 25 mL 鱼系统水中加入 200 μL 4 mg/mL 麻醉剂来麻醉成年 CG1 斑马鱼。
- 如第 1 节所述,将 5 μL 细胞悬液注入斑马鱼的 IP 腔中,适用于染色和未染色的细胞。每组注射 5-6 条斑马鱼,以考虑注射后的潜在死亡率。
- 在镇静下每周 2 次通过荧光显微镜检查动物的白血病发展情况。
注意:~10-14 天后,白血病应占据这个身体的 30-40% 左右。在此时间范围内计划白血病收获和后续排序。等待肿瘤扩大到较大尺寸可能会导致荧光细胞染料被稀释,并且难以检测其信号。考虑为所选的肿瘤模型优化肿瘤收获的时间。此外,这里建议更频繁地监测肿瘤,以确保捕获所需的肿瘤大小。
5. 准备分选 CT-FR 染色的斑马鱼 T-ALL 细胞
- 准备以下用于细胞分选的对照:无颜色对照(未染色、非转基因、单细胞悬液,来自野生型斑马鱼)、GFP 标记的 T-ALL 细胞和新染色的 CT-FR WT 斑马鱼细胞(用于设置 Far-Red 信号的最大阈值)。
- 制备未染色和 CT-FR 对照
- 通过在含有 9 mL 鱼系统水的培养皿中加入 1 mL 4 mg/mL 麻醉剂,对未移植的 CG1 斑马鱼实施安乐死来收获野生型 (WT) 鱼细胞。
- 将斑马鱼移至新的培养皿中,加入 1 mL 鱼培养基作为细胞的缓冲液。使用新的剃须刀片先将斑马鱼斩首,然后使用相同的剃须刀片将斑马鱼浸碎;上下移液以去除大细胞团块。
- 将细胞通过 40 μm 细胞过滤器放入 50 mL 锥形管中,以解离成单细胞悬液。将细胞放在冰上。
- 对于 CT-FR 对照,将 250,000 个 WT 细胞转移到微量离心管中,并在室温下以 2,500 × g 离心 5 分钟来沉淀细胞。去除鱼培养基并加入 500 μL 0.9x PBS+ 1% FBS。
- 加入 0.5 μL 的 1 mM CT-FR 染料储备液,终浓度为 1 μM。用 1,000 μL 移液管轻轻移液混合。在 37 °C 下孵育 20 分钟,避光。
- 取出液体并用 500 μL 鱼培养基洗涤细胞以去除多余的染料。
- 再次离心使细胞沉淀,除去液体,将细胞重悬于 500 μL 0.9x PBS+ 1% FBS 中,并通过 35 μm 过滤帽进入 FACS 管中。保持在冰上。
- 准备供体板
注:供体板是一个 96 孔 V 形底板,来自移植斑马鱼的 CT-FR 染色的 T-ALL 细胞将被分选到其中。板的每个孔在 50 μL 鱼培养基中含有 5,000 个未染色的 WT CG1 细胞,作为载体,帮助在后续步骤中沉淀分选的细胞。- 计数 500,000 个 WT CG1 细胞并将其转移到 15 mL 锥形管中。
- 通过添加 5 mL 鱼类培养基,将此细胞原液稀释至 100 个细胞/μL。
- 将 50 μL 细胞悬液分配到 96 孔板的每个孔中。每行后混合细胞悬液储备管,以保持细胞悬液的均匀性。将板保持在 4 °C 直至分选。
- 准备移植的鱼样本
- 选择负荷为 30-40% T-ALL 的移栽鱼。收集用 CT-FR 染色的细胞和未染色的 GFP 肿瘤细胞移植的鱼。
- 如第 2 节所述收获细胞。
注意:由于预计染料保留细胞以低丰度存在,因此准备从 CT-FR GFP 样品中分选大量细胞。 - 在 0.9x PBS + 1% FBS 中稀释成适当的浓度以分选 ~3-5 ×10 6 个细胞/mL,并通过 35 μm 过滤器盖进入 FACS 管。添加 1:1,000 稀释度的 DAPI (1 mg/mL) 作为活性染料,以排除死细胞。保持在冰上。
- 对于未染色的 GFP 肿瘤细胞,将 250,000 个细胞转移到微量离心管中,并在室温下以 2,500 × g 沉淀 5 分钟。去除鱼培养基,加入 500 μL PBS,然后通过 35 μm 过滤帽进入 FACS 管。保持在冰上。
6. 排序
注意:除用于分选外,请始终将所有试管和供体板置于冰上。
- 对于分选参数和门,首先应用前向和侧向散射门控,以根据细胞的大小识别感兴趣的细胞并消除细胞碎片。接下来,使用前向散射高度与前向散射区域来排除重复的单元格并仅保留单体。最后,使用无色和单色对照绘制象限以识别 GFP 阳性和 CT-FR 阳性细胞群。
注意:预计 CT-FR 对照将比用于分选的样品亮得多,因为对照的染色是新鲜完成的,没有细胞分裂;来自 CT-FR GFP 样品的细胞预计会出现在 CT-FR 阳性门的下端。 - 将要移植到每条鱼中的细胞数量分类到供体板的一个孔中。
注意:在本实验中,我们使用极限稀释测定法来估计 CT-FR High 和 CT-FR Low 中白血病干细胞的频率。该测定使用了 25 个细胞的剂量,移植到 3 只动物中,以及 10 个细胞的剂量,移植到 10 只动物中。使用斑马鱼 rag2:Myc 衍生的 T-ALL 的典型极限稀释测定将涉及具有较高细胞数(500 或 1,000)的一组,因为该模型中的 LSC 频率估计为数百个细胞中的 1 个 LSC。然而,在该测定中,我们使用的是 Blackburn 等人之前描述的 T-ALL 克隆之一15。此处使用的样品中的 LSC 频率为数十个单元中的 ~1 LSC;我们预测在 25 细胞组移植的动物中检测到白血病。当您的疾病模型优化此检测时,在选择较高的细胞数组时应小心,以确保肿瘤的植入。 - 分选后,将板放在冰上,直到准备好移植。
注:分选程序可能会带来压力并影响细胞活力。在运行实际的极限稀释实验之前,进行了中试分选实验。移植分选的细胞并监测白血病的发展,以确定分选是否对细胞活力有害。或者,可以通过用台盼蓝对分选的细胞进行染色并在移植前在显微镜下检查来评估细胞活力。
7. 在有限稀释度下移植分选的细胞并追踪肿瘤发作
- 使用 4 °C 下 2,500 × g 的大型台式离心机旋转板。
- 小心地从每个孔中取出 45 μL 上清液,留下 5 μL 液体,并确保避免接触孔底部的细胞沉淀。
- 用 20 μL 移液管重悬细胞。用移液管重悬 2-3 个孔,然后使用 Hamilton 微升注射器,通过 IP 移植将每个孔中的细胞悬液注射到所需数量的 CG1 斑马鱼中。然后,将细胞重悬于下一组孔中,以避免细胞重新复位。
- 在镇静下每周一次通过荧光显微镜检查斑马鱼的 T-ALL 发展情况,持续至少 6 周。
8. 白血病干细胞频率的测定
- 在移植后 6 周记录每个细胞剂量和治疗组的阳性动物数量,认为具有任何数量的 GFP 信号的动物为阳性。当 GFP 信号占据身体的 >50% 时,考虑动物具有显着的白血病负担。
- 使用基于 Web 的 ELDA(极限稀释分析)统计软件 (http://bioinf.wehi.edu.au/software/elda/)19 计算每个细胞群中 LSC 的频率。
注意: 图 1 提供了工作流程的示意图。
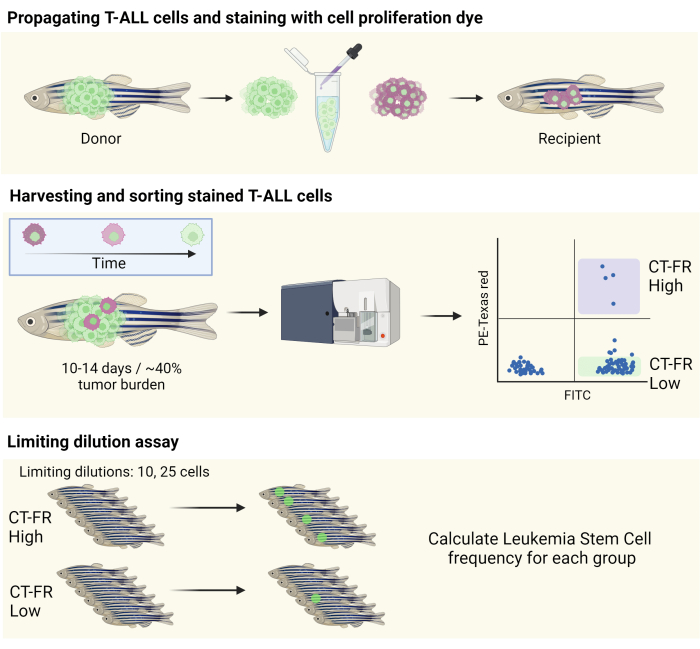
图 1:在斑马鱼 T-ALL 模型中使用细胞示踪染料分离静止细胞的工作流程。 使用细胞增殖染色剂对斑马鱼 T-ALL 细胞进行染色,繁殖到 CG1 斑马鱼中(上图)以及根据细胞增殖染色剂的保留情况对细胞进行分选(中图)的示意图。收集的细胞用于有限稀释测定以确定 LSC 的频率(下图)。缩写:T-ALL = T 细胞急性淋巴细胞白血病;LSCs = 白血病干细胞;CT-FR = CellTrace 远红;FITC = 异硫氰酸荧光素;PE = 藻红蛋白。 请单击此处查看此图的较大版本。
结果
我们按照上述方案对保留细胞增殖染料 CT-FR 的细胞进行分选,并将它们用于极限稀释测定 (LDA) 以估计 CT-FR High 和 CT-FR Low 群体中的 LSC 频率。为了设置流式细胞术实验的门控,除了单色对照外,我们还使用了无荧光团(无颜色)对照 (图 2A)。这些象限用于识别 FITC 和 PE 阳性和阴性群体,以设置排序门。在分选的同一天,通过对未?...
讨论
已知 LSC 对常规的抗增殖化疗具有耐药性,寻找针对这些细胞的靶向疗法在减少复发发生和改善患者预后方面具有很大的前景20。以前的研究描述了使用 T-ALL PDX 模型中的荧光细胞增殖染色剂来识别与耐药性和干性相关的一小部分静止细胞群13。在这项工作中,我们描述了使用类似的细胞增殖染色来分辨 T-ALL 斑马鱼模型中的缓慢分裂或静...
披露声明
作者没有需要披露的利益冲突。
致谢
这项研究的资金由美国国家癌症研究所 (R37CA227656 JSB) 提供。这项研究也得到了肯塔基大学马基癌症中心 (P30CA177558) 的流式细胞术和免疫监测共享资源的支持。
材料
| Name | Company | Catalog Number | Comments |
| 26 G/2” micro-syringe | Hamilton | 87930 | NA |
| 35 µm filter cap FACS tubes | Falcon | 352235 | NA |
| 40 µm cell strainer | CELLTREAT | 229482 | NA |
| 96-well skirted PCR plate | Thermo Fisher Scientific | AB0800 | NA |
| Cell sorter | Sony Biotechnology | SY3200 | NA |
| CellTrace Far Red | Thermo Fisher Scientific | C34564 | NA |
| Conical tubes | VWR | 10026-078 | NA |
| DAPI | Thermo Fisher Scientific | 62248 | NA |
| DMSO | Sigma-Aldrich | D4818 | NA |
| Dulbecco'sPhosphate-buffered saline (PBS) | Caisson Labs | 22110001 | NA |
| Epifluorescence stereo microscope | Nikon | SMZ25 | NA |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | 12306C | NA |
| Fish system water | N/A | N/A | 0.03-0.05% salinity, pH 6.5-8, buffered with sodium bicarbonate |
| Microcentrifuge tubes | Thermo Fisher Scientific | C2171 | NA |
| MS-222 | Pentaire | TRS-1 | tricaine mesylate, an anesthetic |
| Petri dishes | Corning | 07-202-011 | NA |
| Razor blades | American Line | 66-0089 | NA |
| Trypan Blue | Thermo Fisher Scientific | T10282 | NA |
参考文献
- Reya, T., Morrison, S. J., Clarke, M. F., Weissman, I. L. Stem cells, cancer, and cancer stem cells. Nature. 414 (6859), 105-111 (2001).
- Arai, F., et al. Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell. 118 (2), 149-161 (2004).
- Li, L., Bhatia, R. Stem cell quiescence. Clin. Cancer Res. 17 (15), 4936-4941 (2011).
- Kreso, A., Dick, J. E. Evolution of the cancer stem cell model. Cell Stem Cell. 14 (3), 275-291 (2014).
- Chen, W., Dong, J., Haiech, J., Kilhoffer, M. -. C., Zeniou, M. Cancer stem cell quiescence and plasticity as major challenges in cancer therapy. Stem Cells Int. 2016, 1740936 (2016).
- Kleffel, S., Schatton, T. Tumor dormancy and cancer stem cells: Two sides of the same coin. Adv Exp Med Biol. 734, 145-179 (2013).
- Tuy, K., Rickenbacker, L., Hjelmeland, A. B. Reactive oxygen species produced by altered tumor metabolism impacts cancer stem cell maintenance. Redox Biol. 44, 101953 (2021).
- Zhou, B. -. B. S., et al. Tumour-initiating cells: Challenges and opportunities for anticancer drug discovery. Nat Rev Drug Discov. 8 (10), 806-823 (2009).
- Lyons, A. B., Blake, S. J., Doherty, K. V. Flow cytometric analysis of cell division by dilution of cfse and related dyes. Curr Protoc Cytom. 64 (1), 11-12 (2013).
- Lyons, A. B. Analysing cell division in vivo and in vitro using flow cytometric measurement of cfse dye dilution. J Immunol Methods. 243 (1-2), 147-154 (2000).
- Azari, H., Deleyrolle, L. P., Reynolds, B. A. Using carboxy fluorescein succinimidyl ester (cfse) to identify quiescent glioblastoma stem-like cells. Methods Mol Biol. 1686, 59-67 (2018).
- Deleyrolle, L. P., Rohaus, M. R., Fortin, J. M., Reynolds, B. A., Azari, H. Identification and isolation of slow-dividing cells in human glioblastoma using carboxy fluorescein succinimidyl ester (cfse). J Vis Exp. (62), e3918 (2012).
- Ebinger, S., et al. Characterization of rare, dormant, and therapy-resistant cells in acute lymphoblastic leukemia. Cancer Cell. 30 (6), 849-862 (2016).
- Langenau, D. M., et al. Myc-induced t cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Blackburn, J. S., et al. Clonal evolution enhances leukemia-propagating cell frequency in t cell acute lymphoblastic leukemia through akt/mtorc1 pathway activation. Cancer Cell. 25 (3), 366-378 (2014).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. J Vis Exp. (53), e2790 (2011).
- Borga, C., et al. Simultaneous b and t cell acute lymphoblastic leukemias in zebrafish driven by transgenic myc: Implications for oncogenesis and lymphopoiesis. Leukemia. 33 (2), 333-347 (2019).
- Hu, Y., Smyth, G. K. Elda: Extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Bhojwani, D., Pui, C. -. H. Relapsed childhood acute lymphoblastic leukaemia. Lancet Oncol. 14 (6), e205-e217 (2013).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. 4 (1), 35-44 (2005).
- Al-Hamaly, M. A., et al. Zebrafish drug screening identifies erlotinib as an inhibitor of wnt/β-catenin signaling and self-renewal in t-cell acute lymphoblastic leukemia. Biomed Pharmacother. 170, 116013 (2024).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。