このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
細胞増殖染色を用いたゼブラフィッシュT細胞急性リンパ芽球性白血病モデルにおける静止細胞の同定
要約
細胞増殖染色を用いて、ゼブラフィッシュT急性リンパ芽球性白血病モデルにおける静止細胞を同定しました。染色は非分裂細胞に保持され、細胞増殖中に減少するため、さらなる調査のために休眠細胞を選択できます。このプロトコルは、細胞の静止の文脈で自己複製を研究するための機能的なツールを提供します。
要約
細胞の静止状態は、正常幹細胞およびがん幹細胞(CSC)で説明される成長停止または増殖の遅延状態です。静止は、CSCを抗増殖性化学療法薬から保護する可能性があります。T細胞性急性リンパ芽球性白血病(T-ALL)患者由来異種移植片(PDX)マウスモデルでは、静止細胞は治療抵抗性および幹細胞性に関連しています。細胞増殖色素は、細胞分裂を追跡するための一般的なツールです。蛍光色素は、メンブレン上のアミン基と細胞内の高分子に共有結合的に固定されています。これにより、標識細胞を最大10分裂まで追跡でき、フローサイトメトリーで解決できます。
最終的に、増殖速度が最も高い細胞は、細胞分裂のたびに希釈されるため、色素の保持が低くなりますが、休眠中の分裂の遅い細胞は保持率が高くなります。休眠細胞を単離するための細胞増殖色素の使用は最適化されており、T-ALLマウスモデルで説明されています。既存のマウスモデルを補完する 、rag2:Myc由来のゼブラフィッシュT-ALLモデルは、白血病幹細胞(LSC)の頻度が高いことと、ゼブラフィッシュが大規模な移植実験に便利であることから、T-ALLの自己複製を調査する優れた場所を提供します。
ここでは、ゼブラフィッシュT-ALL細胞を細胞増殖色素で染色するワークフロー、ゼブラフィッシュ細胞の色素濃度の最適化、 in vivoでの染色に成功した細胞の継代、および移植動物からの生細胞選別によるさまざまなレベルの色素保持を持つ細胞の収集について説明します。T-ALLにはLSCの細胞表面メーカーが確立されていないため、このアプローチはin vivoで静止細胞を調べる機能的な手段を提供します。代表的な結果として、高色素保持細胞と低色素保持細胞の生着効率とLSC頻度について説明します。この方法は、薬物応答、転写プロファイル、形態など、静止細胞のさらなる特性を調べるのに役立ちます。
概要
成体幹細胞は、特定の臓器における分化した細胞型の再生に関与しており、主に休眠中の非分裂状態で存在します1,2。例えば、血液を維持する造血幹細胞(HSC)は、大部分が静止したままであり、ごく一部だけが細胞周期に入って自己更新または分化して成熟した血液成分を生成する3。同様に、がんでは、がん幹細胞(CSC)と呼ばれる細胞のまれな亜集団が自己複製能力を持ち、悪性腫瘍の長期維持に関与しています4。がん幹細胞は、in vivoで静止状態または増殖が遅い状態で存在し、それにより、抗増殖がん治療5を回避し、免疫系6によるクリアランスを回避し、酸化ストレスを軽減し、DNA修復経路7を強化することができる可能性があります。治療後に残されたCSCの数が少ない場合でも、腫瘍が再増殖し、患者の再発につながる可能性があります8。したがって、細胞の静止を理解することは、CSCの潜在的な脆弱性を特定し、それらを標的とする新しい方法の開発に大きな期待を寄せています。
カルボキシフルオレセインスクシンイミジルエステル(CFSE)染色剤やその誘導体などの細胞増殖色素は、細胞分裂の頻度を追跡するために一般的に使用されています9。この色素は細胞膜を透過し、細胞内に入ると、細胞内エステラーゼによって活性化され、蛍光生成物になります。得られた蛍光化合物は、細胞内タンパク質のスクシンイミジル部分とアミン官能基との間に形成される共有アミド結合を通じて細胞内に保持される10。細胞分裂のたびに、蛍光化合物は得られた2つの細胞間で均等に分割され、シグナルが2倍に希釈されます。この色素は、フローサイトメトリー解析11により、最大10の細胞分裂を検出することができます。
このアプローチは、色素11,12の保持が高い細胞のスローサイクリング集団を同定することにより、in vitroでCSC集団を濃縮するために以前に利用されてきました。T-ALLでは、マウスの患者由来異種移植片における腫瘍増殖のin vivo追跡にCFSEが使用されています。細胞標識と移植の3週間後、フローサイトメトリー分析では、CFSE蛍光をまだ保持している細胞のまれな集団が示されました。この集団は、患者における幹細胞性、治療抵抗性、および再発原因細胞との高い類似性に関連していました13。したがって、この色素は、T-ALLにおける白血病幹細胞(LSC)表現型の研究に有用なツールを提供します。
この研究の目的は、ゼブラフィッシュのT-ALLモデルを使用してin vivo での静止を研究するための細胞増殖色素の応用を拡大することです。特に、 rag2:Myc駆動のゼブラフィッシュT-ALLモデル14 は、マウスモデルやヒト疾患15と比較してLSCの頻度が高いため、自己複製の研究に最適な場所を提供します。さらに、ゼブラフィッシュの使用により、大規模な移植研究が可能になり、マウスと比較してはるかに低いケアとメンテナンスのコストで行うことができます16。ゼブラフィッシュは、蛍光標識された腫瘍細胞を単純な蛍光顕微鏡を使用して容易に観察し、腫瘍の発生速度を推定できるため、ライブイメージングアプリケーションにも優れています16。
このプロトコールでは、ゼブラフィッシュのT-ALL細胞を細胞増殖色素で染色し、続いて同系CG1ゼブラフィッシュで染色した細胞をin vivo で増殖させるワークフローについて説明します。白血病の発症に際し、色素を保持した細胞の選別と、LSCの自己複製速度を定量化するためのその後の限界希釈移植実験での使用について説明します。このプロトコールは、静止LSCを標的とするための潜在的な化合物の in vivo 薬物スクリーニングなど、追加のアプリケーションに拡張できます。さらに、収集された細胞は、トランスクリプトームプロファイリング、プロテオミクス、メタボロミクスなどのさまざまなダウンストリーム解析に使用でき、T-ALLにおける静止LSCの挙動に関する独自の洞察を提供します。
プロトコル
このプロトコルでは、CG1株で以前に生成されたGFP標識ゼブラフィッシュT-ALL細胞を使用しているため、レシピエントの同系CG1ゼブラフィッシュ15に直接注入することができます。簡単に説明すると、白血病は、単一細胞CG1ゼブラフィッシュ胚への rag2:Myc および rag2:GFP のDNAマイクロインジェクションによって生成されました。動物は、注射後3週間から蛍光顕微鏡を用いて白血病の発症をモニターした。GFP陽性白血病細胞をFACSで単離し、レシピエントCG1ゼブラフィッシュに連続移植して、LSCの頻度が高いクローンを作製しました。プロトコル全体の詳細は、Blackburnら15によって説明されています。
あるいは、ゼブラフィッシュ胚17のDNAマイクロインジェクションにより、一次rag2:Myc由来のT-ALLを作製することができる。rag2:MycにGFPなどのrag2駆動型蛍光レポーターをDNAマイクロインジェクションすると、B細胞、T細胞、および混合ALL18が発生する可能性があります。このプロトコルで使用された白血病クローンは、以前にT-ALL15であることが確認されていました。ゼブラフィッシュを含むすべての実験手順は、ケンタッキー大学の動物管理・使用委員会(プロトコル2019-3399)によって審査され、承認されました。
1. ゼブラフィッシュのT-ALL細胞の生体内増殖
- 凍結GFP標識ゼブラフィッシュT-ALL細胞1 mLが入ったバイアル1本を、37°Cの水浴で穏やかに振とうしながら解凍します。解凍したら、氷に移します。
- チューブの内容物を15mLの円錐形チューブにゆっくりとピペットで入れ、4mLの魚培地(0.9x PBS + 5%FBS)を入れて凍結培地を希釈します。
- 2,500 × g 、4°Cで5分間スピンダウンします。 ペレットからメディアを取り除きます。0.5 mLの魚培地に再懸濁し、細胞を氷上に保ちます。
- 細胞をカウントし、必要に応じて100,000細胞/5 μLに希釈します。
- 成魚のCG1ゼブラフィッシュに麻酔をかけ、200 μLの4 mg/mL麻酔薬(MS-222)を25 mLの魚類システム水にペトリ皿で加えます。CG1魚を腹側を上にして保持し、ハミルトンマイクロリットルシリンジを使用して腹腔内(IP)スペースに5〜6μLを注入します。動物を水槽に戻し、通常の水泳に戻るのを確認してから、システムに戻します。
注:このプロトコルに記載されている移植研究には、60日以上の成体ゼブラフィッシュが使用されました。 - 週に一度、蛍光顕微鏡を使用して白血病の進行を監視します。審査の詳細については、下記2.をご覧ください。
2. 蛍光標識白血病細胞の回収
- 移植後約21〜28日で、200μL(4〜5滴)の4 mg / mL麻酔薬を25 mLの魚類システム水にペトリ皿で追加して、成体のCG1ゼブラフィッシュに麻酔をかけます。
- CG1ゼブラフィッシュの白血病負荷を調べるには、エピ蛍光顕微鏡で動物中のGFP標識白血病細胞の割合を評価し、GFP蛍光を検出するための適切なフィルターを使用します。GFP陽性の白血病は、動物の>70%に広がっていれば、すぐに摘出することができます。
- 9 mLの魚系水が入ったシャーレに1 mLの4 mg / mL麻酔薬を追加して、動物を安楽死させます。.生命のすべての兆候が止まるのを許してください。例えば、魚がオペラ運動の停止を観察する(~5分)。
- ゼブラフィッシュを新しいシャーレに移し、細胞の緩衝液として1mLの魚培地を加えます。新しいカミソリの刃を使用して、最初にゼブラフィッシュの首を切り落とし、次に同じカミソリの刃を使用して組織を浸軟させます。ピペで上下に動かして、細胞の大きな塊を取り除きます。
- 細胞を40 μmのセルストレーナーに通して50 mLのコニカルチューブに通し、単一細胞懸濁液に解離します。細胞を氷の上に保ちます。
3. ゼブラフィッシュの染色と細胞生存率のための細胞増殖色素(CellTrace Far Red)濃度の最適化
注:このプロトコルでは、腫瘍細胞がGFP標識されているため、スペクトルの重複を避けるために遠赤血球増殖色素(CellTrace Far Red)を使用しました。
- 使用直前に、メーカーの推奨に従って適切な量のDMSOを添加することにより、蛍光色素の1 mM溶液を調製します。1 mM、0.5 mM、0.1 mM、および0.01 mMの実用的なソリューションを用意します。必要に応じて魚培地で希釈し、染色後の細胞生存率をテストします。
- 細胞を数え、1.5mLの微量遠心チューブに1×106 個の細胞を採取します。
- 2,500 × g 、4°Cで5分間遠心分離します。液体を取り出し、細胞を1 mLの0.9x PBSに再懸濁します。
- 細胞懸濁液をそれぞれ250μLの4本のチューブに分割して、CT-FRで治療します。
- 0.9x PBSを250 μL加えると、約250,000細胞/チューブの容量がそれぞれ最大500 μLになります。
- 上記の作業溶液を4本のチューブのそれぞれに必要量加えて、最終濃度1 μM、0.5 μM、0.1 μM、0.05 μMを達成します。光から保護した状態で37°Cで20分間インキュベートします。
- 細胞を室温で5分間、2,500 × g でスピンダウンしてペレット化します。液体を取り除き、細胞を500μLの魚培地で洗浄して、余分な色素を取り除きます。
- 再度ペレット状にして液体を取り出し、25 μLの魚培地に再懸濁します。1 μLを使用して、50%トリパンブルーで1:10に希釈した細胞をカウントします。
- 顕微鏡下で細胞の生存率を調べます。生細胞はトリパンブルーを保持せず、顕微鏡下で明るく見えますが、死んだ細胞は色素を取り込んで暗く見えます。まず、適切な蛍光チャネルの下の細胞を調べて腫瘍細胞を同定し、次に明視野チャネルを使用して細胞生存率を評価します。
- 細胞生存率を維持しながら染色が成功する濃度を選択してください(>90%トリパンブルー陰性細胞)。
注:この実験で試験したゼブラフィッシュT-ALL細胞については、染色を成功させるために1 μMの濃度を使用し、細胞生存率の>90%を使用しました。
4. CT-FR染色T-ALLゼブラフィッシュ細胞のin vivoでの増殖
- セクション3の最適化されたCT-FR濃度を使用して、ゼブラフィッシュ細胞を染色します。FACSソーティング中のGFP陽性コントロールとして、GFP標識T-ALL腫瘍の生成のために一部の腫瘍細胞を未染色のままにしておきます。染色した細胞と未染色の細胞の両方を50,000細胞/5 μLに希釈して移植します。
- 成魚のCG1ゼブラフィッシュに麻酔をかけ、4 mg/mLの麻酔薬200 μLをシャーレ内の魚類システム水25 mLに加えます。
- セクション1で説明したように、染色した細胞と染色していない細胞の両方について、5 μLの細胞懸濁液をゼブラフィッシュのIPキャビティに注入します。注射後の潜在的な死亡率を考慮して、グループごとに5〜6匹のゼブラフィッシュを注射します。
- 白血病の発症について、週2回の鎮静下で蛍光顕微鏡で動物を検査します。
注:~10〜14日後、白血病はこの体の約30〜40%を占めるはずです。この時間枠内で白血病の収穫とその後の分類を計画します。腫瘍が大きく拡大するのを待つと、蛍光細胞色素の希釈度が高くなり、そのシグナルの検出が困難になる可能性があります。選択した腫瘍モデルに対する腫瘍採取のタイミングの最適化を検討します。さらに、ここでは、目的の腫瘍サイズを確実に捕捉するために、より頻繁な腫瘍モニタリングが推奨されます。
5. CT-FR染色ゼブラフィッシュT-ALL細胞の選別準備
- 細胞ソーティングには、以下のコントロールを準備します:カラーコントロールなし(野生型ゼブラフィッシュ由来の未染色、非トランスジェニック、単一細胞懸濁液)、GFP標識T-ALL細胞、および新たに染色したCT-FR WTゼブラフィッシュ細胞(Far-Redシグナルの最大閾値を設定するため)。
- 未染色コントロールおよびCT-FRコントロールの調製
- 9 mL の魚系水が入ったシャーレに 1 mL の 4 mg/mL 麻酔薬を添加することにより、移植されていない CG1 ゼブラフィッシュを安楽死させることにより、野生型 (WT) 魚細胞を採取します。
- ゼブラフィッシュを新しいシャーレに移し、細胞の緩衝液として1mLの魚培地を加えます。新しいカミソリの刃を使用して、最初にゼブラフィッシュの首を切り落とし、次に同じカミソリの刃を使用してゼブラフィッシュを浸軟させます。ピペで上下に動かして、大きな細胞の塊を取り除きます。
- 細胞を40 μmのセルストレーナーに通して50 mLのコニカルチューブに通し、単一細胞懸濁液に解離します。細胞を氷の上に保ちます。
- CT-FRコントロールでは、250,000 WTの細胞を微量遠心チューブに移し、2,500 × g で室温で5分間遠心分離してペレット化します。魚用培地を取り出し、0.9x PBS+ 1% FBSを500μL加えます。
- 1 mM CT-FR色素ストック溶液0.5 μLを添加し、最終濃度を1 μMに増やし、1,000 μLのピペットで静かにピペットで混合します。37°Cで20分間インキュベートし、光から保護します。
- 液体を取り除き、細胞を500μLの魚培地で洗浄して、余分な色素を取り除きます。
- 再度遠心分離により細胞をペレット化し、液体を除去し、細胞を0.9x PBS+ 1% FBSの500μLに再懸濁し、35μmのフィルターキャップをFACSチューブに通します。氷の上を保ってください。
- ドナープレートの準備
注:ドナープレートは、移植されたゼブラフィッシュのCT-FR染色T-ALL細胞が選別される96ウェルV底プレートです。プレートの各ウェルには、50 μLの魚培地に5,000個の未染色のWT CG1細胞が含まれており、その後のステップで選別された細胞をペレット化するのを助けるキャリアとして機能します。- 500,000個のWT CG1細胞をカウントし、15 mLのコニカルチューブに移します。
- この細胞ストックを5 mLの魚培地を加えて100細胞/μLに希釈します。
- 50 μLの細胞懸濁液を96ウェルプレートの各ウェルに分注します。細胞懸濁液ストックチューブを各列の後に混合して、細胞懸濁液の均一性を維持します。選別するまでプレートを4°Cに保ちます。
- 移植した魚のサンプルの準備
- T-ALL負荷が30-40%の移植魚を選択します。CT-FR染色細胞と未染色GFP腫瘍細胞の両方を移植した魚を採取します。
- セクション2で説明されているように細胞を採取します。
注:色素保持細胞は少量で存在すると予想されるため、CT-FR GFPサンプルから多数の細胞を選別する準備をしてください。 - 0.9x PBS + 1% FBSで~3-5 × 106 細胞/mLをソーティングするのに適切な濃度に希釈し、35μmのフィルターキャップをFACSチューブに通します。1:1,000希釈でDAPI(1 mg/mL)をバイタル色素として添加し、死細胞を除外します。氷の上を保ってください。
- 未染色のGFP腫瘍細胞については、250,000個の細胞を微量遠心チューブに移し、室温で5分間、2,500 × g のペレットでペレット化します。魚用培地を取り出し、500μLのPBSを加え、35μmのフィルターキャップを通してFACSチューブに入れます。氷の上を保ってください。
6. 仕分け
注:選別に使用する場合を除き、すべてのチューブとドナープレートを氷の上に置いてください。
- パラメーターとゲートのソーティングについては、まず前方散乱ゲートと側方散乱光ゲートを適用して、サイズに基づいて目的の細胞を特定し、細胞の破片を排除します。次に、前方散布図の高さと前方散布図面積を使用して、重複するセルを除外し、シングレットのみを保持します。最後に、無色コントロールと単色コントロールを使用して象限を描画し、GFP陽性細胞集団とCT-FR陽性細胞集団を同定します。
注:CT-FRコントロールは、コントロールの染色が細胞分裂なしで新鮮に行われたため、選別用のサンプルよりもはるかに明るいと予想されます。CT-FR GFPサンプルの細胞は、CT-FRポジティブゲートの下端に現れることが予想されます。 - 各魚に移植する細胞の数をドナープレートの1つのウェルに分類します。
注:この実験では、CT-FR HighおよびCT-FR Lowにおける白血病幹細胞の頻度を推定するために、限界希釈アッセイを使用しました。このアッセイでは、25細胞を3匹の動物に移植し、10細胞を10匹の動物に移植しました。ゼブラフィッシュ rag2:Myc由来のT-ALLを用いた一般的な限界希釈アッセイでは、このモデルのLSC頻度は数百の細胞で1LSCと推定されるため、細胞数が多いグループ(500または1,000)が関与します。しかし、このアッセイでは、Blackburnらによって以前に記載されたT-ALLクローンの1つを使用しています15。ここで使用したサンプルのLSC周波数は、数十個のセルで~1 LSCです。我々は、25細胞群に移植した動物で白血病が検出されると予測しています。このアッセイをお客様の疾患モデルに最適化する場合、腫瘍の生着を確実にするために、より高い細胞数グループを選択する際には注意が必要です。 - 選別後、移植の準備ができるまでプレートを氷の上に置いておきます。
注:選別手順はストレスがかかり、細胞の生存率に影響を与える可能性があります。実際の限界希釈実験を実行する前に、パイロット選別実験が行われました。選別した細胞を移植し、白血病の発症をモニタリングして、選別が細胞生存率に有害であるかどうかを判断しました。あるいは、選別した細胞をトリパンブルーで染色し、移植前に顕微鏡で調べることで細胞生存率を評価することもできます。
7. 限定希釈で選別した細胞を移植し、腫瘍発症を追跡する
- 大型の卓上型遠心分離機を使用して、4°Cで2,500 × g でプレートをスピンダウンします。
- 各ウェルから45 μLの上清を慎重に取り除き、5 μLの液体を残し、ウェルの底にある細胞ペレットに触れないようにします。
- 20 μLピペットで細胞を再懸濁します。ピペットで2〜3ウェルを再懸濁し、次にハミルトンマイクロリットルシリンジを使用して、各ウェルからの細胞懸濁液をIP移植を介して所望の数のCG1ゼブラフィッシュに注入します。次に、細胞の沈降を避けるために、次のウェルグループに細胞を再懸濁します。
- ゼブラフィッシュを週に一度、鎮静下で蛍光顕微鏡で観察し、少なくとも6週間にわたってT-ALLの発生を確認します。
8. 白血病幹細胞頻度の測定
- 移植後6週間で、移植後6週間の細胞用量および治療群あたりの陽性動物の数を記録し、任意の量のGFPシグナルを持つ動物を陽性と見なします。GFPシグナルが体の>50%を占める場合、動物は白血病に重大な負担がかかると考えてください。
- ウェブベースのELDA(Extreme Limiting Dilution Analysis)統計ソフトウェア(http://bioinf.wehi.edu.au/software/elda/)19を使用して、各細胞集団内のLSCの頻度を計算します。
注: ワークフローの概略図を 図 1 に示します。
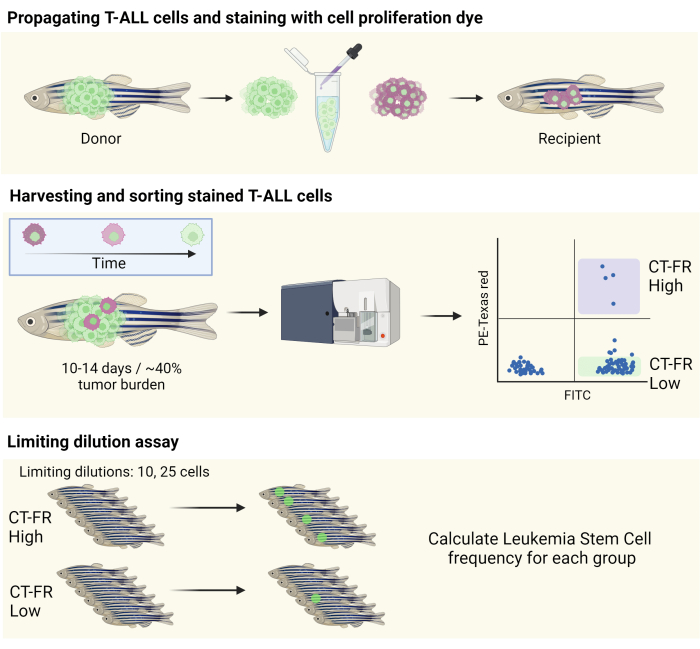
図1:ゼブラフィッシュT-ALLモデルで静止細胞を単離するための細胞追跡染色剤のワークフロー。 ゼブラフィッシュT-ALL細胞を細胞増殖染色で染色し、CG1ゼブラフィッシュに増殖(上面)、細胞増殖染色の保持に基づく細胞選別(中段)の模式図。収集した細胞を、LSCの頻度を決定するための限界希釈アッセイに使用しました(下パネル)。略語:T-ALL = T細胞急性リンパ芽球性白血病;LSCs = 白血病幹細胞;CT-FR = CellTrace ファーレッド。FITC = フルオレセインイソチオシアネート;PE =フィコエリトリン。 この図の拡大版を表示するには、ここをクリックしてください。
結果
上記のプロトコルに従って、細胞増殖色素CT-FRを保持している細胞を選別し、それらをLimiting dilution assay(LDA)に使用して、CT-FR HighおよびCT-FR Low集団のLSC頻度を推定しました。フローサイトメトリー実験のゲーティングを設定するために、単色コントロール(図2A)に加えて、フルオロフォアなし(カラーなし)コントロールを使用しました...
ディスカッション
LSCは、従来の抗増殖性化学療法治療に耐性があることが知られており、これらの細胞に対する標的療法を見つけることは、再発の発生を減らし、患者の予後を改善する上で大きな期待が寄せられています20。以前の研究では、T-ALL PDXモデル13において、薬剤耐性および幹細胞性に関連する静止細胞の小さな集団を同定するための蛍?...
開示事項
著者には、開示すべき利益相反はありません。
謝辞
本研究の資金は、国立がん研究所(JSBのR37CA227656)から提供されました。この研究は、ケンタッキー大学マーキーがんセンター(P30CA177558)のFlow Cytometry and Immune Monitoring Shared Resourcesの支援も受けました。
資料
| Name | Company | Catalog Number | Comments |
| 26 G/2” micro-syringe | Hamilton | 87930 | NA |
| 35 µm filter cap FACS tubes | Falcon | 352235 | NA |
| 40 µm cell strainer | CELLTREAT | 229482 | NA |
| 96-well skirted PCR plate | Thermo Fisher Scientific | AB0800 | NA |
| Cell sorter | Sony Biotechnology | SY3200 | NA |
| CellTrace Far Red | Thermo Fisher Scientific | C34564 | NA |
| Conical tubes | VWR | 10026-078 | NA |
| DAPI | Thermo Fisher Scientific | 62248 | NA |
| DMSO | Sigma-Aldrich | D4818 | NA |
| Dulbecco'sPhosphate-buffered saline (PBS) | Caisson Labs | 22110001 | NA |
| Epifluorescence stereo microscope | Nikon | SMZ25 | NA |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | 12306C | NA |
| Fish system water | N/A | N/A | 0.03-0.05% salinity, pH 6.5-8, buffered with sodium bicarbonate |
| Microcentrifuge tubes | Thermo Fisher Scientific | C2171 | NA |
| MS-222 | Pentaire | TRS-1 | tricaine mesylate, an anesthetic |
| Petri dishes | Corning | 07-202-011 | NA |
| Razor blades | American Line | 66-0089 | NA |
| Trypan Blue | Thermo Fisher Scientific | T10282 | NA |
参考文献
- Reya, T., Morrison, S. J., Clarke, M. F., Weissman, I. L. Stem cells, cancer, and cancer stem cells. Nature. 414 (6859), 105-111 (2001).
- Arai, F., et al. Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell. 118 (2), 149-161 (2004).
- Li, L., Bhatia, R. Stem cell quiescence. Clin. Cancer Res. 17 (15), 4936-4941 (2011).
- Kreso, A., Dick, J. E. Evolution of the cancer stem cell model. Cell Stem Cell. 14 (3), 275-291 (2014).
- Chen, W., Dong, J., Haiech, J., Kilhoffer, M. -. C., Zeniou, M. Cancer stem cell quiescence and plasticity as major challenges in cancer therapy. Stem Cells Int. 2016, 1740936 (2016).
- Kleffel, S., Schatton, T. Tumor dormancy and cancer stem cells: Two sides of the same coin. Adv Exp Med Biol. 734, 145-179 (2013).
- Tuy, K., Rickenbacker, L., Hjelmeland, A. B. Reactive oxygen species produced by altered tumor metabolism impacts cancer stem cell maintenance. Redox Biol. 44, 101953 (2021).
- Zhou, B. -. B. S., et al. Tumour-initiating cells: Challenges and opportunities for anticancer drug discovery. Nat Rev Drug Discov. 8 (10), 806-823 (2009).
- Lyons, A. B., Blake, S. J., Doherty, K. V. Flow cytometric analysis of cell division by dilution of cfse and related dyes. Curr Protoc Cytom. 64 (1), 11-12 (2013).
- Lyons, A. B. Analysing cell division in vivo and in vitro using flow cytometric measurement of cfse dye dilution. J Immunol Methods. 243 (1-2), 147-154 (2000).
- Azari, H., Deleyrolle, L. P., Reynolds, B. A. Using carboxy fluorescein succinimidyl ester (cfse) to identify quiescent glioblastoma stem-like cells. Methods Mol Biol. 1686, 59-67 (2018).
- Deleyrolle, L. P., Rohaus, M. R., Fortin, J. M., Reynolds, B. A., Azari, H. Identification and isolation of slow-dividing cells in human glioblastoma using carboxy fluorescein succinimidyl ester (cfse). J Vis Exp. (62), e3918 (2012).
- Ebinger, S., et al. Characterization of rare, dormant, and therapy-resistant cells in acute lymphoblastic leukemia. Cancer Cell. 30 (6), 849-862 (2016).
- Langenau, D. M., et al. Myc-induced t cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Blackburn, J. S., et al. Clonal evolution enhances leukemia-propagating cell frequency in t cell acute lymphoblastic leukemia through akt/mtorc1 pathway activation. Cancer Cell. 25 (3), 366-378 (2014).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. J Vis Exp. (53), e2790 (2011).
- Borga, C., et al. Simultaneous b and t cell acute lymphoblastic leukemias in zebrafish driven by transgenic myc: Implications for oncogenesis and lymphopoiesis. Leukemia. 33 (2), 333-347 (2019).
- Hu, Y., Smyth, G. K. Elda: Extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Bhojwani, D., Pui, C. -. H. Relapsed childhood acute lymphoblastic leukaemia. Lancet Oncol. 14 (6), e205-e217 (2013).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. 4 (1), 35-44 (2005).
- Al-Hamaly, M. A., et al. Zebrafish drug screening identifies erlotinib as an inhibitor of wnt/β-catenin signaling and self-renewal in t-cell acute lymphoblastic leukemia. Biomed Pharmacother. 170, 116013 (2024).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved