Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Идентификация покоящихся клеток в модели острого лимфобластного лейкоза Т-клеток данио-рерио с использованием окрашивания пролиферацией клеток
В этой статье
Резюме
Мы использовали окрашивание пролиферацией клеток для идентификации спокойных клеток в модели Т-острого лимфобластного лейкоза рыбок данио. Окрашивание сохраняется в неделящихся клетках и уменьшается во время пролиферации клеток, что позволяет отобрать спящие клетки для дальнейшего исследования. Этот протокол предоставляет функциональный инструмент для изучения самообновления в контексте клеточного покоя.
Аннотация
Клеточный покой — это состояние остановки роста или замедления пролиферации, которое описывается в нормальных и раковых стволовых клетках (ОСК). Состояние покоя может защитить ЦСК от антипролиферативных химиотерапевтических препаратов. В мышиных моделях ксенотрансплантата (PDX) с Т-клеточным острым лимфобластным лейкозом (Т-ОЛЛ) покоящиеся клетки связаны с резистентностью к лечению и стволовостью. Красители для пролиферации клеток являются популярными инструментами для отслеживания деления клеток. Флуоресцентный краситель ковалентно закреплен в аминогруппах на мембране и макромолекулах внутри клетки. Это позволяет отслеживать меченые клетки до 10 делений, которые могут быть разрешены с помощью проточной цитометрии.
В конечном счете, клетки с самыми высокими темпами пролиферации будут иметь низкое удержание красителя, так как он будет разбавляться при каждом делении клетки, в то время как спящие, медленно делящиеся клетки будут иметь наибольшее удержание. Использование красителей для пролиферации клеток для выделения спящих клеток было оптимизировано и описано в мышиных моделях T-ALL. В дополнение к существующим моделям мышей, модель T-ALL рыбок данио-рерио rag2:Myc обеспечивает прекрасную площадку для изучения самообновления в T-ALL благодаря высокой частоте лейкемических стволовых клеток (LSC) и удобству рыбок данио для крупномасштабных экспериментов по трансплантации.
В этой статье мы описываем рабочий процесс окрашивания клеток T-ALL рыбок данио с помощью красителя для пролиферации клеток, оптимизацию концентрации красителя для клеток рыбок данио, пассирование успешно окрашенных клеток in vivo и сбор клеток с различными уровнями удержания красителя путем сортировки живых клеток от трансплантированных животных. Учитывая отсутствие хорошо зарекомендовавших себя создателей клеточной поверхности для LSC в T-ОЛЛ, этот подход предоставляет функциональные средства для опроса неактивных клеток in vivo. Для получения репрезентативных результатов мы описываем эффективность приживления и частоту LSC для клеток с высоким и низким уровнем удержания красителя. Этот метод может помочь исследовать дополнительные свойства спокойных клеток, включая реакцию на лекарственные препараты, профили транскрипции и морфологию.
Введение
Взрослые стволовые клетки отвечают за регенерацию дифференцированных типов клеток в данном органе и преимущественно присутствуют в спящем, неделящемся состоянии 1,2. Например, гемопоэтические стволовые клетки (ГСК), которые поддерживают кровь, в основном остаются в покое, и только небольшая часть вступает в клеточный цикл для самообновления или дифференцировки с образованием зрелыхкомпонентов крови. Аналогичным образом, при раке редкая субпопуляция клеток, называемая раковыми стволовыми клетками (ОСК), обладает способностью к самообновлению и отвечает за долгосрочное поддержаниезлокачественного новообразования. Раковые стволовые клетки существуют in vivo в состоянии покоя или медленного роста, что может позволить им избежать антипролиферативныхметодов лечения рака5, уклоняться от клиренса иммунной системы6, уменьшать окислительный стресс и улучшать пути репарации ДНК7. Даже небольшое количество ОСК, оставленных после лечения, потенциально может привести к повторному заселению опухоли, что приведет к рецидиву у пациента8. Соответственно, понимание клеточного покоя имеет большие перспективы для выявления потенциальных уязвимостей ЦСК и разработки новых способов их устранения.
Красители для пролиферации клеток, такие как краситель на основе карбоксифлуоресцеина сукцинимидилового эфира (CFSE) и его производные, обычно используются для отслеживаниячастоты делений клеток9. Краситель проникает через клеточную мембрану и, попадая внутрь клетки, активируется внутриклеточными эстеразами в флуоресцентный продукт. Полученное флуоресцентное соединение удерживается внутри клетки через ковалентные амидные связи, образующиеся между сукцинимидильной частью и аминными функциональными группами внутриклеточных белков10. При каждом делении клетки флуоресцентное соединение делится поровну между двумя образовавшимися клетками, вызывая двукратное разведение сигнала. Этот краситель позволяет обнаруживать до 10 делений клеток с помощью анализа проточной цитометрии11.
Этот подход ранее использовался для обогащения популяций ЦСК in vitro путем идентификации медленно циклирующих популяций клеток с высоким уровнем удержания красителя11,12. При Т-ОЛЛ CFSE использовался для отслеживания роста опухоли in vivo в ксенотрансплантатах, полученных от пациентов, у мышей. После мечения клеток и трех недель трансплантации анализ проточной цитометрии показал редкую популяцию клеток, которые все еще сохраняли флуоресценцию CFSE. Эта популяция была связана со стволовостью, резистентностью к лечению и высоким сходством с клетками, вызывающими рецидив у пациентов13. Соответственно, этот краситель является полезным инструментом для изучения фенотипов стволовых клеток лейкемии (LSC) при Т-ОЛЛ.
Целью работы является расширение применения красителя для пролиферации клеток для изучения покоя in vivo с использованием модели T-ALL рыбки данио. В частности, модель14 dan-ALL с управлением rag2:Myc представляет собой прекрасную площадку для изучения самообновления из-за высокой частоты LSC по сравнению с мышиными моделями и болезнями человека15. Кроме того, использование рыбок данио рерио позволяет проводить крупномасштабные исследования по трансплантации, которые могут быть проведены с гораздо меньшими затратами на уход и содержание по сравнению с их мышиными аналогами. Рыбки данио также отлично подходят для визуализации в реальном времени, так как флуоресцентно меченые опухолевые клетки можно легко рассмотреть с помощью простого флуоресцентного микроскопа для оценкискорости развития опухоли.
В этом протоколе мы описываем процесс окрашивания клеток T-ALL рыбки данио с помощью красителя для пролиферации клеток с последующим размножением in vivo окрашенных клеток у сингенных CG1 рыбок данио. При развитии лейкоза мы описываем сортировку клеток, сохранивших краситель, и их использование для последующего эксперимента по трансплантации с предельным разведением для количественной оценки скоростей самообновления LSC. Этот протокол может быть расширен для дополнительных применений, включая скрининг in vivo потенциальных соединений для нацеливания на неактивные LSC. Кроме того, собранные клетки могут быть использованы для различных последующих анализов, таких как транскриптомное профилирование, протеомика и метаболомика, что дает уникальную информацию о поведении неактивных LSC в T-ОЛЛ.
протокол
В этом протоколе мы используем меченые GFP клетки T-ALL данио-рерио, которые были ранее получены в штамме CG1 и, таким образом, могут быть непосредственно введены в реципиентную сингенную CG1данио-рерио 15. Вкратце, лейкемия была получена путем микроинъекции ДНК rag2:Myc и rag2:GFP в одноклеточные эмбрионы CG1 данио-рерио. За животными наблюдали на предмет развития лейкоза, начиная с 3 недель после инъекции, с помощью флуоресцентной микроскопии. GFP-положительные лейкозные клетки были выделены FACS и серийно трансплантированы реципиентным CG1 данио-рерио для получения клонов с высокой частотой LSC. Детали всего протокола описаны в работе Blackburn et al.15.
В качестве альтернативы, первичный Т-ОЛЛ, полученный из rag2:Myc, может быть получен путем микроинъекции ДНК эмбрионов рыбок данио-рерио17. Микроинъекция ДНК rag2:Myc с помощью флуоресцентного репортера rag2, управляемого rag2, такого как GFP, может привести к развитию B-клеток, Т-клеток и смешанных ALL18. Клоны лейкемии, используемые в этом протоколе, были ранее подтверждены как T-ALL15. Все экспериментальные процедуры с участием рыбок данио были рассмотрены и одобрены Комитетом по институциональному уходу за животными и их использованию Университета Кентукки, протокол 2019-3399.
1. Размножение клеток T-ALL рыбки данио рерио in vivo
- Разморозьте один флакон, содержащий 1 мл замороженных меченых GFP клеток T-ALL данио-рерио, на водяной бане при температуре 37 °C с легким встряхиванием до оттаивания. Как только оттает, переложите на лед.
- Медленно пипетируйте содержимое пробирки в коническую пробирку объемом 15 мл с 4 мл рыбной среды (0,9x PBS + 5% FBS), чтобы разбавить замораживающую среду.
- Отжим в течение 5 минут при 2 500 × g при 4 °C. Удалите среду из гранулы. Ресуспендируйте в 0,5 мл рыбьей среды и держите клетки на льду.
- Подсчитайте ячейки и при необходимости разбавьте их до 100 000 клеток/5 μл.
- Обезболите взрослую рыбку CG1, добавив 200 мкл анестетика 4 мг/мл (MS-222) в 25 мл воды рыбной системы в чашке Петри. Держите рыбу CG1 вентральной стороной вверх и введите 5-6 μL во внутрибрюшинное (IP) пространство с помощью микролитрового шприца Hamilton. Переместите животных обратно в аквариумы и следите за возвращением к нормальному плаванию, прежде чем возвращать их обратно в систему.
ПРИМЕЧАНИЕ: Взрослые рыбки данио-рерио в возрасте 60 дней и старше использовались для исследований трансплантации, описанных в этом протоколе. - Контролируйте рост лейкемии один раз в неделю с помощью флуоресцентного микроскопа. Подробная информация о процедуре скрининга приведена в разделе 2 ниже.
2. Забор флуоресцентно меченых лейкозных клеток
- Примерно через 21-28 дней после трансплантации обезболите взрослую рыбку данио-рерио CG1, добавив 200 μл (4-5 капель) анестетика 4 мг/мл на 25 мл воды рыбьей системы в чашке Петри.
- Исследуйте данио-рерио CG1 на предмет бремени лейкемии, оценив процент меченых GFP лейкозных клеток у животного с помощью эпифлуоресцентного микроскопа, используя соответствующий фильтр для обнаружения флуоресценции GFP. GFP-положительный лейкоз готов к сбору, если он распространился на >70% животного.
- Усыпьте животное, добавив 1 мл анестетика 4 мг/мл в чашку Петри, содержащую 9 мл воды рыбной системы. Позвольте всем признакам жизни прекратиться; Например, понаблюдайте за рыбой на предмет прекращения оперкулярного движения (~5 мин).
- Переместите рыбок данио в новую чашку Петри и добавьте 1 мл рыбной среды, которая будет служить буфером для клеток. Используя новое лезвие бритвы, сначала обезглавьте рыбку данио, а затем размацерируйте ткань тем же лезвием бритвы. Пипетируйте вверх и вниз, чтобы вытеснить большие скопления клеток.
- Пропустите клетки через клеточный фильтр 40 мкм в коническую пробирку объемом 50 мл для диссоциации в одноклеточную суспензию. Держите клетки на льду.
3. Оптимизация концентрации красителя для пролиферации клеток (CellTrace Far Red) для окрашивания и жизнеспособности клеток рыбок данио
ПРИМЕЧАНИЕ: Для этого протокола, а также поскольку опухолевые клетки мечены GFP, мы использовали краситель для пролиферации дальних красных клеток (CellTrace Far Red), чтобы избежать спектрального перекрытия, которое будет называться CT-FR.
- Приготовьте 1 мМ раствор флуоресцентного красителя непосредственно перед использованием, добавив соответствующий объем ДМСО в соответствии с рекомендациями производителя. Имеют рабочие растворы 1 мМ, 0,5 мМ, 0,1 мМ, 0,01 мМ; Разбавляйте по мере необходимости в рыбных средах для проверки жизнеспособности клеток после окрашивания.
- Подсчитайте клетки и соберите 1 × 106 клеток в микроцентрифужные пробирки объемом 1,5 мл.
- Центрифуга при 2 500 × г при 4 °C в течение 5 мин. Удалите жидкость и повторно суспендируйте клетки в 1 мл 0,9x PBS.
- Расщепите клеточную суспензию между четырьмя пробирками по 250 мкл каждая для лечения с помощью CT-FR.
- Добавьте 250 мкл 0,9x PBS, чтобы довести объем до 500 мкл каждая, имея примерно 250 000 клеток/пробирку.
- Добавьте необходимые количества рабочих растворов, описанных выше, в каждую из четырех пробирок для достижения следующих конечных концентраций 1 μМ, 0,5 μМ, 0,1 μМ и 0,05 μМ. Инкубируйте в течение 20 минут при 37 °С, защищенном от света месте.
- Гранулируйте ячейки, вращая при 2500 × г в течение 5 минут при комнатной температуре. Удалите жидкость и промойте клетки 500 μл рыбной среды, чтобы удалить излишки красителя.
- Снова смешайте гранулы, удалите жидкость и снова суспендируйте в 25 мкл рыбной среды. Используйте 1 мкл для подсчета клеток в разведении 1:10 в 50% трипановом сине.
- Исследуйте клетки под микроскопом на жизнеспособность клеток; живые клетки не сохраняют трипановый синий цвет и кажутся яркими под микроскопом, в то время как мертвые клетки впитывают краситель и кажутся темными. Сначала исследуйте клетки под соответствующим флуоресцентным каналом, чтобы идентифицировать опухолевые клетки, а затем используйте светлопольный канал для оценки жизнеспособности клеток.
- Выберите концентрацию, которая приводит к успешному окрашиванию при сохранении жизнеспособности клеток (>90% трипановых синеотрицательных клеток).
ПРИМЕЧАНИЕ: Для клеток T-ALL рыбок данио, протестированных в этом эксперименте, использовалась концентрация 1 мкМ для успешного окрашивания и >90% жизнеспособности клеток.
4. Размножение окрашенных CT-FR клеток T-ALL in vivo
- Используя оптимизированную концентрацию CT-FR из раздела 3, окрасьте клетки рыбок данио. Оставьте некоторые опухолевые клетки неокрашенными для генерации меченой GFP опухоли T-ALL в качестве GFP-положительного контроля во время сортировки FACS. Разбавьте как окрашенные, так и неокрашенные клетки до 50 000 клеток/5 мкл для трансплантации.
- Обезболите взрослую рыбку CG1, добавив 200 мкл анестетика 4 мг/мл в 25 мл воды рыбьей системы в чашке Петри.
- Введите 5 мкл клеточной суспензии в полость рерио-рерио, как описано в разделе 1, как для окрашенных, так и для неокрашенных клеток. Вводите 5-6 рыбок данио рерио в каждой группе, чтобы учесть потенциальную смертность после инъекции.
- Осматривайте животных с помощью флуоресцентной микроскопии под седацией 2 раза в неделю на предмет развития лейкемии.
ПРИМЕЧАНИЕ: Через ~10-14 дней лейкемия должна занимать около 30-40% этого тела. Планируйте сбор урожая лейкемии и последующую сортировку в течение этого времени. Ожидание, пока опухоль разрастется до больших размеров, может привести к большему разведению флуоресцентного клеточного красителя и трудностям в обнаружении его сигнала. Рассмотрим оптимизацию времени забора опухоли для выбранной модели опухоли. Кроме того, здесь рекомендуется более частый мониторинг опухоли, чтобы обеспечить захват желаемого размера опухоли.
5. Подготовка к сортировке окрашенных CT-FR клеток данио-рерио T-ALL
- Подготовьте следующие элементы управления для сортировки клеток: Без контроля цвета (неокрашенные, нетрансгенные, одноклеточные суспензии, полученные от дикого типа данио-рерио), GFP-меченые T-ALL клетки и недавно окрашенные CT-FR WT клетки данио-рерио (для установки максимального порога дальнего красного сигнала).
- Подготовка неокрашенных средств контроля и контроля CT-FR
- Соберите клетки рыб дикого типа (WT) путем усыпления нетрансплантированной рыбки данио-рерио CG1 путем добавления 1 мл анестетика 4 мг/мл в чашку Петри, содержащую 9 мл воды рыбной системы.
- Переместите рыбок данио в новую чашку Петри и добавьте 1 мл рыбной среды, которая будет служить буфером для клеток. Используйте новое лезвие бритвы, чтобы сначала обезглавить, а затем выжать рыбку данио, используя то же лезвие бритвы; Пипетка вверх и вниз для вытеснения крупных клеточных комков.
- Пропустите клетки через клеточный фильтр 40 мкм в коническую пробирку объемом 50 мл для диссоциации в одноклеточную суспензию. Держите клетки на льду.
- Для управления CT-FR перенесите 250 000 WT-клеток в микроцентрифужную пробирку и гранулируйте их путем центрифугирования при температуре 2 500 × г в течение 5 минут при комнатной температуре. Удалите рыбную среду и добавьте 500 μл 0,9x PBS + 1% FBS.
- Добавьте 0,5 мкл 1 мМ раствора красителя CT-FR до конечной концентрации 1 мкМ. Аккуратно пипетируйте с 1 000 мкл пипетки для смешивания. Выдерживать при температуре 37 °C в течение 20 минут в защищенном от света месте.
- Удалите жидкость и промойте клетки 500 μл рыбной среды, чтобы удалить излишки красителя.
- Снова гранулируйте элементы центрифугированием, удалите жидкость и повторно суспендируйте элементы в 500 μл 0,9x PBS + 1% FBS и пропустите через фильтрующий колпачок 35 μм в пробирку FACS. Держите на льду.
- Подготовка донорской пластины
ПРИМЕЧАНИЕ: Донорская пластина представляет собой 96-луночную пластину с V-образным дном, в которую будут отсортированы окрашенные CT-FR T-ALL клетки трансплантированных рыбок данио. Каждая лунка планшета содержит 5000 неокрашенных клеток WT CG1 в 50 мкл рыбной среды, которые служат носителем для гранулирования отсортированных клеток на последующих этапах.- Подсчитайте 500 000 WT клеток CG1 и перенесите их в коническую пробирку объемом 15 мл.
- Разбавьте этот клеточный запас до 100 клеток/μл, добавив 5 мл рыбной среды.
- Диспонируйте 50 мкл клеточной суспензии в каждую лунку 96-луночного планшета. Перемешивайте пробирку с клеточной суспензией после каждого ряда, чтобы поддерживать однородность клеточной суспензии. Держите тарелку при температуре 4 °C до сортировки.
- Подготовка пересаженных образцов рыб
- Отбирайте пересаженных рыб с нагрузкой 30-40% T-ALL. Соберите рыбу, пересаженную как с CT-FR-окрашенными клетками, так и с неокрашенными опухолевыми клетками GFP.
- Сборка клеток в соответствии с разделом 2.
Примечание: Поскольку ожидается, что клетки, удерживающие краситель, будут присутствовать в небольшом количестве, приготовьтесь к сортировке большого количества клеток из образца CT-FR GFP. - Разбавьте до концентрации, подходящей для сортировки, ~3-5 ×10 6 клеток/мл в 0,9x PBS + 1% FBS и пропустите через фильтрующий колпачок 35 мкм в пробирку FACS. Добавьте DAPI (1 мг/мл) в соотношении 1:1000 в качестве жизненно важного красителя для исключения мертвых клеток. Держите на льду.
- Для неокрашенных опухолевых клеток GFP перенесите 250 000 клеток в микроцентрифужную пробирку и поместите гранулы в 2 500 × г в течение 5 минут при комнатной температуре. Удалите рыбный фильтрующий материал, добавьте 500 μL PBS и пропустите через фильтрующий колпачок 35 μm в пробирку FACS. Держите на льду.
6. Сортировка
ПРИМЕЧАНИЕ: Держите все пробирки и донорскую пластину на льду все время, за исключением случаев, когда они используются для сортировки.
- Для сортировки параметров и стробов начните с применения прямого и бокового стробирования рассеяния, чтобы идентифицировать интересующие клетки на основе их размера и удалить остатки клеток. Затем используйте высоту прямого рассеивания против области прямого рассеивания, чтобы исключить дубликаты ячеек и оставить только синглеты. Наконец, используйте элементы управления без цвета и одноцветные элементы управления, чтобы нарисовать квадранты для идентификации GFP-положительных и CT-FR-положительных популяций клеток.
ПРИМЕЧАНИЕ: Ожидается, что контроль CT-FR будет намного ярче, чем образцы для сортировки, поскольку окрашивание для контроля было сделано свежим, без клеточных делений; ожидается, что клетки из образцов CT-FR GFP появятся на нижнем конце положительного затвора CT-FR. - Отсортируйте количество клеток, которые должны быть пересажены каждой рыбке, в одну лунку донорской пластины.
Примечание: Для этого эксперимента мы использовали анализ предельного разведения для оценки частоты стволовых клеток лейкемии в CT-FR High и CT-FR Low. В этом анализе использовалась доза в 25 клеток, пересаженных 3 животным, и доза в 10 клеток, пересаженная 10 животным. Типичный анализ предельного разведения с использованием T-ALL с использованием T-ALL на основе метода rag2:Myc будет включать группу с большим числом клеток (500 или 1000), поскольку частота LSC в этой модели оценивается как 1 LSC на сотни клеток. Однако в этом анализе мы используем один из клонов T-ALL, ранее описанных Blackburn et al.15. Частота LSC в использованном здесь образце составляет ~1 LSC в десятках ячеек; Мы прогнозируем выявление лейкемии у животных, трансплантированных в группу 25 клеток. При оптимизации этого анализа для вашей модели заболевания следует быть осторожным при выборе группы с более высоким числом клеток, чтобы обеспечить приживление опухоли. - После сортировки держите тарелку на льду до готовности к пересадке.
ПРИМЕЧАНИЕ: Процедуры сортировки могут быть стрессовыми и влиять на жизнеспособность клеток. Перед проведением фактического эксперимента по предельному разбавлению был проведен пилотный эксперимент по сортировке. Отсортированные клетки трансплантировали, и развитие лейкемии контролировали, чтобы определить, наносит ли сортировка вред жизнеспособности клеток. В качестве альтернативы жизнеспособность клеток можно оценить, окрашивая отсортированные клетки трипановым синим и исследуя их под микроскопом перед трансплантацией.
7. Трансплантация отсортированных клеток при ограничении разведения и отслеживании начала опухоли
- Вращайте планшет с помощью большой настольной центрифуги при температуре 2 500 × г при 4 °C.
- Осторожно удалите 45 мкл надосадочной жидкости из каждой лунки, оставив 5 мкл жидкости и стараясь не касаться клеточной гранулы на дне лунки.
- Ресуспендируйте клетки с помощью пипетки объемом 20 μл. Повторно суспендируйте 2-3 лунки с помощью пипетки, а затем с помощью микролитрового шприца Гамильтона введите клеточные суспензии из каждой лунки в нужное количество CG1 данио-рерио с помощью IP-трансплантата. Затем повторно суспендируйте ячейки в следующей группе лунок, чтобы избежать повторного оседания ячеек.
- Осматривайте рыбок данио с помощью флуоресцентной микроскопии под седацией один раз в неделю на предмет развития Т-ОЛЛ в течение не менее 6 недель.
8. Определение частоты использования стволовых клеток лейкемии
- Запишите количество положительных животных на клеточную дозу и группу лечения через 6 недель после трансплантации, считая животных с любым количеством сигнала GFP положительными. Считайте, что животные имеют значительную нагрузку лейкемии, когда сигнал GFP занимает >50% тела.
- Используйте статистическое программное обеспечение ELDA (Extreme Limiting Dilution Analysis) (http://bioinf.wehi.edu.au/software/elda/)19 для расчета частоты LSC в каждой клеточной популяции.
ПРИМЕЧАНИЕ: Схематическая иллюстрация рабочего процесса представлена на рисунке 1.
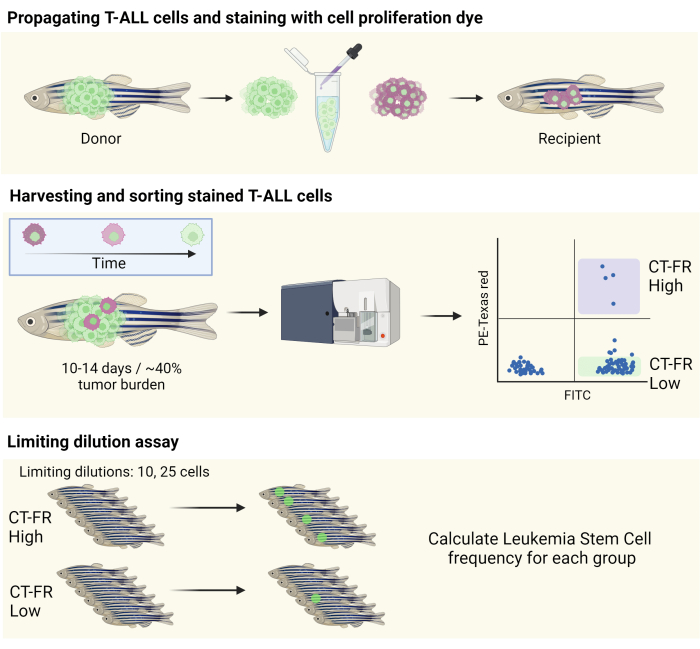
Рисунок 1: Рабочий процесс использования окрашивания для отслеживания клеток для изоляции неподвижных клеток в модели T-ALL рыбки данио. Схематическая иллюстрация окрашивания клеток T-ALL рыбки данио с помощью окрашивания пролиферацией клеток, размножения в рыбку данио-рерио CG1 (верхняя панель) и сортировки клеток на основе удержания окрашивания пролиферацией клеток (средняя панель). Собранные клетки были использованы для анализа предельного разведения для определения частоты LSC (нижняя панель). Сокращения: T-ALL = Т-клеточный острый лимфобластный лейкоз; LSC = лейкемические стволовые клетки; CT-FR = дальний красный цвет CellTrace; FITC = флуоресцеин изотиоцианат; ПЭ = фикоэритрин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Мы следовали описанному выше протоколу для сортировки клеток, которые сохранили краситель для пролиферации клеток, CT-FR, и использовали их для анализа предельного разведения (LDA) для оценки частоты LSC в популяциях CT-FR High и CT-FR Low. Чтобы установить стробирование для экспер...
Обсуждение
Известно, что ЛСК устойчивы к традиционным, антипролиферативным химиотерапевтическим методам, и поиск таргетной терапии против этих клеток имеет большие перспективы в снижении частоты рецидивов и улучшении прогноза дляпациентов. В предыдущем исследов?...
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Финансирование этого исследования было предоставлено Национальным институтом рака (R37CA227656 JSB). Это исследование также было поддержано Общими ресурсами проточной цитометрии и иммунного мониторинга Онкологического центра Марки Университета Кентукки (P30CA177558).
Материалы
| Name | Company | Catalog Number | Comments |
| 26 G/2” micro-syringe | Hamilton | 87930 | NA |
| 35 µm filter cap FACS tubes | Falcon | 352235 | NA |
| 40 µm cell strainer | CELLTREAT | 229482 | NA |
| 96-well skirted PCR plate | Thermo Fisher Scientific | AB0800 | NA |
| Cell sorter | Sony Biotechnology | SY3200 | NA |
| CellTrace Far Red | Thermo Fisher Scientific | C34564 | NA |
| Conical tubes | VWR | 10026-078 | NA |
| DAPI | Thermo Fisher Scientific | 62248 | NA |
| DMSO | Sigma-Aldrich | D4818 | NA |
| Dulbecco'sPhosphate-buffered saline (PBS) | Caisson Labs | 22110001 | NA |
| Epifluorescence stereo microscope | Nikon | SMZ25 | NA |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | 12306C | NA |
| Fish system water | N/A | N/A | 0.03-0.05% salinity, pH 6.5-8, buffered with sodium bicarbonate |
| Microcentrifuge tubes | Thermo Fisher Scientific | C2171 | NA |
| MS-222 | Pentaire | TRS-1 | tricaine mesylate, an anesthetic |
| Petri dishes | Corning | 07-202-011 | NA |
| Razor blades | American Line | 66-0089 | NA |
| Trypan Blue | Thermo Fisher Scientific | T10282 | NA |
Ссылки
- Reya, T., Morrison, S. J., Clarke, M. F., Weissman, I. L. Stem cells, cancer, and cancer stem cells. Nature. 414 (6859), 105-111 (2001).
- Arai, F., et al. Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell. 118 (2), 149-161 (2004).
- Li, L., Bhatia, R. Stem cell quiescence. Clin. Cancer Res. 17 (15), 4936-4941 (2011).
- Kreso, A., Dick, J. E. Evolution of the cancer stem cell model. Cell Stem Cell. 14 (3), 275-291 (2014).
- Chen, W., Dong, J., Haiech, J., Kilhoffer, M. -. C., Zeniou, M. Cancer stem cell quiescence and plasticity as major challenges in cancer therapy. Stem Cells Int. 2016, 1740936 (2016).
- Kleffel, S., Schatton, T. Tumor dormancy and cancer stem cells: Two sides of the same coin. Adv Exp Med Biol. 734, 145-179 (2013).
- Tuy, K., Rickenbacker, L., Hjelmeland, A. B. Reactive oxygen species produced by altered tumor metabolism impacts cancer stem cell maintenance. Redox Biol. 44, 101953 (2021).
- Zhou, B. -. B. S., et al. Tumour-initiating cells: Challenges and opportunities for anticancer drug discovery. Nat Rev Drug Discov. 8 (10), 806-823 (2009).
- Lyons, A. B., Blake, S. J., Doherty, K. V. Flow cytometric analysis of cell division by dilution of cfse and related dyes. Curr Protoc Cytom. 64 (1), 11-12 (2013).
- Lyons, A. B. Analysing cell division in vivo and in vitro using flow cytometric measurement of cfse dye dilution. J Immunol Methods. 243 (1-2), 147-154 (2000).
- Azari, H., Deleyrolle, L. P., Reynolds, B. A. Using carboxy fluorescein succinimidyl ester (cfse) to identify quiescent glioblastoma stem-like cells. Methods Mol Biol. 1686, 59-67 (2018).
- Deleyrolle, L. P., Rohaus, M. R., Fortin, J. M., Reynolds, B. A., Azari, H. Identification and isolation of slow-dividing cells in human glioblastoma using carboxy fluorescein succinimidyl ester (cfse). J Vis Exp. (62), e3918 (2012).
- Ebinger, S., et al. Characterization of rare, dormant, and therapy-resistant cells in acute lymphoblastic leukemia. Cancer Cell. 30 (6), 849-862 (2016).
- Langenau, D. M., et al. Myc-induced t cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Blackburn, J. S., et al. Clonal evolution enhances leukemia-propagating cell frequency in t cell acute lymphoblastic leukemia through akt/mtorc1 pathway activation. Cancer Cell. 25 (3), 366-378 (2014).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. J Vis Exp. (53), e2790 (2011).
- Borga, C., et al. Simultaneous b and t cell acute lymphoblastic leukemias in zebrafish driven by transgenic myc: Implications for oncogenesis and lymphopoiesis. Leukemia. 33 (2), 333-347 (2019).
- Hu, Y., Smyth, G. K. Elda: Extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Bhojwani, D., Pui, C. -. H. Relapsed childhood acute lymphoblastic leukaemia. Lancet Oncol. 14 (6), e205-e217 (2013).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. 4 (1), 35-44 (2005).
- Al-Hamaly, M. A., et al. Zebrafish drug screening identifies erlotinib as an inhibitor of wnt/β-catenin signaling and self-renewal in t-cell acute lymphoblastic leukemia. Biomed Pharmacother. 170, 116013 (2024).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены