A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد استقرار مصل إنزيم الأدينوزين 1 البشري
In This Article
Summary
في هذه المقالة ، نوضح بالتفصيل طرقا لتوصيف قدرة الإنزيم على الاحتفاظ بالوظيفة عند تحضينه عند 37 درجة مئوية في المصل البشري ، وهي خاصية دوائية يشار إليها باسم استقرار المصل. قد تكون هذه القدرة عاملا رئيسيا في التنبؤ بملف الحركة الدوائية للإنزيم ومدى ملاءمته للاستخدام العلاجي.
Abstract
يستخدم مفهوم استقرار الإنزيم عادة للإشارة إلى الثبات الحراري للإنزيم - قدرته على الاحتفاظ بالبنية والنشاط مع زيادة درجة الحرارة. بالنسبة للإنزيم العلاجي ، قد تكون مقاييس الاستقرار الأخرى حاسمة أيضا ، لا سيما قدرته على الاحتفاظ بالوظيفة في المصل البشري عند 37 درجة مئوية ، والتي نشير إليها باسم استقرار المصل. هنا ، نصف مقايسة في المختبر لتقييم استقرار مصل إنزيم Homo sapiens adenosine deaminase I (HsADA1) من النوع البري باستخدام إجراء صفيحة دقيقة قائم على الامتصاص. على وجه التحديد ، تصف هذه المخطوطة تحضير المخازن المؤقتة والكواشف ، وهي طريقة لترتيب تكاثر HsADA1 في المصل ، وطريقة لتحليل عينات الاختبار باستخدام قارئ صفيحة دقيقة ، وتحليل مصاحب لتحديد جزء النشاط الذي يحتفظ به إنزيم HsADA1 في المصل كدالة للوقت. نناقش كذلك اعتبارات تكييف هذا البروتوكول مع الإنزيمات الأخرى ، باستخدام مثال على إنزيم Homo sapiens kynureninase ، للمساعدة في تكيف البروتوكول مع الإنزيمات الأخرى حيث يكون استقرار المصل ذا أهمية.
Introduction
الطريقة التالية تسمح للمستخدم بتقييم قدرة الإنزيم على الاحتفاظ بنشاطه كميا عند تعرضه لظروف تحاكي ما سيواجهه بعد الحقن في الوريد. تحاكي طريقة المختبر مثل هذه الظروف في الجسم الحي وتتكون من حضانة الإنزيم في مصل بشري مجمع عند 37 درجة مئوية وتحليلات متمتصلة للاحتفاظ بنشاط الإنزيم. نشير إلى قدرة الإنزيم على الاحتفاظ بالنشاط في هذه الظروف على أنها استقرار المصل ، وتستفيد طريقة تحليل نشاط الإنزيم من الاختلافات في الامتصاص بين ركيزة الإنزيم والمنتج الناتج. مفهوم استقرار المصل ليس فقط خاصا بالإنزيم وقد تم تطبيقه على العديد من طرق العلاج الأخرى أيضا. على سبيل المثال ، تم تقييم استقرار مصل مقبضات الحمض النووي الريبي التي تستهدف بروتينات سبايك COVID سابقا من خلال مراقبة تحللها بعد الحضانة باستخدام مصل ربلة الساق الجنينية1. كما تم تقييم الببتيدات المضادة للبكتيريا لقدرتها على قمع نمو البكتيريا بعد الحضانة باستخدام مصل بشريمجمع 2.
HsADA1 هو إنزيم يحفز تحويل الأدينوزين أو 2-ديوكسيأدينوزين إلى إينوزين أو 2-ديوكسيإينوزين ، على التوالي3. تبلغ ذروة امتصاص الأدينوزين 260 نانومتر ، بينما يمتص الإينوزين أقوى عند 250 نانومتر4. يمكن اكتشاف هذا التحول في قمم الامتصاص على قارئ الصفيحة الدقيقة عن طريق انخفاض شدة الامتصاص عند 260 نانومتر عند إضافة HsADA1 إلى الأدينوزين. إنزيم HsADA1 له آثار مهمة في جسم الإنسان ، ويؤدي نقصه إلى نقص المناعة المشترك الشديد (ADA-SCID)5. يمكن استخدام متماثل الأبقار ل HsADA1 ، BtADA1 ، كعلاج بديل للإنزيم لعلاج ADA-SCID ، وقد أظهرنا سابقا أن النوع البري HsADA1 يفقد نشاطه عند تحضنه بمصل بشري مجمع ، مما قد يعيق استخدامه كعلاج6. لذلك ، اخترنا إنزيم HsADA1 من النوع البري لإثبات إجراء لتحديد استقرار مصل الإنزيم. تم وصف طريقة تنقية مفصلة ل HsADA1 سابقا6.
في البروتوكول التالي (كما هو مفصل في الشكل 1) ، نوضح كيفية احتضان النوع البري HsADA1 في مصل بشري مجمع عند 37 درجة مئوية. خلال هذا الوقت ، يتم أخذ عينات الاختبار في نقاط زمنية محددة ويتم تجميدها سريعا لتحليلها في المستقبل. بمجرد أخذ جميع العينات ، يتم إجراء اختبار صفيحة دقيقة حيث يتم دمج كل عينة مع الركيزة ، مع انخفاض الامتصاص الناتج كارتباط بالنشاط المحتفظ به للإنزيم. يتم عرض النتائج التمثيلية التي توضح استقرار مصل HsADA1 ، ولأن هذا المقياس قد يكون ذا صلة بتحديد القيمة العلاجية المحتملة للإنزيمات الأخرى ، فإننا نناقش أيضا اعتبارات تكييف هذا البروتوكول مع إنزيم Homo sapiens kynureninase (HsKYNase) وأي إنزيمات بشكل عام. HsKYNase هو إنزيم يشارك في عملية التمثيل الغذائي للتربتوفان وهو قادر على تحلل منتجات التربتوفان الثانوية كينورينين وهيدروكسي كينورينين (OH-Kyn) إلى حمض الأنثرانيليك وحمض الهيدروكسي أنثرانيليك (OH-AA) ، على التوالي. قد يكون التعديل بوساطة الإنزيم لعملية التمثيل الغذائي التربتوفان ذا أهميةعلاجية 7.
Protocol
1. حضانة المصل
- قم بإعداد مخزون 10x من HsADA1 في 1x PBS pH 7.4 (1x PBS) بتركيز نهائي قدره 10 ميكرومتر. قم بإذابة 15 مل من المصل البشري المجمع وتسخينه مسبقا إلى 37 درجة مئوية. قم بتسخين 50 مل من 1x PBS إلى 37 درجة مئوية.
- تحضير مخاليط حضانة الإنزيم والمصل عن طريق إضافة 100 ميكرولتر من مخزون 10x HsADA1 إلى 900 ميكرولتر من المصل البشري المجمع في أنبوب طرد مركزي دقيق منخفض الارتباط ، يشار إليه باسم خليط الإنزيم + المصل. في أنبوب منفصل منخفض الارتباط لأجهزة الطرد المركزي الدقيقة ، أضف 100 ميكرولتر من مخزون 10x HsADA1 إلى 900 ميكرولتر من 1x PBS للمقارنة مع عنصر تحكم غير مصلي ، يشار إليه باسم خليط الإنزيم + 1x PBS. سيكون التركيز النهائي ل HsADA1 في كل خليط 1 ميكرومتر.
- قم بإعداد عنصر تحكم إضافي في أنبوب طرد مركزي دقيق منخفض الربط يتكون من 100 ميكرولتر من 1x PBS ممزوجا ب 900 ميكرولتر من المصل البشري المجمع. سيكون هذا بمثابة التحكم غير الإنزيمي لخليط الإنزيم + المصل. بالإضافة إلى ذلك ، قم بعمل عنصر تحكم يتكون من 1 مل من 1x PBS. سيكون هذا بمثابة التحكم غير الإنزيمي للإنزيم + خليط PBS + 1x.
- Aliquot 100 ميكرولتر من كل خليط من الخطوة 1.2 في أنابيب منفصلة منخفضة الارتباط وتخفيف 1: 1 مع 100 ميكرولتر من 30٪ (حجم / حجم) الجلسرين في 1x PBS. تجميد سريع مع النيتروجين السائل وتخزينه في درجة حرارة -80 درجة مئوية. ستكون هذه العينات هي النقطة الزمنية لليوم 0 ، وسيكون تركيز HsADA1 فيها 500 نانومتر. كرر هذه الخطوة لمخاليط التحكم غير الإنزيمية من 1.3. أغلق جميع الإنزيمات ومخاليط التحكم بغشاء شفاف وضعها في حاضنة 37 درجة مئوية.
- بعد 24 ساعة ، قم بتناول 100 ميكرولتر من كل عينة محتضنة وتخفيف 1: 1 مع 100 ميكرولتر من 30٪ (حجم / حجم) من الجلسرين في 1x PBS. تجميد سريع مع النيتروجين السائل وتخزينه في درجة حرارة -80 درجة مئوية. ستكون هذه العينات هي النقطة الزمنية لليوم 1. أعد جميع مخاليط الإنزيم والتحكم إلى الحاضنة 37 درجة مئوية. كرر هذه الخطوة في 72 ساعة و 120 ساعة.
ملاحظة: لا تحتاج العينات المقتبسة بالضرورة إلى تجميدها بسرعة. بدلا من ذلك ، يمكن للمستخدم إجراء الفحص القائم على الصفيحة الدقيقة فور أخذ كل عينة ، على الرغم من أنه يجب تحضير منحنيات قياسية جديدة ومخزون ركيزة الأدينوزين في كل مرة يتم فيها اختبار العينة.
2. الفحص القائم على Microplate
- قم بإعداد قارئ الصفيحة الدقيقة عن طريق إعداد بروتوكول قراءة حركية (الشكل 2) لقياس الامتصاص عند 260 نانومتر مع أقصر فاصل قراءة لمدة 30 دقيقة وتسخين القارئ مسبقا إلى نقطة ضبط تبلغ 37 درجة مئوية.
- قم بإذابة جميع العينات التي تم جمعها على الجليد. قم بتخفيف كل عينة مذابة بنسبة 1:10 باستخدام 1x PBS مسخن مسبقا إلى 37 درجة مئوية كمخفف في أنابيب الطرد المركزي الدقيقة منخفضة الربط. سيكون تركيز HsADA1 الجديد في هذه العينات 50 نانومتر.
- قم بعمل تخفيف 10x إلى 1x PBS من عينة التحكم في المصل غير الإنزيمي أيضا. بالإضافة إلى ذلك ، قم بإعداد مخزون أدينوزين 5 ملي مولار عن طريق إضافة 66.8 مجم من الأدينوزين إلى 50 مل من 1x PBS. قم بإعداد تخفيف 250 ميكرومتر من الأدينوزين عن طريق إضافة 400 ميكرولتر من مخزون الأدينوزين إلى 7,600 ميكرولتر من 1x PBS وتسخينه مسبقا إلى 37 درجة مئوية في حاضنة.
- إلى صفيحة دقيقة متوافقة مع الأشعة فوق البنفسجية ذات 96 بئرا ، أضف 160 ميكرولتر من تخفيف الأدينوزين 250 ميكرومتر و 40 ميكرولتر من كل عينة بروتين مخففة في ثلاث نسخ لحجم إجمالي قدره 200 ميكرولتر. سينتج عن ذلك تركيز أدينوزين نهائي يبلغ 200 ميكرومتر وتركيز إنزيم نهائي يبلغ 10 نانومتر.
- كرر التخفيف للعينات الضابطة عن طريق إضافة 40 ميكرولتر من المصل المخفف أو 1x عناصر تحكم PBS و 160 ميكرولتر من تخفيف الأدينوزين 250 ميكرومتر في ثلاث نسخ. سينتج عن ذلك أيضا تركيز أدينوزين نهائي يبلغ 200 ميكرومتر ولكن بدون إنزيم.
ملاحظة: قد يكون من المفيد إضافة جميع عينات الإنزيم والتحكم المخفف بشكل فردي إلى الصفيحة الدقيقة أولا ثم إضافة ركيزة الأدينوزين مع ماصة دقيقة ذات 12 قناة لتقليل وقت التحميل الإجمالي. بالإضافة إلى ذلك ، يجب استخدام الألواح الشفافة للأشعة فوق البنفسجية في هذه الخطوة لمنع اللوحة نفسها من إرباك إشارة الامتصاص المقاسة. - قم بقياس امتصاص كل بئر عند 260 نانومتر لمدة 30 دقيقة عند 37 درجة مئوية. بمجرد الانتهاء من ذلك ، قم بتصدير البيانات إلى جدول بيانات لمزيد من التحليل.
3. تحليل بيانات قارئ اللوحة الدقيقة
- حدد ميل المنطقة الخطية لبيانات الامتصاص كدالة للوقت للدقائق العديدة الأولى من بيانات الصفيحة الدقيقة. بالنسبة للعينات المخففة بالمصل ، يتوافق هذا مع أول ~ 120 ثانية. بالنسبة للعينات المخففة ب 1x PBS ، يتوافق هذا مع أول ~ 270 ثانية. سيكون لهذا الميل لقيم الامتصاص الهابطة قيمة عددية سالبة وسيكون له وحدات تغيير في وحدات الامتصاص في الثانية (ΔA260 / ثانية).
- اطرح منحدر المكافحة السلبية التي تتكون من مصل بشري مجمع من منحدر الإنزيم + بيانات المصل. قم بإجراء نفس العملية على مخاليط الإنزيم + 1x PBS عن طريق طرح منحدر عنصر التحكم 1x PBS.
- تطبيع جميع المنحدرات المعدلة إلى المنحدر الأصلي عند t = 0 h للحصول على جزء النشاط المتبقي باستخدام المعادلة 1.
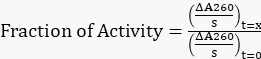 المعادلة 1
المعادلة 1 - ارسم جزء النشاط المتبقي مقابل الوقت.
النتائج
توضح الأشكال نتائج تشغيل الفحص عند إجراؤها باستخدام النوع البري HsADA1. يوضح الشكل 3 أ ، ب منحنيات انخفاض الامتصاص عند 260 نانومتر من العينات التي نشأت من 1x PBS / مخاليط إنزيم مصل للنوع البري HsADA1 بعد إضافة الأدينوزين. هذا الامتصاص المتناقص كدالة لبيانا?...
Discussion
يستخدم هذا البروتوكول تغيير الامتصاص حيث يتم تحويل الركيزة إلى المنتج لقياس نشاط الإنزيم. على هذا النحو ، يجب أن يكون للركيزة والمنتج ملامح طيفية مميزة. هذا هو الحال مع الأدينوزين والإينوزين اللذين لهما ملامح طيفية مميزة ومعاملات انقراض بين 260-265 نانومتر6...
Disclosures
JB و MRJ مخترعان في براءات الاختراع أو طلبات براءات الاختراع المتعلقة بإنزيمات الأدينوزين ديميناز و / أو كينورينيناز. جميع المؤلفين الآخرين ليس لديهم تضارب في المصالح للإفصاح عنهم.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة [1DP2CA280622-01] وبتمويل من Biolocity. نشكر الدكتورة ماريا جينينغز وأندريا فوكس على توفير متجهات التعبير HsADA1 و HsKYNase.
Materials
| Name | Company | Catalog Number | Comments |
| Adenosine | Sigma Aldrich | A9251-25G | 25 g |
| BioTek Synergy HT Microplate Reader | |||
| Eppendorf LoBind Microcentrifuge Tubes: Protein | Fisher Scientific | 13-698-795 | 2 mL |
| Glycerol | Fisher Scientific | G33-4 | 4 L |
| HsKYNase66-W102H-T333N | In-house | ||
| Human Serum, Pooled | MP Biomedicals | 92931149 | 100 mL |
| Hydroxy-kynurenine | Cayman Chemicals | 27778 | |
| Inosine | TCI | I0037 | 25 g |
| PBS, 1x pH 7.4+/- 0.1 | Corning | 21-040-CM | |
| Pyridoxal 5-phosphate monohydrate, 99% | Thermo Scientifc | 228170010 | 1 g |
| UV-STAR MICROPLATE, 96 WELL, COC, F-BOTTOM | Greiner Bio | 655801 | |
| Wildtype Human Adenosine Deaminase 1 | In-house |
References
- Valero, J., et al. A serum-stable RNA aptamer specific for SARS-COV-2 neutralizes viral entry. Proc Natl Acad Sci U S A. 118 (50), e2112942118 (2021).
- Iannuzo, N., et al. High-throughput screening identifies synthetic peptides with antibacterial activity against mycobacterium abscessus and serum stability. ACS Omega. 7 (27), 23967-23977 (2022).
- Ma, M. T., Jennings, M. R., Blazeck, J., Lieberman, R. L. Catalytically active holo homo sapiens adenosine deaminase i adopts a closed conformation. Acta Crystallograph Sect D. 78 (1), 91-103 (2022).
- Li, W., et al. Determination of 4 nucleosides via one reference compound in chinese cordyceps by hplc-uv at equal absorption wavelength. Natural Prod Comm. 18 (3), 1934578X231161410 (2023).
- Whitmore, K. V., Gaspar, H. B. Adenosine deaminase deficiency - more than just an immunodeficiency. Front Immunol. 7, 314 (2016).
- Jennings, M. R., et al. Optimized expression and purification of a human adenosine deaminase in E. coli and characterization of its asp8asn variant. Prot Express Purificat. 213, 106362 (2024).
- Blazeck, J., et al. Bypassing evolutionary dead ends and switching the rate-limiting step of a human immunotherapeutic enzyme. Nat Catalysis. 5 (10), 952-967 (2022).
- Lu, J., Grenache, D. G. Development of a rapid, microplate-based kinetic assay for measuring adenosine deaminase activity in body fluids. Clinica Chimica Acta. 413 (19), 1637-1640 (2012).
- Maciel, L. G., Dos Anjos, J. V., Soares, T. A. Fast and low-cost evaluation of hydroxykynurenine activity. MethodsX. 7, 100982 (2020).
- Bokman, A. H., Schweigert, B. S. 3-hydroxyanthranilic acid metabolism. Iv. Spectrophotometric evidence for the formation of an intermediate. Arch Biochem Biophys. 33 (2), 270-276 (1951).
- Tanford, C. . Advances in protein chemistry. 23, 121-282 (1968).
- Tritsch, G. L. Validity of the continuous spectrophotometric assay of kalckar for adenosine deaminase activity. Anal Biochem. 129 (1), 207-209 (1983).
- Gracia, E., et al. The catalytic site structural gate of adenosine deaminase allosterically modulates ligand binding to adenosine receptors. FASEB J. 27 (3), 1048-1061 (2013).
- Kalckar, H. M. Differential spectrophotometry of purine compounds by means of specific enzymes: Iii. Studies of the enzymes of purine metabolism. J Bio Chem. 167 (2), 461-475 (1947).
- Hartwick, R., Jeffries, A., Krstulovic, A., Brown, P. R. An optimized assay for adenosine deaminase using reverse phase high pressure liquid chromatography. J Chromatographic Sci. 16 (9), 427-435 (1978).
- Paul, M. K., Grover, V., Mukhopadhyay, A. K. Merits of hplc-based method over spectrophotometric method for assessing the kinetics and inhibition of mammalian adenosine deaminase. J Chromatography B. 822 (1), 146-153 (2005).
- Ubbink, J. B., Vermaak, W. J. H., Bissbort, S. H. High-performance liquid chromatographic assay of human lymphocyte kynureninase activity levels. J Chromatography B: Biomed Sci Appl. 566 (2), 369-375 (1991).
- Tsentalovich, Y. P., Snytnikova, O. A., Forbes, M. D. E., Chernyak, E. I., Morozov, S. V. Photochemical and thermal reactivity of kynurenine. Exp Eye Res. 83 (6), 1439-1445 (2006).
- Demain, A. L., Vaishnav, P. Production of recombinant proteins by microbes and higher organisms. Biotechnol Adv. 27 (3), 297-306 (2009).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Faber, M. S., Whitehead, T. A. Data-driven engineering of protein therapeutics. Curr Opin Biotechnol. 60, 104-110 (2019).
- Das, S., Zhao, L., Elofson, K., Finn, M. G. Enzyme stabilization by virus-like particles. Biochemistry. 59 (31), 2870-2881 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved