このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒトアデノシンデアミナーゼ1酵素の血清安定性の測定
要約
この記事では、ヒト血清中で37°Cでインキュベートした場合の酵素の機能保持能力(血清安定性と呼ばれる薬理学的特性)を特徴付ける方法について詳しく説明します。この能力は、酵素の薬物動態プロファイルと治療使用への適合性を予測する上で重要な要素となる可能性があります。
要約
酵素の安定性の概念は、通常、酵素の熱安定性、つまり温度が上昇しても構造と活性を保持する能力を指すために使用されます。治療用酵素の場合、安定性の他の尺度、特に37°Cでヒト血清中の機能を保持する能力(これを血清安定性と呼んでいます)も重要になる可能性があります。ここでは、吸光度ベースのマイクロプレート手順を使用して、野生型ホモ・サピエンス・アデノシン・デアミナーゼI(HsADA1)酵素の血清安定性を評価するためのin vitroアッセイについて説明します。具体的には、この原稿では、バッファーと試薬の調製、血清中のHsADA1の共インキュベーションの手配方法、マイクロプレートリーダーを使用して試験サンプルを分析する方法、およびHsADA1酵素が時間の関数として血清中に保持する活性の割合を決定するための付随する分析について説明します。さらに、ホモ・サピエンス・キヌレニナーゼ酵素の例を使用して、このプロトコルを他の酵素に適応させるための考慮事項について議論し、血清の安定性が関心のある他の酵素へのプロトコルの適応を支援します。
概要
次の方法により、ユーザーは、静脈内注射後に遭遇するものを模倣する条件にさらされたときに、酵素がその活性を保持する能力を定量的に評価できます。 in vitro 法は、このような in vivo 条件を模倣し、37°Cでプールされたヒト血清中での酵素のインキュベーションと、酵素活性の保持の経時的な分析で構成されています。これらの条件下で活性を保持する酵素の能力を血清安定性と呼び、酵素活性の分析法では、酵素の基質と得られる生成物との間の吸光度の違いを利用しています。血清安定性の概念は酵素特異的なものではなく、他のいくつかの治療法にも適用されています。例えば、COVIDスパイクタンパク質を標的とするRNAアプタマーの血清安定性は、以前にウシ胎児血清1とのインキュベーション後の分解をモニタリングすることで評価されてきました。抗菌ペプチドは、プールされたヒト血清2とのインキュベーション後に細菌の増殖を抑制する能力についても評価されています。
HsADA1は、アデノシンまたは2-デオキシアデノシンからイノシンまたは2-デオキシイノシンへの変換を触媒する酵素です3。アデノシンの吸収ピークは260nmですが、イノシンは250nm4で最も強く吸収します。この吸収ピークのシフトは、アデノシンにHsADA1を添加すると260 nmで吸収強度が低下することで、マイクロプレートリーダーで検出できます。HsADA1酵素は人体に重要な意味を持ち、その欠乏は重度の複合免疫不全症(ADA-SCID)5を引き起こします。HsADA1のウシ相同体であるBtADA1は、ADA-SCIDの治療のための酵素代替治療薬として利用することができ、野生型HsADA1はプールされたヒト血清とインキュベートするとその活性を失い、治療薬としての使用を妨げる可能性があることを以前に示しました6。そこで、野生型HsADA1酵素を選定し、酵素の血清安定性を測定する手順を実証しました。HsADA1の詳細な精製方法は、前述した6。
以下のプロトコル( 図1に詳述)では、野生型HsADA1をプールしたヒト血清中で37°Cで共インキュベートする方法を示します。 この間、テストサンプルは定義された時点で採取され、将来の分析のために急速凍結されます。すべてのサンプルを採取した後、マイクロプレートアッセイを実行し、各サンプルを基質と結合し、結果として生じる吸光度の減少が酵素の保持活性と相関します。HsADA1の血清安定性を示す代表的な結果が示されており、この指標は他の酵素の潜在的な治療価値の決定に関連している可能性があるため、このプロトコルを操作された ホモサピエンスキ ヌレニナーゼ酵素(HsKYNase)およびより一般的に任意の酵素に適応させるための考慮事項についても説明します。HsKYNaseは、トリプトファンの代謝に関与する酵素であり、トリプトファン副産物であるキヌレニンとヒドロキシキヌレニン(OH-Kyn)をそれぞれアントラニル酸とヒドロキシアントラニル酸(OH-AA)に分解することができます。酵素を介したトリプトファン代謝の調節は、治療に関連性がある可能性があります7。
プロトコル
1. 血清インキュベーション
- 最終濃度10 μMで1x PBS pH 7.4 (1x PBS)中のHsADA1の10倍ストックを調製し、プールしたヒト血清の15 mLアリコートを解凍し、37°Cに予熱します。 1x PBSの50 mLアリコートを37°Cに予温します。
- 酵素+血清混合物と呼ばれる低結合微量遠心チューブで、10x HsADA1ストック100 μLをプールしたヒト血清900 μLを加えて、酵素-血清インキュベーション混合物を調製します。別の低結合微量遠心チューブで、10x HsADA1ストック100 μLを1x PBSストック900 μLに加えて、酵素+1x PBS混合物と呼ばれる非血清コントロールと比較します。各混合物中のHsADA1の最終濃度は1μMになります。
- 100 μL の 1x PBS と 900 μL のプールされたヒト血清を混合した低結合マイクロ遠心チューブで、追加のコントロールを調製します。これは、酵素+血清混合物の非酵素制御として機能します。さらに、1 mLの1x PBSからなるコントロールを作成します。これは、酵素+ 1x PBS混合物の非酵素制御として機能します。
- ステップ1.2の各混合物100 μLを別々の低結合チューブに分注し、1x PBSで30%(v / v)グリセロール100 μLで1:1に希釈します。液体窒素で急速凍結し、-80°Cで保存します。 これらのサンプルは Day 0 の時点であり、サンプル中の HsADA1 の濃度は 500 nM になります。1.3の非酵素制御混合物について、この手順を繰り返します。すべての酵素とコントロール混合物を透明フィルムで密封し、37°Cのインキュベーターに入れます。
- 24時間後、インキュベートした各サンプル100 μLを分量し、1x PBSで30%(v / v)グリセロール100 μLで1:1に希釈します。液体窒素で急速凍結し、-80°Cで保存します。 これらのサンプルは Day 1 の時点になります。すべての酵素およびコントロール混合物を37°Cインキュベーターに戻します。この手順を 72 時間と 120 時間で繰り返します。
注:分注サンプルは、必ずしも急速冷凍する必要はありません。あるいは、各サンプルを採取した直後にマイクロプレートベースのアッセイを実施することもできますが、サンプルを試験するたびに新鮮な標準曲線とアデノシン基質ストックを調製する必要があります。
2. マイクロプレートを用いたアッセイ
- マイクロプレートリーダーを準備するには、キネティックリードプロトコル(図2)を設定して、最短の読み取り間隔30分で260nmの吸光度を測定し、リーダーを37°Cの設定値に予熱します。
- 収集したすべてのサンプルを氷上で解凍します。37°Cに予熱した1x PBSを低結合微量遠心チューブの希釈剤として使用して、解凍した各サンプルを1:10に希釈します。これらのサンプル中の新しいHsADA1濃度は50 nMになります。
- 非酵素血清コントロールサンプルから1x PBSに10倍希釈します。さらに、50 mLの1x PBSに66.8 mgのアデノシンを添加して、5 mMのアデノシンストックを調製します。1x PBSの7,600 μLに400 μLのアデノシンストックを加えて、250 μMのアデノシン希釈液を調製し、インキュベーターで37°Cに予温します。
- 96ウェルUV適合マイクロプレートに、250 μMのアデノシン希釈液160 μLと希釈したタンパク質サンプル40 μLを三重に添加して、総容量200 μLにします。これにより、最終的なアデノシン濃度は200 μM、最終的な酵素濃度は10 nMになります。
- 希釈した血清または1x PBSコントロール40 μLと250 μMアデノシン希釈液160 μLを三重に添加して、コントロールサンプルの希釈を繰り返します。これにより、最終的なアデノシン濃度は200 μMになりますが、酵素は含まれていません。
注:最初にすべての希釈酵素サンプルとコントロールサンプルをマイクロプレートに個別に追加し、次に12チャンネルマイクロピペットでアデノシン基質を追加すると、合計ロード時間を短縮できます。さらに、このステップでは、プレート自体が測定された吸光度信号と交絡するのを防ぐために、UV透過性プレートを使用する必要があります。 - 260 nmで各ウェルの吸光度を37°Cで30分間測定します。 完了したら、データをスプレッドシートにエクスポートして、さらに分析します。
3. マイクロプレートリーダーデータの解析
- 吸光度データの最初の数分間の時間の関数として、吸光度データの線形領域の傾きを決定します。血清希釈サンプルの場合、これは最初の~120秒に対応しました。1x PBS希釈サンプルの場合、これは最初の~270秒に相当します。この減衰吸収値の傾きは負の数値を持ち、1 秒あたりの吸光度単位 (ΔA260/s) の変化単位を持ちます。
- プールされたヒト血清からなるネガティブコントロールの傾きを、酵素+血清データの傾きから差し引きます。酵素 + 1x PBS混合物に対して、1x PBSコントロールの傾きを差し引いて同じ操作を行います。
- 調整されたすべての傾きを t=0 h の元の傾きに正規化し、式 1 を使用して残りの活動の割合を求めます。
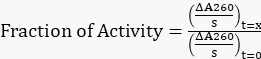 数式 1
数式 1 - 残りのアクティビティの割合と時間をプロットします。
結果
図は、野生型HsADA1で実施した場合のアッセイ実行結果を示しています。 図3A、B は、アデノシン添加後の野生型HsADA1の1x PBS/血清-酵素混合物に由来するサンプルの260 nmでの吸光度低下曲線を示しています。この時間データの関数としての吸光度の低下は、マイクロプレートベースのアッセイが成功裏に完了したときにユーザーが期待...
ディスカッション
このプロトコルでは、基質が製品に変換される際の吸光度変化を使用して、酵素の活性を測定します。そのため、基板と製品は異なるスペクトルプロファイルを持つ必要があります。これは、アデノシンとイノシンの両方が異なるスペクトルプロファイルを持ち、吸光係数が260〜265 nmの場合です6,8,12,13。
開示事項
JBおよびMRJは、アデノシンデアミナーゼおよび/またはキヌレニナーゼ酵素に関連する特許または特許出願の発明者です。他のすべての著者には、開示すべき利益相反はありません。
謝辞
この研究は、国立衛生研究所[1DP2CA280622-01]とBiolocityからの資金提供によって支援されました。HsADA1およびHsKYNase発現ベクターを提供してくださったMaria Jennings博士とAndrea Fox博士に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Adenosine | Sigma Aldrich | A9251-25G | 25 g |
| BioTek Synergy HT Microplate Reader | |||
| Eppendorf LoBind Microcentrifuge Tubes: Protein | Fisher Scientific | 13-698-795 | 2 mL |
| Glycerol | Fisher Scientific | G33-4 | 4 L |
| HsKYNase66-W102H-T333N | In-house | ||
| Human Serum, Pooled | MP Biomedicals | 92931149 | 100 mL |
| Hydroxy-kynurenine | Cayman Chemicals | 27778 | |
| Inosine | TCI | I0037 | 25 g |
| PBS, 1x pH 7.4+/- 0.1 | Corning | 21-040-CM | |
| Pyridoxal 5-phosphate monohydrate, 99% | Thermo Scientifc | 228170010 | 1 g |
| UV-STAR MICROPLATE, 96 WELL, COC, F-BOTTOM | Greiner Bio | 655801 | |
| Wildtype Human Adenosine Deaminase 1 | In-house |
参考文献
- Valero, J., et al. A serum-stable RNA aptamer specific for SARS-COV-2 neutralizes viral entry. Proc Natl Acad Sci U S A. 118 (50), e2112942118 (2021).
- Iannuzo, N., et al. High-throughput screening identifies synthetic peptides with antibacterial activity against mycobacterium abscessus and serum stability. ACS Omega. 7 (27), 23967-23977 (2022).
- Ma, M. T., Jennings, M. R., Blazeck, J., Lieberman, R. L. Catalytically active holo homo sapiens adenosine deaminase i adopts a closed conformation. Acta Crystallograph Sect D. 78 (1), 91-103 (2022).
- Li, W., et al. Determination of 4 nucleosides via one reference compound in chinese cordyceps by hplc-uv at equal absorption wavelength. Natural Prod Comm. 18 (3), 1934578X231161410 (2023).
- Whitmore, K. V., Gaspar, H. B. Adenosine deaminase deficiency - more than just an immunodeficiency. Front Immunol. 7, 314 (2016).
- Jennings, M. R., et al. Optimized expression and purification of a human adenosine deaminase in E. coli and characterization of its asp8asn variant. Prot Express Purificat. 213, 106362 (2024).
- Blazeck, J., et al. Bypassing evolutionary dead ends and switching the rate-limiting step of a human immunotherapeutic enzyme. Nat Catalysis. 5 (10), 952-967 (2022).
- Lu, J., Grenache, D. G. Development of a rapid, microplate-based kinetic assay for measuring adenosine deaminase activity in body fluids. Clinica Chimica Acta. 413 (19), 1637-1640 (2012).
- Maciel, L. G., Dos Anjos, J. V., Soares, T. A. Fast and low-cost evaluation of hydroxykynurenine activity. MethodsX. 7, 100982 (2020).
- Bokman, A. H., Schweigert, B. S. 3-hydroxyanthranilic acid metabolism. Iv. Spectrophotometric evidence for the formation of an intermediate. Arch Biochem Biophys. 33 (2), 270-276 (1951).
- Tanford, C. . Advances in protein chemistry. 23, 121-282 (1968).
- Tritsch, G. L. Validity of the continuous spectrophotometric assay of kalckar for adenosine deaminase activity. Anal Biochem. 129 (1), 207-209 (1983).
- Gracia, E., et al. The catalytic site structural gate of adenosine deaminase allosterically modulates ligand binding to adenosine receptors. FASEB J. 27 (3), 1048-1061 (2013).
- Kalckar, H. M. Differential spectrophotometry of purine compounds by means of specific enzymes: Iii. Studies of the enzymes of purine metabolism. J Bio Chem. 167 (2), 461-475 (1947).
- Hartwick, R., Jeffries, A., Krstulovic, A., Brown, P. R. An optimized assay for adenosine deaminase using reverse phase high pressure liquid chromatography. J Chromatographic Sci. 16 (9), 427-435 (1978).
- Paul, M. K., Grover, V., Mukhopadhyay, A. K. Merits of hplc-based method over spectrophotometric method for assessing the kinetics and inhibition of mammalian adenosine deaminase. J Chromatography B. 822 (1), 146-153 (2005).
- Ubbink, J. B., Vermaak, W. J. H., Bissbort, S. H. High-performance liquid chromatographic assay of human lymphocyte kynureninase activity levels. J Chromatography B: Biomed Sci Appl. 566 (2), 369-375 (1991).
- Tsentalovich, Y. P., Snytnikova, O. A., Forbes, M. D. E., Chernyak, E. I., Morozov, S. V. Photochemical and thermal reactivity of kynurenine. Exp Eye Res. 83 (6), 1439-1445 (2006).
- Demain, A. L., Vaishnav, P. Production of recombinant proteins by microbes and higher organisms. Biotechnol Adv. 27 (3), 297-306 (2009).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Faber, M. S., Whitehead, T. A. Data-driven engineering of protein therapeutics. Curr Opin Biotechnol. 60, 104-110 (2019).
- Das, S., Zhao, L., Elofson, K., Finn, M. G. Enzyme stabilization by virus-like particles. Biochemistry. 59 (31), 2870-2881 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved