需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
测定人腺苷脱氨酶 1 酶的血清稳定性
摘要
在本文中,我们详细介绍了表征酶在人血清中于 37 °C 孵育时保持功能能力的方法,这种药理学特性称为其血清稳定性。这种能力可能是预测酶的药代动力学特征及其治疗用途适用性的关键因素。
摘要
酶稳定性的概念通常用于指代酶的热稳定性,即随着温度升高而保持结构和活性的能力。对于治疗性酶,其他稳定性指标也可能至关重要,尤其是它在 37 °C 下保持人血清功能的能力,我们称之为血清稳定性。在这里,我们描述了一种 体外 测定法,以使用基于吸光度的微孔板程序评估野生型 Homo sapiens 腺苷脱氨酶 I (HsADA1) 酶的血清稳定性。具体来说,本手稿描述了缓冲液和试剂的制备、安排 HsADA1 在血清中共孵育的方法、使用酶标仪分析测试样品的方法,以及确定 HsADA1 酶在血清中保留的活性分数随时间变化的分析。我们进一步讨论了使该方案适应其他酶的考虑因素,使用 Homo sapiens 犬尿氨酸酶的例子,以帮助该方案适应对血清稳定性感兴趣的其他酶。
引言
以下方法允许用户定量评估酶在暴露于模拟静脉注射后会遇到的条件时保持其活性的能力。 体外 方法模拟了这种 体内 条件,包括在 37 °C 下在混合人血清中孵育酶和酶活性保留的时间进程分析。我们将酶在这些条件下保持活性的能力称为其血清稳定性,酶活性分析方法利用了酶底物与所得产物之间吸光度的差异。血清稳定性的概念不仅具有酶特异性,还已应用于其他几种治疗方式。例如,靶向 COVID 刺突蛋白的 RNA 适体的血清稳定性先前是通过监测它们与胎牛血清孵育后的降解来评估的1。还评估了抗菌肽在与混合人血清孵育后抑制细菌生长的能力2。
HsADA1 是一种催化腺苷或 2-脱氧腺苷分别转化为肌苷或 2-脱氧肌苷的酶3。腺苷的吸收峰为 260 nm,而肌苷在 250 nm 处吸收最强4。当 HsADA1 添加到腺苷中时,可以通过 260 nm 处吸收强度的降低在酶标仪上检测到吸收峰的这种变化。HsADA1 酶在人体中具有重要意义,其缺陷会导致严重的联合免疫缺陷 (ADA-SCID)5。HsADA1 的牛同源物 BtADA1 可用作治疗 ADA-SCID 的酶替代疗法,我们之前已经证明,野生型 HsADA1 在与混合人血清孵育时会失去活性,这可能会阻碍其用作治疗药物6。因此,我们选择了野生型 HsADA1 酶来演示确定酶血清稳定性的程序。HsADA1 的详细纯化方法已在前面描述过 6。
在以下方案中(如图 1 中详述),我们演示了如何在 37 °C 下在混合人血清中共孵育野生型 HsADA1。 在此期间,在定义的时间点采集测试样本并快速冷冻以备将来分析。采集所有样品后,进行微孔板分析,其中每个样品与底物结合,由此产生的吸光度降低与酶的保留活性相关。显示了说明 HsADA1 血清稳定性的代表性结果,并且由于该指标可能与确定其他酶的潜在治疗价值相关,我们还讨论了使该方案 适应工程化 智人犬尿氨酸酶 (HsKYNase) 和更普遍的任何酶的考虑因素。HsKYNase 是一种参与色氨酸代谢的酶,能够将色氨酸副产物犬尿氨酸和羟基犬尿氨酸 (OH-Kyn) 分别降解为邻氨基苯甲酸和羟基邻氨基苯甲酸 (OH-AA)。酶介导的色氨酸代谢调节可能具有治疗相关性7。
研究方案
1. 血清孵育
- 在 1x PBS pH 7.4 (1x PBS) 中制备 10x HsADA1 储备液,终浓度为 10 μM。解冻 15 mL 等分试样的混合人血清,并将其预热至 37 °C。 将 50 mL 等分试样的 1x PBS 预热至 37 °C。
- 通过在低结合微量离心管中将 100 μL 的 10x HsADA1 原液添加到 900 μL 混合的人血清中来制备酶-血清孵育混合物,称为酶 + 血清混合物。在单独的低结合微量离心管中,将 100 μL 的 10x HsADA1 原液添加到 900 μL 的 1x PBS 中,以与非血清对照(称为酶 + 1x PBS 混合物)进行比较。每种混合物中 HsADA1 的最终浓度为 1 μM。
- 在低结合微量离心管中制备额外的对照,该离心管由 100 μL 1x PBS 和 900 μL 混合的人血清混合而成。这将用作酶 + 血清混合物的非酶对照。此外,制作由 1 mL 1x PBS 组成的对照。这将用作酶 + 1x PBS 混合物的非酶对照。
- 将步骤 1.2 中的每种混合物 100 μL 分装到单独的低结合管中,并在 1x PBS 中用 100 μL 30% (v/v) 甘油以 1:1 稀释。用液氮速冻并储存在 -80 °C。 这些样品将是第 0 天的时间点,其中 HsADA1 的浓度为 500 nM。对 1.3 中的非酶对照混合物重复此步骤。用透明薄膜密封所有酶和对照混合物,并将它们放入 37 °C 培养箱中。
- 24 小时后,分装 100 μL 每个孵育样品,并在 1x PBS 中用 100 μL 30% (v/v) 甘油以 1:1 稀释。用液氮速冻并储存在 -80 °C。 这些样本将是第 1 天的时间点。将所有酶和对照混合物放回 37 °C 培养箱中。在 72 小时和 120 小时重复此步骤。
注:等分的样品不一定需要快速冷冻。或者,用户可以在采集每个样品后立即进行基于微孔板的检测,但每次检测样品时都应准备新鲜的标准曲线和腺苷底物储备。
2. 基于微孔板的检测
- 通过设置动力学读取方案(图 2)来准备酶标仪,以最短读取间隔测量 260 nm 处的吸光度 30 分钟,并将酶标仪预热至 37 °C 的设定点。
- 在冰上解冻所有收集的样品。在低结合微量离心管中使用预热至 37 °C 的 1x PBS 作为稀释剂,以 1:10 稀释每个解冻的样品。这些样品中新的 HsADA1 浓度为 50 nM。
- 也从非酶血清对照样品中将 10 倍稀释到 1 倍 PBS 中。此外,通过将 66.8 mg 腺苷添加到 50 mL 1x PBS 中来制备 5 mM 腺苷原液。通过将 400 μL 腺苷原液添加到 7,600 μL 的 1x PBS 中,制备 250 μM 稀释的腺苷,并在培养箱中将其预热至 37 °C。
- 向 96 孔 UV 兼容微孔板中,加入 160 μL 的 250 μM 腺苷稀释液和 40 μL 每种稀释的蛋白质样品,一式三份,总体积为 200 μL。这将产生 200 μM 的最终腺苷浓度和 10 nM 的最终酶浓度。
- 通过加入 40 μL 稀释血清或 1x PBS 对照和 160 μL 250 μM 腺苷稀释液,重复对对照样品进行稀释,一式三份。这也将产生 200 μM 的最终腺苷浓度,但不含酶。
注:先将所有稀释的酶和对照样品分别添加到微孔板中,然后用 12 通道微量移液器添加腺苷底物以减少总加载时间,这可能是有益的。此外,在此步骤中必须使用紫外线透明板,以防止板本身混淆测得的吸光度信号。 - 在 37 °C 下测量每个孔在 260 nm 处的吸光度 30 分钟。 完成后,将数据导出到电子表格以供进一步分析。
3. 酶标仪数据分析
- 确定吸光度数据线性区域的斜率作为微孔板数据前几分钟的时间函数。对于血清稀释的样品,这对应于第一个 ~120 秒。对于 1x PBS 稀释的样品,这对应于第一个 ~270 秒。这个下降的吸光度值的斜率将具有负数值,并且将具有每秒吸光度单位 (ΔA260/s) 的变化单位。
- 从酶 + 血清数据的斜率中减去由合并人血清组成的阴性对照的斜率。通过减去 1x PBS 对照的斜率,对酶 + 1x PBS 混合物执行相同的操作。
- 将所有调整后的斜率归一化为 t=0 h 时的原始斜率,以使用公式 1 获得剩余活动的分数。
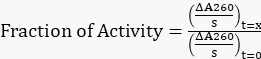 方程 1
方程 1 - 绘制剩余活动与时间的比例。
结果
这些图显示了使用野生型 HsADA1 进行检测时进行的检测结果。 图 3A、B 说明了加入腺苷后源自野生型 HsADA1 的 1x PBS/血清-酶混合物的样品在 260 nm 处的吸光度下降曲线。这种随时间数据变化的吸光度下降是用户在成功完成基于微孔板的测定后可能期望的结果,并且类似于向腺苷中加入足够量的功能性 HsADA1 后出现的吸光度数据。
讨论
该方案使用底物转化为产物时的吸光度变化来测量酶的活性。因此,衬底和产品必须具有不同的光谱图。腺苷和肌苷都具有不同的光谱图和消光系数,介于 260-265 nm之间 6,8,12,13。该测定法的灵感来自以前的几项工作。例如,Kalackar 利用 265 nm 处的吸光度变化作为腺苷脱氨酶活?...
披露声明
JB 和 MRJ 是腺苷脱氨酶和/或犬尿氨酸酶相关专利或专利申请的发明人。所有其他作者没有需要披露的利益冲突。
致谢
这项工作得到了美国国立卫生研究院 [1DP2CA280622-01] 和 Biolocity 的资助。我们感谢 Maria Jennings 博士和 Andrea Fox 提供 HsADA1 和 HsKYNase 表达载体。
材料
| Name | Company | Catalog Number | Comments |
| Adenosine | Sigma Aldrich | A9251-25G | 25 g |
| BioTek Synergy HT Microplate Reader | |||
| Eppendorf LoBind Microcentrifuge Tubes: Protein | Fisher Scientific | 13-698-795 | 2 mL |
| Glycerol | Fisher Scientific | G33-4 | 4 L |
| HsKYNase66-W102H-T333N | In-house | ||
| Human Serum, Pooled | MP Biomedicals | 92931149 | 100 mL |
| Hydroxy-kynurenine | Cayman Chemicals | 27778 | |
| Inosine | TCI | I0037 | 25 g |
| PBS, 1x pH 7.4+/- 0.1 | Corning | 21-040-CM | |
| Pyridoxal 5-phosphate monohydrate, 99% | Thermo Scientifc | 228170010 | 1 g |
| UV-STAR MICROPLATE, 96 WELL, COC, F-BOTTOM | Greiner Bio | 655801 | |
| Wildtype Human Adenosine Deaminase 1 | In-house |
参考文献
- Valero, J., et al. A serum-stable RNA aptamer specific for SARS-COV-2 neutralizes viral entry. Proc Natl Acad Sci U S A. 118 (50), e2112942118 (2021).
- Iannuzo, N., et al. High-throughput screening identifies synthetic peptides with antibacterial activity against mycobacterium abscessus and serum stability. ACS Omega. 7 (27), 23967-23977 (2022).
- Ma, M. T., Jennings, M. R., Blazeck, J., Lieberman, R. L. Catalytically active holo homo sapiens adenosine deaminase i adopts a closed conformation. Acta Crystallograph Sect D. 78 (1), 91-103 (2022).
- Li, W., et al. Determination of 4 nucleosides via one reference compound in chinese cordyceps by hplc-uv at equal absorption wavelength. Natural Prod Comm. 18 (3), 1934578X231161410 (2023).
- Whitmore, K. V., Gaspar, H. B. Adenosine deaminase deficiency - more than just an immunodeficiency. Front Immunol. 7, 314 (2016).
- Jennings, M. R., et al. Optimized expression and purification of a human adenosine deaminase in E. coli and characterization of its asp8asn variant. Prot Express Purificat. 213, 106362 (2024).
- Blazeck, J., et al. Bypassing evolutionary dead ends and switching the rate-limiting step of a human immunotherapeutic enzyme. Nat Catalysis. 5 (10), 952-967 (2022).
- Lu, J., Grenache, D. G. Development of a rapid, microplate-based kinetic assay for measuring adenosine deaminase activity in body fluids. Clinica Chimica Acta. 413 (19), 1637-1640 (2012).
- Maciel, L. G., Dos Anjos, J. V., Soares, T. A. Fast and low-cost evaluation of hydroxykynurenine activity. MethodsX. 7, 100982 (2020).
- Bokman, A. H., Schweigert, B. S. 3-hydroxyanthranilic acid metabolism. Iv. Spectrophotometric evidence for the formation of an intermediate. Arch Biochem Biophys. 33 (2), 270-276 (1951).
- Tanford, C. . Advances in protein chemistry. 23, 121-282 (1968).
- Tritsch, G. L. Validity of the continuous spectrophotometric assay of kalckar for adenosine deaminase activity. Anal Biochem. 129 (1), 207-209 (1983).
- Gracia, E., et al. The catalytic site structural gate of adenosine deaminase allosterically modulates ligand binding to adenosine receptors. FASEB J. 27 (3), 1048-1061 (2013).
- Kalckar, H. M. Differential spectrophotometry of purine compounds by means of specific enzymes: Iii. Studies of the enzymes of purine metabolism. J Bio Chem. 167 (2), 461-475 (1947).
- Hartwick, R., Jeffries, A., Krstulovic, A., Brown, P. R. An optimized assay for adenosine deaminase using reverse phase high pressure liquid chromatography. J Chromatographic Sci. 16 (9), 427-435 (1978).
- Paul, M. K., Grover, V., Mukhopadhyay, A. K. Merits of hplc-based method over spectrophotometric method for assessing the kinetics and inhibition of mammalian adenosine deaminase. J Chromatography B. 822 (1), 146-153 (2005).
- Ubbink, J. B., Vermaak, W. J. H., Bissbort, S. H. High-performance liquid chromatographic assay of human lymphocyte kynureninase activity levels. J Chromatography B: Biomed Sci Appl. 566 (2), 369-375 (1991).
- Tsentalovich, Y. P., Snytnikova, O. A., Forbes, M. D. E., Chernyak, E. I., Morozov, S. V. Photochemical and thermal reactivity of kynurenine. Exp Eye Res. 83 (6), 1439-1445 (2006).
- Demain, A. L., Vaishnav, P. Production of recombinant proteins by microbes and higher organisms. Biotechnol Adv. 27 (3), 297-306 (2009).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Faber, M. S., Whitehead, T. A. Data-driven engineering of protein therapeutics. Curr Opin Biotechnol. 60, 104-110 (2019).
- Das, S., Zhao, L., Elofson, K., Finn, M. G. Enzyme stabilization by virus-like particles. Biochemistry. 59 (31), 2870-2881 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。