Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Adenozin Deaminaz 1 Enziminin Serum Stabilitesinin Belirlenmesi
Bu Makalede
Özet
Bu makalede, bir enzimin insan serumunda 37 °C'de inkübe edildiğinde işlevini sürdürme yeteneğini karakterize etmek için yöntemleri detaylandırıyoruz, bu da serum stabilitesi olarak adlandırılan farmakolojik bir özelliktir. Bu yetenek, bir enzimin farmakokinetik profilini ve terapötik kullanım için uygunluğunu tahmin etmede önemli bir faktör olabilir.
Özet
Enzim stabilitesi kavramı tipik olarak bir enzimin termostabilitesine atıfta bulunmak için kullanılır - sıcaklık arttıkça yapı ve aktiviteyi koruma yeteneği. Terapötik bir enzim için, diğer stabilite ölçümleri de, özellikle insan serumunda 37 ° C'de fonksiyonu koruma kabiliyeti de kritik olabilir, buna serum stabilitesi denir. Burada, absorbans bazlı bir mikroplaka prosedürü kullanarak vahşi tip Homo sapiens adenosin deaminaz I (HsADA1) enziminin serum stabilitesini değerlendirmek için bir in vitro testi tarif ediyoruz. Spesifik olarak, bu el yazması, tamponların ve reaktiflerin hazırlanmasını, HsADA1'in serumda çakıştırılmasını düzenleyen bir yöntemi, bir mikroplaka okuyucu kullanarak test numunelerini analiz etmek için bir yöntemi ve bir HsADA1 enziminin serumda zamanın bir fonksiyonu olarak tuttuğu aktivite fraksiyonunu belirlemek için eşlik eden bir analizi açıklar. Protokolün serum stabilitesinin önemli olduğu diğer enzimlere adaptasyonuna yardımcı olmak için bir Homo sapiens kinüreninaz enzimi örneği kullanarak bu protokolü diğer enzimlere uyarlamak için düşünceleri daha fazla tartışıyoruz.
Giriş
Aşağıdaki yöntem, bir kullanıcının, intravenöz enjeksiyondan sonra karşılaşacağı şeyi taklit eden koşullara maruz kaldığında bir enzimin aktivitesini koruma yeteneğini kantitatif olarak değerlendirmesine olanak tanır. İn vitro yöntem, bu tür in vivo koşulları taklit eder ve enzimin 37 ° C'de havuzlanmış insan serumunda inkübasyonundan ve enzim aktivitesinin tutulmasının zaman vadeli analizlerinden oluşur. Bir enzimin bu koşullarda aktiviteyi koruma kabiliyetine serum stabilitesi olarak atıfta bulunuruz ve enzim aktivitesi için analiz yöntemi, bir enzimin substratı ile elde edilen ürün arasındaki absorpsiyon farklılıklarından yararlanır. Serum stabilitesi kavramı sadece enzime özgü değildir ve diğer birçok tedavi yöntemine de uygulanmıştır. Örneğin, COVID spike proteinlerini hedef alan RNA aptamerlerinin serum stabilitesi, daha önce fetal baldır serumu1 ile inkübasyon sonrası bozulmalarının izlenmesiyle değerlendirilmiştir. Antibakteriyel peptitler, havuzlanmış insan serumu2 ile inkübasyon sonrası bakteri üremesini baskılama yetenekleri açısından da değerlendirilmiştir.
HsADA1, adenozin veya 2-deoksiadenosinin sırasıyla inosin veya 2-deoksiinosinedönüşümünü katalize eden bir enzimdir 3. Adenozin 260 nm'lik bir absorpsiyon zirvesine sahipken, inosin 250 nm'de en güçlü şekilde emer4. Absorpsiyon tepe noktalarındaki bu kayma, adenozine HsADA1 eklendiğinde 260 nm'de absorpsiyon yoğunluğunda bir azalma ile bir mikroplaka okuyucuda tespit edilebilir. HsADA1 enziminin insan vücudunda önemli etkileri vardır ve eksikliği ciddi bir kombine immün yetmezliğe (ADA-SCID) neden olur5. HsADA1'in sığır homologu olan BtADA1, ADA-SCID tedavisi için bir enzim replasman terapötiği olarak kullanılabilir ve daha önce vahşi tip HsADA1'in havuzlanmış insan serumu ile inkübe edildiğinde aktivitesini kaybettiğini ve potansiyel olarak terapötik olarak kullanımını engellediğini göstermiştik6. Bu nedenle, bir enzimin serum stabilitesini belirlemek için bir prosedür göstermek için vahşi tip HsADA1 enzimini seçtik. HsADA1 için ayrıntılı bir saflaştırma yöntemi daha öncetarif edilmiştir 6.
Aşağıdaki protokolde ( Şekil 1'de detaylandırıldığı gibi), vahşi tip HsADA1'in 37 ° C'de havuzlanmış insan serumunda nasıl birlikte inkübe edileceğini gösteriyoruz. Bu süre zarfında, test numuneleri tanımlanmış zaman noktalarında alınır ve gelecekteki analizler için flaş dondurulur. Tüm numuneler alındıktan sonra, her bir numunenin substrat ile birleştirildiği bir mikroplaka tahlili çalıştırılır ve sonuçta ortaya çıkan absorbans azalması, enzimin tutulan aktivitesi için bir korelasyon olur. HsADA1'in serum stabilitesini gösteren temsili sonuçlar gösterilmiştir ve bu metrik diğer enzimlerin potansiyel terapötik değerini belirlemekle ilgili olabileceğinden, bu protokolü tasarlanmış bir Homo sapiens kinüreninaz enzimine (HsKYNase) ve daha genel olarak herhangi bir enzime uyarlamak için hususları da tartışıyoruz. HsKYNase, triptofanın metabolizmasında yer alan bir enzimdir ve triptofan yan ürünleri kinürenin ve hidroksi-kinürenini (OH-Kyn) sırasıyla antranilik asit ve hidroksi-antranilik aside (OH-AA) indirgeyebilir. Triptofan metabolizmasının enzim aracılı modülasyonu terapötik öneme sahip olabilir7.
Protokol
1. Serum inkübasyonu
- 10 μM'lik bir nihai konsantrasyonda 1x PBS pH 7.4'te (1x PBS) 10x HsADA1 stoğu hazırlayın. 15 mL'lik bir havuzlanmış insan serumu alikotunu çözün ve 37 ° C'ye ısıtın. 50 mL'lik 1x PBS'lik bir alikotu 37 °C'ye önceden ısıtın.
- Enzim + serum karışımı olarak adlandırılan düşük bağlı bir mikrosantrifüj tüpünde 900 μL havuzlanmış insan serumuna 10 μL 10x HsADA1 stoğu ekleyerek enzim-serum inkübasyon karışımlarını hazırlayın. Ayrı bir düşük bağlı mikrosantrifüj tüpünde, enzim + 1x PBS karışımı olarak adlandırılan serum olmayan bir kontrolle karşılaştırmak için 10 μL 10x HsADA1 stokunu 900 μL 1x PBS'ye ekleyin. Her karışımdaki nihai HsADA1 konsantrasyonu 1 μM olacaktır.
- 900 μL havuzlanmış insan serumu ile karıştırılmış 100 μL 1x PBS'den oluşan düşük bağlı bir mikrosantrifüj tüpünde ek bir kontrol hazırlayın. Bu, enzim + serum karışımı için enzim olmayan kontrol görevi görecektir. Ek olarak, 1 mL 1x PBS'den oluşan bir kontrol yapın. Bu, enzim + 1x PBS karışımı için enzim olmayan kontrol görevi görecektir.
- Adım 1.2'den itibaren her karışımın 100 μL'sini ayrı düşük bağlı tüplere alın ve 1x PBS'de 100 μL% 30 (h / h) gliserol ile 1: 1 seyreltin. Sıvı nitrojen ile hızlı dondurun ve -80 °C'de saklayın. Bu numuneler Gün 0 zaman noktası olacak ve içlerindeki HsADA1 konsantrasyonu 500 nM olacaktır. 1.3'ten itibaren enzim olmayan kontrol karışımları için bu adımı tekrarlayın. Tüm enzimleri ve kontrol karışımlarını şeffaf film ile kapatın ve 37 °C'lik bir inkübatöre yerleştirin.
- 24 saat sonra, inkübe edilen her numuneden 100 μL'yi ayırın ve 1x PBS'de 100 μL% 30 (h / h) gliserol ile 1: 1 seyreltin. Sıvı nitrojen ile hızlı dondurun ve -80 °C'de saklayın. Bu örnekler 1. gün zaman noktası olacaktır. Tüm enzim ve kontrol karışımlarını 37 °C inkübatöre geri koyun. Bu adımı 72 saat ve 120 saatte tekrarlayın.
NOT: Aliquoted örneklerinin mutlaka flaşla dondurulması gerekmez. Alternatif olarak, kullanıcı her bir numuneyi aldıktan hemen sonra mikroplaka bazlı testi gerçekleştirebilir, ancak her numune test edildiğinde taze standart eğriler ve adenosin substrat stokları hazırlanmalıdır.
2. Mikroplaka bazlı test
- 260 dakika boyunca en kısa okuma aralığı ile 30 nm'de absorbansı ölçmek için bir kinetik okuma protokolü (Şekil 2) ayarlayarak mikroplaka okuyucuyu hazırlayın ve okuyucuyu 37 °C'lik bir ayar noktasına önceden ısıtın.
- Toplanan tüm örnekleri buz üzerinde çözdürün. Düşük bağlı mikrosantrifüj tüplerinde seyreltici olarak 37 ° C'ye önceden ısıtılmış 1x PBS kullanarak çözülen her numuneyi 1:10 oranında seyreltin. Bu numunelerdeki yeni HsADA1 konsantrasyonu 50 nm olacaktır.
- Enzim olmayan serum kontrol örneğinden de 1x PBS'ye 10x seyreltme yapın. Ek olarak, 50 mL 1x PBS'ye 66.8 mg adenosin ekleyerek 5 mM'lik bir adenosin stoğu hazırlayın. 7.600 μL 1x PBS'ye 400 μL adenosin stoğu ekleyerek 250 μM'lik bir adenozin seyreltmesi hazırlayın ve bir inkübatörde 37 °C'ye ısıtın.
- 96 oyuklu UV uyumlu bir mikroplakaya, toplam 200 μL'lik bir hacim için üç kopya halinde 160 μL 250 μM adenosin seyreltmesi ve her seyreltilmiş protein örneğinden 40 μL ekleyin. Bu, 200 μM'lik bir nihai adenozin konsantrasyonu ve 10 nM'lik bir nihai enzim konsantrasyonu verecektir.
- Üç kopya halinde 40 μL seyreltilmiş serum veya 1x PBS kontrolü ve 160 μL 250 μM adenosin seyreltmesi ekleyerek kontrol numuneleri için seyreltmeyi tekrarlayın. Bu aynı zamanda 200 μM'lik bir nihai adenozin konsantrasyonu verecektir, ancak enzim içermez.
NOT: Toplam yükleme süresini azaltmak için önce tüm seyreltilmiş enzim ve kontrol numunelerini mikroplakaya ayrı ayrı eklemek ve ardından adenozin substratını 12 kanallı bir mikropipet ile eklemek faydalı olabilir. Ek olarak, plakanın kendisinin ölçülen absorbans sinyalini karıştırmasını önlemek için bu adımda UV şeffaf plakalar kullanılmalıdır. - Her bir kuyucuğun absorpsiyonunu 260 nm'de 30 ° C'de 37 dakika boyunca ölçün. Tamamlandığında, daha fazla analiz için verileri bir elektronik tabloya aktarın.
3. Mikroplaka okuyucu verilerinin analizi
- Mikroplaka verilerinin ilk birkaç dakikası için zamanın bir fonksiyonu olarak absorbans verilerinin doğrusal bölgesinin eğimini belirleyin. Serumla seyreltilmiş numuneler için bu, ilk ~ 120 s'ye karşılık geldi. 1x PBS ile seyreltilmiş numuneler için bu, ilk ~ 270 s'ye karşılık geldi. Azalan soğurma değerlerinin bu eğimi, negatif bir sayısal değere sahip olacak ve saniyedeki soğurma birimlerinde (ΔA260/s) değişim birimlerine sahip olacaktır.
- Havuzlanmış insan serumundan oluşan negatif kontrolün eğimini enzim + serum verilerinin eğiminden çıkarın. Aynı işlemi 1x PBS kontrolünün eğimini çıkararak enzim + 1x PBS karışımları üzerinde de gerçekleştirin.
- Denklem 0'i kullanarak kalan aktivite fraksiyonunu elde etmek için ayarlanan tüm eğimleri t=1 h'deki orijinal eğime normalleştirin.
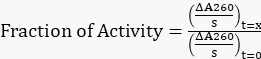 Denklem 1
Denklem 1 - Zamana karşı kalan etkinlik oranını çizin.
Sonuçlar
Şekiller, vahşi tip HsADA1 ile yapıldığında yapılan tahlil çalışmasının sonuçlarını göstermektedir. Şekil 3A,B, adenozin ilavesinden sonra vahşi tip HsADA1 için 1x PBS/serum-enzim karışımlarından kaynaklanan numunelerin 260 nm'deki absorbans düşüş eğrilerini göstermektedir. Zaman verilerinin bir fonksiyonu olarak bu azalan absorbans, kullanıcının mikroplaka bazlı testin başarılı bir şekilde tamamlanmasın...
Tartışmalar
Bu protokol, bir enzimin aktivitesini ölçmek için substrat ürüne dönüştürülürken absorbans değişimini kullanır. Bu nedenle, substrat ve ürün farklı spektral profillere sahip olmalıdır. Bu, her ikisi de farklı spektral profillere ve 260-265 nm 6,8,12,13 arasında sönme katsayılarına sahip adenozin ve inosin için geçerlidir. Bu tahlil, ö...
Açıklamalar
JB ve MRJ, adenozin deaminaz ve/veya kinüreninaz enzimleri ile ilgili patentler veya patent başvuruları konusunda mucitlerdir. Diğer tüm yazarların açıklanması gereken herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri [1DP2CA280622-01] tarafından desteklenmiş ve Biolocity'den fon sağlanmıştır. Dr. Maria Jennings ve Andrea Fox'a HsADA1 ve HsKYNase ekspresyon vektörlerini sağladıkları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adenosine | Sigma Aldrich | A9251-25G | 25 g |
| BioTek Synergy HT Microplate Reader | |||
| Eppendorf LoBind Microcentrifuge Tubes: Protein | Fisher Scientific | 13-698-795 | 2 mL |
| Glycerol | Fisher Scientific | G33-4 | 4 L |
| HsKYNase66-W102H-T333N | In-house | ||
| Human Serum, Pooled | MP Biomedicals | 92931149 | 100 mL |
| Hydroxy-kynurenine | Cayman Chemicals | 27778 | |
| Inosine | TCI | I0037 | 25 g |
| PBS, 1x pH 7.4+/- 0.1 | Corning | 21-040-CM | |
| Pyridoxal 5-phosphate monohydrate, 99% | Thermo Scientifc | 228170010 | 1 g |
| UV-STAR MICROPLATE, 96 WELL, COC, F-BOTTOM | Greiner Bio | 655801 | |
| Wildtype Human Adenosine Deaminase 1 | In-house |
Referanslar
- Valero, J., et al. A serum-stable RNA aptamer specific for SARS-COV-2 neutralizes viral entry. Proc Natl Acad Sci U S A. 118 (50), e2112942118 (2021).
- Iannuzo, N., et al. High-throughput screening identifies synthetic peptides with antibacterial activity against mycobacterium abscessus and serum stability. ACS Omega. 7 (27), 23967-23977 (2022).
- Ma, M. T., Jennings, M. R., Blazeck, J., Lieberman, R. L. Catalytically active holo homo sapiens adenosine deaminase i adopts a closed conformation. Acta Crystallograph Sect D. 78 (1), 91-103 (2022).
- Li, W., et al. Determination of 4 nucleosides via one reference compound in chinese cordyceps by hplc-uv at equal absorption wavelength. Natural Prod Comm. 18 (3), 1934578X231161410 (2023).
- Whitmore, K. V., Gaspar, H. B. Adenosine deaminase deficiency - more than just an immunodeficiency. Front Immunol. 7, 314 (2016).
- Jennings, M. R., et al. Optimized expression and purification of a human adenosine deaminase in E. coli and characterization of its asp8asn variant. Prot Express Purificat. 213, 106362 (2024).
- Blazeck, J., et al. Bypassing evolutionary dead ends and switching the rate-limiting step of a human immunotherapeutic enzyme. Nat Catalysis. 5 (10), 952-967 (2022).
- Lu, J., Grenache, D. G. Development of a rapid, microplate-based kinetic assay for measuring adenosine deaminase activity in body fluids. Clinica Chimica Acta. 413 (19), 1637-1640 (2012).
- Maciel, L. G., Dos Anjos, J. V., Soares, T. A. Fast and low-cost evaluation of hydroxykynurenine activity. MethodsX. 7, 100982 (2020).
- Bokman, A. H., Schweigert, B. S. 3-hydroxyanthranilic acid metabolism. Iv. Spectrophotometric evidence for the formation of an intermediate. Arch Biochem Biophys. 33 (2), 270-276 (1951).
- Tanford, C. . Advances in protein chemistry. 23, 121-282 (1968).
- Tritsch, G. L. Validity of the continuous spectrophotometric assay of kalckar for adenosine deaminase activity. Anal Biochem. 129 (1), 207-209 (1983).
- Gracia, E., et al. The catalytic site structural gate of adenosine deaminase allosterically modulates ligand binding to adenosine receptors. FASEB J. 27 (3), 1048-1061 (2013).
- Kalckar, H. M. Differential spectrophotometry of purine compounds by means of specific enzymes: Iii. Studies of the enzymes of purine metabolism. J Bio Chem. 167 (2), 461-475 (1947).
- Hartwick, R., Jeffries, A., Krstulovic, A., Brown, P. R. An optimized assay for adenosine deaminase using reverse phase high pressure liquid chromatography. J Chromatographic Sci. 16 (9), 427-435 (1978).
- Paul, M. K., Grover, V., Mukhopadhyay, A. K. Merits of hplc-based method over spectrophotometric method for assessing the kinetics and inhibition of mammalian adenosine deaminase. J Chromatography B. 822 (1), 146-153 (2005).
- Ubbink, J. B., Vermaak, W. J. H., Bissbort, S. H. High-performance liquid chromatographic assay of human lymphocyte kynureninase activity levels. J Chromatography B: Biomed Sci Appl. 566 (2), 369-375 (1991).
- Tsentalovich, Y. P., Snytnikova, O. A., Forbes, M. D. E., Chernyak, E. I., Morozov, S. V. Photochemical and thermal reactivity of kynurenine. Exp Eye Res. 83 (6), 1439-1445 (2006).
- Demain, A. L., Vaishnav, P. Production of recombinant proteins by microbes and higher organisms. Biotechnol Adv. 27 (3), 297-306 (2009).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Faber, M. S., Whitehead, T. A. Data-driven engineering of protein therapeutics. Curr Opin Biotechnol. 60, 104-110 (2019).
- Das, S., Zhao, L., Elofson, K., Finn, M. G. Enzyme stabilization by virus-like particles. Biochemistry. 59 (31), 2870-2881 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır