Method Article
القياس الكمي للجينومات الفيروسية المرتبطة بالغدينو في عينات النواقل المنقاة بواسطة تفاعل البلمرة المتسلسل للقطرات الرقمية
In This Article
Summary
يعد التحديد الكمي الدقيق لنسخ الجينوم الناقل للفيروس المرتبط بالغدي (AAV) أمرا بالغ الأهمية ، ولكن لم يتم بعد إنشاء بروتوكول موحد. يصف هذا البروتوكول طريقة تم التحقق من صحتها لإعداد عينات AAV المنقاة وإجراء تفاعل البوليميراز المتسلسل الرقمي (dd_PCR) لتحديد عيار الجينوم الفيروسي بشكل موثوق.
Abstract
الفيروس المرتبط بالغدي (AAV) هو فيروس غير ممرض يستخدم كوسيلة توصيل لنقل الجينات العلاجية إلى المرضى. يعد القياس الكمي الدقيق لرقم نسخة جينوم AAV في مستحضرات النواقل أمرا ضروريا لتحسين العملية الحيوية وحساب الجرعة في كل من الدراسات قبل السريرية والسريرية لمنتجات العلاج الجيني القائمة على AAV. حاليا ، لا يوجد بروتوكول إجماع لمعايرة الجينوم الفيروسي AAV. هنا ، نقدم بروتوكول PCR (dd_PCR) الرقمي للقطرات لتحديد كمية الجينومات الفيروسية في عينات النواقل المنقى. تتم معالجة العينات باستخدام DNase I للتخلص من الحمض النووي الملوث غير المعبأ. ثم يتم خلط العينات المعالجة ب DNase مع مجموعة مسبار أولية مناسبة (مصممة وفقا لجينوم AAV المستهدف) وكواشف تفاعل البوليميراز المتسلسل ، ثم يتم تحميلها في مولد القطيرات. يتم نقل القطرات المحضرة إلى لوحة PCR ، حيث يتم إجراء تضخيم PCR وتحليله. يتم حساب عيار الجينوم الفيروسي بناء على التركيز (نسخ / ميكرولتر) ، وهو ما يمثل تخفيفات العينة. يظهر القياس الناجح فصلا واضحا بين سحب القطيرات الموجبة والسالبة ، ويحتوي على 10000 قطرة مقبولة على الأقل ، ويظهر قيمة تتراوح بين 10 نسخ / ميكرولتر و 10000 نسخة / ميكرولتر ، وله معامل اختلاف (CV) بين التكرارات أقل من 20٪. ستساعد معايرة الجينوم الفيروسي الموثوقة في تطوير منتجات علاج جيني آمنة وفعالة قائمة على AAV.
Introduction
العلاج الجيني هو طريقة علاجية شائعة الاستخدام لعلاج الاضطرابات الوراثية. إن تصميم أي علاج جيني معين خاص بعلم الأمراض المرتبط بالمؤشر المستهدف ، ولكن جميع العلاجات الجينية تتضمن توصيل المواد الوراثية داخل الخلايا إلى الخلايا المستهدفة من أجل استنباط تأثير علاجي1. يمكن تصنيف العلاج الجيني إلى عدة فئات ، بما في ذلك استبدال الجينات لطفرات فقدان الوظيفة ، وإسكات الجينات لتشوهات اكتساب الوظيفة ، وتقنيات تحرير الجينات. بغض النظر عن الاستراتيجية المحددة المستخدمة ، يجب تعبئة مادة الحمض النووي العلاجية (المشار إليها باسم جين التحوير) داخل ناقل من أجل تحقيق التسليم المستهدف داخل الخلايا2.
على الرغم من توفر مجموعة متنوعة من أنظمة النواقل الفيروسية وغير الفيروسية لتطوير العلاج الجيني ، إلا أن الفيروسات المرتبطة بالغدي (AAVs) يتم اختيارها بشكل متكرر بسبب الانتحاء الفيروسي الواسع وانخفاض المناعة المرتبطة بهذه المجموعة من الفيروسات 1,2. حتى الآن، حصلت سبعة علاجات جينية تستخدم AAV لتوصيل الجينات العلاجية على موافقة إما من وكالة الأدوية الأوروبية (EMA) أو إدارة الغذاء والدواء (FDA) التي تستهدف أمراضا تتراوح من الهيموفيليا (على سبيل المثال، Roctavian) إلى ضمور العضلات الشوكي (على سبيل المثال، Zolgensma)3.
ينبع إنتاج العلاجات الجينية القائمة على AAV من فهم النوع البري AAV نفسه. AAV هو فيروس DNA صغير ضمن عائلة Parvoviridae التي تضم 13 نمطا مصليا رئيسيا (AAV1-13) 3. يتكون جينوم AAV من ~ 4.7 كيلو بايت ، جزيء DNA أحادي الشريط يحتوي على إطارين رئيسيين مفتوحين للقراءة (ORFs) يشفران الجينات الفيروسية الأساسية اللازمة لتكرار الجينوم ، وتجميع القفيصة ، والتعبئة (rep ، cap). يحيط بالجينوم الفيروسي في كل من النهايات 5 'و 3' تسلسلات النوكليوتيدات المتباينة ، والتي يشار إليها باسم التكرارات الطرفية المقلوبة (ITRs). وتشكل لوائح الاتصالات الدولية هذه هياكل تشبه دبوس الشعر تؤدي أدوارا حاسمة في تكرار الجينوم وتعبئة الجينومات الفيروسية الجديدة في قفيصات فيروسية مركبة حديثا. AAV هو فيروس يعتمد على المساعد ، وبالتالي ، يتطلب التعبير عن الجينات المساعدة من فيروسات أخرى ، مثل فيروس الهربس البسيط (HSV) أو الفيروس الغدي (AdV) من أجل أن يصبح مؤهلا للتكرار1.
من أجل إنتاج AAVs ، يتم استخدام نظام تعبير مناسب قائم على الخلايا لتسهيل التعبير عن بروتينات القفيصة الفيروسية والتجميع اللاحق في جزيئات فيروسية جديدة ، يليها تغليف جين تحوير مختار محاط ب ITR (يشار إليه أيضا باسم جينوم المتجه). تستخدم هذه العملية عادة نظام بلازميد ثلاثي ، يتألف من (1) جينات مساعدة تؤوي البلازميد مشتقة من فيروس مساعد ، (2) بلازميد يشفر العناصر الفيروسية الأساسية (rep / cap) ، و (3) بلازميد يحمل كاسيت التعبير العلاجي (يشار إليه عادة باسم بلازميد النقل) 4. يضمن الوجود الفريد لإشارات تغليف التكرار الطرفي المقلوب (ITR) التي تحيط بشريط التعبير العلاجي في بلازميد النقل تغليفا محددا لجين التحوير ، بينما يستبعد في الغالب الجينات الفيروسية الموجودة على البلازميدات الأخرى. يؤدي النقل المشترك لهذا النظام ثلاثي البلازميد إلى منصة تعبير قائمة على الخلايا (عادة HEK293T خلايا) إلى إنتاج جزيئات فيروسية ذات كفاءة في التحويل وتفتقر إلى النسخ المتماثل مناسبة للاستخدام في تطبيقات العلاج الجيني 3,4.
هناك عدد من سمات الجودة الحرجة (CQAs) المرتبطة بإنتاج العلاجات الجينية القائمة على AAV والتي يجب تقييمها من أجل ضمان فعالية ونقاء وسلامة المنتج الطبي المقصود4. تتضمن CQAs عيار الفيروس ومحتوى القفيصة والتجميع. عيار الفيروس نفسه هو مزيج من عدد الجسيمات الفيروسية (عيار القفيصة) وعدد جينومات النواقل (عيار الجينوم المتجه) الموجود في أي مستحضر معين. من الناحية المثالية ، يجب أن تكون النسبة بين هذين التترين 1: 1 لأن كل جسيم فيروسي يجب أن يحتوي على جينوم ناقل واحد ، لكن أوجه القصور في تعبئة جينوم الناقل أثناء التخليق الحيوي تؤدي إلى الإنتاج المشترك للقفيصات الفارغة أو المملوءة جزئيا (تلك التي تحتوي على تسلسلات جينوم متجه جزئي و / أو تسلسلات جينوم غير متجه)5. يمكن أن يؤدي وجود مثل هذه الشوائب إلى استجابات مناعية لا مبرر لها والتنافس على مواقع ربط النواقل ، مما يزيد من خطر السمية المناعية ويقلل من معدل نقل القفيصات الكاملة6. لذلك فإن القياس الكمي الدقيق لجينومات AAV ضروري لتحديد عيار الفيروس ومحتوى القفيصة. يؤثر هذا على كل من الأبحاث الأساسية وكذلك صناعة العلاج الجيني ، والتي تتطلب جرعة دقيقة من أجل الحفاظ على سلامة وفعالية المنتجات الطبية.
أصبح تفاعل البوليميراز المتسلسل الرقمي (dd_PCR) مرتبطا ارتباطا وثيقا بالقياس الكمي لعيار الفيروس حيث يمكن استخدامه لتحديد عدد جينومات النواقل الموجودة في أي مستحضرمعين 7. تم تقديم PCR الرقمي نفسه لأول مرة في تسعينيات القرن العشرين 8,9 و dd_PCR هو تعزيز لهذه التكنولوجيا التي تسمح بمعالجة العينات عالية الإنتاجية10,11. في dd_PCR ، يتم تقسيم تفاعل البوليميراز المتسلسل في الوقت الفعلي 20 ميكرولتر إلى ما يقرب من 20000 قطرة مغلفة بالزيت ، مما يعطي ما يصل إلى 96 تفاعلا من هذا القبيل عند استيعابه على لوحة قياسية من 96 بئرا. بالمقارنة مع تفاعل البوليميراز المتسلسل الكمي التقليدي (qPCR) ، يوفر dd_PCR العديد من المزايا ، بما في ذلك الحساسية المحسنة ، وزيادة الدقة ، والقياس الكمي المباشر والمطلق للتسلسلات المستهدفة دون الحاجة إلى منحنيات قياسية. علاوة على ذلك ، فإن المستوى العالي من التقسيم في dd_PCR يقلل من تأثير مثبطات تفاعل البوليميراز المتسلسل ويقلل من احتمالية التحيز من التضخيم التفضيلي لقوالب معينة ، مما يجعله خيارا جذابا للقياس التحليلي لمعايرة الجينوم المتجه.
Protocol
تم تصميم البروتوكول الموصوف هنا لتحديد عيار الجينوم الفيروسي لناقل AAV9 المنقى والمنتج داخليا مع بروتين الفلورسنت الأخضر (GFP) باعتباره جينالتحوير 12 بمستوى عال من الدقة (الجدول 1). ومع ذلك ، فإن هذا البروتوكول ينطبق على أي نمط مصلي AAV وأي تصميم جينوم ناقل ، بشرط أن تكون مجموعات التمهيدي / المسبار مصممة لاستهداف جينوم المتجه المحدد محل الاهتمام. يتم سرد تفاصيل الكواشف والبادئات والمجسات والمعدات المستخدمة في هذه الدراسة في جدول المواد.
1. إعداد حلول الأسهم
ملاحظة: قم بإعداد جميع حلول المخزون المطلوبة لتخفيف العينة في محطة عمل PCR لتجنب التلوث من الحمض النووي الأجنبي.
- قم بإعداد 10x PCR مقايسة المخزن المؤقت ، والذي يتكون من 500 mM من KCl ، و 100 mM من Tris-HCl ، و 15 mM من MgCl2 ، و 0.01٪ (w / v) BSA. قم بقياس الرقم الهيدروجيني للمحلول واضبطه على 8.3.
ملاحظة: يمكن الاحتفاظ بهذا الحل في درجة حرارة الغرفة لمدة تصل إلى 1 شهر. - قم بإعداد المخزن المؤقت لتخفيف AAV ، والذي يتكون من 1x PCR مقايسة العازلة ، 0.2 نانوغرام / ميكرولتر من الحمض النووي للحيوانات المنوية المنفصمة (SSS) ، و 0.1٪ pluronic F-68. اصنع هذا المحلول طازجا مع كل اختبار واحتفظ به عند 4 درجات مئوية.
ملاحظة: في حالة عدم توفر F-68 pluronic ، يمكن استخدام بديل مثل Poloxamer 188 السطحي غير الأيوني.
2. تحضير العينات - معالجة DNase I والتخفيف التسلسلي
ملاحظة: من أجل إزالة ملوثات الحمض النووي التي يمكن أن تقلل من دقة معايرة الجينوم الناقل ، يمكن إزالة الحمض النووي الحر الموجود داخل عينة AAV (بما في ذلك الحمض النووي البلازميدي المتبقي أو الجينومات الفيروسية غير المغلفة) قبل تضخيم تفاعل البوليميراز المتسلسل باستخدام DNase. هذا ممكن لأن جينومات النواقل مغلفة داخل قفيصات AAV وبالتالي لا يمكن الوصول إليها حتى خطوة تغيير طبيعة تفاعل تفاعل البوليميراز المتسلسل نفسه (انظر الخطوة 5). علاوة على ذلك ، نظرا لأن رقم الجينوم المتجه في أي عينة معينة غير معروف ، فمن الضروري إجراء تخفيف تسلسلي للعينات لضمان بقاء القياسات ضمن الحدود العليا والدنيا التي يمكن اكتشافها. قم بإجراء جميع عمليات معالجة العينات في محطة عمل PCR. احتفظ بجميع العينات على الثلج ما لم ينص على خلاف ذلك.
- امزج عينة AAV المختارة للتحليل عن طريق الدوامة لفترة وجيزة ثم الطرد المركزي لضمان بقاء كل السائل في قاع الأنبوب الذي يحتوي على العينة.
- لمعالجة DNase ، أضف 45 ميكرولتر من محلول يحتوي على 1x DNase I buffer ، و 0.1٪ pluronic F-68 ، و 0.04 U / μL DNase I في ماء خال من DNase في أنبوب شريط PCR 8 أنبوب 0.2 مل PCR.
- نقل 5 ميكرولتر من العينة إلى الأنبوب الذي يحتوي على محلول DNAse. دوامة العينات وأجهزة الطرد المركزي لفترة وجيزة لضمان بقاء جميع السوائل في القاع.
- في جهاز تدوير حراري ، احتضان العينات لمدة 1 ساعة عند 37 درجة مئوية ، ثم تبرد إلى 4 درجات مئوية. ضعه على الثلج في أسرع وقت ممكن بعد الوصول إلى 4 درجات مئوية.
- باستخدام شريط PCR جديد سعة 0.2 مل من 8 أنابيب ، قم بإجراء التخفيفات المناسبة للعينة المعالجة ب DNase في المخزن المؤقت لتخفيف AAV. تعتمد تخفيفات العينة الموصى بها على عيار vg المتوقع (الجدول 2) ، ولكنها تهدف إلى تخفيفين مختلفين على الأقل لكل عينة وتشغيل كل تخفيف في نسختين. تأكد من دقة (2000-3000 دورة في الدقيقة) دوامة العينات لمدة 5 ثوان قبل إخراج أي حجم.
- بعد التخفيف التسلسلي ، دوامة العينات وأجهزة الطرد المركزي لضمان بقاء كل السائل في قاع الأنابيب.
- قم بتضمين عنصر تحكم إيجابي يعرف به عيار vg ، وعنصر تحكم سلبي (مخزن مؤقت لتخفيف AAV فقط) والذي يسمى أيضا عنصر التحكم بدون قالب (NTC).
ملاحظة: يمكن أن يكون التحكم الإيجابي عبارة عن AAV منتج داخليا أو مادة مرجعية تجارية AAV ، والتي تتضمن التسلسل المستهدف للبادئات / المسبار.
3. إعداد مزيج رئيسي dd_PCR
ملاحظة: حدد تسلسلا مستهدفا مناسبا داخل جينوم المتجه وصمم مجسات أولية أمامية وأولية عكسية ومجسات تحلل مائي موسومة بفلوروفورات مراسل FAM أو HEX وفقا للإرشادات المنشورة13. وتفضل الأعداد الأولية التي تستهدف جين التحوير على البادئات التي تستهدف لوائح الاتصالات الدولية لأن جين التحوير خاص بتصميم جينوم المتجهات، ويمكن للبنية الثانوية المرتبطة بتكوين دبوس الشعر في لوائح الاتصالات الدولية أن تعيق الربط الفعال للبرايمر التمهيدي. وعلاوة على ذلك، قد تبالغ بادئات لوائح الاتصالات الدولية في تقدير عيار AAV إذا كانت القفيصات المملوءة جزئيا والتي تحتوي على شظايا جينوم متجه مقطوعة موجودة ولا تزال تضم أيا من تسلسلات لوائح الاتصالات الدولية14. قم بإعداد المزيج الرئيسي dd_PCR في محطة عمل مخصصة ومنفصلة (غرفة ما قبل PCR). يجب أن تكون هذه الغرفة منفصلة عن تلك التي يتم فيها تحضير العينات لتجنب التلوث المتبادل.
- اسمح للكواشف التمهيدية والمسبار dd_PCR الفائقة بالوصول إلى درجة حرارة الغرفة (20-25 درجة مئوية). بعد ذلك ، دوامة جميع الكواشف وأجهزة الطرد المركزي لفترة وجيزة الأنابيب لجمع كل السوائل في الجزء السفلي من الأنبوب.
- قم بإعداد حجم dd_PCR المزيج الرئيسي في أنبوب طرد مركزي دقيق منفصل وفقا للعدد المطلوب من التفاعلات من خلال الجمع بين البادئات الأمامية والخلفية ، والمسبار ، و dd_PCR supermix ، والماء الخالي من DNase وفقا للأحجام والتركيزات الموضحة في الجدول 3.
- دوامة المزيج الرئيسي ثم الطرد المركزي لفترة وجيزة الأنبوب لضمان بقاء كل السائل في قاع الأنبوب.
ملاحظة: قم دائما بإعداد حجم مزيج رئيسي إضافي dd_PCR أكثر من المطلوب (n + 1) من أجل حساب فقدان حجم الماصة.
- دوامة المزيج الرئيسي ثم الطرد المركزي لفترة وجيزة الأنبوب لضمان بقاء كل السائل في قاع الأنبوب.
- انقل 19.8 ميكرولتر من المزيج الرئيسي إلى كل أنبوب على شريط PCR جديد سعة 0.2 مل مكون من 8 أنابيب.
4. توليد القطيرات
ملاحظة: يتم خلط العينات والمزيج الرئيسي dd_PCR بشكل منفصل قبل التحميل في خرطوشة توليد القطرات. قم بإجراء جميع عمليات التلاعب في محطة عمل PCR ، ويفضل أن تكون مختلفة عن مكان تحضير العينات ، لتجنب تلوث الأمبليكون. بدلا من ذلك ، قم بتنظيف محطة عمل PCR جيدا بعد تحضير العينات.
- انقل 2.2 ميكرولتر من العينة المخففة إلى حجم 19.8 ميكرولتر من المزيج الرئيسي dd_PCR في كل أنبوب من شريط PCR المكون من 8 أنابيب واخلطه جيدا. دوامة وأجهزة طرد مركزي لفترة وجيزة لضمان بقاء جميع السوائل في القاع.
- انقل 20 ميكرولتر من هذا المحلول إلى الآبار الموجودة في صف "العينة" الأوسط لخرطوشة توليد القطيرات. تجنب الفقاعات في خرطوشة توليد القطرات ؛ يمكن أن يتسبب هذا في حدوث أخطاء في الأداة ، وسيفشل إنشاء القطرات.
ملاحظة: نظرا لأن الخراطيش بتنسيق 8 آبار ، وكذلك شرائط أنبوب PCR ، يوصى باستخدام ماصة ذات 8 قنوات. - انقل 60 ميكرولتر من زيت توليد القطيرات إلى الآبار الموجودة في صف "الزيت" السفلي من خرطوشة توليد القطيرات.
ملاحظة: لا تترك أبدا بئر خرطوشة توليد القطيرات فارغة ؛ املأ العينة الفارغة جيدا بالتحكم dd_PCR في المخزن المؤقت للمجسات (مع الحجم المقابل الموضح أعلاه). - ضع حشية مطاطية فوق خرطوشة توليد القطيرات وضعها في مولد القطيرات.
- بعد توليد القطرات ، استخدم ماصة ذات 8 قنوات لنقل محلول 42.5 ميكرولتر ببطء من شريحة dd_PCR إلى لوحة PCR متعددة الآبار.
ملاحظة: ماصة ببطء وبزاوية 45 درجة لتجنب قص القطيرات في السائل أثناء الماصة. افحص اللوحة بصريا بحيث تمتلئ جميع الآبار بنفس الكمية من السائل وتكون القطرات مرئية كطبقة معتمة في البئر. - أغلق اللوحة بغطاء من رقائق الألومنيوم في آلة مانعة للتسرب الحراري لمدة 5 ثوان عند 180 درجة مئوية.
ملاحظة: افحص بصريا أن جميع الآبار مغلقة. إذا لم يكن كذلك ، كرر 5 ثوان أخرى عند 180 درجة مئوية. يمكن الاحتفاظ باللوحة محكمة الغلق لمدة تصل إلى 4 ساعات عند 4 درجات مئوية قبل تضخيم dd_PCR في جهاز تدوير حراري.
5. تضخيم dd_PCR
ملاحظة: يجب وضع جهاز التدوير الحراري في غرفة منفصلة عن غرفة ما قبل تفاعل البوليميراز المتسلسل لفصل أنشطة ما قبل تفاعل البوليميراز المتسلسل مكانيا عن تضخيم تفاعل البوليميراز المتسلسل وتجنب النتائج الإيجابية الكاذبة بسبب تلوث الأمبليكون.
- ضع اللوحة في جهاز تدوير حراري (مع وحدة تفاعل بئر بعمق 96) لتضخيم تفاعل البوليميراز المتسلسل وأغلقها بإحكام.
- قم بتكوين جهاز التدوير الحراري ليعمل في الظروف الموضحة في الجدول 4 وبحجم تفاعل يبلغ 40 ميكرولتر. قم بتضمين خطوة التسخين المسبق في إعدادات البرنامج وتأكد من تسخين الغطاء إلى 99 درجة مئوية.
- عند انتهاء برنامج تفاعل البوليميراز المتسلسل ، احتفظ باللوحة عند 4 درجات مئوية لمدة 15 دقيقة على الأقل لضمان تبريد اللوحة بالكامل.
ملاحظة: يمكن الاحتفاظ باللوحة لمدة 48-72 ساعة عند 4 درجات مئوية قبل قراءة القطرات.
6. قراءة القطيرات
- قم بتحميل اللوحة في قارئ قطرات ، وأدخل المعلومات التالية في برنامج النظام ، وتابع القراءة.
ملاحظة: نوع التجربة = القياس الكمي المباشر. Supermix = dd_PCR supermix للتحقيقات (بدون dUTP) ؛ نوع الفحص = هدف واحد لكل قناة ؛ معلومات الهدف ، قناة الإشارة 1 = قناة FAM أو قناة HEX وفقا للمسبار المستخدم. - قم بالتعليق على العينات بحيث يمكن تحديد موضع كل عينة وتحديدها بشكل فعال من ملف البيانات.
7. تحليل البيانات
- قم بإجراء تحليل البيانات باستخدام البرنامج المتوافق الذي توفره الشركة المصنعة لقارئ القطرات.
- قم بإجراء اختبار ملاءمة النظام لتقييم الأداء العام (وبالتالي الموثوقية) للفحص.
- تحقق من عدد الأحداث (عدد القطرات) المقاسة لكل بئر على لوحة تفاعل البوليميراز المتسلسل. من الناحية المثالية ، يتراوح عدد الأحداث بين 15,000 و 20,000. إذا كان عدد الأحداث <10000 ، فيجب استبعاد هذه القيمة من التحليل.
- قم بتقييم مخطط السعة 1D أو 2D وتحقق من وجود مطر قطرات.
- انتقل إلى علامة تبويب جدول البيانات وقم بتصدير البيانات إلى ملف Excel.
- احسب عيار vg باتباع الخطوات التالية:
- نطاق عمل dd_PCR هو 10-10000 نسخة / ميكرولتر. استبعاد أي قيمة <10 نسخ / ميكرولتر من التحليل. النطاق الموصى به للمعدات dd_PCR المستخدمة هنا هو 25-5000 نسخة / ميكرولتر.
ملاحظة: سيوفر برنامج تحليل البيانات رقم جينوم متجه وفقا لحجم تفاعل تفاعل تفاعل البوليميراز المتسلسل (40 ميكرولتر) ، لكن هذا لا يأخذ في الاعتبار عوامل التخفيف المطبقة أثناء تحضير العينة. - احسب عيار vg للعينة لكل حجم (يتم التعبير عنه عادة ك vg / mL) عن طريق مراعاة عوامل التخفيف المختلفة خلال تحضير العينة باستخدام العلاقة التالية:
ملاحظة: التركيز (القيمة التي تم الحصول عليها من تحليل البيانات) × 10 (تخفيف DNase I قبل المعالجة) × 10 (تخفيف مزيج PCR الرئيسي) × 1000 (ميكرولتر إلى مل) تخفيف العينة المختارة (في المخزن المؤقت لتخفيف AAV - على سبيل المثال ، الجدول 2). - احسب معامل الاختلاف (٪ CV) بين النسخ المتماثلة وبين التخفيفات المختلفة لنفس العينة.
ملاحظة: يتم حساب النسبة المئوية للسيرة الذاتية بقسمة الانحراف المعياري على المتوسط. إذا كانت النسبة المئوية للسيرة الذاتية بين التخفيفات المختلفة هي >20٪ ، فلا ينبغي اعتبار القيمة دقيقة. - تحقق من قيم السيطرة السلبية والإيجابية. يجب أن يكون التحكم السلبي أقل من 5 نسخ / ميكرولتر.
- نطاق عمل dd_PCR هو 10-10000 نسخة / ميكرولتر. استبعاد أي قيمة <10 نسخ / ميكرولتر من التحليل. النطاق الموصى به للمعدات dd_PCR المستخدمة هنا هو 25-5000 نسخة / ميكرولتر.
النتائج
يمكن تصور النتائج باستخدام البرامج المناسبة. لكل بئر ، يعرض مخطط السعة 1D جميع القطرات بالنسبة إلى سعتها. من المتوقع وجود فصل واضح بين القطرات الإيجابية والسلبية. إذا تم العثور على أكثر من 10٪ من إجمالي القطرات بين سحب القطيرات الإيجابية والسلبية (وهي ظاهرة يشار إليها باسم مطر القطرات) ، فمن الضروري إعادة قياس العينة (انظر الشكل 1). تتوفر معلومات إضافية حول قطرات المطر في المناقشة.
يمكن إنشاء جدول بيانات لتلخيص جميع المعلومات المسجلة ، بما في ذلك اسم العينة وعدد القطرات المقبولة (عدد الأحداث) والتركيز (نسخ / ميكرولتر). من الناحية المثالية ، يجب أن يتراوح عدد الأحداث بين 15,000 و 20,000 قطرة مقبولة. إذا كان عدد الأحداث لبئر أقل من 10000 ، فيجب استبعاد نقطة البيانات من التحليل. ويرد مثال على بيانات الإخراج في الجدول 5.
يمكن حساب عيار vg بناء على التركيز (نسخ / ميكرولتر) ، مع مراعاة تخفيفات العينة. نطاق العمل dd_PCR هو 10-10000 نسخة / ميكرولتر. يجب استبعاد القيم التي تقل عن 10 نسخ / ميكرولتر من التحليل. يجب حساب عيار vg للعينات ، وكذلك الضوابط الإيجابية والسلبية. يجب أن يكون للقيمة المقاسة للتحكم الإيجابي معامل تباين (٪ CV) أقل من 20٪ بالنسبة للقيمة النظرية. يجب أن يكون التحكم السلبي أقل من 5 نسخ / ميكرولتر. بالإضافة إلى ذلك ، يجب حساب النسبة المئوية للسيرة الذاتية بين التكرارات والتخفيفات المختلفة لكل عينة. إذا تجاوزت النسبة المئوية للسيرة الذاتية بين التخفيفات المختلفة 20٪ ، فقد تعتبر القيمة غير دقيقة ، وقد تحتاج العينة إلى إعادة قياسها.
يتميز القياس الناجح بفصل واضح لسحب القطيرات الموجبة والسالبة ، وما لا يقل عن 10000 قطرة مقبولة ، وقيمة تتراوح بين 10 نسخ / ميكرولتر و 10000 نسخة / ميكرولتر ، و ٪ CV بين التكرارات أقل من 20٪.
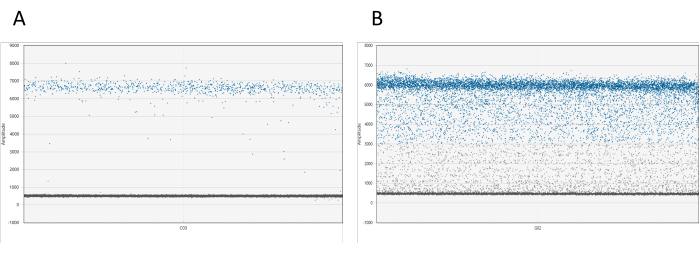
الشكل 1: تصور قطرات dd_PCR. (أ) يوضح مخطط السعة 1D فصلا واضحا بين القطرات الموجبة والسالبة ، مما يشير إلى تقسيم القطرات بنجاح. (ب) يوضح المخطط فصلا ضعيفا بين القطرات الموجبة والسالبة ، والمعروفة باسم المطر القطيرات ، مما يشير إلى تقسيم دون المستوى الأمثل أو مشاكل محتملة في الفحص. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
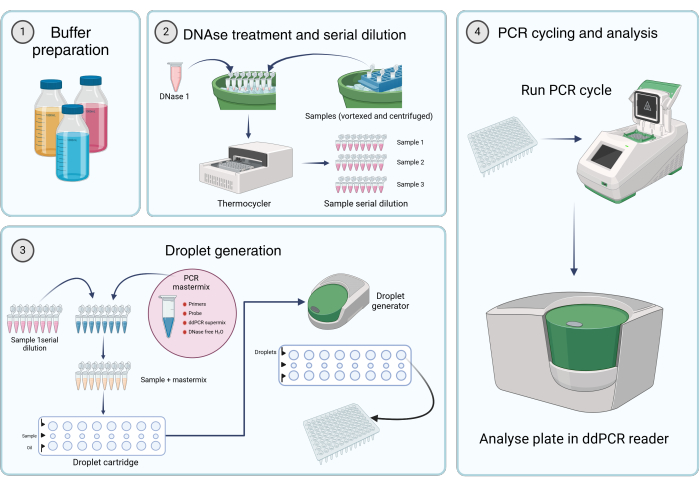
الشكل 2: سير العمل لقياس كمية الجينومات الفيروسية باستخدام PCR الرقمي للقطرات. (1) يتم تحضير المخازن المؤقتة والكواشف والمحاليل وفقا لتعليمات الشركة المصنعة أو الخطوة 1 من البروتوكول (إعداد حلول المخزون). (2) يتم نقل 45 ميكرولتر من محلول DNase I في كل أنبوب من شريط PCR مكون من 8 أنابيب. بعد الدوامة والطرد المركزي للعينات لفترة وجيزة ، تتم إضافة 5 ميكرولتر من العينة إلى أحد الأنابيب. يتم تحضين DNase I وشريط تفاعل البوليميراز المتسلسل المكون من ثمانية أنابيب المحتوي على عينة في دورة حرارية لمدة 1 ساعة عند 37 درجة مئوية ، تليها التخفيفات التسلسلية للعينات. (3) يتم تحضير مزيج PCR الرئيسي كما هو موصوف ، ويتم نقل 19.8 ميكرولتر في كل أنبوب من شريط PCR المكون من 8 أنابيب. تتم إضافة عينة التخفيفات التسلسلية من الخطوة 2 إلى mastermix. 20 ميكرولتر من ماستر ميكس بلس
يتم تحميل محلول العينة في الصف الأوسط من الخرطوشة ، ويتم نقل 60 ميكرولتر من زيت توليد القطيرات إلى الآبار السفلية لخرطوشة توليد القطيرات. ثم يتم وضع الخرطوشة في مولد القطيرات وتشغيلها وفقا للشروط المحددة. بعد توليد القطيرات ، يتم نقل 42.5 ميكرولتر من الصف العلوي للخرطوشة إلى لوحة PCR متعددة الآبار. (4) يتم تحميل لوحة PCR في دورة حرارية PCR وتشغيلها وفقا للشروط المقدمة. يتم تحليل اللوحة باستخدام قارئ dd_PCR. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: بيانات دقيقة. يعرض هذا الجدول بيانات دقيقة من أربع مجموعات من عينات مراقبة الجودة (QC) ، لكل منها خمسة تركيزات (QC1-QC5). تم قياس كل مراقبة الجودة خمس مرات. يظهر معامل الاختلاف (٪ CV) بين عمليات التشغيل المختلفة ، والتي تمثل قابلية التكرار (A) ، وبين مجموعات مختلفة من العينات ، والتي تمثل الدقة المتوسطة (B). الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: تخفيفات العينة. يوضح الجدول تخفيفات العينة الموصى بها بناء على عيار الجينوم الفيروسي المتوقع (vg / mL). يوصى بما مجموعه ثلاثة تخفيفات لضمان وقوع قيمتين على الأقل ضمن نطاق عمل الفحص. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 3: dd_PCR تكوين المزيج الرئيسي. يوضح هذا الجدول تكوين المزيج الرئيسي dd_PCR ، والذي يتضمن برايمر أمامي وخلفي (909 نانومتر) ، ومسبار (227 نانومتر) ، ومزيج فائق dd_PCR للتحقيقات (بدون dUTP ، 1x). الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 4: ظروف التدوير الحراري. يوضح الجدول بالتفصيل برنامج تفاعل البوليميراز المتسلسل الموصى به ، والذي يتضمن: (1) حضانة لمدة 10 دقائق عند 95 درجة مئوية لتعطيل القفيصة وتنشيط الإنزيم ، (2) 40 دورة من 30 ثانية عند 94 درجة مئوية لتمسخ الحمض النووي ، ودقيقة واحدة عند 60 درجة مئوية للتلدين والتمديد ، (3) حضانة لمدة 10 دقائق عند 98 درجة مئوية لتعطيل الإنزيم ، و (4) عقد عند 4 درجات مئوية. قد تتطلب درجة حرارة التلدين التحسين بناء على مجموعة التمهيدي / المسبار المستخدمة. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 5: مثال على بيانات الإخراج من تشغيل AAV فعلي. يقدم الجدول مثالا على بيانات الإخراج من تشغيل AAV الفعلي ، حيث تم قياس عينة واحدة في تخفيفين مختلفين ، كل منهما في نسختين. يتم حساب عيار الجينوم الفيروسي (vg) (في vg / mL) باستخدام الصيغة التالية: 10 (DNase I المعالجة المسبقة) × 10 (التخفيف في المزيج الرئيسي) × 1000 (ميكرولتر إلى مل) × التخفيف في المخزن المؤقت لتخفيف AAV. يمثل STDEV الانحراف المعياري ، وتشير السيرة الذاتية إلى معامل التباين. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
يعد القياس الكمي الدقيق لنسخ جينوم ناقل AAV في مستحضرات النواقل أمرا ضروريا لتطوير منتجات العلاج الجيني القائمة على AAV. توجد عدة طرق لتحديد عيار vg ، مع تفاعل البوليميراز المتسلسل الكمي (qPCR) و dd_PCR هما التقنيتان الأكثر استخداما وقبولا. غالبا ما يفضل dd_PCR على qPCR نظرا لاستقلاله عن كفاءة التضخيم والدقة العالية والمتانةالأكبر 15. تتوفر العديد من بروتوكولات معايرة الجينوم المتجه بواسطة dd_PCR في الأدبيات ، ولكل منها طرق تحضير العينات الخاصة بها15،16،17. ومع ذلك ، هناك نقص في بروتوكول توافق الآراء المؤهل. تقدم هذه المقالة بروتوكول dd_PCR ملائم للغرض تم التحقق من صحته للقياس الكمي لجينومات ناقلات AAV في عينات النواقل المنقاة (الشكل 2).
يعد الاهتمام الوثيق بمعالجة العينات أمرا بالغ الأهمية عند تنفيذ هذا البروتوكول. يمكن أن يشكل التلوث المتبادل تحديا كبيرا في التقييم الدقيق لعيار vg ؛ لذلك ، من الأفضل معالجة العينات تحت محطة عمل PCR لتجنب التلوث بالحمض النووي الأجنبي. بالإضافة إلى ذلك ، يعد التنفيذ السليم لحضانة DNase أمرا بالغ الأهمية للقضاء على الحمض النووي الملوث غير المعبأ دون تعطيل القفيصة وربما هضم جينوم الناقل المعبأ. تتضمن العديد من البروتوكولات تعطيل الحرارة وعلاج البروتيناز K16،17،18. ومع ذلك ، أثناء تطوير الطريقة الداخلية ، وجد أن التسخين المفرط كان ضارا بمعايرة vg ، وأن معالجة البروتيناز K غير ضرورية (البيانات غير معروضة).
نظرا لأن dd_PCR أصبحت شائعة بشكل متزايد لقياس كمية الجينومات الفيروسية ، فقد نشر المصنعون أدلة تطبيق مفصلة مع إرشادات حول تصميم وتحسين فحوصاتdd_PCR 19. تتوفر أيضا معلومات استكشاف الأخطاء وإصلاحها. في الممارسة العملية ، عندما يتم تصميم الفحص بشكل صحيح ، تشمل المشكلات الأكثر شيوعا مطر القطيرات وانخفاض عدد القطرات. غالبا ما يحدث المطر القطيرات بسبب ضعف إمكانية الوصول إلى التمهيدي / المجسات إلى amplicon ، ولكن يمكن للعديد من الاستراتيجيات معالجة هذه المشكلة. على سبيل المثال ، يمكن أن تساعد تجربة تدرج درجة الحرارة في تحديد درجة حرارة التلدين المثلى. بالإضافة إلى ذلك ، يمكن أن يؤدي تخفيف العينات لخفض كمية الحمض النووي (يوصى بأن تكون أقل من 66 نانوغرام) أو إجراء هضم تقييد باستخدام إنزيمات معينة تقطع خارج منطقة amplicon إلى تحسين إمكانية الوصول إلى القالب. عادة ما تكون التوصية ب 10 U من إنزيم التقييد لكل ميكروغرام من الحمض النووي فعالة. غالبا ما ترجع مشكلة انخفاض عدد القطرات (أقل من 10000) إلى ضعف سحب العينة والزيت في الخراطيش. يوصى بسحب بطيء مع نصائح مناسبة لتجنب قص القطرات. في حين أن الفحص dd_PCR قوي ، فإن أحد القيود هو الوقت الممتد للنتيجة. تستغرق العملية من معالجة العينة إلى قراءة القطيرات عدة ساعات ، مما قد يكون عيبا عند الحاجة إلى النتائج بسرعة.
يعد القياس الكمي الدقيق لنسخ جينوم AAV في مستحضرات النواقل ضروريا في جميع مراحل دورة حياة العلاج الجيني AAV. على وجه التحديد ، من المهم تحسين عمليات الإنتاج والتنقية ، وإجراء الدراسات قبل السريرية ، وتحديد الجرعات السريرية لمنتجات العلاج الجيني القائمة على AAV. بروتوكول dd_PCR المعروض هنا قابل للتطبيق على نطاق واسع ويمكن استخدامه على منتجات AAV المنقاة ذات الأنماط المصلية المختلفة وجينات التحوير.
Disclosures
IVH و BM و EH هم مؤسسون مشاركون لشركة Tavira Therapeutics. يعلن المؤلفون الآخرون عدم وجود تضارب في المصالح.
Acknowledgements
أصبح هذا البحث ممكنا بفضل دعم "مرونة فلاندرز" من الحكومة الفلمنكية ، الناشئة عن "مرفق التعافي والقدرة على الصمود الأوروبي" (RRF) (VV021/13). يتم إنشاء الشكل 2 باستخدام Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 8-channel pipette 10 µL | Eppendorf | 3,12,50,00,010 | |
| 8-channel pipette 200 µL | Eppendorf | 3,12,50,00,036 | |
| 8-channel pipette 300 µL | Eppendorf | 3,12,50,00,052 | |
| 8-well PCR strip | Sarstedt | 72.991.002 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9418 | |
| C1000 Touch Thermal Cycler with 96–Deep Well Reaction Module | Bio-Rad | 1851197 | |
| ddPCR Buffer Control for Probes 9 mL (2 x 4.5 mL) | Bio-Rad | 1863052 | |
| ddPCR Supermix for Probes (No dUTP) (2 x 1 mL) | Bio-Rad | 1863023 | |
| ddPCR 96-Well Plates (pkg of 25) | Bio-Rad | 12001925 | |
| ddPCR Droplet Reader Oil (2 x 1L) | Bio-Rad | 1863004 | |
| DG8 Cartridge Holder | Bio-Rad | 1863051 | |
| DG8 Cartridges for QX200/QX100 (pkg of 24) | Bio-Rad | 1864008 | |
| DG8 Gaskets for QX200/QX100 (pkg of 24) | Bio-Rad | 1863009 | |
| DNase I (10U/µL) + buffer | Roche | 4716728001 | |
| Droplet Generation Oil for Probes (10 x 7 mL) | Bio-Rad | 1863005 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 0.1-10 μL, 34 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078500 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 20-300 μL, 55 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078560 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 2-100 μL, 53 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078543 | |
| Forward lyophilized primers and respective master stocks at 100 mM | IDT | GFP as target sequence. Forward primer: 5'-GAACGGCATCAAGGTGAACT-3' | |
| Lyopohilized probe and master stock at 100 µM | IDT | GFP as target sequence. PrimeTime Eco Probe: /56-FAM/CAAGATCCG/ZEN/CCACAACATCGAGGA/3IABkFQ/ | |
| Magnesium Chloride (MgCl2) | Chemlab Analytical | CL00.1381 | |
| Nuclease free water | IDT | 11-04-02-01 | |
| PCR Plate Heat Seal, foil, pierceable (pkg of 100) | Bio-Rad | 1814040 | |
| Pluronic F-68 non-ionic surfactant (100x) | Thermo Fisher Scientific | 24040032 | |
| Potassium Chloride (KCl) | Honeywell research chemicals | 31248 | |
| QX manager software | Bio-Rad | Software to analyse ddPCR data | |
| QX200 Droplet Generator | Bio-Rad | 1864002 | |
| QX200 Droplet Reader | Bio-Rad | 1864003 | |
| Reagent reservoir | VWR | 613-1181 | |
| Reverse lyophilized primers and respective master stocks at 100 mM | IDT | GFP as target sequence. Reverse primer: 5'-TGCTCAGGTAGTGGTTGTCG-3' | |
| SafeSeal reaction tube, 1.5 mL | Sarstedt | 72.706.200 | |
| Salmon Sperm DNA, sheared (10 mg/mL) | Thermo Fisher Scientific | AM9680 | |
| TE buffer | IDT | Accompanied by primers when ordering | |
| Tris hydrochloride (Tris-HCl) | Roche | 10812846001 |
References
- Balakrishnan, B., Jayandharan, G. R. Basic biology of adeno-associated virus (AAV) vectors used in gene therapy. Curr Gene Ther. 14 (2), 86-100 (2014).
- Srivastava, A. In vivo tissue-tropism of adeno-associated viral vectors. Curr Opin Virol. 21, 75-80 (2016).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Gimpel, A. L., et al. Analytical methods for process and product characterization of recombinant adeno-associated virus-based gene therapies. Mol Ther Methods Clin Dev. 20, 740-754 (2021).
- Brimble, M. A., et al. Preventing packaging of translatable P5-associated DNA contaminants in recombinant AAV vector preps. Mol Ther Methods Clin Dev. 24, 280-291 (2022).
- Wright, J. F. Product-related impurities in clinical-grade recombinant AAV vectors: Characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, (2019).
- Sidransky, D., et al. Identification of ras oncogene mutations in the stool of patients with curable colorectal tumors. Science. 256 (5053), 102-105 (1992).
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proc Natl Acad Sci USA. 96 (16), 9236-9241 (1999).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Anal Chem. 83 (22), 8604-8610 (2011).
- Pinheiro, L. B., et al. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification. Anal Chem. 84 (2), 1003-1011 (2012).
- Sanmiguel, J., Gao, G., Vandenberghe, L. H. Quantitative and digital droplet-based AAV genome titration. Methods Mol Biol. 1950, 51-83 (2019).
- Bio-Rad Laboratories Inc. Planning droplet digital PCR experiments. , https://www.bio-rad.com/en-in/life-science/learning-center/introduction-to-digital-pcr/planning-ddpcr-experiments (2024).
- Dorange, F., Le Bec, C. Analytical approaches to characterize AAV vector production & purification: Advances and challenges. Cell Gene Ther Insights. 4 (2), 119-129 (2018).
- Lock, M., et al. Absolute determination of single-stranded and self-complementary adeno-associated viral vector genome titers by droplet digital PCR. Hum Gene Ther Methods. 25 (2), 115-125 (2014).
- Prantner, A., Maar, D. Genome concentration, characterization, and integrity analysis of recombinant adeno-associated viral vectors using droplet digital PCR. PLoS One. 18 (1), e0280242(2023).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570(2019).
- Suoranta, T., Laham-Karam, N., Yla-Herttuala, S. Optimized protocol for accurate titration of adeno-associated virus vectors. Hum Gene Ther. 32 (19-20), 1270-1279 (2021).
- Bio-Rad. Droplet digital PCR applications guide. Bulletin 6407. , https://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_6407.pdf (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved