Method Article
Dijital Damlacık Polimeraz Zincir Reaksiyonu ile Saflaştırılmış Vektör Örneklerinde Adeno İlişkili Viral Genomların Miktar Tayini
Bu Makalede
Özet
Adeno-ilişkili virüs (AAV) vektör genom kopyalarının kesin miktar tayini kritiktir, ancak standart bir protokol henüz oluşturulmamıştır. Bu protokol, saflaştırılmış AAV numunelerinin hazırlanması ve viral genom titresinin güvenilir bir şekilde ölçülmesi için dijital damlacık polimeraz zincir reaksiyonunun (dd_PCR) yürütülmesi için doğrulanmış bir yöntemi tanımlar.
Özet
Adeno-ilişkili virüs (AAV), terapötik genleri hastalara aktarmak için bir dağıtım aracı olarak kullanılan patojenik olmayan bir virüstür. Vektör preparatlarında AAV genom kopya sayısının doğru bir şekilde ölçülmesi, AAV bazlı gen terapisi ürünlerinin hem klinik öncesi hem de klinik çalışmalarında biyoproses optimizasyonu ve dozaj hesaplaması için gereklidir. Şu anda, AAV viral genom titrasyonu için bir konsensüs protokolü eksiktir. Burada, saflaştırılmış vektör örneklerinde viral genomların miktar tayini için bir dijital damlacık PCR (dd_PCR) protokolü sunuyoruz. Numuneler, paketlenmemiş kirletici DNA'yı ortadan kaldırmak için DNaz I ile muamele edilir. DNaz ile muamele edilen numuneler daha sonra uygun bir primer-prob seti (hedef AAV genomuna göre tasarlanmış) ve PCR reaktifleri ile karıştırılır ve daha sonra bir damlacık jeneratörüne yüklenir. Hazırlanan damlacıklar, PCR amplifikasyonunun gerçekleştirildiği ve analiz edildiği bir PCR plakasına aktarılır. Viral genom titresi, numune seyreltmelerini hesaba katan konsantrasyona (kopyalar/μL) göre hesaplanır. Başarılı bir ölçüm, pozitif ve negatif damlacık bulutlarının net bir şekilde ayrıldığını gösterir, en az 10.000 kabul edilmiş damlacığa sahiptir, 10 kopya/μL ile 10.000 kopya/μL arasında bir değer gösterir ve %20'den düşük tekrarlar arasında bir varyasyon katsayısına (CV) sahiptir. Güvenilir viral genom titrasyonu, güvenli ve etkili AAV bazlı gen tedavisi ürünlerinin geliştirilmesine yardımcı olacaktır.
Giriş
Gen terapisi, genetik bozuklukları tedavi etmek için yaygın olarak kullanılan terapötik bir yöntemdir. Herhangi bir gen terapisinin tasarımı, hedef endikasyonun ilişkili patolojisine özgüdür, ancak tüm gen terapileri, terapötik bir etki ortaya çıkarmak için genetik materyalin hedef hücrelere hücre içi verilmesini içerir1. Gen terapisi, fonksiyon kaybı mutasyonları için gen replasmanı, fonksiyon kazancı anormallikleri için gen susturma ve gen düzenleme teknikleri dahil olmak üzere çeşitli kategorilere ayrılabilir. Kullanılan spesifik stratejiden bağımsız olarak, terapötik nükleik asit materyali (transgen olarak adlandırılır), hedeflenen hücre içi iletimi elde etmek için bir vektör içinde paketlenmelidir2.
Gen terapisi gelişimi için çeşitli viral ve viral olmayan vektör sistemleri mevcut olmasına rağmen, adeno-ilişkili virüsler (AAV'ler), bu virüs grubuyla ilişkili geniş viral tropizm ve düşük immünojenisite nedeniyle sıklıkla seçilmektedir 1,2. Bugüne kadar, terapötik gen iletimi için AAV'yi kullanan yedi gen terapisi, Avrupa İlaç Ajansı (EMA) veya Gıda ve İlaç İdaresi'nden (FDA) hemofiliden (örneğin Roctavian) spinal müsküler atrofiye (örneğin, Zolgensma) kadar değişen hastalıkları hedef alan onay almıştır3.
AAV bazlı gen terapilerinin üretimi, vahşi tip AAV'nin kendisinin anlaşılmasından kaynaklanmaktadır. AAV, Parvoviridae ailesi içinde 13 ana serotip (AAV1-13) içeren küçük bir DNA virüsüdür3. AAV genomu, genom replikasyonu, kapsid montajı ve paketleme (rep, cap) için gerekli olan temel viral genleri kodlayan iki ana açık okuma çerçevesi (ORF) içeren ~4.7 kb, tek sarmallı bir DNA molekülü içerir. Viral genom, hem 5' hem de 3' uçlarda, ters terminal tekrarlar (ITR'ler) olarak adlandırılan palindromik nükleotid dizileri ile çevrilidir. Bu ITR'ler, genom replikasyonunda ve de novo viral genomların yeni sentezlenmiş viral kapsidlere paketlenmesinde çok önemli roller oynayan firkete benzeri yapılar oluşturur. AAV, yardımcıya bağımlı bir virüstür ve bu nedenle, replikasyon yeteneğine sahip olmak için herpes simpleks virüsü (HSV) veya adenovirüs (AdV) gibi diğer virüslerden yardımcı genlerin ekspresyonunu gerektirir1.
AAV'leri üretmek için, viral kapsid proteinlerinin ekspresyonunu ve ardından de novo viral partiküllere montajını kolaylaştırmak için uygun bir hücre bazlı ekspresyon sistemi kullanılır, ardından ITR ile çevrili seçilmiş bir transgenin (vektör genomu olarak da adlandırılır) kapsüllenmesi takip edilir. Bu işlem yaygın olarak (1) bir yardımcı virüsten türetilen yardımcı genleri barındıran bir plazmit, (2) temel viral elementleri kodlayan bir plazmit (rep/cap) ve (3) terapötik ekspresyon kasetini taşıyan bir plazmid (genellikle bir transfer plazmidi olarak adlandırılır) içeren üçlü bir plazmit sistemi kullanır4. Transfer plazmidindeki terapötik ekspresyon kasetini çevreleyen ters terminal tekrar (ITR) paketleme sinyallerinin benzersiz varlığı, çoğunlukla diğer plazmitlerde bulunan viral genleri dışlarken, transgenin spesifik olarak paketlenmesini sağlar. Bu üç plazmit sisteminin hücre bazlı bir ekspresyon platformuna (tipik olarak HEK293T hücreler) birlikte transfeksiyonu, gen terapisi uygulamalarında kullanıma uygun, transdüksiyon yetkin, replikasyon eksikliği olan viral partiküllerin üretilmesiyle sonuçlanır 3,4.
Amaçlanan tıbbi ürünün gücünü, saflığını ve güvenliğini sağlamak için değerlendirilmesi gereken AAV bazlı gen terapilerinin üretimi ile ilişkili bir dizi kritik kalite özelliği (CQA) vardır4. Bu CQA'lar virüs titresi, kapsid içeriği ve toplamayı içerir. Virüs titresinin kendisi, herhangi bir preparatta bulunan viral partiküllerin (kapsid titresi) ve vektör genomlarının sayısının (vektör genom titresi) bir kombinasyonudur. İdeal olarak, bu iki titre arasındaki oran 1:1 olmalıdır, çünkü her viral parçacık bir vektör genomu içermelidir, ancak biyosentez sırasında vektör genom paketlemesindeki verimsizlikler, boş veya kısmen doldurulmuş kapsidlerin (kısmi vektör genom dizileri ve/veya vektör olmayan genom dizileri içerenler) birlikte üretilmesine neden olur5. Bu tür safsızlıkların varlığı potansiyel olarak istenmeyen bağışıklık tepkilerini uyandırabilir ve vektör bağlama bölgeleri için rekabet edebilir, böylece immünotoksisite riskini artırabilir ve tam kapsidlerin transdüksiyon oranını azaltabilir6. Bu nedenle, AAV genomlarının doğru bir şekilde ölçülmesi, virüs titresi ve kapsid içeriğinin belirlenmesi için gereklidir. Bu, hem temel araştırmaları hem de tıbbi ürünlerin hem güvenliğini hem de etkinliğini korumak için doğru dozaj gerektiren gen terapisi endüstrisini etkiler.
Dijital Damlacık polimeraz zincir reaksiyonu (dd_PCR), herhangi bir preparatta bulunan vektör genomlarının sayısını belirlemek için kullanılabildiğinden, virüs titresinin miktar tayini ile yakından ilişkili hale gelmiştir7. Dijital PCR'nin kendisi ilk olarak 1990'lardatanıtıldı 8,9 ve dd_PCR, yüksek verimli numune işlemeye izin veren bu teknolojide bir geliştirmedir10,11. dd_PCR'de, 20 μL'lik bir gerçek zamanlı PCR reaksiyonu, yaklaşık 20.000 yağ kaplı damlacığa bölünür ve standart 96 oyuklu bir plakaya yerleştirildiğinde bu tür 96'ya kadar reaksiyon verir. Konvansiyonel kantitatif PCR (qPCR) ile karşılaştırıldığında, dd_PCR, gelişmiş hassasiyet, artırılmış hassasiyet ve standart eğrilere ihtiyaç duymadan hedef dizilerin daha doğrudan ve mutlak miktar tayini dahil olmak üzere çeşitli avantajlar sunar. Ayrıca, dd_PCR'daki yüksek bölümleme seviyesi, PCR inhibitörlerinin etkisini azaltır ve belirli şablonların tercihli amplifikasyonundan kaynaklanan sapma potansiyelini en aza indirir, bu da onu vektör genom titrasyonunun analitik ölçümü için çekici bir seçenek haline getirir.
Protokol
Burada açıklanan protokol, transgen 12 olarak transgen12 olarak saflaştırılmış, kurum içi üretilen bir AAV9 vektörünün viral genom titresini yüksek düzeyde hassasiyetle ölçmek için tasarlanmıştır (Tablo 1). Bununla birlikte, bu protokol, primer/prob setlerinin ilgilenilen spesifik vektör genomunu hedeflemek üzere tasarlanmış olması koşuluyla, herhangi bir AAV serotipine ve herhangi bir vektör genom tasarımına uygulanabilir. Bu çalışmada kullanılan reaktiflerin, primerlerin, probların ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Stok çözeltilerinin hazırlanması
NOT: Yabancı DNA'dan kontaminasyonu önlemek için numune seyreltmesi için gerekli tüm stok solüsyonlarını bir PCR iş istasyonunda hazırlayın.
- 500 mM KCl, 100 mM Tris-HCl, 15 mMMgCl2 ve% 0.01 (a/h) BSA'dan oluşan 10x PCR test tamponu hazırlayın. Çözeltinin pH'ını ölçün ve 8.3'e ayarlayın.
NOT: Bu çözelti oda sıcaklığında 1 aya kadar saklanabilir. - 1x PCR test tamponu, 0.2 ng/μL somon spermi kesilmiş (sss) DNA ve %0.1 pluronik F-68'den oluşan AAV seyreltme tamponunu hazırlayın. Bu çözeltiyi her tahlilde taze olarak hazırlayın ve 4 ° C'de tutun.
NOT: Çoğul F-68 mevcut değilse, Poloxamer 188 iyonik olmayan yüzey aktif madde gibi bir alternatif kullanılabilir.
2. Numunelerin hazırlanması - DNaz I işlemi ve seri seyreltme
NOT: Vektör genom titrasyonunun doğruluğunu azaltabilecek DNA kontaminantlarını uzaklaştırmak için, AAV numunesi içinde bulunan serbest DNA (kalan plazmid DNA veya kapsüllenmemiş viral genomlar dahil) DNaz kullanılarak PCR amplifikasyonundan önce çıkarılabilir. Bu mümkündür, çünkü vektör genomları AAV kapsidleri içinde kapsüllenir ve bu nedenle PCR reaksiyonunun kendisinin denatüre etme aşamasına kadar erişilebilir değildir (bkz. adım 5). Ayrıca, herhangi bir numunedeki vektör genom sayısı bilinmediğinden, ölçümlerin üst ve alt tespit edilebilir sınırlar içinde kalmasını sağlamak için numunelerin seri seyreltilmesi gereklidir. Tüm numune manipülasyonlarını bir PCR iş istasyonunda gerçekleştirin. Aksi belirtilmedikçe tüm numuneleri buz üzerinde tutun.
- Analiz için seçilen AAV numunesini, numuneyi içeren tüpün dibinde tüm sıvının kaldığından emin olmak için kısa bir süre girdaplama ve ardından santrifüjleme ile karıştırın.
- DNaz tedavisi için, DNaz içermeyen suda 1x DNaz I tamponu, %0.1 pluronik F-68 ve 0.04 U/μL DNaz I içeren 45 μL'lik bir çözeltiyi 0.2 mL PCR 8 tüplü bir şerit tüpüne ekleyin.
- 5 μL numuneyi DNAse solüsyonunu içeren tüpe aktarın. Numuneleri vorteksleyin ve tüm sıvının altta kalmasını sağlamak için kısa bir süre santrifüjleyin.
- Bir termocycler'da, numuneleri 37 °C'de 1 saat inkübe edin, ardından 4 °C'ye soğutun. 4 °C'ye ulaştıktan sonra mümkün olan en kısa sürede buzun üzerine yerleştirin.
- Taze bir 0.2 mL PCR 8 tüp şeridi kullanarak, DNaz ile muamele edilmiş numunenin AAV seyreltme tamponunda uygun seyreltmelerini yapın. Önerilen numune seyreltmeleri, beklenen vg titresine bağlıdır (Tablo 2), ancak numune başına en az 2 farklı seyreltme hedefleyin ve her seyreltmeyi iki kez çalıştırın. Herhangi bir hacim çıkarmadan önce numuneleri 2,000 saniye boyunca titizlikle (3,000-5 rpm) vortekslediğinizden emin olun.
- Seri seyreltmeden sonra, tüm sıvının tüplerin dibinde kalmasını sağlamak için numuneleri vorteksleyin ve santrifüjleyin.
- Vg titresinin bilindiği pozitif bir kontrol ve şablon yok kontrolü (NTC) olarak da adlandırılan negatif bir kontrol (yalnızca AAV seyreltme tamponu) ekleyin.
NOT: Pozitif kontrol, şirket içinde üretilen bir AAV veya primerlerin/probun hedef sırasını içeren ticari bir AAV referans malzemesi olabilir.
3. dd_PCR ana karışımının hazırlanması
NOT: Vektör genomu içinde uygun bir hedef dizi seçin ve yayınlanmış yönergeleri13 izleyerek FAM veya HEX raportör floroforları ile etiketlenmiş bir ileri primer, ters primer ve hidroliz probları tasarlayın. Transgeni hedefleyen primerler, ITR'leri hedefleyen primerlere göre tercih edilir, çünkü transgen vektör genom tasarımına özgüdür ve ITR'lerin firkete oluşumu ile ilişkili ikincil yapı, verimli primer bağlanmasını engelleyebilir. Ayrıca, ITR primerleri, kesilmiş vektör genom fragmanları içeren kısmen doldurulmuş kapsidler mevcutsa ve hala ITR dizilerinden herhangi birini barındırıyorsa AAV titrelerini fazla tahmin edebilir14. dd_PCR ana karışımını özel, ayrı bir iş istasyonunda (PCR öncesi oda) hazırlayın. Bu oda, çapraz kontaminasyonu önlemek için numunelerin hazırlandığı odadan ayrı olmalıdır.
- Astar, prob ve dd_PCR süper karışım reaktiflerinin oda sıcaklığına (20-25 °C) ulaşmasına izin verin. Daha sonra, tüm reaktifleri vorteksleyin ve tüpün altındaki tüm sıvıyı toplamak için tüpleri kısaca santrifüjleyin.
- Tablo 3'te açıklanan hacim ve konsantrasyonlara göre ileri ve geri primerleri, probu, dd_PCR süper karışımını ve DNaz içermeyen suyu birleştirerek gerekli reaksiyon sayısına göre ayrı bir mikrosantrifüj tüpünde bir hacim dd_PCR ana karışımı hazırlayın.
- Ana karışımı girdaplayın ve ardından tüm sıvının tüpün dibinde kalmasını sağlamak için tüpü kısaca santrifüjleyin.
NOT: Pipetleme hacmi kaybını hesaba katmak için her zaman gerekenden (n + 1) daha fazla dd_PCR ana karışım hacmi hazırlayın.
- Ana karışımı girdaplayın ve ardından tüm sıvının tüpün dibinde kalmasını sağlamak için tüpü kısaca santrifüjleyin.
- 19.8 μL ana karışımı taze bir 0.2 mL PCR 8 tüplü şerit üzerinde her bir tüpe aktarın.
4. Damlacık oluşumu
NOT: Numuneler ve dd_PCR ana karışımı, damlacık oluşturan bir kartuşa yüklenmeden önce ayrı ayrı karıştırılır. Amplikon kontaminasyonunu önlemek için tüm manipülasyonları bir PCR iş istasyonunda, tercihen numunelerin hazırlandığı yerden farklı bir iş istasyonunda gerçekleştirin. Alternatif olarak, numuneleri hazırladıktan sonra PCR iş istasyonunu iyice temizleyin.
- Seyreltilmiş numunenin 2,2 μL'sini PCR 8 tüplü şeridin her bir tüpündeki 19,8 μL hacimli dd_PCR ana karışıma aktarın ve iyice karıştırın. Tüm sıvının altta kalmasını sağlamak için girdap yapın ve kısaca santrifüjleyin.
- Bu çözeltinin 20 μL'sini damlacık üreten bir kartuşun orta "numune" satırında bulunan kuyucuklara aktarın. Damlacık oluşturan kartuşta kabarcık oluşmasını önleyin; Bu, cihazın hata vermesine neden olabilir ve damlacıklar oluşturulamaz.
NOT: Kartuşlar, PCR tüp şeritleri gibi 8 oyuklu formatta olduğundan, 8 kanallı bir pipet kullanılması önerilir. - Damlacık üreten kartuşun alt "yağ" sırasında bulunan kuyucuklara 60 μL damlacık üretim yağı aktarın.
NOT: Damlacık oluşturan kartuşun bir kuyusunu asla boş bırakmayın; Boş numune kuyusunu problar için dd_PCR tampon kontrolü ile doldurun (yukarıda açıklanan ilgili hacim ile). - Damlacık üreten kartuşun üzerine lastik bir conta yerleştirin ve damlacık üretecine yerleştirin.
- Damlacıklar oluşturulduktan sonra, 42,5 μL'lik çözeltiyi dd_PCR çipinden çok kuyulu bir PCR plakasına yavaşça aktarmak için 8 kanallı bir pipet kullanın.
NOT: Pipetleme sırasında sıvıda damlacık kesilmesini önlemek için yavaşça ve 45 derecelik bir açıyla pipetleyin. Plakayı, tüm kuyucukların aynı miktarda sıvı ile doldurulması ve damlacıkların kuyuda opak bir tabaka olarak görünmesi için görsel olarak inceleyin. - Plakayı, 180 °C'de 5 saniye boyunca ısıyla yapıştırma makinesinde bir alüminyum folyo kapakla kapatın.
NOT: Tüm kuyuların sızdırmaz olduğunu görsel olarak inceleyin. Değilse, 180 °C'de 5 saniye daha tekrarlayın. Sızdırmaz plaka, bir termal döngüleyicide dd_PCR amplifikasyondan önce 4 °C'de 4 saate kadar tutulabilir.
5. dd_PCR amplifikasyonu
NOT: Termal döngüleyici, PCR öncesi aktiviteleri PCR amplifikasyonundan uzamsal olarak ayırmak ve amplikon kontaminasyonu nedeniyle yanlış pozitif sonuçlardan kaçınmak için PCR öncesi odadan ayrı bir odaya yerleştirilmelidir.
- PCR amplifikasyonu için plakayı bir termal döngüleyiciye (96 derinliğinde kuyu reaksiyon modülü ile) yerleştirin ve güvenli bir şekilde kapatın.
- Termodöngüleyiciyi Tablo 4'te açıklanan koşullarda ve 40 μL'lik bir reaksiyon hacminde çalışacak şekilde yapılandırın. Program ayarlarına bir ön ısıtma adımı ekleyin ve kapağın 99 °C'ye ısıtıldığından emin olun.
- PCR programı bittiğinde, plakanın tamamen soğuduğundan emin olmak için plakayı en az 4 dakika boyunca 15 °C'de tutun.
NOT: Plaka, damlacıkların okunması gerekmeden önce 4 ° C'de 48-72 saat tutulabilir.
6. Damlacık okuma
- Plakayı bir damlacık okuyucuya yerleştirin, aşağıdaki bilgileri sistem yazılımına girin ve okumaya devam edin.
NOT: Deney türü = Doğrudan niceleme; Süper karışım = problar için dd_PCR süper karışım (dUTP yok); Tahlil türü = kanal başına tek hedef; Hedef bilgisi, kullanılan proba göre sinyal kanalı 1 = FAM kanalı veya HEX kanalı. - Her bir numunenin konumunun veri dosyasından etkili bir şekilde belirlenebilmesi ve tanımlanabilmesi için numunelere açıklama ekleyin.
7. Veri analizi
- Damlacık okuyucu üreticisi tarafından sağlanan uyumlu yazılımı kullanarak veri analizini gerçekleştirin.
- Testin genel performansını (ve dolayısıyla güvenilirliğini) değerlendirmek için bir sistem uygunluk testi yapın.
- PCR plakasındaki her kuyucuk için ölçülen olay sayısını (damlacık sayısı) kontrol edin. İdeal olarak, olay sayısı 15.000 ile 20.000 arasındadır. Etkinlik sayısı 10.000 < ise, bu değerin analizden çıkarılması gerekir.
- 1D veya 2D genlik grafiğini değerlendirin ve damlacık yağmurunun varlığını kontrol edin.
- Veri tablosu sekmesine gidin ve verileri bir Excel dosyasına aktarın.
- Aşağıdaki adımları izleyerek vg titresini hesaplayın:
- dd_PCR'nin çalışma aralığı 10-10.000 kopya/μL'dir. <10 kopya/μL olan herhangi bir değeri analizden çıkarın. Burada kullanılan dd_PCR ekipman için önerilen aralık 25-5000 kopya/μL'dir.
NOT: Veri analiz yazılımı, PCR reaksiyon hacmine (40 μL) uygun olarak bir vektör genom numarası sağlayacaktır, ancak bu, numune hazırlama sırasında uygulanan seyreltme faktörlerini dikkate almaz. - Aşağıdaki ilişkiyi kullanarak numune hazırlama boyunca çeşitli seyreltme faktörlerini hesaba katarak hacim başına numune vg titresini (tipik olarak vg/mL olarak ifade edilir) hesaplayın:
NOT: Konsantrasyon (veri analizinden elde edilen değer) x 10 (DNaz I işlem öncesi seyreltme) x 10 (PCR ana karışım seyreltmesi) x 1000 (μL ila mL) seçilen numune seyreltmesi (AAV seyreltme tamponunda - örn., Tablo 2). - Replikalar arasındaki ve aynı numunenin farklı seyreltmeleri arasındaki varyasyon katsayısını (%CV) hesaplayın.
NOT: %CV, standart sapmanın ortalamaya bölünmesiyle hesaplanır. Farklı seyreltmeler arasındaki %CV %>20 ise, değerin doğru olduğu kabul edilmemelidir. - Negatif ve pozitif kontrolün değerlerini kontrol edin. Negatif kontrol 5 kopya/μL'den az olmalıdır.
- dd_PCR'nin çalışma aralığı 10-10.000 kopya/μL'dir. <10 kopya/μL olan herhangi bir değeri analizden çıkarın. Burada kullanılan dd_PCR ekipman için önerilen aralık 25-5000 kopya/μL'dir.
Sonuçlar
Sonuçlar uygun yazılım kullanılarak görselleştirilebilir. Her kuyu için, 1B genlik grafiği, genliklerine göre tüm damlacıkları görüntüler. Pozitif ve negatif damlacıklar arasında net bir ayrım beklenir. Pozitif ve negatif damlacık bulutları arasında toplam damlacıkların %10'undan fazlası bulunursa (damlacık yağmuru olarak adlandırılan bir fenomen), numunenin yeniden ölçülmesi gerekir (bkz. Şekil 1). Damlacık yağmuru hakkında ek bilgi tartışmada mevcuttur.
Numune adı, kabul edilen damlacık sayısı (olay sayıları) ve konsantrasyon (kopya/μL) dahil olmak üzere kaydedilen tüm bilgileri özetlemek için bir veri tablosu oluşturulabilir. İdeal olarak, olay sayısı 15.000 ila 20.000 kabul edilen damlacık arasında olmalıdır. Bir kuyu için olay sayısı 10.000'in altındaysa, veri noktası analizden çıkarılmalıdır. Çıktı verilerinin bir örneği Tablo 5'te verilmiştir.
vg titresi, numune seyreltmeleri dikkate alınarak konsantrasyona (kopya/μL) dayalı olarak hesaplanabilir. dd_PCR çalışma aralığı 10-10.000 kopya/μL'dir. 10 kopya/μL'nin altındaki değerler analizden çıkarılmalıdır. Numuneler için vg titresinin yanı sıra pozitif ve negatif kontroller de hesaplanmalıdır. Pozitif kontrolün ölçülen değeri, teorik değere göre% 20'den daha düşük bir varyasyon katsayısına (% CV) sahip olmalıdır. Negatif kontrol 5 kopya/μL'den az olmalıdır. Ek olarak, her numune için tekrarlar ve farklı seyreltmeler arasındaki %CV hesaplanmalıdır. Farklı seyreltmeler arasındaki %CV %20'yi aşarsa, değer yanlış olarak kabul edilebilir ve numunenin yeniden ölçülmesi gerekebilir.
Başarılı bir ölçüm, pozitif ve negatif damlacık bulutlarının net bir şekilde ayrılması, en az 10.000 kabul edilen damlacık, 10 kopya/μL ile 10.000 kopya/μL arasında bir değer ve %20'den düşük tekrarlar arasında %CV ile karakterize edilir.
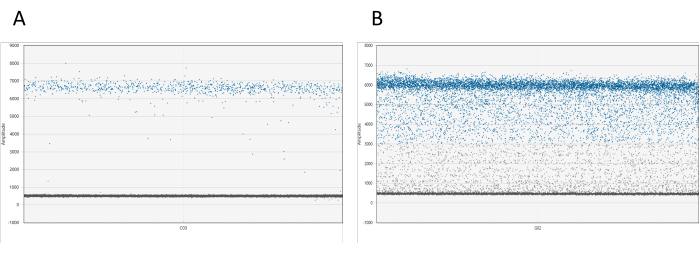
Şekil 1: dd_PCR damlacıklarının görselleştirilmesi. (A) 1D genlik grafiği, pozitif ve negatif damlacıkların net bir şekilde ayrıldığını gösterir, bu da başarılı damlacık bölümlemesini gösterir. (B) Grafik, damlacık yağmuru olarak bilinen pozitif ve negatif damlacıkların zayıf bir ayrımını gösterir, bu da optimal olmayan bölümlemeyi veya tahlille ilgili potansiyel sorunları önerir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
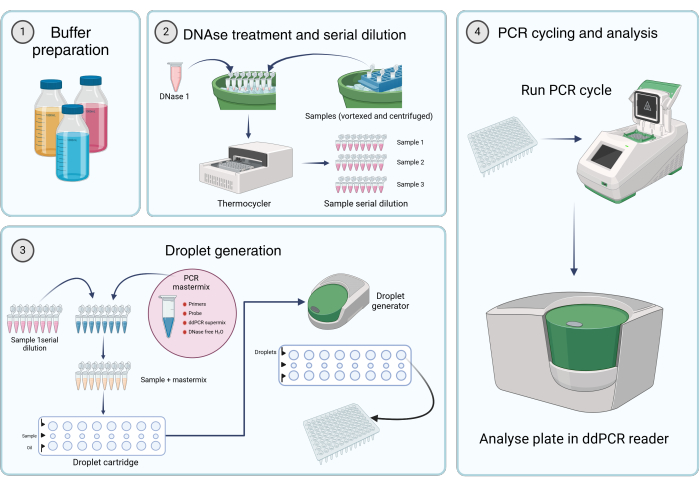
Şekil 2: Dijital damlacık PCR kullanarak viral genomların miktarını belirlemek için iş akışı. (1) Tamponlar, reaktifler ve çözeltiler, üreticinin talimatlarına veya protokolün 1. adımına (Stok çözeltilerinin hazırlanması) göre hazırlanır. (2) DNaz I çözeltisinin 45 μL'si, 8 tüplü bir PCR şeridinin her bir tüpüne aktarılır. Numunelerin girdaplanması ve kısaca santrifüjlenmesinden sonra, tüplerden birine 5 μL numune eklenir. DNaz I ve numune içeren sekiz tüplü PCR şeridi, 37 ° C'de 1 saat boyunca bir termosiklerde inkübe edilir, ardından numunelerin seri seyreltmeleri yapılır. (3) PCR mastermix'i tarif edildiği gibi hazırlanır ve 8 tüplü bir PCR şeridinin her bir tüpüne 19.8 μL eklenir. 2. adımdaki numune seri seyreltmeleri mastermix'e eklenir. 20 μL mastermix plus
numune çözeltisi kartuşun orta sırasına yüklenir ve 60 μL damlacık oluşturma yağı, damlacık üreten bir kartuşun alt kuyularına aktarılır. Kartuş daha sonra damlacık üretecine yerleştirilir ve belirtilen koşullara göre çalıştırılır. Damlacık oluşumundan sonra, kartuşun üst sırasından 42,5 μL, çok kuyulu bir PCR plakasına aktarılır. (4) PCR plakası bir PCR termocycler'a yüklenir ve sağlanan koşullara göre çalıştırılır. Plaka, bir dd_PCR okuyucu kullanılarak analiz edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Hassas veriler. Bu tablo, her biri beş konsantrasyona (QC1-QC5) sahip dört set kalite kontrol (QC) numunesinden elde edilen hassas verileri sunar. Her QC beş kez ölçüldü. Tekrarlanabilirliği (A) temsil eden farklı çalışmalar arasındaki ve orta hassasiyeti (B) temsil eden farklı numune setleri arasındaki varyasyon katsayısı (%CV) gösterilir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Örnek seyreltmeler. Tablo, beklenen viral genom titresine (vg/mL) dayalı olarak önerilen numune seyreltmelerini göstermektedir. En az iki değerin testin çalışma aralığına girmesini sağlamak için toplam üç seyreltme önerilir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: dd_PCR ana karışım bileşimi. Bu tablo, bir ileri ve geri astar (909 nM), prob (227 nM) ve problar için dd_PCR süper karışım (dUTP olmadan, 1x) içeren dd_PCR ana karışımının bileşimini özetlemektedir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 4: Termodöngü koşulları. Tablo, aşağıdakileri içeren önerilen PCR programını detaylandırmaktadır: (1) kapsid bozulması ve enzim aktivasyonu için 95 ° C'de 10 dakikalık bir inkübasyon, (2) DNA denatürasyonu için 94 ° C'de 30 s'lik 40 döngü ve tavlama ve uzatma için 60 ° C'de 1 dakika, (3) enzim deaktivasyonu için 98 ° C'de 10 dakikalık bir inkübasyon, ve (4) 4 ° C'de tutma. Tavlama sıcaklığı, kullanılan astar/prob setine bağlı olarak optimizasyon gerektirebilir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 5: Gerçek bir AAV çalışmasından elde edilen çıktı verilerine örnek. Tablo, bir numunenin her biri çift olarak iki farklı seyreltmede ölçüldüğü gerçek bir AAV çalışmasından elde edilen çıktı verilerinin bir örneğini sağlar. Viral genom (vg) titresi (vg / mL cinsinden) aşağıdaki formül kullanılarak hesaplanır: 10 (DNaz I ön işlemi) x 10 (ana karışımda seyreltme) x 1.000 (μL ila mL) x AAV seyreltme tamponunda seyreltme. STDEV standart sapmayı temsil eder ve CV varyasyon katsayısını gösterir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Vektör preparatlarında AAV vektör genom kopyalarının doğru bir şekilde ölçülmesi, AAV bazlı gen terapisi ürünlerinin geliştirilmesi için esastır. Kantitatif PCR (qPCR) ve dd_PCR en yaygın kullanılan ve kabul edilen iki teknik olmak üzere, vg titresini belirlemek için çeşitli yöntemler mevcuttur. dd_PCR, amplifikasyon verimliliğinden bağımsızlığı, daha yüksek hassasiyeti ve daha fazla sağlamlığı nedeniyle genellikle qPCR'ye göre tercih edilir15. Literatürde dd_PCR ile vektör genom titrasyonu için çok sayıda protokol mevcuttur ve her biri kendi numune hazırlama yöntemlerine sahiptir 15,16,17. Ancak, nitelikli bir konsensüs protokolü eksikliği vardır. Bu makale, saflaştırılmış vektör örneklerinde AAV vektör genomlarının nicelleştirilmesi için doğrulanmış bir amaca uygun dd_PCR protokolü sunmaktadır (Şekil 2).
Bu protokolü gerçekleştirirken numune işlemeye çok dikkat etmek çok önemlidir. Çapraz kontaminasyon, vg titrelerinin doğru bir şekilde değerlendirilmesinde önemli bir zorluk oluşturabilir; bu nedenle, yabancı DNA ile kontaminasyonu önlemek için numuneler en iyi şekilde bir PCR iş istasyonu altında işlenir. Ek olarak, DNaz inkübasyonunun uygun şekilde yürütülmesi, kapsidi bozmadan ve paketlenmiş vektör genomunu potansiyel olarak sindirmeden paketlenmemiş kirletici DNA'yı ortadan kaldırmak için çok önemlidir. Birçok protokol ısı inaktivasyonu ve proteinaz K tedavisiniiçerir 16,17,18. Bununla birlikte, kurum içi yöntem geliştirme sırasında, aşırı ısınmanın vg titrasyonu için zararlı olduğu ve proteinaz K tedavisinin gereksiz olduğu bulunmuştur (veriler gösterilmemiştir).
dd_PCR viral genomların miktarını belirlemek için giderek daha popüler hale geldikçe, üreticiler dd_PCR tahlillerinin tasarlanması ve optimize edilmesine ilişkin kılavuzları içeren ayrıntılı uygulama kılavuzları yayınlamışlardır19. Sorun giderme bilgileri de mevcuttur. Uygulamada, bir tahlil doğru bir şekilde tasarlandığında, en sık karşılaşılan sorunlar arasında damlacık yağmuru ve düşük damlacık sayısı yer alır. Damlacık yağmuru genellikle astarın/probların amplikona erişiminin zayıf olmasından kaynaklanır, ancak çeşitli stratejiler bu sorunu çözebilir. Örneğin, bir sıcaklık gradyanı deneyi, optimum tavlama sıcaklığının belirlenmesine yardımcı olabilir. Ek olarak, DNA miktarını düşürmek için numunelerin seyreltilmesi (66 ng'den az olması önerilir) veya amplikon bölgesinin dışını kesen spesifik enzimlerle bir kısıtlama sindirimi gerçekleştirmek, şablon erişilebilirliğini iyileştirebilir. μg DNA başına 10 U kısıtlama enzimi önerisi tipik olarak etkilidir. Düşük damlacık sayısı (10.000'den az) sorunu, genellikle numunenin ve kartuşlardaki yağın yetersiz pipetlenmesinden kaynaklanır. Damlacıkların kesilmesini önlemek için uygun uçlarla yavaş pipetleme yapılması önerilir. dd_PCR tahlili sağlam olsa da, bir sınırlama, sonuç alma süresinin uzamasıdır. Numune işleminden damlacık okumasına kadar olan süreç birkaç saat sürer ve bu da sonuçlara hızlı bir şekilde ihtiyaç duyulduğunda bir dezavantaj olabilir.
Vektör preparatlarında AAV genom kopyalarının doğru bir şekilde ölçülmesi, AAV gen terapisi yaşam döngüsünün tüm aşamaları boyunca gereklidir. Spesifik olarak, üretim ve saflaştırma süreçlerini optimize etmek, klinik öncesi çalışmalar yürütmek ve AAV bazlı gen tedavisi ürünleri için klinik dozajları belirlemek için önemlidir. Burada sunulan dd_PCR protokolü geniş çapta uygulanabilir ve farklı serotiplere ve transgenlere sahip saflaştırılmış AAV ürünlerinde kullanılabilir.
Açıklamalar
IVH, BM ve EH, Tavira Therapeutics'in kurucu ortaklarıdır. Diğer yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Bu araştırma, Flaman Hükümeti'nin 'Avrupa Kurtarma ve Dayanıklılık Tesisi'nden (RRF) (VV021/13) kaynaklanan 'Flanders Resilience' sübvansiyonu ile mümkün olmuştur. Şekil 2 Biorender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 8-channel pipette 10 µL | Eppendorf | 3,12,50,00,010 | |
| 8-channel pipette 200 µL | Eppendorf | 3,12,50,00,036 | |
| 8-channel pipette 300 µL | Eppendorf | 3,12,50,00,052 | |
| 8-well PCR strip | Sarstedt | 72.991.002 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9418 | |
| C1000 Touch Thermal Cycler with 96–Deep Well Reaction Module | Bio-Rad | 1851197 | |
| ddPCR Buffer Control for Probes 9 mL (2 x 4.5 mL) | Bio-Rad | 1863052 | |
| ddPCR Supermix for Probes (No dUTP) (2 x 1 mL) | Bio-Rad | 1863023 | |
| ddPCR 96-Well Plates (pkg of 25) | Bio-Rad | 12001925 | |
| ddPCR Droplet Reader Oil (2 x 1L) | Bio-Rad | 1863004 | |
| DG8 Cartridge Holder | Bio-Rad | 1863051 | |
| DG8 Cartridges for QX200/QX100 (pkg of 24) | Bio-Rad | 1864008 | |
| DG8 Gaskets for QX200/QX100 (pkg of 24) | Bio-Rad | 1863009 | |
| DNase I (10U/µL) + buffer | Roche | 4716728001 | |
| Droplet Generation Oil for Probes (10 x 7 mL) | Bio-Rad | 1863005 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 0.1-10 μL, 34 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078500 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 20-300 μL, 55 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078560 | |
| Eppendorf ep Dualfilter T.I.P.S. Filter Tip, 2-100 μL, 53 mm, Rack, PCR Clean, STERILE | Eppendorf | 30078543 | |
| Forward lyophilized primers and respective master stocks at 100 mM | IDT | GFP as target sequence. Forward primer: 5'-GAACGGCATCAAGGTGAACT-3' | |
| Lyopohilized probe and master stock at 100 µM | IDT | GFP as target sequence. PrimeTime Eco Probe: /56-FAM/CAAGATCCG/ZEN/CCACAACATCGAGGA/3IABkFQ/ | |
| Magnesium Chloride (MgCl2) | Chemlab Analytical | CL00.1381 | |
| Nuclease free water | IDT | 11-04-02-01 | |
| PCR Plate Heat Seal, foil, pierceable (pkg of 100) | Bio-Rad | 1814040 | |
| Pluronic F-68 non-ionic surfactant (100x) | Thermo Fisher Scientific | 24040032 | |
| Potassium Chloride (KCl) | Honeywell research chemicals | 31248 | |
| QX manager software | Bio-Rad | Software to analyse ddPCR data | |
| QX200 Droplet Generator | Bio-Rad | 1864002 | |
| QX200 Droplet Reader | Bio-Rad | 1864003 | |
| Reagent reservoir | VWR | 613-1181 | |
| Reverse lyophilized primers and respective master stocks at 100 mM | IDT | GFP as target sequence. Reverse primer: 5'-TGCTCAGGTAGTGGTTGTCG-3' | |
| SafeSeal reaction tube, 1.5 mL | Sarstedt | 72.706.200 | |
| Salmon Sperm DNA, sheared (10 mg/mL) | Thermo Fisher Scientific | AM9680 | |
| TE buffer | IDT | Accompanied by primers when ordering | |
| Tris hydrochloride (Tris-HCl) | Roche | 10812846001 |
Referanslar
- Balakrishnan, B., Jayandharan, G. R. Basic biology of adeno-associated virus (AAV) vectors used in gene therapy. Curr Gene Ther. 14 (2), 86-100 (2014).
- Srivastava, A. In vivo tissue-tropism of adeno-associated viral vectors. Curr Opin Virol. 21, 75-80 (2016).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Gimpel, A. L., et al. Analytical methods for process and product characterization of recombinant adeno-associated virus-based gene therapies. Mol Ther Methods Clin Dev. 20, 740-754 (2021).
- Brimble, M. A., et al. Preventing packaging of translatable P5-associated DNA contaminants in recombinant AAV vector preps. Mol Ther Methods Clin Dev. 24, 280-291 (2022).
- Wright, J. F. Product-related impurities in clinical-grade recombinant AAV vectors: Characterization and risk assessment. Biomedicines. 2 (1), 80-97 (2014).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, (2019).
- Sidransky, D., et al. Identification of ras oncogene mutations in the stool of patients with curable colorectal tumors. Science. 256 (5053), 102-105 (1992).
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proc Natl Acad Sci USA. 96 (16), 9236-9241 (1999).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Anal Chem. 83 (22), 8604-8610 (2011).
- Pinheiro, L. B., et al. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification. Anal Chem. 84 (2), 1003-1011 (2012).
- Sanmiguel, J., Gao, G., Vandenberghe, L. H. Quantitative and digital droplet-based AAV genome titration. Methods Mol Biol. 1950, 51-83 (2019).
- Bio-Rad Laboratories Inc. Planning droplet digital PCR experiments. , https://www.bio-rad.com/en-in/life-science/learning-center/introduction-to-digital-pcr/planning-ddpcr-experiments (2024).
- Dorange, F., Le Bec, C. Analytical approaches to characterize AAV vector production & purification: Advances and challenges. Cell Gene Ther Insights. 4 (2), 119-129 (2018).
- Lock, M., et al. Absolute determination of single-stranded and self-complementary adeno-associated viral vector genome titers by droplet digital PCR. Hum Gene Ther Methods. 25 (2), 115-125 (2014).
- Prantner, A., Maar, D. Genome concentration, characterization, and integrity analysis of recombinant adeno-associated viral vectors using droplet digital PCR. PLoS One. 18 (1), e0280242(2023).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 10, 1570(2019).
- Suoranta, T., Laham-Karam, N., Yla-Herttuala, S. Optimized protocol for accurate titration of adeno-associated virus vectors. Hum Gene Ther. 32 (19-20), 1270-1279 (2021).
- Bio-Rad. Droplet digital PCR applications guide. Bulletin 6407. , https://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_6407.pdf (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır