A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
دراسة متعددة الوسائط لإعادة تشكيل القلب والأوعية الدموية في الفئران: التصوير بالموجات فوق الصوتية رباعية الأبعاد وقياس الطيف الكتلي
* These authors contributed equally
In This Article
Summary
هنا ، نصف بروتوكولا لاستخدامه في الجسم الحي التصوير بالموجات فوق الصوتية رباعي الأبعاد وتصوير قياس الطيف الكتلي خارج الجسم الحي لتقييم التغيرات الميكانيكية الحيوية والجزيئية الحيوية في نظام القلب والأوعية الدموية للفئران. يتم تطبيق هذه التقنية لتحليل إعادة تشكيل القلب في احتشاء عضلة القلب المستحث جراحيا وتغيرات الأوعية الدموية في المتقدمة في السن.
Abstract
أمراض القلب والأوعية الدموية (CVD) هي السبب الرئيسي للوفاة في الولايات المتحدة. يمكن أن يكون الضرر في نظام القلب والأوعية الدموية بسبب التعرض البيئي أو الصدمة أو سمية الأدوية أو العديد من العوامل الأخرى. نتيجة لذلك ، تخضع أنسجة القلب والأوعية الدموية لتغيرات هيكلية وتظهر وظيفة متناقصة. يمكن اكتشاف الضرر وإعادة التشكيل الناتج وقياسه كميا من خلال التصوير بالموجات فوق الصوتية (الولايات المتحدة) على مستوى الأعضاء وتصوير قياس الطيف الكتلي (MSI) على المستوى الجزيئي. تصف هذه المخطوطة منهجية مبتكرة لدراسة الفيزيولوجيا المرضية لقلب الفئران ، واقتران التصوير بالموجات فوق الصوتية رباعي الأبعاد (4D) في الجسم الحي وتحليله مع امتصاص / تأين الليزر بمساعدة مصفوفة خارج الجسم الحي (MADLI) MSI للقلب. يمكن أن توفر الموجات فوق الصوتية 4D قياسات حجمية ديناميكية ، بما في ذلك الإزاحة الشعاعية ، وإجهاد مساحة السطح ، والإجهاد الطولي طوال دورة القلب بأكملها. في الأوعية الدموية ، يتم استخدام MSI والموجات فوق الصوتية لتقييم تركيبات جدار الأوعية الدموية وديناميكا الدم وديناميكيات جدار الوعاء. يمكن تصميم المنهجية لدراسة عدد لا يحصى من أمراض السيرة الذاتية عن طريق تعديل المقاييس الوظيفية ذات الأهمية و / أو بروتوكول MALDI MSI المتغير لاستهداف جزيئات معينة. يمكن استخدام MALDI MSI لدراسة الدهون والمستقلبات الصغيرة والببتيدات والجليكان. يحدد هذا البروتوكول استخدام MALDI MSI لتحليل الدهون غير المستهدف واستخدام التصوير بالموجات فوق الصوتية لديناميكا الدم القلبية الوعائية والميكانيكا الحيوية.
Introduction
أمراض القلب والأوعية الدموية (CVD) هي سبب رئيسي للوفيات في جميع أنحاءالعالم 1. تتطلب الوقاية من الأمراض القلبية الوعائية وعلاجها فهما متعمقا للتكيفات الجزيئية للقوى الميكانيكية الحيوية والتغيرات الناتجة في الخواص الميكانيكية. في جميع أنحاء نظام القلب والأوعية الدموية بأكمله ، تلعب القوى الميكانيكية الحيوية دورا مهما في وظيفة وهيكل الأنسجة2. تتأثر الخصائص الميكانيكية لأنسجة القلب والأوعية الدموية (CV) بهذه القوى ، مما يجعلها مؤشرات للصحة والمرض3،4،5،6. للوقاية من الأمراض القلبية الوعائية وتشخيصها وعلاجها ، من الأهمية بمكان تطوير طرق لفهم ومراقبة عمليات بدء المرض وتطوره. كان التصوير الطبي الحيوي مفتاحا في توليد رؤى فسيولوجية وميكانيكية ، ويتم تطوير تقنيات التصوير الجديدة وتقنيات التحليل باستمرار. يوضح هذا البروتوكول منهجية للجمع بين تقنيتين لتصوير القلب والأوعية الدموية وتحليلها للتحقق من إمكانات طرائق التصوير هذه في أمراض القلب الإقفارية وشيخوخة الأوعية الدموية.
غالبا ما يقترب الباحثون في المجال الميكانيكي الحيوي من دراسة الميكانيكا الحيوية من خلال مزيج من طرق in vivo و ex vivo و silico . ركزت الأبحاث السابقة في الميكانيكا الحيوية الجزيئية بشكل أساسي على البروتينات7 (خاصة بروتينات المصفوفة خارج الخلية الكولاجين والإيلاستين بسبب تأثيرها على الخصائص الميكانيكية الحيوية) ، واقتصر العمل على الجمع بين الميكانيكا الحيوية للتصوير في الجسم الحي مع الدراسات الجزيئية على علم الأنسجة والكيمياء المناعية. على الرغم من أن هذه الأساليب يمكن أن تنتج العديد من المؤشرات الجزيئية وأسفرت عن آليات مقترحة لإعادة تشكيل ECM والخلايا ، إلا أنها تقتصر عادة على البقع أو الأجسام المضادة المتاحة حاليا ، على التوالي. يفتقد هذا المجال من البحث إلى فئات كبيرة من الجزيئات ، على سبيل المثال ، الدهون. في حين أن هذه الفئات الجزيئية قد تكون أو لا تكون متورطة ميكانيكيا ، إلا أن التكيفات الجزيئية الناتجة مهمة لفهمها لأن هذه الجزيئات يمكن أن تكون أهدافا محتملة لكل من العلامات التشخيصية والعلاجات. يمكن تطبيق تقنيات الكيمياء التحليلية ، مثل الكروماتوغرافيا السائلة - قياس الطيف الكتلي (LC-MS). ومع ذلك ، يتم فقد الاتجاه المكاني للجزيئات في هذه التقنيات. مع التصوير الطيفي الكتلي (MSI) ، يظل التوزيع المكاني للجزيئات سليما ، ويمكن تصوير أنواع متعددة من التحليلات (فئات الجزيئات) بأقسام تسلسلية. MSI هي أداة تحليلية قوية للتحقيق في التوزيعات المكانية لجميع أنواع الجزيئات تقريبا في الأنسجة البيولوجية ، بما في ذلك المستقلبات والدهون والجليكان والببتيدات والأدوية ذات الوزن الجزيئيالصغير 8. امتصاص / تأين الليزر بمساعدة المصفوفة (MALDI) MSI هو نوع من MSI مناسب تماما للتحليل القائم على الاكتشاف للأوزان الجزيئية في حدود 50-8000 Da. MALDI-MSI هي تقنية تأين تطبق مصفوفة لامتصاص الطاقة بالليزر على العينة للمساعدة في تأين التحليلات ذات الأهمية. يمنع هذا النهج الاقتصار على هدف جزيئي واحد ويمكن استخدام أدوات المعلوماتية الحيوية لتحديد الجزيئات التي لها تأثير على الخصائص الميكانيكية الحيوية وإعادة التشكيل.
الموجات فوق الصوتية رباعية الأبعاد (4DUS) هي طريقة غير جراحية في الجسم الحي مفيدة لكل من التوصيف الزمني والمكاني للقلب. يستخدم 4DUS سلسلة من الحلقات السينمائية ذات معدل الإطارات العالي من مستويات مختلفة ، وتجميعها في مجموعة بيانات ثلاثية الأبعاد تتضمن معلومات زمنية. يسمح ذلك بالتصور المباشر والقياس الكمي لتغييرات الشكل ثلاثية الأبعاد المعقدة لغرف القلب على مدار الدورة القلبية دون الاعتماد على الافتراضات الهندسية كما هو مطلوب لتخطيط صدى القلب ثنائي الأبعاد التقليدي. يسمح 4DUS بحساب المقاييس الوظيفية في الجسم الحي من الشكل والحركة المعقدة للقلب9،10 ، ويسمح MALDI MSI بالدراسة المكانية للجزيئات البيولوجية داخل أنسجة القلب خارج الجسم الحي11. لفهم التغيرات في القلب مع الأمراض القلبية الوعائية بشكل كامل ، يجب فحص كل من الآليات الميكانيكية والجزيئية. وبالتالي ، تم اقتراح منهجية مشتركة لدراسة الفيزيولوجيا المرضية لقلب الفئران ، وربط التصوير والتحليل 4DUS مع MALDI MSI للدهون في القلب. يتم توضيح هذه المنهجية في نموذج الفئران لاحتشاء عضلة القلب.
تلعب الميكانيكا الحيوية للأوعية الدموية أيضا دورا مهما في تنظيم وظيفة القلب والأوعيةالدموية 2. تصلب الأوعية الدموية ، المرتبط بالشيخوخة ، هو عامل خطر للإصابة بالأمراض القلبية الوعائية12. يمكن تصوير التغيرات الميكانيكية الحيوية والدموية في الأوعية باستخدام الموجات فوق الصوتية. تعتبر التركيبات الجزيئية لجدران الأوعية الدموية مكونات مهمة في الميكانيكا الحيوية كما أنها حساسة بشكل رائع لقوى ديناميكا الدم. على سبيل المثال ، تم تورط إجهاد قص الجدار التذبذبي في تطور لويحات تصلب الشرايين3. سيتم تقديم البيانات الأولية لميكانيكا السفن وديناميكا الدم في المسنة لاحقا.
يهتم الفريق بالعلاقة بين الميكانيكا الحيوية والتركيب الجزيئي في حالات المرض المختلفة. يستخدم التصوير بالموجات فوق الصوتية قبل السريرية و MSI لتحديد التوزيع المكاني للتغيرات الجزيئية في الأنسجة والتغيرات الميكانيكية الحيوية المرتبطة بها التي تحدث أثناء تطور المرض. يصف هذا التقرير هذه المنهجيات بالتفصيل ويقدم بيانات أولية عن القلب والأوعية الدموية في الرأس / الرقبة.
Protocol
يتم إجراء التجارب على الموصوفة بموافقة لجنة رعاية واستخدام المؤسسية بجامعة تينيسي في نوكسفيل.
1. التصوير بالموجات فوق الصوتية13
- الإعداد وإعداد
- قبل بدء التجربة ، تحقق من مستوى تخدير الأيزوفلوران وأعد تعبئته إذا لزم الأمر. افحص مستويات خزان الأكسجين قبل تشغيل الغاز. قم بوزن الفحم وتسجيله على الحاوية.
- قم بإعداد مساحة التصوير عن طريق وضع المستلزمات بالقرب من منصة التصوير. تشمل المستلزمات شريطا مقطوعا مسبقا ، وكريم مزيل الشعر ، وشاش ، ومسحات قطنية ، وماء معقم ، وزيوت تشحيم القرنية ، وجل التشحيم ، ومسبار درجة حرارة المستقيم ، وسلك قطب كهربائي ، وهلام بالموجات فوق الصوتية ، وهلام القطب الكهربائي (إن أمكن) ، والمصباح الحراري (الشكل 1 أ).
- قم بتشغيل جهاز الموجات فوق الصوتية وتهيئة المحرك (النظام قادر أيضا على جمع بيانات صورة 4DUS). قم بإعداد تجربة جديدة على نظام الموجات فوق الصوتية: حدد دراسة جديدة أو سلسلة جديدة واملأ معلومات الماوس. قم بتشغيل الجهاز اللوحي للمراقبة الفسيولوجية.
- تحقق من محبس التثبيت للتأكد من أن التدفق مفتوح على صندوق الحث ومغلق على مخروط الأنف. املأ صندوق تحريض التخدير مسبقا عن طريق تشغيل الأكسجين إلى 1 لتر / دقيقة على المرذاذ وتدوير القرص إلى 3٪ -5٪.
- قم بإزالة الماوس من قفص الإسكان.
- ضع الفأر في صندوق الحث حتى يتم تخدير بالكامل بالأيزوفلوران بين 3٪ -5٪.
- قم بتبديل محبس التثبيت لتغيير التدفق إلى مخروط الأنف على لوحة التصوير بالموجات فوق الصوتية. أدر قرص الأيزوفلوران بين 1٪ -2٪.
- أخرج الماوس من صندوق الحث وقم بوزن. سجل وزن.
- ضع الماوس في وضع ضعيف على لوحة التصوير.
- ضع زيوت التشحيم القرنية على عيون.
- في حالة وجود فراء ، قم بإزالة الفراء من منطقة التصوير باستخدام كريم إزالة الشعر المتاح تجاريا ومسحات قطنية. امسحي الكريم عن الجلد بالماء على الإسفنج لإزالة أي كريم زائد لإزالة الشعر من الجلد ومنع الحروق.
- أدخل تخطيط كهربية القلب (ECG) يؤدي تحت الجلد على جانبي الصدر والطرف الخلفي ، اعتمادا على وضع.
- بمجرد إدخالها ، أمسك أسلاك تخطيط القلب في مكانها بواسطة شريط لاصق. إذا لم يتم استخدام خيوط تخطيط القلب (أي لا يتم إدخال خيوط تخطيط القلب) ، راقب مخطط كهربية القلب عبر لوحة التصوير الحيواني.
- للتوصيل الكهربائي من الجلد إلى الصفيحة ، ضع الجل الموصل على اللوحة وامسك أطراف في موضعها.
- أمسك أطراف في مكانها إما بشريط لاصق أو شريط مطاطي يوضع حول اللوحة وفوق الأطراف (الشكل 1 ب).
- استخدم جل التشحيم لإدخال مسبار درجة حرارة المستقيم وتأمين المسبار بشريط لاصق.
- تحقق من إشارات تخطيط القلب والتنفس ودرجة الحرارة على الجهاز اللوحي. تأكد من أن معدل ضربات القلب ~ 350-600 نبضة في الدقيقة ، والتنفس ~ 50-100 نفس / دقيقة ، ودرجة حرارة المستقيم بين 35-37 درجة مئوية. اضبط مستويات الأيزوفلوران حسب الحاجة.
- إذا لزم الأمر ، قم بتشغيل مصباح حراري (على سبيل المثال ، لمبة تسخين 250 واط بالأشعة تحت الحمراء) 14 واضبط الارتفاع للحفاظ على درجة الحرارة الأساسية (الشكل 1C).
- ضع المصباح الحراري على مسافة لا تزيد عن 12 بوصة من. للدراسات الأولية لتحديد المسافة المثلى بين البصلة ، اضبط الارتفاع وسجل درجة حرارة الجلد باستخدام مقياس حرارة بالأشعة تحت الحمراء ، والذي يجب ألا يتجاوز 42 درجة مئوية15.
- الموجات فوق الصوتية للقلب 4D
- ضع محول الطاقة في الحامل في وضع شبه مغلق.
- قم بتوجيه النقطة البارزة على محول الطاقة باستخدام النقطة الزرقاء على الشاشة. العرف هو وضع النقطة باتجاه الجانب الأيمن للحيوان.
- أدر محول الطاقة بحيث يتم توجيهه على طول المستوى السهمي للفأر مع وجود شق مرتفع يشير إلى الاتجاه الذيلي.
- استخدم الرافعة الموجودة في قاعدة لوحة الموجات فوق الصوتية لإمالة. استخدم الرافعة الموجودة في قاعدة محول الطاقة لضبط زاوية محول الطاقة.
- ضع كمية وفيرة من جل الموجات فوق الصوتية على السطح البطني للتجويف الصدري للاقتران الصوتي بين سطح الجلد ومحول الطاقة. تأكد من عدم وجود فرو متبقي قبل التوصيل.
- اخفض محول الطاقة للتلامس مع جل الموجات فوق الصوتية.
- قم بإجراء تعديلات دقيقة باستخدام مقابض X / Y في قاعدة اللوحة ، أو حرك اللوحة بأكملها لإجراء تعديلات كبيرة.
- تأكد من أن عرض المحور الطويل الظرفي يتضمن القمة ومسار تدفق البطين الأيسر والشريان الأورطي محاذاة أفقيا على الشاشة للحصول على صورة ذات محور قصير أكثر دقة (الشكل 2 أ ، ب).
- حدد اسم الصورة في الزاوية السفلية لحفظ الصورة في السلسلة الحالية.
- قم بتدوير محول الطاقة بزاوية 90 درجة في اتجاه عقارب الساعة للتبديل إلى عرض المحور القصير القصي (الشكل 2 ج).
ملاحظة: للحصول على أفضل جودة للصورة 4D ، يجب على المستخدمين محاولة محاذاة محرك السائر على طول المحور الطويل للبطين الذي لا يكون دائما موازيا مباشرة لعظم القص. غالبا ما يجلس القلب/الجهد المنخفض في الزاوية اليسرى الهابطة. - تأكد من أن البطين الأيسر مرئي على الجانب الأيمن من الشاشة وأن البطين الأيمن على الجانب الأيسر من الشاشة (الشكل 2 د).
- إذا كان الماوس لديه إيقاع تنفسي مستقر ، فاضغط على مربع مخطط كهربية القلب في الزاوية العلوية اليسرى من الصورة لتشغيل بوابات الجهاز التنفسي للصورة 4D. إذا لم تكن مستقرة، فأكمل هذه الخطوة أثناء المعالجة اللاحقة.
- حدد المكعب في الزاوية العلوية اليسرى من الشاشة لإعداد صورة 4D.
- أعد ضبط محول الطاقة قبل ضبط موضعي البدء والإيقاف لمحول الطاقة.
- اضبط موضع البدء على أسفل القمة مباشرة وموضع التوقف إلى القوس الأبهري.
- اضبط حجم الخطوة على 0.08-0.13 مم ومعدل الإطارات على 200-300 هرتز.
ملاحظة: قد توفر أحجام الخطوات الأصغر دقة صورة أفضل للتحليل ولكنها ستزيد من وقت الاكتساب. تكون أحجام الخطوات الأكبر مقبولة إذا تم جمع البيانات بمحاذاة البطين الأيسر المثالية تقريبا والحاجة إلى الحد الأدنى / عدم إعادة التوجيه أثناء التحليل. ضع في اعتبارك زيادة معدل الإطارات عند العمل مع ذات معدلات ضربات القلب الأعلى (>450 نبضة في الدقيقة). - تأكد من استقرار العلامات الحيوية وإشارة مخطط كهربية القلب باستمرار (>350 نبضة في الدقيقة والتنفس أعلى من 50 دورة / دقيقة) قبل الوصول إلى الفحص.
- بمجرد اكتمال الفحص والمعالجة ، قم بتشغيل حفظ بيانات EKV / 4D للمعالجة اللاحقة وتشغيل بوابة التنفس.
- حدد اسم الصورة في أسفل اليمين وقم بتضمين معرف الماوس في الاسم.
- للتحقق من جودة الصورة ، اضغط على المزيد من عناصر التحكم وحدد تحميل في 4D.
- راجع كل عرض مستوي للقلب ، وتأكد من أن مركز القلب لا يتحرك طوال الدورة القلبية. تشير حركة المركز إلى التباين في مخطط كهربية القلب و / أو بوابات الجهاز التنفسي وبالتالي تعقد عملية التحليل. أعد ضبط الشاشات وكرر الفحص إذا لزم الأمر.
- تحليل الموجات فوق الصوتية للقلب 4D
- انتقل إلى مستعرض الدراسة. قم بتصدير جميع صور B-Mode 2D إلى Vevo Lab وتصدير بيانات 4D كنوع ملف آخر ، وتحديد تنسيق البيانات ".raw" إلى محرك الأقراص الثابتة.
ملاحظة: صندوق أدوات واجهة المستخدم الرسومية 4D المستخدمة في هذا العمل غير متاح للجمهور حاليا. لطلب الوصول والتعليمات التفصيلية ، تواصل مع الدكتور كريج غورجن ، جامعة بوردو. - قم بإجراء تحليل بديل للبيانات 4D باستخدام برنامج VevoLab. لاستخدام هذا الإطار ، قم بتصدير بيانات 4D من الجهاز إلى ملفات Vevo Lab.
- انتقل إلى مستعرض الدراسة. قم بتصدير جميع صور B-Mode 2D إلى Vevo Lab وتصدير بيانات 4D كنوع ملف آخر ، وتحديد تنسيق البيانات ".raw" إلى محرك الأقراص الثابتة.
- تصوير الأوعية الدموية
- بالنسبة لصور الوضع B للشرايين السباتية ، ضع محول الطاقة بالموجات فوق الصوتية موازيا للشرايين السباتية ، بالقرب من خط الوسط.
- بمجرد أن يصبح الشريان السباتي مرئيا ، حرك محول الطاقة العلوي للعثور على تشعب الشريان السباتي.
- عند العثور على صورة واضحة لتشعب الشريان السباتي ، اضبط إعداد الكسب على 35 ديسيبل والتقط صورة الوضع B.
- قد يؤدي تحريك محول الطاقة إلى اليسار أو اليمين إلى تحسين الصورة. اضبط زاوية محول الطاقة أو المرحلة بحيث لا يكون الوعاء محل الاهتمام موازيا مباشرة لمحول الطاقة. هذا يسمح لزاوية دوبلر بالبقاء أقل من 60 درجة. خلاف ذلك ، قد تكون هناك حاجة إلى تحول +/- 15 درجة.
- قم بالتبديل إلى وضع دوبلر الموجة النبضية للحصول على قياسات السرعة.
- ضع حجم العينة في وسط الوعاء. اضبط زاوية المؤشر بحيث تكون موازية للشريان السباتي. ثم اضغط على تشغيل لبدء قياسات السرعة وحفظها لتسجيلها.
- للحصول على صورة الوضع B للأوردة الوداجية ، ضع محول الطاقة بالموجات فوق الصوتية موازيا للأوردة الوداجية. الأوردة الوداجية الأمامية والجانبية للشرايين السباتية.
- بمجرد تحديد موقع الوريد الوداجي ، انقل محول الطاقة إلى الموقع الذي يندمج فيه الوداج الداخلي والخارجي. عند العثور على صورة واضحة، اضبط إعداد الكسب على 35 ديسيبل والتقط صورة الوضع B.
- قم بالتبديل إلى وضع دوبلر الموجة النبضية للحصول على قياسات السرعة.
- ضع حجم العينة في وسط الوعاء. اضبط زاوية المؤشر بحيث تكون موازية للوريد الوداجي. ثم اضغط على تشغيل لبدء قياسات السرعة وحفظها لتسجيلها.
- تحليل الأوعية الدموية بالموجات فوق الصوتية
- بعد جمع صور الوضع B وقياسات دوبلر ذات الموجة النبضية ، قم بقياس الأقطار والسرعات باستخدام البرنامج.
- بمجرد تحميل الصور في البرنامج ، حدد حزمة الأوعية الدموية.
- حدد كل جانب من جوانب الوعاء للحصول على القطر الكامل.
- بالنسبة للشريان السباتي ، قم بإجراء قياسات القطر في الانقباض والانبساط باستخدام خيار القطر في عبوة الأوعية الدموية.
- قم بإجراء قياسات السرعة باستخدام خيار السرعة في عبوة الأوعية الدموية.
- بالنسبة للشريان السباتي ، حدد أعلى ذروة لقياس السرعة في الانقباض وأدنى ذروة لقياس السرعة في الانبساط.
- استخدم قيم الأقطار لحساب المكون المحيطي لموتر سلالة لاغرانج الأخضر باستخدام المعادلة التالية ،
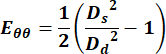 (1)
(1)
حيث يمثل Ds القطر أثناء الانقباض و Dd يمثل القطر أثناء الانبساط. - بالنسبة للوريد الوداجي ، حدد أي نقاط عبر الدورة للحصول على قياس السرعة.
2. القتل الرحيم وحصاد الأنسجة
- قم بإعداد قوارب رقائق الألومنيوم لأنسجة التجميد السريع (الشكل 3).
- في نهاية الدراسة، قتل عن طريق جرعة زائدة من الأيزوفلوران بتركيز 5٪ وإما استرواح الصدر الثنائي أو خلع عنق الرحم (دراسة القلب فقط).
- باستخدام ملقط لخيمة الجلد ، قم بقص جلد الخيام بمقص على الرقبة للأوعية الدموية أو أسفل القص مباشرة للقلب.
- قطع طبقات الجلد والعضلات لكشف الأوعية الدموية أو قطع العظام لكشف القلب.
- باستخدام تشريح حاد باستخدام مسحات قطنية ، اعزل القلب أو الأوعية الدموية عن الأنسجة المحيطة ، بما في ذلك الدهون. تأكد من فصل الوعاء السباتي عن العصب. إزالة القلب والأوعية باستخدام الأدوات الجراحية.
ملاحظة: يمكن استخدام الغرز لإزالة الأوعية الدموية عن طريق خياطة القريبة والبعيدة قبل إزالة الأوعية. - ضع منديلا على قارب من رقائق الألومنيوم المسمى مسبقا وضع القارب في النيتروجين السائل (الشكل 3).
- قم بتخزين المناديل في -80 درجة مئوية حتى وقت التقطيع بالتبريد. نقل الأنسجة مع الثلج الجاف للحفاظ على درجة الحرارة.
3. تصوير قياس الطيف الكتلي
- التقطيع بالتبريد ودرجة حرارة القطع المثلى (OCT) التركيب على الشرائح الزجاجية
- اضبط درجة حرارة ناظم البرد على -25 درجة مئوية وأدخل الشفرة.
- قم بإعداد ظرف معدني عن طريق تطبيق OCT والسماح له بالتجميد في ناظم البرد.
- ثبت قاعدة القلب على ظرف المعدن المحضر باستخدام OCT (الشكل 4 أ). لا تسمح ل OCT بلمس منطقة العينة محل الاهتمام لأن OCT سوف يلوث الأطياف الكتلية (تلوث البولي إيثيلين جلايكول [PEG]) ويقلل من إشارات الدهون ذات الأهمية.
ملاحظة: خيار لإجراء تركيب المياه لتجنب تلوث العينات. راجع البروتوكول الإضافي أدناه للحصول على التعليمات. - بناء على أهمية المحاذاة المكانية في هذه المنهجية ، استخدم العرض الرقمي المتدرج للقلب الذي قدمته واجهة المستخدم الرسومية MATLAB لتوجيه التقسيم (الشكل 4 ب).
- عد كل دورة (10 ميكرومتر) أثناء التقسيم ولاحظ العمق بالمليمترات لكل شريحة يتم تركيبها على الشريحة.
ملاحظة: من الضروري تتبع مواقع محددة في القلب أو الأوعية الدموية من أجل تطابق دقيق مع العرض الرقمي لبيانات الموجات فوق الصوتية التي يوفرها MATLAB. - قم بإذابة أقسام الأنسجة (بسمك 10 ميكرومتر) على شرائح المجهر.
ملاحظة: يعتمد نوع الشرائح على مطياف الكتلة المستخدم. تتضمن كل شريحة قسما واحدا من كل منطقة من القلب. مطلوب ما لا يقل عن ثلاث شرائح (وضع الأيونات الموجب ، وضع الأيونات السالبة ، إضافي). - بالنسبة إلى n = 1 / مجموعة ، قم بتقسيم القلب عبر المحور الطويل لتصور التغيرات الجزيئية من القمة إلى القاعدة.
- بالنسبة للأوعية الدموية ، قم بتضمين الأنسجة في الجيلاتين والتجميد السريع قبل التقسيم11.
- قم بتخزين الشرائح في رسائل بريدية منزلقة عند -80 درجة مئوية حتى تجارب تصوير قياس الطيف الكتلي.
- في حالة إجراء قياس الطيف الكتلي للكروماتوغرافيا السائلة (LC-MS) لتحديد الدهون أو المستقلبات وتحديدها بشكل أكبر ، قم بتقسيم أقسام الأنسجة التسلسلية ~ 60-100 ميكرومتر وجمعها في أنابيب 0.5-2 مل قبل التجميد.
- التشريح بالتبريد ومناديل تركيب الماء على الشرائح الزجاجية
- املأ دورق بماء كروماتوغرافيا سائل عالي الأداء (HPLC) واتركه جانبا بمحاقن سعة 5 مل و 1 مل.
- اضبط درجة حرارة ناظم البرد على -25 درجة مئوية وأدخل الشفرة.
- ضع زوجا من الملقط في ناظم البرد ليبرد قبل التركيب.
- اسحب 5 مل من ماء HPLC في حقنة وضعها في ناظم التبريد.
- قبل تجميد المحقنة بالكامل مباشرة ، أفرغ الماء على ظرف المعدن واتركه يتجمد تماما.
- اسحب 1 مل من ماء HPLC وضع المحقنة في ناظم البرد.
- بعد حوالي 30-60 ثانية ، ضع نقطة صغيرة من الماء المتصلب جزئيا في وسط الظرف أمسك القلب على الفور بالملقط وضعه في النقطة قبل أن يتجمد تماما. امسك القلب في مكانه حتى تتجمد المياه المحيطة تماما.
ملاحظة: قد يتم تركيب القلب بواسطة القمة أو القاعدة ، اعتمادا على منطقة الاهتمام. في هذه الدراسة ، سيتم تركيب القاعدة بحيث تكون القمة متجهة للخارج. - قم بتنفيذ الخطوات المتبقية لهذه الطريقة كما هو موضح في الخطوة 3.1.
- تطبيق المصفوفة
- قم بإزالة الشريحة من الفريزر وضعها في مجفف حتى تجف الشريحة.
- قم بتشغيل بخاخ HTX M3 + ، وافتح تطبيق HTX على الكمبيوتر المحمول ، وحدد الطريقة في منتصف الشاشة. يمكن العثور على تركيزات المصفوفة القياسية في الطرق المخزنة (الطرق الموجودة على الجانب الأيسر من الشاشة > المصفوفة OI_usermethods >).
- لهذا العمل ، اضبط درجة حرارة الفوهة على 75 درجة مئوية ، ومعدل التدفق على 100 ميكرولتر / دقيقة ، والضغط على 10 رطل لكل بوصة مربعة.
- اكتب اسم العينة والقطبية والمصفوفة والمذيب والتركيز في دفتر المختبر. احسب كمية المصفوفة المطلوبة لكل تركيز (على سبيل المثال ، 5 مل عند 10 مجم / مل = 50 مجم من المصفوفة).
- اصنع مذيبا (على سبيل المثال ، 70٪ MeOH).
- لهذا العمل ، قم بإعداد 40 مجم / مل 2،5-ثنائي هيدروكسي بنزويك حمض (DHB) محلول مصفوفة للوضع الإيجابي و 10 مجم / مل 9-أمينوأكريدين (9AA) محلول مصفوفة للوضع السلبي. اصنع كلا المصفوفات بمذيب MeOH بنسبة 70٪. بالنسبة للمصفوفات الشائعة الأخرى ومعلمات الرش ، اتبع الخطوات 3.3.2.
- قم بوزن المصفوفة وأضف المصفوفة إلى أنبوب مخروطي سعة 15 مل. تأكد من أن المبلغ قريب من المبلغ المطلوب المحسوب في الخطوة 3.3.3 ولكن ليس من الضروري أن يكون دقيقا. احسب كمية المذيب بناء على الكتلة المقاسة.
- أضف المذيب إلى الأنبوب المخروطي باستخدام ماصة.
ملاحظة: يعتمد الحجم على الكتلة المقاسة في الخطوة 3.3.5. - صوتنة الخليط لمدة 10 دقائق. أثناء صوتنة المصفوفة ، قم بإزالة الشريحة من المجفف.
- افتح درج البخاخ ، ضع الشريحة في الزاوية اليسرى السفلية ، وقم بلصق الحواف لأسفل.
ملاحظة: قم بطي أحد طرفي الشريط لسهولة إزالتها. - حدد منطقة رش العينة . أغلق الدرج.
- استخدم حقنة وفلتر واسكب المصفوفة في المحقنة ثم قم بتصفية المصفوفة من خلال المحقنة في القارورة مع الغطاء الأسود على الجانب الأيسر من البخاخ.
- ضع القارورة مرة أخرى في مكانها على البخاخ وأدخل أنبوب الخط D في القارورة.
ملاحظة: تأكد من أن الأنبوب لا يلامس قاع القارورة ، وأنه مغمور بالكامل في السائل. - قم بتشغيل الغاز الخامل وتأكد من أن المقياس الموجود على البخاخ يقرأ 10 رطل لكل بوصة مربعة. اضغط على ابدأ. بمجرد أن يصل البخاخ إلى درجة الحرارة المطلوبة ، حدد بداية الوميض.
- بعد اكتمال الرش ، افتح الدرج ، وأزل العينة ، وضعها في حامل منزلق MALDI أو مرة أخرى في المجفف (الشكل 4C).
- امسح حامل الشرائح MALDI ضوئيا وانزلق على الماسحة الضوئية ، أو التقط صورة بهاتف. احفظ الصورة على محرك أقراص محمول لاستخدامها مع MSI.
- حدد الغسيل المناسب أو البخاخ التالي على البخاخ. انقل الخط D من قارورة المصفوفة إلى دورق النفايات في حالة الغسيل.
- رش الميثانول على الصينية وامسحها لتنظيفها. قم بإيقاف تشغيل النيتروجين.
- مالدي MSI
- على الكمبيوتر ، انتقل إلى Synapt ، وتحقق من تغيير القطبية إلى الوضع المطلوب ، وقم بالتبديل إذا لم يكن كذلك.
- قم بتحميل الشريحة الموجودة في الجهاز الموجود على مصدر MALDI وانقر فوق زر التحميل على الكمبيوتر باستخدام البرنامج.
- انقل الصورة (الخطوة 1.2.17) إلى مجلد الصور في مجلد المشروع .
- انتقل إلى HD Imaging وافتح المشروع السابق (المشروع الذي يستخدم نفس المصفوفة).
- في دفتر ملاحظات مختبر ، قم بتسجيل نطاق الكتلة ، وفخ ونقل طاقة الاصطدام ، وطاقة الليزر ، ووضع neg / pos.
- في HD Imaging ، انتقل إلى أيقونة الصفحة البيضاء. ثم انقر فوق سهم القائمة المنسدلة وحدد لوحة جديدة.
- استعرض للعثور على الصورة في مجلد Project > Images Folder وافتحها.
- قم بتغيير نوع اللوحة إلى MALDI Standard وحدد حواف اللوحة (اختر 4 زوايا موضحة أدناه مع علامات زائد حمراء).
ملاحظة: المربع العلوي الأيسر مخصص للانتقال إلى كل زاوية. المربع العلوي الأيمن مخصص لتحديد الزوايا. المربع السفلي مخصص فقط لتصور الشريحة بأكملها. - انتقل إلى علامة تبويب النمط الصغيرة في الزاوية العلوية اليسرى وانقر فوق قلم رصاص أو خيارات مستطيل أو دائرة أخرى لتحديد الأنسجة. حدد الخطوط العريضة للأنسجة باستخدام النقرات اليسرى وانقر بزر الماوس الأيمن للإنهاء.
- حجم البكسل افتراضيا هو 50 ميكرومتر. قم بالتغيير إذا لزم الأمر.
- انقر فوق حفظ باسم وانتقل إلى Project Imaging AcqFolder وقم بتسميتها باسم الشريحة (تنسيق YYYYMMDD). ثم احفظ.
- انقر على الوشق الجماعي زر في أعلى المنتصف للتصدير إلى Mass Lynx.
- انتقل إلى برنامج Mass Lynx.
- انقر فوق ملف > فتح مجلد المشروع. قم بتحرير اسم الملف واسم النص إلى الشريحة (تنسيق YYYYMMDD).
- انقر بزر الماوس الأيمن فوق ملف MS ، وتصفح واختر الشريحة الحالية.
- انقر بزر الماوس الأيمن مرة أخرى على ملف MS وانقر فوق تحرير. انقر بزر مزدوج بزر الماوس الأيسر على المربع الأزرق.
- انتقل إلى ظروف الفحص. ابحث عن إعدادات المصدر وقم بالتغيير إلى محدد من قبل المستخدم. ثم انتقل إلى مجلد المشروع الصحيح > المجلد الذي تم الحصول عليه > الشريحة الحالية > موافق.
- احفظ بالنقر فوق حفظ باسم وقم بتضمين اسم الشريحة.
- معايرة الجهاز باستخدام مركب مرجعي (على سبيل المثال ، الفوسفور الأحمر)
- انتقل إلى Synapt (معايرة). انقر فوق زر التشغيل لبدء الحصول على البيانات. قم بتسمية YYYYMMDD_cal1 (على سبيل المثال: 20230614_cal1).
- تأكد من أن لها نفس نطاق الكتلة 50 - 2000. يمكن أن تكون طاقة الليزر حوالي 175.
- اضغط على تشغيل الليزر الناري ، ثم انقر فوق الزر التالي . دعها تعمل إلى حوالي 15 أو 20. انقر فوق التوقف الأحمر.
- انتقل إلى وحدة تحكم W.
- قم بإنشاء معايرة وانقر فوق ابدأ. ضمن محرر ملف تعريف المعايرة، انقر فوق ملف > جديد. اكتب YYYYMMDD_cal1.
- قم بتحرير نطاق الكتلة إلى نطاق الكتلة المطلوب للمشروع (على سبيل المثال ، 50-2000).
- اختر المعايرة اليدوية. اختر وضع الدقة وانقر فوق تحرير. اختر الفوسفور الأحمر كمركب مرجعي.
- انقر فوق ملف البيانات الأولية ، وقم بالتمرير إلى الأسفل (يجب أن يكون ما تم الحصول عليه للتو).
- انتقل إلى السجل في الأسفل ، وحدد كتلة Acc > حسنا > بخير.
- استمر في النقر فوق التالي وموافق حتى يظهر زر البدء ، واضغط على ابدأ.
- انتقل إلى التحقق الأخضر وانظر إلى القمم التي لم يتم العثور عليها.
- انتقل إلى Mass Lynx (ابدأ التشغيل الفعلي للعينات التجريبية).
- اضغط على زر التشغيل وتأكد من صحة عدد العينات
- انتقل إلى التصوير عالي الدقة.
- تحقق للتأكد من أن حجم البكسل لا يزال كما تم تعيينه في الأصل
- انتقل إلى Synapt للتحقق من القطبية.
- انقر فوق زر الكاميرا للتأكد من أنها تتحرك وتطلق الليزر.
- تحقق وتأكد من أنها تجمع البيانات. يجب عرض الطيف الكتلي المكتسب على صفحة Synapt.
- تحليل مرض التصلب العصبي المتعدد
- استخدم برنامج HD Imaging و Mass Lynx للتحليل.
- معالجة بيانات التصوير باستخدام علامة التبويب عملية في التصوير عالي الدقة.
- تصور صور الأيونات الجزيئية، التي تسمى أيضا صور التصلب العصبي المتعدد، في التصوير عالي الدقة في علامة التبويب التحليل . توضح الخريطة الحرارية لصورة الأيونات الجزيئية شدة أيون m / z على منطقة (الشكل 5). استخدم تراكبات صور MS لإظهار التوزيع المكاني للجزيئات (الشكل 6 والشكل 7).
- تطبيع البيانات باستخدام TIC أو التطبيع المناسب للتصوير.
- تحديد قمم m/z التي ترتبط مكانيا بمناطق الاهتمام. قم بتشغيل ارتباط مكاني (R > 0.65) على التصوير عالي الدقة لتحديد القمم الموضعية المشتركة.
- ابحث عن تحديد الدهون المفترض لهذه القمم باستخدام LipidMaps16 و METASPACE17.
- تأكيد التعليقات التوضيحية للدهون باستخدام بيانات LC-MS اللاحقة. استخدم Metaboanalyst للتحليل الإحصائي لبيانات LC-MS.
النتائج
تم استخدام بروتوكولات التصوير الموضحة أعلاه في دراستين أوليتين: إعادة تشكيل احتشاء عضلة القلب (MI) وشيخوخة الأوعية الدموية. بالنسبة للتجارب القلبية ، تم إجراء جراحة ربط الشريان التاجي الدائمة من أجل إحداث احتشاء عضلة القلب الحاد18،19. تم إج?...
Discussion
يمكن أن يعتمد التصوير الأمريكي على المشغل ، لكن استخدام المعالم التشريحية والتدريب الكافي يمكن أن يحد من تحيز المستخدم. الموجات فوق الصوتية ثنائية الأبعاد معرضة بشكل خاص للتباين بين المستخدمين لأن الآراء تعتمد على الزاوية ، في حين أن 4DUS أقل عرضة لأن الاستحواذ يشمل الحج?...
Disclosures
كريج جيه جورجن هو مستشار مدفوع الأجر لشركة FUJIFILM VisualSonics.
Acknowledgements
أليسون جونز مدعومة من قبل جامعة تينيسي ، زمالة الدراسات العليا في قسم الهندسة الميكانيكية والفضاء والطبية الحيوية. تم دعم البحث الوارد في هذا المنشور (كونر إيرل) من قبل المعهد الوطني للقلب والرئة والدم التابع للمعاهد الوطنية للصحة F30HL162452. المحتوى هو مسؤولية المؤلفين وحدهم ولا يمثل بالضرورة الآراء الرسمية للمعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid (DHB) | Supelco, >99.0% (HPLC) | 85707-10MG-F | DHB matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sigma/85707?cm_sp=Insite-_-wimsShippingEmailRecs_wims EmailAPI_wimsGruCrossEntropy-_-wimsEmailAPI10-3 |
| 9-aminoacridine (9AA) | Supelco, ≥99.5% (HPLC) | 92817-1G | 9-Aminoacridine matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sial/92817?srsltid=AfmBOooiQjQ4pWv_XxITkU 4Lkm0UnHXKekGS_ dFl7V40V9QLWoPpNLoc |
| Aquasonic Ultrasound Gel | Parker Laboratories | Parker 01-02 | Ultrasound Gel; https://www.parkerlabs.com/products/aquasonic-100-ultrasound-transmission-gel/ |
| Benchtop Dewar Flasks | ThermoScientific | 4150-2000 | Container for liquid nitrogen; https://www.thermofisher.com/order/catalog/product/4150-4000?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sQVc2f-NxN04Nb5Mv F6TZ7GLHWWDEeqDYmEvtKJSQ YHDeVgZ9qylvYaAs27EALw_wcB &source=google_shopping&ISO_ CODE=us&LANG_CODE=en&ef_id =Cj0KCQjwpvK4BhDUARIsADHt9 sQVc2f-NxN04Nb5MvF6TZ7GLHWWDE eqDYmEvtKJSQYHDeVgZ9qylvYa As27EALw_wcB:G:s&s_kwcid=AL!3652 !3!716188292869!!!g!2366243726129 !!21787513085!171591181194&ev_chn =shop&cid=0se_gaw_30092024_ PBYTXL&source=google_shopping &ISO_CODE=us&LANG_CODE= en&gad_source=1 |
| Cryostat | Leica Biosystems | CM Series | https://www.leicabiosystems.com/us/histology-equipment/cryostats/ |
| Dessicator | VWR | 89054-052 | https://us.vwr.com/store/product/9104882/desiccator-plastic-ace-glass-incorporated |
| Epredia MX35 Premier Disposable Low-profile Microtome Blades | Fisher Scientific | 3052835 | Cryostat blade; https://www.fishersci.com/shop/products/mx35-premier-disposable-low-profile-microtome-blades/3052835 |
| Falcon 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | Conical Tubes; https://www.fishersci.com/shop/products/falcon-15ml-conical-centrifuge-tubes-5/1495953A?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sSBcy5n-lhShligJUOX5KKVGn0bt87 8AB2_muOD2PPTue1phpZgeqwa AqgiEALw_wcB&ef_id=Cj0KCQjw pvK4BhDUARIsADHt9sSBcy5n-lhS hligJUOX5KKVGn0bt878AB2_muO D2PPTue1phpZgeqwaAqgiEALw_ wcB:G:s&ppc_id=PLA_goog_20861 45674_81843405034_1495953A__ 386247001345_165426395473886 37329&ev_chn=shop&s_kwcid=AL!4428!3 !386247001345!!!g!856907751004!& gad_source=1 |
| Flex-Tubes Microcentrifuge Tubes | Eppendorf | EP022364120 | Centrifuge tubes; https://www.sigmaaldrich.com/US/en/product/sigma/ep022364120?utm_source=google%2Cgoogle&utm _medium=organicshopping%2Ccpc&utm _campaign=21043330280&utm_ content=&gclid=Cj0KCQjwpv K4BhDUARIsADHt9sTHRD35k CHPtfI2A41axodnMVr6a1eBKk zM4bSUYQAyfEKo3UgTAEQa Ap7wEALw_wcB |
| Gas Nitrogen | Airgas | N/A | |
| Glass microscope slides | Electron Microscopy Sciences | 71873-02 | https://www.emsdiasum.com/positive-charge-microscope-slides |
| Liquid Nitrogen | Airgas | N/A | |
| Mass Spectrometer | Waters | Synapt G2-Si | https://www.waters.com/waters/en_US/SYNAPT-G2-Si-Mass-Spectrometry/nav.htm?locale=en_mkcid=1000251Foodety%3C/a%3E&cid=134740653&bcid= 134528734 |
| Matrix Sprayer | HTX Technologies | M3+ | https://www.htximaging.com/htx-m3-sprayer |
| Methanol (HPLC), >99.9% | Fisher Chemical | A4524 | Methanol; https://www.fishersci.com/shop/products/methanol-hplc-fisher-chemical-9/A4524?crossRef=A4524#?keyword=A4524 |
| Preclinical Ultrasound System | FUJIFILM VisualSonics | Vevo 3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100; Vevo F2 has replaced the Vevo 3100 in production. System includes isoflurane vaporizer and induction box. |
| Reynolds Wrap | N/A | N/A | Aluminum foil |
| Signagel Electrode Gel | Parker Laboratories | Parker 15-60 | Electrode Conducting Gel; https://www.parkerlabs.com/products/signagel-electrode-gel/ |
| Sterile Lubricating Jelly | Medline | MDS032273Z | Lubricating Gel; https://www.medline.com/ce/product/Sterile-Lubricating-Jelly/Lubricating-Jelly/Z05-PF03664?sku=MDPMDS032273H |
| Surgical instruments: scissors, forceps/tweezers, sutures | Fine Science Tools | 11252-00, 11050-10, 14016-14, 14084-08, 15000-08 | info@finescience.com |
| Surgical Sponges 200 Pack –Gauze Pads Non sterile -First Aid Wound Care Dressing Sponge –Woven Medical Nonstick, Non Adherent Mesh Scrubbing | Medpride | B08RZGQ5GW | Gauze; https://www.amazon.com/Medpride-Surgical-Sponges-200-Pack/dp/B08RZGQ5GW/ref=asc_df_B08RZGQ5GW/?tag=hyprod-20&linkCode=df0&h vadid=693270340506&hvpos= &hvnetw=g&hvrand=960915122 2290977669&hvpone=&hvptwo= &hvqmt=&hvdev=c&hvdvcmdl=& hvlocint=&hvlocphy=9192978&hv targid=pla-1245491514869&psc= 1&mcid=33f4d647c88630c79116 888d565a63b0 |
| Tissue-Plus O.C.T. Compound | Fisher Scientific | 23-730-571 | OCT; https://www.fishersci.com/shop/products/tissue-plus-o-c-t-compound-2/23730571 |
| Wood Handled Cotton Swabs and Applicators | Fisherbrand | 22-363-160 | Cotton swab; https://www.fishersci.com/shop/products/wood-handled-cotton-swabs-applicators-8/p-7146852 |
References
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: A report from the American Heart Association. Circulation. 145 (8), E153-E639 (2022).
- Kassab, G. S. Biomechanics of the cardiovascular system: The aorta as an illustratory example. J R Soc Interface. 3 (11), 719-740 (2006).
- Moore, J. E., Xu, C., Glagov, S., Zarins, C. K., Ku, D. N. Fluid wall shear stress measurements in a model of the human abdominal aorta: Oscillatory behavior and relationship to atherosclerosis. Atherosclerosis. 110 (2), 225-240 (1994).
- Nerem, R. M. Vascular fluid mechanics, the arterial wall, and atherosclerosis. J Biomech Eng. 114 (3), 274 (1992).
- Cecchi, E., et al. Role of hemodynamic shear stress in cardiovascular disease. Atherosclerosis. 214 (2), 249-256 (2011).
- Good, B. The influence of blood composition and loading conditions on the behavior of embolus analogs. J Mech Behav Biomed Mater. 140, 105738 (2023).
- Bao, G., et al. Molecular biomechanics: The molecular basis of how forces regulate cellular function NIH public access. Mol Cell Biomech. 3 (2), 91-105 (2010).
- Schwamborn, K., Caprioli, R. M. Molecular imaging by mass spectrometry-looking beyond classical histology. Nat Rev Cancer. 10 (9), 639-646 (2010).
- Soepriatna, A. H., Kevin Yeh, A., Clifford, A. D., Bezci, S. E., O'Connell, G. D., Goergen, C. J. Three-dimensional myocardial strain correlates with murine left ventricular remodelling severity post-infarction. J R Soc Interface. 16 (160), 20190570 (2019).
- Damen, F. W., et al. High-frequency 4-dimensional ultrasound (4DUS): A reliable method for assessing murine cardiac function. Tomography. 3 (4), 180-187 (2017).
- McDonald, R., Poulos, D., Gutzwiller, L., Sheth, R. A., Good, B., Crouch, A. C. A MALDI mass spectrometry imaging sample preparation method for venous thrombosis with initial lipid characterization of lab made and murine clots. J Am Soc Mass Spectrom. 34 (9), 1879-1889 (2023).
- Benetos, A., et al. Influence of age, risk factors, and cardiovascular and renal disease on arterial stiffness: Clinical applications. Am J Hypertens. 15 (12), 1101-1108 (2002).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. C. Murine echocardiography and ultrasound imaging. J Vis Exp. (42), v2100 (2010).
- Bellantuono, I., et al. A toolbox for the longitudinal assessment of healthspan in aging mice. Nat Protoc. 15 (2), 540-574 (2020).
- Henriques, F. C., Moritz, A. R. Studies of thermal injury: I. The conduction of heat to and through skin and the temperatures attained therein. A theoretical and an experimental investigation. Am J Pathol. 23 (4), 530 (1947).
- Conroy, M. J., et al. LIPID MAPS: Update to databases and tools for the lipidomics community. Nucleic Acids Res. 52 (D1), D1677-D1682 (2024).
- Palmer, A., et al. FDR-controlled metabolite annotation for high-resolution imaging mass spectrometry. Nat Methods. 14 (1), 57-60 (2016).
- Michael, L. H., et al. Myocardial ischemia and reperfusion: A murine model. Am J Physiol. 269 (6 Pt 2), H2147-H2154 (1995).
- Clark, J. E., Flavell, R. A., Faircloth, M. E., Davis, R. J., Heads, R. J., Marber, M. S. Post-infarction remodeling is independent of mitogen-activated protein kinase kinase 3 (MKK3). Cardiovasc Res. 75 (3), 523-530 (2007).
- Hattori, Y., Konno, H., Abe, M., Miyoshi, H., Goto, T., Makabe, H. Synthesis, determination of the absolute configuration of tonkinelin, and inhibitory action with bovine heart mitochondrial complex I. Bioorg Med Chem. 15 (8), 3026-3031 (2007).
- Golam Mostofa, M., et al. CLIP and cohibin separate rDNA from nucleolar proteins destined for degradation by nucleophagy. J Cell Biol. 217 (8), 2675-2690 (2018).
- Chan, J. N. Y., Poon, B. P. K., Salvi, J., Olsen, J. B., Emili, A., Mekhail, K. Perinuclear cohibin complexes maintain replicative life span via roles at distinct silent chromatin domains. Dev Cell. 20 (6), 867-879 (2011).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. Am J Physiol Heart Circ Physiol. 322 (3), H359-H372 (2022).
- Kaya, I., Sämfors, S., Levin, M., Borén, J., Fletcher, J. S. Multimodal MALDI imaging mass spectrometry reveals spatially correlated lipid and protein changes in mouse heart with acute myocardial infarction. J Am Soc Mass Spectrom. 31 (10), 2133-2142 (2020).
- Tressler, C., et al. Factorial design to optimize matrix spraying parameters for MALDI mass spectrometry imaging. J Am Soc Mass Spectrom. 32 (12), 2728 (2021).
- Zhang, L., et al. Vascular lipidomics analysis reveals increased levels of phosphocholine and lysophosphocholine in atherosclerotic mice. Nutr Metab. 20 (1), 1-16 (2023).
- Kohno, M., et al. Induction by lysophosphatidylcholine, a major phospholipid component of atherogenic lipoproteins, of human coronary artery smooth muscle cell migration. Circulation. 98 (4), 353-359 (1998).
- Crouch, A. C., Batra, A., Greve, J. M. Hemodynamic response to thermal stress varies with sex and age: A murine MRI study. Int J Hyperthermia. 39 (1), 69-80 (2022).
- Crouch, A. C., Scheven, U. M., Greve, J. M. Cross-sectional areas of deep/core veins are smaller at lower core body temperatures. Physiol Rep. 6 (16), e13839 (2018).
- Crouch, A. C., Castle, P. E., Fitzgerald, L., Scheven, U. M., Greve, J. M. Assessing structural and functional response of murine vasculature to acute β-adrenergic stimulation in vivo during hypothermic and hyperthermic conditions. Int J Hyperthermia. 36 (1), 1136-1145 (2019).
- Crouch, A. C., Manders, A. B., Cao, A. A., Scheven, U. M., Greve, J. M. Cross-sectional area of the murine aorta linearly increases with increasing core body temperature. Int J Hyperthermia. 34 (7), 1121-1133 (2018).
- Clift, C. L., Mehta, A., Drake, R. R., Angel, P. M. Multiplexed imaging mass spectrometry of histological staining, N-glycan and extracellular matrix from one tissue section: A tool for fibrosis research. Methods Mol Biol. 2350, 313-329 (2021).
- Salehi, H. S., et al. Coregistered photoacoustic and ultrasound imaging and classification of ovarian cancer: Ex vivo and in vivo studies. J Biomed Opt. 21 (4), 046006 (2016).
- Verbeeck, N., et al. Connecting imaging mass spectrometry and magnetic resonance imaging-based anatomical atlases for automated anatomical interpretation and differential analysis. Biochim Biophys Acta. 1865 (7), 967-977 (2017).
- Yang, E. Y., et al. Real-time co-registration using novel ultrasound technology: Ex vivo validation and in vivo applications. J Am Soc Echocardiogr. 24 (7), 720 (2011).
- Maris, L., et al. Method for co-registration of high-resolution specimen PET-CT with histopathology to improve insight into radiotracer distributions. EJNMMI Phys. 11 (1), 1-20 (2024).
- Lin, B. J., et al. MSIr: Automatic registration service for mass spectrometry imaging and histology. Anal Chem. 95 (6), 3317-3324 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved