A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מחקר רב-מודאלי של שיפוץ לב וכלי דם בעכברים: אולטרסאונד ארבע-ממדי והדמיית ספקטרומטריית מסה
* These authors contributed equally
In This Article
Summary
כאן, אנו מתארים פרוטוקול לשימוש בהדמיית אולטרסאונד ארבע-ממדית in vivo והדמיית ספקטרומטריית מסה ex vivo כדי להעריך שינויים ביומכניים וביו-מולקולריים במערכת הלב וכלי הדם של העכברים. טכניקה זו מיושמת לניתוח שיפוץ לב באוטם שריר הלב המושרה בניתוח ושינויים בכלי הדם בבעלי חיים מזדקנים.
Abstract
מחלות לב וכלי דם (CVD) הן סיבת המוות המובילה בארצות הברית. נזק במערכת הלב וכלי הדם יכול לנבוע מחשיפה סביבתית, טראומה, רעילות לתרופות או גורמים רבים אחרים. כתוצאה מכך, רקמת הלב וכלי הדם עוברים שינויים מבניים ומציגים תפקוד מופחת. ניתן לזהות ולכמת את הנזק ואת העיצוב מחדש שנוצר באמצעות הדמיית אולטרסאונד (US) ברמת האיבר והדמיית ספקטרומטריית מסה (MSI) ברמה המולקולרית. כתב יד זה מתאר מתודולוגיה חדשנית לחקר פתופיזיולוגיה של לב עכברים, צימוד הדמיה וניתוח אולטרסאונד ארבע-ממדי (4D) עם ספיגה/יינון לייזר בסיוע מטריצת ex vivo (MADLI) MSI של הלב. אולטרסאונד 4D יכול לספק מדידות נפח דינמיות, כולל תזוזה רדיאלית, מתח שטח פנים ומתח אורכי לאורך מחזור לב שלם. בכלי הדם, MSI ואולטרסאונד משמשים להערכת קומפוזיציות דופן כלי הדם, המודינמיקה ודינמיקה של דופן כלי הדם. ניתן להתאים את המתודולוגיה לחקר מספר עצום של מחלות לב וכלי דם על ידי התאמת מדדים תפקודיים מעניינים ו/או שינוי פרוטוקול MALDI MSI כדי להתמקד במולקולות ספציפיות. ניתן להשתמש ב-MALDI MSI לחקר שומנים, מטבוליטים קטנים, פפטידים וגליקנים. פרוטוקול זה מתאר את השימוש ב-MALDI MSI לניתוח ליפידומי לא ממוקד ושימוש בהדמיית אולטרסאונד להמודינמיקה וביומכניקה קרדיווסקולרית.
Introduction
מחלות לב וכלי דם (CVD) הן גורם מוביל לתמותה ברחבי העולם1. מניעה וטיפול במחלות לב וכלי דם דורשים הבנה מעמיקה של התאמות מולקולריות לכוחות ביומכניים והשינויים הנובעים מכך בתכונות המכניות. בכל מערכת הלב וכלי הדם, כוחות ביומכניים ממלאים תפקיד חשוב בתפקוד ובמבנה הרקמה2. התכונות המכניות של רקמת לב וכלי דם (CV) מושפעות מכוחות אלה, מה שהופך אותם לאינדיקטורים לבריאות ומחלות 3,4,5,6. כדי למנוע, לאבחן ולטפל במחלות לב וכלי דם, חיוני לפתח שיטות להבנה והתבוננות בתהליכי התחלת המחלה והתקדמותה. הדמיה ביו-רפואית הייתה המפתח ביצירת תובנות פיזיולוגיות ומכניסטיות, וטכנולוגיות הדמיה וטכניקות ניתוח חדשות מפותחות כל הזמן. פרוטוקול זה מדגים מתודולוגיה לשילוב שתי טכניקות הדמיה וניתוח קרדיווסקולריות כדי לאמת את הפוטנציאל של שיטות הדמיה אלה במחלת לב איסכמית והזדקנות כלי הדם.
חוקרים בתחום הביומכני ניגשים לעתים קרובות לחקר הביומכניקה באמצעות שילוב של שיטות in vivo, ex vivo ו-in silico . מחקרים קודמים בביומכניקה מולקולרית התמקדו בעיקר בחלבונים7 (במיוחד חלבוני מטריצה חוץ-תאיים קולגן ואלסטין בגלל השפעתם על תכונות ביומכניות), והעבודה לשילוב ביומכניקה של הדמיה in vivo עם מחקרים מולקולריים הוגבלה להיסטולוגיה ואימונוהיסטוכימיה. למרות שגישות אלה יכולות להניב אינדיקטורים מולקולריים רבים והניבו מנגנונים מוצעים לעיצוב מחדש של ECM ותאים, הם בדרך כלל מוגבלים לכתמים או לנוגדנים הזמינים כיום, בהתאמה. תחום מחקר זה חסר סוגים גדולים של מולקולות, למשל שומנים. בעוד שמחלקות מולקולריות אלה עשויות להיות מעורבות מכנית או לא, חשוב להבין את ההתאמות המולקולריות המתקבלות מכיוון שמולקולות אלו יכולות להיות מטרות פוטנציאליות הן לסמני אבחון והן לטיפולים. ניתן ליישם טכניקות כימיה אנליטית, כגון כרומטוגרפיה נוזלית-ספקטרומטריית מסה (LC-MS); עם זאת, ההתמצאות המרחבית של המולקולות בטכניקות אלה הולכת לאיבוד. עם הדמיית ספקטרומטריית מסה (MSI), ההתפלגות המרחבית של מולקולות נשארת שלמה, וניתן לדמות סוגי אנליטים מרובים (מחלקות של מולקולות) עם חתכים סדרתיים. MSI הוא כלי אנליטי רב עוצמה לחקירת ההתפלגות המרחבית של כמעט כל סוגי המולקולות ברקמה ביולוגית, כולל מטבוליטים, שומנים, גליקנים, פפטידים ותרופות במשקל מולקולרי קטן8. ספיגה/יינון לייזר בעזרת מטריצה (MALDI) MSI הוא סוג של MSI המתאים היטב לניתוח מבוסס גילוי של משקלים מולקולריים בטווח של 50-8000 Da. MALDI-MSI היא טכניקת יינון המיישמת מטריצה סופגת אנרגיה בלייזר על הדגימה כדי לסייע ביינון האנליטים המעניינים. גישה זו מונעת הגבלה למטרה מולקולרית אחת ויכולה להשתמש בכלים ביואינפורמטיים כדי לקבוע לאילו מולקולות יש השפעה על תכונות ביומכניות ועיצוב מחדש.
אולטרסאונד ארבע-ממדי (4DUS) היא שיטה לא פולשנית in vivo שימושית לאפיון זמני ומרחבי של הלב. 4DUS משתמש בסדרה של לולאות קולנוע בקצב פריימים גבוה ממישורים שונים, ומרכיב אותן למערך נתונים תלת-ממדי הכולל מידע זמני. זה מאפשר הדמיה וכימות ישירים של שינויי הצורה התלת-ממדיים המורכבים של חדרי הלב לאורך מחזור הלב מבלי להסתמך על הנחות גיאומטריות כנדרש עבור אקו לב דו-ממדי מסורתי. 4DUS מאפשר לחשב מדדים פונקציונליים in vivo מהצורה והתנועה המורכבים של הלב 9,10, ו-MALDI MSI מאפשר מחקר מרחבי של מולקולות ביולוגיות בתוך רקמת הלב ex vivo11. כדי להבין באופן מלא שינויים בלב עם מחלות לב וכלי דם, יש לחקור מנגנונים מכניים ומולקולריים כאחד. לפיכך מוצעת מתודולוגיה משולבת לחקר פתופיזיולוגיה של לב עכברים, צימוד הדמיה וניתוח 4DUS עם MALDI MSI של שומנים בלב. מתודולוגיה זו מודגמת במודל עכברי של אוטם שריר הלב.
ביומכניקה של כלי הדם ממלאת גם תפקיד קריטי בוויסות תפקוד הלב וכלי הדם2. התקשות כלי הדם, הקשורה להזדקנות, היא גורם סיכון למחלות לב וכלי דם12. ניתן לדמות את השינויים הביומכניים וההמודינמיים בכלי הדם באמצעות אולטרסאונד. ההרכבים המולקולריים של דפנות כלי הדם הם מרכיבים חשובים בביומכניקה והם גם רגישים להפליא לכוחות המודינמיים. לדוגמה, מתח גזירה של דופן תנודתית היה מעורב בהתפתחות רובד טרשת עורקים3. הנתונים הראשוניים של מכניקת כלי הדם וההמודינמיקה בבעלי חיים מבוגרים יוצגו בהמשך.
הצוות מתעניין בקשר בין ביומכניקה והרכב מולקולרי במצבי מחלה שונים. הדמיית אולטרסאונד פרה-קלינית ו-MSI משמשות לקביעת ההתפלגות המרחבית של שינויים מולקולריים ברקמה והשינויים הביומכניים הנלווים המתרחשים במהלך התקדמות המחלה. דוח זה מתאר את המתודולוגיות הללו בפירוט ומציג נתונים ראשוניים על הלב וכלי הדם של הראש/הצוואר.
Protocol
הניסויים המתוארים בבעלי חיים מבוצעים באישור הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת טנסי, נוקסוויל.
1. הדמיית אולטרסאונד13
- התקנה והכנת בעלי חיים
- לפני תחילת הניסוי, בדוק את רמת ההרדמה של איזופלורן ומלא מחדש במידת הצורך. בדוק את מפלס מיכל החמצן לפני הפעלת הגז. שקלו את הפחם ורשמו אותו על המיכל.
- הגדר את מרחב ההדמיה על-ידי הצבת חומרים מתכלים ליד פלטפורמת ההדמיה. האספקה כוללת סרט חתוך מראש, קרם אפילציה, גזה, צמר גפן, מים חיטוי, חומר סיכה לקרנית, ג'ל סיכה, בדיקת טמפרטורת פי הטבעת, מוליכי אלקטרודות, ג'ל אולטרסאונד, ג'ל אלקטרודות (אם ישים) ומנורת חום (איור 1A).
- הפעל את מכשיר האולטרסאונד ואתחל את המנוע (המערכת מסוגלת גם לאסוף נתוני תמונה של 4DUS). הגדר ניסוי חדש במערכת האולטרסאונד: בחר מחקר חדש או סדרה חדשה ומלא מידע על העכבר. הפעל את הטאבלט לניטור פיזיולוגי.
- בדוק את תא העצירה כדי לוודא שהזרימה פתוחה לתיבת האינדוקציה וסגורה לקונוס האף. מלאו מראש את קופסת האינדוקציה להרדמה על ידי הפעלת חמצן ל-1 ליטר לדקה במכשיר האידוי וסיבוב החוגה ל-3%-5%.
- הסר את העכבר מכלוב הדיור.
- הנח את העכבר בתיבת האינדוקציה עד שהחיה מורדמת לחלוטין עם איזופלורן בין 3%-5%.
- החלף את תא העצירה כדי לשנות את הזרימה לחרוט האף על לוחית הדמיית האולטרסאונד. סובב את חוגת האיזופלורן בין 1%-2%.
- הסר את העכבר מקופסת האינדוקציה ושקול את החיה. רשום את משקל החיה.
- הנח את העכבר במצב שכיבה על לוחית ההדמיה.
- מרחו חומר סיכה לקרנית על עיני החיה.
- אם קיימת פרווה, הסר את הפרווה מאזור ההדמיה באמצעות קרם אפילציה זמין מסחרית וצמר גפן. נגבו את הקרם מהעור במים על ספוגים כדי להסיר עודפי קרם אפילציה מהעור ולמנוע כוויות.
- הכנס את מובילי האלקטרוקרדיוגרפיה (ECG) תת עורית משני צידי החזה והגפה האחורית, בהתאם למיקום החיה.
- לאחר ההכנסה, החזק את מובילי האק"ג במקומם באמצעות סרט. אם לא נעשה שימוש במובילי א.ק.ג (כלומר, לא מוכנסים מובילי א.ק.ג), עקוב אחר א.ק.ג דרך לוחית ההדמיה של בעלי החיים.
- להולכה חשמלית מעור לצלחת, אתר את הג'ל המוליך על הצלחת והחזק את גפיים של בעלי חיים במקומן.
- החזיקו את הגפיים של החיות במקומם באמצעות סרט או רצועה אלסטית שמונחת סביב הצלחת ומעל הגפיים (איור 1B).
- השתמש בג'ל סיכה כדי להכניס את בדיקת הטמפרטורה של פי הטבעת ולאבטח את הגשושית בעזרת סרט.
- בדוק את אותות האק"ג, הנשימה והטמפרטורה בטאבלט. ודא שהדופק הוא ~350-600 פעימות לדקה, נשימה ~50-100 נשימות לדקה וטמפרטורת פי הטבעת בין 35-37 מעלות צלזיוס. התאם את רמות האיזופלורן לפי הצורך.
- במידת הצורך, הפעל חום lamp (למשל, נורת חימום אינפרא אדום 250 W)14 והתאם את הגובה כדי לשמור על טמפרטורת הליבה (איור 1C).
- מקם את מנורת החום לא יותר מ -12 סנטימטרים מהחיה. למחקרים ראשוניים לקביעת המרחק האופטימלי בין הנורה לבעל החיים, התאם את הגובה ורשום את טמפרטורת העור באמצעות מדחום אינפרא אדום, שלא יעלה על 42 מעלות צלזיוס15.
- אולטרסאונד 4D לב
- הנח את המתמר במחזיק במצב נעול למחצה.
- כוון את הנקודה המוגבהת על המתמר עם הנקודה הכחולה על המסך. המוסכמה היא למקם את הנקודה לכיוון הצד הימני של החיה.
- סובב את המתמר כך שהוא מכוון לאורך המישור הסגיטלי של העכבר עם חריץ מוגבה המצביע לכיוון הזנב.
- השתמש בידית בבסיס לוחית האולטרסאונד כדי להטות את החיה. השתמש בידית בבסיס המתמר כדי לכוונן את זווית המתמר.
- מרחו כמות נדיבה של ג'ל אולטרסאונד על פני הגחון של חלל בית החזה לצימוד אקוסטי בין פני העור למתמר. ודא שלא נותרה פרווה לפני הצימוד.
- הורד את המתמר כדי ליצור מגע עם ג'ל האולטרסאונד.
- בצע התאמות מיקרו עם כפתורי X/Y בבסיס הצלחת, או הזז את הצלחת כולה להתאמות גדולות.
- ודא שתצוגת ציר ארוך פראסטרנלית כוללת את הקודקוד, דרכי היציאה של החדר השמאלי ואבי העורקים מיושרים אופקית על המסך לקבלת תמונה מדויקת יותר של ציר קצר (איור 2A, B).
- בחר Name Image בפינה התחתונה כדי לשמור את התמונה בסדרה הנוכחית.
- סובב את המתמר 90° בכיוון השעון כדי לעבור לציר קצר parasternal view (איור 2C).
הערה: לקבלת איכות התמונה הטובה ביותר ב-4D, על המשתמשים לנסות ליישר את מנוע הצעד לאורך הציר הארוך של החדר שלא תמיד מקביל ישירות לעצם החזה. הלב/LV יושב לעתים קרובות בזווית שמאלית כלפי מטה. - ודא שהחדר השמאלי גלוי בצד ימין של המסך והחדר הימני נמצא בצד שמאל של המסך (איור 2D).
- אם לעכבר יש קצב נשימה יציב, לחץ על תיבת האק"ג בפינה השמאלית העליונה של התמונה כדי להפעיל את שער הנשימה עבור התמונה הרביעית. אם לא יציב, השלם שלב זה במהלך העיבוד שלאחר העיבוד.
- בחר את הקוביה בפינה השמאלית העליונה של המסך כדי להגדיר תמונה 4D.
- אפס את המתמר לפני התאמת מיקומי ההתחלה והעצירה של המתמר.
- התאם את מיקום התחלה ממש מתחת לקודקוד ואת מצב העצירה לקשת אבי העורקים.
- הגדר את גודל הצעד ל-0.08-0.13 מ"מ ואת קצב הפריימים ל-200-300 הרץ.
הערה: גדלי צעדים קטנים יותר עשויים לספק רזולוציית תמונה טובה יותר לניתוח, אך יגדילו את זמן הרכישה. גדלי מדרגות גדולים יותר מקובלים אם הנתונים נאספים עם יישור כמעט מושלם של החדר השמאלי ויש צורך בכיוון מינימלי / ללא כיוון מחדש במהלך הניתוח. שקול להגדיל את קצב הפריימים בעת עבודה עם בעלי חיים עם קצב לב גבוה יותר (>450 פעימות לדקה). - ודא שהסימנים החיוניים ואות ה-EKG יציבים באופן עקבי (>350 סל"ד ונשימה מעל 50 סיבובים לדקה) לפני הלחיצה על הסריקה.
- לאחר השלמת הסריקה והעיבוד, הפעל את שמירת נתוני EKV/4D לעיבוד שלאחר ושער הנשימה.
- בחר שם תמונה בפינה השמאלית התחתונה וכלול את מזהה העכבר בשם.
- כדי לבדוק את איכות התמונה, לחץ על פקדים נוספים ובחר טען ל-4D.
- סקור כל מישור של הלב, וודא שמרכז הלב אינו נע לאורך מחזור הלב. תנועת המרכז מצביעה על שונות ב-EKG ו/או בשער הנשימה ובכך מסבכת את תהליך הניתוח. כוונן מחדש את הצגים וחזור על הסריקה במידת הצורך.
- ניתוח אולטרסאונד 4D לב
- נווט אל דפדפן הלימוד. ייצא את כל התמונות הדו-ממדיות של B-Mode ל-Vevo Lab וייצא נתוני 4D כסוג קובץ אחר, תוך בחירת פורמט נתונים ".raw" לכונן קשיח.
הערה: ארגז הכלים של ממשק המשתמש הגרפי 4D המשמש בעבודה זו אינו זמין כרגע לציבור. לבקשת גישה והנחיות מפורטות, פנה לד"ר קרייג גורגן, אוניברסיטת פרדו. - בצע ניתוח חלופי של נתוני 4D באמצעות תוכנת VevoLab. כדי להשתמש במסגרת זו, ייצא נתוני 4D מהמכשיר לקבצי Vevo Lab.
- נווט אל דפדפן הלימוד. ייצא את כל התמונות הדו-ממדיות של B-Mode ל-Vevo Lab וייצא נתוני 4D כסוג קובץ אחר, תוך בחירת פורמט נתונים ".raw" לכונן קשיח.
- הדמיית כלי דם
- לתמונות במצב B של עורקי הצוואר, מקם את מתמר האולטרסאונד במקביל לעורקי הצוואר, ליד קו האמצע.
- לאחר שעורק הצוואר גלוי, הזז את המתמר העליון כדי למצוא את התפצלות הצוואר.
- כאשר נמצאה תמונה ברורה של התפצלות הצוואר, התאם את הגדרת הרווח ל-35 dB וצלם את תמונת מצב B.
- זווית המתמר שמאלה או ימינה עשויה לשפר את התמונה. התאם את זווית המתמר או השלב כך שהכלי המעניין לא יהיה מקביל ישירות למתמר. זה מאפשר לזווית הדופלר להישאר מתחת ל-60°. אחרת, ייתכן שיהיה צורך בהזזה של +/- 15°.
- עבור למצב דופלר גל דופק כדי לקבל את מדידות המהירות.
- הנח את נפח הדגימה במרכז הכלי. כוונן את זווית הסמן כך שתהיה מקבילה לעורק הצוואר. לאחר מכן, לחץ על הפעל כדי להתחיל את מדידות המהירות ושמור כדי להקליט אותן.
- לתמונת מצב B של ורידי הצוואר, מקם את מתמר האולטרסאונד במקביל לוורידי הצוואר. ורידי הצוואר קדמיים ורוחביים לעורקי הצוואר.
- לאחר איתור וריד הצוואר, העבר את המתמר למקום בו מתמזגים הצוואר הפנימי והחיצוני. כאשר נמצאה תמונה ברורה, כוונן את הגדרת הרווח ל-35 dB וצלם את התמונה במצב B.
- עבור למצב דופלר גל דופק כדי לקבל את מדידות המהירות.
- הנח את נפח הדגימה במרכז הכלי. כוונן את זווית הסמן כך שתהיה מקבילה לווריד הצוואר. לאחר מכן, לחץ על הפעל כדי להתחיל את מדידות המהירות ושמור כדי להקליט אותן.
- ניתוח אולטרסאונד כלי דם
- לאחר איסוף תמונות מצב B ומדידות דופלר גל דופק, מדוד את הקטרים והמהירויות באמצעות התוכנה.
- לאחר טעינת התמונות לתוכנה, בחר חבילת כלי דם.
- בחר כל צד של הכלי כדי לקבל את הקוטר המלא.
- עבור עורק הצוואר, בצע מדידות קוטר בסיסטולה ודיאסטולה באמצעות אפשרות הקוטר באריזת כלי הדם.
- בצע מדידות מהירות באמצעות אפשרות המהירות בחבילת כלי הדם.
- עבור עורק הצוואר, בחר את השיא הגבוה ביותר למדידת המהירות בסיסטולה ואת השיא הנמוך ביותר למדידת מהירות בדיאסטולה.
- השתמש בערכי הקוטרים כדי לחשב את הרכיב ההיקפי של טנזור המתח הירוק לגראנז' באמצעות המשוואה הבאה,
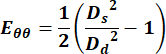 (1)
(1)
כאשר Ds מייצג את הקוטר במהלך הסיסטולה ו-Dd מייצג את הקוטר במהלך הדיאסטולה. - עבור וריד הצוואר, בחר נקודות כלשהן לאורך המחזור כדי לקבל את מדידת המהירות.
2. המתת חסד וקצירת רקמות
- הכן סירות רדיד אלומיניום עבור רקמות הקפאת הבזק (איור 3).
- בסוף המחקר, המתת חסד של החיה על ידי מנת יתר של איזופלורן בריכוז של 5% ופנאומוטורקס דו-צדדי או פריקת צוואר הרחם (מחקר לב בלבד).
- בעזרת מלקחיים לאוהל העור, חותכים את עור האוהל עם מספריים מעל הצוואר לכלי דם או ממש מתחת לעצם החזה ללב.
- חותכים את שכבות העור והשרירים כדי לחשוף את כלי הדם או חותכים את העצם כדי לחשוף את הלב.
- בעזרת דיסקציה קהה עם צמר גפן, בודד את הלב או כלי הדם מהרקמות שמסביב, כולל שומן. הקפד להפריד את כלי הצוואר מהעצב. הסר את הלב וכלי הדם באמצעות כלים כירורגיים.
הערה: ניתן להשתמש בתפרים להסרת כלי הדם על ידי תפירה פרוקסימלית ודיסטלית לפני הסרת הכלים. - הניחו רקמה על סירת רדיד אלומיניום מסומנת מראש והניחו את הסירה בחנקן נוזלי (איור 3).
- יש לאחסן טישו בטמפרטורה של -80 מעלות צלזיוס עד לזמן ההקפאה. הובלת רקמות עם קרח יבש לשמירה על הטמפרטורה.
3. הדמיית ספקטרומטריית מסה
- הרכבה בהקפאה וטמפרטורת חיתוך אופטימלית (OCT) על שקופיות זכוכית
- הגדר את טמפרטורת הקריוסטט ל-25 מעלות צלזיוס והכנס את הלהב.
- הכן צ'אק מתכת על ידי מריחת OCT ואפשר לו לקפוא בקריוסטט.
- קבע את בסיס הלב לתושבת המתכת המוכנה באמצעות OCT (איור 4A). אל תאפשר ל-OCT לגעת באזור הדגימה המעניין מכיוון ש-OCT יזהם את ספקטרום המסה (זיהום פוליאתילן גליקול [PEG]) וידכא אותות שומנים מעניינים.
הערה: אפשרות לבצע הרכבה במים כדי למנוע זיהום דגימה. עיין בפרוטוקול הנוסף שלהלן לקבלת הוראות. - בהתבסס על החשיבות של יישור מרחבי במתודולוגיה זו, השתמש בעיבוד הדיגיטלי המוגדל של הלב שניתן על ידי ממשק המשתמש הגרפי של MATLAB כדי להנחות את החתך (איור 4B).
- ספרו כל סיבוב (10 מיקרומטר) בזמן החיתוך ושימו לב לעומק במילימטרים עבור כל פרוסה שתורכב על השקופית.
הערה: יש צורך לעקוב אחר מיקומים ספציפיים בלב או בכלי הדם להתאמה מדויקת לעיבוד הדיגיטלי של נתוני האולטרסאונד המסופקים על ידי MATLAB. - הפשירו קטעי רקמה (בעובי 10 מיקרומטר) על שקופיות מיקרוסקופ.
הערה: סוג השקופיות יהיה תלוי בספקטרומטר המסה בו נעשה שימוש. כל שקופית כוללת קטע אחד מכל אזור בלב. נדרשות לפחות שלוש שקופיות (מצב יון חיובי, מצב יונים שלילי, תוספת). - עבור n = 1/קבוצה, חתכו את הלב דרך הציר הארוך כדי לדמיין שינויים מולקולריים מהקודקוד לבסיס.
- לכלי דם, הטמיעו את הרקמה בג'לטין והקפיא בזק לפני חתך11.
- אחסן את השקופיות בדוורי שקופיות בטמפרטורה של -80 מעלות צלזיוס עד לניסויי הדמיה של ספקטרומטריית מסה.
- אם מבצעים כרומטוגרפיה נוזלית-ספקטרומטריית מסה (LC-MS) כדי לזהות ולכמת עוד יותר שומנים או מטבוליטים, חתכו קטעי רקמה סדרתיים של ~60-100 מיקרומטר ואספו אותם לצינורות של 0.5-2 מ"ל לפני ההקפאה.
- רקמת הקפאה והרכבה במים על מגלשות זכוכית
- מלאו במי כרומטוגרפיה נוזלית (HPLC) בעלי ביצועים גבוהים והניחו בצד עם מזרקים של 5 מ"ל ו-1 מ"ל.
- הגדר את טמפרטורת הקריוסטט ל-25 מעלות צלזיוס והכנס את הלהב.
- הנח זוג מלקחיים לתוך הקריוסטט להתקרר לפני ההרכבה.
- שאבו 5 מ"ל מי HPLC במזרק והניחו אותם בקריוסטט.
- רגע לפני שהמזרק קפוא במלואו, רוקנו מים על צ'אק המתכת והניחו לו לקפוא במלואו.
- שאבו 1 מ"ל של מי HPLC והניחו את המזרק בקריוסטט.
- לאחר כ-30-60 שניות, הנח נקודה קטנה של מים מוצקים חלקית על מרכז הצ'אק. תפסו מיד את הלב בעזרת מלקחיים והניחו אותו בנקודה לפני שהוא קופא לחלוטין. החזק את הלב במקומו עד שהמים שמסביב קפאו לחלוטין.
הערה: הלב עשוי להיות מותקן על ידי קודקוד או בסיס, בהתאם לאזור העניין. עבור מחקר זה, הבסיס יותקן כשהקודקוד פונה כלפי חוץ. - בצע את שאר השלבים עבור שיטה זו כמתואר בשלב 3.1.
- יישום מטריקס
- מוציאים את השקופית מהמקפיא ומניחים אותה במייבש עד שהמגלשה יבשה.
- הפעל את מרסס HTX M3+, פתח את אפליקציית HTX במחשב הנייד ובחר שיטה באמצע המסך. ניתן למצוא ריכוזי מטריצה סטנדרטיים בשיטות המאוחסנות (שיטות בצד שמאל של המסך > מטריצת OI_usermethods >).
- עבור עבודה זו, הגדר את טמפרטורת הזרבובית ל-75 מעלות צלזיוס, את קצב הזרימה ל-100 מיקרוליטר לדקה ואת הלחץ ל-10 psi.
- רשום את שם הדגימה, הקוטביות, המטריצה, הממס והריכוז במחברת המעבדה. חשב את כמות המטריצה הדרושה לריכוז (למשל, 5 מ"ל ב-10 מ"ג/מ"ל = 50 מ"ג מטריצה).
- הכינו ממס (למשל, 70% MeOH).
- לעבודה זו, הכינו תמיסת מטריצה של 40 מ"ג/מ"ל 2,5-חומצה דיהידרוקסיבנזואית (DHB) למצב חיובי ותמיסת מטריצה של 10 מ"ג/מ"ל 9-אמינואקרידין (9AA) למצב שלילי. הכינו את שתי המטריצות עם ממס MeOH של 70%. למטריצות נפוצות אחרות ופרמטרי ריסוס, בצע את השלבים 3.3.2.
- שקלו את המטריצה והוסיפו את המטריצה לצינור חרוטי של 15 מ"ל. ודא שהסכום קרוב לסכום הנדרש המחושב בשלב 3.3.3 אך אינו חייב להיות מדויק. חשב את כמות הממס על סמך המסה הנמדדת.
- הוסף ממס לצינור החרוטי באמצעות פיפטה.
הערה: הנפח מבוסס על המסה שנמדדה בשלב 3.3.5. - סוניקציה של התערובת למשך 10 דקות. בזמן שהמטריצה עוברת סוניקציה, הסר את השקופית מהמייבשת.
- פתח את מגש המרסס, הנח את המגלשה בפינה השמאלית התחתונה והדביק את הקצוות.
הערה: קפלו קצה אחד של הסרט להסרה קלה. - בחר אזור ריסוס לדוגמה . סגור את המגש.
- השתמש במזרק ובפילטר ושפך את המטריצה לתוך המזרק ואז סנן את המטריצה דרך המזרק לתוך הבקבוקון עם המכסה השחור בצד שמאל של המרסס.
- הנח את הבקבוקון בחזרה למקומו על המרסס והכנס את צינור קו ה-D לתוך הבקבוקון.
הערה: ודא שהצינור אינו נוגע בתחתית הבקבוקון, והוא שקוע במלואו בנוזל. - הפעל את הגז האינרטי וודא שהמד על המרסס קורא 10 psi. לחץ על התחל. לאחר שהמרסס נמצא בטמפרטורה הרצויה, בחר את ההתחלה המהבהבת.
- לאחר השלמת הריסוס, פתח את המגש, הסר את הדגימה והנח אותה במחזיק השקופיות של MALDI או בחזרה במייבש (איור 4C).
- סרוק את מחזיק השקופיות של MALDI והחלק על הסורק, או צלם תמונה עם טלפון. שמור את התמונה בכונן הבזק לשימוש עם MSI.
- בחר את הכביסה המתאימה או את התרסיס הבא על המרסס. העבר את קו ה-D מבקבוקון המטריצה לכוס הפסולת אם שוטפים.
- ריססו מתנול על המגש ונגבו לניקוי. כבה חנקן.
- מאלדי MSI
- במחשב, נווט אל Synapt, בדוק שהקוטביות השתנתה למצב הדרוש והחלף אם לא.
- טען את השקופית במכשיר במקור MALDI ולחץ על כפתור הטעינה במחשב באמצעות התוכנה.
- העבר את התמונה (שלב 1.2.17) לתיקיית התמונות בתיקיית הפרויקט .
- נווט אל הדמיית HD ופתח את הפרויקט הקודם (כזה שמשתמש באותה מטריצה).
- במחברת מעבדה, רשום טווח מסה, לכידה והעברת אנרגיית התנגשות, אנרגיית לייזר, מצב neg/pos.
- בהדמיית HD, נווט אל סמל הדף הלבן. לאחר מכן לחץ על החץ הנפתח ובחר לוחית חדשה.
- דפדף כדי למצוא את התמונה בתיקיית Project > בתיקיית התמונות ופתח אותה.
- שנה את סוג הלוח ל-MALDI Standard והגדר את קצוות הצלחת (בחר 4 פינות המוצגות להלן עם סימני פלוס אדומים).
הערה: התיבה השמאלית העליונה מיועדת לניווט לכל פינה. התיבה השמאלית העליונה מיועדת לבחירת הפינות. התיבה התחתונה מיועדת רק להמחשה חזותית של השקופית כולה. - נווט אל לשונית התבנית הקטנה בפינה השמאלית העליונה ולחץ על עיפרון או אפשרויות מלבן או עיגול אחרות כדי לשרטט רקמות. מתאר רקמות באמצעות לחיצות שמאליות ולחיצה ימנית לסיום.
- ברירת המחדל של גודל הפיקסלים היא 50 מיקרומטר. החלף במידת הצורך.
- לחץ על שמירה בשם ונווט אל Project Imaging AcqFolder ותווית כשם שקופית (תבנית YYYYMMDD). לאחר מכן, שמור.
- לחץ על כפתור Mass Lynx באמצע העליון כדי לייצא ל-Mass Lynx.
- נווט אל תוכנת Mass Lynx.
- לחץ על קובץ > לפתוח את תיקיית הפרויקט. עריכת שם הקובץ ושם הטקסט בשקופית (תבנית YYYYMMDD).
- לחץ לחיצה ימנית על קובץ MS, דפדף ובחר את השקופית הנוכחית.
- לחץ לחיצה ימנית שוב על קובץ MS ולחץ על ערוך. לחץ פעמיים לחיצה ימנית על התיבה הכחולה.
- נווט אל תנאי הסריקה. מצא את הגדרות המקור ושנה למוגדר על-ידי המשתמש. לאחר מכן נווט לתיקיית הפרויקט הנכונה > התיקיה שנרכשה > השקופית הנוכחית > בסדר.
- שמור על ידי לחיצה על שמור בשם וכלול את שם השקופית.
- כייל את המכשיר באמצעות תרכובת ייחוס (למשל, זרחן אדום)
- נווט אל Synapt (כיול). לחץ על כפתור ההפעלה כדי להתחיל להשיג נתונים. תווית כ-YYYYMMDD_cal1 (לדוגמה: 20230614_cal1).
- ודא שיש לו את אותו טווח מסה 50 - 2000. אנרגיית הלייזר יכולה להיות בערך 175.
- לחץ על הפעל לייזר אש ולאחר מכן לחץ על הכפתור הבא . תן לזה לרוץ בערך 15 או 20. לחץ על נקודה אדומה.
- נווט אל קונסולת W.
- צור כיול ולחץ על התחל. תחת עורך פרופיל כיול, לחץ על קובץ > חדש. הקלד YYYYMMDD_cal1.
- ערוך את טווח המסה לטווח המסה הרצוי עבור הפרויקט (למשל, 50-2000).
- בחר כיול ידני. בחר מצב רזולוציה ולחץ על ערוך. בחר זרחן אדום כתרכובת ייחוס.
- לחץ על קובץ הנתונים הגולמיים וגלול לתחתית (זה אמור להיות מה שנרכש זה עתה).
- עבור להיסטוריה בתחתית, בחר Acc mass > בסדר > בסדר.
- המשך ללחוץ על הבא ובסדר עד שנראה כפתור ההתחלה, ולחץ על התחל.
- נווט לסימון ירוק ובדוק אילו פסגות לא נמצאו.
- נווט אל Mass Lynx (התחל את הריצה בפועל עבור דגימות ניסיוניות).
- לחץ על כפתור ההפעלה ובדוק שמספר הדגימות נכון
- נווט אל הדמיית HD.
- ודא שגודל הפיקסלים הוא עדיין מה שהוגדר במקור
- נווט אל Synapt כדי לבדוק את הקוטביות.
- לחץ על כפתור המצלמה כדי לוודא שהוא נע ויורה את הלייזר.
- בדוק וודא שהוא אוסף נתונים. יש להציג את ספקטרום המסה הנרכש בדף Synapt.
- ניתוח טרשת נפוצה
- השתמש בתוכנת הדמיית HD וב-Mass Lynx לניתוח.
- עבד נתוני הדמיה באמצעות הכרטיסייה תהליך בהדמיית HD.
- דמיין תמונות יונים מולקולריות, הנקראות גם תמונות MS, בהדמיית HD בכרטיסייה ניתוח . מפת חום של תמונת יונים מולקולרית מתארת את העוצמה של אותו יון m/z על פני אזור (איור 5). השתמשו בשכבות-על של תמונות טרשת נפוצה כדי להראות את ההתפלגות המרחבית של מולקולות (איור 6 ואיור 7).
- נרמל נתונים באמצעות TIC או נורמליזציה מתאימה להדמיה.
- זהה פסגות m/z המתואמות מרחבית עם אזורי עניין. הפעל מתאם מרחבי (R > 0.65) בהדמיית HD כדי לזהות שיאים משותפים.
- חפש זיהוי שומנים משוער של פסגות אלה עם LipidMaps16 ו-METASPACE17.
- אשר הערות שומנים עם נתוני LC-MS הבאים. השתמש ב-Metaboanalyst לניתוח סטטיסטי של נתוני LC-MS.
תוצאות
פרוטוקולי ההדמיה שתוארו לעיל שימשו לשני מחקרים ראשוניים: עיצוב מחדש של אוטם שריר הלב (MI) והזדקנות כלי הדם. לצורך ניסויי הלב בוצע ניתוח קבוע לקשירת עורקים כליליים על מנת לגרום לאוטם שריר הלבהחריף 18,19. אולטרסאונד 4D ו-MALDI MSI בוצעו בהדרגה על אות?...
Discussion
הדמיה בארה"ב יכולה להיות תלויה במפעיל, אך השימוש בציוני דרך אנטומיים והכשרה מתאימה יכולים להגביל את הטיית המשתמש. אולטרסאונד דו-ממדי רגיש במיוחד לשונות בין משתמשים מכיוון שהנופים תלויים בזווית, בעוד ש-4DUS פחות רגיש מכיוון שהרכישה מקיפה את כל הנפח ואינה תלויה בזווית. כמו כ...
Disclosures
קרייג ג'יי גרגן הוא יועץ בתשלום של FUJIFILM VisualSonics.
Acknowledgements
אליסון ג'ונס נתמכת על ידי מלגת בוגר המחלקה להנדסה מכנית, אווירונאוטיקה וחלל וביו-רפואית של אוניברסיטת טנסי. המחקר שדווח בפרסום זה (קונר ארל) נתמך על ידי המכון הלאומי ללב, ריאות ודם של המכונים הלאומיים לבריאות F30HL162452. התוכן הוא באחריות המחברים בלבד ואינו מייצג בהכרח את העמדות הרשמיות של המכונים הלאומיים לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid (DHB) | Supelco, >99.0% (HPLC) | 85707-10MG-F | DHB matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sigma/85707?cm_sp=Insite-_-wimsShippingEmailRecs_wims EmailAPI_wimsGruCrossEntropy-_-wimsEmailAPI10-3 |
| 9-aminoacridine (9AA) | Supelco, ≥99.5% (HPLC) | 92817-1G | 9-Aminoacridine matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sial/92817?srsltid=AfmBOooiQjQ4pWv_XxITkU 4Lkm0UnHXKekGS_ dFl7V40V9QLWoPpNLoc |
| Aquasonic Ultrasound Gel | Parker Laboratories | Parker 01-02 | Ultrasound Gel; https://www.parkerlabs.com/products/aquasonic-100-ultrasound-transmission-gel/ |
| Benchtop Dewar Flasks | ThermoScientific | 4150-2000 | Container for liquid nitrogen; https://www.thermofisher.com/order/catalog/product/4150-4000?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sQVc2f-NxN04Nb5Mv F6TZ7GLHWWDEeqDYmEvtKJSQ YHDeVgZ9qylvYaAs27EALw_wcB &source=google_shopping&ISO_ CODE=us&LANG_CODE=en&ef_id =Cj0KCQjwpvK4BhDUARIsADHt9 sQVc2f-NxN04Nb5MvF6TZ7GLHWWDE eqDYmEvtKJSQYHDeVgZ9qylvYa As27EALw_wcB:G:s&s_kwcid=AL!3652 !3!716188292869!!!g!2366243726129 !!21787513085!171591181194&ev_chn =shop&cid=0se_gaw_30092024_ PBYTXL&source=google_shopping &ISO_CODE=us&LANG_CODE= en&gad_source=1 |
| Cryostat | Leica Biosystems | CM Series | https://www.leicabiosystems.com/us/histology-equipment/cryostats/ |
| Dessicator | VWR | 89054-052 | https://us.vwr.com/store/product/9104882/desiccator-plastic-ace-glass-incorporated |
| Epredia MX35 Premier Disposable Low-profile Microtome Blades | Fisher Scientific | 3052835 | Cryostat blade; https://www.fishersci.com/shop/products/mx35-premier-disposable-low-profile-microtome-blades/3052835 |
| Falcon 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | Conical Tubes; https://www.fishersci.com/shop/products/falcon-15ml-conical-centrifuge-tubes-5/1495953A?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sSBcy5n-lhShligJUOX5KKVGn0bt87 8AB2_muOD2PPTue1phpZgeqwa AqgiEALw_wcB&ef_id=Cj0KCQjw pvK4BhDUARIsADHt9sSBcy5n-lhS hligJUOX5KKVGn0bt878AB2_muO D2PPTue1phpZgeqwaAqgiEALw_ wcB:G:s&ppc_id=PLA_goog_20861 45674_81843405034_1495953A__ 386247001345_165426395473886 37329&ev_chn=shop&s_kwcid=AL!4428!3 !386247001345!!!g!856907751004!& gad_source=1 |
| Flex-Tubes Microcentrifuge Tubes | Eppendorf | EP022364120 | Centrifuge tubes; https://www.sigmaaldrich.com/US/en/product/sigma/ep022364120?utm_source=google%2Cgoogle&utm _medium=organicshopping%2Ccpc&utm _campaign=21043330280&utm_ content=&gclid=Cj0KCQjwpv K4BhDUARIsADHt9sTHRD35k CHPtfI2A41axodnMVr6a1eBKk zM4bSUYQAyfEKo3UgTAEQa Ap7wEALw_wcB |
| Gas Nitrogen | Airgas | N/A | |
| Glass microscope slides | Electron Microscopy Sciences | 71873-02 | https://www.emsdiasum.com/positive-charge-microscope-slides |
| Liquid Nitrogen | Airgas | N/A | |
| Mass Spectrometer | Waters | Synapt G2-Si | https://www.waters.com/waters/en_US/SYNAPT-G2-Si-Mass-Spectrometry/nav.htm?locale=en_mkcid=1000251Foodety%3C/a%3E&cid=134740653&bcid= 134528734 |
| Matrix Sprayer | HTX Technologies | M3+ | https://www.htximaging.com/htx-m3-sprayer |
| Methanol (HPLC), >99.9% | Fisher Chemical | A4524 | Methanol; https://www.fishersci.com/shop/products/methanol-hplc-fisher-chemical-9/A4524?crossRef=A4524#?keyword=A4524 |
| Preclinical Ultrasound System | FUJIFILM VisualSonics | Vevo 3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100; Vevo F2 has replaced the Vevo 3100 in production. System includes isoflurane vaporizer and induction box. |
| Reynolds Wrap | N/A | N/A | Aluminum foil |
| Signagel Electrode Gel | Parker Laboratories | Parker 15-60 | Electrode Conducting Gel; https://www.parkerlabs.com/products/signagel-electrode-gel/ |
| Sterile Lubricating Jelly | Medline | MDS032273Z | Lubricating Gel; https://www.medline.com/ce/product/Sterile-Lubricating-Jelly/Lubricating-Jelly/Z05-PF03664?sku=MDPMDS032273H |
| Surgical instruments: scissors, forceps/tweezers, sutures | Fine Science Tools | 11252-00, 11050-10, 14016-14, 14084-08, 15000-08 | info@finescience.com |
| Surgical Sponges 200 Pack –Gauze Pads Non sterile -First Aid Wound Care Dressing Sponge –Woven Medical Nonstick, Non Adherent Mesh Scrubbing | Medpride | B08RZGQ5GW | Gauze; https://www.amazon.com/Medpride-Surgical-Sponges-200-Pack/dp/B08RZGQ5GW/ref=asc_df_B08RZGQ5GW/?tag=hyprod-20&linkCode=df0&h vadid=693270340506&hvpos= &hvnetw=g&hvrand=960915122 2290977669&hvpone=&hvptwo= &hvqmt=&hvdev=c&hvdvcmdl=& hvlocint=&hvlocphy=9192978&hv targid=pla-1245491514869&psc= 1&mcid=33f4d647c88630c79116 888d565a63b0 |
| Tissue-Plus O.C.T. Compound | Fisher Scientific | 23-730-571 | OCT; https://www.fishersci.com/shop/products/tissue-plus-o-c-t-compound-2/23730571 |
| Wood Handled Cotton Swabs and Applicators | Fisherbrand | 22-363-160 | Cotton swab; https://www.fishersci.com/shop/products/wood-handled-cotton-swabs-applicators-8/p-7146852 |
References
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: A report from the American Heart Association. Circulation. 145 (8), E153-E639 (2022).
- Kassab, G. S. Biomechanics of the cardiovascular system: The aorta as an illustratory example. J R Soc Interface. 3 (11), 719-740 (2006).
- Moore, J. E., Xu, C., Glagov, S., Zarins, C. K., Ku, D. N. Fluid wall shear stress measurements in a model of the human abdominal aorta: Oscillatory behavior and relationship to atherosclerosis. Atherosclerosis. 110 (2), 225-240 (1994).
- Nerem, R. M. Vascular fluid mechanics, the arterial wall, and atherosclerosis. J Biomech Eng. 114 (3), 274 (1992).
- Cecchi, E., et al. Role of hemodynamic shear stress in cardiovascular disease. Atherosclerosis. 214 (2), 249-256 (2011).
- Good, B. The influence of blood composition and loading conditions on the behavior of embolus analogs. J Mech Behav Biomed Mater. 140, 105738 (2023).
- Bao, G., et al. Molecular biomechanics: The molecular basis of how forces regulate cellular function NIH public access. Mol Cell Biomech. 3 (2), 91-105 (2010).
- Schwamborn, K., Caprioli, R. M. Molecular imaging by mass spectrometry-looking beyond classical histology. Nat Rev Cancer. 10 (9), 639-646 (2010).
- Soepriatna, A. H., Kevin Yeh, A., Clifford, A. D., Bezci, S. E., O'Connell, G. D., Goergen, C. J. Three-dimensional myocardial strain correlates with murine left ventricular remodelling severity post-infarction. J R Soc Interface. 16 (160), 20190570 (2019).
- Damen, F. W., et al. High-frequency 4-dimensional ultrasound (4DUS): A reliable method for assessing murine cardiac function. Tomography. 3 (4), 180-187 (2017).
- McDonald, R., Poulos, D., Gutzwiller, L., Sheth, R. A., Good, B., Crouch, A. C. A MALDI mass spectrometry imaging sample preparation method for venous thrombosis with initial lipid characterization of lab made and murine clots. J Am Soc Mass Spectrom. 34 (9), 1879-1889 (2023).
- Benetos, A., et al. Influence of age, risk factors, and cardiovascular and renal disease on arterial stiffness: Clinical applications. Am J Hypertens. 15 (12), 1101-1108 (2002).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. C. Murine echocardiography and ultrasound imaging. J Vis Exp. (42), v2100 (2010).
- Bellantuono, I., et al. A toolbox for the longitudinal assessment of healthspan in aging mice. Nat Protoc. 15 (2), 540-574 (2020).
- Henriques, F. C., Moritz, A. R. Studies of thermal injury: I. The conduction of heat to and through skin and the temperatures attained therein. A theoretical and an experimental investigation. Am J Pathol. 23 (4), 530 (1947).
- Conroy, M. J., et al. LIPID MAPS: Update to databases and tools for the lipidomics community. Nucleic Acids Res. 52 (D1), D1677-D1682 (2024).
- Palmer, A., et al. FDR-controlled metabolite annotation for high-resolution imaging mass spectrometry. Nat Methods. 14 (1), 57-60 (2016).
- Michael, L. H., et al. Myocardial ischemia and reperfusion: A murine model. Am J Physiol. 269 (6 Pt 2), H2147-H2154 (1995).
- Clark, J. E., Flavell, R. A., Faircloth, M. E., Davis, R. J., Heads, R. J., Marber, M. S. Post-infarction remodeling is independent of mitogen-activated protein kinase kinase 3 (MKK3). Cardiovasc Res. 75 (3), 523-530 (2007).
- Hattori, Y., Konno, H., Abe, M., Miyoshi, H., Goto, T., Makabe, H. Synthesis, determination of the absolute configuration of tonkinelin, and inhibitory action with bovine heart mitochondrial complex I. Bioorg Med Chem. 15 (8), 3026-3031 (2007).
- Golam Mostofa, M., et al. CLIP and cohibin separate rDNA from nucleolar proteins destined for degradation by nucleophagy. J Cell Biol. 217 (8), 2675-2690 (2018).
- Chan, J. N. Y., Poon, B. P. K., Salvi, J., Olsen, J. B., Emili, A., Mekhail, K. Perinuclear cohibin complexes maintain replicative life span via roles at distinct silent chromatin domains. Dev Cell. 20 (6), 867-879 (2011).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. Am J Physiol Heart Circ Physiol. 322 (3), H359-H372 (2022).
- Kaya, I., Sämfors, S., Levin, M., Borén, J., Fletcher, J. S. Multimodal MALDI imaging mass spectrometry reveals spatially correlated lipid and protein changes in mouse heart with acute myocardial infarction. J Am Soc Mass Spectrom. 31 (10), 2133-2142 (2020).
- Tressler, C., et al. Factorial design to optimize matrix spraying parameters for MALDI mass spectrometry imaging. J Am Soc Mass Spectrom. 32 (12), 2728 (2021).
- Zhang, L., et al. Vascular lipidomics analysis reveals increased levels of phosphocholine and lysophosphocholine in atherosclerotic mice. Nutr Metab. 20 (1), 1-16 (2023).
- Kohno, M., et al. Induction by lysophosphatidylcholine, a major phospholipid component of atherogenic lipoproteins, of human coronary artery smooth muscle cell migration. Circulation. 98 (4), 353-359 (1998).
- Crouch, A. C., Batra, A., Greve, J. M. Hemodynamic response to thermal stress varies with sex and age: A murine MRI study. Int J Hyperthermia. 39 (1), 69-80 (2022).
- Crouch, A. C., Scheven, U. M., Greve, J. M. Cross-sectional areas of deep/core veins are smaller at lower core body temperatures. Physiol Rep. 6 (16), e13839 (2018).
- Crouch, A. C., Castle, P. E., Fitzgerald, L., Scheven, U. M., Greve, J. M. Assessing structural and functional response of murine vasculature to acute β-adrenergic stimulation in vivo during hypothermic and hyperthermic conditions. Int J Hyperthermia. 36 (1), 1136-1145 (2019).
- Crouch, A. C., Manders, A. B., Cao, A. A., Scheven, U. M., Greve, J. M. Cross-sectional area of the murine aorta linearly increases with increasing core body temperature. Int J Hyperthermia. 34 (7), 1121-1133 (2018).
- Clift, C. L., Mehta, A., Drake, R. R., Angel, P. M. Multiplexed imaging mass spectrometry of histological staining, N-glycan and extracellular matrix from one tissue section: A tool for fibrosis research. Methods Mol Biol. 2350, 313-329 (2021).
- Salehi, H. S., et al. Coregistered photoacoustic and ultrasound imaging and classification of ovarian cancer: Ex vivo and in vivo studies. J Biomed Opt. 21 (4), 046006 (2016).
- Verbeeck, N., et al. Connecting imaging mass spectrometry and magnetic resonance imaging-based anatomical atlases for automated anatomical interpretation and differential analysis. Biochim Biophys Acta. 1865 (7), 967-977 (2017).
- Yang, E. Y., et al. Real-time co-registration using novel ultrasound technology: Ex vivo validation and in vivo applications. J Am Soc Echocardiogr. 24 (7), 720 (2011).
- Maris, L., et al. Method for co-registration of high-resolution specimen PET-CT with histopathology to improve insight into radiotracer distributions. EJNMMI Phys. 11 (1), 1-20 (2024).
- Lin, B. J., et al. MSIr: Automatic registration service for mass spectrometry imaging and histology. Anal Chem. 95 (6), 3317-3324 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved