JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐 심혈관 리모델링에 대한 다중 모드 연구: 4차원 초음파 및 질량 분석 이미징
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 쥐 심혈관계의 생체 역학 및 생체 분자 변화를 평가하기 위해 생체 내 4차원 초음파 이미징 및 생체 외 질량 분석 이미징을 사용하는 프로토콜에 대해 설명합니다. 이 기술은 수술로 유도된 심근경색의 심장 리모델링과 노화 동물의 혈관 변화를 분석하는 데 적용됩니다.
초록
심혈관 질환(CVD)은 미국에서 가장 큰 사망 원인입니다. 심혈관계의 손상은 환경 노출, 외상, 약물 독성 또는 기타 여러 요인으로 인해 발생할 수 있습니다. 그 결과, 심장 조직과 혈관 조직은 구조적 변화를 겪게 되고 기능이 저하됩니다. 손상과 그에 따른 리모델링은 장기 수준에서는 초음파(US) 이미징으로, 분자 수준에서는 질량 분석 이미징(MSI)으로 감지하고 정량화할 수 있습니다. 이 원고는 쥐 심장 병태생리학을 연구하고, 생체 내 4차원(4D) 초음파 이미징 및 분석을 심장의 MADLI(ex vivo matrix-assisted laser desorption/ionization) MSI와 결합하기 위한 혁신적인 방법론을 설명합니다. 4D 초음파는 전체 심장 주기에 걸쳐 방사형 변위, 표면적 변형 및 종방향 변형을 포함한 동적 체적 측정을 제공할 수 있습니다. 혈관 구조에서는 MSI와 초음파를 사용하여 혈관 벽 구성, 혈류역학 및 혈관 벽 역학을 평가합니다. 이 방법론은 관심 있는 기능적 지표를 조정하거나 특정 분자를 표적으로 하는 다양한 MALDI MSI 프로토콜을 조정하여 수많은 CV 질환을 연구하도록 맞춤화할 수 있습니다. MALDI MSI는 지질, 작은 대사 산물, 펩타이드 및 글라이칸을 연구하는 데 사용할 수 있습니다. 이 프로토콜은 비표적 지질체학 분석을 위한 MALDI MSI의 사용과 심혈관 혈류역학 및 생체 역학을 위한 초음파 이미징의 사용을 간략하게 설명합니다.
서문
심혈관 질환(CVD)은 전 세계적으로 주요 사망 원인입니다1. CVD의 예방 및 치료를 위해서는 생체 역학적 힘에 대한 분자 적응과 그에 따른 기계적 특성의 변화에 대한 심층적인 이해가 필요합니다. 전체 심혈관계에서 생체역학적 힘은 조직의 기능과 구조에 중요한 역할을 합니다2. 심혈관 조직의 기계적 특성은 이러한 힘의 영향을 받아 건강과 질병의 지표가 됩니다 3,4,5,6. CVD를 예방, 진단 및 치료하기 위해서는 질병의 시작과 진행 과정을 이해하고 관찰할 수 있는 방법을 개발하는 것이 중요합니다. 생체 의학 이미징은 생리학적 및 기계론적 통찰력을 생성하는 데 핵심적인 역할을 해 왔으며 새로운 이미징 기술과 분석 기법이 지속적으로 개발되고 있습니다. 이 프로토콜은 허혈성 심장 질환 및 혈관 노화에서 이러한 이미징 양식의 잠재력을 검증하기 위해 두 가지 심혈관 이미징 및 분석 기술을 결합하는 방법론을 보여줍니다.
생체 역학 분야의 연구자들은 종종 생체 내, 생체 외 및 인실리코 방법의 조합을 통해 생체 역학 연구에 접근합니다. 분자 생체 역학에 대한 이전 연구는 주로 단백질7 (특히 생체 역학적 특성에 미치는 영향 때문에 특히 세포 외 기질 단백질인 콜라겐 및 엘라스틴)에 중점을 두었으며, 생체 내 이미징 생체 역학과 분자 연구를 결합하기 위한 작업은 조직학 및 면역조직화학에 국한되었습니다. 이러한 접근법은 많은 분자 지표를 산출할 수 있고 ECM 및 세포의 리모델링에 대해 제안된 메커니즘을 산출할 수 있지만, 일반적으로 각각 현재 사용 가능한 염색 또는 항체로 제한됩니다. 이 연구 분야에는 지질과 같은 큰 종류의 분자가 빠져 있습니다. 이러한 분자 부류는 기계론적으로 관련될 수도 있고 그렇지 않을 수도 있지만, 이러한 분자는 진단 마커와 치료제 모두에 대한 잠재적 표적이 될 수 있기 때문에 결과적인 분자 적응을 이해하는 것이 중요합니다. 액체 크로마토그래피-질량 분석법(LC-MS)과 같은 분석 화학 기술을 적용할 수 있습니다. 그러나 이러한 기술에서 분자의 공간적 방향은 손실됩니다. 질량 분석 이미징(MSI)을 사용하면 분자의 공간적 분포가 그대로 유지되며 여러 분석물 유형(분자 부류)을 연속 절편으로 이미지화할 수 있습니다. MSI는 대사 산물, 지질, 글라이칸, 펩타이드 및 저분자량 약물을 포함한 생물학적 조직에서 거의 모든 유형의 분자의 공간 분포를 조사하는 강력한 분석 도구입니다8. MALDI(Matrix-assisted laser desorption/ionization) MSI는 50-8000Da 범위의 분자량에 대한 발견 기반 분석에 매우 적합한 MSI 유형입니다. MALDI-MSI는 레이저 에너지 흡수 매트릭스를 샘플에 적용하여 관심 분석물의 이온화를 돕는 이온화 기술입니다. 이 접근 방식은 하나의 분자 표적에 국한되지 않고 생물정보학 도구를 사용하여 어떤 분자가 생체 역학적 특성과 리모델링에 영향을 미치는지 결정할 수 있습니다.
4차원 초음파(4DUS)는 심장의 시간적, 공간적 특성화에 유용한 비침습적 생체 내 방법입니다. 4DUS는 서로 다른 평면의 일련의 높은 프레임 속도 시네 루프를 활용하여 시간 정보를 포함하는 3D 데이터 세트로 컴파일합니다. 이를 통해 기존 2D 심초음파에 필요한 기하학적 가정에 의존하지 않고 심장 주기에 걸쳐 심실의 복잡한 3D 모양 변화를 직접 시각화하고 정량화할 수 있습니다. 4DUS는 심장의 복잡한 모양과 움직임으로부터 생체 내 기능 지표를 계산할 수 있으며, 9,10 MALDI MSI는 생체 외 심장 조직 내의 생물학적 분자에 대한 공간 연구를 허용합니다 11. CVD로 인한 심장의 변화를 완전히 이해하려면 기계적 메커니즘과 분자적 메커니즘을 모두 조사해야 합니다. 따라서 쥐 심장 병태생리학을 연구하기 위한 결합된 방법론이 제안되었으며, 4DUS 이미징 및 분석을 심장 내 지질의 MALDI MSI와 결합합니다. 이 방법론은 심근 경색의 쥐 모델에서 입증되었습니다.
혈관 생체 역학은 또한 심혈관 기능을 조절하는 데 중요한 역할을 합니다2. 노화와 관련된 혈관 경직은 CVD12의 위험 인자입니다. 혈관의 생체역학적, 혈역학적 변화는 초음파를 사용하여 이미지화할 수 있습니다. 혈관 벽의 분자 구성은 생체 역학의 중요한 구성 요소이며 혈역학적 힘에 매우 민감합니다. 예를 들어, 진동벽 전단 응력은 죽상경화성 플라크 발달과 관련이 있습니다3. 노화 동물의 혈관 역학 및 혈류역학에 대한 예비 데이터는 이후에 제시될 것입니다.
이 팀은 다양한 질병 상태에서 생체 역학과 분자 구성 사이의 관계에 관심이 있습니다. 전임상 초음파 영상 및 MSI는 조직 내 분자 변화의 공간적 분포와 질병 진행 중에 발생하는 관련 생체 역학적 변화를 결정하는 데 사용됩니다. 이 보고서는 이러한 방법론을 자세히 설명하고 심장 및 두경부의 혈관 구조에 대한 예비 데이터를 제공합니다.
프로토콜
설명된 동물 실험은 테네시 대학교 녹스빌 기관 동물 관리 및 사용 위원회의 승인을 받아 수행됩니다.
1. 초음파 이미징13
- 설정 및 동물 준비
- 실험을 시작하기 전에 이소플루란 마취 수준을 확인하고 필요한 경우 다시 채웁니다. 가스를 켜기 전에 산소 탱크 수위를 확인하십시오. 숯의 무게를 달아 용기에 기록하십시오.
- 이미징 플랫폼 근처에 소모품을 배치하여 이미징 공간을 설정합니다. 공급품에는 미리 절단된 테이프, 제모 크림, 거즈, 면봉, 오토클레이브 물, 각막 윤활제, 윤활 젤, 직장 온도 프로브, 전극 리드, 초음파 젤, 전극 젤(해당되는 경우) 및 열 램프가 포함됩니다(그림 1A).
- 초음파 기계를 켜고 모터를 초기화합니다(시스템은 4DUS 이미지 데이터도 수집할 수 있음). 초음파 시스템에서 새로운 실험 설정: 새 연구 또는 새 시리즈 를 선택하고 마우스 정보를 입력합니다. 생리학적 모니터링을 위해 태블릿을 켭니다.
- 스톱콕을 확인하여 흐름이 인덕션 박스에 열려 있고 노즈 콘에 닫혀 있는지 확인하십시오. 기화기에서 산소를 1L/min으로 켜고 다이얼을 3%-5%로 돌려 마취 유도 상자를 미리 채웁니다.
- 하우징 케이지에서 마우스를 제거합니다.
- 동물이 3%-5% 사이의 이소플루란으로 완전히 마취될 때까지 마우스를 유도 상자에 넣습니다.
- 스톱콕을 전환하여 초음파 이미징 플레이트의 노즈콘으로 흐름을 변경합니다. 이소플루란 다이얼을 1%-2% 사이로 돌립니다.
- 인덕션 박스에서 마우스를 제거하고 동물의 무게를 잰다. 동물의 체중을 기록합니다.
- 이미징 플레이트의 누운 위치에 마우스를 놓습니다.
- 동물의 눈에 각막 윤활제를 바르십시오.
- 털이 있는 경우 시중에서 판매하는 제모 크림과 면봉을 사용하여 이미징 영역에서 털을 제거합니다. 스펀지에 물을 묻혀 피부에 묻은 크림을 닦아내면 피부에 남아 있는 제모 크림을 제거하고 화상을 예방할 수 있습니다.
- 동물의 위치에 따라 가슴과 뒷다리의 양쪽에 심전도(ECG) 리드를 피하로 삽입합니다.
- 삽입되면 ECG 리드를 테이프로 제자리에 고정합니다. ECG 리드를 사용하지 않는 경우(즉, ECG 리드가 삽입되지 않은 경우) 동물 이미징 플레이트를 통해 ECG를 모니터링합니다.
- 피부에서 플레이트로 전기 전도를 하려면 플레이트에서 전도성 젤을 찾아 동물의 팔다리를 제자리에 고정합니다.
- 플레이트 주위와 팔다리 위에 테이프나 탄성 밴드를 놓아 동물의 팔다리를 제자리에 고정합니다(그림 1B).
- 윤활 젤을 사용하여 직장 온도 프로브를 삽입하고 프로브를 테이프로 고정합니다.
- 태블릿에서 ECG, 호흡 및 온도 신호를 확인합니다. 심박수가 ~350-600bpm, 호흡이 ~50-100호흡/분, 직장 온도가 35-37°C인지 확인하십시오. 필요에 따라 이소플루란 수치를 조정합니다.
- 필요한 경우 열 l을 켭니다.amp(예: 250W 적외선 온난화 전구)14 높이를 조정하여 심부 온도를 유지합니다(그림 1C).
- 열 램프를 동물로부터 12인치 이상 떨어지지 않게 하십시오. 전구와 동물 사이의 최적 거리를 결정하기 위한 초기 연구의 경우 높이를 조정하고 적외선 온도계를 사용하여 피부 온도를 기록하며, 이는 42°C를 초과해서는 안 됩니다15.
- 심장 4D 초음파
- 변환기를 홀더의 반 잠금 위치에 놓습니다.
- 변환기의 돌출된 점을 화면의 파란색 점과 함께 향하게 합니다. 관례는 동물의 오른쪽을 향해 점을 배치하는 것입니다.
- 변환기를 돌려 꼬리 방향을 가리키는 돌출된 노치가 있는 마우스의 시상면을 따라 향하도록 합니다.
- 초음파 플레이트 바닥에 있는 레버를 사용하여 동물을 기울입니다. 변환기 바닥에 있는 레버를 사용하여 변환기 각도를 조정합니다.
- 피부 표면과 변환기 사이의 음향 결합을 위해 흉강의 복부 표면에 충분한 양의 초음파 젤을 바르십시오. 커플링하기 전에 남아 있는 털이 없는지 확인하십시오.
- 초음파 젤과 접촉하도록 변환기를 내립니다.
- 플레이트 바닥에 있는 X/Y 노브로 미세 조정을 하거나 큰 조정을 위해 전체 플레이트를 이동합니다.
- 보다 정확한 단축 이미지를 위해 흉골 주위 장축 보기에 정점, 좌심실 유출로 및 대동맥이 화면에 수평으로 정렬되어 있는지 확인합니다(그림 2A, B).
- 아래쪽 모서리에서 이미지 이름을 선택하여 이미지를 현재 시리즈에 저장합니다.
- 변환기를 시계 방향으로 90° 회전하여 흉골 주위 단축 view(그림 2C).
참고: 최상의 4D 이미지 품질을 위해 사용자는 항상 흉골과 직접 평행하지 않은 심실의 흉골 주위 장축을 따라 스테퍼 모터를 정렬해야 합니다. 심장/좌심측은 종종 왼쪽 아래쪽 각도에 위치합니다. - 좌심실이 화면 오른쪽에 표시되고 우심실이 화면 왼쪽에 있는지 확인합니다(그림 2D).
- 마우스의 호흡 리듬이 안정적인 경우 이미지의 왼쪽 상단 모서리에 있는 심전도 상자를 눌러 4D 이미지에 대한 호흡 게이팅을 켭니다. 안정적이지 않은 경우 후처리 중에 이 단계를 완료합니다.
- 화면의 왼쪽 상단 모서리에 있는 큐브를 선택하여 4D 이미지를 설정합니다.
- 변환기의 시작 및 중지 위치를 조정하기 전에 변환기를 재설정하십시오.
- Start position( 시작 위치)을 정점 바로 아래로, Stop position(중지 위치)을 대동맥궁(aortic arch)으로 조정합니다.
- 단계 크기를 0.08-0.13mm로 설정하고 프레임 속도를 200-300Hz로 설정합니다.
참고: 단계 크기가 작을수록 분석을 위한 이미지 해상도가 더 좋아질 수 있지만 획득 시간이 늘어납니다. 데이터가 거의 완벽한 좌심실 정렬로 수집되고 분석 중에 최소한의 방향 전환이 필요하지 않은 경우 더 큰 단계 크기가 허용됩니다. 심박수가 더 높은 동물과 작업할 때는 >450bpm을 높이는 것이 좋습니다. - 스캔을 하기 전에 활력 징후와 EKG 신호가 일관되게 안정적(>350bpm 및 50resp/min 이상의 호흡)인지 확인하십시오.
- 스캔 및 처리가 완료되면 후처리를 위한 EKV/4D 데이터 저장 및 호흡 게이팅 을 켭니다.
- 오른쪽 하단에서 이미지 이름 지정을 선택하고 이름에 마우스 ID를 포함합니다.
- 이미지 품질을 확인하려면 추가 컨트롤을 누르고 4D로 로드를 선택합니다.
- 심장의 각 평면도를 검토하여 심장의 중심이 심장 주기 전반에 걸쳐 움직이지 않는지 확인합니다. 중심의 움직임은 심전도 및/또는 호흡기 게이팅의 가변성을 나타내므로 분석 과정을 복잡하게 만듭니다. 모니터를 다시 조정하고 필요한 경우 스캔을 반복합니다.
- 심장 4D 초음파 분석
- 스터디 브라우저로 이동합니다. 모든 B-Mode 2D 이미지를 Vevo Lab으로 내보내고 ".raw" 데이터 형식을 선택하여 하드 드라이브로 4D 데이터를 다른 파일 형식으로 내보냅니다.
참고: 이 작업에 사용된 4D 그래픽 사용자 인터페이스 도구 상자는 현재 공개적으로 사용할 수 없습니다. 액세스 및 자세한 지침을 요청하려면 Purdue University의 Craig Goergen 박사에게 문의하십시오. - VevoLab 소프트웨어를 사용하여 4D 데이터의 대체 분석을 수행할 수 있습니다. 이 프레임워크를 사용하려면 컴퓨터에서 Vevo Lab 파일로 4D 데이터를 내보냅니다.
- 스터디 브라우저로 이동합니다. 모든 B-Mode 2D 이미지를 Vevo Lab으로 내보내고 ".raw" 데이터 형식을 선택하여 하드 드라이브로 4D 데이터를 다른 파일 형식으로 내보냅니다.
- 혈관 영상
- 경동맥의 B-모드 영상의 경우, 초음파 변환기를 경동맥과 평행하게 정중선 근처에 배치합니다.
- 경동맥이 보이면 트랜스듀서를 상부로 움직여 경동맥 분기점을 찾습니다.
- 경동맥 분기의 선명한 이미지가 발견되면 게인 설정을 35dB로 조정하고 B 모드 이미지를 캡처합니다.
- 변환기를 왼쪽이나 오른쪽으로 비스듬히 기울이면 이미지가 향상될 수 있습니다. 트랜스듀서 또는 스테이지의 각도를 조정하여 관심 용기가 트랜스듀서와 직접 평행하지 않도록 합니다. 이렇게 하면 도플러 각도가 60° 미만으로 유지될 수 있습니다. 그렇지 않으면 +/- 15° 이동이 필요할 수 있습니다.
- 펄스파파 도플러 모드로 전환하여 속도 측정값을 얻습니다.
- 샘플 부피를 용기 중앙에 놓습니다. 커서가 경동맥과 평행이 되도록 커서의 각도를 조정합니다. 그런 다음 재생을 눌러 속도 측정을 시작하고 저장 하여 기록합니다.
- 경정맥의 B-모드 영상의 경우, 초음파 변환기를 경정맥과 평행하게 놓습니다. 경정맥은 경동맥의 앞쪽과 측면에 있습니다.
- 경정맥이 위치하면 경정맥의 내부와 외부가 합쳐지는 위치로 변환기를 이동합니다. 선명한 이미지가 발견되면 게인 설정을 35dB로 조정하고 B 모드 이미지를 캡처합니다.
- 펄스파파 도플러 모드로 전환하여 속도 측정값을 얻습니다.
- 샘플 부피를 용기 중앙에 놓습니다. 경정맥과 평행이 되도록 커서 각도를 조정합니다. 그런 다음 재생을 눌러 속도 측정을 시작하고 저장 하여 기록합니다.
- 혈관 초음파 분석
- B-모드 이미지와 펄스파파 도플러 측정값을 수집한 후 소프트웨어를 사용하여 직경과 속도를 측정합니다.
- 이미지가 소프트웨어에 로드되면 혈관 패키지를 선택합니다.
- 용기의 각 면을 선택하여 전체 지름을 구합니다.
- 경동맥의 경우, 혈관 패키지의 직경 옵션을 사용하여 수축기와 이완기에서 직경을 측정합니다.
- vascular package의 velocity 옵션을 사용하여 속도를 측정합니다.
- 경동맥의 경우, 수축기에서 속도 측정을 위해 가장 높은 피크를 선택하고 이완기에서 속도를 측정하기 위해 가장 낮은 피크를 선택합니다.
- 지름의 값을 사용하여 다음 방정식을 사용하여 Green Lagrange 변형 텐서의 원주 성분을 계산합니다.
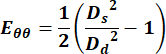 (1)
(1)
여기서 D s는 수축기 동안의 직경을 나타내고 Dd는 이완기 동안의 직경을 나타냅니다. - 경정맥의 경우, 사이클 전체의 모든 점을 선택하여 속도 측정값을 얻습니다.
2. 안락사와 조직 적출
- 급속 동결 조직을 위해 알루미늄 호일 보트를 준비합니다(그림 3).
- 연구가 끝나면 5% 농도의 이소플루란 과다 투여와 양측 기흉 또는 자궁 경부 탈구(심장 검사만 해당)로 동물을 안락사시킵니다.
- 집게를 사용하여 피부를 막고, 혈관 구조를 위해 목에 가위로 텐트를 치거나 심장을 위해 흉골 바로 아래를 자릅니다.
- 피부와 근육층을 잘라 혈관 구조를 드러내거나 뼈를 잘라 심장을 드러냅니다.
- 면봉으로 둔기를 해부하여 심장이나 혈관 구조를 지방을 포함한 주변 조직으로부터 분리하십시오. 경동맥 혈관과 신경을 분리해야 합니다. 수술 도구를 사용하여 심장과 혈관을 제거합니다.
참고: 봉합사는 혈관을 제거하기 전에 근위부 및 원위부를 봉합하여 혈관 구조를 제거하는 데 사용할 수 있습니다. - 미리 라벨링된 알루미늄 호일 보트에 티슈를 놓고 보트를 액체 질소에 넣습니다(그림 3).
- 동결 절편 시간까지 조직을 -80 °C에서 보관하십시오. 온도를 유지하기 위해 드라이 아이스로 조직을 운반하십시오.
3. 질량 분석 이미징
- 극저온 절편 및 최적 절단 온도(OCT) 장착 유리 슬라이드에
- 저온 유지 온도를 -25 °C로 설정하고 블레이드를 삽입합니다.
- OCT를 바르고 저온 유지 장치에서 동결시켜 금속 척을 준비합니다.
- OCT를 사용하여 준비된 금속 척에 하트 바닥을 고정합니다(그림 4A). OCT는 질량 스펙트럼(폴리에틸렌 글리콜[PEG] 오염)을 오염시키고 관심 있는 지질 신호를 억제하므로 OCT가 관심 샘플 영역에 닿지 않도록 하십시오.
알림: 시편 오염을 방지하기 위해 물 장착을 수행하는 옵션. 지침은 아래의 추가 프로토콜을 참조하십시오. - 이 방법론에서 공간 정렬의 중요성에 따라 MATLAB GUI에서 제공하는 심장의 스케일링된 디지털 렌더링을 사용하여 단면화를 안내합니다(그림 4B).
- 절단하는 동안 각 회전(10μm)을 세고 슬라이드에 장착할 각 슬라이스의 깊이를 밀리미터 단위로 기록하십시오.
참고: MATLAB에서 제공하는 초음파 데이터의 디지털 렌더링과 정확하게 일치시키기 위해 심장 또는 혈관 구조의 특정 위치를 추적해야 합니다. - 조직 절편(10μm 두께)을 현미경 슬라이드에 해동 장착합니다.
참고: 슬라이드 유형은 사용되는 질량 분석기에 따라 다릅니다. 각 슬라이드에는 심장의 각 영역에서 하나의 섹션이 포함되어 있습니다. 최소 3개의 슬라이드가 필요합니다(양이온 모드, 음이온 모드, 추가). - n = 1/group의 경우, 장축을 통해 심장을 절단하여 정점에서 기저부까지의 분자 변화를 시각화합니다.
- 혈관 구조의 경우, 조직을 젤라틴에 삽입하고 절편11 전에 급속 동결합니다.
- 질량 분석 이미징 실험이 있을 때까지 -80°C에서 슬라이드 메일러에 슬라이드를 보관하십시오.
- 지질 또는 대사 산물을 추가로 식별하고 정량화하기 위해 액체 크로마토그래피-질량 분석법(LC-MS)을 수행하는 경우 ~60-100μm의 연속 조직 절편을 절단하고 동결하기 전에 0.5-2mL 튜브에 수집합니다.
- 유리 슬라이드에 동결 절편 및 물 장착 티슈
- 비커에 고성능 액체 크로마토그래피(HPLC) 물을 채우고 5mL 및 1mL 주사기를 따로 보관합니다.
- 저온 유지 온도를 -25 °C로 설정하고 블레이드를 삽입합니다.
- 장착하기 전에 집게 한 쌍을 저온 유지 장치에 넣어 식히십시오.
- 주사기에 HPLC 물 5mL를 추출하여 저온 유지 장치에 넣습니다.
- 주사기가 완전히 얼기 직전에 금속 척에 물을 비우고 완전히 얼리십시오.
- HPLC 물 1mL를 추출하고 주사기를 저온 유지 장치에 넣습니다.
- 약 30-60초 후 척 중앙에 부분적으로 응고된 물의 작은 점을 놓습니다. 즉시 집게로 심장을 잡고 완전히 얼기 전에 점에 넣으십시오. 주변 물이 완전히 얼 때까지 심장을 제자리에 고정하십시오.
참고: 심장은 관심 지역에 따라 정점 또는 베이스로 장착될 수 있습니다. 이 연구에서는 정점이 바깥쪽을 향하도록 베이스를 장착합니다. - 이 메서드의 나머지 단계는 3.1단계에 설명된 대로 수행합니다.
- 매트릭스 적용
- 냉동실에서 슬라이드를 제거하고 슬라이드가 마를 때까지 데시케이터에 넣습니다.
- HTX M3+ 분무기를 켜고 노트북에서 HTX 앱을 연 다음 화면 중앙에서 방법을 선택합니다. 표준 매트릭스 농도는 저장된 방법(화면 왼쪽의 방법 > OI_usermethods > 매트릭스)에서 찾을 수 있습니다.
- 이 작업을 위해 노즐 온도를 75°C로, 유속을 100μL/min으로, 압력을 10psi로 설정합니다.
- 시료 이름, 극성, 매트릭스, 용매 및 농도를 실험실 노트에 기록하십시오. 농도당 필요한 매트릭스의 양을 계산합니다(예: 10mg/mL에서 5mL = 매트릭스 50mg).
- 용매를 만듭니다(예: 70% MeOH).
- 이 작업을 위해 포지티브 모드의 경우 40mg/mL 2,5-디하이드록시벤조산(DHB) 매트릭스 용액을 준비하고 네거티브 모드의 경우 10mg/mL 9-아미노아크리딘(9AA) 매트릭스 용액을 준비합니다. 70% MeOH 용매로 두 매트릭스를 모두 만듭니다. 다른 일반적인 매트릭스 및 스프레이 매개변수의 경우 3.3.2단계를 따르십시오.
- 매트릭스의 무게를 측정하고 매트릭스를 15mL 원뿔형 튜브에 추가합니다. 금액이 3.3.3단계에서 계산된 필수 금액에 가까운지 확인하지만 정확할 필요는 없습니다. 측정된 질량을 기준으로 용매 양을 계산합니다.
- 피펫을 사용하여 원뿔형 튜브에 용매를 추가합니다.
알림: 부피는 3.3.5단계에서 측정한 질량을 기준으로 합니다. - 혼합물을 10분 동안 초음파 처리합니다. 매트릭스가 초음파 처리되는 동안 데시케이터에서 슬라이드를 제거합니다.
- 분무기 트레이를 열고 슬라이드를 왼쪽 하단 모서리에 놓고 가장자리를 테이프로 감습니다.
알림: 테이프의 한쪽 끝을 접어 쉽게 제거할 수 있습니다. - 샘플 스프레이 영역을 선택합니다. 트레이를 닫습니다.
- 주사기와 필터를 사용하여 매트릭스를 주사기에 붓고 주사기를 통해 매트릭스를 분무기 왼쪽에 검은색 뚜껑이 있는 바이알로 필터링합니다.
- 바이알을 분무기의 제자리에 다시 놓고 D-line 튜브를 바이알에 삽입합니다.
알림: 튜브가 바이알 바닥에 닿지 않고 액체에 완전히 잠겨 있는지 확인하십시오. - 불활성 가스를 켜고 분무기의 게이지가 10psi를 가리키는지 확인합니다. 시작을 누릅니다. 분무기가 원하는 온도에 도달하면 깜박이는 시작을 선택합니다.
- 스프레이가 완료되면 트레이를 열고 샘플을 제거한 다음 MALDI 슬라이드 홀더에 넣거나 데시케이터에 다시 넣습니다(그림 4C).
- MALDI 슬라이드 홀더를 스캔하고 스캐너를 밀어 넣거나 휴대폰으로 사진을 찍습니다. MSI와 함께 사용할 수 있도록 플래시 드라이브에 사진을 저장합니다.
- 분무기에서 적절한 세척 또는 다음 스프레이 를 선택하십시오. 세척하는 경우 매트릭스 바이알에서 폐기물 비커로 D-라인을 이동합니다.
- 트레이에 메탄올을 뿌리고 닦아 청소합니다. 질소를 끕니다.
- 말디 MSI
- 컴퓨터에서 Synapt로 이동하여 극성이 필요한 모드로 변경되었는지 확인하고 그렇지 않은 경우 전환합니다.
- MALDI 소스의 기기에 슬라이드를 로드하고 소프트웨어를 사용하여 컴퓨터의 로드 버튼을 클릭합니다.
- 이미지(1.2.17단계)를 Project 폴더의 Images 폴더로 이동합니다.
- HD Imaging으로 이동하여 이전 프로젝트(동일한 매트릭스를 사용하는 프로젝트)를 엽니다.
- 실험실 노트북에서 질량 범위, 트랩 및 전달 충돌 에너지, 레이저 에너지, 음극/POS 모드를 기록합니다.
- HD Imaging에서 흰색 페이지 아이콘으로 이동합니다. 그런 다음 드롭다운 화살표를 클릭하고 새 플레이트를 선택합니다.
- 프로젝트 폴더 > 이미지 폴더에서 이미지를 찾아 엽니다.
- 플레이트 유형을 MALDI 표준 으로 변경하고 플레이트의 가장자리를 정의합니다(아래 빨간색 더하기 기호로 표시된 4개의 모서리 선택).
참고: 왼쪽 상단 상자는 각 모서리로 이동하기 위한 것입니다. 오른쪽 상단 상자는 모서리를 선택하기 위한 것입니다. 아래쪽 상자는 전체 슬라이드를 시각화하기 위한 것입니다. - 왼쪽 상단 모서리에 있는 작은 패턴 탭으로 이동하여 연필 또는 기타 사각형 또는 원 옵션을 클릭하여 조직의 윤곽을 그립니다. 왼쪽 클릭과 오른쪽 클릭을 사용하여 조직의 윤곽을 그려 완료합니다.
- 픽셀 크기는 기본적으로 50μm입니다. 필요한 경우 변경합니다.
- 다른 이름으로 저장을 클릭하고 Project Imaging AcqFolder 및 레이블을 슬라이드 이름(YYYYMMDD 형식)으로 이동합니다. 그런 다음 저장합니다.
- 상단 중앙에 있는 Mass Lynx 버튼을 클릭하여 Mass Lynx로 내보냅니다.
- Mass Lynx 소프트웨어로 이동합니다.
- 파일을 클릭하여 프로젝트 폴더를 >. 슬라이드의 파일 이름과 텍스트 이름을 편집합니다(YYYYMMDD 형식).
- MS 파일을 마우스 오른쪽 버튼으로 클릭하고 현재 슬라이드를 찾아 선택합니다.
- MS 파일을 다시 마우스 오른쪽 버튼으로 클릭하고 편집을 클릭합니다. 파란색 상자를 마우스 왼쪽 버튼으로 두 번 클릭합니다.
- 검사 조건으로 이동합니다. 소스 설정을 찾고 사용자 정의로 변경합니다. 그런 다음 현재 슬라이드> 가져온 폴더 >> 올바른 프로젝트 폴더로 이동합니다.
- Save as(다른 이름으로 저장)를 클릭하여 저장하고 슬라이드 이름을 포함합니다.
- 기준 화합물(예: 적린)을 사용하여 기기를 보정합니다.
- Synapt(보정)로 이동합니다. 재생 버튼을 클릭하여 데이터 수집을 시작합니다. YYYYMMDD_cal1로 레이블을 지정합니다(예: 20230614_cal1).
- 50 - 2000과 동일한 질량 범위를 갖는지 확인합니다. 레이저 에너지는 약 175가 될 수 있습니다.
- 발사 레이저 재생을 누르고 다음 버튼을 클릭합니다. 약 15 또는 20으로 실행하십시오. 빨간색 정지를 클릭합니다.
- W Console로 이동합니다.
- 보정을 생성하고 시작을 클릭합니다. 캘리브레이션 프로파일 편집기에서 파일 > 새로 만들기를 클릭합니다. YYYYMMDD_cal1를 입력합니다.
- 질량 범위를 프로젝트에 대해 원하는 질량 범위(예: 50-2000)로 편집합니다.
- 수동 보정을 선택합니다. 해상도 모드를 선택하고 편집을 클릭합니다. 적린을 참조 화합물로 선택합니다.
- 원시 데이터 파일을 클릭하고 맨 아래로 스크롤합니다(방금 가져온 파일이어야 함).
- 하단의 기록으로 이동하여 Acc mass > ok > okay를 선택합니다.
- 시작 버튼이 나타날 때까지 다음을 계속 클릭하고 확인을 누르고 시작을 누르십시오.
- 녹색 확인 표시로 이동하여 어떤 피크가 발견되지 않았는지 확인합니다.
- Mass Lynx로 이동합니다(실험 샘플에 대한 실제 실행 시작).
- 재생 버튼을 누르고 샘플 수가 올바른지 확인하십시오.
- HD 이미징으로 이동합니다.
- 픽셀 크기가 원래 설정된 크기인지 확인합니다.
- Synapt로 이동하여 극성을 확인합니다.
- 카메라 버튼을 클릭하여 카메라가 움직이고 레이저를 발사하는지 확인합니다.
- 데이터를 수집하고 있는지 확인하고 확인합니다. 획득한 질량 스펙트럼은 Synapt 페이지에 표시되어야 합니다.
- MS 분석
- 분석을 위해 HD 이미징 소프트웨어와 Mass Lynx를 사용합니다.
- HD Imaging의 프로세스 탭을 사용하여 이미징 데이터를 처리합니다.
- MS 이미지라고도 하는 분자 이온 이미지를 Analysis 탭의 HD Imaging으로 시각화합니다. 분자 이온 이미지의 히트 맵은 영역에 대한 m/z 이온의 강도를 보여줍니다(그림 5). MS 이미지의 오버레이를 사용하여 분자의 공간적 분포를 표시합니다(그림 6 및 그림 7).
- TIC 또는 이미징을 위한 적절한 정규화를 사용하여 데이터를 정규화합니다.
- 관심 영역과 공간적으로 상관관계가 있는 m/z 피크를 식별합니다. HD Imaging에서 공간 상관관계(R > 0.65)를 실행하여 공동 국소화된 피크를 식별합니다.
- LipidMaps16 및 METASPACE17을 사용하여 이러한 피크의 추정 지질 식별을 검색합니다.
- 후속 LC-MS 데이터로 지질 주석을 확인합니다. LC-MS 데이터의 통계 분석을 위해 Metaboanalyst를 사용합니다.
결과
위에서 설명한 이미징 프로토콜은 심근 경색(MI) 리모델링과 혈관 노화의 두 가지 예비 연구에 사용되었습니다. 심장 실험의 경우, 급성 심근경색을 유발하기 위해 영구적인 관상동맥 결찰 수술을 시행했다18,19. 4D 초음파와 MALDI MSI는 동일한 조직에서 점진적으로 수행되어 생리학적, 분자적 변화를 밝혔습니다. 경색된 심장의 대...
토론
미국 이미징은 작업자에 따라 달라질 수 있지만 해부학적 랜드마크를 사용하고 적절한 교육을 받으면 사용자 편향을 제한할 수 있습니다. 2D 초음파는 보기가 각도에 따라 달라지기 때문에 사용자 간 변동성에 특히 취약한 반면, 4DUS는 획득이 전체 볼륨을 포함하며 각도에 독립적이기 때문에 덜 민감합니다. 또한 조정 가능한 동물 플랫폼과 변환기 홀더로 인해 이미지 재?...
공개
크레이그 괴르겐(Craig J. Goergen)은 후지필름 비주얼소닉스(FUJIFILM VisualSonics)의 유료 컨설턴트입니다.
감사의 말
Allison Jones는 University of Tennessee, Mechanical, Aerospace & Biomedical Engineering Department Graduate Fellowship의 지원을 받고 있습니다. 이 간행물(Conner Earl)에 보고된 연구는 미국 국립보건원(National Institutes of Health F30HL162452)의 국립 심장, 폐 및 혈액 연구소(National Heart, Lung, and Blood Institute)의 지원을 받았습니다. 이 내용은 전적으로 저자의 책임이며 반드시 미국 국립보건원(National Institutes of Health)의 공식 견해를 나타내는 것은 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid (DHB) | Supelco, >99.0% (HPLC) | 85707-10MG-F | DHB matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sigma/85707?cm_sp=Insite-_-wimsShippingEmailRecs_wims EmailAPI_wimsGruCrossEntropy-_-wimsEmailAPI10-3 |
| 9-aminoacridine (9AA) | Supelco, ≥99.5% (HPLC) | 92817-1G | 9-Aminoacridine matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sial/92817?srsltid=AfmBOooiQjQ4pWv_XxITkU 4Lkm0UnHXKekGS_ dFl7V40V9QLWoPpNLoc |
| Aquasonic Ultrasound Gel | Parker Laboratories | Parker 01-02 | Ultrasound Gel; https://www.parkerlabs.com/products/aquasonic-100-ultrasound-transmission-gel/ |
| Benchtop Dewar Flasks | ThermoScientific | 4150-2000 | Container for liquid nitrogen; https://www.thermofisher.com/order/catalog/product/4150-4000?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sQVc2f-NxN04Nb5Mv F6TZ7GLHWWDEeqDYmEvtKJSQ YHDeVgZ9qylvYaAs27EALw_wcB &source=google_shopping&ISO_ CODE=us&LANG_CODE=en&ef_id =Cj0KCQjwpvK4BhDUARIsADHt9 sQVc2f-NxN04Nb5MvF6TZ7GLHWWDE eqDYmEvtKJSQYHDeVgZ9qylvYa As27EALw_wcB:G:s&s_kwcid=AL!3652 !3!716188292869!!!g!2366243726129 !!21787513085!171591181194&ev_chn =shop&cid=0se_gaw_30092024_ PBYTXL&source=google_shopping &ISO_CODE=us&LANG_CODE= en&gad_source=1 |
| Cryostat | Leica Biosystems | CM Series | https://www.leicabiosystems.com/us/histology-equipment/cryostats/ |
| Dessicator | VWR | 89054-052 | https://us.vwr.com/store/product/9104882/desiccator-plastic-ace-glass-incorporated |
| Epredia MX35 Premier Disposable Low-profile Microtome Blades | Fisher Scientific | 3052835 | Cryostat blade; https://www.fishersci.com/shop/products/mx35-premier-disposable-low-profile-microtome-blades/3052835 |
| Falcon 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | Conical Tubes; https://www.fishersci.com/shop/products/falcon-15ml-conical-centrifuge-tubes-5/1495953A?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sSBcy5n-lhShligJUOX5KKVGn0bt87 8AB2_muOD2PPTue1phpZgeqwa AqgiEALw_wcB&ef_id=Cj0KCQjw pvK4BhDUARIsADHt9sSBcy5n-lhS hligJUOX5KKVGn0bt878AB2_muO D2PPTue1phpZgeqwaAqgiEALw_ wcB:G:s&ppc_id=PLA_goog_20861 45674_81843405034_1495953A__ 386247001345_165426395473886 37329&ev_chn=shop&s_kwcid=AL!4428!3 !386247001345!!!g!856907751004!& gad_source=1 |
| Flex-Tubes Microcentrifuge Tubes | Eppendorf | EP022364120 | Centrifuge tubes; https://www.sigmaaldrich.com/US/en/product/sigma/ep022364120?utm_source=google%2Cgoogle&utm _medium=organicshopping%2Ccpc&utm _campaign=21043330280&utm_ content=&gclid=Cj0KCQjwpv K4BhDUARIsADHt9sTHRD35k CHPtfI2A41axodnMVr6a1eBKk zM4bSUYQAyfEKo3UgTAEQa Ap7wEALw_wcB |
| Gas Nitrogen | Airgas | N/A | |
| Glass microscope slides | Electron Microscopy Sciences | 71873-02 | https://www.emsdiasum.com/positive-charge-microscope-slides |
| Liquid Nitrogen | Airgas | N/A | |
| Mass Spectrometer | Waters | Synapt G2-Si | https://www.waters.com/waters/en_US/SYNAPT-G2-Si-Mass-Spectrometry/nav.htm?locale=en_mkcid=1000251Foodety%3C/a%3E&cid=134740653&bcid= 134528734 |
| Matrix Sprayer | HTX Technologies | M3+ | https://www.htximaging.com/htx-m3-sprayer |
| Methanol (HPLC), >99.9% | Fisher Chemical | A4524 | Methanol; https://www.fishersci.com/shop/products/methanol-hplc-fisher-chemical-9/A4524?crossRef=A4524#?keyword=A4524 |
| Preclinical Ultrasound System | FUJIFILM VisualSonics | Vevo 3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100; Vevo F2 has replaced the Vevo 3100 in production. System includes isoflurane vaporizer and induction box. |
| Reynolds Wrap | N/A | N/A | Aluminum foil |
| Signagel Electrode Gel | Parker Laboratories | Parker 15-60 | Electrode Conducting Gel; https://www.parkerlabs.com/products/signagel-electrode-gel/ |
| Sterile Lubricating Jelly | Medline | MDS032273Z | Lubricating Gel; https://www.medline.com/ce/product/Sterile-Lubricating-Jelly/Lubricating-Jelly/Z05-PF03664?sku=MDPMDS032273H |
| Surgical instruments: scissors, forceps/tweezers, sutures | Fine Science Tools | 11252-00, 11050-10, 14016-14, 14084-08, 15000-08 | info@finescience.com |
| Surgical Sponges 200 Pack –Gauze Pads Non sterile -First Aid Wound Care Dressing Sponge –Woven Medical Nonstick, Non Adherent Mesh Scrubbing | Medpride | B08RZGQ5GW | Gauze; https://www.amazon.com/Medpride-Surgical-Sponges-200-Pack/dp/B08RZGQ5GW/ref=asc_df_B08RZGQ5GW/?tag=hyprod-20&linkCode=df0&h vadid=693270340506&hvpos= &hvnetw=g&hvrand=960915122 2290977669&hvpone=&hvptwo= &hvqmt=&hvdev=c&hvdvcmdl=& hvlocint=&hvlocphy=9192978&hv targid=pla-1245491514869&psc= 1&mcid=33f4d647c88630c79116 888d565a63b0 |
| Tissue-Plus O.C.T. Compound | Fisher Scientific | 23-730-571 | OCT; https://www.fishersci.com/shop/products/tissue-plus-o-c-t-compound-2/23730571 |
| Wood Handled Cotton Swabs and Applicators | Fisherbrand | 22-363-160 | Cotton swab; https://www.fishersci.com/shop/products/wood-handled-cotton-swabs-applicators-8/p-7146852 |
참고문헌
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: A report from the American Heart Association. Circulation. 145 (8), E153-E639 (2022).
- Kassab, G. S. Biomechanics of the cardiovascular system: The aorta as an illustratory example. J R Soc Interface. 3 (11), 719-740 (2006).
- Moore, J. E., Xu, C., Glagov, S., Zarins, C. K., Ku, D. N. Fluid wall shear stress measurements in a model of the human abdominal aorta: Oscillatory behavior and relationship to atherosclerosis. Atherosclerosis. 110 (2), 225-240 (1994).
- Nerem, R. M. Vascular fluid mechanics, the arterial wall, and atherosclerosis. J Biomech Eng. 114 (3), 274 (1992).
- Cecchi, E., et al. Role of hemodynamic shear stress in cardiovascular disease. Atherosclerosis. 214 (2), 249-256 (2011).
- Good, B. The influence of blood composition and loading conditions on the behavior of embolus analogs. J Mech Behav Biomed Mater. 140, 105738 (2023).
- Bao, G., et al. Molecular biomechanics: The molecular basis of how forces regulate cellular function NIH public access. Mol Cell Biomech. 3 (2), 91-105 (2010).
- Schwamborn, K., Caprioli, R. M. Molecular imaging by mass spectrometry-looking beyond classical histology. Nat Rev Cancer. 10 (9), 639-646 (2010).
- Soepriatna, A. H., Kevin Yeh, A., Clifford, A. D., Bezci, S. E., O'Connell, G. D., Goergen, C. J. Three-dimensional myocardial strain correlates with murine left ventricular remodelling severity post-infarction. J R Soc Interface. 16 (160), 20190570 (2019).
- Damen, F. W., et al. High-frequency 4-dimensional ultrasound (4DUS): A reliable method for assessing murine cardiac function. Tomography. 3 (4), 180-187 (2017).
- McDonald, R., Poulos, D., Gutzwiller, L., Sheth, R. A., Good, B., Crouch, A. C. A MALDI mass spectrometry imaging sample preparation method for venous thrombosis with initial lipid characterization of lab made and murine clots. J Am Soc Mass Spectrom. 34 (9), 1879-1889 (2023).
- Benetos, A., et al. Influence of age, risk factors, and cardiovascular and renal disease on arterial stiffness: Clinical applications. Am J Hypertens. 15 (12), 1101-1108 (2002).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. C. Murine echocardiography and ultrasound imaging. J Vis Exp. (42), v2100 (2010).
- Bellantuono, I., et al. A toolbox for the longitudinal assessment of healthspan in aging mice. Nat Protoc. 15 (2), 540-574 (2020).
- Henriques, F. C., Moritz, A. R. Studies of thermal injury: I. The conduction of heat to and through skin and the temperatures attained therein. A theoretical and an experimental investigation. Am J Pathol. 23 (4), 530 (1947).
- Conroy, M. J., et al. LIPID MAPS: Update to databases and tools for the lipidomics community. Nucleic Acids Res. 52 (D1), D1677-D1682 (2024).
- Palmer, A., et al. FDR-controlled metabolite annotation for high-resolution imaging mass spectrometry. Nat Methods. 14 (1), 57-60 (2016).
- Michael, L. H., et al. Myocardial ischemia and reperfusion: A murine model. Am J Physiol. 269 (6 Pt 2), H2147-H2154 (1995).
- Clark, J. E., Flavell, R. A., Faircloth, M. E., Davis, R. J., Heads, R. J., Marber, M. S. Post-infarction remodeling is independent of mitogen-activated protein kinase kinase 3 (MKK3). Cardiovasc Res. 75 (3), 523-530 (2007).
- Hattori, Y., Konno, H., Abe, M., Miyoshi, H., Goto, T., Makabe, H. Synthesis, determination of the absolute configuration of tonkinelin, and inhibitory action with bovine heart mitochondrial complex I. Bioorg Med Chem. 15 (8), 3026-3031 (2007).
- Golam Mostofa, M., et al. CLIP and cohibin separate rDNA from nucleolar proteins destined for degradation by nucleophagy. J Cell Biol. 217 (8), 2675-2690 (2018).
- Chan, J. N. Y., Poon, B. P. K., Salvi, J., Olsen, J. B., Emili, A., Mekhail, K. Perinuclear cohibin complexes maintain replicative life span via roles at distinct silent chromatin domains. Dev Cell. 20 (6), 867-879 (2011).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. Am J Physiol Heart Circ Physiol. 322 (3), H359-H372 (2022).
- Kaya, I., Sämfors, S., Levin, M., Borén, J., Fletcher, J. S. Multimodal MALDI imaging mass spectrometry reveals spatially correlated lipid and protein changes in mouse heart with acute myocardial infarction. J Am Soc Mass Spectrom. 31 (10), 2133-2142 (2020).
- Tressler, C., et al. Factorial design to optimize matrix spraying parameters for MALDI mass spectrometry imaging. J Am Soc Mass Spectrom. 32 (12), 2728 (2021).
- Zhang, L., et al. Vascular lipidomics analysis reveals increased levels of phosphocholine and lysophosphocholine in atherosclerotic mice. Nutr Metab. 20 (1), 1-16 (2023).
- Kohno, M., et al. Induction by lysophosphatidylcholine, a major phospholipid component of atherogenic lipoproteins, of human coronary artery smooth muscle cell migration. Circulation. 98 (4), 353-359 (1998).
- Crouch, A. C., Batra, A., Greve, J. M. Hemodynamic response to thermal stress varies with sex and age: A murine MRI study. Int J Hyperthermia. 39 (1), 69-80 (2022).
- Crouch, A. C., Scheven, U. M., Greve, J. M. Cross-sectional areas of deep/core veins are smaller at lower core body temperatures. Physiol Rep. 6 (16), e13839 (2018).
- Crouch, A. C., Castle, P. E., Fitzgerald, L., Scheven, U. M., Greve, J. M. Assessing structural and functional response of murine vasculature to acute β-adrenergic stimulation in vivo during hypothermic and hyperthermic conditions. Int J Hyperthermia. 36 (1), 1136-1145 (2019).
- Crouch, A. C., Manders, A. B., Cao, A. A., Scheven, U. M., Greve, J. M. Cross-sectional area of the murine aorta linearly increases with increasing core body temperature. Int J Hyperthermia. 34 (7), 1121-1133 (2018).
- Clift, C. L., Mehta, A., Drake, R. R., Angel, P. M. Multiplexed imaging mass spectrometry of histological staining, N-glycan and extracellular matrix from one tissue section: A tool for fibrosis research. Methods Mol Biol. 2350, 313-329 (2021).
- Salehi, H. S., et al. Coregistered photoacoustic and ultrasound imaging and classification of ovarian cancer: Ex vivo and in vivo studies. J Biomed Opt. 21 (4), 046006 (2016).
- Verbeeck, N., et al. Connecting imaging mass spectrometry and magnetic resonance imaging-based anatomical atlases for automated anatomical interpretation and differential analysis. Biochim Biophys Acta. 1865 (7), 967-977 (2017).
- Yang, E. Y., et al. Real-time co-registration using novel ultrasound technology: Ex vivo validation and in vivo applications. J Am Soc Echocardiogr. 24 (7), 720 (2011).
- Maris, L., et al. Method for co-registration of high-resolution specimen PET-CT with histopathology to improve insight into radiotracer distributions. EJNMMI Phys. 11 (1), 1-20 (2024).
- Lin, B. J., et al. MSIr: Automatic registration service for mass spectrometry imaging and histology. Anal Chem. 95 (6), 3317-3324 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유