Method Article
تعزيز الكفاءة وإنتاجية الوسم الإشعاعي للروابط المشعة الكربون 11 للبحوث السريرية باستخدام طريقة الحلقة
In This Article
Summary
يقدم هذا البروتوكول إجراء مفصلا لإعداد أربعة متتبعات إشعاعية للكربون 11 عن طريق "طريقة الحلقة" [11درجة مئوية] مثيلية. نصف إجراء تصنيع [11C] ER-176 ، مع بيانات لثلاثة متتبعات إشعاعية إضافية: [11C] MRB ، [11C] mHED ، و [11C] PiB. توفر طريقة الحلقة توليفا فعالا مع زيادة إنتاجية كيميائية إشعاعية ضد مثيلة وعاء التفاعل التقليدي [11درجة مئوية].
Abstract
يتطلب برنامج التصوير المقطعي بالإصدار البوزيتروني الناجح الذي يتضمن متتبعات الإشعاع الكربون 11 طرقا توليفية سريعة وفعالة وموثوقة ، مما يتطلب مجموعة سيكلوترون وكيمياء إشعاعية في الموقع ، بالإضافة إلى طاقم سريري مدرب على العمل في ظل القيود الفريدة للنويدات المشعة الكربون 11. تبحث هذه الدراسة في مزايا ومزايا "طريقة الحلقة" للمذيبات الأسيرة المتمثلة في وضع العلامات الإشعاعية على أربعة متتبعات باستخدام النويدات المشعة الكربون -11 ، مما ينتج عنها الروابط المشعة [11C] ER-176 و [11C] MRB و [11C] mHED و [11C] PiB.
تتم مقارنة "طريقة الحلقة" بالطريقة التقليدية القائمة على المفاعل لمثيلة الكربون 11 في سياق تصنيع نفس المتتبعات الإشعاعية على المنصة الآلية المتطابقة. علاوة على ذلك ، يتم تقديم نظرة عامة كاملة على إعداد البحث السريري لجهاز التتبع الإشعاعي [11C] ER-176. كما يتضح من إنتاج [11C] ER-176 ، أثبتت "طريقة الحلقة" للمذيبات الأسيرة للألكلة غير المتجانسة أنها أكثر كفاءة ، مع نقاء كيميائي إشعاعي ممتاز (99.6 ± 0.6٪ ، ن = 25) ، إنتاجية كيميائية إشعاعية أعلى وأكثر اتساقا (نهاية التخليق (EOS) = 5.4 ± 2.2 جيجابايت ، ن = 25) مقارنة بطريقة المفاعل (EOS = 1.6 ± 0.5 جيجابايت ، ن = 6) ، زيادة النشاط المولي (طريقة الحلقة = 194 ± 66 جيجابايت / ميكرومول ، ن = 25 ؛ طريقة المفاعل = 132 ± 78 جيجابايت / ميكرومول ، ن = 6) ، جنبا إلى جنب مع متوسط تسلسل تفاعل أقصر بمتوسط 5 دقائق.
Introduction
من بين الطرائق في التصوير الجزيئي ، يتميز التصوير المقطعي بالإصدار البوزيتروني (PET) في طريقة حل العمليات الكيميائية الحيوية المرتبطة بأهداف فسيولوجية محددة أو مناطق ذات أهمية1،2. يتم تسخير الحساسية المميزة والطبيعة غير الغازية للتصوير المقطعي بالإصدار البوزيتروني من أجل التصور في الجسم الحي والقياس الكمي للفيزيولوجيا المرضية للمرض ، وغالبا ما تكشف عن أهداف غير مرئية من خلال تقنيات التصوير التشريحي مثل التصوير المقطعي المحوسب (CT) 3 أو التصوير بالرنين المغناطيسي (MRI) 4. يرى التصوير الجزيئي المعاصر مزيجا من التصوير المقطعي بالإصدار البوزيتروني مع التصوير المقطعي المحوسب أو التصوير بالرنين المغناطيسي (التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب أو التصوير المقطعي بالإصدار البوزيتروني / التصوير بالرنين المغناطيسي ، على التوالي) ، والاستفادة من دقة التصوير عالي التباين في PET ومعلمات التصوير القابلة للقياس الكمي لتوفير خرائط تصحيح توهين عالية الدقة (PET / CT) ودقة مكانية محسنة (PET / MR) 5 ، والتغلب على بعض العقبات التي يمثلها التباين في الطاقات الحركية الأعلى للبوزيترونات من النويدات المشعة مثل الغاليوم -68 والروبيديوم -826. تقوم تقنيات التصوير المزدوجة هذه بتوجيه السمات المميزة لكل طريقة فردية ، مما يزود الأطباء أو الباحثين بثروة من الأفكار التشريحية والكيميائية الحيوية المسجلة بشكل مشترك في موضوعالدراسة 5.
إن التطبيق السريري لتقنية التصوير هذه واسع النطاق ، حيث يوفر تصورا وقياسا للعمليات الفسيولوجية على المستوى الجزيئي المتنوعة مثل استقلاب الجلوكوز7،8 ، وارتباط مستقبلات الناقل العصبي9 ، وتروية عضلة القلب10 ، والحالات العصبيةالمختلفة 11. خارج الاستخدام السريري ، تتماشى السمات المتأصلة في التصوير المقطعي بالإصدار البوزيتروني لتلعب دورا أساسيا في تطوير الأدوية التشخيصية والعلاجية ، مما يسمح بالقياس الكمي للمعلمات مثل إمكانات الربط (BP) ، والتوزيع الحيوي ، وحجم التوزيع (VT) ، وإشغال مستقبلات الدواء (RO٪) من خلال الملاحظة المباشرة لتفاعل علم الأدوية والحركية الدوائية والديناميكا الدوائية. وهذا بدوره يساهم في التحديدات، بما في ذلك ما إذا كان المركب يصل إلى هدف بتركيز جرعة فعالة (ED50)، ومدى الاختراق الفعال للحاجز الدموي الدماغي، والسلامة الأيضية للمركب، والجرعة المناسبة وفاصل الجرعات11.
عند تطوير مسبار مفيد لتصوير التصوير المقطعي بالإصدار البوزيتروني ، عند تحديد مؤشر حيوي مناسب واختيار رابط مرتبط ، فإن وضع العلامات الإشعاعية للجزيء الحيوي باستخدام نويدات مشعة PET مناسبة ينتج عن مسبار التتبع الإشعاعي لدراسة التصوير المقطعي بالإصدار البوزيتروني. من بين النويدات المشعة PET للتحقيق في الأسئلة البيولوجية أو الدوائية أو الطبية ، يوفر الكربون 11 مزيجا من التنوع الاصطناعي والخصائص الفيزيائية المواتية التي تتيح استخدامه على نطاق واسع عبر الجزيئات الحيوية المتنوعة والروابط المؤهلة6. مع انبعاث بوزيترون بنسبة 99.8٪ ونصف عمر 20.4 دقيقة12 ، يسمح الكربون 11 بإعطاء الموضوعات بشكل متكرر خلال فترات قصيرة مع السماح بتوليفات متعددة الخطوات. ومع ذلك ، فإن هذه المزايا تتطلب منشأة ذات قدرات السيكلوترون والكيمياء الإشعاعية في الموقع5.
تتطلب هذه المرافق طرق مثيلة موثوقة وقوية وقابلة للتكرار تمكن من وضع العلامات الإشعاعية لجزيئات السلائف ، غالبا باستخدام الركيزة المحبة للكهرباء [11 درجة مئوية] CH3I) أو [11C] ميثيل ثلاثي الفلات ([11C] CH3OTf)13. عادة ما يتم تكوين وحدة التخليق الإشعاعي ، كما يتم توفيرها من الشركة المصنعة ، لنهج وعاء التفاعل لتفاعلات المثيلة [11درجة مئوية] 14. يتضمن ذلك تبريد الوعاء من أجل الاحتفاظ الفعال [11درجة مئوية] باليودوميثان أو [11درجة مئوية] ميثيل ثلاثي الفلات عند التسليم ، وإغلاق الوعاء وتسخينه لتنفيذ التفاعل ، وإخماد ، ثم نقل المحتويات المتفاعلة إلى نظام كروماتوغرافيا سائلة عالية الأداء (HPLC) للتنقية شبه التحضيرية13. على الرغم من فعاليتها15 ، إلا أن هذه التقنية تقدم العديد من نقاط الفشل الهيكلية المحتملة ، بما في ذلك الحاجز القندرية والإبر وخطوط النقل المرتبطة بها.
وجهت الحاجة إلى طريقة مثيلة أكثر موثوقية وقابلية للتكرار الاستفسار والسعي إلى تعديل المذيبات الأسيرة للعديد من بروتوكولات تخليق الترابط الإشعاعي للكربون -11. يهدف هذا النهج إلى معالجة قيود طريقة أوعية التفاعل التقليدية مع الحفاظ على كفاءة وضع العلامات الراديوية أو تحسينها.
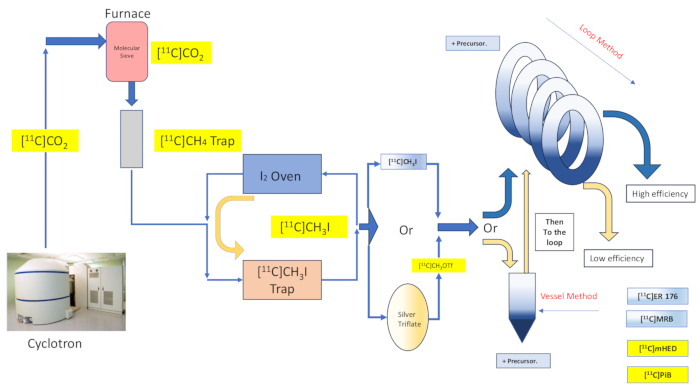
الشكل 2: تصميم وتدفق تخليق وعاء التفاعل وطريقة الحلقة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تقدم كيمياء المذيبات الأسيرة وعدا باصطياد كاشف الملصقات الراديوية والتفاعل معه بكفاءة عن طريق نشر محلول السلائف على مساحة كبيرة من مادة أو هيكل داعم ، ثم توجيه كاشف الملصقات الغازية إلى ملامسة المادة المطلية16،17. هذا يعزز مدى وجودة التلامس بين المرحلتين المتفاعلتين16،18. تم توثيق العديد من التطبيقات والاختلافات في هذه التقنية في وقت مبكر من عام 198516،17،18،19،20 ، وقد وجدت تطبيقا مع [11C] يوديد الميثيل ، [11C] ميثيل ثلاثي اللات ، بالإضافة إلى كاشف Grignard [11C] تفاعلات وضع العلامات الإشعاعية لثاني أكسيد الكربون20. تم تقديم مزيد من التحسين من خلال مناقشة كيمياء "طريقة الحلقة" للمذيبات الأسيرة ، الموصوفة في الأصل من قبل ويلسون وآخرون ، والتي لا تتطلب أي دعم إضافي لتلك التي توفرها بالفعل حلقة تنقية HPLC ، ولا تسخين أو تبريد بيئة التفاعل13. تم العثور على الملصقات الراديوية "طريقة الحلقة" للمذيبات الأسيرة لنقل تفاعلات المثيلة من اليودوميثان والميثيل ثلاثي الفلات [11درجة مئوية] مع مزايا الحد الأدنى من فقدان النقل ، والعائد الكيميائي الإشعاعي العالي ، والنشاط المولي العالي ، وانخفاض وقت التفاعل ، والبساطة7،21،22،23.
هنا نصف تنفيذ مجموعتنا ل "طريقة الحلقة" [11C] تقنية المثيلة التي وصفها ويلسون13 في الأصل ، وغيرها بعد ذلك14،15،18،21،22،23 ، (انظر الشكل 2) عن طريق التعديل الميكانيكي (انظر الشكل 3) لوحدة التوليف الخاصة بنا (يشار إليها فيما يلي باسم الوحدة). كانت هذه التعديلات الميكانيكية ، التي تربط بأكبر قدر ممكن من روح البساطة الطموحة ، ضئيلة ويمكن الوصول إليها ، مما أدى إلى تقليل التعقيد الهندسي بشكل عام ، وإضافة المكونات الأساسية فقط إلى تلك التي تم تركيبها بالفعل من قبل الشركة المصنعة للوحدة كما هي مرتبطة بترتيب وضع العلامات الراديوية لوعاء التفاعل الافتراضي. ينعكس هذا في قرار استخدام حلقة تنقية HPLC المصنوعة من الفولاذ المقاوم للصدأ التي تم توفيرها وتركيبها مسبقا من قبل الشركة المصنعة للوحدة ، كما هو موضح أدناه ، والتي أثبتت توافقها وفعاليتها مع التوليفات التي تم فحصها. نناقش ، بالتفصيل الكامل ، بروتوكول وضع العلامات الإشعاعية لطريقة الحلقة الكاملة والتي تم التحقق من صحتها المستخدم في إنتاج الأبحاث السريرية لتخليق المقتفي الإشعاعي [11C] - (R) -N-sec-butyl-4- (2-chlorophenyl) -N-methylquinazoline-2-carboxamide ، [11C] ER-176 (1) ، باستخدام الكربون -11 يودوميثان. علاوة على ذلك ، نقارن العديد من السمات المتعلقة بكفاءة وضع العلامات الراديوية كما تم إجراؤها بواسطة كل من طريقة المفاعل وطريقة الحلقة عبر ثلاثة روابط إشعاعية إضافية ، والتي تشمل (S ، S) - [11C] ميثيل ريبوكستين ([11C] MRB (2)) ، [11C] -meta-hydroxyephedrine ([11C] mHED (3)) ، و 2- [4- [(11C) methylamino] phenyl] -1،3-benzothiazol-6-ol ([11C] PiB (4)) التي تم تطويرها في منشأتنا، على النحو الذي يحدده تحليل الدفعات المركبة (انظر الجدول 1 والشكل 1 ). توضح هذه المقارنة النعمة الواضحة لمعلمات مثل العائد الكيميائي الإشعاعي والنشاط المولي المرتبط بتنفيذ الوسم الإشعاعي "طريقة الحلقة" ، والتي توفرها تعديلات الوحدة الميسرة والبسيطة بأقل تكلفة لمختبر الكيمياء الإشعاعية.
Protocol
ملاحظة: يتم تنفيذ جميع المعدات والتوليفات إما في خلية ساخنة محمية من الرصاص أو خلية صغيرة. تنبيه: يتم توليد الجسيمات الباعثة للبوزيترون عالية الطاقة واستخدامها من السيكلوترون. تتم مراقبة المنطقة باستخدام عدادات جيجر معايرة ، ويرتدي الأفراد حلقات وشارات قياس الجرعات الصادرة عن السلامة الإشعاعية. يتم تدريب جميع الموظفين على العمل مع المواد المشعة عالية الطاقة.
يتم إجراء جميع عمليات التوليف على وحدة نظيفة ومعقمة وفقا لإجراءات التشغيل القياسية الداخلية (SOP). تتضمن عملية التنظيف استخدام 1 نيوتن حمض الهيدروكلوريك والماء والأسيتون والأسيتونيتريل لجزء التفاعل من الوحدة. وفي الوقت نفسه ، يتم تنظيف جزء الصياغة من الوحدة وتعقيمها بالماء والإيثانول.
1. وضع العلامات الراديوية ل [11C] ER-176 (1) عن طريق طريقة الحلقة
ملاحظة: للحصول على قائمة بالمواد المستخدمة في إعداد [11C] ER-176 (1) ، يرجى الاطلاع على جدول المواد.
- أعد تركيب الوحدة النمطية لإنتاج طريقة الحلقة (انظر الشكل 4A-D). قم بتوصيل صمام V8 بوحدة تتصل مباشرة بحلقة HPLC. سيؤدي ذلك إلى تجاوز وعاء التفاعل.
- قم بتكييف فرن الميثان (CH4) عند 350 درجةمئوية لمدة 20 دقيقة مع تدفق غاز الهيدروجين 100 مل / دقيقة قبل جميع عمليات الإنتاج التي يتم إجراؤها على الوحدة. تبرد إلى 45 درجةمئوية قبل المتابعة.
- قم بتكييف مصيدة CH4 عند 120 درجة مئويةلمدة 20 دقيقة مع تدفق غاز الهيليوم 50 مل / دقيقة قبل جميع عمليات الإنتاج التي يتم إجراؤها على الوحدة. تبرد إلى 70 درجة مئويةقبل المتابعة.
- قم بتكييف مصيدة يوديد الميثيل عند 190 درجةمئوية لمدة 20 دقيقة بتدفق غاز الهيليوم 50 مل / دقيقة قبل جميع عمليات الإنتاج التي يتم إجراؤها على الوحدة. تبرد إلى 50 درجةمئوية قبل المتابعة.
- تحميل الكاشف للوحدة النمطية:
- باستخدام حقنة سعة 100 ميكرولتر ، قم بحقن الخليط التالي من خلال المحول في الموضع # 1 من حلقة HPLC الداخلية للصمام ذي الستة منافذ: (R) -N-sec-butyl-4- (2-chlorophenyl) -quinazoline -2-carboxamide (1.0 ± 0.05 mg) في ثنائي ميثيل سلفوكسيد -d 6 (100 ± 10 ميكرولتر) و 6 نيوتن هيدروكسيد الصوديوم (4 ميكرولتر).
ملاحظة: تم اختيار المذيبات المزيلة لتوافرها في شكل أمبولة ولأنها عادة ما يتم تقطيرها أثناء التصنيع ، مما يضمن خلوها من الماء. - قم بتحميل خزان V4 ب 3.0 مل من كلوريد الصوديوم 0.9٪ للحقن.
- قم بتحميل خزان V5 بسعة 1.0 مل من الإيثانول المقاوم للعيار 200.
- قم بتحميل خزان V6 ب 10 مل من الماء المعقم منزوع الأيونات.
- املأ قارورة الاستقبال الكبيرة ب 25 مل من الماء المعقم منزوع الأيونات.
- املأ قارورة التركيبة ب 6.0 مل من كلوريد الصوديوم 0.9٪ للحقن.
- تأكد من توصيل خط التسليم بقارورة معقمة للمنتج النهائي مجمعة مسبقا.
- تحضير المرحلة المتنقلة بمزيج 37:63 (حجم / حجم) من الأسيتونيتريل وهيدروكسيد الأمونيوم 20 مليمتر.
- قم بتكييف العمود شبه الإعدادي بأربعة أحجام أعمدة من المرحلة المتنقلة.
ملاحظة: العمود المستخدم هو عمود الطور العكسي C18 100 مم × 10 مم.
- باستخدام حقنة سعة 100 ميكرولتر ، قم بحقن الخليط التالي من خلال المحول في الموضع # 1 من حلقة HPLC الداخلية للصمام ذي الستة منافذ: (R) -N-sec-butyl-4- (2-chlorophenyl) -quinazoline -2-carboxamide (1.0 ± 0.05 mg) في ثنائي ميثيل سلفوكسيد -d 6 (100 ± 10 ميكرولتر) و 6 نيوتن هيدروكسيد الصوديوم (4 ميكرولتر).
- أثناء إعداد الوحدة الآلية ، قصف هدف الكربون 11 سيكلوترون (1٪ أكسجين ، 99٪ نيتروجين) على سيكلوترون 11 ميجا فولت عند 55 ميكرو أمبير لمدة 60-80 دقيقة على أهداف الحزمة المزدوجة لإنتاج [11درجة مئوية] ثاني أكسيد الكربون بواسطة التفاعل النووي 14نيوتن (ص ، α) 11درجة مئوية.
- قبل حوالي 20 دقيقة من تفريغ ثاني أكسيد الكربون [11درجة مئوية] من السيكلوترون إلى الوحدة النمطية، ابدأ القائمة الزمنية التي تم التحقق من صحتها لتوليف [11درجة مئوية]ER-176 بالنقر فوق زر البدء . اترك عمود CH4 يبرد إلى 45 درجةمئوية قبل استقبال ثاني أكسيد الكربون المشع [11درجة مئوية] (انظر الشكل 3). اترك مصيدة عمود الكربوسفير (مصيدة CH4 ) لتبرد إلى -75 درجةمئوية.
- دع الطريقة المضمنة في الوحدة لتحويل ثاني أكسيد الكربون [11درجة مئوية] إلى [11درجة مئوية] يوديد الميثيل ، عن طريق عملية الكيمياء الجافة ، تسير على النحو التالي:
- قم بتحويل نشاط ثاني أكسيد الكربون [11درجة مئوية] إلى [11درجة مئوية] الميثان عن طريق التفاعل مع غاز الهيدروجين عند 350 درجةمئوية فوق محفز النيكل (شيماليت - نيكل). استخدم مصيدة الأسكاريت (هيدروكسيد الصوديوم) للاحتفاظ بثاني أكسيد الكربون غير المحول [11درجة مئوية] والماء المكون.
- احتجاز الميثان المتشكل [11درجة مئوية] على مصيدة عمود كربوسفير (مصيدة CH4 ) عند -75 درجة مئويةلمزيد من التنقية والتركيز. لتحرير الميثان المحاصر [11درجة مئوية] ، قم بتسخين عمود الكربوسفير إلى 80 درجةمئوية.
- تفاعل الميثان المنقى [11درجة مئوية] مع عنصر اليود عند 720 درجةمئوية لتكوين [11درجة مئوية] يوديد الميثيل ([11درجة مئوية] CH3I) عن طريق مضخة غاز إعادة تدوير الهيليوم حيث يتم الاحتفاظ بيوديد الهيدروجين المتولد عن طريق مصيدة أخرى من الأسكاريت بينما يعود الميثان غير المحول [11C] إلى عملية الدوران.
- ضع [11درجة مئوية] CH3I المتشكل في درجة حرارة الغرفة على عمود يوديد الميثيل (MeI) الذي تراكم أثناء عملية إعادة التدوير.
- في نهاية عملية الدوران ، حرر [11درجة مئوية] CH3I المجمعة من مصيدة MeI عن طريق التسخين إلى 190 درجةمئوية تحت تدفق الهيليوم (15 مل / دقيقة) ، وتجاوزه من عمود MeTf ، وتوجيهه من خلال صمام فحص إلى حلقة الفولاذ المقاوم للصدأ سعة 1.5 مل تحتوي على محلول السلائف المحمل مسبقا (الخطوة 1.5.1).
- بمجرد أن يمر [11C] CH3I عبر الحلقة لمدة 180 ثانية ، قم بحقن خليط التفاعل على عمود HPLC شبه الإعدادي للتنقية. استخدم شروط HPLC التالية: المرحلة المتنقلة 37:63 (حجم / حجم) أسيتونيتريل: 20 ملي مولار هيدروكسيد الأمونيوم بمعدل تدفق 5.0 مل / دقيقة وطول موجي للأشعة فوق البنفسجية يبلغ 235 نانومتر. وقت الاستبقاء (tR) من [11درجة مئوية]ER-176: حوالي 12-14 دقيقة. انظر الشكل 5.
- اجمع عينة الكسر في قارورة استقبال كبيرة تحتوي على 25 مل من الماء المعقم منزوع الأيونات. قم بتحميل الخليط المخفف على خرطوشة استخراج الطور الصلب الخفيف C18 (SPE).
- اغسل المنتج (1) ب 10 مل إضافية من الماء المعقم منزوع الأيونات.
- قم بإزالة المنتج المطلوب من C18 Light SPE باستخدام الإيثانول 200 (1 مل). قم بتوجيه هذا الشطف إلى قارورة تركيبة محملة مسبقا بكلوريد الصوديوم 0.9٪ للحقن (6 مل).
- اشطف C18 Light SPE بسعة 3 مل إضافية من كلوريد الصوديوم 0.9٪ للحقن عبر خزان V4.
- اجمع المحلول النهائي في قارورة التركيبة (~ 10 مل) وقم بتمرير مرشح تعقيم 0.22 ميكرومتر إلى قارورة زجاجية معقمة مسبقا ، أبروجينيك ، USP من النوع الأول 50 مل ، مختومة بحاجز مطاطي ومجعد بغطاء من الألومنيوم.
- باستخدام أجهزة المعالجة عن بعد ، قم بإزالة حصة من قارورة المنتج النهائي كعينة لمراقبة الجودة (QC). إخضاع هذه العينة للعديد من اختبارات مراقبة الجودة لضمان التوافق مع المواصفات المقررة قبل الإفراج عنها وإعطائها للمريض (انظر الجدول 2).
ملاحظة: تطبيق إجراء طريقة الحلقة هذا باستخدام [11C] CH3I للوسم الإشعاعي ل (2) ؛ قم بإنشاء واستخدام [11C] CH3OTf لإنتاج (3) و (4) (انظر الملف التكميلي 1).- لمتابعة تحليل مراقبة الجودة النموذجي الذي تم إجراؤه في المنشأة ، استخدم أجهزة المعالجة عن بعد لنقل عينة من قارورة المنتج النهائي إلى حقنة السل ثم إلى غرفة مراقبة الجودة باستخدام حامل محمي من الرصاص.
- في منطقة محمية من الرصاص (L-block) ، قم بطرد العينة في أنبوب خال من البيروجين ، ثم قم بتوزيعها في قوارير زجاجية أصغر (50-100 ميكرولتر) لتحليلات HPLC وكروماتوغرافيا الغاز (GC).
- قم بتخفيف عينة ثانية بالماء الخالي من البيروجين إلى التركيز المناسب لتحليل السموم الداخلية البكتيرية.
- تلقيح عينة من محلول المنتج النهائي (في كل من مرق الصويا التريبتيك (TSB) ووسط الثيوغليكولات السائل (FTM) كعينة عقم). احتضان ومراقبة هذه العينات للنمو على مدار 14 يوما.
- ضع حصة صغيرة على شريط الأس الهيدروجيني لتحديد حموضة / قاعدية محلول المنتج النهائي بصريا.
2. طريقة وعاء التفاعل للوسم الإشعاعي ل [11C] ER-176 (1)
- تأكد من تنظيف الوحدة بالكامل وفقا لبروتوكول التنظيف الداخلي.
- استخدم 1 نيوتن حمض الهيدروكلوريك والماء والأسيتون والأسيتونيتريل لتنظيف جزء التفاعل من الوحدة ، والماء متبوعا بالإيثانول لتنظيف وتعقيم جزء التركيبة من الوحدة.
- قم بتكييف فرن الميثان (CH4) عند 350 درجةمئوية لمدة 20 دقيقة مع تدفق غاز الهيدروجين 100 مل / دقيقة قبل جميع عمليات الإنتاج التي يتم إجراؤها على الوحدة. تبرد إلى 45 درجةمئوية قبل المتابعة.
- قم بتكييف مصيدة CH4 عند 120 درجة مئويةلمدة 20 دقيقة مع تدفق غاز الهيليوم 50 مل / دقيقة قبل جميع عمليات الإنتاج التي يتم إجراؤها على الوحدة. تبرد إلى 70 درجة مئويةقبل المتابعة.
- قم بتكييف مصيدة MeI عند 190 درجةمئوية لمدة 20 دقيقة بتدفق غاز الهيليوم 50 مل / دقيقة قبل جميع عمليات الإنتاج. تبرد إلى 50 درجةمئوية قبل المتابعة. تأكد من توصيل أنبوب V8 بالإبرة الموجودة في الوعاء.
- قم بإجراء اختبار تسرب باستخدام غاز الهيليوم ، من صمام الاستقبال (V24 إلى V16) إلى حلقة MeI الداخلية ، ومن V8 إلى السفينة باستخدام V23 كمصدر للختم / العادم.
- تحميل الكاشف للوحدة النمطية:
- أضف ما يلي: (R) -N-sec - بوتيل - 4 - (2-كلوروفينيل) - كينازولين - 2 - كاربوكسميد (1.0 ± 0.05 ملغ) في ثنائي ميثيل سلفوكسيد - د6 (100 ± 10 ميكرولتر) و 6 نيوتن هيدروكسيد الصوديوم (4 ميكرولتر) إلى وعاء المفاعل.
- قم بتحميل خزان V2 ب 1.0 مل من 37:63 أسيتونيتريل: 20 ملي مولار هيدروكسيد الأمونيوم.
- قم بتحميل خزان V4 ب 3.0 مل من كلوريد الصوديوم 0.9٪ للحقن.
- قم بتحميل خزان V5 بسعة 1.0 مل من الإيثانول المقاوم للعيار 200.
- قم بتحميل خزان V6 ب 10 مل من الماء المعقم منزوع الأيونات.
- املأ قارورة الاستقبال الكبيرة ب 25 مل من الماء المعقم منزوع الأيونات.
- املأ قارورة التركيبة ب 6.0 مل من كلوريد الصوديوم 0.9٪ للحقن.
- تأكد من توصيل خط التسليم بقارورة المنتج النهائي المعقمة المجمعة مسبقا.
- املأ الخزان بمرحلة HPLC المتنقلة (37:63 (حجم / حجم) أسيتونيتريل: 20 ملي مولار هيدروكسيد الأمونيوم) وقم بتوصيله بمضخة HPLC.
ملاحظة: العمود شبه الإعدادي المستخدم هو نفسه كما هو مذكور أعلاه ومشروط مسبقا بالمرحلة المتنقلة (4 وحدات تخزين أعمدة).
- أثناء إعداد الوحدة الآلية ، قصف هدف الكربون 11 سيكلوترون (1٪ أكسجين ، 99٪ نيتروجين) على سيكلوترون 11 ميجا فولت عند 55 ميكرو أمبير لمدة 60-80 دقيقة على أهداف الحزمة المزدوجة لإنتاج [11درجة مئوية] ثاني أكسيد الكربون بواسطة التفاعل النووي 14نيوتن (ص ، α) 11درجة مئوية.
- قبل حوالي 20 دقيقة من تفريغ ثاني أكسيد الكربون [11درجة مئوية] من السيكلوترون إلى الوحدة النمطية، ابدأ القائمة الزمنية التي تم التحقق من صحتها لتوليف [11درجة مئوية]ER-176 بالنقر فوق زر البدء. اترك عمود CH4 يبرد إلى 45 درجةمئوية قبل استقبال ثاني أكسيد الكربون المشع [11درجة مئوية] (انظر الشكل 3). اترك مصيدة عمود الكربوسفير (مصيدة CH4) لتبرد إلى -75 درجة مئوية
- دع الطريقة المضمنة في الوحدة لتحويل ثاني أكسيد الكربون [11درجة مئوية] إلى [11درجة مئوية] يوديد الميثيل ، عن طريق عملية الكيمياء الجافة ، تسير على النحو التالي:
- قم بتحويل نشاط ثاني أكسيد الكربون [11درجة مئوية] إلى [11درجة مئوية] الميثان عن طريق التفاعل مع غاز الهيدروجين عند 350 درجةمئوية فوق محفز النيكل (شيماليت - نيكل). احتفظ بكل من ثاني أكسيد الكربون غير المحول [11درجة مئوية] والماء المشكل باستخدام مصيدة الأسكاريت (هيدروكسيد الصوديوم).
- احتباس [11درجة مئوية] الميثان على عمود كربوسفير عند -75 درجة مئويةلمزيد من التنقية والتركيز. لتحرير الميثان [11درجة مئوية] ، قم بتسخين عمود الكربوسفير إلى 80 درجةمئوية.
- تفاعل الميثان المنقى [11درجة مئوية] مع عنصر اليود عند 720 درجةمئوية لتشكيل [11درجة مئوية] يوديد الميثيل عن طريق مضخة غاز إعادة التدوير حيث يتم الاحتفاظ بالهيدروجين الناتج عن الحوادث بواسطة مصيدة أسكاريت أخرى بينما يعود الميثان غير المحول [11درجة مئوية] إلى عملية الدوران ، والتي تسمى إعادة تدوير الحلقة الداخلية.
- ضع يوديد الميثيل المتشكل [11درجة مئوية] في درجة حرارة الغرفة على عمود MeI الذي تراكم أثناء عملية إعادة التدوير.
- في نهاية عملية الدوران ، قم بتسخين مصيدة الماصة البوليمرية المسامية إلى 190 درجةمئوية تحت تدفق الهيليوم (30 مل / دقيقة) لإطلاق يوديد الميثيل المجمعة [11درجة مئوية] وتوجيهه من خلال صمام فحص إلى وعاء تفاعل 3 مل لوضع العلامات الإشعاعية للكربون -11 ( 1).
- بمجرد استقرار توليد وتراكم يوديد ميثيل [11درجة مئوية] ، تجاوز عمود ثلاثي الفلات الفضي وقم بتوجيه الغاز المشع عبر V8 إلى وعاء التفاعل الذي يحتوي على خليط السلائف. اترك يوديد الميثيل [11درجة مئوية] يغلي لمدة 3 دقائق ، ثم أغلق وعاء التفاعل وقم بتسخينه عند 80 درجةمئوية لمدة 5 دقائق.
- بمجرد اكتمال وضع العلامات ، بعد 5 دقائق ، قم بتبريد وعاء التفاعل إلى 30 درجةمئوية وتخفيفه ب 1 مل من الطور المتحرك من خزان V2.
- حقن الخليط على عمود HPLC شبه الإعدادي للتنقية باستخدام ظروف HPLC التالية: المرحلة المتنقلة من 37:63 (v / v) أسيتونيتريل: 20 ملي مولار هيدروكسيد الأمونيوم بمعدل تدفق 5.0 مل / دقيقة وطول موجة للأشعة فوق البنفسجية 235 نانومتر. رR من [11C] ER-176 (1): حوالي 9-11 دقيقة ، انظر الشكل 6.
- اجمع عينة الكسر في قارورة الاستقبال الكبيرة التي تحتوي على 25 مل من الماء المعقم منزوع الأيونات. قم بتحميل هذا الخليط المخفف على خرطوشة SPE خفيفة C18 .
- اغسل المنتج المحاصر (1) ب 10 مل إضافية من الماء المعقم منزوع الأيونات.
- قم بإزالة المنتج المطلوب من C18 Light SPE باستخدام 200 من الإيثانول المقاوم (1.0 مل) ، الموجه إلى قارورة تركيبة محملة مسبقا بكلوريد الصوديوم 0.9٪ للحقن (6.0 مل).
- اشطف C18 Light SPE ب 3.0 مل إضافي من كلوريد الصوديوم 0.9٪ للحقن.
- اجمع المحلول النهائي في قارورة التركيبة (~ 10 مل). مرر هذه الوسائط من خلال مرشح تعقيم 0.22 ميكرومتر إلى قارورة زجاجية معقمة مجمعة مسبقا ، خالية من الحرارة ، USP من النوع الأول 50 مل ، مختومة بحاجز مطاطي ومجعد بغطاء من الألومنيوم.
- استخدم أجهزة المعالجة عن بعد لإزالة حصة من قارورة المنتج النهائي كعينة لمراقبة الجودة (QC) (انظر الخطوة 1.15). إخضاع العينة لعدة اختبارات يجب أن يجتاز فيها المقتفي الإشعاعي جميع معايير القبول قبل الإفراج والإدارة للمريض (انظر الجدول 2).
ملاحظة: تطبيق طريقة وعاء المفاعل هذه باستخدام [11C] CH3I للوسم الإشعاعي ل (2) ؛ قم بإنشاء واستخدام [11C] CH3OTf لإنتاج (3) و (4) (انظر الملف التكميلي 1).
النتائج
توفر مجموعة الكيمياء الإشعاعية لجامعة نيويورك لانجون هيلث (NYULH) العديد من أجهزة التتبع الإشعاعي للكربون 11 والفلور 18 والغاليوم 68 المستخدمة في كل من الأبحاث البشرية والتطبيقات قبل السريرية. يتم استخدام عدة طرق لإنتاج أجهزة التتبع الإشعاعي PET. يستخدم فريقنا طريقة الحلقة لتوليف (1) و (2) و (3) و (4) (انظر الشكل 1 والشكل 8). بعد اكتمال الإنتاج ، تتم إزالة الكمية من قارورة المنتج النهائي المعقمة. تستخدم هذه العينة لكل من تلقيح محلول المنتج النهائي (في كل من مرق الصويا التريبتسي (TSB) ووسط الثيوغليكولات السائل (FTM) كعينة عقم) بالإضافة إلى عينة تمثيلية من المحلول السائب لاختبارات مراقبة الجودة. يخضع كل متعقب إشعاعي لاختبارات مراقبة الجودة قبل إطلاق المنتج للإعطاء (انظر الجدول 2).
يتضمن اختبار مراقبة الجودة تصور مظهر المنتج ، والتحقق من سلامة المرشح ، وتحديد هوية النوايا المشعة ، ودرجة الحموضة ، والهوية الكيميائية الإشعاعية (radio-HPLC) ، والنقاء الكيميائي الإشعاعي (radio-HPLC) ، والنقاء الكيميائي (HPLC) ، والنشاط المولي ، والقوة ، والمذيبات المتبقية ، والسموم الداخلية ، والعقم (انظر الجدول 2). تم الحصول على النتائج التالية من الإنتاج السريري لكل مقتفي إشعاعي مذكور أعلاه (انظر الجدول 1).
للحصول على مخطط كروماتوغرام تحليلي تمثيلي HPLC ، انظر الشكل 7 والملف التكميلي 1. يطلب من كل متتبع إشعاعي اجتياز جميع مواصفات مراقبة الجودة (انظر الجدول 2) قبل إطلاقها وإعطائها لموضوع ما.
ارجع إلى الملف التكميلي 1 للحصول على كميات السلائف والكواشف بالإضافة إلى كروماتوجرامات HPLC التحليلية ل [11C] MRB (2) (الشكل التكميلي 1) ، [11C] mHED (3) (الشكل التكميلي 2) ، و [11C] PiB (4) (الشكل التكميلي 3).
| مركب | البارامترات | طريقة الحلقة (متوسط ± std) | طريقة المفاعل (متوسط ± std) |
| [11ج]ER-176 | عدد الإنتاجات | 25 | 6 |
| بداية التوليف | 86 ± 5.0 جيجابايت | 52 ± 25.7 جيجابايت | |
| نهاية التوليف | 5.4 ± 2.2 جيجابايت | 1.6 ± 0.5 جيجابايت | |
| نقاء كيميائي إشعاعي | 99.6 ± 0.6٪ | 99.9 ± 0.1٪ | |
| تركيز ER-176 | 1.1 ± 0.5 ميكروغرام / مل | 0.63 ± 0.37 ميكروغرام / مل | |
| النشاط المولي | 194 ± 66 جيجابايت / ميكرومول | 132 ± 78 جيجابايت / ميكرولتر | |
| إجمالي وقت التوليف | 36 ± 3 دقائق | 44 ± 6 دقائق | |
| [11ج]MRB | عدد الإنتاجات | 70 | 6 |
| بداية التوليف | 84 ± 5.4 جيجابايت | 39 ± 11.9 جيجابايت | |
| نهاية التوليف | 3.0 ± 1.2 جيجابايت | 1.9 ± 0.7 جيجابايت | |
| نقاء كيميائي إشعاعي | 99.5 ± 0.5٪ | 99.7 ± 0.8٪ | |
| تركيز MRB | 0.52 ± 0.24 ميكروغرام / مل | 0.68 ± 0.41 ميكروغرام / مل | |
| النشاط المولي | 190 ± 50 جيجابايت / ميكرومول | 99 ± 55 جيجابايت / ميكرومول | |
| إجمالي وقت التوليف | 35 ± 3 دقائق | 42 ± 3 دقائق | |
| [11ج]mHED | عدد الإنتاجات | 5 | 11 |
| بداية التوليف | 69 ± 10.5 جيجابايت | 82 ± 4.3 جيجابايت | |
| نهاية التوليف | 5.5 ± 1.3 جيجابايت | 3.3 ± 1.0 جيجابايت | |
| نقاء كيميائي إشعاعي | 98.2 ± 1.3٪ | 99.1 ± 0.7٪ | |
| تركيز mHED | 0.40 ± 0.10 ميكروغرام / مل | 0.52 ± 0.37 ميكروغرام / مل | |
| النشاط المولي | 301 ± 48 جيجابايت / ميكرومول | 155 ± 77 جيجابايت / ميكرومول | |
| إجمالي وقت التوليف | 27 ± 4 دقائق | 32 ± 2 دقيقة | |
| [11ج]نقطة الرصاص | عدد الإنتاجات | 51 | 10 |
| بداية التوليف | 86 ± 5.4 جيجابايت | 57 ± 17.2 جيجابايت | |
| نهاية التوليف | 3.2 ± 0.8 جيجابايت | 1.4 ± 0.2 جيجابايت | |
| نقاء كيميائي إشعاعي | 97.0 ± 1.5٪ | 99.1 ± 1.4٪ | |
| تركيز PiB | 0.22 ± 0.51 ميكروغرام / مل | 0.30 ± 0.24 ميكروغرام / مل | |
| النشاط المولي | 201 ± 68 جيجابايت / ميكرومول | 207 ± 124 جيجابايت / ميكرومول | |
| إجمالي وقت التوليف | 35 ± 2 دقيقة | 36 ± 5 دقائق |
الجدول 1: نتائج إنتاج [11C] ER-176 (1) و [11C] MRB (2) و [11C] m HED (3) و [11C] PiB (4) عن طريق طريقة الحلقة أو طريقة وعاء التفاعل. يتم الإبلاغ عن جميع القيم في نهاية التوليف. الاختصارات: [11C] ER-176 = [11C] - (R) -N-sec-butyl-4- (2-chlorophenyl) -N-methylquinazoline-2-carboxamide; [11ج]MRB = (S ، S) - [11C] ميثيل ريبوكستين ؛ [11ج]مHED = [11C] -ميتا هيدروكسي إيفيدرين ؛ [11ج]PiB = 2- [4- [(11C) methylamino] phenyl] -1،3-benzothiazol-6-ol.
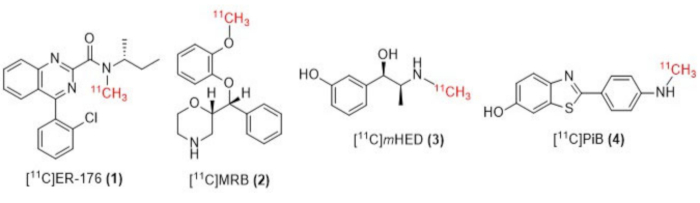
الشكل 1: هياكل [11C] ER-176 (1) و [11C] MRB (2) و [11C] m HED (3) و [11C] PiB (4). الاختصارات: [11C] ER-176 = [11C] - (R) -N-sec-butyl-4- (2-chlorophenyl) -N-methylquinazoline-2-carboxamide; [11ج]MRB = (S ، S) - [11C] ميثيل ريبوكستين ؛ [11ج]مHED = [11C] -ميتا هيدروكسي إيفيدرين ؛ [11ج]PiB = 2- [4- [(11C) methylamino] phenyl] -1،3-benzothiazol-6-ol. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
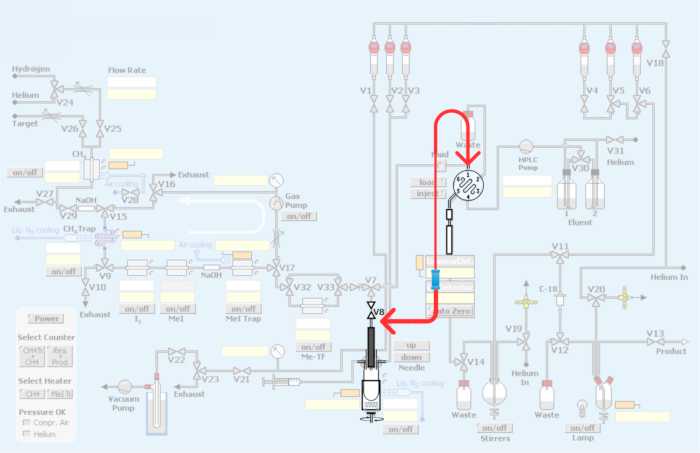
الشكل 3: التعديلات التي تم إجراؤها على الوحدة الآلية. يمثل اللون الأحمر إعادة سباكة وحدة التوليف لدمج الحلقة لإنتاج أجهزة التتبع الإشعاعي PET عن طريق مثيلة الكربون 11. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: السباكة النمطية وإعادة السباكة لدمج طريقة الحلقة لمثيلة الكربون 11 لأجهزة التتبع الإشعاعي PET. (أ) حلقة حقن HPLC مع موصلات الاتحاد. (ب) طريقة وعاء التفاعل. السهم الأحمر الذي يوضح اتصال V8. (ج) طريقة إعادة السباكة الحلقية ، وتجاوز وعاء المفاعل. لاحظ أن اتصال V8 بمدخل HPLC يتجاوز وعاء التفاعل ، مما يسمح [11C] يودوميثان أو [11C] ميثيل ثلاثي الفلات بالوصول المباشر إلى حلقة HPLC. (د) وضع الاتحاد فيما يتعلق بوعاء المفاعل. لاحظ الاتصال بحلقة HPLC المصنوعة من الفولاذ المقاوم للصدأ. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
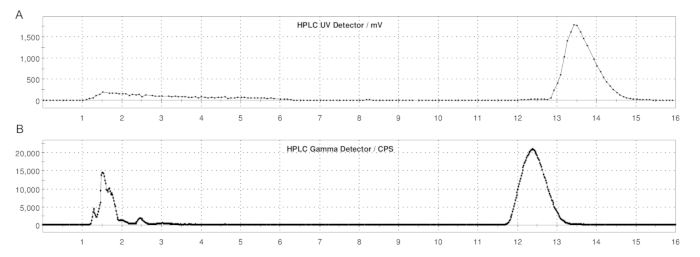
الشكل 5: ملفات تعريف HPLC شبه الإعدادية ل ER-176 و [11C] ER-176 مع إنتاج طريقة الحلقة. (أ) ملف تعريف HPLC شبه إعدادي ل ER-176 (1) عن طريق إنتاج طريقة الحلقة عند الأشعة فوق البنفسجية = 235 نانومتر ؛ tR = 13,2 دقيقة (B) المظهر الجانبي للراديو HPLC شبه الإعدادي ل [11C]ER-176 (1)؛ رR = 12.4 دقيقة. الظروف: المرحلة المتنقلة 37:63 (حجم / حجم) أسيتونيتريل: 20 ملي مولار هيدروكسيد الأمونيوم بمعدل تدفق 5.0 مل / دقيقة. الاختصار: [11C] ER-176 = [11C] - (R) -N-sec-butyl-4- (2-chlorophenyl) -N-methylquinazoline-2-carboxamide. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
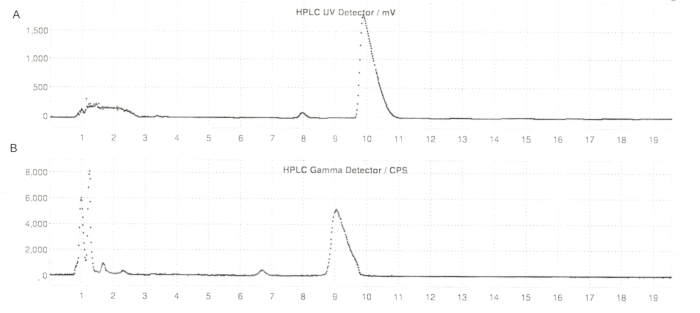
الشكل 6: ملامح HPLC شبه الإعدادية ل ER-176 و [11C] ER-176 مع إنتاج طريقة المفاعل. (أ) ملف تعريف HPLC شبه إعدادي ل ER-176 (1) عن طريق إنتاج طريقة المفاعل عند الأشعة فوق البنفسجية = 235 نانومتر. tR = 9.8 دقيقة (B) المظهر الجانبي للراديو HPLC شبه الإعدادي ل [11C] ER-176 (1)؛ رR = 9.2 دقيقة. الظروف: المرحلة المتنقلة من 37:63 (حجم / حجم) أسيتونيتريل: 20 ملي مولار هيدروكسيد الأمونيوم بمعدل تدفق 5.5 مل / دقيقة. الاختصارات: [11C] ER-176 = [11C] - (R) -N-sec-butyl-4- (2-chlorophenyl) -N-methylquinazoline-2-carboxamide; tR = وقت الاستبقاء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
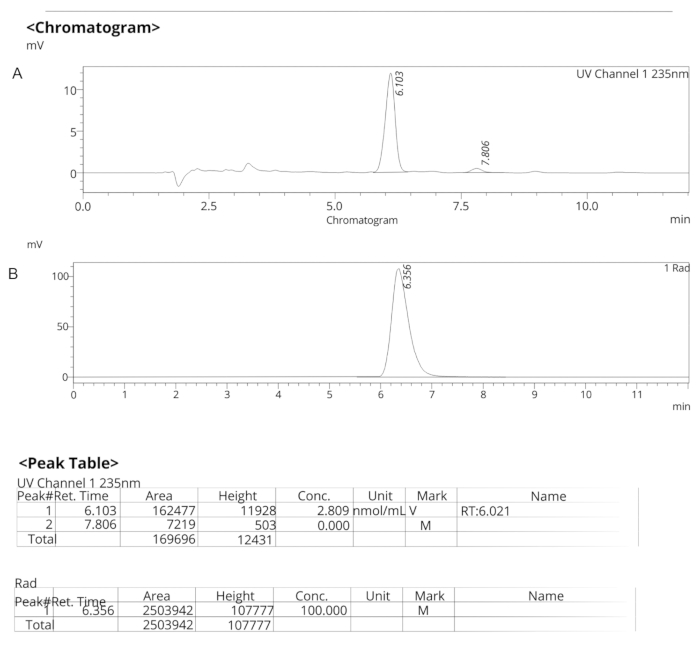
الشكل 7: ملامح HPLC التحليلية ل ER-176. (أ) المظهر الجانبي التحليلي ل HPLC لأطياف الأشعة فوق البنفسجية ل ER-176 (1) عند 235 نانومتر؛ tR = 6.10 دقيقة (B) المظهر الجانبي التحليلي ل HPLC لجهاز التتبع الراديوي ل [11C] ER-176 (1)؛ رR = 6.36 دقيقة. الظروف: 10 ميكرومتر C18 (2) 100  LC عمود 250 × 4.6 مم ؛ الميثانول / الماء 74/26 بمعدل تدفق 1.5 مل / دقيقة. الاختصار: [11C] ER-176 = [11C] - (R) -N-sec-butyl-4- (2-chlorophenyl) -N-methylquinazoline-2-carboxamide ؛ tR = وقت الاحتفاظ الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
LC عمود 250 × 4.6 مم ؛ الميثانول / الماء 74/26 بمعدل تدفق 1.5 مل / دقيقة. الاختصار: [11C] ER-176 = [11C] - (R) -N-sec-butyl-4- (2-chlorophenyl) -N-methylquinazoline-2-carboxamide ؛ tR = وقت الاحتفاظ الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
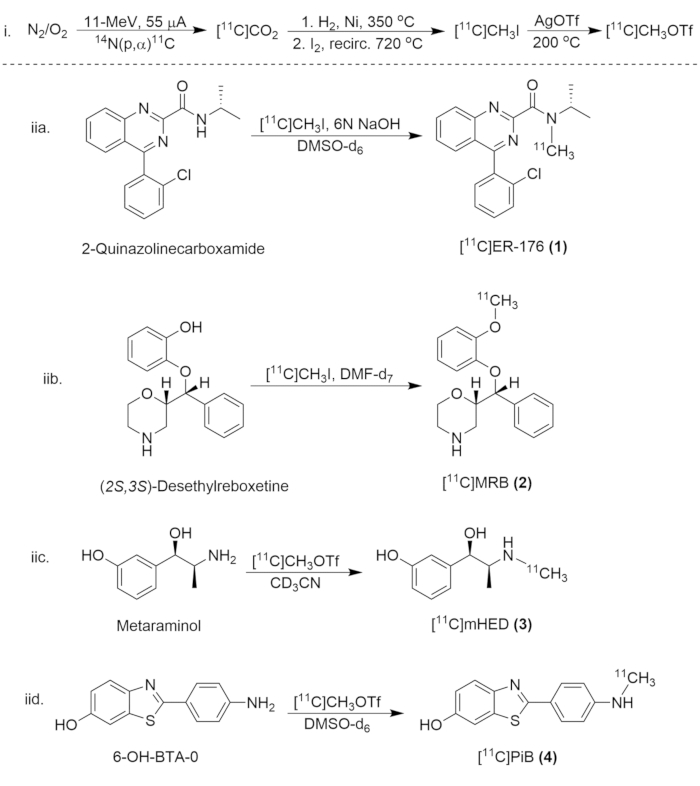
الشكل 8: مخطط تركيبي لتخليق مركبات الكربون 11. (ط) تكوين [11C] CH3I و [11C] CH3OTf ، و (iia.) الملصقات الإشعاعية ل [11C] ER-176 (1) ، (iib.) [11ج]MRB (2) ، (iic.)[11ج]مHED (3) و (المرجع نفسه) [11ج]نقطة الوصل (4). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الاختبار / المعلمات | المواصفات |
| المظهر (الفحص البصري) | محلول شفاف عديم اللون خال من الجسيمات |
| سلامة مرشح الغشاء | ≥ 50 رطل لكل بوصة مربعة |
| الرقم الهيدروجيني | 4.5 - 8.0 |
| الهوية الكليدية المشعة (نصف العمر) | 19.3 - 21.3 دقيقة |
| الهوية الكيميائية الإشعاعية (radio-HPLC) | 0.90 ≤ ربرود / ر آر ستاند ≤ 1.10 |
| النقاء الكيميائي الإشعاعي (الراديو-HPLC) | ≥ 95.0٪† |
| تركيز الدواء (HPLC) | انظر الملاحظات* |
| إجمالي الشوائب الكيميائية (HPLC) | انظر الملاحظات** |
| النشاط المولي (@ EOS) | > 9.25 جيجابايت / ميكرولتر |
| الأسيتونيتريل المتبقي (GC) | ≤ 410 صفحة في الدقيقة |
| الأسيتون المتبقي (GC) | ≤ 5,000 جزء في المليون |
| ثنائي ميثيل سلفوكسيد المتبقي (GC) | ≤ 5,000 جزء في المليون |
| الإيثانول المتبقي (GC) | ≤ 10٪ (حجم حجمي) |
| الميثانول المتبقي (GC) | ≤ 3,000 جزء في المليون |
| المتبقي N ، N-dimethylformamide (GC) | ≤ 880 صفحة في الدقيقة |
| ليمولوس الأميبوسيت المحللة (LAL) | ≤ 17.5 وحدة الاتحاد الأوروبي/مل |
| العقم (البدء في غضون 30 ساعة) | معقم (14 يوما) |
| سجلات التحضير | كاملة ودقيقة |
| تسميات | كاملة ودقيقة ومتصالحة |
الجدول 2: معايير مراقبة الجودة للموافقة على المقتبات الإشعاعية الكربون-11 أو رفضها. † النقاء الكيميائي الإشعاعي ≥ 90.0٪ ل [11درجة مئوية] mHED; * تركيز الدواء: [11درجة مئوية] ER-176 ≤ 10 ميكروغرام / جرعة ؛ [11ج]MRB ≤ 10 ميكروغرام / جرعة ؛ [11ج]مHED ≤ 50 ميكروغرام/جرعة؛ [11ج]PiB ≤ 13.4 ميكروغرام/جرعة؛ ** إجمالي الشوائب الكيميائية: [11درجة مئوية] ER-176 ≤ 1.0 ميكروغرام/جرعة؛ [11ج]MRB ≤ 1.0 ميكروغرام / جرعة ؛ [11ج]مHED ≤ 5.0 ميكروغرام/جرعة؛ [11ج]≤ PiB 1.34 ميكروغرام/جرعة. الاختصارات: [11C] ER-176 = [11C] - (R) -N-sec-butyl-4- (2-chlorophenyl) -N-methylquinazoline-2-carboxamide; [11ج]MRB = (S ، S) - [11C] ميثيل ريبوكستين ؛ [11ج]مHED = [11C] -ميتا هيدروكسي إيفيدرين ؛ [11ج]PiB = 2- [4- [(11C) methylamino] فينيل] -1،3-بنزوثيازول-6-ol; EOS = نهاية التوليف. GC = كروماتوغرافيا الغاز ؛ LAL = Limulus Amebocyte Lysate.
الملف التكميلي 1: المواد الكيميائية والمواد ، الكواشف المستخدمة في طريقة الحلقة أو وعاء المفاعل ، اختبار مراقبة الجودة ، كروماتوغرامات HPLC التحليلية. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يتضمن وضع العلامات الإشعاعية التقليدية للذرات غير المتجانسة الطرفية التي تحتوي على يودوميثان الكربون -11 أو ميثيل تريفلات فقاعات الغاز المحب للكهرباء المشع في وعاء تفاعل ، وحبسه ، والسماح للمحلول بالتفاعل لفترات طويلة من الزمن18. يمكن أن تكون الفقاعات التقليدية للتفاعل غير المتجانس بطيئة وقد تتطلب تسخينا لتسريع معدل التفاعل. قبل التنقية ، قد يكون من الضروري تبريد وسائط التفاعل إلى درجة حرارة الغرفة ، متبوعا بالنقل إلى حلقة HPLC باستخدام مذيب (على سبيل المثال ، المرحلة المتنقلة) لتنقية المقتفي الإشعاعي المطلوب. تستغرق هذه الخطوات وقتا طويلا ، وقد تفقد المنتجات العابرة ذات العلامات الراديوية أثناء نقل هذه المواد.
في منشأتنا ، أظهرنا مبررا لاستخدام طريقة الحلقة ، حيث يتم طلاء محلول السلائف على حلقة من الفولاذ المقاوم للصدأ HPLC ، ويتم وضع العلامات الإشعاعية للمركب داخل الحلقة في درجة حرارة الغرفة. يتم ربط الحلقة بما يتماشى مع توصيل المشع [11C] CH3I أو [11C] CH3OTf وتوصيلها بمنفذ الحقن لنظام HPLC. لا يلزم تسخين لحدوث الملصقات الراديوية ، وبالنسبة لجميع الحالات الموضحة في هذه المخطوطة ، يحدث التفاعل في أقل من 3 دقائق.
يبدو أن معدل التدفق وحجم حلقة HPLC المصنوعة من الفولاذ المقاوم للصدأ أمر بالغ الأهمية لهذه العملية للعمل بكفاءة. بدأ الاختبار بتغيير معدل تدفق الغاز الناقل ، الهيليوم ، من 8.0 مل / دقيقة إلى 15.0 مل / دقيقة للغاز المشع الذي سيتم توصيله إلى الحلقة. درس باكلي أهمية تطبيق معدل التدفق الصحيح وكذلك استخدام مادة المذيبات والحلقة المناسبة15. بالنسبة لنظامنا ، فإن معدل التدفق البالغ 15 مل / دقيقة إما للأنواع المشعة المحبة للكهرباء من [11درجة مئوية] CH3I أو [11C] CH3OTf يعمل بشكل جيد للوسم الإشعاعي لجميع أجهزة التتبع الإشعاعي الأربعة التي تمت مناقشتها في هذه المخطوطة. الحلقة المستخدمة لجميع التوليفات عبارة عن حلقة حقن HPLC من الفولاذ المقاوم للصدأ عند 1.5 مل تمتلك OD 1/16 بوصة ومعرف 1 مم.
بمقارنة الطريقتين (وعاء التفاعل مقابل طريقة الحلقة) ، في أيدينا ، أظهرت طريقة الحلقة زيادة في كفاءة وضع العلامات الإشعاعية جنبا إلى جنب مع زيادة كبيرة في النشاط المولي في نهاية التخليق (EOS) لإنتاج أربعة متتبعات إشعاعية معتمدة من قبل الأبحاث البشرية. على سبيل المثال ، كان لدى المقتفي الإشعاعي [11C] mHED (3) زيادة بمقدار 1.6 مرة في نشاط المنتج النهائي المعزول إلى جانب تحقيق ضعف النشاط المولي في EOS. لوحظ هذا الاتجاه لزيادة النشاط الكلي عبر جميع أجهزة التتبع الإشعاعي الأربعة (انظر الجدول 1). تتضمن النتائج الإيجابية الإضافية عند استخدام طريقة الحلقة تقليل وقت الإعداد بمقدار 5 دقائق وعدم الحاجة إلى تنظيف وعاء التفاعل ، مما يوفر وقت المشغل واستخدام المذيبات لبروتوكول التنظيف.
تتضمن بعض عيوب هذه المنهجية الحدود التي يمكن من خلالها تسمية المتتبعات الراديوية بشكل فعال باستخدام طريقة الحلقة. إذا كانت الحرارة ضرورية لوضع العلامات الراديوية ، فمن الصعب تعديل هذا النظام للسماح بالتسخين داخل حلقة HPLC. يتطلب هذا النظام تعديلات على السباكة. قد تردع هذه الميزة المتمثلة في عدم وجوده جاهزا "خارج الصندوق" المستخدمين الآخرين عن إجراء مثل هذه التعديلات على نظامهم الأساسيالآلي 14. نظرا لأن السباكة التكميلية والنقابات مطلوبة لهذه الطريقة (انظر الشكل 4A-D) ، تزداد احتمالية وجود مواقع إضافية للإطلاقات المشعة عند وضع العلامات في ظل هذه الظروف. من الحكمة إجراء فحص تسرب قبل كل تشغيل على الوحدة النمطية.
قام فريقنا بتنفيذ طريقة الحلقة المستخدمة في تطبيق الأدوية الجديدة التجريبية (IND) والإنتاج المعتمد من لجنة أبحاث الأدوية المشعة (RDRC) لأربعة متتبعات إشعاعية من الكربون 11. في أيدينا ، أثبتت هذه الطريقة أنها عملية أكثر كفاءة وإنتاجية أعلى من طريقة وعاء التفاعل التقليدية. يجب مراعاة السباكة الإضافية والتعديلات على معدل تدفق غاز الهيليوم الناقل عند تطبيق هذه الطريقة على معظم الوحدات الآلية. أخيرا ، هذه الطريقة لها قيود وليست مناسبة لبعض المتتبعات الإشعاعية للكربون 11 ، مثل [11C] UCB-J ، والتي تتطلب تنشيط وسيط البلاديوم (II) وتسخين24 من خليط التفاعل.
Disclosures
يعلن المؤلفون أنه ليس لديهم مصالح ذات صلة أو مالية تتعلق بهذا البحث للإفصاح عنها.
Acknowledgements
نود أن نتوجه بخالص الشكر إلى أعضاء مختبر الكيمياء الإشعاعية السابقين في جامعة نيويورك ، راؤول جاكسون وجريس يون ، لعملهم في الجهود الأولية لمثيلة الكربون 11 باستخدام طريقة الحلقة.
Materials
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
References
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved