Method Article
Verbesserung der Effizienz und der Radiomarkierungsausbeute von Kohlenstoff-11-Radioliganden für die klinische Forschung mit der Loop-Methode
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt ein detailliertes Verfahren zur Herstellung von vier Kohlenstoff-11-Radiotracern mittels der "Schleifenmethode" [11C]methylierung vor. Wir beschreiben das Verfahren zur Synthese von [11C]ER-176 mit Daten für drei weitere Radiotracer: [11C]MRB, [11C]mHED und [11C]PiB. Die Loop-Methode bietet eine effiziente Synthese mit erhöhter radiochemischer Ausbeute gegenüber der herkömmlichen Reaktionsgefäß-Methylierung [11C].
Zusammenfassung
Ein erfolgreiches Positronen-Emissions-Tomographie-Bildgebungsprogramm mit Kohlenstoff-11-Radiotracern erfordert schnelle, effiziente und zuverlässige Synthesemethoden, die eine Zyklotron- und Radiochemiegruppe vor Ort sowie klinisches Personal erfordern, das für den Betrieb unter den einzigartigen Einschränkungen des Kohlenstoff-11-Radionuklids geschult ist. In dieser Studie werden die Vorzüge und Vorteile einer lösungsmittelfreien "Schleifenmethode" untersucht, bei der vier Tracer mit dem Kohlenstoff-11-Radionuklid radioaktiv markiert werden, wodurch die Radioliganden [11C]ER-176, [11C]MRB, [11C]mHED und [11C]PiB hergestellt werden.
Die "Loop-Methode" wird mit der traditionellen reaktorbasierten Methode der Kohlenstoff-11-Methylierung verglichen, wobei dieselben Radiotracer auf der identischen automatisierten Plattform synthetisiert werden. Des Weiteren wird ein vollständiger Überblick über die klinische Forschungsvorbereitung des [11C]ER-176 Radiotracers gegeben. Wie die Herstellung von [11C]ER-176 zeigte, erwies sich die unverlierbare Lösungsmittel-"Schleifenmethode" der heterogenen Alkylierung als effizienter, mit ausgezeichneter radiochemischer Reinheit (99,6 ± 0,6 %, n = 25), höherer und konsistenterer radiochemischer Ausbeute (Ende der Synthese (EOS) = 5,4 ± 2,2 GBq, n = 25) im Vergleich zur Reaktormethode (EOS = 1,6 ± 0,5 GBq, n = 6), erhöhte molare Aktivität (Schleifenmethode = 194 ± 66 GBq/μmol, n = 25; Reaktormethode = 132 ± 78 GBq/μmol, n = 6), zusammen mit einer durchschnittlich 5 min kürzeren Reaktionssequenz.
Einleitung
Unter den Modalitäten der molekularen Bildgebung unterscheidet sich die Positronen-Emissions-Tomographie (PET) durch die Art und Weise, wie sie die biochemischen Prozesse auflöst, die mit spezifischen physiologischen Zielen oder interessierenden Regionen verbunden sind 1,2. Die charakteristische Sensitivität und der nicht-invasive Charakter der PET werden für die In-vivo-Visualisierung und Quantifizierung der Pathophysiologie von Krankheiten genutzt, wobei oft Ziele aufgedeckt werden, die durch eher anatomische Bildgebungsverfahren wie Computertomographie (CT)3 oder Magnetresonanztomographie (MRT)4 unsichtbar sind. In der modernen molekularen Bildgebung wird PET mit CT oder MRT (PET/CT bzw. PET/MR) kombiniert, wobei die hohe Kontrastauflösung und die quantifizierbaren Bildgebungsparameter von PET genutzt werden, um hochpräzise Dämpfungskorrekturkarten (PET/CT) und eine verbesserte räumliche Auflösung (PET/MR)5 zu erhalten, wobei einige Hürden überwunden werden, die sich aus der Variabilität der höheren kinetischen Energien von Positronen aus Radionukliden wie Gallium-68 und Rubidium-82ergeben 6. Diese dual-modalen bildgebenden Verfahren kanalisieren die charakteristischen Attribute jeder einzelnen Modalität und liefern Klinikern oder Forschern eine Fülle von gemeinsam registrierten anatomischen und biochemischen Erkenntnissen über den Studienteilnehmer5.
Die klinische Anwendbarkeit dieses bildgebenden Verfahrens ist enorm und bietet die Visualisierung und Messung physiologischer Prozesse auf molekularer Ebene, die so unterschiedlich sind wie der Glukosestoffwechsel 7,8, die Bindung von Neurotransmitterrezeptoren9, die Myokardperfusion10 und verschiedene neurologische Erkrankungen11. Außerhalb der klinischen Anwendung sind die inhärenten Eigenschaften der PET so ausgerichtet, dass sie eine integrale Rolle bei der diagnostischen und therapeutischen Arzneimittelentwicklung spielen und die Quantifizierung von Parametern wie Bindungspotenzial (BP), Bioverteilung, Verteilungsvolumen (VT) und Arzneimittelrezeptorbelegung (RO%) durch direkte Beobachtung des Zusammenspiels von Pharmakologie, Pharmakokinetik und Pharmakodynamik ermöglichen. Dies wiederum trägt zu den Bestimmungen bei, einschließlich der Frage, ob eine Verbindung ein Ziel bei einer wirksamen Dosiskonzentration (ED50) erreicht, des Ausmaßes der effektiven Durchdringung der Blut-Hirn-Schranke, der metabolischen Integrität der Verbindung und der geeigneten Dosis und des Dosierungsintervalls11.
Bei der Entwicklung einer nützlichen Sonde für die PET-Bildgebung ergibt die Radiomarkierung des Biomoleküls nach der Identifizierung eines geeigneten Biomarkers und der Auswahl eines zugehörigen Liganden die Radiotracersonde für die PET-Studie. Unter den PET-Radionukliden zur Untersuchung biologischer, pharmakologischer oder medizinischer Fragestellungen bietet Kohlenstoff-11 eine Kombination aus synthetischer Vielseitigkeit und günstigen physikalischen Eigenschaften, die seinen breiten Einsatz in verschiedenen Biomolekülen und geeigneten Liganden ermöglicht6. Mit einer Positronenemission von 99,8 % und einer Halbwertszeit von 20,4 Minuten12 ermöglicht Kohlenstoff-11 eine wiederholte Verabreichung an Probanden in kurzen Intervallen, während gleichzeitig mehrstufige Synthesen möglich sind. Diese Vorteile erfordern jedoch eine Anlage mit Zyklotron- und Radiochemie-Fähigkeiten vor Ort5.
Solche Anlagen erfordern zuverlässige, leistungsfähige und reproduzierbare Methylierungsverfahren, die die radioaktive Markierung von Vorläufermolekülen ermöglichen, häufig mit dem elektrophilen [11C]iodomthan ([11C]CH3I) oder [11C]Methyltriflat ([11C]CH3OTf) Substrat13. Ein Radiosynthesemodul, wie es vom Hersteller geliefert wird, ist typischerweise für einen Reaktionsgefäßansatz für [11C]Methylierungsreaktionen14 konfiguriert. Dies beinhaltet das Abkühlen des Gefäßes für eine effektive [11C]iodomthan- oder [11C]Methyltriflat-Retention bei der Verabreichung, das Verschließen und Erhitzen des Gefäßes, um die Reaktion durchzuführen, das Abschrecken und das anschließende Übertragen des umgesetzten Inhalts in ein Hochleistungsflüssigkeitschromatographie-System (HPLC) zur semipräparativen Reinigung13. Diese Technik ist zwar wirksam15, weist aber zahlreiche potenzielle strukturelle Versagenspunkte auf, an denen Fläschchensepten, Nadeln und zugehörige Transferleitungen beteiligt sind.
Der Bedarf an einer zuverlässigeren und reproduzierbaren Methylierungsmethode leitete die Untersuchung und Verfolgung einer unverlierbaren Lösungsmittelmodifikation für viele unserer Kohlenstoff-11-Radioliganden-Syntheseprotokolle. Dieser Ansatz zielt darauf ab, die Einschränkungen der konventionellen Reaktionsgefäßmethode zu überwinden und gleichzeitig die Effizienz der Radiomarkierung beizubehalten oder zu verbessern.
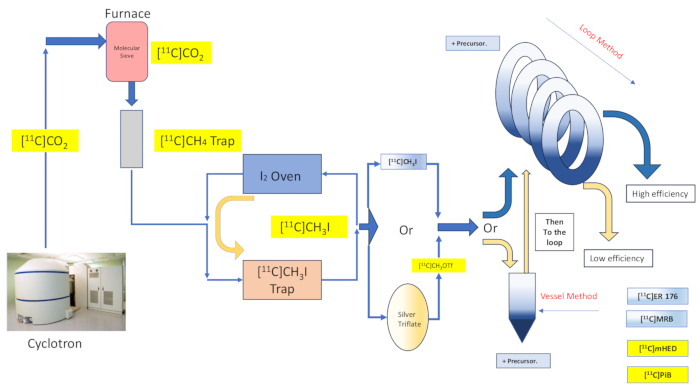
Abbildung 2: Design und Ablauf der Reaktionsgefäßsynthese und der Schleifenmethode. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die unverlierbare Lösungsmittelchemie verspricht ein effizientes Einfangen und eine Reaktion mit dem radioaktiven Markierungsreagenz durch Verteilen der Vorläuferlösung über eine große Fläche eines Trägermaterials oder einer Trägerstruktur und anschließendes Lenken des gasförmigen Markierungsreagenzes in Kontakt mit dem beschichteten Material16, 17. Dies erhöht das Ausmaß und die Qualität des Kontakts zwischen den beiden Reaktantenphasen16, 18. Zahlreiche Implementierungen und Variationen dieser Technik wurden bereits 1985 dokumentiert 16,17,18,19,20, und sie hat Anwendung bei [11C]methyliodid, [11C]methyltriflat sowie Grignard-Reagenz [11C]Kohlendioxid-Radiomarkierungsreaktionen gefunden 20. Eine weitere Verfeinerung wurde durch die Erörterung der ursprünglich von Wilson et al. beschriebenen Chemie der unverlierbaren Lösungsmittel-"Loop-Methode" dargestellt, die weder zusätzliche Stützen zu den bereits vom HPLC-Reinigungskreislauf angebotenen noch Erhitzen oder Abkühlen der Reaktionsumgebung13 benötigt. Es wurde festgestellt, dass die Radiomarkierung mit der "Loop-Methode" des unverlierbaren Lösungsmittels Iodomthan- und Methyltriflat-Methylierungsreaktionen mit den Vorzügen eines minimalen Übertragungsverlusts, einer hohen radiochemischen Ausbeute, einer hohen molaren Aktivität, einer verkürzten Reaktionszeit und einer einfachen 7,21,22,23 hervorruft.
Hierin beschreiben wir die Implementierung der "Schleifenmethode" [11C]methylierungstechnik durch unsere Gruppe, die ursprünglich von Wilson13 und anderen danach 14,15,18,21,22,23 (siehe Abbildung 2) beschrieben wurde, durch mechanische Modifikation (siehe Abbildung 3) an unserem Synthesemodul (im Folgenden als das Modul bezeichnet). Diese mechanischen Modifikationen hielten sich so weit wie möglich an das ehrgeizige Ethos der Einfachheit und waren minimal und zugänglich, was zu einer allgemeinen Reduzierung der technischen Komplexität führte und nur die Hinzufügung wesentlicher Komponenten zu den bereits vom Modulhersteller installierten Komponenten in Verbindung mit einer standardmäßigen Radiomarkierungsanordnung für Reaktionsgefäße ermöglichte. Dies spiegelt sich in der Entscheidung wider, die vom Modulhersteller bereits gelieferte und vorinstallierte HPLC-Aufreinigungsschleife aus Edelstahl zu verwenden, wie im Folgenden beschrieben, die sich mit den untersuchten Synthesen als kompatibel und effektiv erwiesen hat. Wir diskutieren ausführlich das vollständige und validierte Röntgenprotokoll der Schleifenmethode, das in der klinischen Forschungsproduktion für die Synthese des Radiotracers [11C]-(R)-N-sec-butyl-4-(2-chlorphenyl)-N-methylchinazolin-2-carboxamid,[11C]ER-176 (1) unter Verwendung von Kohlenstoff-11-Jodmethan verwendet wird. Darüber hinaus vergleichen wir zahlreiche Attribute im Zusammenhang mit der Radiomarkierungseffizienz, die sowohl mit der Reaktormethode als auch mit der Loop-Methode an drei zusätzlichen Radioliganden durchgeführt werden, darunter (S,S)-[11C]Methylreboxetin ([11C]MRB (2)),[11C]-meta-Hydroxyephedrin ([11C]mHED (3)) und 2-[4-[(11C)methylamino]phenyl]-1,3-benzothiazol-6-ol ([11C]PiB (4)), die in unserer Anlage entwickelt wurden, wie durch die Analyse synthetisierter Chargen ermittelt wurde (siehe Tabelle 1 undAbbildung 1 ). Dieser Vergleich verdeutlicht den klaren Vorteil von Parametern wie radiochemischer Ausbeute und molarer Aktivität, die mit der Implementierung der Radiomarkierung nach der "Schleifenmethode" verbunden sind, die durch zugängliche und einfache Modulmodifikationen mit minimalen Kosten für das radiochemische Labor ermöglicht wird.
Protokoll
HINWEIS: Alle Geräte und Synthesen werden entweder in einer bleiabgeschirmten Hotzelle oder in einer Minizelle durchgeführt. ACHTUNG: Aus dem Zyklotron werden hochenergetische Positronen-emittierende Teilchen erzeugt und genutzt. Der Bereich wird mit kalibrierten Geigerzählern überwacht, und die Personen tragen vom Strahlenschutz ausgestellte Dosimetrieringe und -abzeichen. Das gesamte Personal ist für die Arbeit mit hochenergetischen radioaktiven Materialien geschult.
Alle Synthesen werden auf einem sauberen und sterilisierten Modul gemäß unseren internen Standardarbeitsanweisungen (SOP) durchgeführt. Der Reinigungsprozess umfasst die Verwendung von 1 N HCl, Wasser, Aceton und Acetonitril für den Reaktionsteil des Moduls. In der Zwischenzeit wird der Formulierungsteil des Moduls gereinigt und mit Wasser und Ethanol sterilisiert.
1. Die radioaktive Markierung von [ 11C]ER-176 (1) mittels Schleifenverfahren
HINWEIS: Eine Liste der Materialien, die bei der Herstellung von [11C]ER-176 (1) verwendet wurden, finden Sie in der Materialtabelle.
- Erneuern Sie das Modul für die Herstellung der Schleifenmethode (siehe Abbildung 4A-D). Befestigen Sie ein V8-Ventil an einer Verbindung, die direkt mit der HPLC-Schlaufe verbunden ist. Dadurch wird das Reaktionsgefäß umgangen.
- Konditionieren Sie den Methanofen (CH4) 20 Minuten lang bei 350 °C mit einem Wasserstoffgasstrom von 100 mL/min, bevor alle Produktionen auf dem Modul durchgeführt werden. Vor dem Fortfahren auf 45 °C abkühlen lassen.
- Konditionieren Sie die CH4-Falle 20 Minuten lang bei 120 °C mit einem Heliumgasstrom von 50 mL/min, bevor alle Produktionen auf dem Modul durchgeführt werden. Vor dem Fortfahren auf 70 °C abkühlen lassen.
- Konditionieren Sie die Methyliodidfalle 20 Minuten lang bei 190 °C mit einem Heliumgasstrom von 50 ml/min, bevor alle Produktionen auf dem Modul durchgeführt werden. Vor dem Fortfahren auf 50 °C abkühlen lassen.
- Reagenzienbeladung für das Modul:
- Injizieren Sie mit einer 100-μl-Spritze die folgende Mischung durch den Adapter an Position #1 der internen HPLC-Schleife des Sechswegeventils: (R)-N-sec-butyl-4-(2-chlorphenyl)-chinazolin-2-carboxamid (1,0 ± 0,05 mg) in Dimethylsulfoxid-d6 (100 ± 10 μl) und 6 N Natriumhydroxid (4 μl).
HINWEIS: Deuterierte Lösungsmittel wurden aufgrund ihrer Verfügbarkeit in Ampullenform ausgewählt und weil sie in der Regel während der Herstellung destilliert werden, um sicherzustellen, dass sie frei von Wasser sind. - Befüllen Sie das V4-Reservoir mit 3,0 ml 0,9 % Natriumchlorid zur Injektion.
- Befüllen Sie den V5-Behälter mit 1,0 mL 200-prozentigem Ethanol.
- Befüllen Sie das V6-Reservoir mit 10 mL sterilem entionisiertem Wasser.
- Füllen Sie den großen Auffangkolben mit 25 mL sterilem entionisiertem Wasser.
- Füllen Sie den Formulierungskolben mit 6,0 ml 0,9 % Natriumchlorid zur Injektion.
- Stellen Sie sicher, dass die Verabreichungsleitung an einem sterilen, vormontierten Durchstechflasche für das Endprodukt befestigt ist.
- Bereiten Sie die mobile Phase mit einem 37:63 (v/v) Gemisch aus Acetonitril und 20 mM Ammoniumhydroxid vor.
- Konditionieren Sie die Semi-Prep-Säule mit vier Säulenvolumina der mobilen Phase.
HINWEIS: Bei der verwendeten Säule handelt es sich um eine Umkehrsäule C18 100 mm x 10 mm.
- Injizieren Sie mit einer 100-μl-Spritze die folgende Mischung durch den Adapter an Position #1 der internen HPLC-Schleife des Sechswegeventils: (R)-N-sec-butyl-4-(2-chlorphenyl)-chinazolin-2-carboxamid (1,0 ± 0,05 mg) in Dimethylsulfoxid-d6 (100 ± 10 μl) und 6 N Natriumhydroxid (4 μl).
- Während der Vorbereitung des automatisierten Moduls wird das Kohlenstoff-11-Zyklotron-Target (1 % Sauerstoff, 99 % Stickstoff) auf einem 11 MeV-Zyklotron bei 55 μA für 60–80 Minuten auf Dual-Beam-Targets bombardiert, um [11C]Kohlendioxid durch die 14N(p,α) 11C-Kernreaktion zu erzeugen.
- Etwa 20 Minuten vor dem Entladen von [11C]Kohlendioxid aus dem Zyklotron auf das Modul starten Sie die validierte Zeitliste für die [11C]ER-176-Synthese, indem Sie auf die Schaltfläche Start klicken. Die CH4-Säule auf 45 °C abkühlen lassen, bevor sie radioaktives Kohlendioxid (11 °C) erhält (siehe Abbildung 3). Die Carbosphärensäulenfalle (CH4-Falle ) auf -75 °C abkühlen lassen.
- Das in das Modul eingebettete Verfahren zur Umwandlung von [11C]Kohlendioxid in [11C]methyliodid durch einen trockenchemischen Prozess gehe wie folgt vor:
- Die Kohlendioxidaktivität von [11C] wird in [11C]Methan umgewandelt, indem mit Wasserstoffgas bei 350 °C über einem Nickelkatalysator (Shimalit-Nickel) reagiert wird. Verwenden Sie eine Askaritfalle (Natriumhydroxid), um das nicht umgewandelte Kohlendioxidund das gebildete Wasser zurückzuhalten.
- Das gebildete [11C]Methan wird zur weiteren Reinigung und Konzentration auf einer Carbosphärensäulenfalle (CH4-Falle ) bei -75 °C eingeschlossen. Um das eingeschlossene [11C]Methan freizusetzen, wird die Carbosphärensäule auf 80 °C erhitzt.
- Das gereinigte [11C]Methan wird mit elementarem Jod bei 720 °C zu [11C]methyliodid ([11C]CH3I) über eine Helium-Rezirkulationsgaspumpe umgesetzt, wobei der einfallend erzeugte Wasserstoffiodid von einer anderen Askanitfalle zurückgehalten wird, während unumgewandeltes [11C]Methan in den Zirkulationsprozess zurückkehrt.
- Das gebildete [11C]CH3I wird bei Raumtemperatur auf der Methyliodid (MeI)-Säule eingeschlossen, die sich während des Rezirkulationsprozesses angesammelt hat.
- Am Ende des Zirkulationsprozesses wird das gesammelte [11C]CH3I durch Erhitzen auf 190 °C unter Heliumstrom (15 mL/min) aus der MeI-Falle freigesetzt, von der MeTf-Säule umgangen und durch ein Rückschlagventil in den 1,5-ml-Edelstahlkreislauf geleitet, der die vorgeladene Vorläuferlösung enthält (Schritt 1.5.1).
- Sobald das [11C]CH3I die Schleife 180 s lang durchlaufen hat, injizieren Sie das Reaktionsgemisch zur Reinigung auf die Semi-Prep-HPLC-Säule. Unter folgenden HPLC-Bedingungen sind folgende Bedingungen zu verwenden: mobile Phase mit 37:63 (v/v) Acetonitril: 20 mM Ammoniumhydroxid bei einer Flussrate von 5,0 mL/min und einer UV-Wellenlänge von 235 nm; Retentionszeit (tR) von [11C]ER-176: ca. 12–14 min. Siehe Abbildung 5.
- Die Fraktionsprobe wird in einen großen Auffangkolben gegeben, der 25 ml steriles entionisiertes Wasser enthält. Laden Sie das verdünnte Gemisch auf eine C18-Patrone für die Leichtphasenextraktion (SPE).
- Waschen Sie das Produkt (1) mit zusätzlichen 10 mL sterilem entionisiertem Wasser.
- Eluieren Sie das gewünschte Produkt von der C18 light SPE mit Hilfe von 200-prozentigem Ethanol (1 mL). Diese Elution wird zur Injektion in einen mit 0,9 % Natriumchlorid vorgeladenen Formulierungskolben (6 ml) geleitet.
- Spülen Sie das C18 light SPE mit zusätzlichen 3 mL 0,9 % Natriumchlorid zur Injektion über das V4-Reservoir.
- Sammeln Sie die endgültige Lösung im Formulierungskolben (~10 mL) und geben Sie sie durch einen 0,22-μm-Sterilisationsfilter in ein vormontiertes steriles, apyrogenes USP Typ I 50 mL-Glasfläschchen, das mit einem Gummiseptum verschlossen und mit einer Aluminiumkappe gecrimpt ist.
- Entfernen Sie mit Hilfe von Telemanipulatoren ein Aliquot aus dem Fläschchen des Endprodukts als Probe für die Qualitätskontrolle (QC). Unterziehen Sie diese Probe zahlreichen QK-Tests, um sicherzustellen, dass sie den festgelegten Spezifikationen entspricht, bevor sie freigegeben und einem Patienten verabreicht wird (siehe Tabelle 2).
ANMERKUNG: Wenden Sie dieses Verfahren der Schleifenmethode unter Verwendung von [11C]CH3I für die Radiomarkierung von (2) an; [11C]CH3OTf erzeugen und verwenden, um (3) und (4) zu erzeugen (siehe Zusatzdatei 1).- Um der typischen Qualitätskontrollanalyse zu folgen, die in der Einrichtung durchgeführt wird, verwenden Sie Telemanipulatoren, um eine Probe aus dem Fläschchen des Endprodukts in eine TB-Spritze und dann mit einem bleiabgeschirmten Träger in den Qualitätskontrollraum zu übertragen.
- Stoßen Sie die Probe in einem bleigeschützten Bereich (L-Block) in ein pyrogenfreies Röhrchen aus und geben Sie sie dann in kleinere Glasfläschchen (50–100 μl) für HPLC- und Gaschromatographie-Analysen (GC) ab.
- Verdünnen Sie eine zweite Probe mit pyrogenfreiem Wasser auf die für die bakterielle Endotoxinanalyse geeignete Konzentration.
- Beimpfen Sie eine Probe der Endproduktlösung (sowohl in tryptischer Sojabrühe (TSB) als auch in flüssigem Thioglycolatmedium (FTM) als Sterilitätsprobe). Inkubieren Sie diese Proben und beobachten Sie sie auf Wachstum über einen Zeitraum von 14 Tagen.
- Tragen Sie ein kleines Aliquot auf einen pH-Streifen auf, um den Säuregehalt/die Basizität der Endproduktlösung visuell zu bestimmen.
2. Reaktionsgefäßverfahren für die radioaktive Markierung von [11C]ER-176 (1)
- Stellen Sie sicher, dass das Modul gemäß dem internen Reinigungsprotokoll gründlich gereinigt wird.
- Verwenden Sie 1 N HCl, Wasser, Aceton und Acetonitril zur Reinigung des Reaktionsteils des Moduls und Wasser gefolgt von Ethanol, um den Formulierungsteil des Moduls zu reinigen und zu sterilisieren.
- Konditionieren Sie den Methanofen (CH4) 20 Minuten lang bei 350 °C mit einem Wasserstoffgasstrom von 100 mL/min, bevor alle Produktionen auf dem Modul durchgeführt werden. Vor dem Fortfahren auf 45 °C abkühlen lassen.
- Konditionieren Sie die CH4-Falle 20 Minuten lang bei 120 °C mit einem Heliumgasstrom von 50 mL/min, bevor alle Produktionen auf dem Modul durchgeführt werden. Vor dem Fortfahren auf 70 °C abkühlen lassen.
- Konditionieren Sie die MeI-Falle 20 Minuten lang bei 190 °C mit einem Heliumgasfluss von 50 mL/min vor allen Produktionen. Vor dem Fortfahren auf 50 °C abkühlen lassen. Stellen Sie sicher, dass der V8-Schlauch mit der Nadel im Behälter verbunden ist.
- Eine Dichtheitsprüfung mit Heliumgas vom Aufnahmeventil (V24 bis V16) bis zum internen MeI-Kreislauf und von V8 zum Behälter unter Verwendung von V23 als Dichtungs-/Abgasquelle durchführen.
- Reagenzienbeladung für das Modul:
- Folgendes hinzufügen: (R)-N-sec-butyl-4-(2-chlorphenyl)-chinazolin-2-carboxamid (1,0 ± 0,05 mg) in Dimethylsulfoxid-d6 (100 ± 10 μl) und 6 N Natriumhydroxid (4 μl) in den Reaktorbehälter.
- Befüllen Sie das V2-Reservoir mit 1,0 mL 37:63 Acetonitril:20 mM Ammoniumhydroxid.
- Befüllen Sie das V4-Reservoir mit 3,0 ml 0,9 % Natriumchlorid zur Injektion.
- Befüllen Sie den V5-Behälter mit 1,0 mL 200-prozentigem Ethanol.
- Befüllen Sie das V6-Reservoir mit 10 mL sterilem entionisiertem Wasser.
- Füllen Sie den großen Auffangkolben mit 25 mL sterilem entionisiertem Wasser.
- Füllen Sie den Formulierungskolben mit 6,0 ml 0,9 % Natriumchlorid zur Injektion.
- Stellen Sie sicher, dass die Zuführleitung mit dem vormontierten sterilen Fläschchen des Endprodukts verbunden ist.
- Füllen Sie ein Reservoir mit der mobilen HPLC-Phase (37:63 (v/v) Acetonitril:20 mM Ammoniumhydroxid) und schließen Sie es an die HPLC-Pumpe an.
HINWEIS: Die verwendete Semi-Prep-Säule ist die gleiche wie oben und mit der mobilen Phase (4 Säulenvolumen) vorkonditioniert.
- Während der Vorbereitung des automatisierten Moduls wird das Kohlenstoff-11-Zyklotron-Target (1 % Sauerstoff, 99 % Stickstoff) auf einem 11 MeV-Zyklotron bei 55 μA für 60–80 Minuten auf Dual-Beam-Targets bombardiert, um [11C]Kohlendioxid durch die 14N(p,α) 11C-Kernreaktion zu erzeugen.
- Etwa 20 Minuten vor dem Entladen von [11C]Kohlendioxid aus dem Zyklotron auf das Modul starten Sie die validierte Zeitliste für die [11C]ER-176-Synthese, indem Sie auf die Schaltfläche Start klicken. Die CH4-Säule auf 45 °C abkühlen lassen, bevor sie radioaktives Kohlendioxid (11 °C) erhält (siehe Abbildung 3). Lassen Sie die Carbosphärensäulenfalle (CH4-Falle ) auf -75 °C abkühlen
- Das in das Modul eingebettete Verfahren zur Umwandlung von [11C]Kohlendioxid in [11C]methyliodid durch einen trockenchemischen Prozess gehe wie folgt vor:
- Die Kohlendioxidaktivität von [11C] wird in [11C]Methan umgewandelt, indem mit Wasserstoffgas bei 350 °C über einem Nickelkatalysator (Shimalit-Nickel) reagiert wird. Sowohl nicht umgesetztes [11C]Kohlendioxid als auch gebildetes Wasser werden mit einer Ascaritfalle (Natriumhydroxid) zurückgehalten.
- [11°C]Methan wird zur weiteren Reinigung und Konzentration auf einer Karbosphärensäule bei -75 °C eingeschlossen. Um das Methan [11 °C] freizusetzen, wird die Karbosphärensäule auf 80 °C erhitzt.
- Reagiert das gereinigte [11C]Methan mit elementarem Jod bei 720 °C zu [11C]methyliodid über eine Umwälzgaspumpe, wobei der einfallend erzeugte Wasserstoff von einer anderen Ascaritfalle zurückgehalten wird, während unumgewandeltes [11C]Methan in den Zirkulationsprozess zurückkehrt, der als interne Kreislaufrezirkulation bezeichnet wird.
- Das gebildete [11C]methyliodid wird bei Raumtemperatur auf der MeI-Säule eingeschlossen, das sich während des Rezirkulationsprozesses angesammelt hat.
- Am Ende des Zirkulationsprozesses wird die poröse polymere Adsorptionsfalle unter Heliumfluss (30 ml/min) auf 190 °C erhitzt, um das gesammelte [11C]methyliodid freizusetzen und durch ein Rückschlagventil in das 3-ml-Reaktionsgefäß für die Kohlen-11-Radiomarkierung von (1) zu leiten.
- Sobald die Erzeugung und Akkumulation von [11C]methyliodid ein Plateau erreicht haben, wird die Silbertriflatsäule umgangen und das radioaktive Gas durch V8 in das Reaktionsgefäß geleitet, das das Vorläufergemisch enthält. Lassen Sie das [11C]Methyliodid 3 min lang sprudeln, verschließen Sie dann das Reaktionsgefäß und erhitzen Sie es 5 min lang auf 80 °C.
- Sobald die Markierung abgeschlossen ist, wird das Reaktionsgefäß nach 5 Minuten auf 30 °C abgekühlt und mit 1 ml mobiler Phase aus dem V2-Reservoir verdünnt.
- Injizieren Sie das Gemisch zur Reinigung unter den folgenden HPLC-Bedingungen auf die Semi-Prep-HPLC-Säule: mobile Phase von 37:63 (v/v) Acetonitril: 20 mM Ammoniumhydroxid bei einer Flussrate von 5,0 mL/min und einer UV-Wellenlänge von 235 nm; tR von [11C]ER-176 (1): ca. 9–11 min, siehe Abbildung 6.
- Die Fraktionsprobe wird in den großen Auffangkolben gegeben, der 25 ml steriles entionisiertes Wasser enthält. Laden Sie diese verdünnte Mischung auf eine SPE-Kartusche C18 light.
- Waschen Sie das eingeschlossene Produkt (1) mit zusätzlichen 10 ml sterilem entionisiertem Wasser.
- Eluieren Sie das gewünschte Produkt von der C18 light SPE unter Verwendung von 200 Proof Ethanol (1,0 mL) und leiten Sie es in einen Formulierungskolben, der mit 0,9 % Natriumchlorid zur Injektion (6,0 mL) vorgeladen ist.
- Spülen Sie das C18 light SPE mit zusätzlichen 3,0 ml 0,9% Natriumchlorid zur Injektion.
- Sammeln Sie die endgültige Lösung im Formulierungskolben (~10 mL). Führen Sie dieses Medium durch einen 0,22-μm-Sterilisationsfilter in ein vormontiertes steriles, apyrogenes USP Typ I 50-ml-Glasfläschchen, das mit einem Gummiseptum versiegelt und mit einer Aluminiumkappe gecrimpt ist.
- Verwenden Sie Telemanipulatoren, um ein Aliquot aus dem Durchstechzeug des Endprodukts als Qualitätskontrollprobe (QC) zu entnehmen (siehe Schritt 1.15). Die Probe wird mehreren Tests unterzogen, bei denen der Radiotracer alle Akzeptanzkriterien erfüllen muss, bevor er freigesetzt und an einen Patienten verabreicht wird (siehe Tabelle 2).
ANMERKUNG: Dieses Reaktorgefäßverfahren unter Verwendung von [11C]CH3I für die radioaktive Markierung von (2) anwenden; [11C]CH3OTf erzeugen und verwenden, um (3) und (4) zu erzeugen (siehe Zusatzdatei 1).
Ergebnisse
Die Radiochemie-Gruppe der New York University Langone Health (NYULH) bietet verschiedene Kohlenstoff-11-, Fluor-18- und Gallium-68-Radiotracer an, die sowohl für die Humanforschung als auch für präklinische Anwendungen verwendet werden. Für die Herstellung der PET-Radiotracer werden verschiedene Verfahren eingesetzt. Unser Team verwendet die Schleifenmethode für die Synthese von (1), (2), (3) und (4) (siehe Abbildung 1 und Abbildung 8). Nach Abschluss der Produktion wird ein Aliquot aus dem sterilen Fläschchen mit dem Endprodukt entfernt. Diese Probe wird sowohl für die Inokulation der Endproduktlösung (sowohl in tryptischen Sojabrühe (TSB) als auch in flüssigen Thioglycolatmedien (FTM) als Sterilitätsprobe verwendet) als auch für eine repräsentative Probe der Bulk-Lösung für QC-Tests. Jeder Radiotracer wird QC-Tests unterzogen, bevor das Produkt zur Verabreichung freigegeben wird (siehe Tabelle 2).
Die Qualitätskontrollprüfung umfasst die Visualisierung des Produktaussehens, die Überprüfung der Filterintegrität, die Bestimmung der radionukliden Identität, des pH-Werts, der radiochemischen Identität (Radio-HPLC), der radiochemischen Reinheit (Radio-HPLC), der chemischen Reinheit (HPLC), der molaren Aktivität, der Stärke, des Restlösungsmittels, der Endotoxine und der Sterilität (siehe Tabelle 2). Die folgenden Ergebnisse wurden aus der klinischen Herstellung jedes oben genannten Radiotracers erzielt (siehe Tabelle 1).
Ein repräsentatives analytisches HPLC-Chromatogramm finden Sie in Abbildung 7 und in der ergänzenden Datei 1. Jeder Radiotracer muss alle Spezifikationen der Qualitätskontrolle (siehe Tabelle 2) erfüllen, bevor er freigegeben und einem Probanden verabreicht werden kann.
In der Ergänzenden Datei 1 finden Sie die Mengen an Vorläufern und Reagenzien sowie die analytischen HPLC-Chromatogramme von [11C]MRB (2) (Ergänzende Abbildung 1), [11C]mHED (3) (Ergänzende Abbildung 2) und [11C]PiB (4) (Ergänzende Abbildung 3).
| Verbindung | Parameter | Loop-Methode (durchschnittlich ± std) | Reaktormethode (durchschnittlich ± std) |
| [11K]ER-176 | Anzahl der Produktionen | 25 | 6 |
| Start der Synthese | 86 ± 5,0 GBq | 52 ± 25,7 GBq | |
| Ende der Synthese | 5,4 ± 2,2 GBq | 1,6 ± 0,5 GBq | |
| Radiochemische Reinheit | 99,6 ± 0,6 % | 99,9 ± 0,1 % | |
| ER-176-Konzentration | 1,1 ± 0,5 μg/ml | 0,63 ± 0,37 μg/ml | |
| molare Aktivität | 194 ± 66 GBq/μmol | 132 ± 78 GBq/μmol | |
| Totale Synthesezeit | 36 ± 3 min | 44 ± 6 Minuten | |
| [11K]MRB | Anzahl der Produktionen | 70 | 6 |
| Start der Synthese | 84 ± 5,4 GBq | 39 ± 11.9 GBq | |
| Ende der Synthese | 3,0 ± 1,2 GBq | 1,9 ± 0,7 GBq | |
| Radiochemische Reinheit | 99,5 ± 0,5 % | 99,7 ± 0,8 % | |
| MRB-Konzentration | 0,52 ± 0,24 μg/ml | 0,68 ± 0,41 μg/ml | |
| molare Aktivität | 190 ± 50 GBq/μmol | 99 ± 55 GBq/μmol | |
| Totale Synthesezeit | 35 ± 3 Minuten | 42 ± 3 min | |
| [11C]mHED | Anzahl der Produktionen | 5 | 11 |
| Start der Synthese | 69 ± 10,5 GBq | 82 ± 4,3 GBq | |
| Ende der Synthese | 5,5 ± 1,3 GBq | 3,3 ± 1,0 GBq | |
| Radiochemische Reinheit | 98,2 ± 1,3 % | 99,1 ± 0,7 % | |
| mHED-Konzentration | 0,40 ± 0,10 μg/ml | 0,52 ± 0,37 μg/ml | |
| molare Aktivität | 301 ± 48 GBq/μmol | 155 ± 77 GBq/μmol | |
| Totale Synthesezeit | 27 ± 4 min | 32 ± 2 min | |
| [11K]PiB | Anzahl der Produktionen | 51 | 10 |
| Start der Synthese | 86 ± 5,4 GBq | 57 ± 17,2 GBq | |
| Ende der Synthese | 3,2 ± 0,8 GBq | 1,4 ± 0,2 GBq | |
| Radiochemische Reinheit | 97,0 ± 1,5 % | 99,1 ± 1,4 % | |
| PiB-Konzentration | 0,22 ± 0,51 μg/ml | 0,30 ± 0,24 μg/ml | |
| molare Aktivität | 201 ± 68 GBq/μmol | 207 ± 124 GBq/μmol | |
| Totale Synthesezeit | 35 ± 2 Minuten | 36 ± 5 Minuten |
Tabelle 1: Ergebnisse aus der Herstellung von [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) und [11C]PiB (4) mittels Schleifenmethode oder Reaktionsgefäßmethode. Alle Werte werden am Ende der Synthese angegeben. Abkürzungen: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorphenyl)-N-methylchinazolin-2-carboxamid; [11K]MRB = (S,S)-[11C]methylreboxetin; [11K]mHED = [11C]-Meta-Hydroxyephedrin; [11K]PiB = 2-[4-[(11C)methylamino]phenyl]-1,3-benzothiazol-6-ol.
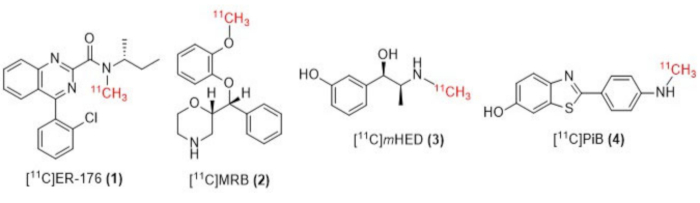
Abbildung 1: Strukturen von [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) und [11C]PiB (4). Abkürzungen: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorphenyl)-N-methylchinazolin-2-carboxamid; [11K]MRB = (S,S)-[11C]methylreboxetin; [11K]mHED = [11C]-Meta-Hydroxyephedrin; [11K]PiB = 2-[4-[(11C)methylamino]phenyl]-1,3-benzothiazol-6-ol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
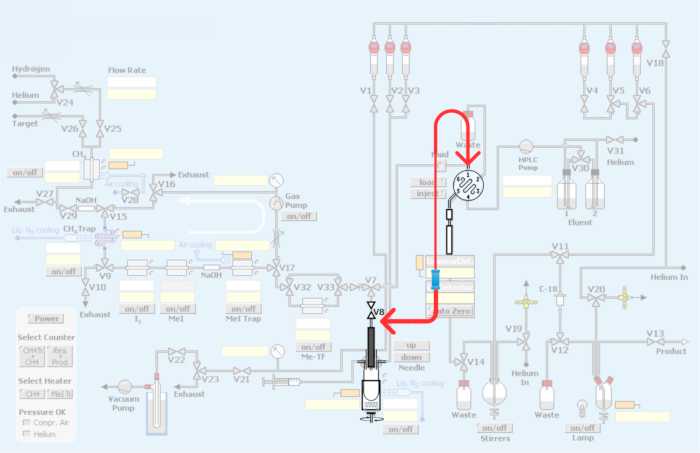
Abbildung 3: Änderungen, die am automatisierten Modul vorgenommen wurden. In Rot ist der Umbau des Synthesemoduls dargestellt, um den Kreislauf für die Herstellung von PET-Radiotracern durch Kohlenstoff-11-Methylierung einzubauen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Modulinstallation und -erneuerung zur Integration der Schleifenmethode für die Kohlenstoff-11-Methylierung von PET-Radiotracern. (A) HPLC-Injektionsschleife mit Verbindungsanschlüssen. (B) Methode des Reaktionsgefäßes. Der rote Pfeil zeigt die V8-Verbindung. (C) Neuinstallation der Loop-Methode, Umgehung des Reaktorbehälters. Es ist zu beachten, dass die V8-Verbindung zum HPLC-Einlass das Reaktionsgefäß umgeht und so den direkten Zugang von [11C]iodomethan oder [11C]methyltriflat zur HPLC-Schleife ermöglicht. (D) Platzierung der Verbindung in Bezug auf den Reaktorbehälter. Beachten Sie die Verbindung zur HPLC-Schlaufe aus Edelstahl. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
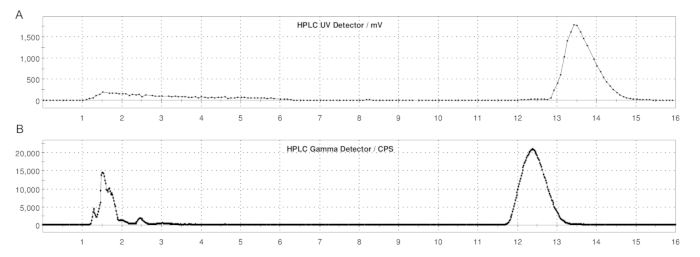
Abbildung 5: Semi-Prep HPLC Profile von ER-176 und [11C]ER-176 mit Loop Method Herstellung. (A) Semi-Prep HPLC Profil für ER-176 (1) mittels Loop-Methode bei UV = 235 nm; tR = 13,2 min. (B) Semi-Prep-Radio-HPLC-Profil für [11C]ER-176 (1); tR = 12,4 min. Bedingungen: mobile Phase von 37:63 (v/v) Acetonitril: 20 mM Ammoniumhydroxid bei einer Flussrate von 5,0 mL/min. Abkürzung: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorphenyl)-N-methylchinazolin-2-carboxamid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
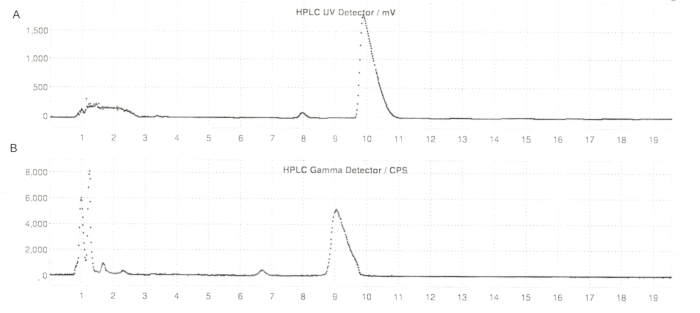
Abbildung 6: Semi-Prep-HPLC-Profile von ER-176 und [11C]ER-176 mit Reaktormethode. (A) Semi-Prep-HPLC-Profil von ER-176 (1) mittels Reaktormethodenproduktion bei UV = 235 nm; tR = 9,8 min. (B) Semi-Prep-Radio-HPLC-Profil für [11C]ER-176 (1); tR = 9,2 min. Bedingungen: mobile Phase von 37:63 (v/v) Acetonitril: 20 mM Ammoniumhydroxid bei einer Flussrate von 5,5 mL/min. Abkürzungen: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorphenyl)-N-methylchinazolin-2-carboxamid; tR = Verweilzeit. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
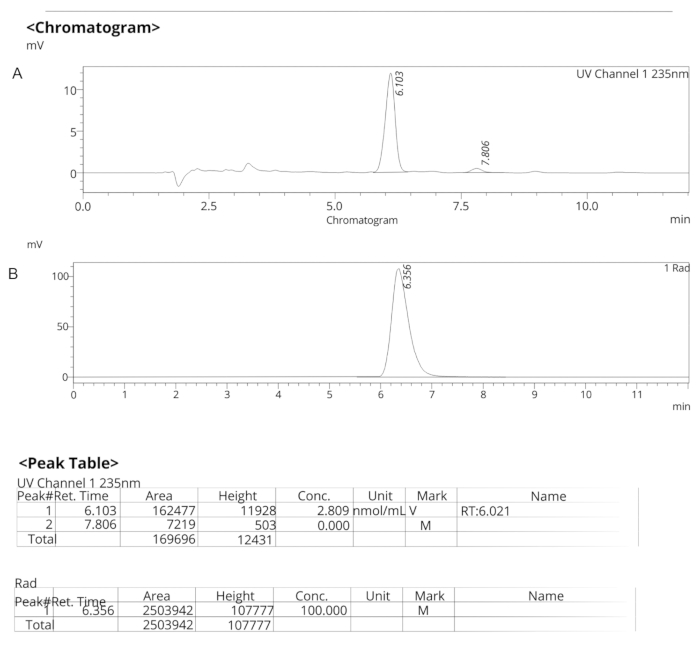
Abbildung 7: Analytische HPLC-Profile für ER-176. (A) Analytisches HPLC-Profil der UV-Spektren für ER-176 (1) bei 235 nm; tR = 6,10 min. (B) Analytisches HPLC-Profil des Radiotracers für [11C]ER-176 (1); tR = 6,36 min. Bedingungen: 10 μm C18 (2) 100  LC Säule 250 x 4,6 mm; Methanol/Wasser 74/26 mit einer Durchflussrate von 1,5 mL/min. Abkürzung: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorphenyl)-N-methylchinazolin-2-carboxamid; tR = Retentionszeit Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
LC Säule 250 x 4,6 mm; Methanol/Wasser 74/26 mit einer Durchflussrate von 1,5 mL/min. Abkürzung: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorphenyl)-N-methylchinazolin-2-carboxamid; tR = Retentionszeit Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
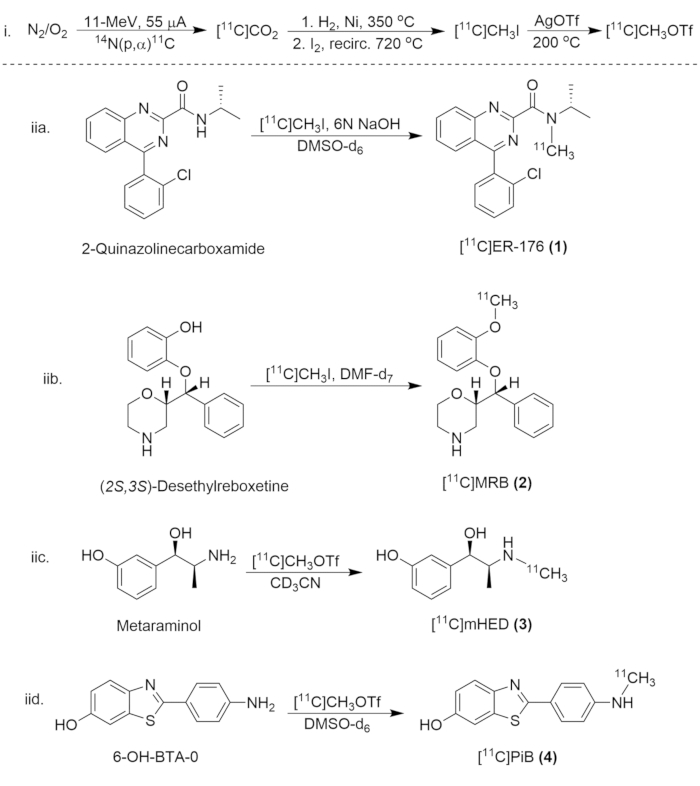
Abbildung 8: Syntheseschema für die Synthese von Kohlenstoff-11-Verbindungen. (i) Die Bildung von [11C]CH3I und [11C]CH3OTf, und (iia) die radioaktive Markierung von [11C]ER-176 (1), (iib.) [11K]MRB (2), (iic.)[11K]mHED (3) und (iid.) [11K]PiB (4). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Test/Parameter | Leistungsbeschreibung |
| Aussehen (Sichtprüfung) | Klare, farblose Lösung, die frei von Feinstaub ist |
| Integrität des Membranfilters | ≥ 50 psi |
| Ph | 4.5 - 8.0 |
| Radionuklide Identität (Halbwertszeit) | 19,3 - 21,3 Minuten |
| Radiochemische Identität (Radio-HPLC) | 0,90 ≤ tR Prod / t R Std ≤ 1,10 |
| Radiochemische Reinheit (Radio-HPLC) | ≥ 95,0 %† |
| Wirkstoffkonzentration (HPLC) | siehe Anmerkungen* |
| Chemische Verunreinigungen insgesamt (HPLC) | Siehe Anmerkungen** |
| Molare Aktivität (@ EOS) | > 9,25 GBq/μmol |
| Restacetonitril (GC) | ≤ 410 Seiten/Min. |
| Restaceton (GC) | ≤ 5.000 ppm |
| Rückstand von Dimethylsulfoxid (GC) | ≤ 5.000 ppm |
| Restethanol (GC) | ≤ 10% (v/v) |
| Restmethanol (GC) | ≤ 3.000 ppm |
| Restliches N,N-Dimethylformamid (GC) | ≤ 880 Seiten/Min. |
| Limulus-Amöbozyten-Lysat (LAL) | ≤ 17,5 EU/ml |
| Sterilität (innerhalb von 30 h einleiten) | Steril (14 Tage) |
| Aufzeichnungen über die Vorbereitung | Vollständig und genau |
| Etiketten | Vollständig, genau, abgestimmt |
Tabelle 2: Qualitätskontrollkriterien für die Zulassung oder Ablehnung von Kohlendioxid-11-Radiotracern. † Radiochemische Reinheit ≥ 90,0 % für [11C]mHED; * Wirkstoffkonzentration: [11C]ER-176 ≤ 10 μg/Dosis; [11K]MRB ≤ 10 μg/Dosis; [11K]mHED ≤ 50 μg/Dosis; [11K]PiB ≤ 13,4 μg/Dosis; ** Chemische Verunreinigungen insgesamt: [11C]ER-176 ≤ 1,0 μg/Dosis; [11K]MRB ≤ 1,0 μg/Dosis; [11K]mHED ≤ 5,0 μg/Dosis; [11K]PiB ≤ 1,34 μg/Dosis. Abkürzungen: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorphenyl)-N-methylchinazolin-2-carboxamid; [11K]MRB = (S,S)-[11C]methylreboxetin; [11K]mHED = [11C]-Meta-Hydroxyephedrin; [11K]PiB = 2-[4-[(11C)methylamino]phenyl]-1,3-benzothiazol-6-ol; EOS = Ende der Synthese; GC = Gaschromatographie; LAL = Limulus-Amöbozyten-Lysat.
Ergänzende Datei 1: Chemikalien und Materialien, Reagenzien für die Schleifen- oder Reaktorgefäßmethode, Qualitätskontrolltests, analytische HPLC-Chromatogramme. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Bei der traditionellen Radiomarkierung von terminalen Heteroatomen mit Kohlenstoff-11-Jodmethan oder Methyltriflat wird das radioaktive elektrophile Gas in ein Reaktionsgefäß geblasen, eingefangen und die Lösung über längere Zeiträume reagieren lassen18. Das konventionelle Blasenblasen der heterogenen Reaktion kann träge sein und erfordert möglicherweise eine Erwärmung, um die Reaktionsgeschwindigkeit zu beschleunigen. Vor der Aufreinigung kann ein Abkühlen des Reaktionsmediums auf Raumtemperatur erforderlich sein, gefolgt von der Überführung in eine HPLC-Schleife unter Verwendung von Lösungsmittel (z. B. mobile Phase) zur Aufreinigung des gewünschten Radiotracers. Diese Schritte sind zeitaufwändig, und flüchtige radioaktiv markierte Produkte können während des Transports solcher Materialien verloren gehen.
In unserer Anlage haben wir die Rechtfertigung für die Verwendung der Loop-Methode demonstriert, bei der die Vorläuferlösung auf eine HPLC-Edelstahlschleife aufgetragen wird und die Radiomarkierung der Verbindung innerhalb der Schleife bei Raumtemperatur stattfindet. Die Schleife wird in Linie mit der Abgabe des radioaktiven [11C]CH3I oder [11C]CH3OTf gebunden und mit dem Injektionsanschluss eines HPLC-Systems verbunden. Für die Radiomarkierung ist keine Erhitzung erforderlich, und in allen in diesem Manuskript gezeigten Fällen findet die Reaktion in weniger als 3 Minuten statt.
Die Durchflussrate und die Größe der HPLC-Schleife aus Edelstahl scheinen entscheidend für den effizienten Ablauf dieses Prozesses zu sein. Die Tests begannen mit der Variation der Durchflussrate des Trägergases Helium von 8,0 mL/min auf 15,0 mL/min, damit das radioaktive Gas in den Kreislauf eingespeist werden konnte. Buckley untersuchte, wie wichtig es ist, die richtige Durchflussrate anzuwenden und das geeignete Lösungsmittel und Schlingenmaterialzu verwenden 15. Für unser System ist die Flussrate von 15 mL/min für entweder radioaktive elektrophile Spezies von [11C]CH3I oder [11C]CH3OTf gut für die Radiomarkierung aller vier in diesem Manuskript diskutierten Radiotracer geeignet. Die für alle Synthesen verwendete Schleife ist eine HPLC-Injektionsschleife aus Edelstahl bei 1,5 mL mit einem Außendurchmesser von 1/16 Zoll und einem ID von 1 mm.
Beim Vergleich der beiden Methoden (Reaktionsgefäß versus Loop-Methode) zeigte die Loop-Methode in unseren Händen eine erhöhte Effizienz der Radiomarkierung zusammen mit einer erheblichen Steigerung der molaren Aktivität am Ende der Synthese (EOS) für die Herstellung von vier am Menschen zugelassenen Radiotracern. Als Beispiel zeigte der Radiotracer [11C]mHED (3) eine 1,6-fache Steigerung der isolierten Endproduktaktivität bei gleichzeitiger Verdoppelung der molaren Aktivität bei EOS. Dieser Trend einer erhöhten Gesamtaktivität ist bei allen vier Radiotracern zu beobachten (siehe Tabelle 1). Zu den weiteren positiven Ergebnissen bei der Verwendung der Loop-Methode gehören eine um 5 Minuten verkürzte Einrichtungszeit und die Tatsache, dass das Reaktionsgefäß nicht gereinigt werden muss, wodurch der Bediener Zeit und den Einsatz von Lösungsmitteln für ein Reinigungsprotokoll spart.
Zu den Nachteilen dieser Methode gehören die Grenzen, an denen Radiotracer mit der Schleifenmethode effektiv markiert werden können. Wenn Wärme für die Radiomarkierung erforderlich ist, ist es schwierig, dieses System so zu modifizieren, dass eine Erwärmung im Inneren der HPLC-Schleife möglich ist. Dieses System erfordert Änderungen an den Rohrleitungen; Diese Eigenschaft, wenn sie nicht "out of the box" bereit ist, kann andere Benutzer davon abhalten, solche Änderungen an ihrer automatisierten Plattformvorzunehmen 14. Da für diese Methode zusätzliche Rohrleitungen und Verschraubungen erforderlich sind (siehe Abbildung 4A-D), steigt das Potenzial für zusätzliche Stellen für radioaktive Freisetzungen bei der Markierung unter diesen Bedingungen. Es ist ratsam, vor jedem Lauf des Moduls eine Dichtheitsprüfung durchzuführen.
Unser Team hat die Loop-Methode implementiert, die bei der von der Investigational New Drug Application (IND) und dem Radioactive Drug Research Committee (RDRC) zugelassenen Produktion von vier Kohlenstoff-11-Radiotracern verwendet wird. In unseren Händen erwies sich diese Methode als ein effizienteres und ergiebigeres Verfahren als die traditionelle Reaktionsgefäßmethode. Zusätzliche Rohrleitungen und Anpassungen der Durchflussrate des Träger-Heliumgases müssen berücksichtigt werden, wenn diese Methode auf die meisten automatisierten Module angewendet wird. Schließlich weist dieses Verfahren Einschränkungen auf und ist nicht geeignet für bestimmte Kohlenstoff-11-Radiotracer, wie z. B. [11C]UCB-J, das eine Aktivierung des Palladium(II)-Zwischenprodukts und das Erhitzen24 des Reaktionsgemisches erfordert.
Offenlegungen
Die Autoren erklären, dass sie keine relevanten oder finanziellen Interessen im Zusammenhang mit dieser Forschung offenlegen müssen.
Danksagungen
Wir möchten den ehemaligen Mitgliedern des NYULH-Radiochemielabors, Raul Jackson und Grace Yoon, für ihre Arbeit an den ersten Bemühungen um die Kohlenstoff-11-Methylierung mit einer Schleifenmethode danken.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
Referenzen
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten