Method Article
使用 Loop 方法提高用于临床研究的碳 11 放射性配体的效率和放射性标记产量
摘要
该协议提出了通过"环法"[11C] 甲基化制备四种碳 11 放射性示踪剂的详细程序。我们描述了合成 [11C]ER-176 的程序,以及三种额外放射性示踪剂的数据:[11C]MRB、[11C]mHED 和 [11C]PiB。环法提供了一种高效的合成方法,与传统反应容器 [11C] 甲基化相比,放射化学产率更高。
摘要
涉及碳 11 放射性示踪剂的成功正电子发射断层扫描成像计划需要快速、高效和可靠的合成方法,需要现场回旋加速器和放射化学小组,以及受过培训的临床工作人员,以便在碳 11 放射性核素的独特限制下进行作。本研究研究了用碳 11 放射性核素对四个示踪剂进行放射性标记的捕获溶剂"环法"的优点和优势,从而产生放射性配体 [11C]ER-176、[11C]MRB、[11C]mHED 和 [11C]PiB。
在相同的自动化平台上合成相同的放射性示踪剂的过程中,将"循环方法"与传统的基于反应器的碳 11 甲基化方法进行了比较。此外,还介绍了 [11C]ER-176 放射性示踪剂的临床研究准备的完整概述。正如 [11C]ER-176 的生产所证明的那样,非均相烷基化的捕获溶剂"回路法"被证明更有效,与反应器法(EOS = 1.6 ± 0.5 GBq,n = 6)相比,具有优异的放射化学纯度(99.6 ± 0.6%,n = 25),放射化学产率更高且更一致(合成结束 (EOS) = 5.4 ± 2.2 GBq,n = 25), 摩尔活性增加(定量环法 = 194 ± 66 GBq/μmol,n = 25;反应器法 = 132 ± 78 GBq/μmol,n = 6),反应序列平均缩短 5 min。
引言
在分子成像的模式中,正电子发射断层扫描 (PET) 在解析与特定生理靶标或感兴趣区域相关的生化过程的方式上有所不同 1,2。PET 的特有灵敏度和非侵入性特性被用于疾病病理生理学的体内可视化和量化,通常会揭示计算机断层扫描 (CT) 3 或磁共振成像 (MRI)4 等解剖成像技术所看不到的目标。现代分子成像将 PET 与 CT 或 MRI(分别为 PET/CT 或 PET/MR)相结合,利用 PET 的高对比度分辨率和可量化的成像参数来提供高精度的衰减校正图 (PET/CT) 和改进的空间分辨率 (PET/MR)5,克服了放射性核素(如镓 68 和铷 82)的正电子高动能变化所带来的一些障碍6.这些双模态成像技术引导了每种模态的标志性属性,为临床医生或研究人员提供了对研究对象的大量共同注册的解剖学和生化见解5。
这种成像技术的临床应用范围很广,可以可视化和测量分子水平的生理过程,如葡萄糖代谢 7,8、神经递质受体结合 9、心肌灌注10 和各种神经系统疾病11。在临床使用之外,PET 的固有属性在诊断和治疗药物开发中发挥着不可或缺的作用,允许通过直接观察药理学、药代动力学和药效学的相互作用来量化结合电位 (BP)、生物分布、分布容积 (VT) 和药物受体占有率 (RO%) 等参数。这反过来又有助于确定,包括化合物是否在有效剂量 (ED50) 浓度下达到目标、血脑屏障的有效渗透程度、化合物的代谢完整性以及适当的剂量和给药间隔11。
在开发用于 PET 成像的有用探针时,在确定合适的生物标志物并选择相关配体后,用合适的 PET 放射性核素对生物分子进行放射性标记,从而产生用于 PET 研究的放射性示踪探针。在用于研究生物学、药理学或医学问题的 PET 放射性核素中,碳 11 结合了合成多功能性和良好的物理特性,使其能够广泛用于各种生物分子和合格的配体6。碳 11 具有 99.8% 的正电子发射和 20.4 分钟的半衰期12,允许在短时间内对受试者重复给药,同时仍允许多步合成。然而,这些优势需要具有现场回旋加速器和放射化学能力的设施5。
此类设施需要可靠、强大且可重现的甲基化方法,以便能够对前体分子进行放射性标记,通常使用亲电 [11C] 碘甲烷 ([11C]CH3I) 或 [11C] 甲基三氟磺酸酯 ([11C]CH3OTf) 底物13。制造商提供的放射性合成模块通常配置为 [11C] 甲基化反应的反应容器方法14。这包括冷却容器以在输送时有效保留 [11C] 碘甲烷或 [11C] 甲基三氟磺酸酯,密封和加热容器以实现反应,淬灭,然后将反应内容物转移到高效液相色谱 (HPLC) 系统进行半制备纯化13。虽然有效15,但该技术存在许多潜在的结构故障点,涉及样品瓶隔垫、针头和相关转移管线。
对更可靠和可重复的甲基化方法的需求指导了我们对许多碳 11 放射性配体合成方案的捕获溶剂修饰的研究和追求。该方法旨在解决传统反应容器方法的局限性,同时保持或提高放射性标记效率。
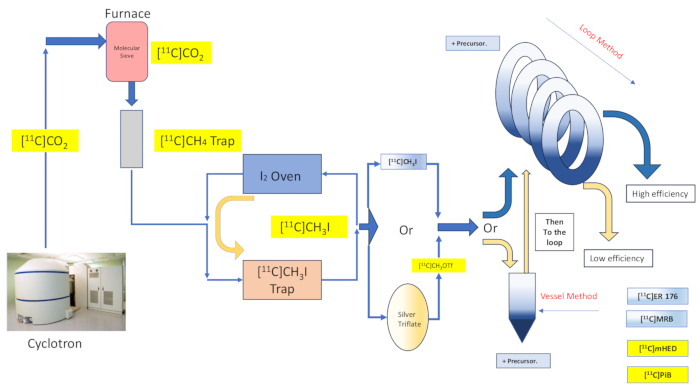
图 2:反应容器合成和定量环法的设计和流程。请单击此处查看此图的较大版本。
捕获溶剂化学通过将前体溶液铺展到支撑材料或结构的大面积上,然后将气态标记试剂与包被材料接触,从而有望有效地捕获放射性标记试剂并与之反应16,17。这提高了两种反应物相之间接触的程度和质量16,18。早在 1985 年,该技术的许多实施和变体就已被记录在 16,17,18,19,20 中,它已应用于 [11C] 甲基碘、[11C] 甲基三氟磺酸酯以及格氏试剂 [11C] 二氧化碳放射性标记反应 20.Wilson 等人最初描述了捕获溶剂"定量环法"化学方法,进一步完善了该方法,该化学方法不需要对 HPLC 纯化定量环已经提供的任何额外支持,也不需要对反应环境进行加热或冷却13。发现俘虏溶剂"环法"放射性标记可赋予碘甲烷和三氟甲磺酸甲酯 [11C] 甲基化反应,具有转移损失最小、放射化学产率高、摩尔活性高、反应时间缩短和简单性等优点 7,21,22,23。
在本文中,我们描述了我们小组最初由 Wilson13 和其他人14、15、18、21、22、23(见图 2)通过机械修改(见图 3)对我们的合成模块(以下简称模块)进行机械修改(见图 3)的"循环法"[11C] 甲基化技术的实现).这些机械修改尽可能接近简单的理想精神,最小且易于访问,从而整体降低了工程复杂性,并且仅在模块制造商已经安装的部件上添加了与默认反应容器放射性标记安排相关的基本组件。这反映在决定使用模块制造商已经提供和预装的不锈钢 HPLC 纯化定量环上,如下所述,事实证明,该定量环与所检查的合成物兼容且有效。我们详细讨论了临床研究生产中用于合成放射性示踪剂 [11C]-(R)-N-sec-butyl-4-(2-chlorophenyl)-N-甲基喹唑啉-2-羧酰胺,[11C]ER-176 (1))的完整且经过验证的循环方法放射性标记方案,使用碳-11 碘甲烷。此外,我们比较了反应器方法和环法对三个附加放射性配体进行的反应器方法与放射性标记效率相关的许多属性,其中包括 (S,S)-[11C]甲基瑞波西汀 ([11C]MRB (2))、[11C]-间羟基麻黄碱 ([11C]mHED (3)) 和 2-[4-[(11C)甲基氨基]苯基] -1,3-苯并噻唑-6-醇 ([11C]PiB (4))在我们的设施中开发,通过分析合成批次确定(见表 1 和图 1 )。这种比较说明了与实施"环法"放射性标记相关的放射化学产率和摩尔活性等参数的明显优势,通过对放射化学实验室来说成本最低的可访问和简单的模块修改。
研究方案
注:所有设备和合成均在铅屏蔽热室或微型电池中进行。注意:高能正电子发射粒子由回旋加速器产生和使用。该区域由校准的盖革计数器监测,个人佩戴辐射安全颁发的剂量测定环和徽章。所有人员都经过了处理高能放射性物质的培训。
所有合成均根据我们的内部标准作程序 (SOP) 在干净和消毒的模块上进行。清洁过程包括对模块的反应部分使用 1 N HCl、水、丙酮和乙腈。同时,模块的配方部分用水和乙醇进行清洁和消毒。
1. 通过环法对 [ 11C]ER-176 (1) 进行放射性标记
注:有关制备 [11C]ER-176 (1) 所用材料清单,请参阅 材料表。
- 重新连接模块以生产循环方法(参见 图 4A-D)。将 V8 阀连接到直接连接到 HPLC 定量环的接头上。这将绕过反应容器。
- 在模块上进行所有生产之前,将甲烷 (CH4) 炉在 350 °C 下以 100 mL/min 的氢气流量调节 20 分钟。冷却至 45 oC 后再继续。
- 在模块上进行所有生产之前,将 CH4 捕集阱在 120 °C 下以 50 mL/min 的氦气流量调节 20 分钟。冷却至 70 oC 后再继续。
- 在模块上进行所有生产之前,将甲基碘捕集阱在 190 °C 下以 50 mL/min 的氦气流量调节 20 分钟。冷却至 50 oC 后再继续。
- 模块的试剂加载:
- 使用 100 μL 注射器,通过适配器将以下混合物注入六通阀内部 HPLC 定量环的位置 #1:(R)-N-仲丁基-4-(2-氯苯基)-喹唑啉-2-甲酰胺 (1.0 ± 0.05 mg) 在二甲基亚砜-d 6 (100 ± 10 μL) 和 6 N 氢氧化钠 (4 μL) 中。
注:选择氘代溶剂是因为它们以安瓿形式存在,并且因为它们通常在制造过程中进行蒸馏,确保它们不含水。 - 向 V4 储液槽中加入 3.0 mL 0.9% 氯化钠进行注射。
- 向 V5 储液槽中加入 1.0 mL 的 200 级乙醇。
- 在 V6 储液槽中加入 10 mL 无菌去离子水。
- 在大接收瓶中加入 25 mL 无菌去离子水。
- 用 6.0 mL 0.9% 氯化钠填充制剂瓶,用于注射。
- 确保输送管线连接到无菌的预组装最终产品样品瓶上。
- 用乙腈和 20 mM 氢氧化铵的 37:63 (v/v) 混合物制备流动相。
- 用 4 倍柱体积的流动相调节半制备柱。
注:使用的色谱柱是 C18 100 mm x 10 mm 反相色谱柱。
- 使用 100 μL 注射器,通过适配器将以下混合物注入六通阀内部 HPLC 定量环的位置 #1:(R)-N-仲丁基-4-(2-氯苯基)-喹唑啉-2-甲酰胺 (1.0 ± 0.05 mg) 在二甲基亚砜-d 6 (100 ± 10 μL) 和 6 N 氢氧化钠 (4 μL) 中。
- 在自动化模块的准备过程中,在 11 MeV 回旋加速器上以 55 μA 的电流轰击碳-11 回旋加速器靶(1% 氧气,99% 氮气)60-80 分钟,以产生 [11C] 二氧化碳通过 14N(p,α) 11C 核反应。
- 在将 [11C] 二氧化碳从回旋加速器卸载到模块前大约 20 分钟,单击开始按钮启动 [11C]ER-176 合成的验证时间列表。在接收放射性 [11C] 二氧化碳之前,让 CH4 色谱柱冷却至 45 oC(参见图 3)。让碳球柱捕集器(CH4 捕集阱)冷却至 -75 °C。
- 让模块中嵌入的通过干化学过程将 [11C] 二氧化碳转化为 [11C] 碘甲烷的方法进行如下作:
- 通过在镍催化剂 (Shimalite-Nickel) 上与 350 oC 的氢气反应,将 [11C] 二氧化碳活性转化为 [11C] 甲烷。使用蛔石捕集器(氢氧化钠)保留未转化的 [11C] 二氧化碳和形成的水。
- 将形成的 [11C] 甲烷捕获在 -75 °C 的碳球柱捕集器(CH4 捕集阱)上,以进一步纯化和浓缩。要释放捕获的 [11C] 甲烷,请将碳球柱加热至 80 oC。
- 通过氦再循环气泵将纯化的 [11C] 甲烷与元素碘在 720 oC 下反应形成 [11C] 甲基碘 ([11C]CH3I),其中入射产生的碘化氢被另一个蛔石捕集器保留,而未转化的 [11C] 甲烷返回循环过程。
- 在室温下将形成的 [11C]CH3I 包封在再循环过程中积累的碘甲烷 (MeI) 柱上。
- 在循环过程结束时,在氦气流 (15 mL/min) 下加热至 190 °C,将收集的 [11C]CH3I 从 MeI 捕集阱中释放出来,从 MeTf 柱旁路,并通过止回阀进入含有预加载前体溶液的 1.5 mL 不锈钢定量环(步骤 1.5.1)。
- [11C]CH3I 通过定量环 180 秒后,将反应混合物注入半制备 HPLC 色谱柱进行纯化。使用以下 HPLC 条件:37:63 (v/v) 乙腈的流动相:20 mM 氢氧化铵,流速为 5.0 mL/min,UV 波长为 235 nm;[11C]ER-176 的保留时间 (tR):约 12–14 min。参见图 5。
- 将馏分样品收集到装有 25 mL 无菌去离子水的大接收瓶中。将稀释的混合物上样到 C18 轻固相萃取 (SPE) 小柱上。
- 用另外 10 mL 无菌去离子水洗涤产品 (1)。
- 使用 200 级乙醇 (1 mL) 从 C18 light SPE 中洗脱所需产物。将洗脱液直接放入预装有 0.9% 氯化钠的注射用制剂培养瓶 (6 mL) 中。
- 再加入 3 mL 0.9% 氯化钠,进一步冲洗 C18 light SPE,以便通过 V4 储液槽进样。
- 将最终溶液收集在制剂瓶 (~10 mL) 中,并通过 0.22 μm 灭菌过滤器进入预组装的无菌、无热原 USP I 型 50 mL 玻璃样品瓶中,用橡胶隔垫密封并用铝盖压接。
- 使用远程纵器,从最终产品样品瓶中取出等分试样作为质量控制 (QC) 样品。对该样品进行大量 QC 测试,以确保在释放和给药给患者之前符合既定规范(见 表 2)。
注:使用 [11C]CH3I 对 (2) 进行放射性标记,应用此循环方法程序;生成并使用 [11C]CH3OTf 生成 (3) 和 (4)( 参见 补充文件 1)。- 为了遵循在工厂中进行的典型质量控制分析,使用远程机械手将样品从最终产品瓶转移到 TB 注射器中,然后使用铅屏蔽载体转移到质量控制室。
- 在铅屏蔽区域(L 块)中,将样品排入无热原的试管中,然后将其分配到较小的玻璃样品瓶 (50–100 μL) 中,用于 HPLC 和气相色谱 (GC) 分析。
- 用无热原的水将第二个样品稀释至适当的浓度,以进行细菌内毒素分析。
- 接种最终产品溶液的样品(在胰蛋白酶大豆汤 (TSB) 和巯基乙酸盐液 (FTM) 培养基中作为无菌样品)。孵育并观察这些样品在 14 天内的生长情况。
- 将少量等分试样涂在 pH 试纸上,以目测确定最终产品溶液的酸度/碱度。
2. 用于 [11C]ER-176 放射性标记的反应容器法 (1)
- 确保根据内部清洁协议彻底清洁模块。
- 使用 1 N HCl、水、丙酮和乙腈清洁模块的反应部分,然后用水和乙醇清洁和消毒模块的制剂部分。
- 在模块上进行所有生产之前,将甲烷 (CH4) 炉在 350 °C 下以 100 mL/min 的氢气流量调节 20 分钟。冷却至 45 oC 后再继续。
- 在模块上进行所有生产之前,将 CH4 捕集阱在 120 °C 下以 50 mL/min 的氦气流量调节 20 分钟。冷却至 70 oC 后再继续。
- 在所有生产之前,将 MeI 捕集阱在 190 °C 下以 50 mL/min 的氦气流速调节 20 分钟。冷却至 50 oC 后再继续。确保 V8 管路连接到容器中的针头。
- 使用氦气进行泄漏测试,从接收阀(V24 到 V16)到内部 MeI 回路,以及从 V8 到容器,使用 V23 作为密封/排气源。
- 模块的试剂加载:
- 将以下内容:(R)-N-仲丁基-4-(2-氯苯基)-喹唑啉-2-甲酰胺 (1.0 ± 0.05 mg) 在二甲基亚砜-d 6 (100 ± 10 μL) 和 6 N 氢氧化钠 (4 μL) 中加入反应器容器中。
- 向 V2 储液槽中加入 1.0 mL 37:63 乙腈:20 mM 氢氧化铵。
- 向 V4 储液槽中加入 3.0 mL 0.9% 氯化钠进行注射。
- 向 V5 储液槽中加入 1.0 mL 的 200 级乙醇。
- 在 V6 储液槽中加入 10 mL 无菌去离子水。
- 在大接收瓶中加入 25 mL 无菌去离子水。
- 用 6.0 mL 0.9% 氯化钠填充制剂瓶,用于注射。
- 确保输送管线连接到预组装的无菌最终产品样品瓶。
- 用 HPLC 流动相(37:63 (v/v) 乙腈:20 mM 氢氧化铵)填充储液槽并连接到 HPLC 泵。
注:使用的半制备柱与上述相同,并使用流动相(4 倍柱体积)进行预处理。
- 在自动化模块的准备过程中,在 11 MeV 回旋加速器上以 55 μA 的电流轰击碳-11 回旋加速器靶(1% 氧气,99% 氮气)60-80 分钟,以产生 [11C] 二氧化碳通过 14N(p,α) 11C 核反应。
- 在将 [11C] 二氧化碳从回旋加速器卸载到模块前大约 20 分钟,单击开始按钮启动 [11C]ER-176 合成的验证时间列表。在接收放射性 [11C] 二氧化碳之前,让 CH4 色谱柱冷却至 45 oC(参见图 3)。让碳球柱捕集阱(CH4 捕集阱)冷却至 -75 oC
- 让模块中嵌入的通过干化学过程将 [11C] 二氧化碳转化为 [11C] 碘甲烷的方法进行如下作:
- 通过在镍催化剂 (Shimalite-Nickel) 上与 350 oC 的氢气反应,将 [11C] 二氧化碳活性转化为 [11C] 甲烷。用蛔石捕集器(氢氧化钠)保留未转化的 [11C] 二氧化碳和形成的水。
- 在 -75 oC 的碳球柱上捕获 [11C] 甲烷,以进一步纯化和浓缩。要释放 [11C] 甲烷,请将碳球柱加热至 80 oC。
- 通过再循环气泵将纯化的 [11C] 甲烷与元素碘在 720 oC 下反应形成 [11C] 甲基碘,其中事件产生的氢气被另一个蛔石捕集器保留,而未转化的 [11C] 甲烷返回循环过程,称为内部回路再循环。
- 在室温下将形成的 [11C] 甲基碘捕获在再循环过程中积累的 MeI 柱上。
- 在循环过程结束时,在氦气流 (30 mL/min) 下将多孔聚合物吸附剂捕集阱加热至 190 °C,以释放收集的 [11C] 甲基碘,并将其通过止回阀引导至 3 mL 反应容器,用于对 (1) 进行碳 11 放射性标记。
- 一旦 [11C] 甲基碘的生成和积累趋于稳定,绕过三氟甲磺酸银柱,将放射性气体通过 V8 引导到含有前驱体混合物的反应容器中。让 [11C] 甲基碘鼓泡 3 分钟,然后密封反应容器并在 80 °C 下加热 5 分钟。
- 标记完成后,5 分钟后,将反应容器冷却至 30 °C,并用 V2 储液槽中的 1 mL 流动相稀释。
- 将混合物注入半制备型 HPLC 色谱柱上,使用以下 HPLC 条件进行纯化:37:63 (v/v) 乙腈的流动相:20 mM 氢氧化铵,流速为 5.0 mL/min,UV 波长为 235 nm;[11C]ER-176 (1) 的 tR:大约 9-11 分钟,见图 6。
- 将馏分样品收集到装有 25 mL 无菌去离子水的大接收瓶中。将此稀释的混合物上样到 C18 Light SPE 小柱上。
- 用另外 10 mL 无菌去离子水清洗被捕获的产品 (1)。
- 使用 200 标准乙醇 (1.0 mL) 从 C18 light SPE 中洗脱所需产物,将乙醇直接放入预装有 0.9% 注射用氯化钠的配方瓶 (6.0 mL) 中。
- 再加入 3.0 mL 0.9% 氯化钠冲洗 C18 light SPE,用于进样。
- 将最终溶液收集在制剂培养瓶 (~10 mL) 中。将此填料通过 0.22 μm 灭菌过滤器,放入预组装的无菌、无热原、USP I 型 50 mL 玻璃样品瓶中,该玻璃瓶用橡胶隔膜密封,并用铝盖压接。
- 使用遥控机械手从最终产品瓶中取出等分试样作为质量控制 (QC) 样品(参见步骤 1.15)。对样本进行多次测试,其中放射性示踪剂必须在释放和给药到患者之前通过所有验收标准(见 表 2)。
注:使用 [11C]CH3I 对 (2) 进行放射性标记;生成并使用 [11C]CH3OTf 生成 (3) 和 (4)( 参见 补充文件 1)。
结果
纽约大学朗格尼健康中心 (NYULH) 放射化学小组提供各种碳 11、氟 18 和镓 68 放射性示踪剂,用于人类研究和临床前应用。PET 放射性示踪剂的生产采用了多种方法。我们的团队采用循环方法合成 (1) 、 (2) 、 (3) 和 (4) (见图 1 和图 8)。生产完成后,从无菌最终产品样品瓶中取出等分试样。该样品用于接种最终产品溶液(在胰蛋白酶大豆汤 (TSB) 和巯基乙酸液态培养基 (FTM) 培养基中作为无菌样品)以及用于 QC 测试的散装溶液的代表性样品。每种放射性示踪剂在产品放行给药之前都经过 QC 测试(见 表 2)。
质量控制测试包括产品外观的可视化、过滤器完整性的验证、放射性核素鉴定、pH 值、放射化学鉴定(放射 HPLC)、放射化学纯度(放射 HPLC)、化学纯度 (HPLC)、摩尔活度、强度、残留溶剂、内毒素和无菌性的测定(见 表 2)。从上述每种放射性示踪剂的临床生产中获得以下结果(见 表 1)。
有关具有代表性的分析 HPLC 色谱图,请参见图 7 和 补充文件 1。每个放射性示踪剂都必须通过所有质量控制规范(见 表 2),然后才能释放并施用于受试者。
有关母离子和试剂的量以及 [11C]MRB (2)(补充图 1)、[11C]mHED (3)(补充图 2)和 [11C]PiB (4)(补充图 3)的分析型 HPLC 色谱图,请参阅补充文件 1。
| 复合 | 参数 | 循环法 (avg ± std) | 反应器法 (avg ± std) |
| [11个分类]ER-176 系列 | 产品数量 | 25 | 6 |
| 合成开始 | 86 ± 5.0 GB q | 52 ± 25.7 GB q | |
| 合成结束 | 5.4 ± 2.2 GB q | 1.6 ± 0.5 GB q | |
| 放射化学纯度 | 99.6 ± 0.6% | 99.9 ± 0.1% | |
| ER-176 浓度 | 1.1 ± 0.5 μg/mL | 0.63 ± 0.37 μg/mL | |
| 摩尔活性 | 194 ± 66 GBq/μmol | 132 ± 78 GBq/μmol | |
| 总合成时间 | 36 ± 3 分钟 | 44 ± 6 分钟 | |
| [11个分类]MRB | 产品数量 | 70 | 6 |
| 合成开始 | 84 ± 5.4 GB q | 39 ± 11.9 GB q | |
| 合成结束 | 3.0 ± 1.2 GB q | 1.9 ± 0.7 GB q | |
| 放射化学纯度 | 99.5 ± 0.5% | 99.7 ± 0.8% | |
| MRB 浓度 | 0.52 ± 0.24 μg/mL | 0.68 ± 0.41 μg/mL | |
| 摩尔活性 | 190 ± 50 GBq/μmol | 99 ± 55 GBq/μmol | |
| 总合成时间 | 35 ± 3 分钟 | 42 ± 3 分钟 | |
| [11C]mHED | 产品数量 | 5 | 11 |
| 合成开始 | 69 ± 10.5 GB q | 82 ± 4.3 GB q | |
| 合成结束 | 5.5 ± 1.3 GB q | 3.3 ± 1.0 GBq | |
| 放射化学纯度 | 98.2 ± 1.3% | 99.1 ± 0.7% | |
| mHED 浓度 | 0.40 ± 0.10 μg/mL | 0.52 ± 0.37 μg/mL | |
| 摩尔活性 | 301 ± 48 GBq/μmol | 155 ± 77 GBq/μmol | |
| 总合成时间 | 27 ± 4 分钟 | 32 ± 2 分钟 | |
| [11个分类]PiB | 产品数量 | 51 | 10 |
| 合成开始 | 86 ± 5.4 GB q | 57 ± 17.2 GB q | |
| 合成结束 | 3.2 ± 0.8 GBq | 1.4 ± 0.2 GB q | |
| 放射化学纯度 | 97.0 ± 1.5% | 99.1 ± 1.4% | |
| PiB 浓度 | 0.22 ± 0.51 μg/mL | 0.30 ± 0.24 μg/mL | |
| 摩尔活性 | 201 ± 68 GBq/μmol | 207 ± 124 GBq/μmol | |
| 总合成时间 | 35 ± 2 分钟 | 36 ± 5 分钟 |
表 1:通过定量环法或反应容器法生产 [11C]ER-176 (1)、[11C]MRB (2)、[11C] m HED (3) 和 [11C] PiB (4) 的结果。所有值都在合成结束时报告。缩写: [11C]ER-176 = [11C]-(R)-N-仲丁基-4-(2-氯苯基)-N-甲基喹唑啉-2-甲酰胺;[11个分类]MRB = (S,S)-[11C] 甲基瑞波西汀;[11个分类]米HED = [11C]-间羟基麻黄碱;[11个分类]PiB = 2-[4-[(11C)甲基氨基]苯基]-1,3-苯并噻唑-6-醇。
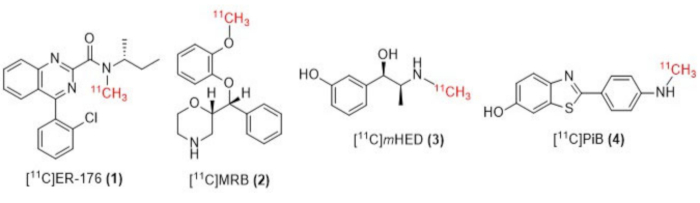
图 1:[11C]ER-176 (1)、[11C]MRB (2)、[11C] m HED (3) 和 [11C] PiB (4) 的结构。 缩写: [11C]ER-176 = [11C]-(R)-N-仲丁基-4-(2-氯苯基)-N-甲基喹唑啉-2-甲酰胺;[11个分类]MRB = (S,S)-[11C] 甲基瑞波西汀;[11个分类]米HED = [11C]-间羟基麻黄碱;[11个分类]PiB = 2-[4-[(11C)甲基氨基]苯基]-1,3-苯并噻唑-6-醇。请单击此处查看此图的较大版本。
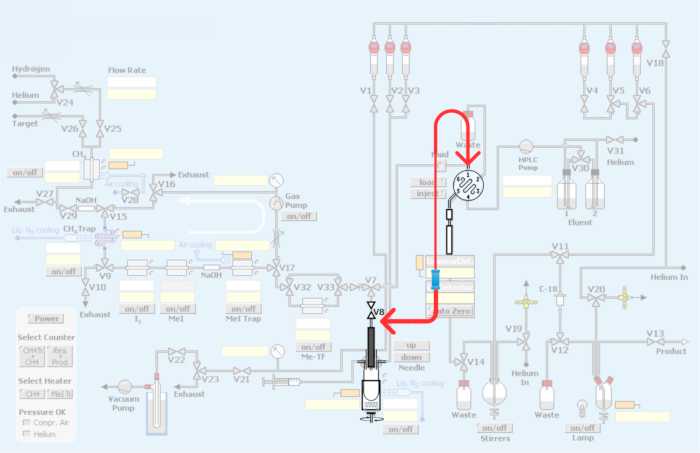
图 3:对自动化模块所做的修改。 红色代表合成模块的重新管道,以整合通过碳 11 甲基化生产 PET 放射性示踪剂的回路。 请单击此处查看此图的较大版本。

图 4:模块管道和再管道,以结合 PET 放射性示踪剂碳 11 甲基化的回路方法。(A) 带有活接头的 HPLC 进样回路。(B) 反应容器法。显示 V8 连接的红色箭头。(C) 循环法重新连接,绕过反应器容器。请注意,与 HPLC 入口的 V8 连接绕过了反应容器,允许 [11C] 碘甲烷或 [11C] 甲基三氟甲磺酸直接进入 HPLC 定量环。(D) 活接器相对于反应堆容器的位置。注意与不锈钢 HPLC 定量环的连接。请单击此处查看此图的较大版本。
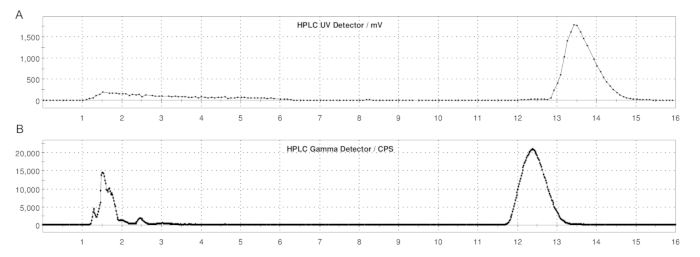
图 5:使用定量环法生产 ER-176 和 [11C]ER-176 的半制备 HPLC 曲线。 (A) ER-176 的半制备 HPLC 曲线 (1) 在 UV = 235 nm 下通过定量环法生产;tR = 13.2 min. (B) [11C]ER-176 的半制备放射性 HPLC 曲线 (1);tR = 12.4 分钟。条件:37:63 (v/v) 流动相乙腈:20 mM 氢氧化铵,流速为 5.0 mL/min。缩写:[11C]ER-176 = [11C]-(R)-N-仲丁基-4-(2-氯苯基)-N-甲基喹唑啉-2-甲酰胺。 请单击此处查看此图的较大版本。
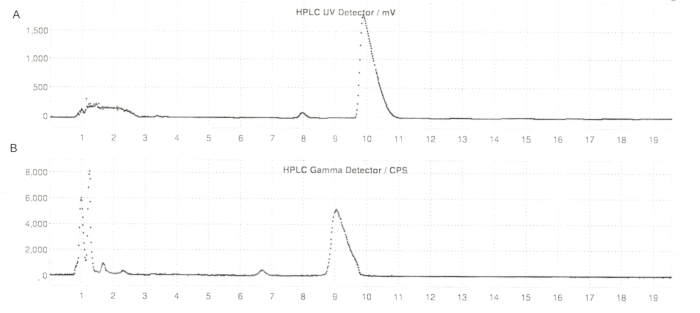
图 6:ER-176 和 [11C]ER-176 在反应器方法下半制备 HPLC 曲线。 (A) ER-176 的半制备 HPLC 曲线 (1) 在 UV = 235 nm 下通过反应器方法生产;tR = 9.8 min. (B) [11C]ER-176 的半制备放射性 HPLC 曲线 (1);tR = 9.2 分钟。条件:37:63 (v/v) 乙腈流动相:20 mM 氢氧化铵,流速为 5.5 mL/min。缩写: [11C]ER-176 = [11C]-(R)-N-仲丁基-4-(2-氯苯基)-N-甲基喹唑啉-2-甲酰胺;tR = 保留时间。 请单击此处查看此图的较大版本。
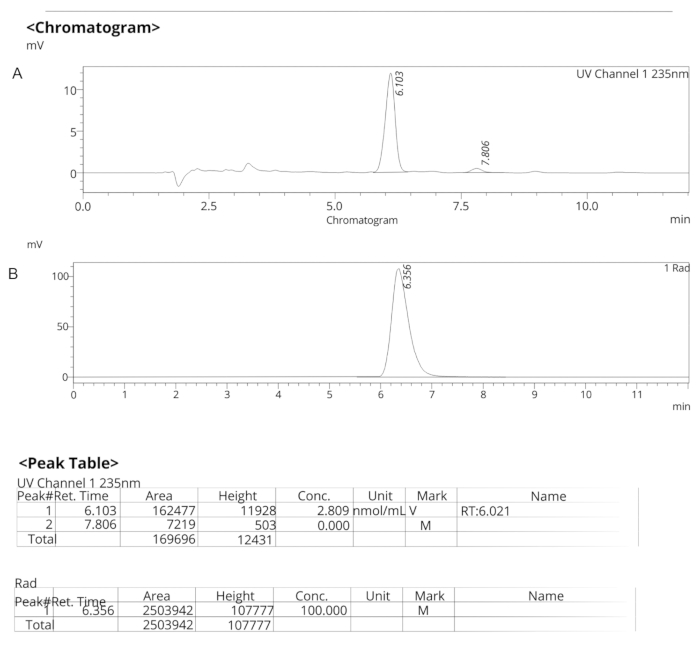
图 7:ER-176 的分析型 HPLC 曲线。 (A) ER-176 的 UV 光谱分析 HPLC 曲线 (1) 在 235 nm 处;tR = 6.10 min. (B) 放射性示踪剂对 [11C]ER-176 的分析型 HPLC 曲线 (1);tR = 6.36 分钟条件:10 μm C18 (2) 100  LC 色谱柱 250 × 4.6 mm;甲醇/水 74/26,流速为 1.5 mL/min。缩写:[11C]ER-176 = [11C]-(R)-N-仲丁基-4-(2-氯苯基)-N-甲基喹唑啉-2-甲酰胺;tR = 保留时间 请点击此处查看此图的较大版本。
LC 色谱柱 250 × 4.6 mm;甲醇/水 74/26,流速为 1.5 mL/min。缩写:[11C]ER-176 = [11C]-(R)-N-仲丁基-4-(2-氯苯基)-N-甲基喹唑啉-2-甲酰胺;tR = 保留时间 请点击此处查看此图的较大版本。
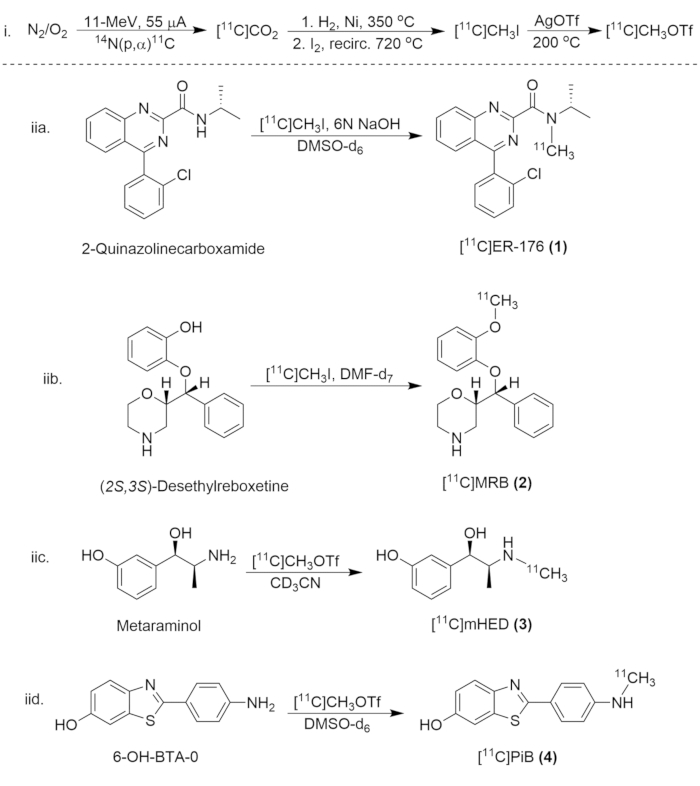
图 8:合成碳 11 化合物的合成方案。 (i) [11C]CH3I 和 [11C]CH3OTf 的形成,以及 (iia.) [11C]ER-176 (1)、(iib.) 的放射性标记。[11个分类]MRB (2), (iic.)[11个分类]米HED (3) 和 (iid.)[11个分类]PiB (4) 的 Bean S (4)。 请单击此处查看此图的较大版本。
| 测试/参数 | 规格 |
| 外观(目视检查) | 无颗粒物的透明无色溶液 |
| 膜过滤器完整性 | ≥ 50 磅/平方英寸 |
| 酸碱度 | 4.5 - 8.0 |
| 放射性核素特性(半衰期) | 19.3 - 21.3 分钟 |
| 放射化学鉴定(放射性 HPLC) | 0.90 ≤ 吨R 印制 / 吨 R 标准 ≤ 1.10 |
| 放射化学纯度(放射性 HPLC) | ≥ 95.0%† |
| 药物浓度 (HPLC) | 见注释* |
| 总化学杂质 (HPLC) | 查看注释** |
| 摩尔活性 (@ EOS) | > 9.25 GBq/μmol |
| 残留乙腈 (GC) | ≤ 410 页/分钟 |
| 残留丙酮 (GC) | ≤ 5,000 页/分钟 |
| 残留的二甲基亚砜 (GC) | ≤ 5,000 页/分钟 |
| 残余乙醇 (GC) | ≤ 10% (v/v) |
| 残留甲醇 (GC) | ≤ 3,000 页/分钟 |
| 残留的 N,N-二甲基甲酰胺 (GC) | ≤ 880 页/分钟 |
| 鲎变形细胞裂解物 (LAL) | ≤ 17.5 EU/mL |
| 无菌(30 小时内开始) | 无菌 (14 天) |
| 准备记录 | 完整准确 |
| 标签 | 完整、准确、协调 |
表 2:批准或拒绝碳 11 放射性示踪剂的质量控制标准。 † [11C]mHED 的放射化学纯度≥ 90.0%;* 药物浓度:[11C]ER-176 ≤ 10 μg/剂;[11个分类]MRB ≤ 10 μg/剂量;[11个分类]米HED ≤ 50 μg/剂量;[11个分类]PiB ≤ 13.4 μg/剂量;** 总化学杂质:[11C]ER-176 ≤ 1.0 μg/剂量;[11个分类]MRB ≤ 1.0 μg/剂;[11个分类]米HED ≤ 5.0 μg/剂量;[11个分类]PiB ≤ 1.34 μg/剂量。缩写: [11C]ER-176 = [11C]-(R)-N-仲丁基-4-(2-氯苯基)-N-甲基喹唑啉-2-甲酰胺;[11个分类]MRB = (S,S)-[11C] 甲基瑞波西汀;[11个分类]米HED = [11C]-间羟基麻黄碱;[11个分类]PiB = 2-[4-[(11C)甲基氨基]苯基]-1,3-苯并噻唑-6-醇;EOS = 综合结束;GC = 气相色谱法;LAL = 鲎试剂 Amebocyte Lysate。
补充文件 1: 化学品和材料、用于定量环或反应器容器法的试剂、质量控制测试、分析 HPLC 色谱图。 请点击此处下载此文件。
讨论
用碳 11 碘甲烷或三氟甲磺酸甲酯对末端杂原子进行传统的放射性标记,包括将放射性亲电气体鼓泡到反应容器中,将其捕获,并让溶液长时间反应18。非均相反应的常规鼓泡可能很缓慢,可能需要加热以加快反应速率。纯化前,可能需要将反应介质冷却至室温,然后使用溶剂(例如流动相)转移到 HPLC 定量环中,以纯化所需的放射性示踪剂。这些步骤非常耗时,并且在转移此类材料期间可能会丢失转瞬即逝的放射性标记产品。
在我们的工厂,我们已经证明了使用定量环法的合理性,其中前驱体溶液包被在 HPLC 不锈钢定量环上,化合物的放射性标记在室温下在定量环内进行。该定量环与放射性 [11C]CH3I 或 [11C]CH3OTf 的输送线相连,并连接到 HPLC 系统的进样口。放射性标记发生不需要加热,对于本手稿中显示的所有情况,反应都在 3 分钟内发生。
不锈钢 HPLC 定量环的流速和尺寸似乎对于该工艺的高效运行至关重要。首先将载气氦气的流速从 8.0 mL/min 更改为 15.0 mL/min,以便将放射性气体输送到定量环。Buckley 研究了应用正确流速以及使用适当溶剂和定量环材料的重要性15。对于我们的系统,[11C]CH3I 或 [11 C]CH3OTf 的放射性亲电物质的流速为 15mL/min,对于本手稿中讨论的所有四种放射性示踪剂的放射性标记表现良好。用于所有合成的定量环是 1.5 mL 的不锈钢 HPLC 进样定量环,外径为 1/16 inch,内径为 1 mm。
比较我们手中的两种方法(反应容器与环法),环法证明,对于生产四种人类研究批准的放射性示踪剂,放射性标记效率提高,合成末 (EOS) 的摩尔活性显著增加。例如,放射性示踪剂 [11C]mHED (3) 的分离最终产物活性增加了 1.6 倍,同时在 EOS 处实现了两倍的摩尔活性。在所有四种放射性示踪剂中都观察到这种总体活性增加的趋势(见表 1)。使用定量环法时的其他有利结果包括:设置时间缩短了 5 min,并且无需清洁反应容器,从而节省了作人员的时间,并使用溶剂进行清洁。
这种方法的一些缺点包括使用循环方法可以有效标记的放射性示踪剂的限制。如果放射性标记需要加热,则很难修改该系统以允许在 HPLC 回路内加热。该系统需要对管道进行修改;这种没有"开箱即用"的功能可能会阻止其他用户对其自动化平台14 进行此类更改。由于该方法需要补充管道和接头(参见图 4A-D),因此在这些条件下标记时,放射性释放的额外位点的可能性会增加。谨慎的做法是在每次运行模块之前执行泄漏检查。
我们的团队已经实施了用于研究性新药申请 (IND) 和放射性药物研究委员会 (RDRC) 批准的四种碳 11 放射性示踪剂生产的循环方法。在我们手中,这种方法被证明是一种比传统反应容器方法更高效、产量更高的工艺。将此方法应用于大多数自动化模块时,需要考虑额外的管道和对载气氦气流速的调整。最后,这种方法有局限性,不适用于某些碳 11 放射性示踪剂,例如 [11C]UCB-J,它需要活化钯 (II) 中间体并加热24 反应混合物。
披露声明
作者声明他们没有与本研究相关的或经济利益需要披露。
致谢
我们要感谢纽约大学放射化学实验室的前成员 Raul Jackson 和 Grace Yoon,感谢他们在使用环法进行碳 11 甲基化的初步工作中所做的工作。
材料
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
参考文献
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。