Method Article
Amélioration de l’efficacité et des rendements de radiomarquage des radioligands de carbone 11 pour la recherche clinique à l’aide de la méthode de la boucle
Dans cet article
Résumé
Ce protocole présente une procédure détaillée pour préparer quatre radiotraceurs de carbone 11 par le biais de la « méthode en boucle » de la méthylation du [11C]. Nous décrivons la procédure de synthèse du [11C]ER-176, avec des données pour trois radiotraceurs supplémentaires : [11C]MRB, [11C]mHED et [11C]PiB. La méthode en boucle permet une synthèse efficace avec des rendements radiochimiques accrus par rapport à la méthylation traditionnelle du récipient de réaction [11C].
Résumé
Le succès d’un programme d’imagerie par tomographie par émission de positons impliquant des radiotraceurs au carbone 11 exige des méthodes de synthèse rapides, efficaces et fiables, nécessitant un cyclotron et un groupe de radiochimie sur place, ainsi qu’un personnel clinique formé pour fonctionner sous les contraintes uniques du radionucléide au carbone 11. Cette étude examine les mérites et les avantages d’une méthode de « boucle » de solvant captif pour radiomarquer quatre traceurs avec le radionucléide de carbone 11, produisant les radioligands [11C]ER-176, [11C]MRB, [11C]mHED et [11C]PiB.
La « méthode de la boucle » est comparée à la méthode traditionnelle de méthylation du carbone 11 basée sur un réacteur au cours de la synthèse des mêmes radiotraceurs sur la même plate-forme automatisée. De plus, un aperçu complet de la préparation de la recherche clinique du radiotraceur [11C]ER-176 est présenté. Comme l’a démontré la production de [11C]ER-176, la méthode de la « boucle » d’alkylation hétérogène par solvant captif s’est avérée plus efficace, avec une excellente pureté radiochimique (99,6 ± 0,6 %, n = 25), un rendement radiochimique plus élevé et plus constant (fin de synthèse (EOS) = 5,4 ± 2,2 GBq, n = 25) par rapport à la méthode du réacteur (EOS = 1,6 ± 0,5 GBq, n = 6), augmentation de l’activité molaire (méthode en boucle = 194 ± 66 GBq/μmol, n = 25 ; méthode du réacteur = 132 ± 78 GBq/μmol, n = 6), ainsi qu’une séquence de réaction moyenne plus courte de 5 minutes.
Introduction
Parmi les modalités de l’imagerie moléculaire, la tomographie par émission de positons (TEP) se distingue par sa manière de résoudre les processus biochimiques associés à des cibles physiologiques spécifiques ou à des régions d’intérêt 1,2. La sensibilité caractéristique et la nature non invasive de la TEP sont exploitées pour la visualisation et la quantification in vivo de la physiopathologie de la maladie, révélant souvent des cibles invisibles par des techniques d’imagerie plus anatomiques telles que la tomodensitométrie (TDM)3 ou l’imagerie par résonance magnétique (IRM)4. L’imagerie moléculaire contemporaine combine la TEP avec la TDM ou l’IRM (TEP/TDM ou TEP/IRM, respectivement), en tirant parti de la résolution à contraste élevé et des paramètres d’imagerie quantifiables de la TEP pour fournir des cartes de correction d’atténuation (TEP/TDM) très précises et une résolution spatiale améliorée (TEP/IRM)5, surmontant ainsi certains obstacles présentés par la variabilité des énergies cinétiques plus élevées des positrons provenant de radionucléides tels que le gallium-68 et le rubidium-826. Ces techniques d’imagerie à double modalité canalisent les attributs caractéristiques de chaque modalité individuelle, fournissant aux cliniciens ou aux chercheurs une multitude d’informations anatomiques et biochimiques co-enregistrées sur le sujet de l’étude5.
L’applicabilité clinique de cette technique d’imagerie est vaste, offrant la visualisation et la mesure de processus physiologiques au niveau moléculaire aussi divers que le métabolisme du glucose 7,8, la liaison des récepteurs de neurotransmetteurs9, la perfusion myocardique10 et diverses affections neurologiques11. En dehors de l’utilisation clinique, les attributs inhérents à la TEP sont alignés pour jouer un rôle essentiel dans le développement de médicaments diagnostiques et thérapeutiques, permettant la quantification de paramètres tels que le potentiel de liaison (PA), la biodistribution, le volume de distribution (VT) et l’occupation des récepteurs du médicament (RO %) par l’observation directe de l’interaction de la pharmacologie, de la pharmacocinétique et de la pharmacodynamie. Cela contribue à son tour à déterminer, notamment si un composé atteint une cible à une concentration de dose efficace (ED50), l’étendue de la pénétration effective de la barrière hémato-encéphalique, l’intégrité métabolique du composé, la dose appropriée et l’intervalle posologique11.
Lors de la mise au point d’une sonde utile pour l’imagerie TEP, après l’identification d’un biomarqueur approprié et la sélection d’un ligand associé, le radiomarquage de la biomolécule avec un radionucléide TEP approprié permet d’obtenir la sonde radiotraceur pour l’étude TEP. Parmi les radionucléides PET pour l’étude de questions biologiques, pharmacologiques ou médicales, le carbone 11 offre une combinaison de polyvalence synthétique et de caractéristiques physiques favorables qui permet son utilisation généralisée dans diverses biomolécules et ligands éligibles6. Avec une émission de positrons de 99,8 % et une demi-vie de 20,4 minutes12, le carbone 11 permet une administration répétée à des sujets dans de courts intervalles tout en permettant des synthèses en plusieurs étapes. Cependant, ces avantages nécessitent une installation dotée de capacités de cyclotron et de radiochimie sursite5.
De telles installations nécessitent des méthodes de méthylation fiables, puissantes et reproductibles qui permettent le radiomarquage des molécules précurseurs, souvent avec le substrat électrophile [11C]iodométhane ([11C]CH3I) ou [11C]méthyl triflate ([11C]CH3OTf)13. Un module de radiosynthèse, tel qu’il est fourni par le fabricant, est généralement configuré pour une approche de cuve de réaction pour les réactions de méthylation du [11C]14. Cela implique de refroidir la cuve pour une rétention efficace du [11-C]iodométhane ou du [11-C]méthyle triflate à la livraison, de sceller et de chauffer la cuve pour effectuer la réaction, de l’éteindre, puis de transférer le contenu réagi dans un système de chromatographie liquide à haute performance (CLHP) pour une purification semi-préparative13. Bien qu’efficace15, cette technique présente de nombreux points de défaillance structurels potentiels, impliquant des septa de flacons, des aiguilles et des lignes de transfert associées.
Le besoin d’une méthode de méthylation plus fiable et reproductible a guidé l’enquête et la poursuite d’une modification par solvant captif de plusieurs de nos protocoles de synthèse de radioligands au carbone 11. Cette approche vise à remédier aux limites de la méthode conventionnelle des récipients de réaction tout en maintenant ou en améliorant l’efficacité du radiomarquage.
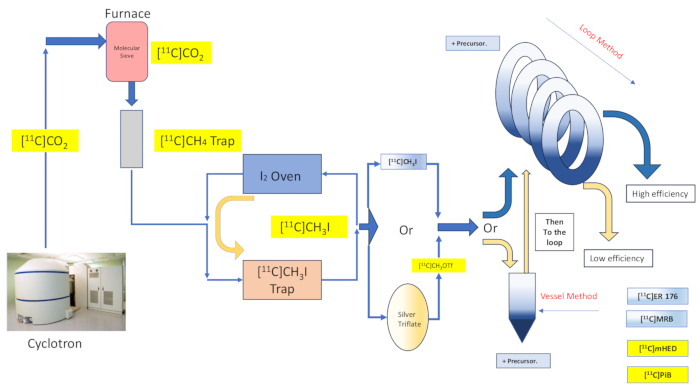
Figure 2 : Conception et écoulement de la méthode de synthèse et de boucle en cuve de réaction. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La chimie des solvants captifs offre la promesse d’un piégeage et d’une réaction efficaces avec le réactif de radiomarquage au moyen de l’étalement de la solution précurseur sur une grande surface d’un matériau ou d’une structure de support, puis de la mise en contact du réactif de marquage gazeux avec le matériau enrobé16,17. Cela améliore l’étendue et la qualité du contact entre les deux phases réactives16,18. De nombreuses mises en œuvre et variantes de cette technique ont été documentées dès 198516,17,18,19,20, et elle a trouvé une application avec l’iodure de méthyle [11C], le triflate de méthyle 11C, ainsi que les réactions de radiomarquage au dioxyde de carbone du réactifde Grignard20. D’autres améliorations ont été apportées par la discussion sur la chimie de la « méthode de la boucle » du solvant captif, décrite à l’origine par Wilson et coll., qui ne nécessite pas de supports supplémentaires à ceux déjà offerts par la boucle de purification HPLC, ni de chauffage ou de refroidissement de l’environnementréactionnel 13. Il a été constaté que le radiomarquage par solvant captif « méthode en boucle » confère des réactions de méthylation à l’iodométhane et au triflate méthylique [11C] avec les vertus d’une perte de transfert minimale, d’un rendement radiochimique élevé, d’une activité molaire élevée, d’une réduction du temps de réaction et d’une simplicité 7,21,22,23.
Nous décrivons ici l’implémentation par notre groupe de la technique de méthylation de la « méthode de la boucle » [11C]décrite à l’origine par Wilson13, et d’autres par la suite 14,15,18,21,22,23, (voir Figure 2) au moyen d’une modification mécanique (voir Figure 3) de notre module de synthèse (ci-après dénommé le Module). Se rapprochant le plus possible de l’éthique ambitieuse de la simplicité, ces modifications mécaniques étaient minimales et accessibles, ce qui a entraîné une réduction globale de la complexité de l’ingénierie, et seulement l’ajout de composants essentiels à ceux déjà installés par le fabricant du module, associés à un arrangement de radiomarquage par défaut de la cuve de réaction. Cela se reflète dans la décision d’utiliser la boucle de purification HPLC en acier inoxydable déjà fournie et préinstallée par le fabricant du module, comme décrit ci-dessous, qui s’est avérée compatible et efficace avec les synthèses examinées. Nous discutons, en détail, du protocole de radiomarquage complet et validé de la méthode de boucle utilisé dans la production de recherche clinique pour la synthèse du radiotraceur [11C]-(R)-N-sec-butyl-4-(2-chlorophényl)-N-méthylquinazoline-2-carboxamide,[11C]ER-176 (1), en utilisant le carbone-11 iodométhane. De plus, nous comparons de nombreux attributs liés à l’efficacité du radiomarquage tels qu’ils sont effectués à la fois par la méthode du réacteur et la méthode par boucle sur trois autres radioligands, à savoir (S,S)-[11C]méthylréboxétine ([11C]MRB (2)),[11C]-méta-hydroxyéphédrine ([11C]mHED (3)), et 2-[4-[(11C)méthylamino]phényl]-1,3-benzothiazol-6-ol ([11C]PiB (4)) mis au point dans nos installations, tel que déterminé par l’analyse des lots synthétisés (voir le tableau 1 etla figure 1 ). Cette comparaison illustre l’avantage évident pour des paramètres tels que le rendement radiochimique et l’activité molaire associés à la mise en œuvre du radiomarquage par la « méthode en boucle », permis par des modifications de module accessibles et simples à un coût minimal pour le laboratoire de radiochimie.
Protocole
REMARQUE : Tous les équipements et synthèses sont effectués dans une cellule chaude ou une minicellule blindée au plomb. ATTENTION : Des particules émettrices de positrons de haute énergie sont générées et utilisées à partir du cyclotron. La zone est surveillée à l’aide de compteurs Geiger calibrés, et les personnes portent des anneaux et des badges de dosimétrie de sécurité contre les radiations. Tout le personnel est formé pour travailler avec des matières radioactives à haute énergie.
Toutes les synthèses sont effectuées sur un module propre et stérilisé conformément à nos procédures opérationnelles standard (SOP) internes. Le processus de nettoyage comprend l’utilisation de 1 N HCl, d’eau, d’acétone et d’acétonitrile pour la partie réaction du module. Pendant ce temps, la partie formulation du module est nettoyée et stérilisée avec de l’eau et de l’éthanol.
1. Le radiomarquage du [ 11C]ER-176 (1) par la méthode de la boucle
REMARQUE : Pour une liste des matériaux utilisés dans la préparation de [11C]ER-176 (1), veuillez consulter la Table des matériaux.
- Replomber le module pour la production de la méthode de boucle (voir Figure 4A-D). Fixez une soupape V8 à un raccord qui se connecte directement à la boucle HPLC. Cela contournera le récipient de réaction.
- Conditionner le four à méthane (CH4) à 350 °C pendant 20 min avec un débit d’hydrogène gazeux de 100 mL/min avant toutes les productions effectuées sur le module. Laisser refroidir à 45 °C avant de continuer.
- Conditionnez le piège CH4 à 120 °C pendant 20 min avec un débit d’hélium gazeux de 50 mL/min avant toutes les productions effectuées sur le module. Laisser refroidir à 70 °C avant de continuer.
- Conditionner le piège à iodure de méthyle à 190 °C pendant 20 min avec un débit d’hélium gazeux de 50 mL/min avant toutes les productions effectuées sur le module. Laisser refroidir à 50 °C avant de continuer.
- Chargement des réactifs pour le module :
- À l’aide d’une seringue de 100 μL, injectez le mélange suivant à travers l’adaptateur à la position #1 de la boucle HPLC interne de la vanne à six voies : (R)-N-sec-butyl-4-(2-chlorophényl)-quinazoline-2-carboxamide (1,0 ± 0,05 mg) dans le diméthylsulfoxyde D6 (100 ± 10 μL) et l’hydroxyde de sodium 6 N (4 μL).
REMARQUE : Les solvants deutérés ont été sélectionnés pour leur disponibilité sous forme d’ampoule et parce qu’ils sont généralement distillés pendant la fabrication, ce qui garantit qu’ils sont exempts d’eau. - Chargez le réservoir V4 avec 3,0 ml de chlorure de sodium à 0,9 % pour injection.
- Chargez le réservoir V5 avec 1,0 ml d’éthanol à 200 degrés.
- Chargez le réservoir V6 avec 10 mL d’eau déminéralisée stérile.
- Remplissez le grand ballon récepteur avec 25 mL d’eau déminéralisée stérile.
- Remplir le ballon de formulation avec 6,0 mL de chlorure de sodium à 0,9 % pour injection.
- Assurez-vous que la ligne de distribution est attachée à un flacon de produit final préassemblé stérile.
- Préparez la phase mobile avec un mélange 37:63 (v/v) d’acétonitrile et de 20 mM d’hydroxyde d’ammonium.
- Conditionnez la colonne de semi-préparation avec quatre volumes de colonne de phase mobile.
REMARQUE : La colonne utilisée est une colonne à phase inverse C18 100 mm x 10 mm.
- À l’aide d’une seringue de 100 μL, injectez le mélange suivant à travers l’adaptateur à la position #1 de la boucle HPLC interne de la vanne à six voies : (R)-N-sec-butyl-4-(2-chlorophényl)-quinazoline-2-carboxamide (1,0 ± 0,05 mg) dans le diméthylsulfoxyde D6 (100 ± 10 μL) et l’hydroxyde de sodium 6 N (4 μL).
- Pendant la préparation du module automatisé, bombardez une cible cyclotron au carbone 11 (1 % d’oxygène, 99 % d’azote) sur un cyclotron de 11 MeV à 55 μA pendant 60 à 80 min sur des cibles à double faisceau pour produire du dioxyde de carbone de [11°C] par la réaction nucléaire de 14N(p,α) 11°C.
- Environ 20 minutes avant de décharger le dioxyde de carbone [11C] du cyclotron vers le module, démarrez la liste de temps validée pour la synthèse du [11C]ER-176 en cliquant sur le bouton de démarrage . Laisser refroidir la colonne CH4 à 45 °C avant de recevoir du dioxyde de carbone radioactif [11°C] (voir figure 3). Laissez le piège à colonne de carbosphère (piège CH4 ) refroidir à -75 °C.
- Soit la méthode intégrée dans le Module pour la conversion du dioxyde de carbone [11C] en iodure de méthyle [11C], au moyen d’un procédé de chimie sèche, procéder comme suit :
- Convertir l’activité du dioxyde de carbone [11°C] en [11°C] méthane en réagissant avec de l’hydrogène gazeux à 350 °C sur un catalyseur au nickel (shimalite-nickel). Utilisez un piège à ascarite (hydroxyde de sodium) pour retenir le dioxyde de carbone [11°C] non converti et l’eau formée.
- Piéger le [11C]méthane formé sur un piège à colonne de carbosphère (piège CH4 ) à -75 °C pour une purification et une concentration supplémentaires. Pour libérer le [11C]méthane piégé, chauffer la colonne de carbosphère à 80 °C.
- Faire réagir le [11C]méthane purifié avec de l’iode élémentaire à 720 °C pour former de l’iodure de méthyle [11C]([11C]CH3I) au moyen d’une pompe à gaz de recirculation d’hélium où l’iodure d’hydrogène généré accidentellement est retenu par un autre piège à ascarite tandis que le [11C]méthane non converti retourne dans le processus de circulation.
- Piéger le [11C]CH3I formé à température ambiante sur la colonne d’iodure de méthyle (MeI) qui s’est accumulée pendant le processus de recirculation.
- À la fin du processus de circulation, libérer le [11C]CH3I collecté du piège MeI en le chauffant à 190 °C sous l’effet d’un écoulement d’hélium (15 mL/min), en le contournant de la colonne MeTf et en le guidant à travers un clapet anti-retour dans la boucle en acier inoxydable de 1,5 mL contenant la solution préchargée de précurseur (étape 1.5.1).
- Une fois que le [11C]CH3I a traversé la boucle pendant 180 s, injectez le mélange réactionnel dans la colonne HPLC semi-préparée pour la purification. Utilisez les conditions HPLC suivantes : phase mobile de 37:63 (v/v) acétonitrile : 20 mM d’hydroxyde d’ammonium à un débit de 5,0 mL/min et une longueur d’onde UV de 235 nm ; temps de rétention (tR) de [11C]ER-176 : environ 12–14 min. Voir la figure 5.
- Prélever l’échantillon de fraction dans un grand ballon récepteur contenant 25 mL d’eau désionisée stérile. Chargez le mélange dilué dans une cartouche d’extraction en phase solide légère (SPE) C18 .
- Lavez le produit (1) avec 10 ml supplémentaires d’eau déminéralisée stérile.
- Éluez le produit souhaité du SPE léger C18 à l’aide d’éthanol à 200 degrés (1 ml). Diriger cette élution dans une fiole de formulation préchargée de chlorure de sodium à 0,9 % pour injection (6 mL).
- Rincez ensuite le C18 light SPE avec 3 ml supplémentaires de chlorure de sodium à 0,9 % pour injection via le réservoir V4.
- Recueillir la solution finale dans le ballon de formulation (~10 mL) et passer à travers un filtre stérilisant de 0,22 μm dans un flacon en verre de 50 mL, stérile, apyrogène, USP Type I préassemblé, scellé avec un septum en caoutchouc et serti avec un capuchon en aluminium.
- À l’aide de télémanipulateurs, prélever une aliquote du flacon du produit final en tant qu’échantillon de contrôle de la qualité (CQ). Soumettre cet échantillon à de nombreux tests de contrôle qualité pour s’assurer qu’il est conforme aux spécifications établies avant sa libération et son administration à un patient (voir le tableau 2).
NOTA : Appliquer cette procédure de méthode en boucle en utilisant [11C]CH3I pour le radiomarquage de (2) ; générer et utiliser [11C]CH3OTf pour produire (3) et (4) (voir Fichier supplémentaire 1).- Pour suivre l’analyse de contrôle de la qualité typique effectuée dans l’installation, utilisez des télémanipulateurs pour transférer un échantillon du flacon de produit final dans une seringue antituberculeux, puis dans la salle de contrôle de la qualité à l’aide d’un support blindé au plomb.
- Dans une zone protégée par du plomb (bloc L), expulsez l’échantillon dans un tube apyrogène, puis distribuez-le dans des flacons en verre plus petits (50 à 100 μL) pour des analyses HPLC et chromatographie en phase gazeuse (GC).
- Diluer un deuxième échantillon avec de l’eau apyrogène à la concentration appropriée pour l’analyse des endotoxines bactériennes.
- Inoculer un échantillon de la solution du produit final (dans un milieu de bouillon de soja tryptique (TSB) et un milieu fluide à base de thioglycolate (FTM) en tant qu’échantillon de stérilité). Incuber et observer la croissance de ces échantillons pendant 14 jours.
- Appliquez une petite aliquote sur une bandelette de pH pour déterminer visuellement l’acidité/basicité de la solution du produit final.
2. Méthode de la cuve de réaction pour le radiomarquage du [11C]ER-176 (1)
- Assurez-vous que le module est soigneusement nettoyé conformément au protocole de nettoyage interne.
- Utilisez du HCl 1 N, de l’eau, de l’acétone et de l’acétonitrile pour nettoyer la partie réaction du module, et de l’eau suivie d’éthanol pour nettoyer et stériliser la partie formulation du module.
- Conditionner le four à méthane (CH4) à 350 °C pendant 20 min avec un débit d’hydrogène gazeux de 100 mL/min avant toutes les productions effectuées sur le module. Laisser refroidir à 45 °C avant de continuer.
- Conditionnez le piège CH4 à 120 °C pendant 20 min avec un débit d’hélium gazeux de 50 mL/min avant toutes les productions effectuées sur le module. Laisser refroidir à 70 °C avant de continuer.
- Conditionner le piège MeI à 190 °C pendant 20 min avec un débit d’hélium gazeux de 50 mL/min avant toutes les productions. Laisser refroidir à 50 °C avant de continuer. Assurez-vous que le tube V8 est connecté à l’aiguille dans le récipient.
- Effectuer un essai d’étanchéité à l’aide d’hélium gazeux, de la soupape réceptrice (V24 à V16) à la boucle interne MeI, et de la V8 à la cuve en utilisant V23 comme source d’étanchéité/échappement.
- Chargement des réactifs pour le module :
- Ajouter ce qui suit : (R)-N-sec-butyl-4-(2-chlorophényl)-quinazoline-2-carboxamide (1,0 ± 0,05 mg) dans du diméthylsulfoxyde de sodium6 (100 ± 10 μL) et de l’hydroxyde de sodium 6 N (4 μL) dans la cuve du réacteur.
- Chargez le réservoir V2 avec 1,0 ml d’acétonitrile 37:63 : 20 mM d’hydroxyde d’ammonium.
- Chargez le réservoir V4 avec 3,0 ml de chlorure de sodium à 0,9 % pour injection.
- Chargez le réservoir V5 avec 1,0 ml d’éthanol à 200 degrés.
- Chargez le réservoir V6 avec 10 mL d’eau déminéralisée stérile.
- Remplissez le grand ballon récepteur avec 25 mL d’eau déminéralisée stérile.
- Remplir le ballon de formulation avec 6,0 mL de chlorure de sodium à 0,9 % pour injection.
- Assurez-vous que la ligne de distribution est connectée au flacon de produit final stérile préassemblé.
- Remplissez un réservoir avec de la phase mobile HPLC (37:63 (v/v) acétonitrile :20 mM d’hydroxyde d’ammonium) et connectez-le à la pompe HPLC.
REMARQUE : La colonne de semi-préparation utilisée est la même que ci-dessus et préconditionnée avec la phase mobile (4 volumes de colonne).
- Pendant la préparation du module automatisé, bombardez une cible cyclotron au carbone 11 (1 % d’oxygène, 99 % d’azote) sur un cyclotron de 11 MeV à 55 μA pendant 60 à 80 min sur des cibles à double faisceau pour produire du dioxyde de carbone de [11°C] par la réaction nucléaire de 14N(p,α) 11°C.
- Environ 20 minutes avant de décharger le dioxyde de carbone [11C] du cyclotron vers le module, démarrez la liste de temps validée pour la synthèse du [11C]ER-176 en cliquant sur le bouton de démarrage . Laisser refroidir la colonne CH4 à 45 °C avant de recevoir du dioxyde de carbone radioactif [11°C] (voir figure 3). Laisser refroidir le piège à colonne de carbosphère (piège CH4 ) à -75 °C
- Soit la méthode intégrée dans le Module pour la conversion du dioxyde de carbone [11C] en iodure de méthyle [11C], au moyen d’un procédé de chimie sèche, procéder comme suit :
- Convertir l’activité du dioxyde de carbone [11°C] en [11°C] méthane en réagissant avec de l’hydrogène gazeux à 350 °C sur un catalyseur au nickel (shimalite-nickel). Retenir à la fois le dioxyde de carbone [11°C] non converti et l’eau formée à l’aide d’un piège à ascarite (hydroxyde de sodium).
- Piéger [11C]méthane sur une colonne de carbosphère à -75 °C pour une purification et une concentration supplémentaires. Pour libérer le [11C]méthane, chauffez la colonne de carbosphère à 80 °C.
- Faire réagir le [11C]méthane purifié avec de l’iode élémentaire à 720 °C pour former de l’iodure de méthyle [11C]au moyen d’une pompe à gaz de recirculation où l’hydrogène généré accidentellement est retenu par un autre piège à ascarite tandis que le [11C]méthane non converti retourne dans le processus de circulation, appelé recirculation en boucle interne.
- Piéger l’iodure de méthyle [11C]formé à température ambiante sur la colonne MeI qui s’est accumulé pendant le processus de recirculation.
- À la fin du processus de circulation, chauffer le piège adsorbant polymère poreux à 190 °C sous un flux d’hélium (30 mL/min) pour libérer l’iodure de méthyle [11°C] collecté et le guider à travers un clapet anti-retour jusqu’à la cuve de réaction de 3 mL pour le radiomarquage au carbone 11 de (1).
- Une fois que la production et l’accumulation d’iodure de méthyle [11C]ont atteint un plateau, contourner la colonne triflate d’argent et diriger le gaz radioactif à travers V8 dans la cuve de réaction contenant le mélange de précurseurs. Laissez l’iodure de méthyle [11°C] bouillonner pendant 3 min, puis fermez le récipient de réaction et chauffez-le à 80 °C pendant 5 min.
- Une fois l’étiquetage terminé, après 5 min, refroidir le récipient de réaction à 30 °C et diluer avec 1 mL de phase mobile du réservoir V2.
- Injecter le mélange dans la colonne HPLC semi-préparée pour la purification en utilisant les conditions HPLC suivantes : phase mobile de 37:63 (v/v) acétonitrile : 20 mM d’hydroxyde d’ammonium à un débit de 5,0 mL/min et une longueur d’onde UV de 235 nm ; tR de [11C]ER-176 (1) : environ 9 à 11 min, voir Figure 6.
- Prélever la fraction de l’échantillon dans la grande fiole réceptrice contenant 25 mL d’eau désionisée stérile. Chargez ce mélange dilué sur une cartouche SPE légère C18 .
- Lavez le produit piégé (1) avec 10 ml supplémentaires d’eau déminéralisée stérile.
- Éluer le produit désiré de l’EPS léger C18 à l’aide d’éthanol à 200 degrés (1,0 mL), dirigé dans un flacon de formulation préchargé de chlorure de sodium à 0,9 % pour injection (6,0 mL).
- Rincez le C18 light SPE avec 3,0 ml supplémentaires de chlorure de sodium à 0,9 % pour injection.
- Prélever la solution finale dans la fiole de formulation (~10 mL). Passez ce média à travers un filtre stérilisant de 0,22 μm dans un flacon en verre préassemblé, stérile, apyrogène, USP de type I de 50 ml, scellé avec un septum en caoutchouc et serti avec un capuchon en aluminium.
- À l’aide de télémanipulateurs, prélever une aliquote du flacon du produit final à titre d’échantillon de contrôle de la qualité (voir l’étape 1.15). Soumettre l’échantillon à plusieurs tests au cours desquels le radiotraceur doit satisfaire à tous les critères d’acceptation avant d’être libéré et administré à un patient (voir le tableau 2).
NOTA : Appliquer cette méthode de cuve de réacteur en utilisant [11C]CH3I pour le radiomarquage de (2) ; générer et utiliser [11C]CH3OTf pour produire (3) et (4) (voir Fichier supplémentaire 1).
Résultats
Le groupe de radiochimie Langone Health (NYULH) de l’Université de New York fournit divers radiotraceurs au carbone 11, au fluor 18 et au gallium 68 utilisés à la fois pour la recherche humaine et les applications précliniques. Plusieurs méthodes sont utilisées pour la production des radiotraceurs TEP. Notre équipe utilise la méthode de la boucle pour la synthèse de (1), (2), (3) et (4) (voir Figure 1 et Figure 8). Une fois la production terminée, une aliquote est retirée du flacon stérile du produit final. Cet échantillon est utilisé à la fois pour l’inoculation de la solution du produit final (dans un milieu de bouillon de soja tryptique (BST) et de milieu thioglycolate fluide (FTM) en tant qu’échantillon de stérilité) ainsi que pour un échantillon représentatif de la solution en vrac pour les tests de CQ. Chaque radiotraceur est soumis à des tests de contrôle de la qualité avant que le produit ne soit libéré pour l’administration (voir le tableau 2).
Les tests de contrôle de la qualité comprennent la visualisation de l’apparence du produit, la vérification de l’intégrité du filtre, la détermination de l’identité radionucléidique, du pH, de l’identité radiochimique (radio-HPLC), de la pureté radiochimique (radio-HPLC), de la pureté chimique (HPLC), de l’activité molaire, de la concentration, du solvant résiduel, des endotoxines et de la stérilité (voir le tableau 2). Les résultats suivants ont été obtenus à partir de la production clinique de chacun des radiotraceurs mentionnés ci-dessus (voir tableau 1).
Pour un chromatogramme HPLC analytique représentatif, voir la figure 7 et le fichier supplémentaire 1. Chaque radiotraceur doit satisfaire à toutes les spécifications de contrôle de la qualité (voir le tableau 2) avant de pouvoir être libéré et administré à un sujet.
Reportez-vous au fichier supplémentaire 1 pour connaître les quantités de précurseurs et de réactifs, ainsi que les chromatogrammes analytiques HPLC du [11C]MRB (2) (figure supplémentaire 1), du [11C]mHED (3) (figure supplémentaire 2) et du [11C]PiB (4) (figure supplémentaire 3).
| Composé | Paramètres | Méthode de boucle (moyenne ± std) | Méthode du réacteur (moyenne ± std) |
| [11C]ER-176 | Nombre de productions | 25 | 6 |
| Début de la synthèse | 86 ± 5,0 GBq | 52 ± 25,7 GBq | |
| Fin de la synthèse | 5,4 ± 2,2 GBq | 1,6 ± 0,5 GBq | |
| Pureté radiochimique | 99,6 ± 0,6 % | 99,9 ± 0,1 % | |
| Concentration ER-176 | 1,1 ± 0,5 μg/mL | 0,63 ± 0,37 μg/mL | |
| Activité molaire | 194 ± 66 GBq/μmol | 132 ± 78 GBq/μmol | |
| Temps total de synthèse | 36 ± 3 min | 44 ± 6 min | |
| [11C]Le | Nombre de productions | 70 | 6 |
| Début de la synthèse | 84 ± 5,4 GBq | 39 ± 11,9 GBq | |
| Fin de la synthèse | 3,0 ± 1,2 GBq | 1,9 ± 0,7 GBq | |
| Pureté radiochimique | 99,5 ± 0,5 % | 99,7 ± 0,8 % | |
| Concentration MRB | 0,52 ± 0,24 μg/mL | 0,68 ± 0,41 μg/mL | |
| Activité molaire | 190 ± 50 GBq/μmol | 99 ± 55 GBq/μmol | |
| Temps total de synthèse | 35 ± 3 min | 42 ± 3 min | |
| [11C]mHED | Nombre de productions | 5 | 11 |
| Début de la synthèse | 69 ± 10,5 GBq | 82 ± 4,3 GBq | |
| Fin de la synthèse | 5,5 ± 1,3 GBq | 3,3 ± 1,0 GBq | |
| Pureté radiochimique | 98,2 ± 1,3 % | 99,1 ± 0,7 % | |
| Concentration de mHED | 0,40 ± 0,10 μg/mL | 0,52 ± 0,37 μg/mL | |
| Activité molaire | 301 ± 48 GBq/μmol | 155 ± 77 GBq/μmol | |
| Temps total de synthèse | 27 ± 4 min | 32 ± 2 min | |
| [11C]PiB | Nombre de productions | 51 | 10 |
| Début de la synthèse | 86 ± 5,4 GBq | 57 ± 17,2 GBq | |
| Fin de la synthèse | 3,2 ± 0,8 GBq | 1,4 ± 0,2 GBq | |
| Pureté radiochimique | 97,0 ± 1,5 % | 99,1 ± 1,4 % | |
| Concentration PiB | 0,22 ± 0,51 μg/mL | 0,30 ± 0,24 μg/mL | |
| Activité molaire | 201 ± 68 GBq/μmol | 207 ± 124 GBq/μmol | |
| Temps total de synthèse | 35 ± 2 min | 36 ± 5 min |
Tableau 1 : Résultats de la production de [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) et [11C]PiB (4) par la méthode de la boucle ou la méthode de la cuve de réaction. Toutes les valeurs sont rapportées à la fin de la synthèse. Abréviations : [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophényl)-N-méthylquinazoline-2-carboxamide ; [11C]MRB = (S,S)-[11C]méthylréboxétine ; [11C]LHED = [11C]-méta-hydroxyéphédrine ; [11C]PiB = 2-[4-[(11C)méthylamino]phényl]-1,3-benzothiazol-6-ol.
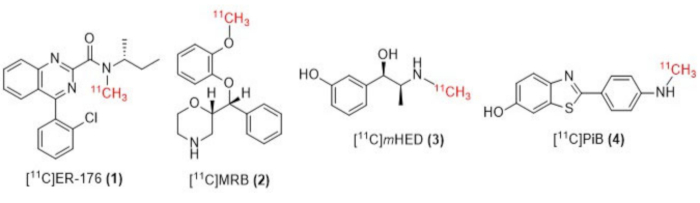
Figure 1 : Structures de [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) et [11C]PiB (4). Abréviations : [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophényl)-N-méthylquinazoline-2-carboxamide ; [11C]MRB = (S,S)-[11C]méthylréboxétine ; [11C]LHED = [11C]-méta-hydroxyéphédrine ; [11C]PiB = 2-[4-[(11C)méthylamino]phényl]-1,3-benzothiazol-6-ol. Veuillez cliquer ici pour voir une version agrandie de cette figure.
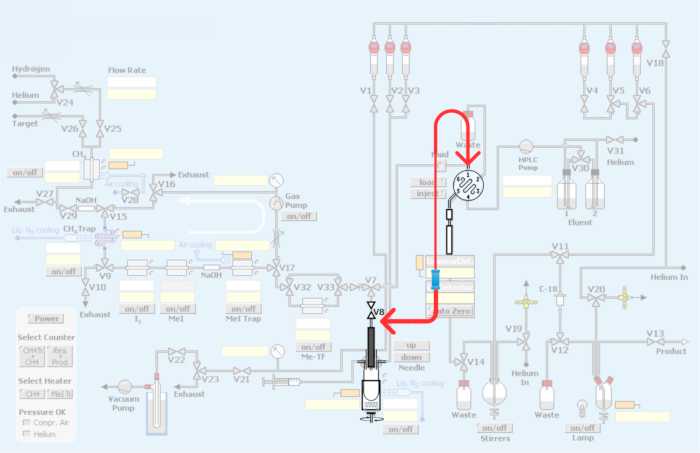
Figure 3 : Modifications apportées au module automatisé. En rouge représente la replomberie du module de synthèse afin d’incorporer la boucle de production de radiotraceurs TEP par méthylation du carbone 11. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Plomberie et replombation du module pour incorporer la méthode de boucle pour la méthylation du carbone 11 des radiotraceurs TEP. (A) Boucle d’injection HPLC avec connecteurs union. (B) Méthode du récipient de réaction. La flèche rouge indiquant la connexion V8. (C) Méthode de replombation en boucle, contournement de la cuve du réacteur. Notez que la connexion V8 à l’entrée HPLC contourne la cuve de réaction, permettant un accès direct au [11C]iodométhane ou au [11C]triflate méthylique à la boucle HPLC. (D) Emplacement du raccord par rapport à la cuve du réacteur. Notez la connexion à la boucle HPLC en acier inoxydable. Veuillez cliquer ici pour voir une version agrandie de cette figure.
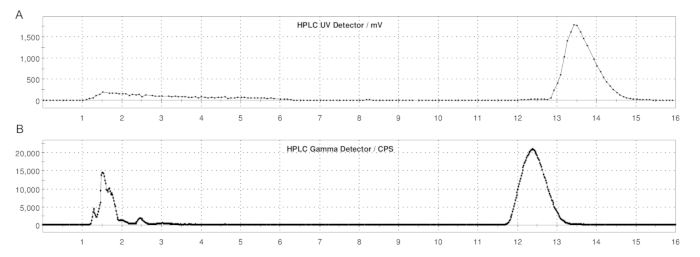
Figure 5 : Profils HPLC semi-préparés de l’ER-176 et du [11C]ER-176 avec production par la méthode des boucles. (A) Profil HPLC semi-préparé pour l’ER-176 (1) par la méthode de la production par boucle à UV = 235 nm ; tR = 13,2 min. (B) Profil radio-HPLC semi-préparé pour [11C]ER-176 (1) ; tR = 12,4 min. Conditions : phase mobile de 37:63 (v/v) acétonitrile : 20 mM d’hydroxyde d’ammonium à un débit de 5,0 mL/min. Abréviation : [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophényl)-N-méthylquinazoline-2-carboxamide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
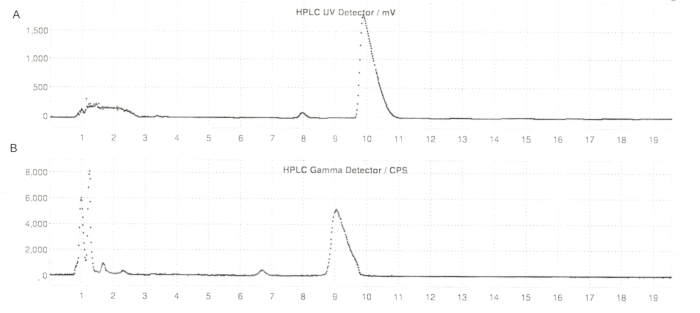
Figure 6 : Profils HPLC semi-préparés de l’ER-176 et du [11C]ER-176 avec production par la méthode du réacteur. (A) Profil HPLC semi-préparé pour l’ER-176 (1) par la production par la méthode du réacteur à UV = 235 nm ; tR = 9,8 min. (B) Profil radio-HPLC semi-préparé pour [11C]ER-176 (1) ; tR = 9,2 min. Conditions : phase mobile de 37:63 (v/v) acétonitrile : 20 mM d’hydroxyde d’ammonium à un débit de 5,5 mL/min. Abréviations : [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophényl)-N-méthylquinazoline-2-carboxamide ; tR = temps de rétention. Veuillez cliquer ici pour voir une version agrandie de cette figure.
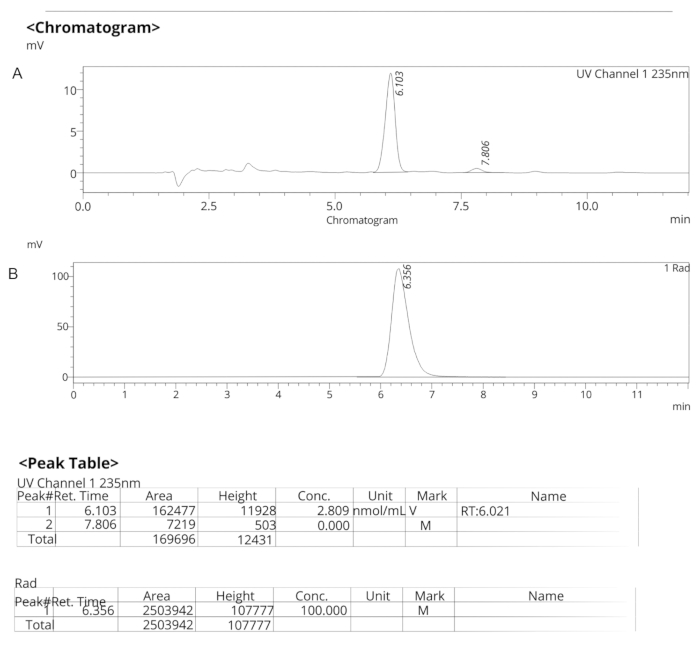
Figure 7 : Profils HPLC analytiques pour ER-176. (A) Profil HPLC analytique des spectres UV pour ER-176 (1) à 235 nm ; tR = 6,10 min. (B) Profil HPLC analytique du radiotraceur pour le [11C]ER-176 (1) ; tR = 6,36 min. Conditions : 10 μm C18 (2) 100  LC Colonne 250 x 4,6 mm ; méthanol/eau 74/26 avec un débit de 1,5 mL/min. Abréviation : [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophényl)-N-méthylquinazoline-2-carboxamide ; tR = temps de rétention Veuillez cliquer ici pour voir une version agrandie de cette figure.
LC Colonne 250 x 4,6 mm ; méthanol/eau 74/26 avec un débit de 1,5 mL/min. Abréviation : [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophényl)-N-méthylquinazoline-2-carboxamide ; tR = temps de rétention Veuillez cliquer ici pour voir une version agrandie de cette figure.
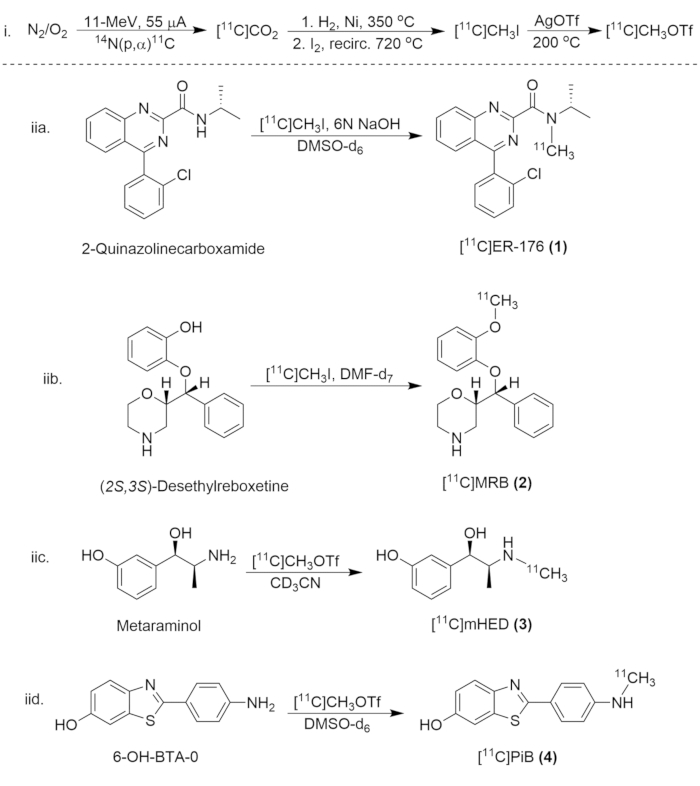
Figure 8 : Schéma synthétique pour la synthèse de composés du carbone 11. (i) La formation de [11C]CH3I et [11C]CH3OTf, et (iia.) le radiomarquage de [11C]ER-176 (1), (iib.) [11C]MRB (2), (iic.)[11C]LHED (3) et (iid.) [11C]PiB (4). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Test/Paramètres | Spécifications |
| Apparence (inspection visuelle) | Solution claire, incolore et exempte de particules |
| Intégrité du filtre à membrane | ≥ 50 psi |
| pH | 4.5 - 8.0 |
| Identité radionucléidique (demi-vie) | De 19,3 à 21,3 minutes |
| Identité radiochimique (radio-HPLC) | 0,90 ≤ tR Prod / t R Std ≤ 1,10 |
| Pureté radiochimique (radio-HPLC) | ≥ 95,0 %† |
| Concentration du médicament (HPLC) | Voir notes* |
| Impuretés chimiques totales (HPLC) | Voir les notes** |
| Activité molaire (@ EOS) | > 9,25 GBq/μmol |
| Acétonitrile résiduel (GC) | ≤ 410 ppm |
| Acétone résiduelle (GC) | ≤ 5 000 ppm |
| Diméthylsulfoxyde résiduel (GC) | ≤ 5 000 ppm |
| Éthanol résiduel (CG) | ≤ 10 % (v/v) |
| Méthanol résiduel (GC) | ≤ 3 000 ppm |
| N,N-diméthylformamide (GC) résiduel | ≤ 880 ppm |
| Lysat d’amibocytes de Limulus (LAL) | ≤ 17,5 UE/ml |
| Stérilité (initié dans les 30 h) | Stérile (14 jours) |
| Registres de préparation | Complet et précis |
| Étiquettes | Complet, précis, rapproché |
Tableau 2 : Critères de contrôle de la qualité pour l’approbation ou le rejet des radiotraceurs au carbone 11 † Pureté radiochimique ≥ 90,0 % pour [11C]mHED ; * Concentration du médicament : [11C]ER-176 ≤ 10 μg/dose ; [11C]MRB ≤ 10 μg/dose ; [11C]LHED ≤ 50 μg/dose ; [11C]PiB ≤ 13,4 μg/dose ; ** Impuretés chimiques totales : [11C]ER-176 ≤ 1,0 μg/dose ; [11C]MRB ≤ 1,0 μg/dose ; [11C]LHED ≤ 5,0 μg/dose ; [11C]PiB ≤ 1,34 μg/dose. Abréviations : [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophényl)-N-méthylquinazoline-2-carboxamide ; [11C]MRB = (S,S)-[11C]méthylréboxétine ; [11C]LHED = [11C]-méta-hydroxyéphédrine ; [11C]PiB = 2-[4-[(11C)méthylamino]phényl]-1,3-benzothiazol-6-ol ; EOS = fin de synthèse ; GC = chromatographie en phase gazeuse ; LAL = lysat d’amébocytes de Limulus.
Dossier supplémentaire 1 : Produits chimiques et matériaux, réactifs utilisés pour la méthode de la boucle ou de la cuve du réacteur, tests de contrôle de la qualité, chromatogrammes analytiques HPLC. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le radiomarquage traditionnel d’hétéroatomes terminaux avec du carbone 11 iodométhane ou du triflate méthyle consiste à faire bouillonner le gaz électrophile radioactif dans une cuve de réaction, à le piéger et à permettre à la solution de réagir pendant de longues périodes de temps18. Le bouillonnement conventionnel de la réaction hétérogène peut être lent et peut nécessiter un chauffage pour accélérer la vitesse de réaction. Avant la purification, il peut être nécessaire de refroidir le milieu réactionnel à température ambiante, puis de le transférer dans une boucle HPLC à l’aide d’un solvant (par exemple, en phase mobile) pour la purification du radiotraceur souhaité. Ces étapes prennent du temps et des produits radiomarqués éphémères peuvent être perdus lors du transfert de ces matériaux.
Dans nos installations, nous avons démontré la justification de l’utilisation de la méthode de la boucle, où la solution de précurseur est enrobée sur une boucle en acier inoxydable HPLC, et le radiomarquage du composé a lieu à l’intérieur de la boucle à température ambiante. La boucle est reliée en ligne avec la distribution du [11C]CH3I ou [11C]CH3OTf radioactif et connectée à l’orifice d’injection d’un système HPLC. Aucun échauffement n’est nécessaire pour que le radiomarquage se produise, et pour tous les cas présentés dans ce manuscrit, la réaction a lieu en moins de 3 min.
Le débit et la taille de la boucle HPLC en acier inoxydable semblent être essentiels au bon fonctionnement de ce processus. Les essais ont commencé par faire varier le débit du gaz vecteur, l’hélium, de 8,0 mL/min à 15,0 mL/min pour que le gaz radioactif soit livré à la boucle. Buckley a étudié l’importance d’appliquer le bon débit ainsi que d’utiliser le solvant et le matériau de boucle appropriés15. Pour notre système, le débit de 15 mL/min pour les espèces électrophiles radioactives de [11C]CH3I ou de [11C]CH3OTf fonctionne bien pour le radiomarquage des quatre radiotraceurs discutés dans ce manuscrit. La boucle utilisée pour toutes les synthèses est une boucle d’injection HPLC en acier inoxydable de 1,5 mL possédant un diamètre extérieur de 1/16 de pouce et un diamètre intérieur de 1 mm.
En comparant les deux méthodes (méthode du récipient de réaction et de la méthode de la boucle), la méthode de la boucle a démontré une efficacité accrue du radiomarquage ainsi qu’une augmentation substantielle de l’activité molaire en fin de synthèse (EOS) pour la production de quatre radiotraceurs humains approuvés pour la recherche. À titre d’exemple, le radiotraceur [11C]mHED (3) a présenté une augmentation de 1,6 fois de l’activité du produit final isolé et une activité molaire doublée à EOS. Cette tendance à l’augmentation de l’activité globale est observée pour les quatre radiotraceurs (voir le tableau 1). Parmi les autres résultats favorables de l’utilisation de la méthode en boucle, citons une réduction du temps de configuration de 5 minutes et l’absence de nettoyage de la cuve de réaction, ce qui permet à l’opérateur d’économiser du temps et d’utiliser des solvants pour un protocole de nettoyage.
Parmi les inconvénients de cette méthodologie, citons les limites dans lesquelles les radiotraceurs peuvent être efficacement marqués à l’aide de la méthode de la boucle. Si la chaleur est nécessaire pour le radiomarquage, il est difficile de modifier ce système pour permettre un chauffage à l’intérieur de la boucle HPLC. Ce système nécessite des modifications à la plomberie ; Cette caractéristique de ne pas l’avoir prêt à l’emploi peut dissuader d’autres utilisateurs d’effectuer de telles modifications sur leur plateforme automatisée14. Étant donné que cette méthode nécessite des travaux de plomberie et des raccords supplémentaires (voir la figure 4A-D), le risque de sites supplémentaires pour les rejets radioactifs augmente lors de l’étiquetage dans ces conditions. Il est prudent d’effectuer une vérification d’étanchéité avant chaque passage sur le module.
Notre équipe a mis en œuvre la méthode de boucle utilisée dans la production de quatre radiotraceurs au carbone 11 approuvée par l’Investigational New Drug Application (IND) et le Radioactive Drug Research Committee (RDRC). Entre nos mains, cette méthode s’est avérée être un processus plus efficace et plus productif que la méthode traditionnelle des récipients de réaction. Des travaux de plomberie supplémentaires et des ajustements du débit de l’hélium gazeux porteur doivent être pris en compte lors de l’application de cette méthode à la plupart des modules automatisés. Enfin, cette méthode présente des limites et n’est pas adaptée à certains radiotraceurs du carbone 11, tels que le [11C]UCB-J, qui nécessite l’activation de l’intermédiaire palladium (II) et le chauffage24 du mélange réactionnel.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun intérêt pertinent ou financier lié à cette recherche à divulguer.
Remerciements
Nous tenons à remercier les anciens membres du laboratoire de radiochimie de NYULH, Raul Jackson et Grace Yoon, pour leur travail sur les efforts initiaux de méthylation du carbone 11 à l’aide d’une méthode en boucle.
matériels
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
Références
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon