Method Article
Aumentando a eficiência e os rendimentos de radiomarcação de radioligantes de carbono-11 para pesquisa clínica usando o método de loop
Neste Artigo
Resumo
Este protocolo apresenta um procedimento detalhado para preparar quatro radiotraçadores de carbono-11 por meio do "método de loop" [11C]metilação. Descrevemos o procedimento para sintetizar [11C]ER-176, com dados para três radiotraçadores adicionais: [11C]MRB, [11C]mHED e [11C]PiB. O método de loop fornece uma síntese eficiente com rendimentos radioquímicos aumentados contra a metilação tradicional do vaso de reação [11C].
Resumo
Um programa bem-sucedido de imagem de tomografia por emissão de pósitrons envolvendo radiotraçadores de carbono-11 exige métodos de síntese rápidos, eficientes e confiáveis, exigindo um grupo de cíclotron e radioquímica no local, bem como uma equipe clínica treinada para operar sob as restrições exclusivas do radionuclídeo de carbono-11. Este estudo examina os méritos e vantagens de um 'método de loop' de solvente cativo de radiomarcação de quatro traçadores com o radionuclídeo carbono-11, produzindo os radioligantes [11C]ER-176, [11C]MRB, [11C]m HED e [11C]PiB.
O 'método de loop' é comparado com o método tradicional baseado em reator de metilação de carbono-11 durante a síntese dos mesmos radiotraçadores na mesma plataforma automatizada. Além disso, é apresentada uma visão geral completa da preparação da pesquisa clínica do radiotraçador [11C]ER-176. Tal como demonstrado pela produção de [11C]ER-176, o «método de laço» de solvente cativo de alquilação heterogénea revelou-se mais eficiente, com excelente pureza radioquímica (99,6 ± 0,6%, n = 25), rendimento radioquímico mais elevado e mais consistente (fim da síntese (EOS) = 5,4 ± 2,2 GBq, n = 25) em comparação com o método do reator (EOS = 1,6 ± 0,5 GBq, n = 6), aumento da atividade molar (método de alça = 194 ± 66 GBq/μmol, n = 25; método do reator = 132 ± 78 GBq/μmol, n = 6), juntamente com uma sequência de reação média 5 min mais curta.
Introdução
Dentre as modalidades de imagem molecular, a tomografia por emissão de pósitrons (PET) é distinta na forma de resolução dos processos bioquímicos associados a alvos fisiológicos específicos ou regiões de interesse 1,2. A sensibilidade característica e a natureza não invasiva da PET são aproveitadas para a visualização in vivo e quantificação da fisiopatologia da doença, muitas vezes revelando alvos invisíveis por técnicas de imagem mais anatômicas, como tomografia computadorizada (TC)3 ou ressonância magnética (RM)4. A imagem molecular contemporânea vê a combinação de PET com TC ou RM (PET/CT ou PET/RM, respectivamente), aproveitando a resolução de alto contraste e os parâmetros de imagem quantificáveis do PET para fornecer mapas de correção de atenuação (PET/CT) altamente precisos e resolução espacial aprimorada (PET/RM)5, superando alguns obstáculos apresentados pela variabilidade nas energias cinéticas mais altas dos pósitrons de radionuclídeos como o gálio-68 e o rubídio-826. Essas técnicas de imagem de dupla modalidade canalizam os atributos característicos de cada modalidade individual, fornecendo aos médicos ou pesquisadores uma riqueza de insights anatômicos e bioquímicos co-registrados sobre o sujeito do estudo5.
A aplicabilidade clínica dessa técnica de imagem é vasta, oferecendo visualização e mensuração de processos fisiológicos em nível molecular tão diversos quanto o metabolismo da glicose 7,8, a ligação ao receptor de neurotransmissor9, a perfusão miocárdica10 e várias condições neurológicas11. Fora do uso clínico, os atributos inerentes do PET estão alinhados para desempenhar um papel integral no desenvolvimento de medicamentos diagnósticos e terapêuticos, permitindo a quantificação de parâmetros como potencial de ligação (PA), biodistribuição, volume de distribuição (VT) e ocupação do receptor do medicamento (RO%) por observação direta da interação da farmacologia, farmacocinética e farmacodinâmica. Isso, por sua vez, contribui para determinações, incluindo se um composto atinge um alvo em uma concentração de dose efetiva (ED50), a extensão da penetração efetiva da barreira hematoencefálica, a integridade metabólica do composto e a dose apropriada e o intervalo de dosagem11.
No desenvolvimento de uma sonda útil para imagens PET, após a identificação de um biomarcador apropriado e a seleção de um ligante associado, a radiomarcação da biomolécula com um radionuclídeo PET adequado produz a sonda radiotraçadora para o estudo PET. Entre os radionuclídeos PET para investigar questões biológicas, farmacológicas ou médicas, o carbono-11 oferece uma combinação de versatilidade sintética e características físicas favoráveis que permitem seu uso generalizado em diversas biomoléculas e ligantes elegíveis6. Com uma emissão de pósitrons de 99,8% e meia-vida de 20,4 minutos12, o carbono-11 permite a administração repetida a indivíduos em intervalos curtos, enquanto ainda permite sínteses em várias etapas. No entanto, essas vantagens exigem uma instalação com recursos de ciclotron e radioquímica no local5.
Tais instalações requerem métodos de metilação confiáveis, poderosos e reprodutíveis que permitam a radiomarcação de moléculas precursoras, muitas vezes com o substrato eletrofílico [11C]iodometano ([11C]CH3I) ou [11C]metil triflato ([11C]CH3OTf)13. Um módulo de radiossíntese, fornecido pelo fabricante, é normalmente configurado para uma abordagem de vaso de reação para reações de metilação [11C]14. Isso envolve resfriar o recipiente para retenção efetiva de [11C] iodometano ou [11C] triflato de metila na entrega, selar e aquecer o recipiente para efetuar a reação, extinguir e, em seguida, transferir o conteúdo reagido para um sistema de cromatografia líquida de alta eficiência (HPLC) para purificação semipreparativa13. Embora eficaz15, essa técnica apresenta vários pontos potenciais de falha estrutural, envolvendo septos frascos, agulhas e linhas de transferência associadas.
A necessidade de um método de metilação mais confiável e reprodutível orientou a investigação e a busca de uma modificação de solvente cativo em muitos de nossos protocolos de síntese de radioligantes de carbono-11. Essa abordagem visa abordar as limitações do método convencional de vasos de reação, mantendo ou melhorando a eficiência da radiomarcação.
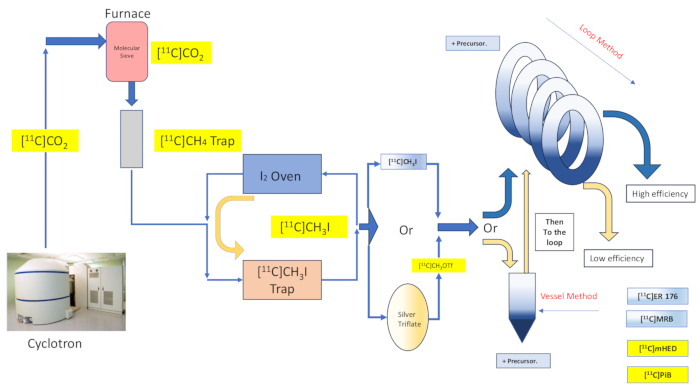
Figura 2: Projeto e fluxo da síntese do vaso de reação e método de loop. Clique aqui para ver uma versão maior desta figura.
A química do solvente cativo oferece a promessa de aprisionamento eficiente e reação com o reagente de radiomarcação por meio do espalhamento da solução precursora sobre uma grande área de um material ou estrutura de suporte e, em seguida, direcionando o reagente de marcação gasosa para contato com o material revestido16,17. Isso aumenta a extensão e a qualidade do contato entre as duas fases do reagente16,18. Numerosas implementações e variações dessa técnica foram documentadas já em 1985 16,17,18,19,20, e ela encontrou aplicação com [11C] iodeto de metila, [11C] triflato de metila, bem como reações de radiomarcação de dióxido de carbono do reagente de Grignard [11C] 20. Um refinamento adicional foi apresentado pela discussão da química do "método de loop" de solvente cativo, originalmente descrita por Wilson et al., que não requer nenhum suporte adicional ao já oferecido pelo loop de purificação de HPLC, nem aquecimento ou resfriamento do ambiente de reação13. Descobriu-se que a radiomarcação do "método de loop" com solvente cativo transmite reações de metila e triflato de metila [11C] com as virtudes de perda mínima de transferência, alto rendimento radioquímico, alta atividade molar, diminuição do tempo de reação e simplicidade 7,21,22,23.
Aqui, descrevemos a implementação de nosso grupo do "método de loop" [11C] técnica de metilação originalmente descrita por Wilson13, e outras posteriormente 14,15,18,21,22,23, (ver Figura 2) por meio de modificação mecânica (ver Figura 3) para nosso módulo de síntese (doravante referido como o Módulo). Seguindo o mais próximo possível do ethos aspiracional de simplicidade, essas modificações mecânicas foram mínimas e acessíveis, resultando em uma redução geral da complexidade da engenharia e apenas na adição de componentes essenciais aos já instalados pelo fabricante do módulo, associados a um arranjo de radiomarcação de vaso de reação padrão. Isso se reflete na decisão de utilizar o circuito de purificação de HPLC de aço inoxidável já fornecido e pré-instalado pelo fabricante do módulo, conforme descrito abaixo, que se mostrou compatível e eficaz com as sínteses examinadas. Discutimos, em detalhes, o protocolo de radiomarcação do método de loop completo e validado utilizado na produção de pesquisa clínica para a síntese do radiotraçador [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida,[11C]ER-176 (1), usando iodometano de carbono-11. Além disso, comparamos vários atributos relacionados à eficiência da radiomarcação conduzida pelo método do reator e pelo método de loop em três radioligantes adicionais, que incluem (S, S) - [11C] metilreboxetina ([11C] MRB (2)), [11C] -meta-hidroxiefedrina ([11C] mHED (3)) e 2- [4- [(11C) metilamino] fenil] -1,3-benzotiazol-6-ol ([11C] PiB (4)) desenvolvido em nosso serviço, conforme determinado pela análise de lotes sintetizados (ver Tabela 1 eFigura 1 ). Essa comparação ilustra o claro benefício para parâmetros como rendimento radioquímico e atividade molar associados à implementação da radiomarcação "método de loop", proporcionada por modificações de módulo simples e acessíveis de custo mínimo para o laboratório de radioquímica.
Protocolo
NOTA: Todos os equipamentos e sínteses são realizados em uma hotcell ou minicell blindada com chumbo. CUIDADO: Partículas emissoras de pósitrons de alta energia são geradas e usadas a partir do cíclotron. A área é monitorada com contadores Geiger calibrados, e os indivíduos usam anéis e crachás de dosimetria emitidos pela segurança contra radiação. Todo o pessoal é treinado para trabalhar com materiais radioativos de alta energia.
Todas as sínteses são realizadas em um Módulo limpo e esterilizado de acordo com nossos procedimentos operacionais padrão internos (SOP). O processo de limpeza inclui o uso de HCl 1 N, água, acetona e acetonitrila para a parte de reação do Módulo. Enquanto isso, a parte de formulação do Módulo é limpa e esterilizada com água e etanol.
1. A radiomarcação de [11C]ER-176 (1) por meio do método de loop
NOTA: Para obter uma lista dos materiais usados na preparação do [11C]ER-176 (1), consulte a Tabela de Materiais.
- Limpe novamente o módulo para a produção do método de loop (consulte a Figura 4AD). Conecte uma válvula V8 a uma união que se conecta diretamente ao loop de HPLC. Isso irá contornar o vaso de reação.
- Condicione o forno de metano (CH4) a 350 oC por 20 min com um fluxo de gás hidrogênio de 100 mL/min antes de todas as produções realizadas no Módulo. Resfrie a 45 oC antes de prosseguir.
- Condicione a armadilha CH4 a 120 oC por 20 min com um fluxo de gás hélio de 50 mL/min antes de todas as produções realizadas no Módulo. Resfrie a 70 oC antes de prosseguir.
- Condicione a armadilha de iodeto de metila a 190 oC por 20 min com um fluxo de gás hélio de 50 mL / min antes de todas as produções realizadas no Módulo. Resfrie a 50 oC antes de prosseguir.
- Carregamento de reagentes para o Módulo:
- Usando uma seringa de 100 μL, injete a seguinte mistura através do adaptador na posição #1 do loop de HPLC interno da válvula de seis portas: (R)-N-sec-butil-4-(2-clorofenil)-quinazolina-2-carboxamida (1,0 ± 0,05 mg) em dimetilsulfóxido-d6 (100 ± 10 μL) e hidróxido de sódio 6 N (4 μL).
NOTA: Os solventes deuterados foram selecionados por sua disponibilidade na forma de ampola e porque são normalmente destilados durante a fabricação, garantindo que estejam livres de água. - Carregue o reservatório V4 com 3,0 ml de cloreto de sódio a 0,9% para injeção.
- Carregue o reservatório V5 com 1,0 mL de etanol à prova de 200.
- Carregue o reservatório V6 com 10 mL de água deionizada estéril.
- Encha o balão receptor grande com 25 mL de água deionizada estéril.
- Encha o frasco de formulação com 6,0 ml de cloreto de sódio a 0,9% para injeção.
- Certifique-se de que a linha de entrega esteja conectada a um frasco de produto final pré-montado estéril.
- Preparar a fase móvel com uma mistura de acetonitrilo a 37:63 (v/v) e hidróxido de amónio a 20 mM.
- Condicione a coluna de semi-preparação com quatro volumes de coluna de fase móvel.
NOTA: A coluna utilizada é uma coluna de fase inversa C18 100 mm x 10 mm.
- Usando uma seringa de 100 μL, injete a seguinte mistura através do adaptador na posição #1 do loop de HPLC interno da válvula de seis portas: (R)-N-sec-butil-4-(2-clorofenil)-quinazolina-2-carboxamida (1,0 ± 0,05 mg) em dimetilsulfóxido-d6 (100 ± 10 μL) e hidróxido de sódio 6 N (4 μL).
- Durante a preparação do módulo automatizado, bombardeie o alvo de ciclotron de carbono-11 (1% de oxigênio, 99% de nitrogênio) em um cíclotron de 11 MeV a 55 μA por 60–80 min em alvos de feixe duplo para produzir dióxido de carbono [11C] pela reação nuclear de 14N (p, α) 11C.
- Aproximadamente 20 minutos antes de descarregar o dióxido de carbono [11C]do cíclotron para o Módulo, inicie a lista de tempo validada para a síntese de [11C]ER-176 clicando no botão Iniciar . Deixar arrefecer a coluna CH4 até 45 °C antes de receber dióxido de carbono radioactivo [11C] (ver figura 3). Deixar o purgador da coluna da carbosfera (purgador CH4 ) arrefecer até -75 °C.
- Que o método incorporado no módulo para a conversão do dióxido de carbono [11C]em iodeto de metilo, por meio de um processo químico seco, proceda do seguinte modo:
- Converter a atividade do dióxido de carbono [11C]em [11C]metano, reagindo com o gás hidrogénio a 350 °C sobre um catalisador de níquel (shimalite-níquel). Use uma armadilha de ascarite (hidróxido de sódio) para reter o dióxido de carbono [11C] não convertido e a água formada.
- Aprisionar o metano [11C]formado num colector de coluna de carbosfera (colector CH4 ) a -75 oC para posterior purificação e concentração. Para liberar o metano [11C]aprisionado, aqueça a coluna da carbosfera a 80 oC.
- Reagir o [11C]metano purificado com iodo elementar a 720 oC para formar iodeto de [11C]metilo ([11C]CH3I) por meio de uma bomba de gás de recirculação de hélio, onde o iodeto de hidrogênio gerado por incidentes é retido por outra armadilha de ascarite enquanto o [11C]metano não convertido retorna ao processo de circulação.
- Aprisionar o [11C]CH3I formado à temperatura ambiente na coluna de iodeto de metilo (MeI) que se acumulou durante o processo de recirculação.
- No final do processo de circulação, libere o [11C]CH3I coletado da armadilha de MeI aquecendo a 190 oC sob fluxo de hélio (15 mL / min), desviado da coluna de MeTf e guiado através de uma válvula de retenção para o circuito de aço inoxidável de 1,5 mL contendo a solução precursora pré-carregada (etapa 1.5.1).
- Uma vez que o [11C]CH3I tenha passado pelo circuito por 180 s, injete a mistura de reação na coluna de HPLC semi-preparada para purificação. Utilizar as seguintes condições de HPLC: fase móvel de acetonitrilo 37:63 (v/v): hidróxido de amónio a 20 mM a um caudal de 5,0 ml/min e um comprimento de onda UV de 235 nm; tempo de retenção (tR) de [11C]ER-176: aproximadamente 12–14 min. Veja a Figura 5.
- Coletar a amostra fracionada em um grande recipiente contendo 25 mL de água desionizada estéril. Carregue a mistura diluída em um cartucho de extração em fase sólida (SPE) leve C18 .
- Lave o produto (1) com mais 10 mL de água deionizada estéril.
- Eluir o produto desejado do SPE C18 light com o uso de etanol à prova de 200 (1 mL). Direcione esta eluição para um frasco de formulação pré-carregado com cloreto de sódio a 0,9% para injeção (6 mL).
- Enxágue ainda mais o SPE C18 light com mais 3 mL de cloreto de sódio a 0,9% para injeção através do reservatório V4.
- Colete a solução final no frasco de formulação (~ 10 mL) e passe por um filtro de esterilização de 0,22 μm em um frasco de vidro estéril, apirogênico, USP Tipo I de 50 mL pré-montado, selado com um septo de borracha e cravado com uma tampa de alumínio.
- Usando telemanipuladores, remova uma alíquota do frasco do produto final como uma amostra de controle de qualidade (CQ). Submeter esta amostra a vários testes de CQ para garantir a conformidade com as especificações estabelecidas antes da liberação e administração a um paciente (ver Tabela 2).
NOTA: Aplique este procedimento de método de loop usando [11C]CH3I para a marcação radioativa de (2); gerar e usar [11C]CH3OTf para produzir (3) e (4) (consulte o Arquivo Suplementar 1).- Para seguir a análise típica de controle de qualidade realizada na instalação, use telemanipuladores para transferir uma amostra do frasco do produto final para uma seringa de TB e, em seguida, para a sala de Controle de Qualidade usando um transportador blindado contra chumbo.
- Em uma área blindada de chumbo (bloco L), expulse a amostra em um tubo livre de pirogênio e, em seguida, distribua-a em frascos de vidro menores (50–100 μL) para análises de HPLC e cromatografia gasosa (GC).
- Diluir uma segunda amostra com água isenta de pirogênio até a concentração apropriada para análise de endotoxinas bacterianas.
- Inocular uma amostra da solução do produto final (em meio de caldo de soja tríptico (TSB) e meio fluido de tioglicolato (FTM) como uma amostra de esterilidade). Incube e observe essas amostras quanto ao crescimento ao longo de 14 dias.
- Aplique uma pequena alíquota a uma tira de pH para determinar visualmente a acidez/basicidade da solução do produto final.
2. Método do recipiente de reação para a marcação radioativa de [11C]ER-176 (1)
- Certifique-se de que o Módulo esteja completamente limpo de acordo com o protocolo de limpeza interno.
- Use HCl 1 N, água, acetona e acetonitrila para limpar a parte de reação do Módulo e água seguida de etanol para limpar e esterilizar a parte de formulação do Módulo.
- Condicione o forno de metano (CH4) a 350 oC por 20 min com um fluxo de gás hidrogênio de 100 mL/min antes de todas as produções realizadas no Módulo. Resfrie a 45 oC antes de prosseguir.
- Condicione a armadilha CH4 a 120 oC por 20 min com um fluxo de gás hélio de 50 mL/min antes de todas as produções realizadas no Módulo. Resfrie a 70 oC antes de prosseguir.
- Condicionar a armadilha MeI a 190 oC por 20 min com um fluxo de gás hélio de 50 mL / min antes de todas as produções. Resfrie a 50 oC antes de prosseguir. Certifique-se de que o tubo V8 esteja conectado à agulha no recipiente.
- Efectuar um ensaio de estanquidade com gás hélio, desde a válvula receptora (V24 a V16) até ao circuito interno de MeI e de V8 até ao reservatório, utilizando V23 como fonte de vedação/escape.
- Carregamento de reagentes para o Módulo:
- Adicionar o seguinte: (R)-N-sec-butil-4-(2-clorofenil)-quinazolina-2-carboxamida (1,0 ± 0,05 mg) em dimetilsulfóxido-d6 (100 ± 10 μL) e hidróxido de sódio 6 N (4 μL) ao recipiente do reator.
- Carregue o reservatório V2 com 1.0 mL de acetonitrila 37:63:20 mM de hidróxido de amônio.
- Carregue o reservatório V4 com 3,0 ml de cloreto de sódio a 0,9% para injeção.
- Carregue o reservatório V5 com 1,0 mL de etanol à prova de 200.
- Carregue o reservatório V6 com 10 mL de água deionizada estéril.
- Encha o balão receptor grande com 25 mL de água deionizada estéril.
- Encha o frasco de formulação com 6,0 ml de cloreto de sódio a 0,9% para injeção.
- Certifique-se de que a linha de entrega esteja conectada ao frasco de produto final estéril pré-montado.
- Encher um reservatório com HPLC de fase móvel (37:63 (v/v) acetonitrilo:20 mM de hidróxido de amónio) e ligar à bomba de HPLC.
NOTA: A coluna de semi-preparação utilizada é a mesma acima e pré-condicionada com a fase móvel (4 volumes de coluna).
- Durante a preparação do módulo automatizado, bombardeie o alvo de ciclotron de carbono-11 (1% de oxigênio, 99% de nitrogênio) em um cíclotron de 11 MeV a 55 μA por 60–80 min em alvos de feixe duplo para produzir dióxido de carbono [11C] pela reação nuclear de 14N (p, α) 11C.
- Aproximadamente 20 minutos antes de descarregar o dióxido de carbono [11C]do cíclotron para o Módulo, inicie a lista de tempo validada para a síntese de [11C]ER-176 clicando no botão Iniciar . Deixar arrefecer a coluna CH4 até 45 °C antes de receber dióxido de carbono radioactivo [11C] (ver figura 3). Deixar o purgador da coluna da carbosfera (purgador CH4 ) arrefecer até -75 °C
- Que o método incorporado no módulo para a conversão do dióxido de carbono [11C]em iodeto de metilo, por meio de um processo químico seco, proceda do seguinte modo:
- Converter a atividade do dióxido de carbono [11C]em [11C]metano, reagindo com o gás hidrogénio a 350 °C sobre um catalisador de níquel (shimalite-níquel). Reter o dióxido de carbono [11C] não convertido e a água formada com uma armadilha de ascarita (hidróxido de sódio).
- Armadilhar [11C]metano numa coluna de carbosfera a -75 oC para posterior purificação e concentração. Para liberar o [11C]metano, aqueça a coluna da carbosfera a 80 oC.
- Reaja o metano [11C]purificado com iodo elementar a 720 oC para formar iodeto de metila [11C]por meio de uma bomba de gás de recirculação onde o hidrogênio gerado por incidente é retido por outra armadilha de ascarite enquanto o metano [11C]não convertido retorna ao processo de circulação, chamado recirculação do circuito interno.
- Aprisionar o iodeto de [11C]metilo formado à temperatura ambiente na coluna de MeI que se acumulou durante o processo de recirculação.
- No final do processo de circulação, aqueça a armadilha adsorvente polimérica porosa a 190 oC sob fluxo de hélio (30 mL / min) para liberar o iodeto de metila [11C] coletado e guiá-lo através de uma válvula de retenção para o vaso de reação de 3 mL para a radiomarcação de carbono-11 de (1).
- Uma vez estabilizada a geração e a acumulação de iodeto de [11C]metilo, contornar a coluna de triflatos de prata e dirigir o gás radioactivo através de V8 para o recipiente de reacção que contém a mistura precursora. Deixe o iodeto de metila [11C] borbulhar por 3 min, depois feche o recipiente de reação e aqueça-o a 80 oC por 5 min.
- Uma vez concluída a rotulagem, após 5 min, resfrie o vaso de reação a 30 oC e dilua com 1 mL de fase móvel do reservatório V2.
- Injectar a mistura na coluna de HPLC semi-preparada para depuração, utilizando as seguintes condições de HPLC: fase móvel de acetonitrilo 37:63 (v/v): hidróxido de amónio a 20 mM a um caudal de 5,0 ml/min e um comprimento de onda UV de 235 nm; tR de [11C]ER-176 (1): aproximadamente 9–11 min, veja a Figura 6.
- Recolher a amostra fraccionada para o balão receptor grande contendo 25 ml de água desionizada estéril. Carregue esta mistura diluída em um cartucho SPE C18 light.
- Lave o produto retido (1) com mais 10 mL de água deionizada estéril.
- Eluir o produto desejado do SPE C18 light com o uso de etanol 200 proof (1,0 mL), direcionado para um frasco de formulação pré-carregado com cloreto de sódio a 0,9% para injeção (6,0 mL).
- Lave o C18 light SPE com mais 3,0 ml de cloreto de sódio a 0,9% para injeção.
- Recolher a solução final no balão de formulação (~10 ml). Passe este meio através de um filtro esterilizante de 0,22 μm para um frasco de vidro estéril, apirogênico, USP Tipo I de 50 mL pré-montado, selado com um septo de borracha e cravado com uma tampa de alumínio.
- Use telemanipuladores para remover uma alíquota do frasco do produto final como uma amostra de controle de qualidade (CQ) (consulte a etapa 1.15). Submeter a amostra a vários testes nos quais o radiotraçador deve passar por todos os critérios de aceitação antes da liberação e administração em um paciente (ver Tabela 2).
NOTA: Aplique este método de vaso de reator usando [11C]CH3I para a radiomarcação de (2); gerar e usar [11C]CH3OTf para produzir (3) e (4) (consulte o Arquivo Suplementar 1).
Resultados
O grupo de radioquímica da New York University Langone Health (NYULH) fornece vários radiotraçadores de carbono-11, flúor-18 e gálio-68 usados para pesquisas em humanos e aplicações pré-clínicas. Vários métodos são utilizados para a produção dos radiotraçadores PET. Nossa equipe emprega o método de loop para a síntese de (1), (2), (3) e (4) (ver Figura 1 e Figura 8). Após a conclusão da produção, uma alíquota é removida do frasco estéril do produto final. Esta amostra é usada para a inoculação da solução do produto final (em meio de caldo de soja tríptico (TSB) e meio fluido de tioglicolato (FTM) como uma amostra de esterilidade), bem como uma amostra representativa da solução a granel para testes de CQ. Cada radiotraçador é submetido a testes de CQ antes de o produto ser libertado para administração (ver Tabela 2).
Os testes de controle de qualidade incluem a visualização da aparência do produto, verificação da integridade do filtro, determinação da identidade radionuclídica, pH, identidade radioquímica (radio-HPLC), pureza radioquímica (radio-HPLC), pureza química (HPLC), atividade molar, resistência, solvente residual, endotoxinas e esterilidade (ver Tabela 2). Os seguintes resultados foram obtidos a partir da produção clínica de cada radiotraçador acima mencionado (ver Tabela 1).
Para um cromatograma HPLC analítico representativo, consulte a Figura 7 e o Arquivo Suplementar 1. Cada radiotraçador é obrigado a passar por todas as especificações de controle de qualidade (ver Tabela 2) antes de poder ser liberado e administrado a um sujeito.
Consulte o Arquivo Suplementar 1 para quantidades de precursores e reagentes, bem como os cromatogramas analíticos de HPLC de [11C]MRB (2) (Figura Suplementar 1), [11C]mHED (3) (Figura Suplementar 2) e [11C]PiB (4) (Figura Suplementar 3).
| Composto | Parâmetros | Método de loop (média ± std) | Método do reator (média ± padrão) |
| [11C]ER-176 | Número de produções | 25 | 6 |
| Início da Síntese | 86 ± 5,0 GBq | 52 ± 25,7 GBq | |
| Fim da Síntese | 5,4 ± 2,2 GBq | 1,6 ± 0,5 GBq | |
| Pureza radioquímica | 99,6 ± 0,6% | 99,9 ± 0,1% | |
| Concentração ER-176 | 1,1 ± 0,5 μg/mL | 0,63 ± 0,37 μg/mL | |
| Atividade molar | 194 ± 66 GBq/μmol | 132 ± 78 GBq/μmol | |
| Tempo Total de Síntese | 36 ± 3 min | 44 ± 6 min | |
| [11C]MRB | Número de produções | 70 | 6 |
| Início da Síntese | 84 ± 5,4 GBq | 39 ± 11,9 GBq | |
| Fim da Síntese | 3,0 ± 1,2 GBq | 1,9 ± 0,7 GBq | |
| Pureza radioquímica | 99,5 ± 0,5% | 99,7 ± 0,8% | |
| Concentração de MRB | 0,52 ± 0,24 μg/mL | 0,68 ± 0,41 μg/mL | |
| Atividade molar | 190 ± 50 GBq/μmol | 99 ± 55 GBq/μmol | |
| Tempo Total de Síntese | 35 ± 3 min | 42 ± 3 min | |
| [11C]mHED | Número de produções | 5 | 11 |
| Início da Síntese | 69 ± 10,5 GBq | 82 ± 4,3 GBq | |
| Fim da Síntese | 5,5 ± 1,3 GBq | 3,3 ± 1,0 GBq | |
| Pureza radioquímica | 98,2 ± 1,3% | 99,1 ± 0,7% | |
| Concentração de mHED | 0,40 ± 0,10 μg/mL | 0,52 ± 0,37 μg/mL | |
| Atividade molar | 301 ± 48 GBq/μmol | 155 ± 77 GBq/μmol | |
| Tempo Total de Síntese | 27 ± 4 min | 32 ± 2 min | |
| [11C]PiB | Número de produções | 51 | 10 |
| Início da Síntese | 86 ± 5,4 GBq | 57 ± 17,2 GBq | |
| Fim da Síntese | 3,2 ± 0,8 GBq | 1,4 ± 0,2 GBq | |
| Pureza radioquímica | 97,0 ± 1,5% | 99,1 ± 1,4% | |
| Concentração de PiB | 0,22 ± 0,51 μg/mL | 0,30 ± 0,24 μg/mL | |
| Atividade molar | 201 ± 68 GBq/μmol | 207 ± 124 GBq/μmol | |
| Tempo Total de Síntese | 35 ± 2 min | 36 ± 5 min |
Quadro 1: Resultados da produção de [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) e [11C]PiB (4) por meio do método de loop ou método de recipiente de reação. Todos os valores são relatados no final da síntese. Abreviaturas: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; [11C]MRB = (S,S)-[11C]metilreboxetina; [11C]mHED = [11C]-meta-hidroxiefedrina; [11C]PiB = 2-[4-[(11C)metilamino]fenil]-1,3-benzotiazol-6-ol.
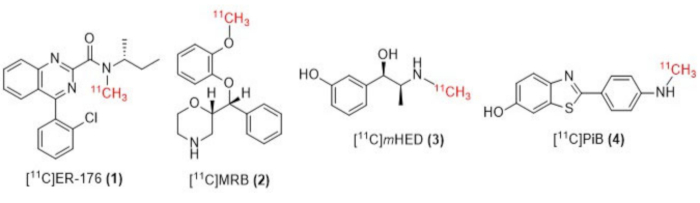
Figura 1: Estruturas de [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) e [11C]PiB (4). Abreviaturas: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; [11C]MRB = (S,S)-[11C]metilreboxetina; [11C]mHED = [11C]-meta-hidroxiefedrina; [11C]PiB = 2-[4-[(11C)metilamino]fenil]-1,3-benzotiazol-6-ol. Clique aqui para ver uma versão maior desta figura.
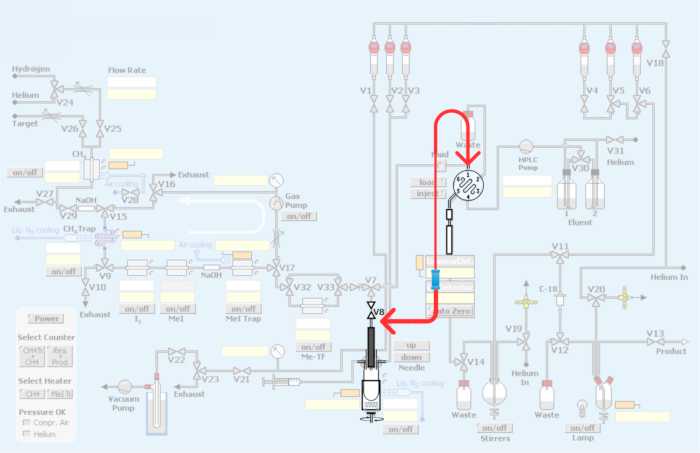
Figura 3: Modificações feitas no Módulo automatizado. Em vermelho representa o encanamento do módulo de síntese para incorporar o loop para a produção de radiotraçadores PET por meio da metilação do carbono-11. Clique aqui para ver uma versão maior desta figura.

Figura 4: Encanamento e reencanamento do módulo para incorporar o método de loop para metilação de carbono-11 de radiotraçadores PET. (A) Loop de injeção de HPLC com conectores de união. (B) Método do recipiente de reação. A seta vermelha mostrando a conexão V8. (C) Reencanamento do método de loop, contornando o vaso do reator. Note-se que a ligação V8 à entrada de HPLC contorna o recipiente de reacção, permitindo o acesso directo ao [11C]iodometano ou ao [11C]metiltriflato ao circuito de HPLC. (D) Colocação da união em relação ao vaso do reator. Observe a conexão ao loop de HPLC de aço inoxidável. Clique aqui para ver uma versão maior desta figura.
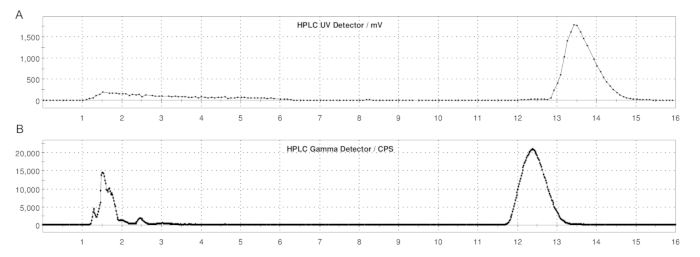
Figura 5: Perfis de HPLC semi-preparados de ER-176 e [11C]ER-176 com produção pelo método de loop. (A) Perfil de HPLC semi-prep para ER-176 (1) por meio de produção de método de loop em UV = 235 nm; tR = 13,2 min. (B) Perfil de radio-HPLC semi-preparado para [11C]ER-176 (1); tR = 12,4 min. Condições: fase móvel de acetonitrila 37:63 (v/v): hidróxido de amônio 20 mM a uma vazão de 5,0 mL/min. Abreviatura: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida. Clique aqui para ver uma versão maior desta figura.
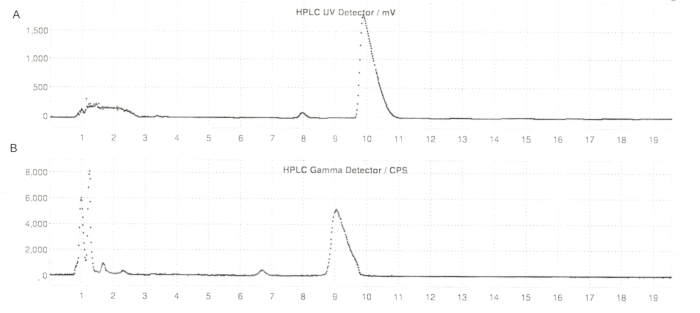
Figura 6: Perfis de HPLC semi-preparados de ER-176 e [11C]ER-176 com produção de métodos de reactores. (A) Perfis de HPLC semi-preparados para ER-176 (1) através da produção de métodos de reactores a UV = 235 nm; tR = 9,8 min. (B) Perfil de radio-HPLC semi-preparada para [11C]ER-176 (1); tR = 9,2 min. Condições: fase móvel de acetonitrila 37:63 (v/v): hidróxido de amônio 20 mM a uma vazão de 5,5 mL/min. Abreviaturas: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; tR = tempo de retenção. Clique aqui para ver uma versão maior desta figura.
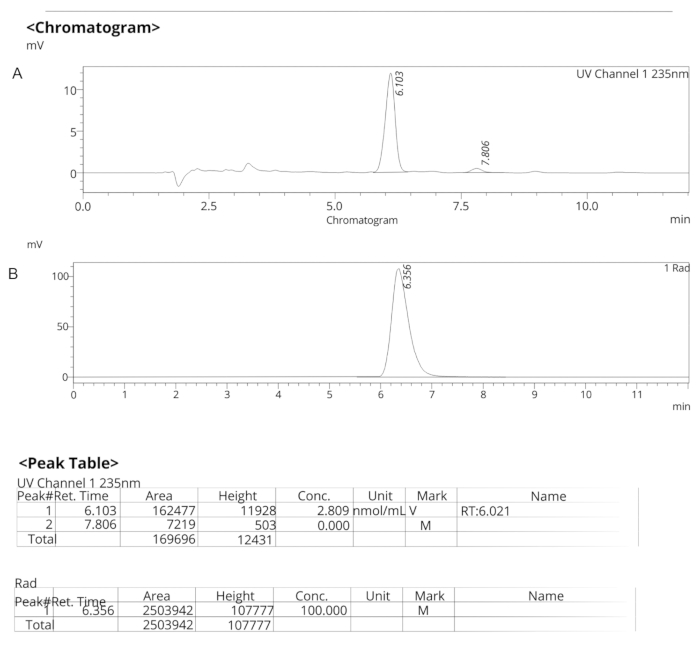
Figura 7: Perfis analíticos de HPLC para ER-176. (A) Perfil analítico de HPLC dos espectros UV para ER-176 (1) a 235 nm; tR = 6,10 min. (B) Perfil analítico de HPLC do radiotraçador para [11C]ER-176 (1); tR = 6,36 min. Condições: 10 μm C18 (2) 100  LC Coluna 250 x 4,6 mm; metanol/água 74/26 com uma vazão de 1,5 mL/min. Abreviatura: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; tR = tempo de retenção Clique aqui para ver uma versão ampliada desta figura.
LC Coluna 250 x 4,6 mm; metanol/água 74/26 com uma vazão de 1,5 mL/min. Abreviatura: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; tR = tempo de retenção Clique aqui para ver uma versão ampliada desta figura.
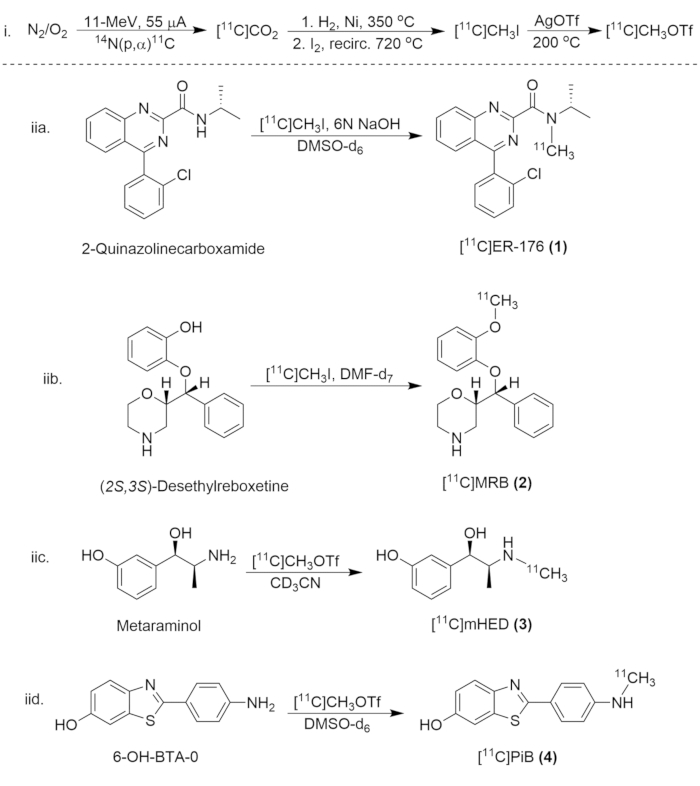
Figura 8: Esquema Sintético para Síntese de Compostos de Carbono-11. (i) A formação de [11C]CH3I e [11C]CH3OTf, e (iia.) a radiomarcação de [11C]ER-176 (1), (iib.) [11C]MRB (2), (iic.)[11C]mHED (3) e (iid.) [11C]PiB (4). Clique aqui para ver uma versão maior desta figura.
| Teste/Parâmetros | Especificações |
| Aparência (inspeção visual) | Solução límpida, incolor e isenta de partículas |
| Integridade do filtro de membrana | ≥ 50 psi |
| ph | 4.5 - 8.0 |
| Identidade radionuclídica (meia-vida) | 19.3 - 21.3 min |
| Identidade radioquímica (radio-HPLC) | 0,90 ≤ tR Prod / t R Std ≤ 1,10 |
| Pureza radioquímica (radio-HPLC) | ≥ 95,0%† |
| Concentração do medicamento (HPLC) | ver notas* |
| Impurezas químicas totais (HPLC) | ver notas** |
| Atividade molar (@ EOS) | > 9,25 GBq/μmol |
| Acetonitrila residual (GC) | ≤ 410 ppm |
| Acetona residual (GC) | ≤ 5.000 ppm |
| Dimetilsulfóxido residual (GC) | ≤ 5.000 ppm |
| Etanol residual (GC) | ≤ 10% (v/v) |
| Metanol residual (GC) | ≤ 3.000 ppm |
| N,N-dimetilformamida residual (GC) | ≤ 880 ppm |
| Limulus Lisado de Amebócitos (LAL) | ≤ 17,5 EU/mL |
| Esterilidade (iniciar em 30 h) | Estéril (14 dias) |
| Registros de preparação | Completo e preciso |
| Rótulos | Completo, preciso, reconciliado |
Tabela 2: Critérios de controle de qualidade para a aprovação ou rejeição de radiotraçadores de carbono-11. † A pureza radioquímica ≥ 90,0% para [11C]mHED; * Concentração da droga: [11C]ER-176 ≤ 10 μg/dose; [11C]MRB ≤ 10 μg/dose; [11C]mHED ≤ 50 μg/dose; [11C]PiB ≤ 13,4 μg/dose; ** Impurezas químicas totais: [11C]ER-176 ≤ 1,0 μg/dose; [11C]MRB ≤ 1,0 μg/dose; [11C]mHED ≤ 5,0 μg/dose; [11C]PiB ≤ 1,34 μg/dose. Abreviaturas: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; [11C]MRB = (S,S)-[11C]metilreboxetina; [11C]mHED = [11C]-meta-hidroxiefedrina; [11C]PiB = 2-[4-[(11C)metilamino]fenil]-1,3-benzotiazol-6-ol; EOS = fim da síntese; GC = cromatografia gasosa; LAL = lisado de amebócitos de Limulus.
Arquivo Suplementar 1: Produtos químicos e materiais, reagentes usados para o método de loop ou vaso de reator, testes de controle de qualidade, cromatogramas analíticos de HPLC. Clique aqui para baixar este arquivo.
Discussão
A radiomarcação tradicional de heteroátomos terminais com iodometano de carbono-11 ou triflato de metila envolve borbulhar o gás eletrofílico radioativo em um recipiente de reação, prendendo-o e permitindo que a solução reaja por longos períodos de tempo18. O borbulhar convencional da reação heterogênea pode ser lento e pode exigir aquecimento para acelerar a taxa de reação. Antes da purificação, pode ser necessário resfriar o meio de reação à temperatura ambiente, seguido pela transferência para um loop de HPLC com o uso de solvente (por exemplo, fase móvel) para purificação do radiotraçador desejado. Essas etapas são demoradas e produtos radiomarcados fugazes podem ser perdidos durante a transferência de tais materiais.
Em nossas instalações, demonstramos a justificativa para o uso do método de alça, onde a solução precursora é revestida em uma alça de aço inoxidável HPLC e a radiomarcação do composto ocorre dentro da alça à temperatura ambiente. O circuito é ligado em linha com a entrega do [11C]CH3I ou [11C]CH3OTf radioativo e ligado à porta de injeção de um sistema HPLC. Nenhum aquecimento é necessário para que a radiomarcação ocorra e, para todos os casos mostrados neste manuscrito, a reação ocorre em menos de 3 min.
A taxa de fluxo e o tamanho do loop de HPLC de aço inoxidável parecem ser críticos para que esse processo funcione com eficiência. Os testes começaram variando a taxa de fluxo do gás de arraste, hélio, de 8,0 mL / min a 15,0 mL / min para que o gás radioativo fosse entregue ao circuito. Buckley estudou a importância de aplicar a taxa de fluxo correta, bem como usar o solvente apropriado e o material de loop15. Para o nosso sistema, a taxa de fluxo de 15 mL / min para espécies eletrofílicas radioativas de [11C]CH3I ou [11C]CH3OTf tem um bom desempenho para a marcação radioativa de todos os quatro radiotraçadores discutidos neste manuscrito. O loop usado para todas as sínteses é um loop de injeção de HPLC de aço inoxidável a 1,5 mL possuindo um OD de 1/16 de polegada e um ID de 1 mm.
Comparando os dois métodos (vaso de reação versus método de alça), em nossas mãos, o método de alça demonstrou maior eficiência de radiomarcação junto com um aumento substancial na atividade molar no final da síntese (EOS) para a produção de quatro radiotraçadores aprovados para pesquisa em humanos. Por exemplo, o radiotraçador [11C]mHED (3) teve um aumento de 1,6 vezes na atividade isolada do produto final, além de atingir o dobro da atividade molar no EOS. Essa tendência de aumento da atividade geral é observada em todos os quatro radiotraçadores (ver Tabela 1). Resultados favoráveis adicionais ao usar o método de loop incluem um tempo de configuração reduzido em 5 minutos e nenhuma necessidade de limpar o vaso de reação, economizando o tempo do operador e o uso de solventes para um protocolo de limpeza.
Algumas desvantagens dessa metodologia incluem os limites nos quais os radiotraçadores podem ser efetivamente rotulados usando o método de loop. Se o calor for necessário para a radiomarcação, é difícil modificar este sistema para permitir o aquecimento dentro do circuito de HPLC. Este sistema requer modificações no encanamento; Esse recurso de não tê-lo pronto 'pronto para uso' pode impedir que outros usuários realizem tais alterações em sua plataforma automatizada14. Como encanamentos e uniões suplementares são necessários para este método (consulte a Figura 4A-D), o potencial para locais adicionais para liberações radioativas aumenta ao rotular nessas condições. É prudente realizar uma verificação de vazamento antes de cada execução no Módulo.
Nossa equipe implementou o método de loop usado na produção aprovada pelo Investigational New Drug Application (IND) e pelo Radioactive Drug Research Committee (RDRC) de quatro radiotraçadores de carbono-11. Em nossas mãos, esse método provou ser um processo mais eficiente e de maior rendimento do que o método tradicional de vasos de reação. Encanamentos adicionais e ajustes na vazão do gás hélio transportador precisam ser considerados ao aplicar este método à maioria dos módulos automatizados. Finalmente, este método tem limitações e não é adequado para certos radiotraçadores de carbono-11, como [11C]UCB-J, que requer a ativação do intermediário de paládio (II) e aquecimento24 da mistura de reação.
Divulgações
Os autores declaram não ter interesses relevantes ou financeiros relacionados a esta pesquisa a divulgar.
Agradecimentos
Gostaríamos de agradecer aos ex-membros do laboratório de radioquímica da NYULH, Raul Jackson e Grace Yoon, por seu trabalho nos esforços iniciais para a metilação do carbono-11 usando um método de loop.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
Referências
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados