Method Article
توصيف التجميع الذاتي القابل للانعكاس المعتمد على الأس الهيدروجيني للغرويات الذهبية المطلية بالأميلويد بيتا 1-40
In This Article
Summary
هنا ، نقدم طريقة منهجية تصف التجميع الذاتي شبه القابل للانعكاس لمجاميع الذهب المطلية بالأميلويد بيتا 1-40 (Aβ 1-40) 20 نانومتر. ارتبطت الشبكات شبه القابلة للانعكاس المعتمدة على حجم النانو بين الببتيدات بأحماض أمينية معينة أو أقسام من مونومر Aβ 1-40.
Abstract
تم إجراء توصيف Aβ 1-40 المطلي على أسطح الجسيمات الغروية النانوية الذهبية باستخدام التحليل الطيفي للرنين البلازمي السطحي (SPR) والفحص المجهري الإلكتروني للإرسال (TEM). ارتبط التحول الملحوظ المعتمد على الأس الهيدروجيني لنطاق SPR لجزيئات الذهب المطلية ب Aβ 1-40 20 نانومتر بتناوب التجميع والتفكيك الذي لوحظ في صور TEM. أدى الرقم الهيدروجيني ~ 4 إلى تكوين غير مطوي ، وأدى الرقم الهيدروجيني ~ 10 إلى تكوين مطوي من Aβ 1-40 على سطح الذهب. لوحظت عملية التجميع القابلة للانعكاس هذه بواسطة تصوير رامان حيث تم تغيير الرقم الهيدروجيني تدريجيا من الرقم الهيدروجيني 4 إلى الرقم الهيدروجيني 10. لاحظنا تغيرا في التشكل المعتمد على الأس الهيدروجيني في Aβ 1-40 على سطح الذهب ، حيث لوحظت مجاميع واضحة عند درجة الحموضة 4. ومع ذلك ، لاحظنا اختلافات طفيفة للغاية في طيف التحليل الطيفي رامان المعزز بالسطح (SERS) بين ظروف الأس الهيدروجيني 4 ودرجة الحموضة 10 ، مع وجود الاختلاف الأكثر لفتا للانتباه هو الكثافة الطيفية في منطقة 250 سم -1 و 1750 سم -1. على وجه التحديد ، أشار تحليل وضع التجميع القابل للانعكاس إلى أن الركام تشكلت من التشكل غير المطوي ل Aβ 1-40 والذي تضمن قسم حلقة البنزين من التيروزين والفينيل ألانين. على العكس من ذلك ، ارتبط تفكيك الركام بالتغيرات التوافقية في طي البروتين ل Aβ 1-40 بما في ذلك الهيستيدين والجلوتامين والميثيونين وحمض الأسبارتيك.
Introduction
تم التحقيق على نطاق واسع في تكوين الليف لببتيدات أميلويد بيتا 1-40 (Aβ 1-40) أو 1-42 (Aβ 1-42) كمكون حاسم في تكوين لويحات الأميلويد التي تعد سببا لمرض الزهايمر1،2،3،4،5،6،7،8،9،10، 11. تتمثل الآلية الرئيسية في تكوين الليف في قلة الببتيدات Aβ 1-40 أو Aβ 1-42 لتشكيل تجمع بروتين سام للأعصاب ، وقد تم إجراء تحقيق مكثف لفهم آليات كيفية تشكيل المونومرات للقلات12،13،14. لقد اتخذنا نهجا لفحص الببتيدات النشوانية التي تشكل مجاميع على سطح نانو ذهبي وتحديد العوامل المسؤولة عن الربط بين الببتيدات البعيدة عن سطح الذهب15،16،17،18،19،20،21،22.
تتبنى Aβ 1-40 شكلا غير مطوي (A) في ظل الظروف الحمضية (درجة الحموضة ~ 4) وتشكل مطوي (B) في ظل الظروف الأساسية (درجة الحموضة ~ 10). لاحظنا جزيئات غروانية ذهبية مطلية بAβ 1-40 مشتتة عند درجة الحموضة ~ 10 ومجاميع غروية ذهبية كبيرة Aβ 1-40 عند درجة الحموضة ~ 4 (الشكل 1) 23،24. يفضل التشكل غير المكشوف ل Aβ 1-40 ، في الظروف الحمضية ، شبكات الببتيد بين مونومرات Aβ 1-40 فوق سطح جسيمات الذهب النانوية ، مما يؤدي إلى تكوين مجاميع غروية ذهبية (انظر أ في الشكل 1). عندما يحمل مونومر Aβ 1-40 التشكل المطوي عند درجة حموضة أساسية أو محايدة ، Aβ 1-40 ، لا تتشابك المونومرات في الركام ، وتظل جزيئات الذهب النانوية المطلية كجزيئات فردية مشتتة (انظر B في الشكل 1). لذلك ، يمكننا استجواب عملية كيفية خضوع ببتيدات Aβ 1-40 لتغييرات توافقية في الشبكة وتشكيل المجاميع عن طريق قياس تحول نطاق SPR على نطاق من ظروف الأسالهيدروجيني 25،26،27،28،29،30،31.
اختبرنا عدة أحجام مختلفة من الجسيمات النانوية للذهب ووجدنا أن الغروانية الذهبية 20 نانومتر أظهر أبرز عملية التجميع الذاتي القابلة للانعكاس لمونومرات Aβ 1-40 استجابة لتغير خارجي في الأس الهيدروجيني (الشكل 2). هذا مؤشر واضح على تغيير قابل للانعكاس في تشكل الببتيد ، حيث تؤدي الظروف الحمضية (أ) إلى تكوين مكشوف ، مما يعزز الشبكات ويؤدي إلى تراكم غرويات الذهب. تم العثور على الشرط الأساسي (ب) للحث على تشكيل مطوي للمونومرات26،27،28،29،30،31.
Protocol
1. تحضير جزيئات الذهب النانوية المطلية Aβ 1-40
- أضف حجما 1 مل من الماء المقطر منزوع الأيونات إلى 1 مجم من Aβ 1-40 المجفف بالتجميد (ميغاواط: 4.2 كيلو دالتون ، نقاء HPLC بنسبة 98٪) باستخدام إبرة حقنة. امزج المحلول بخلاط دوامة لمدة 30 ثانية تقريبا وتأكد من عدم ملاحظة أي جزيئات صلبة في المحلول في درجة حرارة الغرفة (RT ؛ ~ 20 درجة مئوية).
- تحضير جميع محاليل المخزون باستخدام الماء منزوع الأيونات والمقطر (~ 18 MΩ · سم).
- حدد التركيز طيفيا باستخدام امتصاص التيروزين عند 275 نانومتر32 ، والذي يحتوي على معامل انقراض جزيئي ε275 من 1390 سم -1 · م -1.
- قم بتخزين حلول المخزون من Aβ 1-40 عند -80 درجة مئوية. (انظر جدول المواد للمنتجات التجارية Aβ 1-40.)
- قم بإذابة محلول مخزون الببتيد قبل حوالي 5 دقائق من جمع البيانات. امزج حجما 8 ميكرولتر من محلول الببتيد مع 800 ميكرولتر من جزيئات الذهب الغروية في أنبوب طرد مركزي سعة 15 مل. أضف حجما قدره 4.2 مل من الماء المقطر منزوع الأيونات ثم قم بتدوير العينة لمدة 10 ثوان30،31،33،34.
- اثبت تركيز Aβ 1-40 الببتيدات ليكون 1.8 نانومول وحدد نسبة Aβ 1-40 الببتيدات. تراوح عدد الغرويات الذهبية بين ~ 500: 1 إلى ~ 2000: 125.
2. تغيير الأس الهيدروجيني التكراري ومراقبة تحول نطاق SPR المقابل
- اضبط درجة حرارة المحلول على قيمة محددة (على سبيل المثال ، 25 درجة مئوية) باستخدام وحدة التحكم في درجة الحرارة لمقياس الطيف الضوئي للأشعة فوق البنفسجية المرئية والأشعة تحت الحمراء القريبة (UV-Vis-NIR).
- راقب الرقم الهيدروجيني الأولي لمحلول العينة باستخدام مقياس الأس الهيدروجيني واضبطه على أقل بقليل من الرقم الهيدروجيني 7. اجمع طيف الامتصاص في النطاق بين 400 نانومتر و 1000 نانومتر.
- قم بتغيير الرقم الهيدروجيني للعينة إلى ~ pH 4 (أي الرقم الهيدروجيني 4.0 ± 0.3) عن طريق إضافة 10 ميكرولتر من 0.1 M HCl وجمع طيف الامتصاص بين 400 نانومتر و 1000 نانومتر.
- قم بتغيير الرقم الهيدروجيني للعينة إلى ~ درجة الحموضة 10 (أي الرقم الهيدروجيني 10 ± 0.3) عن طريق إضافة 10 ميكرولتر من 0.1 مولار هيدروكسيد الصوديوم وجمع طيف الامتصاص بين 400 نانومتر و 1000 نانومتر.
- قم بتغيير الرقم الهيدروجيني بين الرقم الهيدروجيني 4 ودرجة الحموضة 10 باستخدام حمض الهيدروكلوريك و هيدروكسيد الصوديوم 10 مرات واجمع طيف الامتصاص بشكل مستمر عند 25 ± 0.2 درجة مئوية29,30.
ملاحظة: بالنسبة لجميع حلول العينات، تم الحفاظ على الكثافة البصرية لذروة نطاق SPR حول 0.2. من المتوقع حدوث تأثير مخزن مؤقت بسبب حل المخزن المؤقت المتبقي في محلول. وهكذا ، تم تحديد قيمة الأس الهيدروجيني النهائية بعد تأكيد التوازن. تم قياس قيمة الأس الهيدروجيني مباشرة في عينة من خلية كوفيت باستخدام قطب كهربائي دقيق بدرجة الحموضة الدقيقة ، بدقة ±0.005 درجة حموضة. - احصل على الكود القياسي الأمريكي لتبادل المعلومات (ASCII) مجموعة بيانات الأطوال الموجية كدالة للامتصاص. استخرج متوسط موضع قمم النطاق باستخدام برنامج Peak Fit .
- ارسم مجموعة البيانات لعرض الكثافة الضوئية كدالة للطول الموجي (نانومتر) باستخدام وظيفة المخطط .
- حدد الأطوال الموجية الذروة الأولية λ1 و λ2 و λ3 عن طريق تحديد مواقعها التقريبية في البيانات المرسومة وملاءمة البيانات باستخدام الدالة RUN .
- احصل على الرسم البياني الذي يحتوي على الذروة المركزية لكل (λi) ، XCi ، مع مساحة كل نطاق (Ai).
- قم بتصدير مواضع ومناطق الذروة المستخرجة إلى برنامج جداول البيانات وحساب متوسط موضع الذروة عند درجة حموضة معينة.
- حدد عامل الترجيح ai لكل مركز ذروة λi من خلال مقارنة مساحة النطاق (Ai) بالمساحة الإجمالية للنطاقات بأكملها على النحو التالي:
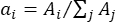 .
. - استخرج متوسط موضع الذروة (
 الرقم الهيدروجيني) باستخدام المعادلة (1).
الرقم الهيدروجيني) باستخدام المعادلة (1).
 (1)
(1)
- حدد عامل الترجيح ai لكل مركز ذروة λi من خلال مقارنة مساحة النطاق (Ai) بالمساحة الإجمالية للنطاقات بأكملها على النحو التالي:
- قم بإنشاء مخطط قابلية للانعكاس باستخدام العملية التالية:
- جدولة متوسط مواضع الذروة ،
 كدالة لكل رقم "عملية" ، n كما
كدالة لكل رقم "عملية" ، n كما  هو مقابل n. اجعل رقم العملية ، n ، ليكون 1 للعينة قبل إضافة الحمض عند ~ درجة الحموضة 7. قم بزيادة رقم العملية بمقدار 1 في كل مرة ، وقم بتغيير الرقم الهيدروجيني ليكون ~ pH4 مع حمض الهيدروكلوريك أو الأس الهيدروجيني ليكون ~ درجة الحموضة 10 مع هيدروكسيد الصوديوم. اجعل n متساويا في حالة حمضية (أي ~ درجة الحموضة 4) وفردي ليكون شرطا أساسيا (أي الرقم الهيدروجيني 10).
هو مقابل n. اجعل رقم العملية ، n ، ليكون 1 للعينة قبل إضافة الحمض عند ~ درجة الحموضة 7. قم بزيادة رقم العملية بمقدار 1 في كل مرة ، وقم بتغيير الرقم الهيدروجيني ليكون ~ pH4 مع حمض الهيدروكلوريك أو الأس الهيدروجيني ليكون ~ درجة الحموضة 10 مع هيدروكسيد الصوديوم. اجعل n متساويا في حالة حمضية (أي ~ درجة الحموضة 4) وفردي ليكون شرطا أساسيا (أي الرقم الهيدروجيني 10). - تحليل موضع الذروة عند كل n ،
 (n) = λ (n) ، باستخدام الصيغة30
(n) = λ (n) ، باستخدام الصيغة30
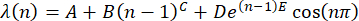 (2)
(2)
ملاحظة: تمثيل متوسط موضع الذروة الأولي عند n = 1 بواسطة A. عبر عن المعلمتين B و C كتحول موضع الذروة المعتمد على n. اجعل المعلمة D كسعة لعامل التخميد ، E ، للتكرار. استخدم دالة الجيب لإظهار تموج موضع الذروة كدالة ل n. - نقل مجموعة البيانات (x, y) إلى برنامج Origin والمؤامرة.
- قم بتشكيل الوظيفة المخصصة الواردة في Eqn. (2) تحت وظيفة تركيب المنحنى غير الخطي للتحليل. اكتب القيم الأولية A و B و C و D و E ، وانقر فوق RUN لإكمال الملاءمة.
- جدولة متوسط مواضع الذروة ،
- تصوير TEM
- اصنع عينات TEM من الغرويات الذهبية المطلية ب Aβ 1-40 20 نانومتر مع شبكات نحاسية مطلية ب Formvar. افحص العينات باستخدام TEM يعمل عند 80 كيلو فولت.
- اجمع الصور بتكبير اسمي يبلغ 28,000x أو 71,000x على كاميرا رقمية CCD بدقة 4 ميجابكسل (AMT) من طراز XR-40. اجمع صور TEM لذهب Aβ 1-40 مطلي بحجم 20 نانومتر عند كل رقم عملية n = 1 (~ pH 7) و n = 2 و 4 و 6 و 8 و 10 (درجة الحموضة 4) و n = 3 و 5 و 7 و 9 (الرقم الهيدروجيني 10).
3. تصوير رامان والتحقيق في التجميع القابل للانعكاس
- ضع 100 ميكرولتر من المحلول على قرص الميكا (قطر 1 سم) لكل عينة عند رقم العملية n. جفف العينات طوال الليل قبل القياس.
- اجمع صور الضوء الأبيض في كل عملية رقم ن. قم بإعداد العينة المنفصلة على قرص الميكا حيث تم تغيير الرقم الهيدروجيني باستمرار بين ~ درجة الحموضة 4 و ~ الأس الهيدروجيني 10 لكل رقم عملية n (الشكل 3).
- اجمع صورة رامان في كل عملية رقم n باستخدام ليزر بطول موجي λ = 633 نانومتر بقوة 0.5 ± 0.05 ميجاوات بدقة مكانية ~ 0.43 ميكرومتر في شبكة تتكون من 100 × 100 بكسل مع وقت تكامل 500 مللي ثانية / طيف للمنطقة بين ~ 200 سم -1 و ~ 2,800 سم -1 (الشكل 4).
- ارسم الطيف التمثيلي لكل n محاذاة كدالة ل n وقم ببناء طيف SERS ثلاثي الأبعاد كدالة ل n ل Aβ1-40 مطلي بالذهب 20 نانومتر (الشكل 5 أ). استخدم العرض العلوي للطيف SERS ثلاثي الأبعاد كخريطة كفافية (الشكل 5 ب) من أجل استخراج الأوضاع المحددة المرتبطة بحالة معينة من الأس الهيدروجيني (أي ~ درجة الحموضة 4 و ~ الأس الهيدروجيني 10). استخرج أي ميزات طيفية محسنة إما في nزوجي فقط أو في nفردي فقط.
النتائج
مع إرفاق Aβ 1-40 على سطح الجسيمات الغروية النانوية الذهبية ، تحول نطاق SPR حول الحد الأقصى للامتصاص 530 نانومتر بشكل كبير إلى وضع الذروة ~ 650 نانومتر عندما أصبح المحلول أكثر حمضية (الرقم الهيدروجيني 4) 35. جنبا إلى جنب مع صور TEM ، حددنا أن السمات الطيفية التي لوحظت عند الرقم الهيدروجيني 4 تتوافق مع تكوين الركام الغروانية الذهبية مع التشكل المفتوح بشكل معقول والتواصل مع مونومرات Aβ 1-40 المحيطة المكشوفة الممتصة على سطح الذهب30. لاحظنا أن مونومرات Aβ 1-40 تنعكس مرة أخرى إلى التشكل المطوي في ظل الظروف الأساسية (الأس الهيدروجيني 10) ، مما يؤدي إلى تشوه الركام بطريقة شبه قابلة للعكس. كانت هذه العملية شبه القابلة للانعكاس واضحة من تناوب متوسط ذروة النطاق ( (n)) ، والتي تحولت بين الطول الموجي الأقصر والأطول ، والتشكل المشتت مقابل الإجمالي في صور TEM بين الظروف الأساسية (الأس الهيدروجيني = 10) والحمضية (الرقم الهيدروجيني = 4). لقد لوحظ سابقا أن جزءا من مونومر Aβ 1-40 لا يزال مكشوفا حتى بعد عودة المحلول إلى الشروط الأساسية36. يوضح الفيديو 1 تغير اللون المعتمد على الأس الهيدروجيني ل Aβ 1-40 و 20 نانومتر غروانية ذهبية مكشوفة.
(n)) ، والتي تحولت بين الطول الموجي الأقصر والأطول ، والتشكل المشتت مقابل الإجمالي في صور TEM بين الظروف الأساسية (الأس الهيدروجيني = 10) والحمضية (الرقم الهيدروجيني = 4). لقد لوحظ سابقا أن جزءا من مونومر Aβ 1-40 لا يزال مكشوفا حتى بعد عودة المحلول إلى الشروط الأساسية36. يوضح الفيديو 1 تغير اللون المعتمد على الأس الهيدروجيني ل Aβ 1-40 و 20 نانومتر غروانية ذهبية مكشوفة.
على سبيل المقارنة ، تم إجراء تحقيق قفزة الأس الهيدروجيني للغروانية الذهبية العاري 20 نانومتر (الشكل 5C و D). مع استمرار عملية تغيير الأس الهيدروجيني ، أظهرت نمو تجميع الغرويات الذهبية في نطاق SPR ، وصور TEM بالإضافة إلى صور الضوء الأبيض. ومن المثير للاهتمام ، أنه كان هناك العديد من الخطوط الطيفية SERS اعتمادا على nفردي و nزوجي. على سبيل المثال ، عند nزوجي (الرقم الهيدروجيني ~ 4) ، لوحظ الخط عند 275 سم -1 ، والذي تم تعيينه كوضع مرتبط ب Aun (ن = 5 ، 6 ، 12 ، 16 ، 20 ، 58) 37 أو وضع Au-Cl- ligand38 تمت ملاحظته بشكل مكثف. من ناحية أخرى ، بالنسبة ل nحتى ، عند 1008 سم -1 لوحظ C-N str39 و CH2 wag39 ، CH2 تشوه40 لوحظ على نطاق واسع عند 1291 سم -1.
على عكس مورفولوجيا التجميع الواضحة المعتمدة على الأس الهيدروجيني والقابل للانعكاس التي لوحظها تصوير الضوء الأبيض ، كانت هناك اختلافات طفيفة نسبيا في السمات الطيفية في طيف SERS بين nفردي و nزوجي. كتقدير تقريبي أول ، كانت كثافة الخط الطيفي في المنطقة بين 250 سم -1 و 1750 سم -1 أعلى ل nفردي من nزوجي. أظهرت الخطوط الطيفية في منطقة بصمات الأصابع ، 1250 سم -1 و 1750 سم -1 (نطاقات أميد الأول والثاني والثالث) ل nفردية سمات طيفية أقل حلا ، مما يعني إما اتساعا أو زيادة في الكثافة الطيفية. في الشكل 6 ، تم تنظيم خريطة كفاف واردة في الشكل 5 ب (الشكل 6 ب) مع إشارات SERS عند 761 سم -1 (أحمر) و 1395 سم -1 (أزرق) ، تمثل التأكيدات عند nفردي و nزوجي ، على التوالي (الشكل 6 ج). كطيف تمثيلي ل SERS ل nفردي و nزوجي ، يظهر طيف SERS عند n = 7 (أحمر) و n = 4 (أزرق) في الأعلى (الشكل 6 أ). من أجل إظهار المراسلات مع إزاحة نطاق SPR للذهب المطلي ب 20 نانومتر Aβ1-40 ، يظهر مخطط إزاحة النطاق في الشكل 3 على الجانب (الشكل 6 د).
بينما لدينا بيانات أولية حول التعيين الكامل للطيف SERS المرصود ، نلاحظ العديد من ميزات تحول رامان البارزة هنا. الخطوط الطيفية و (التخصيصات المعقولة) المحسنة في nفردي هي بشكل أساسي في المنطقة الأقل من 1000 سم -1: 394 سم -1 (Trp) 41،42،43 ، 761 سم -1 (His ، Ala) 39،44،45،46،47 ، 875 سم -1 (إزاحة NH الإندول ، تمدد CC ل Met) 39 ، 974 سم -1 (Glu ، C-COO- تمتد ASP ، الوضع المرتبط بالسترات) 39،48،49. أظهر تحول رامان المعزز عند nحتى سمات طيفية مهمة في منطقة بصمات الأصابع (أميد الأول والثاني والثالث): 1166 سم -1 (N-H + تشوه Tyr) 39،41 ، 1227 سم -1 (Ala-Pro-Gly ، Amide III) 39،50،51 ، 1395 cm-1 (COO- تمدد متماثل أو CH2- CH3- مقص Glu) 39،48، 1585 سم -1 (تمدد الحلقة CC ل Phe ، تمدد غير متماثل للكربوكسيل -Au ، COO- تمدد السترات ، تشوه حلقة البنزين) 39،41،45،46،47،49،52 ، 1592 سم -1 (Phe ، Tyr ، C = C تمدد Tyr ، تمدد CC للحلقة في Phe ، تمدد حلقة البنزين و COO- التمدد في Phe و Tyr ، والتمدد غير المتماثل ل OH) 39 و 41 و 48 و 50 و 51 و 1628 سم -1 (ذروة Amide I الفرعية المميزة للهياكل β الورقية بينالجزيئات 53 ، C = O والأنماط الاهتزازية المقترنة CN / NH للعمود الفقري للبروتين التي تنشأ من هياكل متوازية من نوع β صفائح ، تراكم Aβ54 المجمعة ، الملفات العشوائية ، β المنعطفات ، دبابيس الشعر β48. تظهر التسلسلات التي تظهر ل nفردي أو nزوجي في الشكل 7. بشكل عام ، بالنسبة ل nحتى المقابلة للتجميع القابل للانعكاس أو التشكل غير المطوي ل Aβ 1-40 ، فإن Phe / Tyr التي تحتوي على حلقة البنزين ، والتمدد المتماثل ل COO- ، CH2- CH3- وضع مقص Glu ، و -NH + تشوه Tyr كانت متورطة بشكل كبير في التغيير التوافقي للببتيد. أثناء تفكيك التجميع الذي لوحظ عندما اعتمدت الببتيدات التشكل المطوي المقابل للأوضاع البارزة في nodd ، بدا أن Glu و Asp و Met و His و Ala متورطون.

الشكل 1: الامتصاص والتشكل المعتمدين على الأس الهيدروجيني. يتم عرض طيف الامتصاص عند درجة الحموضة 4 (A) ودرجة الحموضة 10 (B) لجزيئات الذهب النانوية المطلية Aβ 1-40 (20 نانومتر) ، وصور TEM المقابلة ، والرسومات التخطيطية للجسيمات المتراكمة / المشتتة ، وصور المحاليل في القوارير. A هو التشكل غير المطوي لمونومرات Aβ 1-40 في ظل الظروف الحمضية ، و B هو التشكل المطوي في ظل الظروف الأساسية. يتم عرض مخططات لمونومرات Aβ 1-40 في كل شكل وتشكل التجميع / التشتت بجوار صور TEM. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
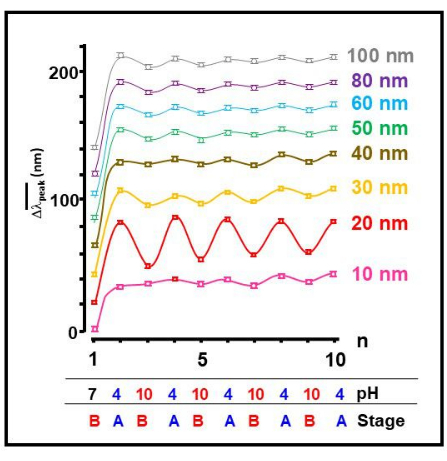
الشكل 2: انعكاس التجميع الذاتي المعتمد على حجم النانو. تحول متوسط موضع الذروة لنطاق SPR ،  كدالة لرقم العملية ، n ، لجميع الأحجام المختبرة لجزيئات الذهب الغروانية. يتم إعطاء قيم الأس الهيدروجيني التقريبية والمرحلة المقابلة من الركام الموضحة في الشكل 1 أيضا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
كدالة لرقم العملية ، n ، لجميع الأحجام المختبرة لجزيئات الذهب الغروانية. يتم إعطاء قيم الأس الهيدروجيني التقريبية والمرحلة المقابلة من الركام الموضحة في الشكل 1 أيضا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
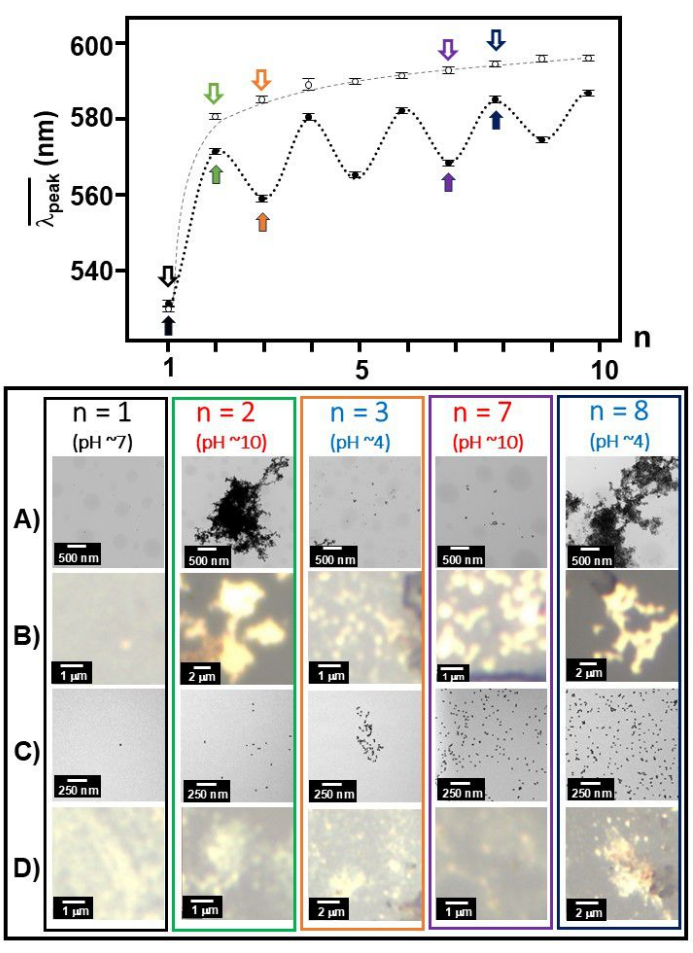
الشكل 3:  وصور TEM / الضوء الأبيض في كل رقم عملية. تم رسم ال
وصور TEM / الضوء الأبيض في كل رقم عملية. تم رسم ال  كدالة لرقم العملية ، n ، معا ل Aβ 1-40 مطلي بالذهب 20 نانومتر (دوائر مغلقة) و 20 نانومتر من الذهب الغرواني (الدوائر المفتوحة) ويتم عرضه مع صور TEM (A و C) / صور الضوء الأبيض (B و D) في أرقام عمليات محددة (n = 1 و 2 و 3 و 7 و 8 مميزة بأسهم غير مشفرة) ل Aβ 1-40 مطلي بالذهب 20 نانومتر (A و B) و 20 نانومتر من الذهب الغرواني (Cو D). يشير الخط الأسود إلى درجة الحموضة 7 ، والخط الأزرق يشير إلى درجة الحموضة 4 ، والخط الأحمر يشير إلى درجة الحموضة 10. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
كدالة لرقم العملية ، n ، معا ل Aβ 1-40 مطلي بالذهب 20 نانومتر (دوائر مغلقة) و 20 نانومتر من الذهب الغرواني (الدوائر المفتوحة) ويتم عرضه مع صور TEM (A و C) / صور الضوء الأبيض (B و D) في أرقام عمليات محددة (n = 1 و 2 و 3 و 7 و 8 مميزة بأسهم غير مشفرة) ل Aβ 1-40 مطلي بالذهب 20 نانومتر (A و B) و 20 نانومتر من الذهب الغرواني (Cو D). يشير الخط الأسود إلى درجة الحموضة 7 ، والخط الأزرق يشير إلى درجة الحموضة 4 ، والخط الأحمر يشير إلى درجة الحموضة 10. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
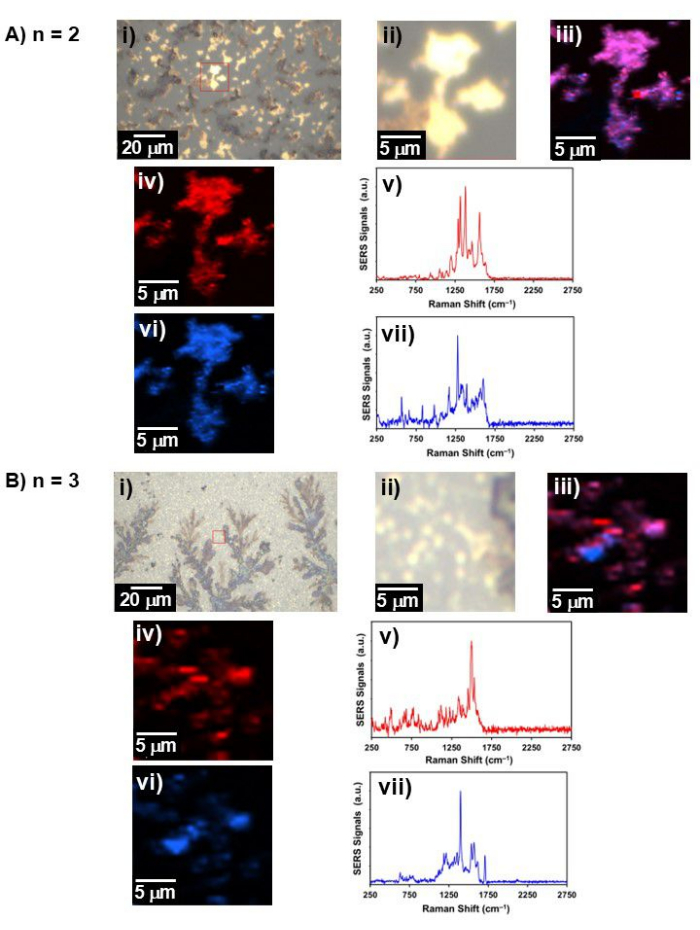
الشكل 4: الضوء الأبيض التمثيلي وصورة رامان. صورة الضوء الأبيض ، صورة رامان ، وطيف SERS ل (A) n = 2 و (B) n = 3 ؛ ط) صورة الضوء الأبيض في مجال رؤية واسع ، ب) صورة الضوء الأبيض في المنطقة التي تم فيها جمع صورة رامان (مصنفة بمربع أحمر في i)) ، ج) صورة رامان لمكونين مجتمعين ، رابعا) صورة رامان للمكون 1 وطيف SERS الرابع) ، سادسا) صورة رامان للمكون 2 ، و vii) طيف SERS من السادس). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
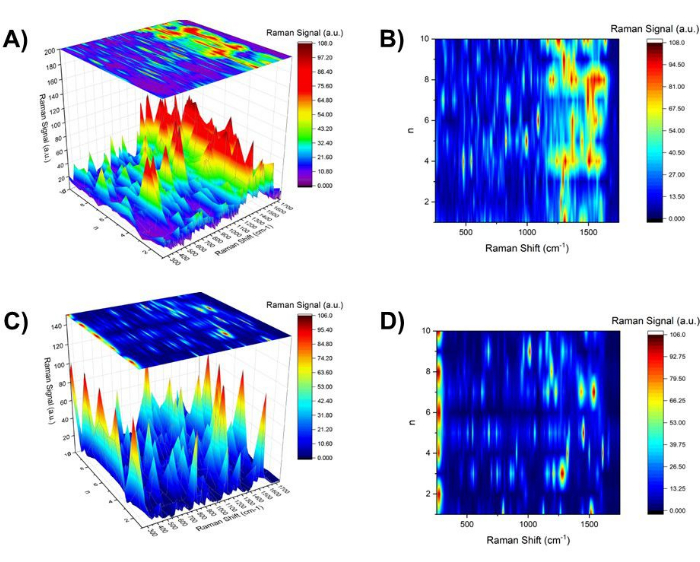
الشكل 5: خريطة كفاف طيف SERS ل nفردي و nزوجي و nall. (أ) الخريطة ثلاثية الأبعاد لطيف SERS في منطقة 250 سم -1 و 1750 سم -1 كدالة ل n ل Aβ1-40 مطلي بالذهب 20 نانومتر مع خريطة كفاف موضحة في (B) في الأعلى. (ج) الخريطة ثلاثية الأبعاد للطيف SERS في منطقة 250 cm-1 و 1750 cm-1 كدالة n للذهب 20 نانومتر مع خريطة كفاف موضحة في (D) في الأعلى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: خريطة كفافية للطيف SERS. الخريطة الكفافية للطيف SERS كدالة ل n (1-10). (أ) الامتصاص عند 1395 سم -1 (أزرق) و 761 سم -1 (أحمر). (ب-د) تظهر اللوحة السفلية طيف SERS وتظهر اللوحة اليمنى اتساع تغير شدة الإشارة لإشارات SERS عند كل n. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
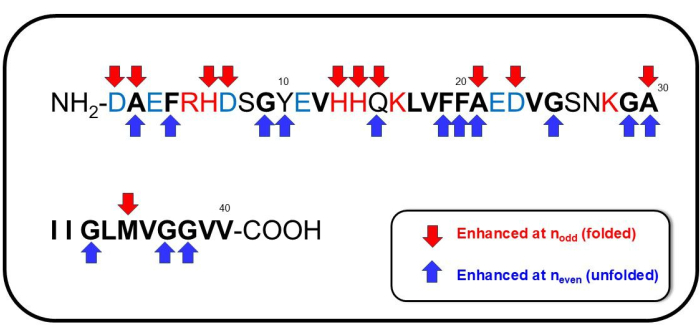
الشكل 7: التسلسلات البارزة ل Aβ1-40. يشار إلى التسلسلات المعينة لمشاركتها الكبيرة في nفردي (المقابلة لتكوين التشكل المطوي) بواسطة أسهم حمراء هابطة ، ويشار إلى تلك المخصصة لمشاركتها الكبيرة عند nزوجي (المقابلة لتكوين التشكل غير المطوي) بواسطة الأسهم الزرقاء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو 1: تغيير اللون المعتمد على الأس الهيدروجيني ل Aβ1-40 و 20 نانومتر الغروانية الذهبية العارية. الرجاء النقر هنا لتنزيل هذا الفيديو.
Discussion
أحد الاعتبارات الحاسمة في دراسات تشكل الببتيد هو صيانة العينة ، حيث ستتدهور العينات إذا تم تخزينها بشكل غير صحيح. تم استلام عينات الببتيد في شكل مجفف بالتجميد وبدأت في تشويه طبيعتها بمجرد إعادة ترطيبها بالماء المقطر منزوع الأيونات ، حتى عندما تم تخزينها عند -80 درجة مئوية. تم التحقق من نقاء الغرويات الذهبية عن طريق تحليل مراقبة الجودة. من أجل الحفاظ على استقرار الغرويات ، تم تخزينها عند 4 درجات مئوية وعدم تجميدها. تم تحضير المحاليل الغروانية الذهبية طازجة لكل تجربة لأن محلول الأملاح العازلة من شأنه أن يزعزع استقرار الغروانية الذهبية. تم تحضير محاليل حمض الهيدروكلوريك وهيدروكسيد الصوديوم طازجة لكل تجربة.
تحد التحديات التقنية المتمثلة في قراءة وتسجيل الأس الهيدروجيني للمحلول يدويا باستخدام أدوات دقيقة مع تغيير الرقم الهيدروجيني بين 4 و 10 من دقة نتائجنا المبلغ عنها. وبالتالي ، لم نلاحظ نتائج متسقة في شدة إشارات SERS. من المحتمل أن يكون هذا قد أدخل خطأ في السعة التي تم استخدامها في مخطط الكنتور. يمكن أن يؤدي العمل المستقبلي للتحقق من الأوضاع المرتبطة ب nزوجي أوn فردي إلى إدخال طفرات لاستبدال الأحماض الأمينية في تسلسل Aβ 1-40 الذي أبلغ عن مشاركته في التغيير التوافقي للبروتين ، مثل بقايا التيروزين أو الأسباراجين المفردة.
"يعتبر التفاعل بين مونومر Aβ1-40 وسطح الذهب تفاعلا ثنائي القطب ، وقد تم افتراض مستوى الترابط الهيدروجيني في عمل H. Schmidbauer et al.55. في عمل منفصل ، قمنا بالتحقيق في التحليل الطيفي SERS كدالة لكمية Aβ1-40 في ظل الحالة الحمضية ، واستخرج تكوين الامتزاز المعتمد على حجمالنانو 56. بالنسبة للذهب 20 نانومتر ، تم التكهن برابطة C = C أو -C-N للهيستيدين (His) لبدء الامتزاز ؛ ومع ذلك ، بالنسبة للذهب 80 نانومتر ، وصل وضع التنفس الدائري للبنزين من فينيل ألانين (Phe) أو التيروزين (Tyr) إلى سطح الذهب لبدء الامتزاز. اعتبرت عملية امتصاص Aβ1-40 على سطح الذهب في ظروف محايدة أو أساسية (درجة الحموضة ~ 10) للحفاظ على غرويات الذهب المطلي Aβ1-40 لتكون محبة للماء حيث لم تتشكل رواسب في الحالة المائية. ومع ذلك ، لوحظت الرواسب عند درجة الحموضة 4 ، مما يعني أن الركام كان كارها للماء.
تظهر صور TEM وصور الضوء الأبيض بشكل غير مباشر فقط دليلا على التجميع. لقد حاولنا إجراء التحليل الطيفي الدائري لثنائي اللون (CD) لربط التشكل الذي لوحظ في التجميع القابل للانعكاس مع الهياكل الثانوية. ومع ذلك ، فإن خطوط القاعدة المتناثرة منعتنا من الحصول على إشارات CD قابلة للتكرار. بدلا من ذلك ، استخدمنا التحليل الطيفي رامان ، مع التركيز بشكل أكبر على الأوضاع المحسنة إما عندما يحدث التجميع (التشكل غير المطوي ل Aβ1-40) تحت درجة الحموضة ~ 4 أو عند التفكيك (التشكل غير المطوي ل Aβ1-40) تحت الرقم الهيدروجيني ~ 10. وبالتالي ، فإن أفضل تكهنات لتحديد الهيكل الثانوي في هذا العمل اقتصرت على مراقبة العقد المرتبطة بالهياكل الثانوية. وقد تجلى ذلك في ملاحظة الورقة β عند 1628 سم -1 ، لا سيما في حالة الأس الهيدروجيني 4.
لاحظت هذه الدراسة فقط التغيير في شكل الببتيد للغرويات الذهبية التي يبلغ قطرها 20 نانومتر وحققت فقط حتى 10. يمكن تغيير خصائص التشكل والتجميع للببتيد Aβ 1-40 حسب حجم الجسيم الذي يمتصونه إلى56. لذلك ، هناك حاجة إلى مزيد من العمل لفهم خصائص الببتيدات التي تعتمد على الشبكات بين المونومرات وتلك التي تتأثر بالخصائص الفيزيائية لسطح الامتزاز. في ظل الظروف التي اختبرناها ، أظهرت الغرويات الذهبية التي يبلغ قطرها 20 نانومتر فقط قابلية انعكاس مورفولوجيا التجميع ، ولا تعرف آليات كيفية تأثير قطر الغروانية على انعكاس هذه الخاصية. يمكن أن توفر زيادة n حتى 20 مزيدا من الأفكار حول الدرجة المعتمدة على الوضع لقابلية انعكاس مورفولوجيا التجميع. ستؤدي هذه التحقيقات حول كيفية تأثير حجم الغروانية الذهبية على تراكم ببتيد بيتا النشواني إلى رؤى مهمة حول الآليات الجزيئية لأمراض مرض الزهايمر.
Disclosures
يعلن المؤلفون أنه ليس لديهم تضارب في المصالح مع هذا العمل للإفصاح عنه.
Acknowledgements
KY مدعوم من قبل NSF-MRI Grant # 2117780. دعمت مؤسسة جينيسيو المرحلة الأولى من هذا المشروع. A. I. ممتن لمنحة البحث الصيفية لخريجي قسم الكيمياء بجامعة ولاية نيويورك جينيسيو (جائزة رودس 19 وجائزة ليبكوفيتز 20) ومنحة مؤسسة دريفوس للأبحاث الصيفية الجامعية لدعمهم.
Materials
| Name | Company | Catalog Number | Comments |
| Amyloid beta peptide 1-40 (Aβ1–40 peptide) | r-Peptide (Bogart, GA, USA) | A-1156-2 | |
| CCD digital camera | AMT | XR-40 4-megapixel CCD | |
| Distilled deionized water from Milli-Q- water system | Millipore Sigma (Burlington, MA, USA) | Milli-Q IQ 7000 | |
| Freezer -86 oC | Thermo Scientific | Revco Chilly Willy RLE Series Unit ID 187004 Build Number 40.04 | |
| Gold Colloid (10 nm) | Ted Pella, Inc. (Redding, California, USA) | 15703-20 | |
| Gold Colloid (100 nm) | Ted Pella, Inc. (Redding, California, USA) | 15711-22 | |
| Gold Colloid (15 nm) | Ted Pella, Inc. (Redding, California, USA) | 15704-20 | |
| Gold Colloid (20 nm) | Ted Pella, Inc. (Redding, California, USA) | 15705-20 | |
| Gold Colloid (30 nm) | Ted Pella, Inc. (Redding, California, USA) | 15706-21 | |
| Gold Colloid (40 nm) | Ted Pella, Inc. (Redding, California, USA) | 15707-21 | |
| Gold Colloid (50 nm) | Ted Pella, Inc. (Redding, California, USA) | 15708-21 | |
| Gold Colloid (60 nm) | Ted Pella, Inc. (Redding, California, USA) | 15709-22 | |
| Gold Colloid (80 nm) | Ted Pella, Inc. (Redding, California, USA) | 15710-22 | |
| Highest Grade V1AFM Mica Discs 10 mm | Ted Pella Inc. | #50 | |
| Hydrochloric Acid Standard Solution, 1.0 N | Fluka | Lot# SHBB4705V 318949-2L | |
| Macro quartz quvette Light Path 10 mm | Fire Fly Science | Type1-MC-Path10mm | |
| Micro pH electrode | HORIBA | Model 9618S (MFG No. 9Y8E0050) | |
| Peak Fit Program | Origin (Northampton, MA, USA) | OriginPro2018b (64-bit) b9.5.5.409 (Academic) | |
| pH 4.00 Buffer solution | VWR | Cat No. 34170-127 | |
| pH 7.00 Buffer Solution | Fisher Chemical | SB107-4 Lot 191041 | |
| pH meter | HORIBA | Model F-72G (MFG No. B27M0017) | |
| Pipet Tips Maxi Tips 1–5 mL | Fisher | 02-707-467 | |
| Pipet Tips 10 mL | Fisher | 02-717-135 | |
| Pipet Tips 1000 mL | Fisher | 02-717-156 | |
| Pipet Tips 1–200 mL | Fisher | 02-717-143 | |
| Pipetter Fisher Brand Elite 0.5–5 mL | Fisher | QU05317 | |
| Pipetter Fisher Brand Elite 100–1000 mL | Fisher | QU01672 | |
| Pipetter Fisher Brand Elite 10–100 mL | Fisher | MU10985 | |
| Pipetter Fisher Brand Elite 1–10 mL | Fisher | MU08178 | |
| Sodium Hydroxide Solution 1.0 M | Fluka | Lot#05096BPV 319511-2L | |
| TEM | FEI Co | Morgagni model 268 | |
| TempAssure PCR Tubes, Flat Caps, Natural | USA Scientific | polypropylene. 0.2 mL individual thin-wall tubes with attached frosted flat caps | |
| UV-Vis-NIR Spectrophotometer | Varian | CARY 5000 UV1106M074 | |
| WI Tec alpha300R Confocal Raman Microscope | WITec-Oxford Instrument | XMB3000-3001 |
References
- Kirschner, D. A., et al. Synthetic peptide homologous to beta protein from Alzheimer disease forms amyloid-like fibrils in vitro. Proc Natl Acad Sci U S A. 84 (19), 6953-6957 (1987).
- Lomakin, A., Chung, D. S., Benedek, G. B., Kirshner, D. A., Teplow, D. B. On the nucleation and growth of amyloid -protein fibrils: detection of nuclei and quantitation of rate constants. Proc Natl Acad Sci U S A. 93 (3), 1125-1129 (1996).
- Walsh, D. M., Lomakin, A., Benedek, G. B., Condron, M. M., Teplow, D. B. Amyloid -protein fibrillogenesis. J Biolog Chem. 272 (3), 22364-22372 (1997).
- Lambert, M. P., et al. nonfibrillar ligands derived from Ab1-42 are potent central nervous system neurotoxins. Proc Natl Acad Sci U S A. 95 (11), 6448-6453 (1998).
- Bucciantini, M., et al. Inherent toxicity of aggregates implies a common mechanism for protein misfolding diseases. Nature. 416 (6880), 507-511 (2002).
- Walsh, D. M., et al. Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo. Nature. 416 (6880), 535-539 (2002).
- Rocha, S., et al. Adsorption of amyloid beta-peptide at polymer surfaces: A neutron reflectivity study. ChemPhysChem. 6 (12), 2527-2534 (2005).
- Attanasio, F., et al. Carnosine inhibits Ab1-42 aggregation by perturbing the H-bond network in and around the central hydrophobic cluster. ChemBioChem. 14 (5), 583-592 (2013).
- Politi, J., Spadavecchia, J., Iodice, M., de Stefano, L. Oligopeptide-heavy metal interaction monitoring by hybrid gold nanoparticle based assay. Analyst. 140 (1), 149-155 (2015).
- Moshe, A., Landau, M., Eisenberg, D. Preparation of Crystalline samples of amyloid fibrils and oligomers. Methods Mol Biol. 1345, 201-210 (2016).
- Scarff, C. A., Ashcroft, A. E., Radford, S. E. Characterization of amyloid oligomers by electrospray ionization-ion mobility spectrometry-mass spectrometry (ESI-IMS-MS). Methods Mol Biol. 1345, 115-132 (2016).
- Sabaté, R., Gallardo, M., Estelrich, J. Temperature dependence of the nucleation constant rate in β amyloid fibrillogenesis. Int J Biol Macromol. 35 (1-2), 9-13 (2005).
- Niraula, T. N., et al. Pressure-dissociable reversible assembly of intrinsically denatured lysozyme is a precursor for amyloid fibrils. Proc Natl Acad Sci U S A. 101 (12), 4089-4093 (2004).
- Miller, A. E., et al. Behavior of β-Amyloid 1-16 at the air-water interface at varying pH by nonlinear spectroscopy and molecular dynamics simulations. J Phys Chem A. 115 (23), 5873-5880 (2011).
- Majzika, A., et al. Functionalization of gold nanoparticles with amino acid, -amyloid peptides and fragment. Colloids Surf B Biointerfaces. 81 (1), 235-241 (2010).
- Liu, L., et al. Electrochemical detectionof β-amyloid peptides on electrode covered with N-terminus-specific antibody based on electrocatalytic O2 reduction by Aβ(1-16)-heme-modified gold nanoparticles. Biosens Bioelectron. 49, 231-235 (2013).
- Elbassal, E. A., et al. Gold Nanoparticles as a Probe for Amyloid-β Oligomer and Amyloid Formation. J Phys Chem C Nanomater Interfaces. 121 (36), 20007-20015 (2017).
- Olmedo, I., et al. How changes in the sequence of the peptide CLPFFD-NH2 can modify the conjugation and stability of gold nanoparticles and their affinity for beta-amyloid fibrils. Bioconjug Chem. 19 (16), 1154-1163 (2008).
- Xu, Y., et al. Attenuation of the aggregation and neurotoxicity of amyloid peptides with neurotransmitter-functionalized ultra-small-sized gold nanoparticles. Eng Sci. 6, 53-63 (2019).
- John, T., Gladytz, A. K., Martin Clemens, L. L., Risselada, H. J., Abel, B. Impact of nanoparticles on amyloid peptide and protein aggregation: A review with a focus on gold nanoparticles. Nanoscale. 45, 20894-20913 (2018).
- Li, J., et al. Reduced aggregation and cytotoxicity of amyloid peptides by graphene oxide/gold nanocomposites prepared by pulsed laser ablation in water. Small. 10 (21), 4386-4394 (2014).
- Araya, E., et al. Gold nanoparticles and microwave irradiation Inhibit beta-amyloid amyloidogenesis. Nanoscale Res Lett. 3, 435 (2008).
- Barrow, C. J., Yasuda, A., Kenny, P. T., Zagorski, M. G. Solution conformations and aggregational properties of synthetic amyloid beta-peptides of Alzheimer's disease. Analysis of circular dichroism spectra. J Mol Biol. 225 (4), 1075-1093 (1992).
- Wood, S. J., MacKenzie, L., Maleeff, B., Hurle, M. R., Wetzel, R. Selective inhibition of Ab fibril formation. J Biolog Chem. 271 (8), 4086-4092 (1996).
- Yokoyama, K. Nanoscale Surface Size Dependence in Protein Conjugation. Advances in Nanotechnology. , (2010).
- Yokoyama, K. Nanoscale Protein Conjugation. Advances in Nanotechnology. , (2010).
- Yokoyama, K. . Modeling of Reversible Protein Conjugation on Nanoscale Surface in Computational Nanotechnology: Modeling and Applications with MATLAB. , (2011).
- Yokoyama, K. Nano Size Dependent Properties of Colloidal Surfaces. Colloids: Classification, Properties and Applications. , (2012).
- Yokoyama, K. Controlling Reversible Self-Assembly Path of Amyloid Beta Peptide over Gold Colloidal Nanoparticle's Surface. Nanoscale Spectroscopy with Applications. , (2013).
- Yokoyama, K., et al. Nanoscale size dependence in the conjugation of amyloid beta and ovalbumin proteins on the surface of gold colloidal particles. Nanotechnology. 19, 375101 (2008).
- Yokoyama, K., Welchons, D. R. The conjugation of amyloid beta protein on the gold colloidal nanoparticles' surfaces. Nanotechnology. 18, 105101 (2007).
- Edelhoch, H. Spectroscopic determination of tryptophan and tyrosine in proteins. Biochemistry. 6 (7), 1948-1954 (1967).
- Yokoyama, K., et al. Examination of adsorption orientation of amyloidogenic peptides over nano-gold colloidal particles surfaces. Int J Mol Sci. 20 (21), 5354-5380 (2019).
- Yokoyama, K., Ichiki, A. Oligomerization and Adsorption Orientation of Amyloidogenic Peptides over Nano-Gold Colloidal Particle Surfaces. Advances in Chemistry Research. , (2020).
- Fan, X., Zheng, W., Singh, D. J. Light scattering and surface plasmons on small spherical particles. Light Sci Appl. 3, e179 (2014).
- Yokoyama, K., et al. Microscopic investigation of reversible nanoscale surface size dependent protein conjugation. Int J Mol Sci. 10 (5), 2348-2366 (2009).
- Vishwanathan, K. Symmetry of gold neutral clusters Au3-20 and normal modes of vibrations by using the numerical finite difference method with density-functional tight-binding (DFTB) approach. Arch Chem Res. 2 (1), 4 (2017).
- Gao, P., Weaver, M. J. Metal-adsorbate vibrational frequencies as a probe of surface bonding: halides and pseudohalides at gold electrodes. J Phys Chem. 90, 4057-4063 (1986).
- Stewart, S., Fredericks, P. M. Surface-enhanced raman spectroscopy of peptides and proteins adsorbed on an electrochemically prepared silver surface. Spectrochim Acta AMol Biomol Spectrosc. 55 (7-8), 1615-1640 (1999).
- Palings, I., et al. Assignment of fingerprint vibrations in the resonance Raman spectra of rhodopsin, isorhodopsin, and bathorhodopsin: Implications for chromophore structure and environment. Biochem. 26 (9), 2544-2556 (1987).
- Szekeres, G. P., Kneipp, J. SERS probing of proteins in gold nanoparticle agglomerates. Front Chem. 7, 30 (2019).
- Lin, V. J. C., Koenig, J. L. Raman studies of bovine serum albumin. Biopolymers. 15 (1), 203-218 (1976).
- Hornemann, A., Drescher, D., Flemig, S., Kneipp, J. Intracellular SERS hybrid probes using BSA-reporter conjugates. Anal Bioanal Chem. 405 (19), 6209-6222 (2013).
- Dong, J., et al. Metal binding and oxidation of amyloid-beta within isolated senile plaque cores: Raman microscopic evidence. Biochemistry. 42 (10), 2768-2773 (2003).
- Carey, P. R. . Biochemical Applications of Raman and Resonance Raman Spectroscopies. , (1982).
- Harada, I., Takeuchi, H. Raman and Ultraviolet Resonance Raman Spectra of Proteins and Related Compounds. Spectroscopy of Biological Systems : Advances in Infrared and Raman Spectroscopy. , (1986).
- Overman, S. A., Thomas, G. J. Raman markers of nonaromatic side chains in an α-helix assembly: Ala, Asp, GGly, Ile, Leu, Lys, Ser, and Val residues of phage fd subunits. Biochemistry. 38 (13), 4018-4027 (1999).
- Talaga, D., et al. Total internal reflection tip-enhanced Raman spectroscopy of tau fibrils. J Phys Chem B. 126 (27), 5024-5032 (2022).
- Grys, D. -. B., et al. Citrate coordination and bridging of gold nanoparticles: The role of gold adatoms in AuNP aging. ACS Nano. 14 (7), 8689-8696 (2020).
- Guo, T., et al. Full-scale label-free surface-enhanced Raman scattering analysis of mouse brain using a black phosphorus-based two-dimensional nanoprobe. Appl Sci. 9 (3), 398-408 (2019).
- Walther, M., Plochocka, P., Fischer, B., Helm, H., Uhd Jepsen, P. Collective vibrational modes in biological molecules investigated by Terahertz time-domain spectroscopy. Biopolymers. 67 (4-5), 310-313 (2002).
- Lochocki, B., et al. label-free fluorescence and Raman imaging of amyloid deposits in snap-frozen Alzheimer's disease human brain tissue. Commun Biol. 4 (1), 474-486 (2021).
- Palombo, F., et al. Detection of Aβ plaque-associated astrogliosis in Alzheimer's disease brain by spectroscopic imaging and immunohistochemistry. Analyst. 143 (4), 850-857 (2018).
- Khoury, Y. E., et al. Raman imaging reveals accumulation of hemoproteins in plaques from Alzheimer's diseased tissues. ACS Chem Neurosci. 12 (15), 2940-2945 (2021).
- Schmidbaur, H., Raubenheimer, H. G., Dobrzańska, L. The gold-hydrogen bond, Au-H, and the hydrogen bond to gold Au∙∙∙H-X. Chem Soc Rev. 43 (1), 345-380 (2014).
- Yokoyama, K., et al. Protein corona formation and aggregation process of amyloid beta 1-40 coated gold nano-colloids. Langmuir. 40 (3), 1728-1746 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved