Method Article
Amyloid Beta 1-40-Coated Gold Colloids의 pH 의존성 가역적 자가 조립의 특성화
요약
여기에서는 아밀로이드 베타 1-40(Aβ 1-40)으로 코팅된 20nm 금 응집체의 준가역적 자체 조립을 설명하는 체계적인 방법을 제시합니다. 펩타이드 간의 나노 크기 의존적 준가역적 네트워킹은 특정 아미노산 또는 Aβ 1-40 단량체의 절편과 상관관계가 있었습니다.
초록
나노 골드 콜로이드 입자 표면에 코팅된Aβ 1-40의 특성화는 표면 플라즈몬 공명(SPR) 분광법 및 투과 전자 현미경(TEM)을 사용하여 수행되었습니다. Aβ 1-40으로 코팅된 20nm 금 입자의 SPR 대역에서 관찰된 pH 의존적 이동은 TEM 이미지에서 관찰된 응집 및 분해의 교대와 상관관계가 있었습니다. ~4의 pH는 풀린 형태를 유도하고 ~10의 pH는 금 표면에서 Aβ 1-40의 접힌 형태를 유도했습니다. 이 가역적 응집 과정은 pH가 pH 4에서 pH 10으로 점차 변화함에 따라 Raman 이미징에 의해 관찰되었습니다. 금 표면에서Aβ 1-40의 pH 의존적 형태 변화를 관찰했으며, pH 4에서 투명한 응집체가 관찰되었습니다. 그러나 pH 4와 pH 10 조건 사이의 표면 강화 라만 분광법(SERS) 스펙트럼에서 매우 미묘한 차이가 관찰되었으며, 가장 두드러진 차이는 250cm-1 및 1750cm-1 영역의 스펙트럼 밀도였습니다. 구체적으로, 가역적 응집체의 모드 분석은 응집체가 티로신과 페닐알라닌의 벤젠 고리 절편을 포함하는 Aβ 1-40의 풀린 형태에 의해 형성되었음을 나타냈습니다. 반대로, 응집체의 분해는 히스티딘, 글루타민, 메티오닌 및 아스파르트산을 포함하는Aβ 1-40의 단백질 접힘의 구조적 변화와 관련이 있었습니다.
서문
아밀로이드 베타 1-40 (Aβ 1-40) 또는 1-42 (Aβ 1-42) 펩타이드의 섬유형성은 알츠하이머병의 원인인 아밀로이드 플라크 형성에 중요한 성분으로 광범위하게 조사되어 왔습니다 1,2,3,4,5,6,7,8,9,10,11. 섬유형성의 핵심 메커니즘은 Aβ 1-40 또는Aβ 1-42 펩타이드의 올리고머화하여 신경독성 단백질 응집체를 형성하는 것이며, 단량체가 올리고머 12,13,14를 형성하는 방법의 메커니즘을 이해하기 위해 광범위한 조사가 수행되었습니다. 우리는 나노 금 표면에 응집체를 형성하는 아밀로이드 생성 펩티드를 조사하고 금 표면에서 멀리 떨어진 펩타이드 사이의 네트워킹을 담당하는 요인을 식별하는 접근 방식을 수행했습니다 15,16,17,18,19,20,21,22.
Aβ 1-40은 산성 조건(pH ~4) 하에서 펼쳐진 형태(A)와 염기성 조건(pH ~10) 하에서 접힌 형태(B)를 채택합니다. pH ~10에서 분산된 Aβ 1-40 코팅된 금 콜로이드 입자와 pH~4에서 큰 Aβ 1-40 코팅된 금 콜로이드 응집체를 관찰했습니다(그림 1)23,24. 산성 조건에서 Aβ 1-40의 풀린 형태는 금-나노 입자 표면에서 Aβ 1-40 단량체 사이의 펩타이드 네트워킹을 선호하여 금 콜로이드 응집체를 형성합니다(그림 1의 A 참조). Aβ 1-40 단량체가 염기성 또는 중성 pH Aβ 1-40에서 접힌 형태를 유지할 때 단량체는 응집체로 네트워크화되지 않고 코팅된 금 나노 입자는 개별적으로 분산된 입자로 남아 있습니다(그림 1의 B 참조). 따라서 Aβ 1-40 펩타이드가 네트워크에 대한 구조적 변화를 겪고 응집체를 형성하는 과정을 조사하려면 다양한 pH 조건 25,26,27,28,29,30,31에서 SPR 대역 이동을 측정해야 합니다.
우리는 여러 가지 크기의 금 나노 입자를 테스트한 결과 20nm 금 콜로이드가 pH의 외부 변화에 대한 반응으로 Aβ 1-40 단량체의 가장 두드러진 가역적 자기 조립 과정을 나타낸다는 것을 발견했습니다(그림 2). 이는 펩타이드 형태의 가역적 변화를 명확하게 나타내는 지표이며, 산성 조건(A)은 풀린 형태를 유도하여 네트워킹을 강화하고 금 콜로이드의 응집으로 이어집니다. 기본 조건 (B)은 단량체 26,27,28,29,30,31의 접힌 형태를 유도하는 것으로 밝혀졌다.
프로토콜
1. aβ 1-40 코팅 금 나노 입자의 제조
- 주사기 바늘을 사용하여 동결건조된Aβ 1-40(MW: 4.2kDa, 98% HPLC 순도) 1mg에 증류수 1mL 부피를 추가합니다. 용액을 와류 혼합기와 약 30초 동안 혼합하고 실온(RT, ~20°C)에서 용액에서 고체 입자가 관찰되지 않도록 합니다.
- 탈이온수 및 증류수(~18MΩ·cm)를 사용하여 모든 원액을 준비합니다.
- 분자 흡광 ε계수가275 cm-1390 cm-1· 남-1.
- Aβ 1-40의 재고 용액을 -80 °C에서 보관하십시오. (Aβ 1-40의 상용 제품에 대한 재료 표 참조)
- 데이터 수집 약 5분 전에 펩타이드 원액을 해동합니다. 15mL 원심분리 튜브에서 8μL 부피의 펩타이드 용액과 800μL의 금 콜로이드 입자를 혼합합니다. 4.2mL의 탈이온수 부피를 첨가한 다음 샘플을 10초 동안 와류로 가열합니다30,31,33,34.
- Aβ 1-40 펩타이드의 농도를 1.8 nmol로 고정하고 Aβ 1-40 펩타이드의 비율 범위를 지정합니다. 금 콜로이드의 수는 ~500:1에서 ~2000:1 사이였습니다25.
2. 반복적인 pH 변화 및 해당 SPR 대역 이동 모니터링
- UV-Vis-NIR(Ultraviolet-Visible-Near Infrared) 분광 광도계의 온도 제어 장치를 사용하여 용액 온도를 결정된 값(예: 25°C)으로 설정합니다.
- s의 초기 pH를 모니터링amppH 측정기를 사용하여 용액을 선택하고 pH 7보다 약간 낮게 설정합니다. 400nm에서 1000nm 사이의 범위에서 흡수 스펙트럼을 수집합니다.
- 10μL 부피의 0.1M HCl을 첨가하여 샘플의 pH를 ~pH 4(즉, pH 4.0 ± 0.3)로 변경하고 400nm와 1000nm 사이의 흡수 스펙트럼을 수집합니다.
- 10μL 부피의 0.1M NaOH를 첨가하여 샘플의 pH를 ~pH 10(즉, pH 10 ± 0.3)으로 변경하고 400nm와 1000nm 사이의 흡수 스펙트럼을 수집합니다.
- HCl과 NaOH를 10회 사용하여 pH 4와 pH 10 사이의 pH를 변경하고 25 ± 0.2 °C29,30에서 지속적으로 흡수 스펙트럼을 수집합니다.
참고: 모든 샘플 용액에서 SPR 대역 피크의 광학 밀도는 약 0.2로 유지되었습니다. 용액의 잔류 완충 용액으로 인한 완충 효과가 예상됩니다. 따라서, 최종 pH 값은 평형이 확인된 후에 결정되었다. pH 값은 ±0.005 pH의 정확도를 가진 마이크로 pH 전극을 사용하여 샘플 큐벳 셀에서 직접 측정되었습니다. - 흡광도의 함수로 파장의 ASCII(American Standard Code for Information Interchange) 데이터 세트를 얻습니다. Peak Fit 프로그램을 사용하여 대역 피크의 평균 위치를 추출합니다.
- Plot 함수를 사용하여 광학 밀도를 파장(nm)의 함수로 보도록 데이터 세트를 플로팅합니다.
- 플로팅된 데이터에서 초기 피크 파장 λ1, λ2, λ3 의 대략적인 위치를 선택하여 표시하고 RUN 함수를 사용하여 데이터를 피팅합니다.
- 각 밴드의 면적(A,i)과 함께 각 피크(λ i)의 중심 피크(λi)를 포함하는 그래프를 구합니다.
- 추출된 피크 위치와 영역을 스프레드시트 프로그램으로 내보내고 주어진 pH에서 평균 피크 위치를 계산합니다.
- 각 피크 중심(λi)의 가중 계수 ai를 밴드의 면적(Ai)을 전체 밴드의 총 면적과 다음과 같이
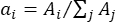 비교함으로써 결정한다.
비교함으로써 결정한다. - Eqn. (1)을 사용하여 평균 피크 위치(
 pH)를 추출합니다.
pH)를 추출합니다.
 (1)
(1)
- 각 피크 중심(λi)의 가중 계수 ai를 밴드의 면적(Ai)을 전체 밴드의 총 면적과 다음과 같이
- 다음 프로세스를 사용하여 가역성 플롯을 생성합니다.
- 평균 피크 위치를
 각 "작동" 번호의 함수로 n과 n으로
각 "작동" 번호의 함수로 n과 n으로  표로 만듭니다. ~pH 7에서 산을 추가하기 전에 샘플에 대해 작업 번호 n을 1로 만듭니다. 매번 작업 횟수를 1씩 늘리고 pH를 HCl로 ~pH4로 변경하거나 pH를 NaOH로 ~pH 10으로 변경합니다. n을 산성 조건(즉, ~pH 4)에서 짝수로, 홀수를 염기성 조건(즉, pH 10)으로 만듭니다.
표로 만듭니다. ~pH 7에서 산을 추가하기 전에 샘플에 대해 작업 번호 n을 1로 만듭니다. 매번 작업 횟수를 1씩 늘리고 pH를 HCl로 ~pH4로 변경하거나 pH를 NaOH로 ~pH 10으로 변경합니다. n을 산성 조건(즉, ~pH 4)에서 짝수로, 홀수를 염기성 조건(즉, pH 10)으로 만듭니다. - 공식30을 사용하여 각 n,
 (n) = λ(n)에서 피크 위치를 분석합니다.
(n) = λ(n)에서 피크 위치를 분석합니다.
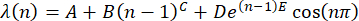 (2)
(2)
참고: n = 1에서 초기 평균 피크 위치를 A로 나타냅니다. 파라미터 B와 C를 n 종속 피크 위치 이동으로 표현합니다. 매개변수 D를 반복의 감쇠 계수 E의 진폭으로 만듭니다. sine 함수를 사용하여 피크 위치의 요동을 n의 함수로 표시합니다. - (x, y)의 데이터 세트를 Origin 소프트웨어로 전송하고 플롯합니다.
- Nonlinear Curve Fitting Function Of Analysis에서 Eqn. (2)에 주어진 사용자 정의 함수를 형성합니다. 초기 A, B, C, D 및 E 값을 입력하고 RUN을 클릭하여 맞춤을 완료합니다.
- 평균 피크 위치를
- TEM 이미징
- Formvar 코팅된 구리 그리드를 사용하여 Aβ 1-40 코팅된 20nm 금 콜로이드의 TEM 샘플을 만듭니다. 80kV에서 작동하는 TEM으로 샘플을 검사합니다.
- 모델 XR-40 4메가픽셀 CCD 디지털 카메라(AMT)에서 28,000x 또는 71,000x의 공칭 배율로 이미지를 수집합니다. 각 작업 횟수 n = 1(~pH 7), n = 2, 4, 6, 8 및 10(pH 4) 및 n = 3, 5, 7 및 9(pH 10)에서 Aβ 1-40 코팅된 20nm 금에 대한 TEM 이미지를 수집합니다.
3. Raman 이미징 및 가역적 응집체 조사
- 작업 번호 n에서 각 샘플에 대해 운모 디스크(직경 1cm)에 100μL의 용액을 놓습니다. 측정하기 전에 밤새 샘플을 건조시키십시오.
- 각 작업 번호 n에서 백색광 이미지를 수집합니다. 각 작업 번호 n에 대해 pH가 ~pH 4와 ~pH 10 사이에서 지속적으로 변경되었으므로 운모 디스크에 별도의 샘플을 준비합니다(그림 3).
- ~200cm-1과 ~2,800cm-1 사이의 영역에 대해 100 ±× 100픽셀 스펙트럼의 통합 시간으로 스펙트럼 500ms/스펙트럼의 통합 시간으로 구성된 그리드에서 0.5 0.05mW 전력에서 0.5 0.05mW 전력에서 λ = 633nm 파장의 레이저를 사용하여 각 작업 번호 n에서 라만 이미지를 수집합니다(그림 4).
- n의 함수로 정렬된 각 n에 대한 대표 스펙트럼을 플롯하고Aβ 1-40 코팅 20nm 금에 대해 n의 함수로 3차원 SERS 스펙트럼을 구성합니다(그림 5A). 특정 pH 조건(즉, ~pH 4 및 ~pH 10)과 관련된 특정 모드를 추출하기 위해 3차원 SERS 스펙트럼의 평면도를 윤곽 맵(그림 5B)으로 활용합니다. n개의짝수 또는 n개의홀수에서만 향상된 스펙트럼 특징을 추출합니다.
결과
금 나노 콜로이드 입자 표면에 Aβ 1-40을 부착하면 용액이 더 산성 (pH 4) 35로 만들어졌을 때 530nm 흡수 최대 주위의 SPR 대역이 ~ 650nm 피크 위치로 크게 적색 편이되었습니다. TEM 이미지와 함께, pH 4에서 관찰된 분광 특징이 금 표면30 위에 흡착된 주변의 펼쳐진 Aβ 1-40 단량체와 그럴듯하게 펼쳐진 형태 및 네트워킹을 가진 금 콜로이드 응집체의 형성과 일치한다는 것을 확인했습니다. 우리는 Aβ 1-40 단량체가 염기성(pH 10) 조건에서 접힌 형태로 역전되어 준가역적 방식으로 응집체가 변형되는 것을 관찰했습니다. 이 준가역적 과정은 더 짧은 파장과 더 긴 파장 사이에서 이동하는 평균 대역 피크( ((n))의 교대와 염기(pH = 10)와 산성(pH = 4) 조건 사이의 TEM 이미지에서 분산된 형태와 응집된 형태에서 분명했습니다. Aβ 1-40 단량체의 일부는 용액이 염기성 조건36으로 되돌아간 후에도 풀린 상태로 남아 있는 것이 이전에 관찰되었습니다. 동영상 1은Aβ 1-40 및 20nm 베어 골드 콜로이드의 pH 의존적 색상 변화를 보여줍니다.
((n))의 교대와 염기(pH = 10)와 산성(pH = 4) 조건 사이의 TEM 이미지에서 분산된 형태와 응집된 형태에서 분명했습니다. Aβ 1-40 단량체의 일부는 용액이 염기성 조건36으로 되돌아간 후에도 풀린 상태로 남아 있는 것이 이전에 관찰되었습니다. 동영상 1은Aβ 1-40 및 20nm 베어 골드 콜로이드의 pH 의존적 색상 변화를 보여줍니다.
이에 비해 20nm 베어 골드 콜로이드의 pH hop 조사가 수행되었습니다(그림 5C 및 D). pH 변화 작업이 진행됨에 따라 SPR 밴드 쇼프트, TEM 이미지 및 백색광 이미지에서 금 콜로이드의 클러스터링 성장을 보여주었습니다. 매우 흥미롭게도, n홀수와 n짝수에 따라 여러 SERS 스펙트럼 라인이 있었습니다. 예를 들어, n의 짝수(pH ~4)에서 Aun(n = 5, 6, 12, 16, 20, 58)37 또는 Au-Cl-리간드(38)와 관련된 모드로 할당된 275cm-1의 선이 집중적으로 관찰되었습니다. 반면에,n개의 짝수에 대해서는, 1008 cm-1 C-N str에서 39 가 관찰되었고, 1291 cm-1 에서 CH2 wag39, CH2 변형40 이 광범위하게 관찰되었다.
백색광 이미징에서 관찰된 명확한 pH 의존성 및 가역적 응집 형태와 대조적으로, n개의홀수와 n개의 짝수 사이의 SERS 스펙트럼의 스펙트럼 특징에는 상대적으로 미묘한 차이가 있었습니다. 첫 번째 근사치로, 250cm-1과 1750cm-1 사이의 영역에서의 스펙트럼 라인 밀도는 n짝수보다 n 홀수에 대해 더 높았습니다. n홀수에 대한 지문 영역, 1250 cm-1 및 1750 cm-1 (아미드 I, II 및 III 대역)의 스펙트럼 라인은 덜 해상도 된 스펙트럼 특징을 보여 주었으며, 이는 스펙트럼 밀도의 확대 또는 증가를 의미합니다. 그림 6에서 그림 5B(그림 6B)에 제공된 등고선 맵은 761cm-1(빨간색) 및 1395cm-1(파란색)의 SERS 신호로 구성되어 각각 n개의 홀수 및 n개의 짝수(그림 6C)에서 강조를 나타냅니다. n개의홀수 및 n개의 짝수에 대한 대표적인 SERS 스펙트럼으로, n=7(빨간색) 및 n=4(파란색)의 SERS 스펙트럼이 상단에 표시되어 있습니다(그림 6A). Aβ 1-40 코팅 20nm 금에 대한 SPR 대역 이동에 대한 대응을 보여주기 위해 그림 3의 대역 이동 플롯이 측면에 표시됩니다(그림 6D).
관찰된 SERS 스펙트럼의 전체 할당에 대한 예비 데이터가 있지만, 여기서는 몇 가지 주목할 만한 라만 이동 특징에 주목합니다. n홀수에서 강화 된 스펙트럼 라인 및 (그럴듯한 할당)은 주로 1000cm-1 미만의 영역에서 발생합니다 : 394 cm-1 (Trp) 41,42,43, 761 cm-1 (His, Ala) 39,44,45,46,47, 875 cm-1 (인돌 NH 변위, Met의 C-C 스트레칭) 39, 974 cm-1 (Glu, C-COO- Asp의 스트레칭, 구연산염과 관련된 모드) 39,48,49. n에서 강화 된 라만 이동은 지문 영역 (Amide I, II 및 III)에서 중요한 분광 기능을 보여주었습니다 : 1166 cm-1 (Tyr의 N-H + 변형) 39,41, 1227 cm-1 (Ala-Pro-Gly, Amide III) 39,50,51, 1395 cm-1 (COO- 대칭 스트레칭 또는 CH2- CH3- Glu의 가위) 39 , 48, 1585 cm-1 (Phe의 고리 CC 스트레칭, 카르복실레이트 -Au의 비대칭 스트레칭, 구연산염의 COO- 스트레칭, 벤젠 링의 변형) 39,41,45,46,47,49,52, 1592 cm-1 (Phe, Tyr, C = C 스트레칭, Phe의 고리 CC 스트레칭, 벤젠 링 스트레칭 및 COO- Phe 및 Tyr에서 스트레칭, OH) 39,41,48,50,51 및 1628 cm-1 (분자간 β-시트 구조53, C=O 및 병렬 β-시트 유형 구조에서 유래한 단백질 백본의 결합된 CN/NH 진동 모드에 고유한 아미드 I 서브 피크, 응집된 Aβ 54의 축적, 무작위 코일, β-턴, β 머리핀48. n,홀수 또는 n,짝수에 대해 나타나는 시퀀스는 그림 7에 나와 있습니다. 전반적으로,Aβ 1-40의 가역적 응집 또는 풀린 형태에 해당하는 n에 대해서도 벤젠 고리를 포함하는 Phe/Tyr, COO-의 대칭 연신, Glu의 CH2-CH 3- 가위화 모드, Tyr의 -NH+ 변형이 펩타이드의 구조적 변화에 유의하게 관여했습니다. 펩타이드가 n 홀수에서 두드러진 모드에 해당하는 접힌 형태를 채택했을 때 관찰된 응집체를 분해하는 동안 Glu, Asp, Met, His 및 Ala가 관여하는 것으로 나타났습니다.

그림 1: pH 의존적 흡광도 및 형태. Aβ 1-40 코팅된 금 나노 입자(20nm)에 대한 pH 4(A) 및 pH 10(B)의 흡수 스펙트럼과 해당 TEM 이미지, 응집/분산 입자 스케치 및 바이알 내 용액 사진이 표시됩니다. A는 산성 조건에서 Aβ 1-40 단량체의 풀린 형태이고 B는 염기성 조건에서 접힌 형태입니다. 각 형태 및 응집/분산 형태에서 Aβ 1-40 단량체의 다이어그램이 TEM 이미지 옆에 표시되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
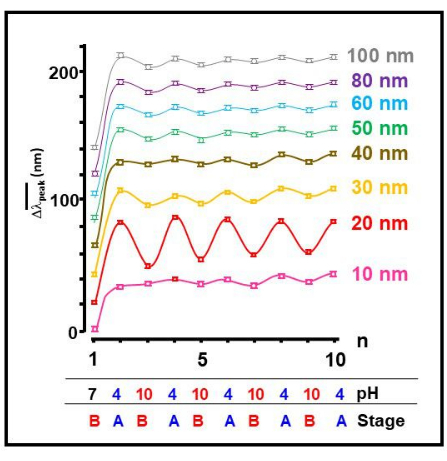
그림 2: 나노 크기에 따른 자체 조립 가역성. 테스트된 모든 크기의 금 콜로이드 입자에 대한 작동 번호 n의 함수로 SPR 대역  의 평균 피크 위치의 이동. 그림 1 에 표시된 응집체의 대략적인 pH 값과 해당 단계도 제공됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
의 평균 피크 위치의 이동. 그림 1 에 표시된 응집체의 대략적인 pH 값과 해당 단계도 제공됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
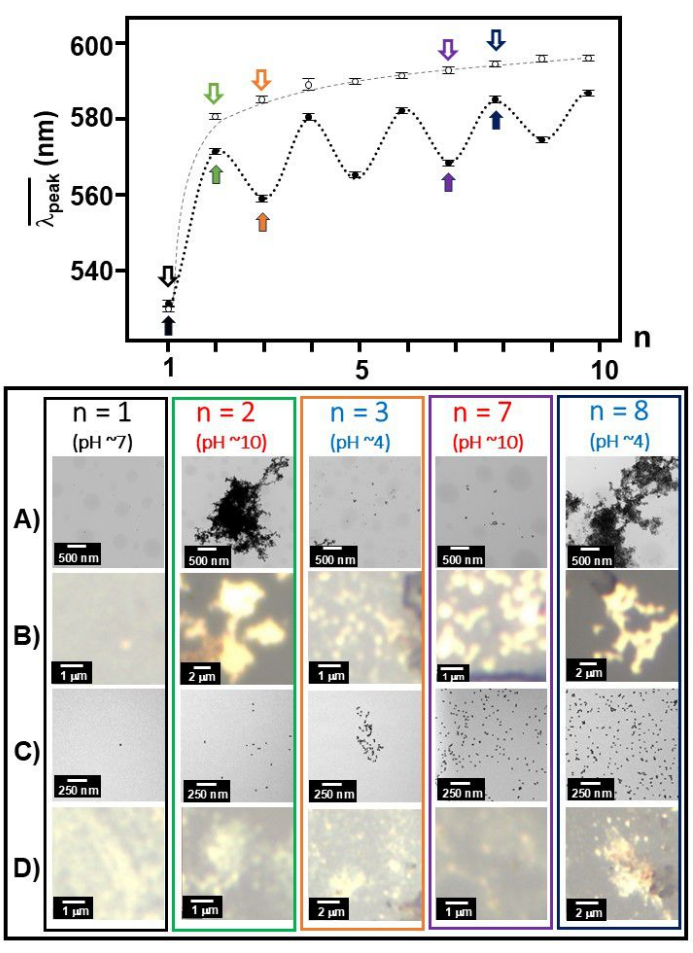
그림 3:  각 작업 번호에서의 TEM/백색광 이미지.
각 작업 번호에서의 TEM/백색광 이미지.  작업 번호 n의 함수로 Aβ 1-40 코팅 20nm 금(닫힌 원) 및 20nm 금 콜로이드(열린 원)에 대해 함께 표시되었으며 Aβ 1-40 코팅 20nm 금(A 및 B) 및 20nm 금 콜로이드(C 및 D)를 참조하십시오. 검은색 글꼴은 pH 7, 파란색 글꼴은 pH 4, 빨간색 글꼴은 pH 10을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
작업 번호 n의 함수로 Aβ 1-40 코팅 20nm 금(닫힌 원) 및 20nm 금 콜로이드(열린 원)에 대해 함께 표시되었으며 Aβ 1-40 코팅 20nm 금(A 및 B) 및 20nm 금 콜로이드(C 및 D)를 참조하십시오. 검은색 글꼴은 pH 7, 파란색 글꼴은 pH 4, 빨간색 글꼴은 pH 10을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
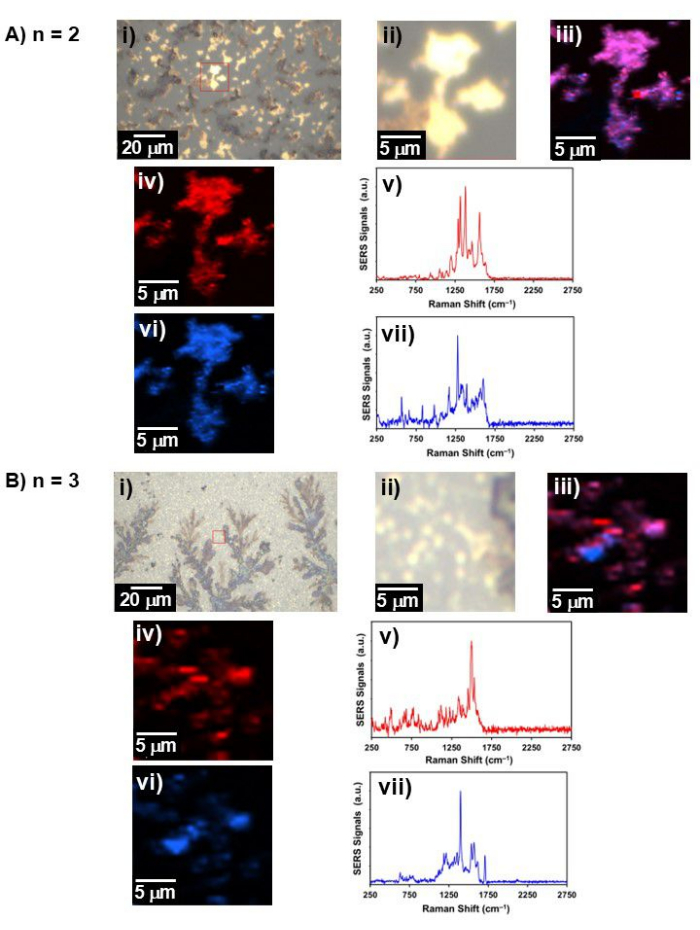
그림 4: 대표적인 백색광 및 라만 이미지. (A) n = 2 및 (B) n = 3에 대한 백색광 이미지, 라만 이미지 및 SERS 스펙트럼; i) 넓은 시야의 백색광 이미지, ii) 라만 이미지가 수집된 영역에서의 백색광 이미지(i)에서 빨간색 사각형으로 표시됨), iii) 두 성분이 결합된 라만 이미지, iv) 성분 1 및 그 v) SERS 스펙트럼 iv), vi) 성분 2의 라만 이미지, 및 vii) VI)의 SERS 스펙트럼). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
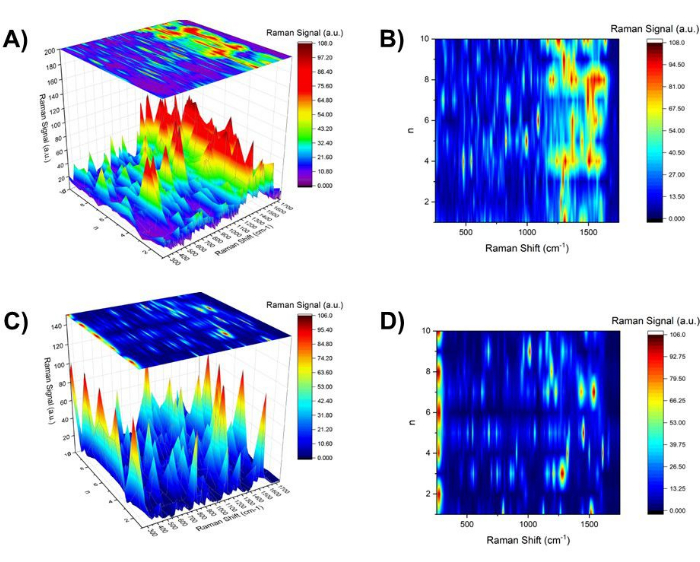
그림 5: n개의홀수, n개의짝수 및 n모두에 대한 SERS 스펙트럼의 등고선 맵.(A) 250cm-1 및 1750cm-1 영역에서Aβ 1-40 코팅된 20nm 금에 대한 n의 함수로 표시되는 SERS 스펙트럼의 3차원 맵과 상단의 (B)에 표시된 등고선 맵. (C) 250cm-1 및 1750cm-1 영역에서 SERS 스펙트럼의 3차원 지도는 20nm 금에 대한 n의 함수로 상단에 (D)에 표시된 등고선 맵과 함께 제공됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: SERS 스펙트럼의 등고선 맵. n(1-10)의 함수로 나타낸 SERS 스펙트럼의 등고선 맵. (A) 1395cm-1(파란색) 및 761cm-1(빨간색)에서의 흡광도. (B-D) 하단 패널은 SERS 스펙트럼을 보여주고 오른쪽 패널은 각 n에서 SERS 신호의 신호 강도 변화 진폭을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
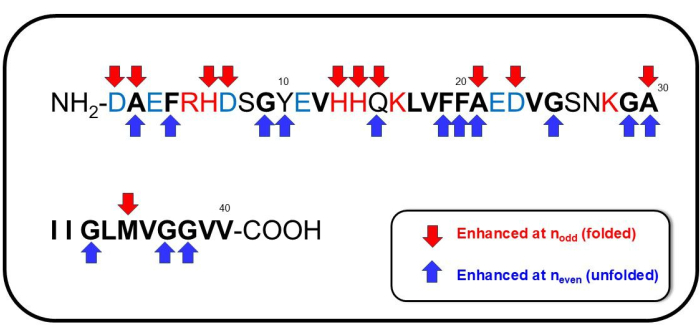
그림 7: Aβ1-40의 주목할 만한 서열. n홀수 (접힌 형태의 형성에 해당)에서 상당한 관여를 갖도록 할당된 서열은 아래쪽 빨간색 화살표로 표시되고, n짝수 (펼쳐진 형태의 형성에 해당)에서 상당한 관여를 갖도록 할당된 시퀀스는 파란색 화살표로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
동영상 1: Aβ1-40 및 20nm 베어 골드 콜로이드의 pH 의존적 색상 변화. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
펩타이드 형태 연구에서 중요한 고려 사항은 검체를 부적절하게 보관하면 변질될 수 있으므로 검체 유지 관리입니다. 펩타이드 샘플은 동결 건조된 형태로 접수되었으며 -80°C에서 보관된 경우에도 증류된 탈이온수로 재수화되면 변성되기 시작했습니다. 금 콜로이드의 순도는 품질 관리 분석에 의해 검증되었습니다. 콜로이드의 안정성을 유지하기 위해 얼지 않고 4°C에서 보관했습니다. 금 콜로이드 용액은 염 완충 용액이 금 콜로이드를 불안정하게 만들기 때문에 각 실험에 대해 신선하게 준비되었습니다. HCl 및 NaOH 용액은 각 실험에 대해 신선하게 준비되었습니다.
pH를 4에서 10 사이로 변경하면서 섬세한 기기로 용액의 pH를 수동으로 판독하고 기록해야 하는 기술적 문제로 인해 보고된 결과의 정밀도가 제한됩니다. 따라서, SERS 신호의 강도에서 일관된 결과를 관찰하지 못했다. 이로 인해 등고선 플롯에 사용된 진폭에 오류가 발생했을 가능성이 있습니다. n짝수 또는 n홀수와 관련된 모드를 확인하기 위한 향후 연구는 단일 티로신 또는 아스파라긴 잔기와 같은 단백질의 구조적 변화에 관여하는 것으로 보고된Aβ 1-40 서열의 아미노산을 대체하기 위한 돌연변이를 도입할 수 있습니다.
"Aβ1-40 단량체와 금 표면 사이의 상호 작용은 쌍극자 상호 작용으로 간주되며, 수소 결합 수준은 H. Schmidbauer et al.55의 연구에서 가설을 세웠습니다. 별도의 연구에서는 산성 조건에서Aβ 1-40 의 양에 따라 SERS 분광법을 조사하여 나노 크기 의존성 흡착 형성(56)을 추출했다. 20nm 금의 경우, 히스티딘 (His)의 C = C 또는 -C-N 결합이 흡착을 시작하는 것으로 추측되었다. 그러나 80nm 금의 경우 페닐알라닌(Phe) 또는 티로신(Tyr)의 벤젠 고리 호흡 모드가 흡착을 시작하기 위해 금 표면에 도달했습니다. 중성 또는 염기성 조건(pH ~10)에서 금 표면에 Aβ1-40 을 흡착하는 과정은 수성 상태에서 침전물이 형성되지 않았기 때문에Aβ 1-40 코팅된 금 콜로이드를 친수성으로 유지하기 위해 고려되었습니다. 그러나, 침전물은 pH 4에서 관찰되었으며, 이는 응집체가 소수성임을 암시합니다.
TEM 이미지와 백색광 이미지는 응집의 증거를 간접적으로만 보여줍니다. 우리는 가역적 응집체에서 관찰된 형태를 2차 구조와 연관시키기 위해 원이색성(CD) 분광법을 수행하려고 시도했습니다. 그러나 산란 기준선으로 인해 재현 가능한 CD 신호를 얻을 수 없었습니다. 따라서 대신 라만 분광법을 사용하여 pH ~4에서 응집(Aβ1-40의 풀림 형태)이 발생하거나 pH ~10에서 분리(Aβ1-40의 풀림 형태)가 발생할 때 향상된 모드에 더 중점을 두었습니다. 따라서 이 작업에서 2차 구조를 식별하기 위한 최선의 추측은 2차 구조와 관련된 노드를 모니터링하는 것으로 제한되었습니다. 이것은 1628cm-1, 특히 pH 4 조건에서 β 시트를 관찰 한 결과에서 입증되었습니다.
이 연구는 20nm 직경의 금 콜로이드에 대한 펩타이드 형태의 변화만 관찰하고 n에서 최대 10개까지만 조사했습니다. Aβ 1-40 펩타이드의 형태 및 응집 특성은56으로 흡착하는 입자의 크기에 따라 변경될 수 있습니다. 그러므로, 단위체 사이 네트워킹에 기초를 두는 펩티드의 재산을 이해하기 위하여 더 많은 일이 필요합니다 및 흡착 표면의 육체적인 특성에 의해 영향을 받는 그들. 우리가 테스트한 조건에서는 20nm 직경의 금 콜로이드만이 응집 형태의 가역성을 나타냈으며, 콜로이드 직경이 이 특성의 가역성에 어떤 영향을 미치는지에 대한 메커니즘은 알려져 있지 않습니다. n을 최대 20까지 늘리면 응집 형태학의 가역성의 모드 의존적 정도에 대한 더 많은 통찰력을 제공할 수 있습니다. 금 콜로이드의 크기가 아밀로이드 베타 펩타이드 응집에 어떤 영향을 미치는지에 대한 이러한 연구는 알츠하이머병 병리학의 분자 메커니즘에 대한 중요한 통찰력을 제공할 것입니다.
공개
저자는 이 작품과 관련하여 공개할 이해 상충이 없음을 선언합니다.
감사의 말
K.Y.는 NSF-MRI Grant #2117780의 지원을 받습니다. Geneseo 재단은 이 프로젝트의 초기 단계를 지원했습니다. A. I.는 SUNY Geneseo 화학과 동문 여름 연구 장학금('19 Rhodes Award 및 '20 Lipkowitz Award)과 Dreyfus Foundation 학부 여름 연구 장학금의 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Amyloid beta peptide 1-40 (Aβ1–40 peptide) | r-Peptide (Bogart, GA, USA) | A-1156-2 | |
| CCD digital camera | AMT | XR-40 4-megapixel CCD | |
| Distilled deionized water from Milli-Q- water system | Millipore Sigma (Burlington, MA, USA) | Milli-Q IQ 7000 | |
| Freezer -86 oC | Thermo Scientific | Revco Chilly Willy RLE Series Unit ID 187004 Build Number 40.04 | |
| Gold Colloid (10 nm) | Ted Pella, Inc. (Redding, California, USA) | 15703-20 | |
| Gold Colloid (100 nm) | Ted Pella, Inc. (Redding, California, USA) | 15711-22 | |
| Gold Colloid (15 nm) | Ted Pella, Inc. (Redding, California, USA) | 15704-20 | |
| Gold Colloid (20 nm) | Ted Pella, Inc. (Redding, California, USA) | 15705-20 | |
| Gold Colloid (30 nm) | Ted Pella, Inc. (Redding, California, USA) | 15706-21 | |
| Gold Colloid (40 nm) | Ted Pella, Inc. (Redding, California, USA) | 15707-21 | |
| Gold Colloid (50 nm) | Ted Pella, Inc. (Redding, California, USA) | 15708-21 | |
| Gold Colloid (60 nm) | Ted Pella, Inc. (Redding, California, USA) | 15709-22 | |
| Gold Colloid (80 nm) | Ted Pella, Inc. (Redding, California, USA) | 15710-22 | |
| Highest Grade V1AFM Mica Discs 10 mm | Ted Pella Inc. | #50 | |
| Hydrochloric Acid Standard Solution, 1.0 N | Fluka | Lot# SHBB4705V 318949-2L | |
| Macro quartz quvette Light Path 10 mm | Fire Fly Science | Type1-MC-Path10mm | |
| Micro pH electrode | HORIBA | Model 9618S (MFG No. 9Y8E0050) | |
| Peak Fit Program | Origin (Northampton, MA, USA) | OriginPro2018b (64-bit) b9.5.5.409 (Academic) | |
| pH 4.00 Buffer solution | VWR | Cat No. 34170-127 | |
| pH 7.00 Buffer Solution | Fisher Chemical | SB107-4 Lot 191041 | |
| pH meter | HORIBA | Model F-72G (MFG No. B27M0017) | |
| Pipet Tips Maxi Tips 1–5 mL | Fisher | 02-707-467 | |
| Pipet Tips 10 mL | Fisher | 02-717-135 | |
| Pipet Tips 1000 mL | Fisher | 02-717-156 | |
| Pipet Tips 1–200 mL | Fisher | 02-717-143 | |
| Pipetter Fisher Brand Elite 0.5–5 mL | Fisher | QU05317 | |
| Pipetter Fisher Brand Elite 100–1000 mL | Fisher | QU01672 | |
| Pipetter Fisher Brand Elite 10–100 mL | Fisher | MU10985 | |
| Pipetter Fisher Brand Elite 1–10 mL | Fisher | MU08178 | |
| Sodium Hydroxide Solution 1.0 M | Fluka | Lot#05096BPV 319511-2L | |
| TEM | FEI Co | Morgagni model 268 | |
| TempAssure PCR Tubes, Flat Caps, Natural | USA Scientific | polypropylene. 0.2 mL individual thin-wall tubes with attached frosted flat caps | |
| UV-Vis-NIR Spectrophotometer | Varian | CARY 5000 UV1106M074 | |
| WI Tec alpha300R Confocal Raman Microscope | WITec-Oxford Instrument | XMB3000-3001 |
참고문헌
- Kirschner, D. A., et al. Synthetic peptide homologous to beta protein from Alzheimer disease forms amyloid-like fibrils in vitro. Proc Natl Acad Sci U S A. 84 (19), 6953-6957 (1987).
- Lomakin, A., Chung, D. S., Benedek, G. B., Kirshner, D. A., Teplow, D. B. On the nucleation and growth of amyloid -protein fibrils: detection of nuclei and quantitation of rate constants. Proc Natl Acad Sci U S A. 93 (3), 1125-1129 (1996).
- Walsh, D. M., Lomakin, A., Benedek, G. B., Condron, M. M., Teplow, D. B. Amyloid -protein fibrillogenesis. J Biolog Chem. 272 (3), 22364-22372 (1997).
- Lambert, M. P., et al. nonfibrillar ligands derived from Ab1-42 are potent central nervous system neurotoxins. Proc Natl Acad Sci U S A. 95 (11), 6448-6453 (1998).
- Bucciantini, M., et al. Inherent toxicity of aggregates implies a common mechanism for protein misfolding diseases. Nature. 416 (6880), 507-511 (2002).
- Walsh, D. M., et al. Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo. Nature. 416 (6880), 535-539 (2002).
- Rocha, S., et al. Adsorption of amyloid beta-peptide at polymer surfaces: A neutron reflectivity study. ChemPhysChem. 6 (12), 2527-2534 (2005).
- Attanasio, F., et al. Carnosine inhibits Ab1-42 aggregation by perturbing the H-bond network in and around the central hydrophobic cluster. ChemBioChem. 14 (5), 583-592 (2013).
- Politi, J., Spadavecchia, J., Iodice, M., de Stefano, L. Oligopeptide-heavy metal interaction monitoring by hybrid gold nanoparticle based assay. Analyst. 140 (1), 149-155 (2015).
- Moshe, A., Landau, M., Eisenberg, D. Preparation of Crystalline samples of amyloid fibrils and oligomers. Methods Mol Biol. 1345, 201-210 (2016).
- Scarff, C. A., Ashcroft, A. E., Radford, S. E. Characterization of amyloid oligomers by electrospray ionization-ion mobility spectrometry-mass spectrometry (ESI-IMS-MS). Methods Mol Biol. 1345, 115-132 (2016).
- Sabaté, R., Gallardo, M., Estelrich, J. Temperature dependence of the nucleation constant rate in β amyloid fibrillogenesis. Int J Biol Macromol. 35 (1-2), 9-13 (2005).
- Niraula, T. N., et al. Pressure-dissociable reversible assembly of intrinsically denatured lysozyme is a precursor for amyloid fibrils. Proc Natl Acad Sci U S A. 101 (12), 4089-4093 (2004).
- Miller, A. E., et al. Behavior of β-Amyloid 1-16 at the air-water interface at varying pH by nonlinear spectroscopy and molecular dynamics simulations. J Phys Chem A. 115 (23), 5873-5880 (2011).
- Majzika, A., et al. Functionalization of gold nanoparticles with amino acid, -amyloid peptides and fragment. Colloids Surf B Biointerfaces. 81 (1), 235-241 (2010).
- Liu, L., et al. Electrochemical detectionof β-amyloid peptides on electrode covered with N-terminus-specific antibody based on electrocatalytic O2 reduction by Aβ(1-16)-heme-modified gold nanoparticles. Biosens Bioelectron. 49, 231-235 (2013).
- Elbassal, E. A., et al. Gold Nanoparticles as a Probe for Amyloid-β Oligomer and Amyloid Formation. J Phys Chem C Nanomater Interfaces. 121 (36), 20007-20015 (2017).
- Olmedo, I., et al. How changes in the sequence of the peptide CLPFFD-NH2 can modify the conjugation and stability of gold nanoparticles and their affinity for beta-amyloid fibrils. Bioconjug Chem. 19 (16), 1154-1163 (2008).
- Xu, Y., et al. Attenuation of the aggregation and neurotoxicity of amyloid peptides with neurotransmitter-functionalized ultra-small-sized gold nanoparticles. Eng Sci. 6, 53-63 (2019).
- John, T., Gladytz, A. K., Martin Clemens, L. L., Risselada, H. J., Abel, B. Impact of nanoparticles on amyloid peptide and protein aggregation: A review with a focus on gold nanoparticles. Nanoscale. 45, 20894-20913 (2018).
- Li, J., et al. Reduced aggregation and cytotoxicity of amyloid peptides by graphene oxide/gold nanocomposites prepared by pulsed laser ablation in water. Small. 10 (21), 4386-4394 (2014).
- Araya, E., et al. Gold nanoparticles and microwave irradiation Inhibit beta-amyloid amyloidogenesis. Nanoscale Res Lett. 3, 435(2008).
- Barrow, C. J., Yasuda, A., Kenny, P. T., Zagorski, M. G. Solution conformations and aggregational properties of synthetic amyloid beta-peptides of Alzheimer's disease. Analysis of circular dichroism spectra. J Mol Biol. 225 (4), 1075-1093 (1992).
- Wood, S. J., MacKenzie, L., Maleeff, B., Hurle, M. R., Wetzel, R. Selective inhibition of Ab fibril formation. J Biolog Chem. 271 (8), 4086-4092 (1996).
- Yokoyama, K. Nanoscale Surface Size Dependence in Protein Conjugation. Advances in Nanotechnology. , Nova Science Publishers. New York, NY. (2010).
- Yokoyama, K. Nanoscale Protein Conjugation. Advances in Nanotechnology. , Nova Science Publishers. New York, NY. (2010).
- Yokoyama, K. Modeling of Reversible Protein Conjugation on Nanoscale Surface in Computational Nanotechnology: Modeling and Applications with MATLAB. , CRC Press. Boca Raton. (2011).
- Yokoyama, K. Nano Size Dependent Properties of Colloidal Surfaces. Colloids: Classification, Properties and Applications. , Nova Science Publishers. New York, NY. (2012).
- Yokoyama, K. Controlling Reversible Self-Assembly Path of Amyloid Beta Peptide over Gold Colloidal Nanoparticle's Surface. Nanoscale Spectroscopy with Applications. , CRC Press, Taylor and Francis Group, LLC. (2013).
- Yokoyama, K., et al. Nanoscale size dependence in the conjugation of amyloid beta and ovalbumin proteins on the surface of gold colloidal particles. Nanotechnology. 19, 375101(2008).
- Yokoyama, K., Welchons, D. R. The conjugation of amyloid beta protein on the gold colloidal nanoparticles' surfaces. Nanotechnology. 18, 105101(2007).
- Edelhoch, H. Spectroscopic determination of tryptophan and tyrosine in proteins. Biochemistry. 6 (7), 1948-1954 (1967).
- Yokoyama, K., et al. Examination of adsorption orientation of amyloidogenic peptides over nano-gold colloidal particles surfaces. Int J Mol Sci. 20 (21), 5354-5380 (2019).
- Yokoyama, K., Ichiki, A. Oligomerization and Adsorption Orientation of Amyloidogenic Peptides over Nano-Gold Colloidal Particle Surfaces. Advances in Chemistry Research. , NOVA Science Publishers. New York, NY. (2020).
- Fan, X., Zheng, W., Singh, D. J. Light scattering and surface plasmons on small spherical particles. Light Sci Appl. 3, e179(2014).
- Yokoyama, K., et al. Microscopic investigation of reversible nanoscale surface size dependent protein conjugation. Int J Mol Sci. 10 (5), 2348-2366 (2009).
- Vishwanathan, K. Symmetry of gold neutral clusters Au3-20 and normal modes of vibrations by using the numerical finite difference method with density-functional tight-binding (DFTB) approach. Arch Chem Res. 2 (1), 4(2017).
- Gao, P., Weaver, M. J. Metal-adsorbate vibrational frequencies as a probe of surface bonding: halides and pseudohalides at gold electrodes. J Phys Chem. 90, 4057-4063 (1986).
- Stewart, S., Fredericks, P. M. Surface-enhanced raman spectroscopy of peptides and proteins adsorbed on an electrochemically prepared silver surface. Spectrochim Acta AMol Biomol Spectrosc. 55 (7-8), 1615-1640 (1999).
- Palings, I., et al. Assignment of fingerprint vibrations in the resonance Raman spectra of rhodopsin, isorhodopsin, and bathorhodopsin: Implications for chromophore structure and environment. Biochem. 26 (9), 2544-2556 (1987).
- Szekeres, G. P., Kneipp, J. SERS probing of proteins in gold nanoparticle agglomerates. Front Chem. 7, 30(2019).
- Lin, V. J. C., Koenig, J. L. Raman studies of bovine serum albumin. Biopolymers. 15 (1), 203-218 (1976).
- Hornemann, A., Drescher, D., Flemig, S., Kneipp, J. Intracellular SERS hybrid probes using BSA-reporter conjugates. Anal Bioanal Chem. 405 (19), 6209-6222 (2013).
- Dong, J., et al. Metal binding and oxidation of amyloid-beta within isolated senile plaque cores: Raman microscopic evidence. Biochemistry. 42 (10), 2768-2773 (2003).
- Carey, P. R. Biochemical Applications of Raman and Resonance Raman Spectroscopies. , Academic Press. New York, NY. (1982).
- Harada, I., Takeuchi, H. Raman and Ultraviolet Resonance Raman Spectra of Proteins and Related Compounds. Spectroscopy of Biological Systems : Advances in Infrared and Raman Spectroscopy. , Wiley. Chichester, UK. (1986).
- Overman, S. A., Thomas, G. J. Jr Raman markers of nonaromatic side chains in an α-helix assembly: Ala, Asp, GGly, Ile, Leu, Lys, Ser, and Val residues of phage fd subunits. Biochemistry. 38 (13), 4018-4027 (1999).
- Talaga, D., et al. Total internal reflection tip-enhanced Raman spectroscopy of tau fibrils. J Phys Chem B. 126 (27), 5024-5032 (2022).
- Grys, D. -B., et al. Citrate coordination and bridging of gold nanoparticles: The role of gold adatoms in AuNP aging. ACS Nano. 14 (7), 8689-8696 (2020).
- Guo, T., et al. Full-scale label-free surface-enhanced Raman scattering analysis of mouse brain using a black phosphorus-based two-dimensional nanoprobe. Appl Sci. 9 (3), 398-408 (2019).
- Walther, M., Plochocka, P., Fischer, B., Helm, H., Uhd Jepsen, P. Collective vibrational modes in biological molecules investigated by Terahertz time-domain spectroscopy. Biopolymers. 67 (4-5), 310-313 (2002).
- Lochocki, B., et al. label-free fluorescence and Raman imaging of amyloid deposits in snap-frozen Alzheimer's disease human brain tissue. Commun Biol. 4 (1), 474-486 (2021).
- Palombo, F., et al. Detection of Aβ plaque-associated astrogliosis in Alzheimer's disease brain by spectroscopic imaging and immunohistochemistry. Analyst. 143 (4), 850-857 (2018).
- Khoury, Y. E., et al. Raman imaging reveals accumulation of hemoproteins in plaques from Alzheimer's diseased tissues. ACS Chem Neurosci. 12 (15), 2940-2945 (2021).
- Schmidbaur, H., Raubenheimer, H. G., Dobrzańska, L. The gold-hydrogen bond, Au-H, and the hydrogen bond to gold Au∙∙∙H-X. Chem Soc Rev. 43 (1), 345-380 (2014).
- Yokoyama, K., et al. Protein corona formation and aggregation process of amyloid beta 1-40 coated gold nano-colloids. Langmuir. 40 (3), 1728-1746 (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유