Method Article
Caracterização da automontagem reversível dependente de pH de colóides de ouro revestidos com beta-amiloide 1-40
Neste Artigo
Resumo
Aqui, apresentamos um método sistemático que descreve a automontagem quase reversível dos agregados de ouro de 20 nm revestidos com beta amilóide 1-40 (Aβ 1-40). A rede quase reversível dependente do tamanho nanométrico entre os peptídeos foi correlacionada com aminoácidos específicos ou seções do monômero Aβ 1-40.
Resumo
A caracterização de Aβ 1-40 revestida sobre as superfícies de partículas coloidais de nano-ouro foi conduzida usando espectroscopia de ressonância plasmônica de superfície (SPR) e microscopia eletrônica de transmissão (MET). O deslocamento dependente do pH observado da banda SPR de partículas de ouro de 20 nm revestidas com Aβ 1-40 foi correlacionado com a alternância de agregação e desagregação observada nas imagens MET. Um pH de ~ 4 induziu uma conformação desdobrada, e um pH de ~ 10 induziu uma conformação dobrada de Aβ 1-40 na superfície do ouro. Este processo de agregação reversível foi observado por imagem Raman à medida que o pH foi gradualmente alterado de pH 4 para pH 10. Observamos uma mudança morfológica dependente do pH em Aβ 1-40 na superfície do ouro, onde agregados claros foram observados em pH 4. No entanto, observamos diferenças muito sutis no espectro de espectroscopia Raman aprimorada por superfície (SERS) entre as condições de pH 4 e pH 10, com a diferença mais marcante sendo a densidade espectral na região de 250 cm-1 e 1750 cm-1. Especificamente, a análise do modo da agregação reversível indicou que os agregados foram formados pela conformação desdobrada de Aβ 1-40 que envolveu a seção do anel benzênico de tirosina e fenilalanina. Por outro lado, a desmontagem dos agregados foi associada a mudanças conformacionais no dobramento de proteínas de Aβ 1-40 envolvendo histidina, glutamina, metionina e ácido aspártico.
Introdução
A fibrilogênese dos peptídeos beta-amiloides 1-40 (Aβ 1-40) ou 1-42 (Aβ 1-42) tem sido extensivamente investigada como um componente crítico na formação de placas amiloides que são uma causa da doença de Alzheimer 1,2,3,4,5,6,7,8,9,10 ,11. O mecanismo-chave na fibrilogênese é uma oligomerização dos peptídeos Aβ 1-40 ou Aβ 1-42 para formar um agregado proteico neurotóxico, e uma extensa investigação foi conduzida para entender os mecanismos de como os monômeros formam os oligômeros 12,13,14. Empreendemos uma abordagem de examinar peptídeos amiloidogênicos formando agregados sobre uma superfície de nano-ouro e identificando fatores responsáveis pela rede entre peptídeos que estão longe da superfície do ouro 15,16,17,18,19,20,21,22.
Aβ 1-40 adota uma conformação desdobrada (A) sob condições ácidas (pH ~ 4) e uma conformação dobrada (B) sob condições básicas (pH ~ 10). Observamos partículas coloidais de ouro revestidas com Aβ 1-40 dispersas em pH ~ 10 e grandes agregados colóides de ouro revestidos com Aβ 1-40 em pH ~ 4 (Figura 1) 23 , 24 . A conformação desdobrada de Aβ 1-40, em condições ácidas, favorece a rede peptídica entre os monômeros Aβ 1-40 sobre a superfície de nanopartículas de ouro, resultando na formação de agregados coloidais de ouro (ver A na Figura 1). Quando o monômero Aβ 1-40 mantém a conformação dobrada em um pH básico ou neutro, Aβ 1-40, os monômeros não se conectam em agregados e as nanopartículas de ouro revestidas permanecem como partículas dispersas individuais (ver B na Figura 1). Podemos, portanto, interrogar o processo de como os peptídeos Aβ 1-40 sofrem mudanças conformacionais na rede e formam agregados, medindo o deslocamento da banda SPR em uma faixa de condições de pH 25,26,27,28,29,30,31.
Testamos vários tamanhos diferentes de nanopartículas de ouro e descobrimos que o colóide de ouro de 20 nm exibiu o processo de automontagem reversível mais proeminente de monômeros Aβ 1-40 em resposta a uma mudança externa no pH (Figura 2). Esta é uma indicação clara de uma mudança reversível na conformação do peptídeo, onde as condições ácidas (A) induzem uma conformação desdobrada, aumentando a rede e levando à agregação de colóides de ouro. A condição básica (B) foi encontrada para induzir uma conformação dobrada de monômeros 26,27,28,29,30,31.
Protocolo
1. Preparação de nanopartículas de ouro revestidas com Aβ 1-40
- Adicione um volume de 1 mL de água destilada deionizada a 1 mg de Aβ 1-40 liofilizado (MW: 4,2 kDa, 98% de pureza de HPLC) usando uma agulha de seringa. Misture a solução com um misturador de vórtice por aproximadamente 30 s e certifique-se de que nenhuma partícula sólida seja observada na solução à temperatura ambiente (RT; ~ 20 ° C).
- Prepare todas as soluções de estoque usando água desionizada e destilada (~ 18 MΩ · cm).
- Identifique espectroscopicamente a concentração usando a absorção de tirosina a 275 nm32, que tem um coeficiente de extinção molecular ε275 de 1390 cm-1 · M-1.
- Armazenar soluções de estoque de Aβ 1-40 a -80 °C. (Ver Tabela de Materiais para os produtos comerciais Aβ 1-40.)
- Descongele a solução estoque de peptídeos aproximadamente 5 minutos antes da coleta de dados. Misture um volume de 8 μL da solução peptídica com 800 μL de partículas coloidais de ouro em um tubo de centrífuga de 15 mL. Adicione um volume de 4,2 mL de água destilada deionizada e, em seguida, vortex a amostra por 10 s 30,31,33,34.
- Fixe a concentração de peptídeos Aβ 1-40 em 1,8 nmol e varie a proporção de peptídeos Aβ 1-40. O número de colóides de ouro variou entre ~500:1 a ~2000:125.
2. Mudança de pH iterativa e monitoramento do deslocamento de banda SPR correspondente
- Defina a temperatura da solução em um determinado valor (por exemplo, 25 ° C) usando a unidade de controle de temperatura do espectrofotômetro ultravioleta-visível-infravermelho próximo (UV-Vis-NIR).
- Monitore o pH inicial da solução de amostra usando um medidor de pH e ajuste-o ligeiramente abaixo do pH 7. Coletar o espectro de absorção na faixa entre 400 nm e 1000 nm.
- Altere o pH da amostra para ~pH 4 (ou seja, pH 4,0 ± 0,3) adicionando volumes de 10 μL de HCl 0,1 M e colete o espectro de absorção entre 400 nm e 1000 nm.
- Altere o pH da amostra para ~pH 10 (ou seja, pH 10 ± 0,3) adicionando volumes de 10 μL de NaOH 0,1 M e colete o espectro de absorção entre 400 nm e 1000 nm.
- Alterar o pH entre pH 4 e pH 10 com HCl e NaOH 10 vezes e recolher continuamente o espectro de absorção a 25 ± 0,2 °C29,30.
NOTA: Para todas as soluções de amostra, a densidade óptica do pico da banda SPR foi mantida em torno de 0,2. Espera-se um efeito tampão devido à solução tampão residual em uma solução. Assim, o valor final do pH foi determinado após a confirmação do equilíbrio. O valor do pH foi medido diretamente em uma célula de cubeta de amostra usando um microeletrodo de pH, que tem uma precisão de ±0,005 pH. - Obtenha o conjunto de dados de comprimentos de onda do código padrão americano para intercâmbio de informações (ASCII) em função da absorbância. Extraia a posição média dos picos da banda usando o programa Peak Fit .
- Plote o conjunto de dados para visualizar a densidade óptica em função do comprimento de onda (nm) usando a função Plot .
- Marque os comprimentos de onda de pico iniciais λ1, λ2 e λ3 selecionando suas posições aproximadas nos dados plotados e ajuste os dados usando a função RUN .
- Obtenha o gráfico contendo o pico central de cada (λi), XCi, com a área de cada banda (Ai).
- Exporte as posições e áreas de pico extraídas para um programa de planilha e calcule a posição média de pico em um determinado pH.
- Determine o fator de ponderação ai de cada centro de pico λi comparando a área da banda (Ai) com a área total de todas as bandas como:
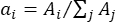 .
. - Extrair a posição
 média do pico (pH) utilizando a Eqn. (1).
média do pico (pH) utilizando a Eqn. (1).
 (1)
(1)
- Determine o fator de ponderação ai de cada centro de pico λi comparando a área da banda (Ai) com a área total de todas as bandas como:
- Gere um gráfico de reversibilidade usando o seguinte processo:
- Tabule as posições médias de pico,
 , em função de cada número de "operação", n como
, em função de cada número de "operação", n como  vs. n. Faça com que o número da operação, n, seja 1 para a amostra antes da adição de ácido a ~ pH 7. Aumente o número de operação em 1 de cada vez, alterando o pH para ~pH4 com HCl ou pH para ~pH 10 com NaOH. Faça n ser par em uma condição ácida (ou seja, ~ pH 4) e ímpar para ser uma condição básica (ou seja, pH 10).
vs. n. Faça com que o número da operação, n, seja 1 para a amostra antes da adição de ácido a ~ pH 7. Aumente o número de operação em 1 de cada vez, alterando o pH para ~pH4 com HCl ou pH para ~pH 10 com NaOH. Faça n ser par em uma condição ácida (ou seja, ~ pH 4) e ímpar para ser uma condição básica (ou seja, pH 10). - Analise a posição de pico em cada n,
 (n) = λ(n), usando a fórmula30
(n) = λ(n), usando a fórmula30
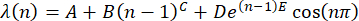 (2)
(2)
NOTA: Represente uma posição de pico média inicial em n = 1 por A. Expresse os parâmetros B e C como o deslocamento da posição de pico dependente de n. Faça o parâmetro D como uma amplitude do fator de amortecimento, E, de repetição. Use a função seno para mostrar a ondulação da posição do pico em função de n. - Transporte o conjunto de dados de (x, y) para o software Origin e plote.
- Forme a função personalizada dada na Eqn. (2) em Função de análise de ajuste de curva não linear. Digite os valores iniciais de A, B, C, D e E e clique em EXECUTAR para concluir o ajuste.
- Tabule as posições médias de pico,
- Imagem TEM
- Faça as amostras MET dos colóides de ouro de 20 nm revestidos com Aβ 1-40 com grades de cobre revestidas com Formvar. Examinar as amostras com um MET operado a 80 kV.
- Colete imagens com uma ampliação nominal de 28.000x ou 71.000x em uma câmera digital CCD (AMT) modelo XR-40 de 4 megapixels. Colete as imagens TEM para ouro de 20 nm revestido com Aβ 1-40 em cada número de operação n = 1 (~pH 7), n = 2, 4, 6, 8 e 10 (pH 4) e n = 3, 5, 7 e 9 (pH 10).
3. Imagem Raman e investigação da agregação reversível
- Colocar 100 μL de solução num disco de mica (diâmetro de 1 cm) para cada amostra no número de operação n. Secar as amostras durante a noite antes da medição.
- Colete imagens de luz branca em cada número de operação n. Prepare a amostra separada em um disco de mica, pois o pH foi continuamente alterado entre ~ pH 4 e ~ pH 10 para cada número de operação n (Figura 3).
- Colete a imagem Raman em cada número de operação n com um laser de comprimento de onda de λ = 633 nm a 0,5 ± potência de 0,05 mW com resolução espacial de ~ 0,43 μm em uma grade composta por 100 × 100 pixels com um tempo de integração de 500 ms / espectro para a região entre ~ 200 cm-1 e ~ 2.800 cm-1 (Figura 4).
- Plote o espectro representativo para cada n alinhado em função de n e construa o espectro SERS tridimensional em função de n para Aβ1-40 revestido de ouro de 20 nm (Figura 5A). Utilize a vista superior do espectro SERS tridimensional como um mapa de contorno (Figura 5B) para extrair os modos específicos associados a uma condição de pH específica (ou seja, ~ pH 4 e ~ pH 10). Extraia quaisquer características espectrais aprimoradas para apenas npar ou apenas nímpar.
Resultados
Com a fixação de Aβ 1-40 na superfície das partículas nanocoloidais de ouro, a banda SPR em torno do máximo de absorção de 530 nm mudou significativamente para a posição de pico de ~ 650 nm quando a solução se tornou mais ácida (pH 4) 35 . Juntamente com as imagens TEM, identificamos que as características espectroscópicas observadas em pH 4 correspondem à formação dos agregados coloidais de ouro com conformação plausivelmente desdobrada e rede com os monômeros Aβ 1-40 desdobrados circundantes adsorvidos sobre a superfície do ouro30. Observamos que os monômeros Aβ 1-40 revertem para a conformação dobrada em condições básicas (pH 10), resultando em uma deformação dos agregados de maneira quase reversível. Esse processo quase reversível ficou evidente a partir da alternância do pico médio da banda ( (n)), que mudou entre um comprimento de onda mais curto e mais longo, e a morfologia dispersa versus agregada em imagens MET entre condições básicas (pH = 10) e ácidas (pH = 4). Foi observado anteriormente que uma porção do monômero Aβ 1-40 permanece desdobrada mesmo depois que a solução foi revertida para as condições básicas36. O vídeo 1 mostra a mudança de cor dependente do pH do colóide de ouro nu Aβ 1-40 e 20 nm.
(n)), que mudou entre um comprimento de onda mais curto e mais longo, e a morfologia dispersa versus agregada em imagens MET entre condições básicas (pH = 10) e ácidas (pH = 4). Foi observado anteriormente que uma porção do monômero Aβ 1-40 permanece desdobrada mesmo depois que a solução foi revertida para as condições básicas36. O vídeo 1 mostra a mudança de cor dependente do pH do colóide de ouro nu Aβ 1-40 e 20 nm.
Como comparação, foi realizada a investigação do pH do salto do colóide de ouro nu de 20 nm (Figura 5C e D). À medida que a operação de mudança de pH prosseguiu, ela mostrou o crescimento da clusterização dos colóides de ouro em imagens de banda SPR, imagens TEM, bem como imagens de luz branca. Curiosamente, havia várias linhas espectrais SERS dependendo de nímpar e npar. Por exemplo, em npar (pH ~ 4), a linha a 275 cm-1, que foi atribuída como a moda associada a Aun (n = 5, 6, 12, 16, 20, 58)37 ou modo de Au-Cl-ligante 38 foi intensamente observada. Por outro lado, para npar, a 1008 cm-1 C-N str foi observado39 e CH2 wag39, deformação CH2 40 foram extensivamente observados a 1291 cm-1.
Em contraste com a morfologia de agregação clara e reversível dependente do pH observada pela imagem de luz branca, houve diferenças relativamente sutis nas características espectrais no espectro SERS entre nímpar e npar. Como primeira aproximação, a densidade de linhas espectrais na região entre 250 cm-1 e 1750 cm-1 foi maior para nímpar do quen par. As linhas espectrais na região da impressão digital, 1250 cm-1 e 1750 cm-1 (bandas de amida I, II e III) para nímpares , mostraram características espectrais menos resolvidas, implicando um alargamento ou aumento nas densidades espectrais. Na Figura 6, um mapa de contorno fornecido na Figura 5B (Figura 6B) foi organizado com os sinais SERS em 761 cm-1 (vermelho) e 1395 cm-1 (azul), representando as ênfases em nímpar e npar, respectivamente (Figura 6C). Como um espectro SERS representativo para nímpar e npar, o espectro SERS em n = 7 (vermelho) e n = 4 (azul) é mostrado na parte superior (Figura 6A). Para mostrar a correspondência com o deslocamento da banda SPR para ouro de 20 nm revestido com Aβ1-40 , o gráfico de deslocamento da banda na Figura 3 é mostrado ao lado (Figura 6D).
Embora tenhamos dados preliminares sobre a atribuição completa do espectro SERS observado, notamos várias características notáveis de deslocamento Raman aqui. As linhas espectrais e (atribuições plausíveis) aprimoradas em nímpares estão principalmente na região inferior a 1000 cm-1: 394 cm-1 (Trp) 41,42,43, 761 cm-1 (His, Ala) 39,44,45,46,47, 875 cm-1 (deslocamento indol NH, alongamento CC de Met) 39, 974 cm-1 (Glu, C-COO- estiramento de Asp, modo associado ao citrato)39,48,49. O deslocamento Raman aprimorado em nainda mostrou características espectroscópicas significativas na região da impressão digital (Amida I, II e III): 1166 cm-1 (deformação N-H+ de Tyr)39,41, 1227 cm-1 (Ala-Pro-Gly, Amida III)39,50,51, 1395 cm-1 (COO- alongamento simétrico ou CH2- CH3- tesoura de Glu)39,48, 1585 cm-1 (estiramento do anel CC de Phe, estiramento assimétrico do carboxilato -Au, estiramento COO- do citrato, deformação do anel de benzeno)39,41,45,46,47,49,52, 1592 cm-1 (Phe, Tyr, C=C estiramento de Tyr, estiramento CC do anel em Phe, estiramento do anel de benzeno e COO- alongamento em Phe e Tyr, e alongamento assimétrico de OH) 39 , 41 , 48 , 50 , 51 e 1628 cm-1 (subpico de amida I distinto para estruturas intermoleculares de folha de β53, C = O e os modos vibracionais CN / NH acoplados da estrutura da proteína originada de estruturas paralelas do tipo folha de β, acúmulo de Aβ54 agregado, bobinas aleatórias, β voltas, β grampos de cabelo48. As sequências que aparecem para nímpar ou npar são mostradas na Figura 7. No geral, para nmesmo correspondendo à agregação reversível ou conformação desdobrada de Aβ 1-40, Phe/Tyr contendo anel benzênico, estiramento simétrico de COO-, CH 2- CH3- modo de tesoura de Glu e deformação -NH+ de Tyr foram significativamente envolvidos na mudança conformacional do peptídeo. Durante a desmontagem da agregação que foi observada quando os peptídeos adotaram a conformação dobrada correspondente aos modos proeminentes em nímpares, Glu, Asp, Met, His e Ala pareciam estar envolvidos.

Figura 1: A absorbância e morfologia dependente do pH. O espectro de absorção em pH 4 (A) e pH 10 (B) para nanopartículas de ouro revestidas com Aβ 1-40 (20 nm) e as imagens TEM correspondentes, esboços de agregação/partículas dispersas e imagens de soluções em frascos são mostrados. A é a conformação desdobrada de monômeros Aβ 1-40 sob condições ácidas, e B é a conformação dobrada sob condições básicas. Diagramas de monômeros Aβ 1-40 em cada conformação e morfologias de agregação/dispersão são mostrados ao lado das imagens MET. Clique aqui para ver uma versão maior desta figura.
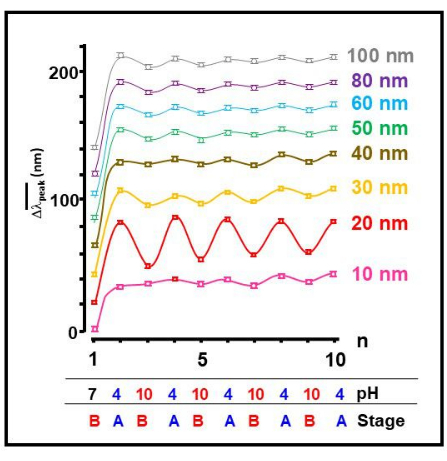
Figura 2: Reversibilidade de automontagem dependente do tamanho nanométrico. O deslocamento da posição média do pico da banda SPR,  , em função do número de operação, n, para todos os tamanhos testados de partículas coloidais de ouro. Os valores aproximados de pH e o estágio correspondente dos agregados mostrados na Figura 1 também são fornecidos. Clique aqui para ver uma versão maior desta figura.
, em função do número de operação, n, para todos os tamanhos testados de partículas coloidais de ouro. Os valores aproximados de pH e o estágio correspondente dos agregados mostrados na Figura 1 também são fornecidos. Clique aqui para ver uma versão maior desta figura.
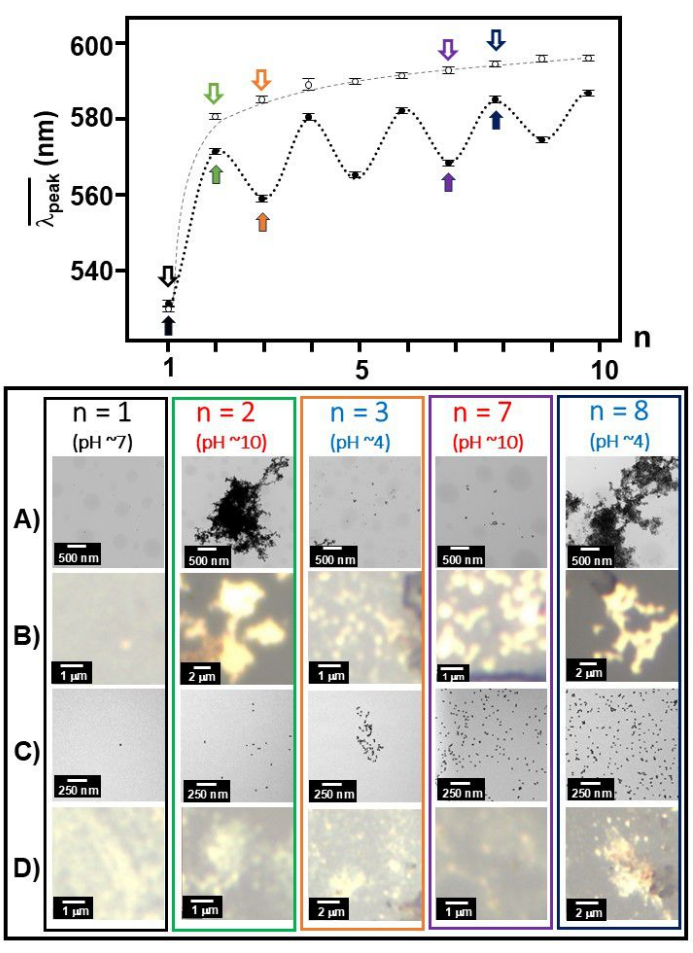
Figura 3:  e imagens TEM/luz branca em cada número de operação. O
e imagens TEM/luz branca em cada número de operação. O  número em função da operação, n, foi plotado em conjunto para Aβ 1-40 revestido de ouro de 20 nm (círculos fechados) e colóide de ouro de 20 nm (círculos abertos) e é mostrado com imagens representativas de TEM (A e C)/luz branca (B e D) em números de operação selecionados (n = 1, 2, 3, 7 e 8 marcados por setas decodificadas) para Aβ 1-40 revestido de ouro de 20 nm (A e B) e colóide de ouro de 20 nm (C e D). A fonte preta indica pH 7, a fonte azul indica pH 4 e a fonte vermelha indica pH 10. Clique aqui para ver uma versão maior desta figura.
número em função da operação, n, foi plotado em conjunto para Aβ 1-40 revestido de ouro de 20 nm (círculos fechados) e colóide de ouro de 20 nm (círculos abertos) e é mostrado com imagens representativas de TEM (A e C)/luz branca (B e D) em números de operação selecionados (n = 1, 2, 3, 7 e 8 marcados por setas decodificadas) para Aβ 1-40 revestido de ouro de 20 nm (A e B) e colóide de ouro de 20 nm (C e D). A fonte preta indica pH 7, a fonte azul indica pH 4 e a fonte vermelha indica pH 10. Clique aqui para ver uma versão maior desta figura.
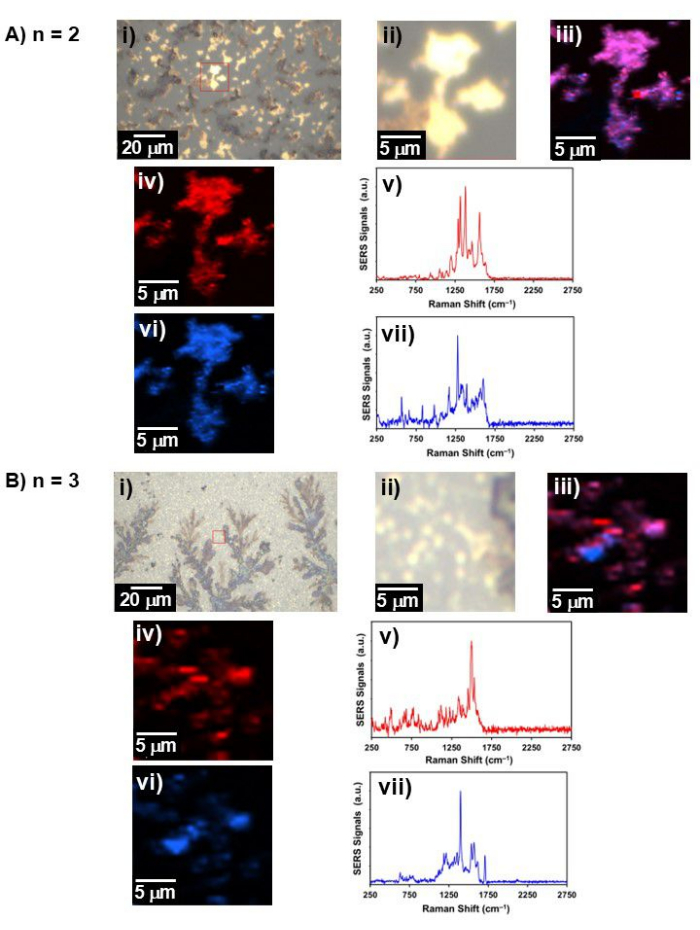
Figura 4: Luz branca representativa e imagem Raman. A imagem de luz branca, imagem Raman e espectro SERS para (A) n = 2 e (B) n = 3; i) imagem de luz branca em um amplo campo de visão, ii) imagem de luz branca na área onde a imagem Raman foi coletada (rotulada por um quadrado vermelho em i)), iii) a imagem Raman de dois componentes combinados, iv) imagem Raman do componente 1 e seu v) espectro SERS de iv), vi) imagem Raman do componente 2, e vii) espectro SERS de vi). Clique aqui para ver uma versão maior desta figura.
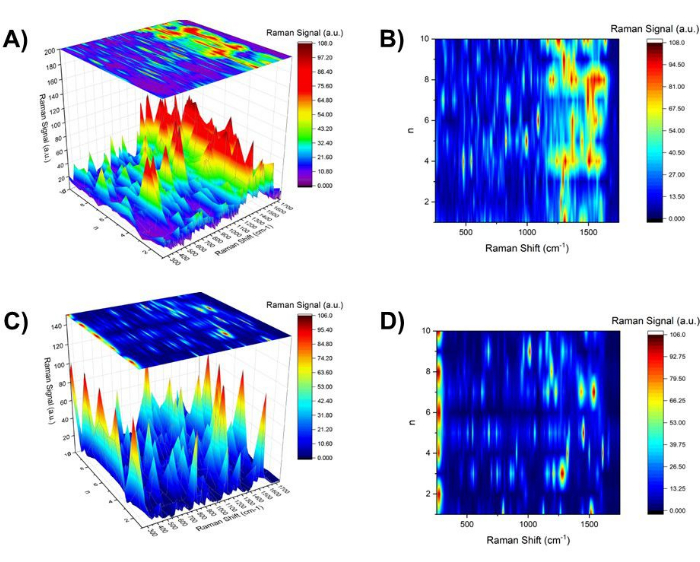
Figura 5: Mapa de contorno do espectro SERS para nímpar, npar e ntodos. (A) O mapa tridimensional do espectro SERS na região de 250 cm-1 e 1750 cm-1 em função de n para Aβ1-40 revestiu ouro de 20 nm com um mapa de contorno mostrado em (B) na parte superior. (C) O mapa tridimensional do espectro SERS na região de 250 cm-1 e 1750 cm-1 em função de n para ouro de 20 nm com um mapa de contorno mostrado em (D) na parte superior. Clique aqui para ver uma versão maior desta figura.

Figura 6: Mapa de contorno do SERS Spectrum. O mapa de contorno do espectro SERS em função de n (1-10). (A) Absorbância a 1395 cm-1 (azul) e 761 cm-1 (vermelho). (BD) O painel inferior mostra o espectro SERS e o painel direito mostra a amplitude da mudança de intensidade do sinal dos sinais SERS a cada n. Clique aqui para ver uma versão maior desta figura.
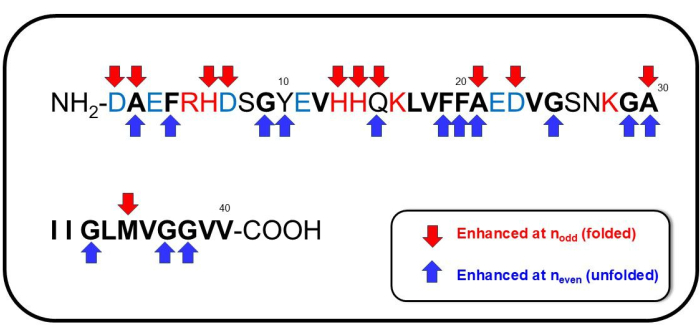
Figura 7: Sequências notáveis de Aβ1-40. As sequências atribuídas a ter envolvimento significativo em nímpares (correspondendo à formação de conformação dobrada) são indicadas por setas vermelhas para baixo, e aquelas atribuídas a ter envolvimento significativo em npares (correspondendo à formação de conformação desdobrada) são indicadas por setas azuis. Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Mudança de cor dependente do pH do colóide de ouro nu Aβ1-40 e 20 nm. Clique aqui para baixar este vídeo.
Discussão
Uma consideração crítica em estudos de conformação de peptídeos é a manutenção da amostra, pois as amostras se deterioram se armazenadas incorretamente. As amostras de peptídeos foram recebidas na forma liofilizada e começaram a desnaturar uma vez que foram reidratadas com água destilada deionizada, mesmo quando armazenadas a -80 °C. A pureza dos colóides de ouro foi verificada por análise de controle de qualidade. Para manter a estabilidade dos coloides, eles foram armazenados a 4 °C e não congelados. As soluções coloidais de ouro foram preparadas frescas para cada experimento porque a solução tampão de sais desestabilizaria o colóide de ouro. As soluções de HCl e NaOH foram preparadas frescas para cada experimento.
Os desafios técnicos de ler e registrar manualmente o pH da solução com instrumentos delicados enquanto alteram o pH entre 4 e 10 limitam a precisão de nossos resultados relatados. Assim, não observamos resultados consistentes na intensidade dos sinais SERS. Isso provavelmente introduziu um erro na amplitude usada para o gráfico de contorno. Trabalhos futuros para verificar os modos associados a npar ou nímpar podem introduzir mutações para substituir os aminoácidos na sequência Aβ 1-40 que relatamos estar envolvidos na mudança conformacional da proteína, como os resíduos únicos de tirosina ou asparagina.
"A interação entre o monômero Aβ1-40 e a superfície do ouro é considerada uma interação dipolo, e o nível de ligação de hidrogênio foi hipotetizado no trabalho de H. Schmidbauer et al.55. Em um trabalho separado, investigamos a espectroscopia SERS em função da quantidade de Aβ1-40 sob a condição ácida, extraiu a formação de adsorção dependente do tamanho nanométrico56. Para ouro de 20 nm, especulou-se que a ligação C = C ou -CN da histidina (His) iniciasse a adsorção; para ouro de 80 nm, no entanto, um modo de respiração do anel benzênico de fenilalanina (Phe) ou tirosina (Tyr) atingiu a superfície do ouro para iniciar a adsorção. O processo de adsorção de Aβ1-40 sobre a superfície do ouro em condições neutras ou básicas (pH ~ 10) foi considerado para manter o colóide de ouro revestido com Aβ1-40 como hidrofílico, uma vez que nenhum precipitado foi formado na condição aquosa. No entanto, os precipitados foram observados em pH 4, implicando que os agregados eram hidrofóbicos.
As imagens TEM e as imagens de luz branca mostram apenas indiretamente evidências da agregação. Tentamos realizar espectroscopia de dicroísmo circular (CD) para correlacionar a morfologia observada na agregação reversível com as estruturas secundárias. No entanto, as linhas de base de espalhamento nos impediram de obter sinais de CD reprodutíveis. Em vez disso, portanto, utilizamos a espectroscopia Raman, concentrando-nos mais nos modos aprimorados quando a agregação (conformação desdobrada de Aβ1-40) ocorreu sob pH ~ 4 ou quando a desagregação (conformação desdobrada de Aβ1-40) sob pH ~ 10. Assim, a melhor especulação para a identificação da estrutura secundária neste trabalho limitou-se ao monitoramento dos nós associados às estruturas secundárias. Isso foi demonstrado na observação da folha de β a 1628 cm-1, particularmente sob condição de pH 4.
Este estudo observou apenas a mudança na conformação do peptídeo para os colóides de ouro de 20 nm de diâmetro e investigou apenas n até 10. As propriedades de conformação e agregação do peptídeo Aβ 1-40 podem ser alteradas pelo tamanho da partícula que eles adsorvem a56. Portanto, mais trabalho é necessário para entender as propriedades dos peptídeos que são baseados na rede entre monômeros e aqueles que são afetados pelas características físicas da superfície de adsorção. Nas condições que testamos, apenas os colóides de ouro de 20 nm de diâmetro exibiram reversibilidade da morfologia de agregação, e os mecanismos de como o diâmetro do colóide afeta a reversibilidade dessa propriedade não são conhecidos. Aumentar n até 20 pode fornecer mais informações sobre o grau dependente do modo da reversibilidade da morfologia de agregação. Essas investigações sobre como o tamanho do colóide de ouro afeta a agregação do peptídeo beta amilóide produzirão informações importantes sobre os mecanismos moleculares da patologia da doença de Alzheimer.
Divulgações
Os autores declaram não ter conflitos de interesse com este trabalho a divulgar.
Agradecimentos
KY é apoiado pelo NSF-MRI Grant # 2117780. A Fundação Geneseo apoiou a fase inicial deste projeto. A AI é grata à Bolsa de Pesquisa de Verão para Ex-Alunos do Departamento de Química da SUNY Geneseo (Prêmio Rhodes '19 e Prêmio Lipkowitz '20) e à Bolsa de Pesquisa de Verão de Graduação da Fundação Dreyfus por seu apoio.
Materiais
| Name | Company | Catalog Number | Comments |
| Amyloid beta peptide 1-40 (Aβ1–40 peptide) | r-Peptide (Bogart, GA, USA) | A-1156-2 | |
| CCD digital camera | AMT | XR-40 4-megapixel CCD | |
| Distilled deionized water from Milli-Q- water system | Millipore Sigma (Burlington, MA, USA) | Milli-Q IQ 7000 | |
| Freezer -86 oC | Thermo Scientific | Revco Chilly Willy RLE Series Unit ID 187004 Build Number 40.04 | |
| Gold Colloid (10 nm) | Ted Pella, Inc. (Redding, California, USA) | 15703-20 | |
| Gold Colloid (100 nm) | Ted Pella, Inc. (Redding, California, USA) | 15711-22 | |
| Gold Colloid (15 nm) | Ted Pella, Inc. (Redding, California, USA) | 15704-20 | |
| Gold Colloid (20 nm) | Ted Pella, Inc. (Redding, California, USA) | 15705-20 | |
| Gold Colloid (30 nm) | Ted Pella, Inc. (Redding, California, USA) | 15706-21 | |
| Gold Colloid (40 nm) | Ted Pella, Inc. (Redding, California, USA) | 15707-21 | |
| Gold Colloid (50 nm) | Ted Pella, Inc. (Redding, California, USA) | 15708-21 | |
| Gold Colloid (60 nm) | Ted Pella, Inc. (Redding, California, USA) | 15709-22 | |
| Gold Colloid (80 nm) | Ted Pella, Inc. (Redding, California, USA) | 15710-22 | |
| Highest Grade V1AFM Mica Discs 10 mm | Ted Pella Inc. | #50 | |
| Hydrochloric Acid Standard Solution, 1.0 N | Fluka | Lot# SHBB4705V 318949-2L | |
| Macro quartz quvette Light Path 10 mm | Fire Fly Science | Type1-MC-Path10mm | |
| Micro pH electrode | HORIBA | Model 9618S (MFG No. 9Y8E0050) | |
| Peak Fit Program | Origin (Northampton, MA, USA) | OriginPro2018b (64-bit) b9.5.5.409 (Academic) | |
| pH 4.00 Buffer solution | VWR | Cat No. 34170-127 | |
| pH 7.00 Buffer Solution | Fisher Chemical | SB107-4 Lot 191041 | |
| pH meter | HORIBA | Model F-72G (MFG No. B27M0017) | |
| Pipet Tips Maxi Tips 1–5 mL | Fisher | 02-707-467 | |
| Pipet Tips 10 mL | Fisher | 02-717-135 | |
| Pipet Tips 1000 mL | Fisher | 02-717-156 | |
| Pipet Tips 1–200 mL | Fisher | 02-717-143 | |
| Pipetter Fisher Brand Elite 0.5–5 mL | Fisher | QU05317 | |
| Pipetter Fisher Brand Elite 100–1000 mL | Fisher | QU01672 | |
| Pipetter Fisher Brand Elite 10–100 mL | Fisher | MU10985 | |
| Pipetter Fisher Brand Elite 1–10 mL | Fisher | MU08178 | |
| Sodium Hydroxide Solution 1.0 M | Fluka | Lot#05096BPV 319511-2L | |
| TEM | FEI Co | Morgagni model 268 | |
| TempAssure PCR Tubes, Flat Caps, Natural | USA Scientific | polypropylene. 0.2 mL individual thin-wall tubes with attached frosted flat caps | |
| UV-Vis-NIR Spectrophotometer | Varian | CARY 5000 UV1106M074 | |
| WI Tec alpha300R Confocal Raman Microscope | WITec-Oxford Instrument | XMB3000-3001 |
Referências
- Kirschner, D. A., et al. Synthetic peptide homologous to beta protein from Alzheimer disease forms amyloid-like fibrils in vitro. Proc Natl Acad Sci U S A. 84 (19), 6953-6957 (1987).
- Lomakin, A., Chung, D. S., Benedek, G. B., Kirshner, D. A., Teplow, D. B. On the nucleation and growth of amyloid -protein fibrils: detection of nuclei and quantitation of rate constants. Proc Natl Acad Sci U S A. 93 (3), 1125-1129 (1996).
- Walsh, D. M., Lomakin, A., Benedek, G. B., Condron, M. M., Teplow, D. B. Amyloid -protein fibrillogenesis. J Biolog Chem. 272 (3), 22364-22372 (1997).
- Lambert, M. P., et al. nonfibrillar ligands derived from Ab1-42 are potent central nervous system neurotoxins. Proc Natl Acad Sci U S A. 95 (11), 6448-6453 (1998).
- Bucciantini, M., et al. Inherent toxicity of aggregates implies a common mechanism for protein misfolding diseases. Nature. 416 (6880), 507-511 (2002).
- Walsh, D. M., et al. Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo. Nature. 416 (6880), 535-539 (2002).
- Rocha, S., et al. Adsorption of amyloid beta-peptide at polymer surfaces: A neutron reflectivity study. ChemPhysChem. 6 (12), 2527-2534 (2005).
- Attanasio, F., et al. Carnosine inhibits Ab1-42 aggregation by perturbing the H-bond network in and around the central hydrophobic cluster. ChemBioChem. 14 (5), 583-592 (2013).
- Politi, J., Spadavecchia, J., Iodice, M., de Stefano, L. Oligopeptide-heavy metal interaction monitoring by hybrid gold nanoparticle based assay. Analyst. 140 (1), 149-155 (2015).
- Moshe, A., Landau, M., Eisenberg, D. Preparation of Crystalline samples of amyloid fibrils and oligomers. Methods Mol Biol. 1345, 201-210 (2016).
- Scarff, C. A., Ashcroft, A. E., Radford, S. E. Characterization of amyloid oligomers by electrospray ionization-ion mobility spectrometry-mass spectrometry (ESI-IMS-MS). Methods Mol Biol. 1345, 115-132 (2016).
- Sabaté, R., Gallardo, M., Estelrich, J. Temperature dependence of the nucleation constant rate in β amyloid fibrillogenesis. Int J Biol Macromol. 35 (1-2), 9-13 (2005).
- Niraula, T. N., et al. Pressure-dissociable reversible assembly of intrinsically denatured lysozyme is a precursor for amyloid fibrils. Proc Natl Acad Sci U S A. 101 (12), 4089-4093 (2004).
- Miller, A. E., et al. Behavior of β-Amyloid 1-16 at the air-water interface at varying pH by nonlinear spectroscopy and molecular dynamics simulations. J Phys Chem A. 115 (23), 5873-5880 (2011).
- Majzika, A., et al. Functionalization of gold nanoparticles with amino acid, -amyloid peptides and fragment. Colloids Surf B Biointerfaces. 81 (1), 235-241 (2010).
- Liu, L., et al. Electrochemical detectionof β-amyloid peptides on electrode covered with N-terminus-specific antibody based on electrocatalytic O2 reduction by Aβ(1-16)-heme-modified gold nanoparticles. Biosens Bioelectron. 49, 231-235 (2013).
- Elbassal, E. A., et al. Gold Nanoparticles as a Probe for Amyloid-β Oligomer and Amyloid Formation. J Phys Chem C Nanomater Interfaces. 121 (36), 20007-20015 (2017).
- Olmedo, I., et al. How changes in the sequence of the peptide CLPFFD-NH2 can modify the conjugation and stability of gold nanoparticles and their affinity for beta-amyloid fibrils. Bioconjug Chem. 19 (16), 1154-1163 (2008).
- Xu, Y., et al. Attenuation of the aggregation and neurotoxicity of amyloid peptides with neurotransmitter-functionalized ultra-small-sized gold nanoparticles. Eng Sci. 6, 53-63 (2019).
- John, T., Gladytz, A. K., Martin Clemens, L. L., Risselada, H. J., Abel, B. Impact of nanoparticles on amyloid peptide and protein aggregation: A review with a focus on gold nanoparticles. Nanoscale. 45, 20894-20913 (2018).
- Li, J., et al. Reduced aggregation and cytotoxicity of amyloid peptides by graphene oxide/gold nanocomposites prepared by pulsed laser ablation in water. Small. 10 (21), 4386-4394 (2014).
- Araya, E., et al. Gold nanoparticles and microwave irradiation Inhibit beta-amyloid amyloidogenesis. Nanoscale Res Lett. 3, 435 (2008).
- Barrow, C. J., Yasuda, A., Kenny, P. T., Zagorski, M. G. Solution conformations and aggregational properties of synthetic amyloid beta-peptides of Alzheimer's disease. Analysis of circular dichroism spectra. J Mol Biol. 225 (4), 1075-1093 (1992).
- Wood, S. J., MacKenzie, L., Maleeff, B., Hurle, M. R., Wetzel, R. Selective inhibition of Ab fibril formation. J Biolog Chem. 271 (8), 4086-4092 (1996).
- Yokoyama, K. Nanoscale Surface Size Dependence in Protein Conjugation. Advances in Nanotechnology. , (2010).
- Yokoyama, K. Nanoscale Protein Conjugation. Advances in Nanotechnology. , (2010).
- Yokoyama, K. . Modeling of Reversible Protein Conjugation on Nanoscale Surface in Computational Nanotechnology: Modeling and Applications with MATLAB. , (2011).
- Yokoyama, K. Nano Size Dependent Properties of Colloidal Surfaces. Colloids: Classification, Properties and Applications. , (2012).
- Yokoyama, K. Controlling Reversible Self-Assembly Path of Amyloid Beta Peptide over Gold Colloidal Nanoparticle's Surface. Nanoscale Spectroscopy with Applications. , (2013).
- Yokoyama, K., et al. Nanoscale size dependence in the conjugation of amyloid beta and ovalbumin proteins on the surface of gold colloidal particles. Nanotechnology. 19, 375101 (2008).
- Yokoyama, K., Welchons, D. R. The conjugation of amyloid beta protein on the gold colloidal nanoparticles' surfaces. Nanotechnology. 18, 105101 (2007).
- Edelhoch, H. Spectroscopic determination of tryptophan and tyrosine in proteins. Biochemistry. 6 (7), 1948-1954 (1967).
- Yokoyama, K., et al. Examination of adsorption orientation of amyloidogenic peptides over nano-gold colloidal particles surfaces. Int J Mol Sci. 20 (21), 5354-5380 (2019).
- Yokoyama, K., Ichiki, A. Oligomerization and Adsorption Orientation of Amyloidogenic Peptides over Nano-Gold Colloidal Particle Surfaces. Advances in Chemistry Research. , (2020).
- Fan, X., Zheng, W., Singh, D. J. Light scattering and surface plasmons on small spherical particles. Light Sci Appl. 3, e179 (2014).
- Yokoyama, K., et al. Microscopic investigation of reversible nanoscale surface size dependent protein conjugation. Int J Mol Sci. 10 (5), 2348-2366 (2009).
- Vishwanathan, K. Symmetry of gold neutral clusters Au3-20 and normal modes of vibrations by using the numerical finite difference method with density-functional tight-binding (DFTB) approach. Arch Chem Res. 2 (1), 4 (2017).
- Gao, P., Weaver, M. J. Metal-adsorbate vibrational frequencies as a probe of surface bonding: halides and pseudohalides at gold electrodes. J Phys Chem. 90, 4057-4063 (1986).
- Stewart, S., Fredericks, P. M. Surface-enhanced raman spectroscopy of peptides and proteins adsorbed on an electrochemically prepared silver surface. Spectrochim Acta AMol Biomol Spectrosc. 55 (7-8), 1615-1640 (1999).
- Palings, I., et al. Assignment of fingerprint vibrations in the resonance Raman spectra of rhodopsin, isorhodopsin, and bathorhodopsin: Implications for chromophore structure and environment. Biochem. 26 (9), 2544-2556 (1987).
- Szekeres, G. P., Kneipp, J. SERS probing of proteins in gold nanoparticle agglomerates. Front Chem. 7, 30 (2019).
- Lin, V. J. C., Koenig, J. L. Raman studies of bovine serum albumin. Biopolymers. 15 (1), 203-218 (1976).
- Hornemann, A., Drescher, D., Flemig, S., Kneipp, J. Intracellular SERS hybrid probes using BSA-reporter conjugates. Anal Bioanal Chem. 405 (19), 6209-6222 (2013).
- Dong, J., et al. Metal binding and oxidation of amyloid-beta within isolated senile plaque cores: Raman microscopic evidence. Biochemistry. 42 (10), 2768-2773 (2003).
- Carey, P. R. . Biochemical Applications of Raman and Resonance Raman Spectroscopies. , (1982).
- Harada, I., Takeuchi, H. Raman and Ultraviolet Resonance Raman Spectra of Proteins and Related Compounds. Spectroscopy of Biological Systems : Advances in Infrared and Raman Spectroscopy. , (1986).
- Overman, S. A., Thomas, G. J. Raman markers of nonaromatic side chains in an α-helix assembly: Ala, Asp, GGly, Ile, Leu, Lys, Ser, and Val residues of phage fd subunits. Biochemistry. 38 (13), 4018-4027 (1999).
- Talaga, D., et al. Total internal reflection tip-enhanced Raman spectroscopy of tau fibrils. J Phys Chem B. 126 (27), 5024-5032 (2022).
- Grys, D. -. B., et al. Citrate coordination and bridging of gold nanoparticles: The role of gold adatoms in AuNP aging. ACS Nano. 14 (7), 8689-8696 (2020).
- Guo, T., et al. Full-scale label-free surface-enhanced Raman scattering analysis of mouse brain using a black phosphorus-based two-dimensional nanoprobe. Appl Sci. 9 (3), 398-408 (2019).
- Walther, M., Plochocka, P., Fischer, B., Helm, H., Uhd Jepsen, P. Collective vibrational modes in biological molecules investigated by Terahertz time-domain spectroscopy. Biopolymers. 67 (4-5), 310-313 (2002).
- Lochocki, B., et al. label-free fluorescence and Raman imaging of amyloid deposits in snap-frozen Alzheimer's disease human brain tissue. Commun Biol. 4 (1), 474-486 (2021).
- Palombo, F., et al. Detection of Aβ plaque-associated astrogliosis in Alzheimer's disease brain by spectroscopic imaging and immunohistochemistry. Analyst. 143 (4), 850-857 (2018).
- Khoury, Y. E., et al. Raman imaging reveals accumulation of hemoproteins in plaques from Alzheimer's diseased tissues. ACS Chem Neurosci. 12 (15), 2940-2945 (2021).
- Schmidbaur, H., Raubenheimer, H. G., Dobrzańska, L. The gold-hydrogen bond, Au-H, and the hydrogen bond to gold Au∙∙∙H-X. Chem Soc Rev. 43 (1), 345-380 (2014).
- Yokoyama, K., et al. Protein corona formation and aggregation process of amyloid beta 1-40 coated gold nano-colloids. Langmuir. 40 (3), 1728-1746 (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados