Method Article
Характеристика pH-зависимой обратимой самосборки коллоидов золота, покрытых бета-амилоидом 1-40
В этой статье
Резюме
В данной работе мы представляем систематический метод, описывающий квазиобратимую самосборку покрытых бета-амилоидом 1-40 (Aβ 1-40) золотых агрегатов размером 20 нм. Наноразмер-зависимая квазиобратимая сеть между пептидами коррелировала с конкретными аминокислотами или участками мономера Aβ 1-40.
Аннотация
Определение характеристик Aβ 1-40, покрытых на поверхности коллоидных частиц нанозолота, проводилось с помощью спектроскопии поверхностного плазмонного резонанса (SPR) и просвечивающей электронной микроскопии (ПЭМ). Наблюдаемое pH-зависимое смещение полосы SPR частиц золота размером 20 нм с покрытием Aβ 1-40 коррелировало с чередованием агрегации и дезагрегации, наблюдаемым на изображениях ПЭМ. pH ~4 индуцировал развернутую конформацию, а pH ~10 индуцировал складчатую конформацию Aβ 1-40 на поверхности золота. Этот обратимый процесс агрегации наблюдался с помощью комбинационной визуализации, поскольку pH постепенно менялся с pH 4 на pH 10. Мы наблюдали рН-зависимое изменение морфологии Aβ 1-40 на поверхности золота, где при рН 4 наблюдались четкие агрегаты. Тем не менее, мы наблюдали очень тонкие различия в спектре спектроскопии комбинационного рассеяния света (SERS) между условиями pH 4 и pH 10, причем наиболее поразительной разницей является спектральная плотность в области 250 см-1 и 1750 см-1. В частности, модальный анализ обратимой агрегации показал, что агрегаты образованы развернутой конформацией Aβ 1-40, которая включает в себя участок бензольного кольца тирозина и фенилаланина. И наоборот, разборка агрегатов была связана с конформационными изменениями в сворачивании белка Aβ 1-40 с участием гистидина, глутамина, метионина и аспарагиновой кислоты.
Введение
Фибриллогенез бета-амилоидных пептидов 1-40 (Aβ 1-40) или 1-42 (Aβ 1-42) был широко исследован в качестве критического компонента в образовании амилоидных бляшек, которые являются причиной болезни Альцгеймера 1,2,3,4,5,6,7,8,9,10 ,11. Ключевым механизмом фибриллогенеза является олигомеризация пептидов Aβ 1-40 или Aβ 1-42 с образованием нейротоксического белкового агрегата, и были проведены обширные исследования, чтобы понять механизмы того, как мономеры образуют олигомеры 12,13,14. Мы применили подход, предусматривающий изучение амилоидогенных пептидов, образующих агрегаты на поверхности нанозолота, и выявление факторов, ответственных за взаимодействие между пептидами, находящимися вдали от поверхности золота 15,16,17,18,19,20,21,22.
Aβ 1-40 принимают развернутую конформацию (A) в кислых условиях (pH ~4) и складчатую конформацию (B) в основных условиях (pH ~10). Мы наблюдали дисперсные коллоидные частицы золота с покрытием Aβ 1-40 при pH ~ 10 и крупные агрегаты коллоидного золота с покрытием Aβ 1-40 при pH ~ 4 (рис. 1)23,24. Развернутая конформация Aβ 1-40 в кислых условиях способствует созданию пептидной сети между мономерами Aβ 1-40 на поверхности наночастиц золота, что приводит к образованию коллоидных агрегатов золота (см. А на рисунке 1). Когда мономер Aβ 1-40 удерживает свернутую конформацию при основном или нейтральном pH, Aβ 1-40, мономеры не объединяются в агрегаты, и покрытые наночастицы золота остаются в виде отдельных дисперсных частиц (см. B на рисунке 1). Таким образом, мы можем исследовать процесс того, как пептиды Aβ 1-40 претерпевают конформационные изменения в сети и образуют агрегаты, измеряя сдвиг зоны SPR в диапазоне условий pH 25,26,27,28,29,30,31.
Мы протестировали несколько наночастиц золота различных размеров и обнаружили, что коллоид золота с длиной волны 20 нм демонстрирует наиболее выраженный процесс обратимой самосборки мономеров Aβ 1-40 в ответ на внешнее изменение pH (рис. 2). Это явный признак обратимого изменения конформации пептидов, когда кислотные условия (А) индуцируют развернутую конформацию, усиливая сетчатость и приводя к агрегации коллоидов золота. Было обнаружено, что основное условие (В) индуцирует свернутую конформацию мономеров 26,27,28,29,30,31.
протокол
1. Получение наночастиц золота с покрытием Aβ 1-40
- Добавьте 1 мл дистиллированной деионизированной воды к 1 мг лиофилизированного Aβ 1-40 (МВт: 4,2 кДа, чистота ВЭЖХ 98%) с помощью иглы для шприца. Перемешайте раствор с помощью вихревого смесителя в течение примерно 30 с и убедитесь, что в растворе не наблюдается твердых частиц при комнатной температуре (RT; ~20 °C).
- Все исходные растворы готовят с использованием деионизированной и дистиллированной воды (~18 МОм·см).
- Спектроскопически определите концентрацию с помощью поглощения тирозина при длине волны 275 нм32, которая имеет коэффициент молекулярного экстинкции ε275 1390 см-1· М-1.
- Храните стоковые растворы Аβ 1-40 при температуре -80 °С. (См. Таблицу материалов для коммерческих продуктов Aβ 1-40.)
- Разморозьте исходный раствор пептида примерно за 5 минут до сбора данных. Смешайте объем пептидного раствора объемом 8 мкл с 800 мкл коллоидных частиц золота в центрифужной пробирке объемом 15 мл. Добавьте объем 4,2 мл деионизированной дистиллированной воды, а затем подвергните образец вихревому воздействию в течение 10 с 30,31,33,34.
- Установите концентрацию пептидов Aβ 1-40 равной 1,8 нмоль и варьируйте соотношение пептидов Aβ 1-40. Количество коллоидов золота колебалось от ~500:1 до ~2000:125.
2. Итеративное изменение pH и мониторинг соответствующего сдвига полосы SPR
- Установите температуру раствора на определенном значении (например, 25 °C) с помощью терморегулятора спектрофотометра ультрафиолетового видимого ближнего инфракрасного диапазона (UV-Vis-NIR).
- Контролируйте начальный pH раствора образца с помощью рН-метра и установите его немного ниже pH 7. Соберите спектр поглощения в диапазоне от 400 нм до 1000 нм.
- Измените pH образца на ~pH 4 (т. е. pH 4,0 ± 0,3), добавив объем 0,1 μL HCl, и соберите спектр поглощения от 400 нм до 1000 нм.
- Измените pH образца на ~pH 10 (т. е. pH 10 ± 0,3), добавив объем 0,1 M NaOH на 10 μL, и соберите спектр поглощения от 400 нм до 1000 нм.
- Измените pH между pH 4 и pH 10 с HCl и NaOH 10 раз и непрерывно собирайте спектр поглощения при температуре 25 ± 0,2 °C29,30.
ПРИМЕЧАНИЕ: Для всех образцов оптическая плотность пика диапазона SPR поддерживалась на уровне около 0,2. Ожидается эффект буфера из-за остаточного буферного раствора в растворе. Таким образом, окончательное значение рН определялось после подтверждения равновесия. Значение pH измеряли непосредственно в кювете образца с помощью микроpH-электрода, который имеет точность ±0,005 pH. - Получите набор данных американского стандартного кода для обмена информацией (ASCII) о длинах волн в зависимости от поглощения. Извлеките среднее положение пиков полос с помощью программы Peak Fit .
- Постройте график набора данных для отображения оптической плотности в зависимости от длины волны (нм) с помощью функции График .
- Отметьте начальные пиковые длины волн λ1, λ2 и λ3 , выбрав их приблизительное положение на построенных графиках данных, и подогнайте данные с помощью функции RUN .
- Получим график, содержащий центральный пик каждой (λi), XCi, с площадью каждой полосы (Ai).
- Экспортируйте извлеченные пиковые положения и площади в программу для работы с электронными таблицами и рассчитайте среднее положение пика при заданном pH.
- Определите весовой коэффициент ai для каждого пикового центра λi путем сравнения площади полосы (Ai) с общей площадью всех полос следующим образом:
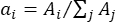 .
. - Извлеките среднее пиковое положение (pH)
 с помощью уравнения (1).
с помощью уравнения (1).
 (1)
(1)
- Определите весовой коэффициент ai для каждого пикового центра λi путем сравнения площади полосы (Ai) с общей площадью всех полос следующим образом:
- Сгенерируйте график обратимости, используя следующий процесс:
- Сведите в таблицу средние пиковые положения
 , как функцию каждого номера «операции», n as
, как функцию каждого номера «операции», n as  и n. Сделайте число операции, n, равным 1 для образца до добавления кислоты при ~pH 7. Каждый раз увеличивайте число операций на 1, изменяя pH на ~pH4 для HCl или pH на ~pH 10 с NaOH. Сделайте n четным при кислом состоянии (т.е. ~pH 4) и нечетным базовым условием (т.е. pH 10).
и n. Сделайте число операции, n, равным 1 для образца до добавления кислоты при ~pH 7. Каждый раз увеличивайте число операций на 1, изменяя pH на ~pH4 для HCl или pH на ~pH 10 с NaOH. Сделайте n четным при кислом состоянии (т.е. ~pH 4) и нечетным базовым условием (т.е. pH 10). - Проанализируйте положение пика в каждом n,
 (n) = λ(n), используя формулу30
(n) = λ(n), используя формулу30
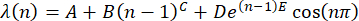 (2)
(2)
ПРИМЕЧАНИЕ: Представьте начальное среднее положение пика при n = 1 с помощью A. Выразите параметры B и C как n-зависимый сдвиг положения пика. Сделайте параметр D амплитудой коэффициента демпфирования E, повторяющегося. Используйте функцию синуса , чтобы показать волнообразность положения пика в зависимости от n. - Перенос набора данных (x, y) в программное обеспечение Origin и построение графика.
- Сформируйте пользовательскую функцию, приведенную в уравнении (2) в разделе Функция анализа нелинейной подгонки кривой. Введите начальные значения A, B, C, D и E и нажмите кнопку ВЫПОЛНИТЬ, чтобы завершить подгонку.
- Сведите в таблицу средние пиковые положения
- ПЭМ визуализация
- Изготовление ПЭМ-образцов коллоидов золота 20 нм с покрытием Aβ 1-40 с медными сетками с покрытием Formvar. Исследуйте образцы с помощью ПЭМ, работающего под напряжением 80 кВ.
- Собирайте изображения с номинальным увеличением 28 000x или 71 000x на модели XR-40 с 4-мегапиксельной цифровой CCD цифровой камерой (AMT). Соберите ПЭМ-изображения для золота 20 нм с покрытием Aβ 1-40 при каждой операции n = 1 (~pH 7), n = 2, 4, 6, 8 и 10 (pH 4) и n = 3, 5, 7 и 9 (pH 10).
3. Рамановская визуализация и исследование обратимой агрегации
- Нанесите 100 мкл раствора на слюдяной диск (диаметр 1 см) для каждого образца под рабочим номером n. Перед измерением просушите образцы на ночь.
- Сбор изображений в белом свете при каждой операции номер n. Подготовьте отдельный образец на слюдяном диске, так как pH непрерывно изменялся в диапазоне от ~pH 4 до ~pH 10 для каждого рабочего числа n (Рисунок 3).
- Соберите рамановское изображение на каждом рабочем числе n лазером с длиной волны λ = 633 нм при мощности 0,5 ± 0,05 мВт с пространственным разрешением ~0,43 мкм в сетку, состоящую из 100 × 100 пикселей со временем интегрирования 500 мс/спектр для области от ~200 см-1 до ~2 800 см-1 (рис. 4).
- Постройте репрезентативный спектр для каждого n, выровненный как функция n, и постройте трехмерный спектр SERS как функцию n для Aβ1-40 с покрытием из золота 20 нм (рис. 5A). Используйте вид сверху трехмерного спектра SERS в качестве контурной карты (рис. 5B) для выделения специфических мод, связанных с определенным состоянием pH (т.е. ~pH 4 и ~pH 10). Извлекает любые спектральные особенности, улучшенные либо при nчетных , либо при nнечетных.
Результаты
При присоединении Aβ 1-40 к поверхности наноколлоидных частиц золота полоса SPR вокруг максимума поглощения 530 нм значительно смещалась в красную сторону до пикового положения ~650 нм, когда раствор становился более кислым (pH 4)35. Вместе с изображениями ПЭМ мы определили, что спектроскопические особенности, наблюдаемые при pH 4, соответствуют образованию коллоидных агрегатов золота с правдоподобно развернутой конформацией и сетью с окружающими развернутыми мономерами Aβ 1-40, адсорбированными по поверхности золота30. Мы заметили, что мономеры Aβ 1-40 возвращаются к свернутой конформации в основных условиях (pH 10), что приводит к квазиобратимой деформации агрегатов. Этот квазиобратимый процесс был очевиден по чередованию среднего пика полосы ( (n)), который смещался между более короткой и длинной длиной волны, а также дисперсной и совокупной морфологии на изображениях ПЭМ между основными (pH = 10) и кислыми (pH = 4) условиями. Ранее было замечено, что часть мономера Aβ 1-40 остается развернутой даже после того, как раствор был возвращен к основным условиям36. На видео 1 показано pH-зависимое изменение цвета Aβ 1-40 и коллоида голого золота на длине волны 20 нм.
(n)), который смещался между более короткой и длинной длиной волны, а также дисперсной и совокупной морфологии на изображениях ПЭМ между основными (pH = 10) и кислыми (pH = 4) условиями. Ранее было замечено, что часть мономера Aβ 1-40 остается развернутой даже после того, как раствор был возвращен к основным условиям36. На видео 1 показано pH-зависимое изменение цвета Aβ 1-40 и коллоида голого золота на длине волны 20 нм.
Для сравнения было проведено исследование pH хмеля коллоида голого золота с длиной волны 20 нм (рис. 5C и D). По мере того, как операция по изменению рН продолжалась, она показала рост кластеризации коллоидов золота в полосе SPR shoft, изображениях ПЭМ, а также изображениях в белом свете. Довольно интересно, что существовало несколько спектральных линий SERS в зависимости от nнечетных и nчетных. Например, при nчете (pH ~4) интенсивно наблюдалась линия на уровне 275 см-1, которая была назначена модой, связанной с Aun (n = 5, 6, 12, 16, 20, 58)37 или модой Au-Cl- ligand38 . С другой стороны,для n чета, при 1008 см-1 C-N str наблюдалась39 и CH2 wag39, деформация CH2 40 широко наблюдалась при 1291 см-1.
В отличие от четкой pH-зависимой и обратимой агрегационной морфологии, наблюдаемой при визуализации в белом свете, наблюдались относительно тонкие различия в спектральных особенностях спектра SERS между nнечетными и nчетными. В первом приближении плотность спектральных линий в области между 250 см-1 и 1750 см-1 была выше для nнечетных , чем для nчетных. Спектральные линии в области отпечатков пальцев 1250 см-1 и 1750 см-1 (каналы амида I, II и III) для nнечетных показали менее разрешенные спектральные особенности, что указывает либо на расширение, либо на увеличение спектральной плотности. На рисунке 6 контурная карта, представленная на рисунке 5B (рисунок 6B), была организована с сигналами SERS в точках 761 см-1 (красный) и 1395 см-1 (синий), представляя акценты на nнечетных и nчетных соответственно (рисунок 6C). В качестве репрезентативного спектра SERS для nнечетных и nчетных, спектр SERS при n = 7 (красный) и n = 4 (синий) показан вверху (рис. 6A). Чтобы показать соответствие сдвигу полосы SPR для золота Aβ1-40 с покрытием 20 нм, график смещения полосы на рисунке 3 показан сбоку (рисунок 6D).
Хотя у нас есть предварительные данные о полном присвоении наблюдаемого спектра SERS, здесь мы отмечаем несколько заметных особенностей комбинационного сдвига. Спектральные линии и (вероятные присвоения), усиленные в nнечетных, в основном находятся в области ниже 1000 см-1: 394 см-1 (Trp)41,42,43, 761 см-1 (His, Ala)39,44,45,46,47, 875 см-1 (индоловое смещение NH, C-C растяжение Met)39, 974 см-1 (Glu, C-COO- растяжение Asp, мода, связанная с цитратом)39,48,49. Усиленный при n рамановский сдвигдаже показал значимые спектроскопические особенности в области отпечатков пальцев (Амид I, II и III): 1166 см-1 (N-H+ деформация Tyr)39,41, 1227 см-1 (Ala-Pro-Gly, Амид III)39,50,51, 1395 см-1 (COO- симметричное растяжение или CH2- CH3- ножницы Glu)39,48, 1585 см-1 (растяжение кольца CC Phe, асимметричное растяжение карбоксилата -Au, COO- растяжение цитрата, деформация бензольного кольца)39,41,45,46,47,49,52, 1592 см-1 (Phe, Tyr, C=C растяжение Tyr, CC растяжение кольца в Phe, растяжение бензольного кольца и COO- растяжение в Phe и Tyr, а также асимметричное растяжение OH)39,41,48,50,51 и 1628 см-1 (субпик амида I, характерный для межмолекулярных β-листовых структур53, C=O и связанных CN/NH колебательных мод белкового каркаса, происходящих из параллельных структур β-листового типа, накопление агрегированных Aβ54, случайных катушек, β-витков, β-шпильки48. Последовательности, появляющиеся для nнечетных или nчетных, показаны на рисунке 7. В целом, для n,даже соответствующего обратимой агрегации или развернутой конформации Aβ 1-40, Phe/Tyr, содержащего бензольное кольцо, симметричное растяжение COO-, CH2-CH 3-, ножничный режим Glu и -NH+ деформация Tyr были значимо вовлечены в конформационное изменение пептида. Во время разборки агрегации, которая наблюдалась, когда пептиды принимали свернутую конформацию, соответствующую модам, заметным на nнечетных, по-видимому, были задействованы Glu, Asp, Met, His и Ala.

Рисунок 1: pH-зависимая абсорбция и морфология. Показан спектр поглощения при рН 4 (А) и рН 10 (В) для наночастиц золота с покрытием Aβ 1-40 (20 нм), а также соответствующие ПЭМ-изображения, эскизы агрегационных/диспергированных частиц и изображения растворов во флаконах. A — развернутая конформация мономеров Aβ 1-40 в кислых условиях, а B — свернутая конформация в основных условиях. Диаграммы мономеров Aβ 1-40 в каждой конформации и морфологии агрегации/дисперсии показаны рядом с изображениями ПЭМ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
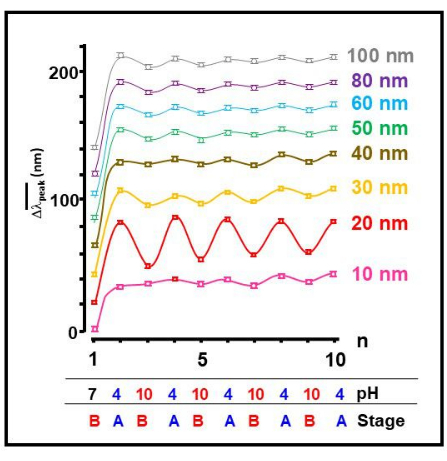
Рисунок 2: Обратимость самосборки, зависящая от наноразмера. Смещение среднего пикового положения полосы SPR,  в зависимости от рабочего числа, n, для всех испытуемых размеров коллоидных частиц золота. Также приведены приблизительные значения рН и соответствующая стадия агрегатов, показанные на рисунке 1 . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
в зависимости от рабочего числа, n, для всех испытуемых размеров коллоидных частиц золота. Также приведены приблизительные значения рН и соответствующая стадия агрегатов, показанные на рисунке 1 . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
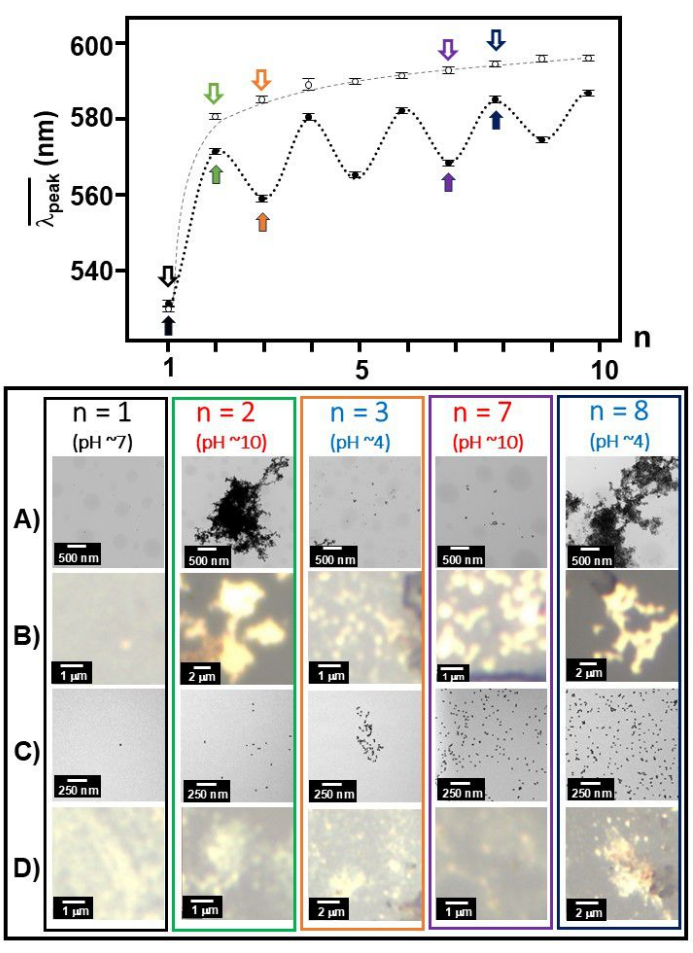
Рисунок 3:  и изображения ПЭМ/белого света по каждому номеру операции. Как
и изображения ПЭМ/белого света по каждому номеру операции. Как  функция рабочего числа, n, была построена вместе для Aβ 1-40 с покрытием 20 нм золота (замкнутые круги) и 20 нм золота коллоида (открытые круги) и показана с репрезентативными изображениями TEM (A и C)/белого света (B и D) при выбранных номерах операций (n = 1, 2, 3, 7 и 8, отмеченных декодированными стрелками) для Aβ 1-40 с покрытием 20 нм золота 20 нм (A и B) и 20 нм золота коллоида (C и D). Черный шрифт обозначает pH 7, синий — pH 4, а красный — pH 10. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
функция рабочего числа, n, была построена вместе для Aβ 1-40 с покрытием 20 нм золота (замкнутые круги) и 20 нм золота коллоида (открытые круги) и показана с репрезентативными изображениями TEM (A и C)/белого света (B и D) при выбранных номерах операций (n = 1, 2, 3, 7 и 8, отмеченных декодированными стрелками) для Aβ 1-40 с покрытием 20 нм золота 20 нм (A и B) и 20 нм золота коллоида (C и D). Черный шрифт обозначает pH 7, синий — pH 4, а красный — pH 10. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
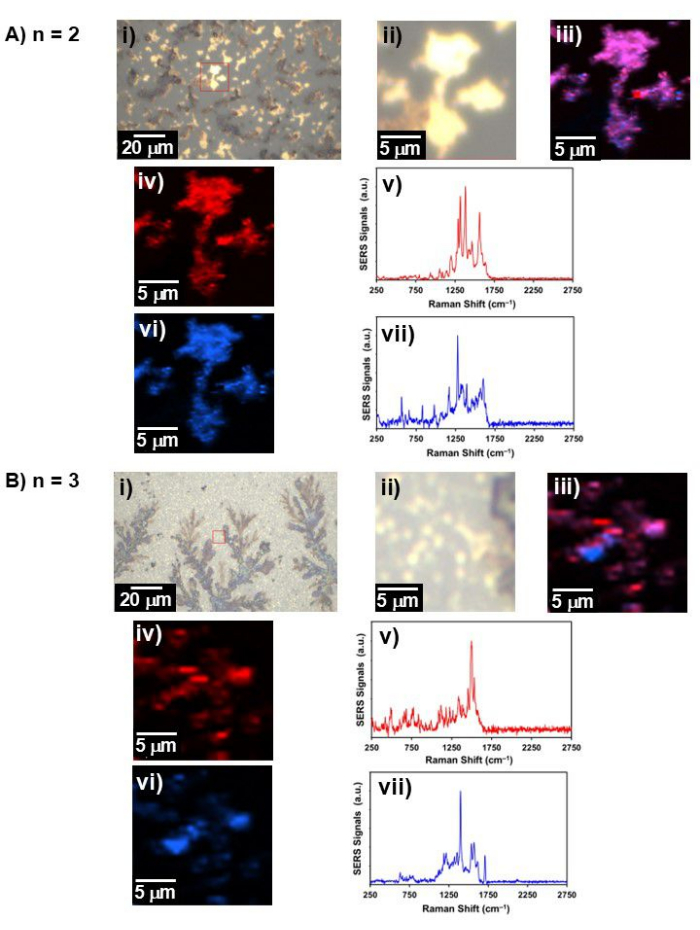
Рисунок 4: Репрезентативный белый свет и рамановское изображение. Изображение в белом свете, рамановское изображение и спектр SERS для (A) n = 2 и (B) n = 3; i) изображение в белом свете в широком поле зрения, ii) изображение в белом свете в области, где было получено рамановское изображение (обозначено красным квадратом в i)), iii) рамановское изображение двух компонентов, объединенных вместе, iv) рамановское изображение компонента 1 и его v) спектр SERS iv), vi) рамановское изображение компонента 2, и vii) спектр SERS vi). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
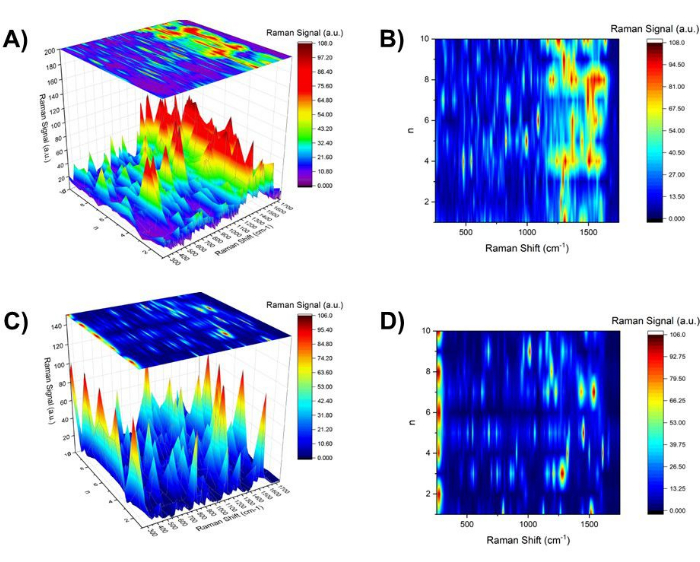
Рисунок 5: Контурная карта спектра SERS для nнечетных, nчетных и nвсех. (A) Трехмерная карта спектра SERS в районе 250 см-1 и 1750 см-1 в зависимости от n для Aβ1-40 покрытого 20 нм золота с контурной картой, показанной на рисунке (B) сверху. (C) Трехмерная карта спектра SERS в районе 250 см-1 и 1750 см-1 в зависимости от n для золота 20 нм с контурной картой, показанной на рисунке (D) сверху. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Контурная карта спектра SERS. Контурная карта спектра SERS в зависимости от n (1-10). (A) Поглощение на 1395 см-1 (синий) и 761 см-1 (красный). (Б-Г) Нижняя панель показывает спектр SERS, а правая панель показывает амплитуду изменения интенсивности сигнала сигналов SERS в каждом n. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
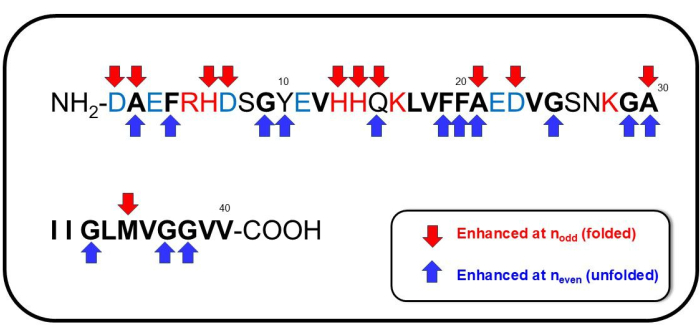
Рисунок 7: Примечательные последовательности Aβ1-40. Последовательности, которым присвоено значительное участие при nнечетных значениях (соответствующих образованию складчатой конформации), обозначены красными стрелками вниз, а последовательности, отнесенные к значительному участию при nчетных числах (соответствующих образованию развернутой конформации), обозначены синими стрелками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Видео 1: pH-зависимое изменение цвета Aβ1-40 и коллоида голого золота 20 нм. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Обсуждение
Критическим фактором в исследованиях конформации пептидов является поддержание образцов, так как образцы могут испортиться при неправильном хранении. Образцы пептидов были получены в лиофилизированной форме и начинали денатурировать после их регидратации дистиллированной деионизированной водой, даже когда они хранились при температуре -80 °C. Чистота коллоидов золота была проверена с помощью анализа контроля качества. Чтобы сохранить стабильность коллоидов, их хранили при температуре 4 °C и не замораживали. Растворы коллоидов золота готовили свежими для каждого эксперимента, потому что буферный раствор солей дестабилизировал бы коллоид золота. Растворы HCl и NaOH готовились свежими для каждого эксперимента.
Технические трудности, связанные с ручным считыванием и регистрацией pH раствора с помощью чувствительных инструментов при изменении pH от 4 до 10, ограничивают точность наших результатов. Таким образом, мы не наблюдали последовательных результатов в интенсивности сигналов SERS. Это, вероятно, внесло ошибку в амплитуду, которая использовалась для контурного графика. Будущая работа по проверке мод, связанных с nчетными или nнечетными, может привести к мутациям для замещения аминокислот в последовательности Aβ 1-40, которые, как мы сообщаем, участвуют в конформационных изменениях белка, таких как одиночные остатки тирозина или аспарагина.
«Взаимодействие между мономером Aβ1-40 и поверхностью золота считается дипольным взаимодействием, а уровень водородных связей был предложен в работе Х. Шмидбауэра и др.55. В отдельной работе мы исследовали спектроскопию SERS в зависимости от количества Aβ1-40 в кислом состоянии, в котором выделяется наноразмерно-зависимое адсорбционное образование56. Предполагается, что для золота с длиной волны 20 нм связь C=C или -C-N гистидина (His) инициирует адсорбцию; Однако для золота с длиной волны 80 нм бензольное кольцо в режиме дыхания фенилаланина (Phe) или тирозина (Tyr) достигало поверхности золота для инициирования адсорбции. Считалось, что процесс адсорбции Aβ1-40 на поверхности золота при нейтральных или основных условиях (pH ~ 10) поддерживает гидрофильность коллоида золота, покрытого покрытием Aβ1-40 , поскольку в водном состоянии не образовываются осадки. Тем не менее, осадки наблюдались при pH 4, что означает, что агрегаты были гидрофобными.
Изображения ПЭМ и изображения в белом свете лишь косвенно свидетельствуют об агрегации. Мы попытались провести спектроскопию кругового дихроизма (CD) для корреляции морфологии, наблюдаемой в обратимой агрегации, с вторичными структурами. Однако рассеивающие базовые линии не позволили нам получить воспроизводимые сигналы CD. Поэтому вместо этого мы использовали рамановскую спектроскопию, уделяя больше внимания модам, усиливающимся либо при агрегации (развернутой конформации Aβ1-40) при pH ~4, либо при дезагрегировании (развернутой конформации Aβ1-40) при pH ~10. Таким образом, наилучшее предположение для идентификации вторичной структуры в этой работе было ограничено мониторингом узлов, связанных со вторичными структурами. Это было продемонстрировано при наблюдении за листом β при 1628 см-1, особенно при pH 4.
В этом исследовании наблюдалось изменение конформации пептидов только для коллоидов золота диаметром 20 нм и изучалось только до 10 нм. Конформационные и агрегационные свойства пептида Aβ 1-40 могут быть изменены в зависимости от размера частицы, которую они адсорбируют до56. Таким образом, необходима дополнительная работа, чтобы понять свойства пептидов, которые основаны на сетевом соединении между мономерами и теми, на которые влияют физические характеристики адсорбционной поверхности. В условиях, которые мы тестировали, только коллоиды золота диаметром 20 нм проявляли обратимость морфологии агрегации, и механизмы влияния диаметра коллоида на обратимость этого свойства неизвестны. Увеличение n до 20 может дать более глубокое понимание модовозависимой степени обратимости морфологии агрегации. Эти исследования того, как размер коллоида золота влияет на агрегацию бета-амилоидных пептидов, позволят получить важное представление о молекулярных механизмах патологии болезни Альцгеймера.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов в связи с этой работой, которую можно было бы раскрыть.
Благодарности
K.Y. поддерживается грантом NSF-MRI #2117780. Фонд Geneseo поддержал начальный этап этого проекта. А. И. благодарен Летней исследовательской стипендии выпускников химического факультета SUNY Geneseo (премия Родса '19 и премия Липковица '20) и стипендии Фонда Дрейфуса для летних исследований бакалавриата за их поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Amyloid beta peptide 1-40 (Aβ1–40 peptide) | r-Peptide (Bogart, GA, USA) | A-1156-2 | |
| CCD digital camera | AMT | XR-40 4-megapixel CCD | |
| Distilled deionized water from Milli-Q- water system | Millipore Sigma (Burlington, MA, USA) | Milli-Q IQ 7000 | |
| Freezer -86 oC | Thermo Scientific | Revco Chilly Willy RLE Series Unit ID 187004 Build Number 40.04 | |
| Gold Colloid (10 nm) | Ted Pella, Inc. (Redding, California, USA) | 15703-20 | |
| Gold Colloid (100 nm) | Ted Pella, Inc. (Redding, California, USA) | 15711-22 | |
| Gold Colloid (15 nm) | Ted Pella, Inc. (Redding, California, USA) | 15704-20 | |
| Gold Colloid (20 nm) | Ted Pella, Inc. (Redding, California, USA) | 15705-20 | |
| Gold Colloid (30 nm) | Ted Pella, Inc. (Redding, California, USA) | 15706-21 | |
| Gold Colloid (40 nm) | Ted Pella, Inc. (Redding, California, USA) | 15707-21 | |
| Gold Colloid (50 nm) | Ted Pella, Inc. (Redding, California, USA) | 15708-21 | |
| Gold Colloid (60 nm) | Ted Pella, Inc. (Redding, California, USA) | 15709-22 | |
| Gold Colloid (80 nm) | Ted Pella, Inc. (Redding, California, USA) | 15710-22 | |
| Highest Grade V1AFM Mica Discs 10 mm | Ted Pella Inc. | #50 | |
| Hydrochloric Acid Standard Solution, 1.0 N | Fluka | Lot# SHBB4705V 318949-2L | |
| Macro quartz quvette Light Path 10 mm | Fire Fly Science | Type1-MC-Path10mm | |
| Micro pH electrode | HORIBA | Model 9618S (MFG No. 9Y8E0050) | |
| Peak Fit Program | Origin (Northampton, MA, USA) | OriginPro2018b (64-bit) b9.5.5.409 (Academic) | |
| pH 4.00 Buffer solution | VWR | Cat No. 34170-127 | |
| pH 7.00 Buffer Solution | Fisher Chemical | SB107-4 Lot 191041 | |
| pH meter | HORIBA | Model F-72G (MFG No. B27M0017) | |
| Pipet Tips Maxi Tips 1–5 mL | Fisher | 02-707-467 | |
| Pipet Tips 10 mL | Fisher | 02-717-135 | |
| Pipet Tips 1000 mL | Fisher | 02-717-156 | |
| Pipet Tips 1–200 mL | Fisher | 02-717-143 | |
| Pipetter Fisher Brand Elite 0.5–5 mL | Fisher | QU05317 | |
| Pipetter Fisher Brand Elite 100–1000 mL | Fisher | QU01672 | |
| Pipetter Fisher Brand Elite 10–100 mL | Fisher | MU10985 | |
| Pipetter Fisher Brand Elite 1–10 mL | Fisher | MU08178 | |
| Sodium Hydroxide Solution 1.0 M | Fluka | Lot#05096BPV 319511-2L | |
| TEM | FEI Co | Morgagni model 268 | |
| TempAssure PCR Tubes, Flat Caps, Natural | USA Scientific | polypropylene. 0.2 mL individual thin-wall tubes with attached frosted flat caps | |
| UV-Vis-NIR Spectrophotometer | Varian | CARY 5000 UV1106M074 | |
| WI Tec alpha300R Confocal Raman Microscope | WITec-Oxford Instrument | XMB3000-3001 |
Ссылки
- Kirschner, D. A., et al. Synthetic peptide homologous to beta protein from Alzheimer disease forms amyloid-like fibrils in vitro. Proc Natl Acad Sci U S A. 84 (19), 6953-6957 (1987).
- Lomakin, A., Chung, D. S., Benedek, G. B., Kirshner, D. A., Teplow, D. B. On the nucleation and growth of amyloid -protein fibrils: detection of nuclei and quantitation of rate constants. Proc Natl Acad Sci U S A. 93 (3), 1125-1129 (1996).
- Walsh, D. M., Lomakin, A., Benedek, G. B., Condron, M. M., Teplow, D. B. Amyloid -protein fibrillogenesis. J Biolog Chem. 272 (3), 22364-22372 (1997).
- Lambert, M. P., et al. nonfibrillar ligands derived from Ab1-42 are potent central nervous system neurotoxins. Proc Natl Acad Sci U S A. 95 (11), 6448-6453 (1998).
- Bucciantini, M., et al. Inherent toxicity of aggregates implies a common mechanism for protein misfolding diseases. Nature. 416 (6880), 507-511 (2002).
- Walsh, D. M., et al. Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo. Nature. 416 (6880), 535-539 (2002).
- Rocha, S., et al. Adsorption of amyloid beta-peptide at polymer surfaces: A neutron reflectivity study. ChemPhysChem. 6 (12), 2527-2534 (2005).
- Attanasio, F., et al. Carnosine inhibits Ab1-42 aggregation by perturbing the H-bond network in and around the central hydrophobic cluster. ChemBioChem. 14 (5), 583-592 (2013).
- Politi, J., Spadavecchia, J., Iodice, M., de Stefano, L. Oligopeptide-heavy metal interaction monitoring by hybrid gold nanoparticle based assay. Analyst. 140 (1), 149-155 (2015).
- Moshe, A., Landau, M., Eisenberg, D. Preparation of Crystalline samples of amyloid fibrils and oligomers. Methods Mol Biol. 1345, 201-210 (2016).
- Scarff, C. A., Ashcroft, A. E., Radford, S. E. Characterization of amyloid oligomers by electrospray ionization-ion mobility spectrometry-mass spectrometry (ESI-IMS-MS). Methods Mol Biol. 1345, 115-132 (2016).
- Sabaté, R., Gallardo, M., Estelrich, J. Temperature dependence of the nucleation constant rate in β amyloid fibrillogenesis. Int J Biol Macromol. 35 (1-2), 9-13 (2005).
- Niraula, T. N., et al. Pressure-dissociable reversible assembly of intrinsically denatured lysozyme is a precursor for amyloid fibrils. Proc Natl Acad Sci U S A. 101 (12), 4089-4093 (2004).
- Miller, A. E., et al. Behavior of β-Amyloid 1-16 at the air-water interface at varying pH by nonlinear spectroscopy and molecular dynamics simulations. J Phys Chem A. 115 (23), 5873-5880 (2011).
- Majzika, A., et al. Functionalization of gold nanoparticles with amino acid, -amyloid peptides and fragment. Colloids Surf B Biointerfaces. 81 (1), 235-241 (2010).
- Liu, L., et al. Electrochemical detectionof β-amyloid peptides on electrode covered with N-terminus-specific antibody based on electrocatalytic O2 reduction by Aβ(1-16)-heme-modified gold nanoparticles. Biosens Bioelectron. 49, 231-235 (2013).
- Elbassal, E. A., et al. Gold Nanoparticles as a Probe for Amyloid-β Oligomer and Amyloid Formation. J Phys Chem C Nanomater Interfaces. 121 (36), 20007-20015 (2017).
- Olmedo, I., et al. How changes in the sequence of the peptide CLPFFD-NH2 can modify the conjugation and stability of gold nanoparticles and their affinity for beta-amyloid fibrils. Bioconjug Chem. 19 (16), 1154-1163 (2008).
- Xu, Y., et al. Attenuation of the aggregation and neurotoxicity of amyloid peptides with neurotransmitter-functionalized ultra-small-sized gold nanoparticles. Eng Sci. 6, 53-63 (2019).
- John, T., Gladytz, A. K., Martin Clemens, L. L., Risselada, H. J., Abel, B. Impact of nanoparticles on amyloid peptide and protein aggregation: A review with a focus on gold nanoparticles. Nanoscale. 45, 20894-20913 (2018).
- Li, J., et al. Reduced aggregation and cytotoxicity of amyloid peptides by graphene oxide/gold nanocomposites prepared by pulsed laser ablation in water. Small. 10 (21), 4386-4394 (2014).
- Araya, E., et al. Gold nanoparticles and microwave irradiation Inhibit beta-amyloid amyloidogenesis. Nanoscale Res Lett. 3, 435 (2008).
- Barrow, C. J., Yasuda, A., Kenny, P. T., Zagorski, M. G. Solution conformations and aggregational properties of synthetic amyloid beta-peptides of Alzheimer's disease. Analysis of circular dichroism spectra. J Mol Biol. 225 (4), 1075-1093 (1992).
- Wood, S. J., MacKenzie, L., Maleeff, B., Hurle, M. R., Wetzel, R. Selective inhibition of Ab fibril formation. J Biolog Chem. 271 (8), 4086-4092 (1996).
- Yokoyama, K. Nanoscale Surface Size Dependence in Protein Conjugation. Advances in Nanotechnology. , (2010).
- Yokoyama, K. Nanoscale Protein Conjugation. Advances in Nanotechnology. , (2010).
- Yokoyama, K. . Modeling of Reversible Protein Conjugation on Nanoscale Surface in Computational Nanotechnology: Modeling and Applications with MATLAB. , (2011).
- Yokoyama, K. Nano Size Dependent Properties of Colloidal Surfaces. Colloids: Classification, Properties and Applications. , (2012).
- Yokoyama, K. Controlling Reversible Self-Assembly Path of Amyloid Beta Peptide over Gold Colloidal Nanoparticle's Surface. Nanoscale Spectroscopy with Applications. , (2013).
- Yokoyama, K., et al. Nanoscale size dependence in the conjugation of amyloid beta and ovalbumin proteins on the surface of gold colloidal particles. Nanotechnology. 19, 375101 (2008).
- Yokoyama, K., Welchons, D. R. The conjugation of amyloid beta protein on the gold colloidal nanoparticles' surfaces. Nanotechnology. 18, 105101 (2007).
- Edelhoch, H. Spectroscopic determination of tryptophan and tyrosine in proteins. Biochemistry. 6 (7), 1948-1954 (1967).
- Yokoyama, K., et al. Examination of adsorption orientation of amyloidogenic peptides over nano-gold colloidal particles surfaces. Int J Mol Sci. 20 (21), 5354-5380 (2019).
- Yokoyama, K., Ichiki, A. Oligomerization and Adsorption Orientation of Amyloidogenic Peptides over Nano-Gold Colloidal Particle Surfaces. Advances in Chemistry Research. , (2020).
- Fan, X., Zheng, W., Singh, D. J. Light scattering and surface plasmons on small spherical particles. Light Sci Appl. 3, e179 (2014).
- Yokoyama, K., et al. Microscopic investigation of reversible nanoscale surface size dependent protein conjugation. Int J Mol Sci. 10 (5), 2348-2366 (2009).
- Vishwanathan, K. Symmetry of gold neutral clusters Au3-20 and normal modes of vibrations by using the numerical finite difference method with density-functional tight-binding (DFTB) approach. Arch Chem Res. 2 (1), 4 (2017).
- Gao, P., Weaver, M. J. Metal-adsorbate vibrational frequencies as a probe of surface bonding: halides and pseudohalides at gold electrodes. J Phys Chem. 90, 4057-4063 (1986).
- Stewart, S., Fredericks, P. M. Surface-enhanced raman spectroscopy of peptides and proteins adsorbed on an electrochemically prepared silver surface. Spectrochim Acta AMol Biomol Spectrosc. 55 (7-8), 1615-1640 (1999).
- Palings, I., et al. Assignment of fingerprint vibrations in the resonance Raman spectra of rhodopsin, isorhodopsin, and bathorhodopsin: Implications for chromophore structure and environment. Biochem. 26 (9), 2544-2556 (1987).
- Szekeres, G. P., Kneipp, J. SERS probing of proteins in gold nanoparticle agglomerates. Front Chem. 7, 30 (2019).
- Lin, V. J. C., Koenig, J. L. Raman studies of bovine serum albumin. Biopolymers. 15 (1), 203-218 (1976).
- Hornemann, A., Drescher, D., Flemig, S., Kneipp, J. Intracellular SERS hybrid probes using BSA-reporter conjugates. Anal Bioanal Chem. 405 (19), 6209-6222 (2013).
- Dong, J., et al. Metal binding and oxidation of amyloid-beta within isolated senile plaque cores: Raman microscopic evidence. Biochemistry. 42 (10), 2768-2773 (2003).
- Carey, P. R. . Biochemical Applications of Raman and Resonance Raman Spectroscopies. , (1982).
- Harada, I., Takeuchi, H. Raman and Ultraviolet Resonance Raman Spectra of Proteins and Related Compounds. Spectroscopy of Biological Systems : Advances in Infrared and Raman Spectroscopy. , (1986).
- Overman, S. A., Thomas, G. J. Raman markers of nonaromatic side chains in an α-helix assembly: Ala, Asp, GGly, Ile, Leu, Lys, Ser, and Val residues of phage fd subunits. Biochemistry. 38 (13), 4018-4027 (1999).
- Talaga, D., et al. Total internal reflection tip-enhanced Raman spectroscopy of tau fibrils. J Phys Chem B. 126 (27), 5024-5032 (2022).
- Grys, D. -. B., et al. Citrate coordination and bridging of gold nanoparticles: The role of gold adatoms in AuNP aging. ACS Nano. 14 (7), 8689-8696 (2020).
- Guo, T., et al. Full-scale label-free surface-enhanced Raman scattering analysis of mouse brain using a black phosphorus-based two-dimensional nanoprobe. Appl Sci. 9 (3), 398-408 (2019).
- Walther, M., Plochocka, P., Fischer, B., Helm, H., Uhd Jepsen, P. Collective vibrational modes in biological molecules investigated by Terahertz time-domain spectroscopy. Biopolymers. 67 (4-5), 310-313 (2002).
- Lochocki, B., et al. label-free fluorescence and Raman imaging of amyloid deposits in snap-frozen Alzheimer's disease human brain tissue. Commun Biol. 4 (1), 474-486 (2021).
- Palombo, F., et al. Detection of Aβ plaque-associated astrogliosis in Alzheimer's disease brain by spectroscopic imaging and immunohistochemistry. Analyst. 143 (4), 850-857 (2018).
- Khoury, Y. E., et al. Raman imaging reveals accumulation of hemoproteins in plaques from Alzheimer's diseased tissues. ACS Chem Neurosci. 12 (15), 2940-2945 (2021).
- Schmidbaur, H., Raubenheimer, H. G., Dobrzańska, L. The gold-hydrogen bond, Au-H, and the hydrogen bond to gold Au∙∙∙H-X. Chem Soc Rev. 43 (1), 345-380 (2014).
- Yokoyama, K., et al. Protein corona formation and aggregation process of amyloid beta 1-40 coated gold nano-colloids. Langmuir. 40 (3), 1728-1746 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены