Method Article
Caratterizzazione dell'autoassemblaggio reversibile pH-dipendente di colloidi d'oro rivestiti di amiloide beta 1-40
In questo articolo
Riepilogo
Qui, presentiamo un metodo sistematico che descrive l'auto-assemblaggio quasi reversibile degli aggregati d'oro da 20 nm rivestiti di amiloide-beta 1-40 (Aβ 1-40). Il networking quasi reversibile nano-dipendente tra i peptidi è stato correlato con specifici amminoacidi o sezioni del monomero Aβ 1-40.
Abstract
La caratterizzazione di Aβ 1-40 rivestita sulle superfici delle particelle colloidali di nano-oro è stata condotta utilizzando la spettroscopia di risonanza plasmonica di superficie (SPR) e la microscopia elettronica a trasmissione (TEM). Lo spostamento pH-dipendente osservato della banda SPR delle particelle d'oro da 20 nm rivestite di Aβ 1-40 è stato correlato con l'alternanza di aggregazione e disaggregazione osservata nelle immagini TEM. Un pH di ~4 induceva una conformazione dispiegata e un pH di ~10 induceva una conformazione ripiegata di Aβ 1-40 sulla superficie dell'oro. Questo processo di aggregazione reversibile è stato osservato dall'imaging Raman quando il pH è stato gradualmente modificato da pH 4 a pH 10. Abbiamo osservato un cambiamento morfologico dipendente dal pH in Aβ 1-40 sulla superficie dell'oro, dove sono stati osservati aggregati chiari a pH 4. Tuttavia, abbiamo osservato differenze molto sottili nello spettro della spettroscopia Raman potenziata dalla superficie (SERS) tra le condizioni di pH 4 e pH 10, con la differenza più evidente che è la densità spettrale nella regione di 250 cm-1 e 1750 cm-1. In particolare, l'analisi modale dell'aggregazione reversibile ha indicato che gli aggregati erano formati dalla conformazione dispiegata di Aβ 1-40 che coinvolgeva la sezione dell'anello benzenico di tirosina e fenilalanina. Al contrario, il disassemblaggio degli aggregati è stato associato a cambiamenti conformazionali nel ripiegamento proteico di Aβ 1-40 che coinvolgono istidina, glutammina, metionina e acido aspartico.
Introduzione
La fibrillogenesi dei peptidi di amiloide-beta 1-40 (Aβ 1-40) o 1-42 (Aβ 1-42) è stata ampiamente studiata come componente critico nella formazione delle placche amiloidi che sono una causa della malattia di Alzheimer 1,2,3,4,5,6,7,8,9,10 ,11. Il meccanismo chiave nella fibrillogenesi è un'oligomerizzazione dei peptidi Aβ 1-40 o Aβ 1-42 per formare un aggregato proteico neurotossico e sono state condotte indagini approfondite per comprendere i meccanismi di come i monomeri formano gli oligomeri 12,13,14. Abbiamo intrapreso un approccio di esame dei peptidi amiloidogenici che formano aggregati su una superficie di nano-oro e l'identificazione dei fattori responsabili della rete tra peptidi che sono lontani dalla superficie dell'oro 15,16,17,18,19,20,21,22.
Aβ 1-40 adotta una conformazione dispiegata (A) in condizioni acide (pH ~4) e una conformazione ripiegata (B) in condizioni basiche (pH ~10). Abbiamo osservato particelle colloidali d'oro rivestite di Aβ 1-40 disperse a pH ~10 e grandi aggregati colloidali d'oro rivestiti di Aβ 1-40 a pH~4 (Figura 1)23,24. La conformazione dispiegata di Aβ 1-40, in condizioni acide, favorisce il networking peptidico tra i monomeri Aβ 1-40 sulla superficie delle nanoparticelle d'oro, con conseguente formazione di aggregati colloidali d'oro (Vedi A in Figura 1). Quando il monomero Aβ 1-40 mantiene la conformazione ripiegata a un pH basico o neutro, Aβ 1-40, i monomeri non si reticolano in aggregati e le nanoparticelle d'oro rivestite rimangono come singole particelle disperse (vedi B nella Figura 1). Possiamo, quindi, interrogare il processo di come i peptidi Aβ 1-40 subiscono cambiamenti conformazionali alla rete e formano aggregati misurando lo spostamento della banda SPR su un intervallo di condizioni di pH 25,26,27,28,29,30,31.
Abbiamo testato diverse dimensioni di nanoparticelle d'oro e abbiamo scoperto che il colloide d'oro da 20 nm mostrava il più importante processo di autoassemblaggio reversibile dei monomeri Aβ 1-40 in risposta a un cambiamento esterno del pH (Figura 2). Questa è una chiara indicazione di un cambiamento reversibile nella conformazione peptidica, in cui le condizioni acide (A) inducono una conformazione dispiegata, migliorando la rete e portando all'aggregazione di colloidi d'oro. Si è scoperto che la condizione di base (B) induce una conformazione ripiegata dei monomeri 26,27,28,29,30,31.
Protocollo
1. Preparazione di nanoparticelle d'oro rivestite Aβ 1-40
- Aggiungere un volume di 1 mL di acqua distillata deionizzata a 1 mg di Aβ 1-40 liofilizzato (MW: 4,2 kDa, purezza HPLC al 98%) utilizzando un ago per siringa. Miscelare la soluzione con un miscelatore a vortice per circa 30 s e assicurarsi che non si osservino particelle solide nella soluzione a temperatura ambiente (RT; ~20 °C).
- Preparare tutte le soluzioni madre utilizzando acqua deionizzata e distillata (~18 MΩ·cm).
- Identifica spettroscopicamente la concentrazione utilizzando l'assorbimento della tirosina a 275 nm32, che ha un coefficiente di estinzione molecolare ε275 di 1390 cm-1· M-1.
- Conservare le soluzioni madre di Aβ 1-40 a -80 °C. (Vedi Tabella dei materiali per i prodotti commerciali di Aβ 1-40.)
- Scongelare la soluzione madre di peptidi circa 5 minuti prima della raccolta dei dati. Miscelare un volume di 8 μl della soluzione peptidica con 800 μl di particelle colloidali d'oro in una provetta da centrifuga da 15 mL. Aggiungere un volume di 4,2 mL di acqua distillata deionizzata e quindi agitare il campione per 10 s 30,31,33,34.
- Fissare la concentrazione di peptidi Aβ 1-40 a 1,8 nmol e variare il rapporto tra peptidi Aβ 1-40. Il numero di colloidi d'oro variava tra ~500:1 e ~2000:125.
2. Variazione iterativa del pH e monitoraggio del corrispondente spostamento della banda SPR
- Impostare la temperatura della soluzione a un determinato valore (ad es. 25 °C) utilizzando l'unità di controllo della temperatura dello spettrofotometro ultravioletto-visibile-vicino infrarosso (UV-Vis-NIR).
- Monitorare il pH iniziale della soluzione campione utilizzando un pHmetro e impostarlo leggermente al di sotto di pH 7. Raccogliere lo spettro di assorbimento nell'intervallo compreso tra 400 nm e 1000 nm.
- Modificare il pH del campione a ~pH 4 (cioè pH 4,0 ± 0,3) aggiungendo 10 μL di volumi di 0,1 M HCl e raccogliere lo spettro di assorbimento tra 400 nm e 1000 nm.
- Modificare il pH del campione a ~pH 10 (cioè pH 10 ± 0,3) aggiungendo 10 μL di volumi di 0,1 M NaOH e raccogliere lo spettro di assorbimento tra 400 nm e 1000 nm.
- Modificare il pH tra pH 4 e pH 10 con HCl e NaOH 10 volte e raccogliere lo spettro di assorbimento in modo continuo a 25 ± 0,2 °C29,30.
NOTA: Per tutte le soluzioni campione, la densità ottica del picco della banda SPR è stata mantenuta intorno a 0,2. È previsto un effetto tampone dovuto alla soluzione tampone residua in una soluzione. Pertanto, il valore finale del pH è stato determinato dopo la conferma dell'equilibrio. Il valore del pH è stato misurato direttamente in una cella in cuvetta campione utilizzando un micro elettrodo di pH, che ha una precisione di ±0,005 pH. - Ottenere il set di dati ASCII (American Standard Code for Information Interchange) delle lunghezze d'onda in funzione dell'assorbanza. Estrarre la posizione media dei picchi di banda utilizzando il programma Peak Fit .
- Traccia il set di dati per visualizzare la densità ottica in funzione della lunghezza d'onda (nm) utilizzando la funzione Traccia .
- Contrassegnare le lunghezze d'onda di picco iniziali λ1, λ2 e λ3 selezionando le loro posizioni approssimative nei dati tracciati e adattare i dati utilizzando la funzione RUN .
- Ottenere il grafico contenente il picco centrale di ciascuno (λi), XCi, con l'area di ogni banda (Ai).
- Esporta le posizioni e le aree dei picchi estratti in un foglio di calcolo e calcola la posizione media dei picchi a un dato pH.
- Determinare il fattore di ponderazione ai di ciascun centro di picco λi confrontando l'area della banda (Ai) con l'area totale delle bande intere come:
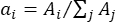 .
. - Estrarre la posizione media del picco,
 (pH) utilizzando Eqn. (1).
(pH) utilizzando Eqn. (1).
 (1)
(1)
- Determinare il fattore di ponderazione ai di ciascun centro di picco λi confrontando l'area della banda (Ai) con l'area totale delle bande intere come:
- Generare un grafico di reversibilità utilizzando il seguente processo:
- Tabella delle posizioni medie dei picchi,
 , in funzione di ciascun numero di "operazione", n come
, in funzione di ciascun numero di "operazione", n come  vs. n. Rendere il numero di operazione, n, 1 per il campione prima dell'aggiunta di acido a ~pH 7. Aumentare il numero di operazioni di 1 ogni volta, modificando il pH in ~pH4 con HCl o pH in ~pH 10 con NaOH. Fa n per essere pari a una condizione acida (cioè ~pH 4) e dispari per essere una condizione basica (cioè pH 10).
vs. n. Rendere il numero di operazione, n, 1 per il campione prima dell'aggiunta di acido a ~pH 7. Aumentare il numero di operazioni di 1 ogni volta, modificando il pH in ~pH4 con HCl o pH in ~pH 10 con NaOH. Fa n per essere pari a una condizione acida (cioè ~pH 4) e dispari per essere una condizione basica (cioè pH 10). - Analizza la posizione del picco ad ogni n,
 (n) = λ(n), utilizzando la formula30
(n) = λ(n), utilizzando la formula30
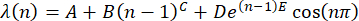 (2)
(2)
NOTA: Rappresentare una posizione di picco media iniziale a n = 1 per A. Esprimere i parametri B e C come spostamento della posizione di picco dipendente da n. Sia il parametro D come ampiezza del fattore di smorzamento, E, di ripetizione. Utilizzare la funzione seno per mostrare l'ondulazione della posizione del picco in funzione di n. - Trasporta il set di dati di (x, y) al software Origin e traccialo.
- Forma la funzione personalizzata data nell'Eqn. (2) in Funzione di adattamento della curva non lineare dell'analisi. Digitate i valori iniziali di A, B, C, D ed E e fate clic su RUN per completare l'adattamento.
- Tabella delle posizioni medie dei picchi,
- Imaging TEM
- Realizzare i campioni TEM dei colloidi d'oro da 20 nm rivestiti in Aβ 1-40 con griglie di rame rivestite in Formvar. Esaminare i campioni con un TEM funzionante a 80 kV.
- Raccogli immagini con un ingrandimento nominale di 28.000x o 71.000x su una fotocamera digitale CCD (AMT) XR-40 da 4 megapixel. Raccogli le immagini TEM per l'oro da 20 nm rivestito Aβ 1-40 ad ogni numero di operazione n = 1 (~pH 7), n = 2, 4, 6, 8 e 10 (pH 4) e n = 3, 5, 7 e 9 (pH 10).
3. Imaging Raman e studio dell'aggregazione reversibile
- Porre 100 μl di soluzione su un disco di mica (diametro di 1 cm) per ciascun campione al numero di operazione n. Asciugare i campioni durante la notte prima della misurazione.
- Raccogliere immagini a luce bianca ad ogni operazione numero n. Preparare il campione separato su un disco di mica poiché il pH è stato continuamente alterato tra ~pH 4 e ~pH 10 per ogni numero di operazione n (Figura 3).
- Raccogliere l'immagine Raman ad ogni numero di operazione n con un laser di una lunghezza d'onda di λ = 633 nm a 0,5 ± 0,05 mW di potenza con una risoluzione spaziale di ~0,43 μm in una griglia composta da 100 × 100 pixel con un tempo di integrazione di 500 ms/spettro per la regione compresa tra ~200 cm-1 e ~2.800 cm-1 (Figura 4).
- Tracciare lo spettro rappresentativo per ogni n allineato in funzione di n e costruire lo spettro SERS tridimensionale in funzione di n per Aβ1-40 rivestito in oro da 20 nm (Figura 5A). Utilizzare la vista dall'alto dello spettro SERS tridimensionale come mappa di contorno (Figura 5B) per estrarre le modalità specifiche associate a una particolare condizione di pH (ad esempio, ~pH 4 e ~pH 10). Estrae tutte le caratteristiche spettrali migliorate per solo npari o solo ndispari.
Risultati
Con l'attacco di Aβ 1-40 sulla superficie delle particelle nano-colloidali d'oro, la banda SPR intorno al massimo di assorbimento di 530 nm si è spostata significativamente verso il rosso fino alla posizione di picco di ~650 nm quando la soluzione è stata resa più acida (pH 4)35. Insieme alle immagini TEM, abbiamo identificato che le caratteristiche spettroscopiche osservate a pH 4 corrispondono alla formazione degli aggregati colloidali d'oro con conformazione plausibilmente dispiegata e rete con i monomeri Aβ 1-40 circostanti adsorbiti sulla superficie d'oro30. Abbiamo osservato che i monomeri Aβ 1-40 tornano alla conformazione ripiegata in condizioni basiche (pH 10), determinando una deformazione degli aggregati in modo quasi reversibile. Questo processo quasi reversibile era evidente dall'alternanza del picco medio di banda ( (n)), che si spostava tra una lunghezza d'onda più corta e una più lunga, e dalla morfologia dispersa rispetto all'aggregato nelle immagini TEM tra condizioni basiche (pH = 10) e acide (pH = 4). È stato precedentemente osservato che una porzione del monomero Aβ 1-40 rimane dispiegata anche dopo che la soluzione è stata riportata alle condizioni basiche36. Il video 1 mostra il cambiamento di colore dipendente dal pH di Aβ 1-40 e del colloide d'oro nudo da 20 nm.
(n)), che si spostava tra una lunghezza d'onda più corta e una più lunga, e dalla morfologia dispersa rispetto all'aggregato nelle immagini TEM tra condizioni basiche (pH = 10) e acide (pH = 4). È stato precedentemente osservato che una porzione del monomero Aβ 1-40 rimane dispiegata anche dopo che la soluzione è stata riportata alle condizioni basiche36. Il video 1 mostra il cambiamento di colore dipendente dal pH di Aβ 1-40 e del colloide d'oro nudo da 20 nm.
A titolo di confronto, è stata condotta l'indagine sul pH del luppolo di un colloide d'oro nudo a 20 nm (Figura 5C e D). Man mano che l'operazione di modifica del pH procedeva, ha mostrato la crescita della clusterizzazione dei colloidi d'oro in banda SPR, immagini TEM e immagini a luce bianca. Abbastanza interessante, c'erano diverse linee spettrali SERS che dipendevano da npari e ndispari. Ad esempio, a npari (pH ~4), la linea a 275 cm-1, che è stata assegnata come la modalità associata a Aun (n = 5, 6, 12, 16, 20, 58)37 o la modalità del ligando Au-Cl- 38 è stata osservata intensamente. D'altra parte, per npari, a 1008 cm-1 C-N str è stato osservato39 e CH2 wag39, CH2 la deformazione40 sono stati ampiamente osservati a 1291 cm-1.
In contrasto con la chiara morfologia di aggregazione reversibile e dipendente dal pH osservata dall'imaging a luce bianca, c'erano differenze relativamente sottili nelle caratteristiche spettrali nello spettro SERS tra npari e npari. In prima approssimazione, la densità della linea spettrale nella regione compresa tra 250 cm-1 e 1750 cm-1 era più alta per ndispari che per npari. Le linee spettrali nella regione dell'impronta digitale, 1250 cm-1 e 1750 cm-1 (bande Ammide I, II e III) per nodd hanno mostrato caratteristiche spettrali meno risolte, implicando un ampliamento o un aumento delle densità spettrali. Nella Figura 6, una mappa di contorno data nella Figura 5B (Figura 6B) è stata organizzata con i segnali SERS a 761 cm-1 (rosso) e 1395 cm-1 (blu), che rappresentano le enfasi rispettivamente a ndispari e npari (Figura 6C). Come spettro SERS rappresentativo per npari e dispari, lo spettro SERS a n = 7 (rosso) e n = 4 (blu) è mostrato in alto (Figura 6A). Al fine di mostrare la corrispondenza con lo spostamento di banda SPR per l'oro da 20 nm rivestito con Aβ1-40, il grafico dello spostamento di banda nella Figura 3 è mostrato a lato (Figura 6D).
Mentre abbiamo dati preliminari sull'assegnazione completa dello spettro SERS osservato, notiamo qui diverse caratteristiche notevoli dello spostamento Raman. Le linee spettrali e (assegnazioni plausibili) aumentate in nodd sono principalmente nella regione inferiore a 1000 cm-1: 394 cm-1 (Trp)41,42,43, 761 cm-1 (His, Ala)39,44,45,46,47, 875 cm-1 (spostamento dell'indolo NH, allungamento C-C di Met)39, 974 cm-1 (Glu, C-COO- stretching di Asp, modalità associata al citrato)39,48,49. Lo spostamento Raman potenziato a nha anche mostrato caratteristiche spettroscopiche significative nella regione dell'impronta digitale (Ammide I, II e III): 1166 cm-1 (deformazione N-H+ di Tyr)39,41, 1227 cm-1 (Ala-Pro-Gly, Ammide III)39,50,51, 1395 cm-1 (COO- allungamento simmetrico o CH2- CH3- forbice di Glu)39,48, 1585 cm-1 (allungamento CC dell'anello di Phe, allungamento asimmetrico del carbossilato -Au, COO- stiramento del citrato, deformazione dell'anello benzenico)39,41,45,46,47,49,52, 1592 cm-1 (Phe, Tyr, C=C allungamento di Tyr, CC stiramento dell'anello in Phe, allungamento dell'anello benzenico e COO- stretching in Phe e Tyr, e stretching asimmetrico di OH)39,41,48,50,51 e 1628 cm-1 (Amide I sub peak distintivo per strutture intermolecolari a foglioβ 53, C=O e i modi vibrazionali accoppiati CN/NH della spina dorsale proteica originata da strutture parallele di tipo β-sheet, accumulo di Aβ54 aggregato, bobine casuali, β-giri, β-forcine48. Le sequenze che appaiono per npari o dispari sono mostrate nella Figura 7. Nel complesso, per nanche corrispondente all'aggregazione reversibile o alla conformazione dispiegata di Aβ 1-40, Phe/Tyr contenente anello benzenico, lo stiramento simmetrico di COO-, la modalità di forbice CH 2- CH 3- di Glu e la deformazione -NH+ di Tyr sono stati significativamente coinvolti nel cambiamento conformazionale del peptide. Durante il disassemblaggio dell'aggregazione che è stato osservato quando i peptidi hanno adottato la conformazione ripiegata corrispondente ai modi prominenti a ndispari, Glu, Asp, Met, His e Ala sembravano essere coinvolti.

Figura 1: L'assorbanza e la morfologia dipendenti dal pH. Vengono mostrati lo spettro di assorbimento a pH 4 (A) e pH 10 (B) per nanoparticelle d'oro rivestite di Aβ 1-40 (20 nm) e le corrispondenti immagini TEM, schizzi di particelle di aggregazione/disperse e immagini di soluzioni in fiale. A è la conformazione dispiegata dei monomeri Aβ 1-40 in condizioni acide e B è la conformazione ripiegata in condizioni basiche. I diagrammi dei monomeri Aβ 1-40 in ciascuna conformazione e morfologia di aggregazione/dispersione sono mostrati accanto alle immagini TEM. Clicca qui per visualizzare una versione più grande di questa figura.
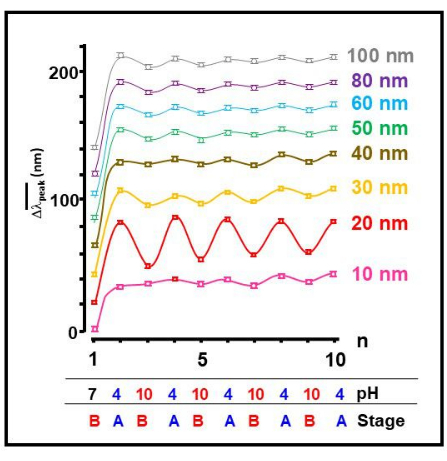
Figura 2: Reversibilità dell'autoassemblaggio dipendente dalle dimensioni nanometriche. Lo spostamento della posizione media del picco della banda SPR,  , in funzione del numero di operazione, n, per tutte le dimensioni testate delle particelle colloidali d'oro. Vengono forniti anche i valori approssimativi di pH e lo stadio corrispondente degli aggregati mostrati nella Figura 1 . Clicca qui per visualizzare una versione più grande di questa figura.
, in funzione del numero di operazione, n, per tutte le dimensioni testate delle particelle colloidali d'oro. Vengono forniti anche i valori approssimativi di pH e lo stadio corrispondente degli aggregati mostrati nella Figura 1 . Clicca qui per visualizzare una versione più grande di questa figura.
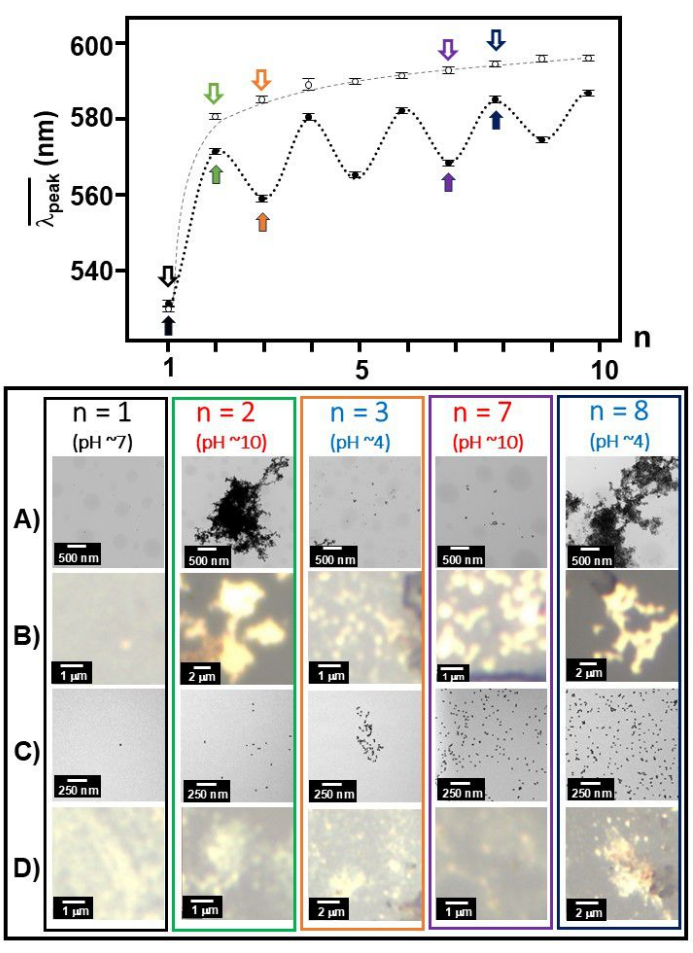
Figura 3:  e immagini TEM/luce bianca ad ogni numero di operazione. In
e immagini TEM/luce bianca ad ogni numero di operazione. In  funzione del numero di operazione, n, è stato tracciato insieme per Aβ 1-40 rivestito in oro da 20 nm (cerchi chiusi) e in oro da 20 nm colloidale (cerchi aperti) ed è mostrato con immagini rappresentative TEM (A e C)/a luce bianca (B e D) ai numeri di operazione selezionati (n = 1, 2, 3, 7 e 8 contrassegnati da frecce decodificate) per Aβ 1-40 rivestito in oro da 20 nm (A e B) e 20 nm in oro colloidale (C e D). Il carattere nero indica pH 7, il carattere blu indica pH 4 e il carattere rosso indica pH 10. Clicca qui per visualizzare una versione più grande di questa figura.
funzione del numero di operazione, n, è stato tracciato insieme per Aβ 1-40 rivestito in oro da 20 nm (cerchi chiusi) e in oro da 20 nm colloidale (cerchi aperti) ed è mostrato con immagini rappresentative TEM (A e C)/a luce bianca (B e D) ai numeri di operazione selezionati (n = 1, 2, 3, 7 e 8 contrassegnati da frecce decodificate) per Aβ 1-40 rivestito in oro da 20 nm (A e B) e 20 nm in oro colloidale (C e D). Il carattere nero indica pH 7, il carattere blu indica pH 4 e il carattere rosso indica pH 10. Clicca qui per visualizzare una versione più grande di questa figura.
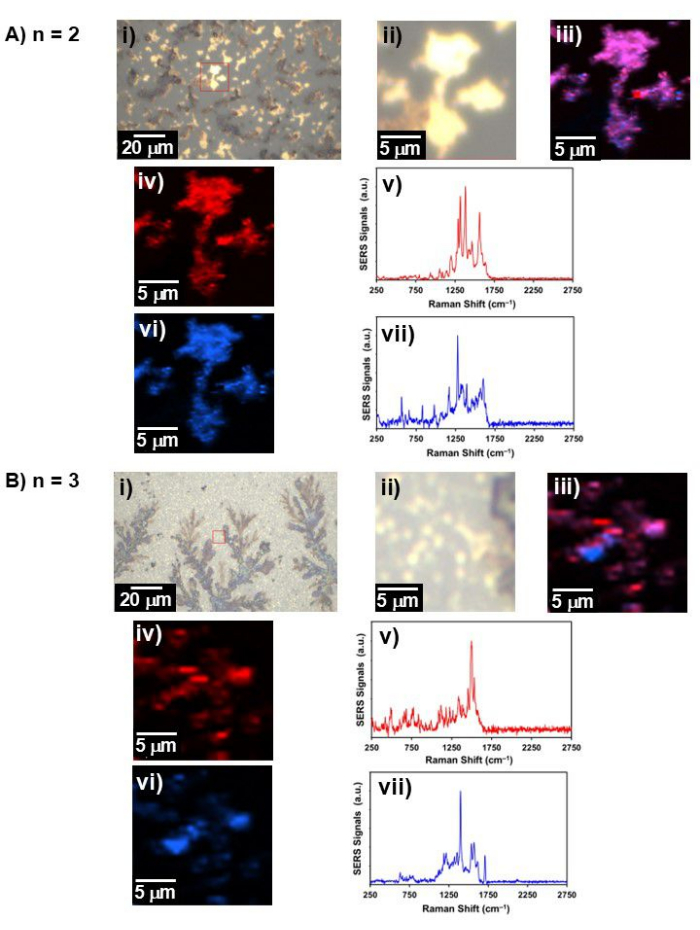
Figura 4: Luce bianca rappresentativa e immagine Raman. L'immagine a luce bianca, l'immagine Raman e lo spettro SERS per (A) n = 2 e (B) n = 3; i) immagine a luce bianca in un ampio campo visivo, ii) immagine a luce bianca nell'area in cui è stata raccolta l'immagine Raman (etichettata da un quadrato rosso in i)), iii) l'immagine Raman di due componenti combinati, iv) immagine Raman della componente 1 e il suo spettro v) SERS di iv), vi) immagine Raman della componente 2, e vii) spettro SERS di vi). Clicca qui per visualizzare una versione più grande di questa figura.
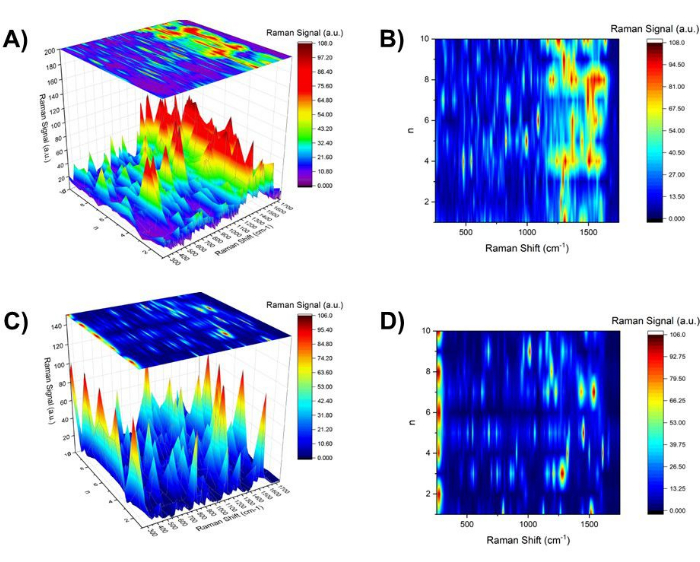
Figura 5: Mappa di contorno dello spettro SERS per ndispari, npari e ntutti. (A) La mappa tridimensionale dello spettro SERS nella regione di 250 cm-1 e 1750 cm-1 in funzione di n per Aβ1-40 rivestito di oro da 20 nm con una mappa di contorno mostrata in (B) in alto. (C) La mappa tridimensionale dello spettro SERS nella regione di 250 cm-1 e 1750 cm-1 in funzione di n per l'oro a 20 nm con una mappa di contorno mostrata in (D) in alto. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Mappa di contorno dello spettro SERS. La mappa di contorno dello spettro SERS in funzione di n (1-10). (A) Assorbanza a 1395 cm-1 (blu) e 761 cm-1 (rosso). (B-D) Il pannello inferiore mostra lo spettro SERS e il pannello destro mostra l'ampiezza della variazione di intensità del segnale dei segnali SERS ad ogni n. Fare clic qui per visualizzare una versione più grande di questa figura.
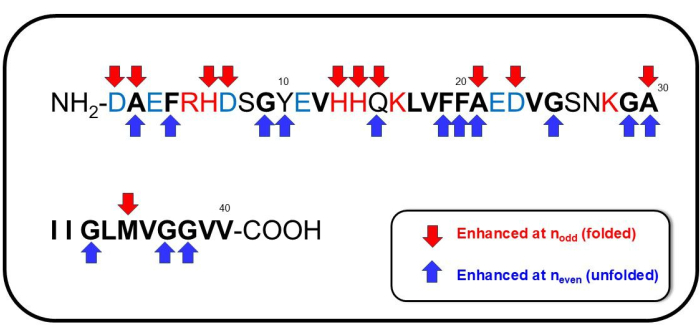
Figura 7: Sequenze notevoli di Aβ1-40. Le sequenze assegnate ad avere un coinvolgimento significativo a ndispari (corrispondente alla formazione di conformazione ripiegata) sono indicate da frecce rosse verso il basso, e quelle assegnate ad avere un coinvolgimento significativo a npari (corrispondente alla formazione di conformazione dispiegata) sono indicate da frecce blu. Clicca qui per visualizzare una versione più grande di questa figura.
Video 1: Variazione di colore dipendente dal pH di Aβ1-40 e colloide d'oro nudo da 20 nm. Clicca qui per scaricare questo video.
Discussione
Una considerazione fondamentale negli studi sulla conformazione dei peptidi è il mantenimento del campione, poiché i campioni si deteriorano se conservati in modo improprio. I campioni di peptidi sono stati ricevuti in forma liofilizzata e hanno iniziato a denaturarsi una volta reidratati con acqua distillata deionizzata, anche quando sono stati conservati a -80 °C. La purezza dei colloidi d'oro è stata verificata mediante analisi di controllo qualità. Per mantenere la stabilità dei colloidi, questi sono stati conservati a 4 °C e non congelati. Le soluzioni colloidali d'oro sono state preparate fresche per ogni esperimento perché la soluzione tampone di sali avrebbe destabilizzato il colloide d'oro. Le soluzioni di HCl e NaOH sono state preparate fresche per ogni esperimento.
Le sfide tecniche legate alla lettura e alla registrazione manuale del pH della soluzione con strumenti delicati e alla modifica del pH tra 4 e 10 limitano la precisione dei risultati riportati. Pertanto, non abbiamo osservato risultati coerenti nell'intensità dei segnali SERS. Questo probabilmente ha introdotto un errore nell'ampiezza utilizzata per il grafico di contorno. Il lavoro futuro per verificare le modalità associate a npari o ndispari potrebbe introdurre mutazioni per sostituire gli amminoacidi nella sequenza Aβ 1-40 che riportiamo essere coinvolti nel cambiamento conformazionale della proteina, come i singoli residui di tirosina o asparagina.
"L'interazione tra il monomero Aβ1-40 e la superficie dell'oro è considerata un'interazione di dipolo, e il livello di legame idrogeno è stato ipotizzato nel lavoro di H. Schmidbauer et al.55. In un lavoro separato, abbiamo studiato la spettroscopia SERS in funzione della quantità di Aβ1-40 in condizioni acide, ha estratto la formazione di adsorbimento dipendente dalle dimensioni nanometriche56. Per l'oro a 20 nm, si è ipotizzato che il legame C=C o -C-N dell'istidina (His) iniziasse l'adsorbimento; per l'oro a 80 nm, tuttavia, un modo di respirazione ad anello benzenico di fenilalanina (Phe) o tirosina (Tyr) ha raggiunto la superficie dell'oro per avviare l'adsorbimento. Si è ritenuto che il processo di adsorbimento di Aβ1-40 sulla superficie dell'oro in condizioni neutre o basiche (pH ~10) mantenga idrofilo il colloide d'oro rivestito di Aβ1-40 poiché non si sono formati precipitati allo stato acquoso. Tuttavia, i precipitati sono stati osservati a pH 4, il che implica che gli aggregati erano idrofobici.
Le immagini TEM e le immagini a luce bianca mostrano solo indirettamente la prova dell'aggregazione. Abbiamo tentato di condurre una spettroscopia di dicroismo circolare (CD) per correlare la morfologia osservata nell'aggregazione reversibile con le strutture secondarie. Tuttavia, le linee di base di scattering ci hanno impedito di ottenere segnali CD riproducibili. Invece, quindi, abbiamo utilizzato la spettroscopia Raman, concentrandoci maggiormente sui modi migliorati sia quando l'aggregazione (conformazione dispiegata di Aβ1-40) ha avuto luogo sotto pH ~4 sia quando la disaggregazione (conformazione dispiegata di Aβ1-40) sotto pH ~10. Pertanto, la migliore speculazione per identificare la struttura secondaria in questo lavoro è stata limitata al monitoraggio dei nodi associati alle strutture secondarie. Ciò è stato dimostrato nell'osservazione del foglio di β a 1628 cm-1, in particolare in condizioni di pH 4.
Questo studio ha osservato solo il cambiamento nella conformazione peptidica per i colloidi d'oro di 20 nm di diametro e ha studiato solo n fino a 10. Le proprietà di conformazione e aggregazione del peptide Aβ 1-40 potrebbero essere alterate dalla dimensione della particella che assorbono a56. Pertanto, è necessario ulteriore lavoro per comprendere le proprietà dei peptidi che si basano sulla rete tra monomeri e quelli che sono influenzati dalle caratteristiche fisiche della superficie di adsorbimento. Nelle condizioni che abbiamo testato, solo i colloidi d'oro di 20 nm di diametro hanno mostrato reversibilità della morfologia dell'aggregazione, e i meccanismi di come il diametro del colloide influenza la reversibilità di questa proprietà non sono noti. L'aumento di n fino a 20 potrebbe fornire maggiori informazioni sul grado di reversibilità della morfologia dell'aggregazione dipendente dalla modalità. Queste indagini su come le dimensioni del colloide d'oro influenzano l'aggregazione del peptide beta-amiloide produrranno importanti intuizioni sui meccanismi molecolari della patologia del morbo di Alzheimer.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse con questo lavoro da divulgare.
Riconoscimenti
K.Y. è supportato da NSF-MRI Grant #2117780. La Fondazione Geneseo ha sostenuto la fase iniziale di questo progetto. A. I. è grato alla borsa di studio estiva per la ricerca estiva degli alunni del Dipartimento di Chimica SUNY Geneseo ('19 Rhodes Award e '20 Lipkowitz Award) e alla borsa di studio per la ricerca estiva universitaria della Dreyfus Foundation per il loro sostegno.
Materiali
| Name | Company | Catalog Number | Comments |
| Amyloid beta peptide 1-40 (Aβ1–40 peptide) | r-Peptide (Bogart, GA, USA) | A-1156-2 | |
| CCD digital camera | AMT | XR-40 4-megapixel CCD | |
| Distilled deionized water from Milli-Q- water system | Millipore Sigma (Burlington, MA, USA) | Milli-Q IQ 7000 | |
| Freezer -86 oC | Thermo Scientific | Revco Chilly Willy RLE Series Unit ID 187004 Build Number 40.04 | |
| Gold Colloid (10 nm) | Ted Pella, Inc. (Redding, California, USA) | 15703-20 | |
| Gold Colloid (100 nm) | Ted Pella, Inc. (Redding, California, USA) | 15711-22 | |
| Gold Colloid (15 nm) | Ted Pella, Inc. (Redding, California, USA) | 15704-20 | |
| Gold Colloid (20 nm) | Ted Pella, Inc. (Redding, California, USA) | 15705-20 | |
| Gold Colloid (30 nm) | Ted Pella, Inc. (Redding, California, USA) | 15706-21 | |
| Gold Colloid (40 nm) | Ted Pella, Inc. (Redding, California, USA) | 15707-21 | |
| Gold Colloid (50 nm) | Ted Pella, Inc. (Redding, California, USA) | 15708-21 | |
| Gold Colloid (60 nm) | Ted Pella, Inc. (Redding, California, USA) | 15709-22 | |
| Gold Colloid (80 nm) | Ted Pella, Inc. (Redding, California, USA) | 15710-22 | |
| Highest Grade V1AFM Mica Discs 10 mm | Ted Pella Inc. | #50 | |
| Hydrochloric Acid Standard Solution, 1.0 N | Fluka | Lot# SHBB4705V 318949-2L | |
| Macro quartz quvette Light Path 10 mm | Fire Fly Science | Type1-MC-Path10mm | |
| Micro pH electrode | HORIBA | Model 9618S (MFG No. 9Y8E0050) | |
| Peak Fit Program | Origin (Northampton, MA, USA) | OriginPro2018b (64-bit) b9.5.5.409 (Academic) | |
| pH 4.00 Buffer solution | VWR | Cat No. 34170-127 | |
| pH 7.00 Buffer Solution | Fisher Chemical | SB107-4 Lot 191041 | |
| pH meter | HORIBA | Model F-72G (MFG No. B27M0017) | |
| Pipet Tips Maxi Tips 1–5 mL | Fisher | 02-707-467 | |
| Pipet Tips 10 mL | Fisher | 02-717-135 | |
| Pipet Tips 1000 mL | Fisher | 02-717-156 | |
| Pipet Tips 1–200 mL | Fisher | 02-717-143 | |
| Pipetter Fisher Brand Elite 0.5–5 mL | Fisher | QU05317 | |
| Pipetter Fisher Brand Elite 100–1000 mL | Fisher | QU01672 | |
| Pipetter Fisher Brand Elite 10–100 mL | Fisher | MU10985 | |
| Pipetter Fisher Brand Elite 1–10 mL | Fisher | MU08178 | |
| Sodium Hydroxide Solution 1.0 M | Fluka | Lot#05096BPV 319511-2L | |
| TEM | FEI Co | Morgagni model 268 | |
| TempAssure PCR Tubes, Flat Caps, Natural | USA Scientific | polypropylene. 0.2 mL individual thin-wall tubes with attached frosted flat caps | |
| UV-Vis-NIR Spectrophotometer | Varian | CARY 5000 UV1106M074 | |
| WI Tec alpha300R Confocal Raman Microscope | WITec-Oxford Instrument | XMB3000-3001 |
Riferimenti
- Kirschner, D. A., et al. Synthetic peptide homologous to beta protein from Alzheimer disease forms amyloid-like fibrils in vitro. Proc Natl Acad Sci U S A. 84 (19), 6953-6957 (1987).
- Lomakin, A., Chung, D. S., Benedek, G. B., Kirshner, D. A., Teplow, D. B. On the nucleation and growth of amyloid -protein fibrils: detection of nuclei and quantitation of rate constants. Proc Natl Acad Sci U S A. 93 (3), 1125-1129 (1996).
- Walsh, D. M., Lomakin, A., Benedek, G. B., Condron, M. M., Teplow, D. B. Amyloid -protein fibrillogenesis. J Biolog Chem. 272 (3), 22364-22372 (1997).
- Lambert, M. P., et al. nonfibrillar ligands derived from Ab1-42 are potent central nervous system neurotoxins. Proc Natl Acad Sci U S A. 95 (11), 6448-6453 (1998).
- Bucciantini, M., et al. Inherent toxicity of aggregates implies a common mechanism for protein misfolding diseases. Nature. 416 (6880), 507-511 (2002).
- Walsh, D. M., et al. Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo. Nature. 416 (6880), 535-539 (2002).
- Rocha, S., et al. Adsorption of amyloid beta-peptide at polymer surfaces: A neutron reflectivity study. ChemPhysChem. 6 (12), 2527-2534 (2005).
- Attanasio, F., et al. Carnosine inhibits Ab1-42 aggregation by perturbing the H-bond network in and around the central hydrophobic cluster. ChemBioChem. 14 (5), 583-592 (2013).
- Politi, J., Spadavecchia, J., Iodice, M., de Stefano, L. Oligopeptide-heavy metal interaction monitoring by hybrid gold nanoparticle based assay. Analyst. 140 (1), 149-155 (2015).
- Moshe, A., Landau, M., Eisenberg, D. Preparation of Crystalline samples of amyloid fibrils and oligomers. Methods Mol Biol. 1345, 201-210 (2016).
- Scarff, C. A., Ashcroft, A. E., Radford, S. E. Characterization of amyloid oligomers by electrospray ionization-ion mobility spectrometry-mass spectrometry (ESI-IMS-MS). Methods Mol Biol. 1345, 115-132 (2016).
- Sabaté, R., Gallardo, M., Estelrich, J. Temperature dependence of the nucleation constant rate in β amyloid fibrillogenesis. Int J Biol Macromol. 35 (1-2), 9-13 (2005).
- Niraula, T. N., et al. Pressure-dissociable reversible assembly of intrinsically denatured lysozyme is a precursor for amyloid fibrils. Proc Natl Acad Sci U S A. 101 (12), 4089-4093 (2004).
- Miller, A. E., et al. Behavior of β-Amyloid 1-16 at the air-water interface at varying pH by nonlinear spectroscopy and molecular dynamics simulations. J Phys Chem A. 115 (23), 5873-5880 (2011).
- Majzika, A., et al. Functionalization of gold nanoparticles with amino acid, -amyloid peptides and fragment. Colloids Surf B Biointerfaces. 81 (1), 235-241 (2010).
- Liu, L., et al. Electrochemical detectionof β-amyloid peptides on electrode covered with N-terminus-specific antibody based on electrocatalytic O2 reduction by Aβ(1-16)-heme-modified gold nanoparticles. Biosens Bioelectron. 49, 231-235 (2013).
- Elbassal, E. A., et al. Gold Nanoparticles as a Probe for Amyloid-β Oligomer and Amyloid Formation. J Phys Chem C Nanomater Interfaces. 121 (36), 20007-20015 (2017).
- Olmedo, I., et al. How changes in the sequence of the peptide CLPFFD-NH2 can modify the conjugation and stability of gold nanoparticles and their affinity for beta-amyloid fibrils. Bioconjug Chem. 19 (16), 1154-1163 (2008).
- Xu, Y., et al. Attenuation of the aggregation and neurotoxicity of amyloid peptides with neurotransmitter-functionalized ultra-small-sized gold nanoparticles. Eng Sci. 6, 53-63 (2019).
- John, T., Gladytz, A. K., Martin Clemens, L. L., Risselada, H. J., Abel, B. Impact of nanoparticles on amyloid peptide and protein aggregation: A review with a focus on gold nanoparticles. Nanoscale. 45, 20894-20913 (2018).
- Li, J., et al. Reduced aggregation and cytotoxicity of amyloid peptides by graphene oxide/gold nanocomposites prepared by pulsed laser ablation in water. Small. 10 (21), 4386-4394 (2014).
- Araya, E., et al. Gold nanoparticles and microwave irradiation Inhibit beta-amyloid amyloidogenesis. Nanoscale Res Lett. 3, 435 (2008).
- Barrow, C. J., Yasuda, A., Kenny, P. T., Zagorski, M. G. Solution conformations and aggregational properties of synthetic amyloid beta-peptides of Alzheimer's disease. Analysis of circular dichroism spectra. J Mol Biol. 225 (4), 1075-1093 (1992).
- Wood, S. J., MacKenzie, L., Maleeff, B., Hurle, M. R., Wetzel, R. Selective inhibition of Ab fibril formation. J Biolog Chem. 271 (8), 4086-4092 (1996).
- Yokoyama, K. Nanoscale Surface Size Dependence in Protein Conjugation. Advances in Nanotechnology. , (2010).
- Yokoyama, K. Nanoscale Protein Conjugation. Advances in Nanotechnology. , (2010).
- Yokoyama, K. . Modeling of Reversible Protein Conjugation on Nanoscale Surface in Computational Nanotechnology: Modeling and Applications with MATLAB. , (2011).
- Yokoyama, K. Nano Size Dependent Properties of Colloidal Surfaces. Colloids: Classification, Properties and Applications. , (2012).
- Yokoyama, K. Controlling Reversible Self-Assembly Path of Amyloid Beta Peptide over Gold Colloidal Nanoparticle's Surface. Nanoscale Spectroscopy with Applications. , (2013).
- Yokoyama, K., et al. Nanoscale size dependence in the conjugation of amyloid beta and ovalbumin proteins on the surface of gold colloidal particles. Nanotechnology. 19, 375101 (2008).
- Yokoyama, K., Welchons, D. R. The conjugation of amyloid beta protein on the gold colloidal nanoparticles' surfaces. Nanotechnology. 18, 105101 (2007).
- Edelhoch, H. Spectroscopic determination of tryptophan and tyrosine in proteins. Biochemistry. 6 (7), 1948-1954 (1967).
- Yokoyama, K., et al. Examination of adsorption orientation of amyloidogenic peptides over nano-gold colloidal particles surfaces. Int J Mol Sci. 20 (21), 5354-5380 (2019).
- Yokoyama, K., Ichiki, A. Oligomerization and Adsorption Orientation of Amyloidogenic Peptides over Nano-Gold Colloidal Particle Surfaces. Advances in Chemistry Research. , (2020).
- Fan, X., Zheng, W., Singh, D. J. Light scattering and surface plasmons on small spherical particles. Light Sci Appl. 3, e179 (2014).
- Yokoyama, K., et al. Microscopic investigation of reversible nanoscale surface size dependent protein conjugation. Int J Mol Sci. 10 (5), 2348-2366 (2009).
- Vishwanathan, K. Symmetry of gold neutral clusters Au3-20 and normal modes of vibrations by using the numerical finite difference method with density-functional tight-binding (DFTB) approach. Arch Chem Res. 2 (1), 4 (2017).
- Gao, P., Weaver, M. J. Metal-adsorbate vibrational frequencies as a probe of surface bonding: halides and pseudohalides at gold electrodes. J Phys Chem. 90, 4057-4063 (1986).
- Stewart, S., Fredericks, P. M. Surface-enhanced raman spectroscopy of peptides and proteins adsorbed on an electrochemically prepared silver surface. Spectrochim Acta AMol Biomol Spectrosc. 55 (7-8), 1615-1640 (1999).
- Palings, I., et al. Assignment of fingerprint vibrations in the resonance Raman spectra of rhodopsin, isorhodopsin, and bathorhodopsin: Implications for chromophore structure and environment. Biochem. 26 (9), 2544-2556 (1987).
- Szekeres, G. P., Kneipp, J. SERS probing of proteins in gold nanoparticle agglomerates. Front Chem. 7, 30 (2019).
- Lin, V. J. C., Koenig, J. L. Raman studies of bovine serum albumin. Biopolymers. 15 (1), 203-218 (1976).
- Hornemann, A., Drescher, D., Flemig, S., Kneipp, J. Intracellular SERS hybrid probes using BSA-reporter conjugates. Anal Bioanal Chem. 405 (19), 6209-6222 (2013).
- Dong, J., et al. Metal binding and oxidation of amyloid-beta within isolated senile plaque cores: Raman microscopic evidence. Biochemistry. 42 (10), 2768-2773 (2003).
- Carey, P. R. . Biochemical Applications of Raman and Resonance Raman Spectroscopies. , (1982).
- Harada, I., Takeuchi, H. Raman and Ultraviolet Resonance Raman Spectra of Proteins and Related Compounds. Spectroscopy of Biological Systems : Advances in Infrared and Raman Spectroscopy. , (1986).
- Overman, S. A., Thomas, G. J. Raman markers of nonaromatic side chains in an α-helix assembly: Ala, Asp, GGly, Ile, Leu, Lys, Ser, and Val residues of phage fd subunits. Biochemistry. 38 (13), 4018-4027 (1999).
- Talaga, D., et al. Total internal reflection tip-enhanced Raman spectroscopy of tau fibrils. J Phys Chem B. 126 (27), 5024-5032 (2022).
- Grys, D. -. B., et al. Citrate coordination and bridging of gold nanoparticles: The role of gold adatoms in AuNP aging. ACS Nano. 14 (7), 8689-8696 (2020).
- Guo, T., et al. Full-scale label-free surface-enhanced Raman scattering analysis of mouse brain using a black phosphorus-based two-dimensional nanoprobe. Appl Sci. 9 (3), 398-408 (2019).
- Walther, M., Plochocka, P., Fischer, B., Helm, H., Uhd Jepsen, P. Collective vibrational modes in biological molecules investigated by Terahertz time-domain spectroscopy. Biopolymers. 67 (4-5), 310-313 (2002).
- Lochocki, B., et al. label-free fluorescence and Raman imaging of amyloid deposits in snap-frozen Alzheimer's disease human brain tissue. Commun Biol. 4 (1), 474-486 (2021).
- Palombo, F., et al. Detection of Aβ plaque-associated astrogliosis in Alzheimer's disease brain by spectroscopic imaging and immunohistochemistry. Analyst. 143 (4), 850-857 (2018).
- Khoury, Y. E., et al. Raman imaging reveals accumulation of hemoproteins in plaques from Alzheimer's diseased tissues. ACS Chem Neurosci. 12 (15), 2940-2945 (2021).
- Schmidbaur, H., Raubenheimer, H. G., Dobrzańska, L. The gold-hydrogen bond, Au-H, and the hydrogen bond to gold Au∙∙∙H-X. Chem Soc Rev. 43 (1), 345-380 (2014).
- Yokoyama, K., et al. Protein corona formation and aggregation process of amyloid beta 1-40 coated gold nano-colloids. Langmuir. 40 (3), 1728-1746 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon