A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تجميع المفاعلات الحيوية للاستزراع المستمر لمجتمعات البراز المعقدة
In This Article
Summary
يوضح هذا البروتوكول بالتفصيل تجميع مصفوفات المفاعلات الحيوية الصغيرة لاستخدامها في زراعة التدفق المستمر لمجتمعات البراز المعقدة في ظل الظروف اللاهوائية. نناقش أيضا طرق تجميع المفاعلات وتلقيحها وأخذ عينات منها لمزيد من التحليل.
Abstract
تستجيب الجراثيم ، وخاصة البكتيريا ، للتعرضات البيئية المختلفة مثل المغذيات الدقيقة والكبيرة ، والمركبات الدوائية ، والوسطاء الالتهابيين ، والتي تغير ديناميكيا تكوين المجتمع وإنتاج التمثيل الغذائي الميكروبي. إن فهم كيفية تأثير ظروف الثقافة الفسيولوجية على المجتمعات الميكروبية وتنوعها وقدرتها الأيضية سيساهم في معرفة مهمة بتأثيرها على الصحة والأمراض. هنا ، نقدم بروتوكولا مقتبسا من القالب الذي نشره Auchtung et al. لإنشاء مصفوفات مفاعلات حيوية صغيرة يمكنها زراعة مجتمعات البراز المعقدة ، وتحديد الاتحادات البكتيرية أو السلالات المفردة في ظل ظروف دقيقة ، بما في ذلك توافر المغذيات ودرجة الحرارة ومعدل التدفق ودرجة الحموضة ومحتوى الأكسجين. نصف عملية بناء نظام المفاعل الحيوي المصغر ، بما في ذلك التكيفات لتحسين القيود في البروتوكول المنشور. نناقش أيضا إعداد نظام المفاعل الحيوي المصغر في ظل ظروف لاهوائية باستخدام وسائط MEGA (مقتبسة من Han et al.) ، وهي وسائط غنية تدعم نمو البكتيريا المتنوعة. نصف تلقيح عينات براز الفأر المتوافقة مع البشر في نظام المفاعل الحيوي المصغر ، متبوعا بإنشاء ثقافات مجتمعية معقدة داخل نظام المفاعل الحيوي المصغر ، والتي يمكن زراعتها تحت التدفق المستمر مع أخذ عينات معقمة لمراقبة تكوين المجتمع. هذا النظام قابل للتكيف مع التغييرات الغذائية والتعديلات الثقافية الأخرى. تسمح التقنيات الموضحة هنا بتوصيف مجتمعات البراز المتنوعة والحساسة في ظل ظروف ديناميكية أو استجابة للاضطراب بمعزل عن العوامل المشتقة من المضيف.
Introduction
الجراثيم الأمعاء هي شبكة واسعة من الكائنات الحية الدقيقة ، بما في ذلك البكتيريا والفطريات والعتائق والفيروسات ، والتي تحتوي على ذخيرة وراثية وأيضية ضخمة يفوق عددها بكثير عدد المضيف البشري1. تشتمل القدرة الأيضية الغنية للميكروبيوم على المستقلبات المنتجة من المعالجة البكتيرية للمغذيات الغذائية ، والمستقلبات المضيفة المعدلة كيميائيا بواسطة البكتيريا ، والمستقلبات التي يتم تصنيعها بشكل فريد بواسطة الجراثيم2. تتورط الجراثيم في جميع العمليات الحيوية للمضيف تقريبا ولكن أيضا في الحالات المرضية مثل مرض التهاب الأمعاء والسرطان واضطرابات التمثيل الغذائي وحتى الاضطرابات العصبية2،3. يعد تشريح مساهمة الكائنات الحية الدقيقة من مساهمة المضيف أمرا ضروريا لفهم دور الكائنات الحية الدقيقة المحددة أو المجتمعات المعقدة في الصحة والمرض. أحد الأساليب التي تمكن من هذا التشريح هو استخدام المفاعلات الحيوية الميكروبية ، التي تزرع مجتمعات ميكروبية متنوعة في ظل ظروف ديناميكية. هناك العديد من المفاعلات الحيوية المتاحة تجاريا والتي تسمح بنمو المجتمعات البكتيرية البرازية لأي غرض تقريبا ، بما في ذلك زراعة المنتجات الحيوية على نطاق واسع أو التحكم الدقيق في عوامل غذائية محددة لدراسة عمليات التمثيل الغذائي. ومع ذلك ، فإن هذه الأنظمة مكلفة للغاية وتتطلب إعدادا مكثفا ، ولا تمكن من فحص الظروف التجريبية المتنوعة بالتوازي. للحصول على نهج مبسط أقل تكلفة وأكثر قابلية للتكيف ويسمح بالعديد من الظروف المتوازية ، نقدم هنا بروتوكول إعداد واستخدام مصفوفة مفاعل حيوي صغير في ظل تدفق مستمر مقتبس من Auchtung et al.4.
يظهر الإعداد الكامل لنظام المفاعل الحيوي المصغر في الشكل 1 أ. يستخدم نظام المفاعل الحيوي المصغر هذا مصفوفات من 6 آبار مفاعلات ، وهي مستقلة تماما عن بعضها البعض ويتم إعدادها في غرفة لاهوائية تحت التدفق التمعجي لتمكين توصيل الوسائط وإزالتها بشكل مستمر (الشكل 1 أ). تقع كل مصفوفة مفاعل على لوحة تحريك مغناطيسية ذات 60 وضعا ، مع مضختين تمعجيين 48 كاسيت تحملان أنبوبا ثنائي التوقف لوسائط المصدر وتدفق النفايات (الشكل 1 أ). تم تجهيز الغرفة اللاهوائية بجهاز مراقبة لاهوائية CAM-12 لمحتوى الأكسجين ، وصندوق محفز لإزالة الأكسجين بسعة تسخين ، وعمود إزالة كبريتيد الهيدروجين لامتصاص الغازات الزائدة من التمثيل الغذائي البكتيري. تم تجهيز كل بئر مفاعل بمدخل وسائط المصدر ومخرج النفايات ومنفذ العينة ، مما يسمح بالتلقيح أو أخذ العينات من كل بئر مفاعل على حدة (الشكل 1 ب).
كما هو موضح ، يتيح نظام المفاعل الحيوي التحكم الديناميكي في درجة الحرارة واستهلاك الوسائط وتوافر المغذيات لدعم زراعة المجتمعات البرازية وصيانتها. يتم تعديل درجة الحرارة بواسطة صندوق محفز بسعة تسخين ، مما يتيح تنفيذ التغيرات في درجة الحرارة في جميع أنحاء الغرفة اللاهوائية بأكملها بسرعة. يتم تنظيم استهلاك الوسائط من خلال معدلات تدفق المضخة التمعجية ، والتي يمكن تعديلها لتغيير دوران الوسائط في المفاعلات. يمكن تخصيص معدل دوران الوسائط وفقا لأنواع المجتمعات التي يتم زراعتها في المفاعلات ، على سبيل المثال ، تكييفها مع السلالات المستهدفة بطيئة النمو أو سريعة النمو. أخيرا ، يمكن تعديل توافر المغذيات ديناميكيا عن طريق إضافة مكونات من خلال منافذ العينة الفردية لكل بئر مفاعل. الظروف الثابتة التي يمكن تعديلها في بداية التجربة ، ولكن ليس لها تحكم ديناميكي في النظام هي نوع الوسائط ومحتوى الأكسجين وعدد المفاعلات المتزامنة. يمكن للمحققين اختيار تنفيذ أي وسائط مصدر يرغبون فيها ، وبينما يتم وصف إحدى وسائل الإعلام هنا ، تم تنفيذ أنواع وسائط المصدر الأخرى التي لا حصر لها بنجاح. يمكن للمرء تشغيل المفاعلات في ظل ظروف هوائية أو دقيقة (اعتمادا على توافر غرفة ميكرووفيل للهوائي). أخيرا ، يمكن إنشاء أكبر عدد ممكن من المفاعلات حسب الحاجة اعتمادا على الاحتياجات التجريبية للمحقق. بينما تكون المفاعلات في مجموعات من ستة داخل مصفوفة ، يعمل كل مفاعل بشكل مستقل عن الآخرين ، ويمكن ربط كل مفاعل بمصدر مختلف إذا رغبت في ذلك.
يمكن إعداد نظام المفاعل الحيوي المعياري هذا بالكامل مقابل حوالي 25,000 دولار (لا يشمل الغرفة اللاهوائية أو المكونات الخاصة بالغرفة) ، مع الجزء الوحيد غير القابل لإعادة الاستخدام هو الأنبوب الذي يمكن استبداله بأقل من 100 دولار لكل تشغيل للنظام. النظام مؤتمت في الغالب ولكنه يتطلب فحصا يوميا لمستويات الوسائط حيث ستحتاج زجاجات مصدر الوسائط إلى التغيير عندما تكون فارغة. بالإضافة إلى ذلك ، يجب إكمال أي أخذ عينات يدويا ، ويجب بدء أي تغييرات شرطية ديناميكية في النظام يدويا (على سبيل المثال ، تغيير درجة الحرارة). من بروتوكول النظام الأصلي الذي نشره Auchtung et al. ، تم تنفيذ بعض التعديلات لتحسين الأداء العام والمنفعة4. أولا ، يتم تعديل مادة الطباعة ثلاثية الأبعاد لمجموعة المفاعلات الحيوية لتكون بلاستيك شفاف شفاف يشبه ABS لتحسين السلامة الهيكلية للنظام من خلال جولات متكررة من التعقيم. بالإضافة إلى ذلك ، بدلا من أنابيب OD PTFE مقاس 1/8 بوصة (3.2 مم) ، يتم استخدام أنابيب E-LFL ، 2.06 مم ID ، 100 قدم بدلا من ذلك بسبب المادة الأكثر ثباتا ، وهي أكثر مقاومة للانهيار ، مما قد يتسبب في انسداد التدفق في النظام. أخيرا ، يتم استخدام تركيبات إضافية باستخدام خيط 1/4 -28 مم لمحولات الذكور الشائكة لتقليل التغييرات في انزلاق الأنبوب من زجاجات مصدر الوسائط. من Han et al. ، توفر وصفة وسائط MEGA المعدلة وسائط غير محددة ومعقدة وغنية للغاية تمكن من زراعة الكائنات الحية الدقيقة اللاهوائيةالحساسة 5. تم تعديل الوسائط لاستخدام التحضير البديل لمكون الهيستيدين - الهيماتين ، حيث لم يعد الأصل متاحا تجاريا. يستخدم هيدروكسيد الصوديوم أيضا لدرجة الحموضة في الوسائط إلى 7.0 أو أي درجة حموضة مرغوبة. بشكل عام ، هذا النظام سهل الميزانية وسهل الاستخدام ومحسن ونقطة دخول ممتازة لأنظمة ثقافة التدفق المستمر.
في هذا البروتوكول ، نصف بالتفصيل إعداد نظام مصفوفة المفاعلات الحيوية المصغرة هذا ، بما في ذلك المواد ، وتعقيم النظام ، والاستخدام اللاحق لزراعة عينات براز الفئران المتوافقة مع البشر في الأمعاء. الهدف العام من هذه الطريقة هو بناء نظام مفاعل حيوي قابل للتكيف وفعال من حيث التكلفة يمكن استخدامه لزراعة المجتمعات الميكروبية في ظل ظروف خاضعة للرقابة. يتم توفير تخطيطي مفصل لسير العمل لتجميع نظام المفاعل الحيوي المصغر في الشكل 2 ويشار إليه في الخطوات المناسبة داخل البروتوكول. في مثالنا ، نقوم بتلقيح مفاعلين بنفس عينة البراز من فئران الأمعاء المتوافقة مع البشر ونصف بنية المجتمع الميكروبي تحت تدفق مستمر لوسائط MEGA.

الشكل 1: رسم تخطيطي لإعداد مصفوفة المفاعلات الحيوية المصغرة في الغرفة اللاهوائية. (أ) منظر كامل لإعداد مصفوفة المفاعلات الحيوية المصغرة المكتملة في الغرفة اللاهوائية. تقع مجموعة المفاعلات الحيوية المكونة من 6 آبار على لوحة التحريك المغناطيسية ذات 60 وضعا. يتم توصيل شبكة نقطة الإنطلاق المصدر بالوسائط المصدر على الجانب الأيسر من خلال غطاء الزجاجة ذو الفتحتين. تحمل مضختان تمعجيتان الأنبوب ذو المحطة الثانية من المصدر وشبكات النفايات على اليسار واليمين ، على التوالي. يتم تفريغ شبكة النفايات في زجاجة النفايات على الجانب الأيمن. يتم ترتيب المعدات الأساسية لتشغيل الغرفة اللاهوائية ، بما في ذلك شاشة CAM-12 ، وصندوق المحفز بسعة تسخين ، وعمود إزالة كبريتيد الهيدروجين ، داخل الغرفة حول نظام المصفوفة. (ب) منظر علوي لمنافذ المصدر والعينة والنفايات المتصلة ببئر مفاعل واحد مع وسائط على الارتفاع المناسب في المفاعل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
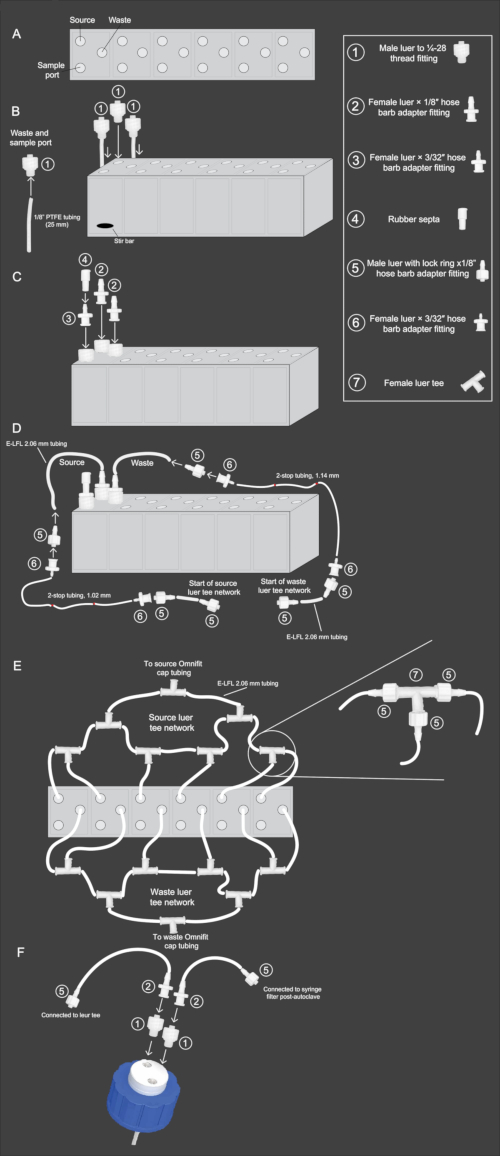
الشكل 2: رسم تخطيطي لسير عمل تجميع مصفوفة المفاعلات الحيوية المصغرة. (أ) عرض من أعلى إلى أسفل لمصفوفة المفاعل الحيوي المصغر ، يوضح اتجاه المصدر والنفايات ومنافذ العينة. (ب) منظر جانبي لمصفوفة المفاعل الحيوي المصغر مع عرض يوضح الخطوات 2.3-2.4 من البروتوكول. يتم إرفاق أنابيب وتركيب PTFE مقاس 1/8 بوصة (1) وإدخالها في منافذ النفايات والعينات. يتم إدخال التركيب (1) بدون PTFE في منفذ المصدر. (ج) منظر جانبي لمصفوفة المفاعلات الحيوية المصغرة التي توضح الخطوات 2.5-2.6 من البروتوكول. يتم إرفاق التركيب (2) بمنافذ المصدر والنفايات. يتم إرفاق التركيب (3) بمنفذ العينة ، ولذلك ، يتم إدخال التركيب (4) في الأعلى. (د) منظر جانبي لمصفوفة المفاعلات الحيوية المصغرة توضح الخطوات 2.9-2.11. يتم توصيل أنابيب E-LFL 2.06 مم بالمصدر ومنافذ النفايات ، ويتم توصيل الطرف الآخر بالتركيبات (5) ثم (6). ثم يتم توصيل الأنابيب ذات المحطة 2 من القطر المناسب بالتركيب (6). ثم يتم تكرار الاتصال العكسي في نهاية الأنبوب المكون من توقفين ، مع توصيل التركيب (6) بالأنبوب ذو التوقفين والتركيب (5) بذلك. أخيرا ، سيتم توصيل أنابيب E-LFL 2.06 مم بالتركيب (5) للاتصال بشبكة luer tee. (ه) عرض من أعلى إلى أسفل لمصفوفة المفاعلات الحيوية المصغرة التي تعرض إعداد شبكة نقطة الإنطلاق المصدر والنفايات الموصوفة في الخطوات 2.12-2.15. يتم استخدام أنبوب E-LFL 2.06 مم ينتهي بالتركيب (5) لتوصيل كل مفاعل بعدة تركيبات (7) ، يتم توصيل الفتحة الأخيرة منها بالغطاء الموجود على المصدر أو زجاجة النفايات. (و) منظر جانبي لمجموعة غطاء الزجاجة ذات الفتحتين الموصوفة في الخطوات 2.16-2.17. يتم توصيل فتحة واحدة في الغطاء بأنابيب PTFE الموضوعة داخل الزجاجة. إلى تلك الفتحة يتم إدخال التركيب (1) ، متبوعا بالتركيب (2) ، وأنابيب E-LFL 2.06 مم متصلة بالتركيب (5). يتم إرفاق هذا التركيب بالمصدر أو شبكة النفايات. إلى الفتحة غير المتصلة بأنبوب PTFE ، يتم إدخال التركيب (1) ، متبوعا بالتركيب (2) ، ويتم توصيل أنبوب E-LFL 2.06 مم بتركيب آخر (5). يتم تغطية هذه النهاية بورق الألمنيوم أثناء تعقيم الأوتوكلاف لتثبيتها في المستقبل بمرشح حقنة معقم 0.22 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم الحصول على عينات البراز المستخدمة في هذه الدراسة من التجارب المعتمدة من قبل اللجنة المؤسسية لرعاية واستخدامه (IACUC) في جامعة فلوريدا (UF) وتم إجراؤها في مرافق رعاية في UF (بروتوكول IACUC #IACUC202300000005). باختصار ، نوع البرية المختلطة بين الجنسين الخالية من الجراثيم (GF WT; C57BL / 6) تم نقل الفئران (التي تم تربيتها وصيانتها في العوازل بواسطة قسم UF Animal Care Services Sec-free Vari) من عوازل التكاثر ووضعها في نظام الاستبعاد البيولوجي ISOcage P للسماح بالتلاعب الميكروبي. تم تجميع وحدات تشكيل مستعمرة متساوية (CFU) من براز المتبرع البشري للتزقيم في الفئران. بعد أسبوعين من التلقيح ، تم جمع عينات البراز من هذه الفئران بشكل تعقيم للتخزين والاستخدام اللاحق في هذا البروتوكول.
ملاحظة: الغرض من جمع عينات البراز وتحضيرها الموصوف هنا هو فقط كمثال على الإجراء الصحيح ، حيث يعتمد هذا الإجراء اعتمادا على نوع العينات التي تم جمعها (الإنسان ، الفأر ، الأخرى) وتخزين هذه العينات ، يمكن أن يختلف هذا الإجراء بشكل كبير. يجب على الأفراد الرجوع إلى الأدبيات المناسبة لتصميم بروتوكول لجمع عينات البراز وحفظها بناء على احتياجات الباحث الفردي.
1. التحضير النموذجي لعينات البراز لتخزين -80 درجة مئوية
- حدد وسائط الحفاظ على الجدوى اللاهوائية (هنا ، استخدمنا Cary Blair). Aliquot 1 مل من وسائط الحفظ في أنابيب معقمة ولولبية 2 مل في خزانة السلامة الحيوية ، ثم نقلها إلى الغرفة اللاهوائية.
- قبل استلام عينات البراز ، تأكد من تقليل جميع المستلزمات (الملاعق المعقمة ، والمحلول الملحي المعقم ، والقوارير المبردة ذات الغطاء اللولبي التي تحتوي على وسائط الحفظ) مسبقا لمدة 24 ساعة في الغرفة اللاهوائية.
- اجمع عينات البراز بشكل معقم من الفئران باستخدام أنابيب معقمة ذات غطاء مفاجئ في خزانة السلامة الحيوية باستخدام أكواب وملقط لجمع البراز المعقم. فور التجميع ، قم بتجميد الأنابيب في النيتروجين السائل.
- انقل العينات على الفور إلى غرفة لاهوائية مع ميزان محمول للوزن. قم بوزن كل أنبوب مسبقا. بالنسبة لعينات براز الفأر, يمكن اقتباس كريات البراز المنفصلة لكل أنبوب. في حالة استخدام عينات بشرية ، استخدم الملاعق المعقمة لتقليب كل عينة وتقسيمها بالتساوي إلى قوارير مبردة. بعد إعادة وزن كل أنبوب ، أضف وسائط بنسبة تقديرية تبلغ 1:10 وسائط البراز (الكتلة: الكتلة) لكل أنبوب للحفاظ على السطح الأمثل.
ملاحظة: يوصى بالحفظ اللاهوائي الفوري لعينات البراز بعد جمعها. قد تكون العينات التي لم يتم حفظها على الفور قد قللت من قابلية البقاء ، والتغييرات التركيبية ، وما إلى ذلك ، مقارنة بالعينات المحفوظةحديثا 6،7،8. تحافظ وسائط حفظ كاري بلير على صلاحية المجتمعات البكتيرية مع تثبيط المزيد من النمو ويمكن تخزينها عند -80 درجة مئوية. بالنسبة للنسبة المقدرة لوسائط الحفظ إلى البراز ، على الرغم من أن الوزن الرطب لعينة البراز متغير للغاية ، إلا أن هذا هو أفضل تقدير متاح. - قم بوضع الملصقات ، وإغلاق الغلق ، وإزالة القوارير من الغرفة اللاهوائية ، وتجميد الفلاش بالنيتروجين السائل ، وتخزينها في درجة حرارة -80 درجة مئوية لمدة تصل إلى عام أو أكثر.
2. بناء مجموعة مفاعلات 6 آبار
- استخدم ملف CAD (الملف التكميلي 1) للطباعة ثلاثية الأبعاد للمفاعل ذو 6 آبار. يمكن إرسال هذا الملف إلى أي شركة طباعة ثلاثية الأبعاد للإنتاج. استخدم البلاستيك الشفاف الشفاف الشبيه بنظام ABS كمادة طباعة لتمكين التصور من خلال المفاعلات مع مقاومة دورات التعقيم المتكررة.
ملاحظة: لقد طلبنا تصنيع مصفوفات المفاعلات المكونة من 6 آبار من البلاستيك الشفاف الشفاف الشبيه ب ABs بواسطة الطباعة الحجرية المجسمة نوصي بإمالة المصفوفة (أي طباعة الجزء ثلاثي الأبعاد بزاوية 30٪ -45٪) في الإنتاج ، مما يقلل من عدم دقة الأبعاد. سيؤدي هذا التصحيح إلى تشغيل خطوط طبقة مرئية قطريا عبر المصفوفة ، لكن هذا لا يؤثر على أداء المفاعلات. - باستخدام أداة التنصت مقاس 25-28 مم ، أدخل خيوط لولبية لكل فتحة من مصفوفة المفاعل.
- قم بقص شرائط 12 ، 25 مم من أنبوب PTFE مقاس 1/8 بوصة وأدخل طرفا واحدا من كل جزء من الأنابيب في فتحة الخيط اللولبي لسور ذكر إلى 25-28 تركيب الخيط. قم بربط التركيبات بإحكام في النفايات المخصصة وفتحات العينات للمصفوفة (الشكل 2 ب).
ملاحظة: يمكن استخدام شفرة الحلاقة لحلق أطراف الأنبوب برفق في تكوين يشبه المخروط لجعل الأنبوب مناسبا بشكل أفضل للإدخال. - أدخل قضيب تحريك صغير في كل بئر مفاعل ثم قم بربط خيط ذكر 1/4-28 يتم تركيبه في فتحات المصدر لكل بئر مفاعل (الشكل 2 ب).
- تركيبات محول شوكة خرطوم برغي × 1/8 بوصة في تركيبات الخيط 1 / 4-28 للنفايات والمصدر لكل بئر مفاعل (الشكل 2 ج).
- برغي أنثى لور × 3/32 بوصة خرطوم محول شوكة في تركيبات الخيط 1 / 4-28 لمنفذ العينة. ضع حاجزا مطاطيا فوق محولات الخرطوم الشائكة مقاس 3/32 بوصة وقم بطي الجزء العلوي (الشكل 2 ج).
- قطع مجموعتين من E-LFL ، أنابيب 2.06 مم بأطوال التالية لخطوط النفايات والمصدر: 14 سم ، 15.25 سم ، 16.5 سم ، 17.75 سم ، 19 سم ، 20.25 سم.
ملاحظة: يمكن استخدام شريط الملصقات الملون الملفوف حول القسم الأوسط لتحديد كل طول للأنبوب. - قم بتوصيل أنبوب E-LFL 2.06 مم بتركيبات محول الخرطوم الشائكة الأنثوية مقاس 1/8 بوصة لتوصيلات المصدر والنفايات (الشكل 2 د). استخدم الماء الساخن لجعل الأنبوب أكثر مرونة. سيسمح ذلك للأنبوب بالملاءمة بسهولة للمحولات.
- قم بتوصيل لوير ذكر بحلقة قفل × محول شوكة خرطوم 1/8 بوصة مناسب للطرف الآخر من الأنبوب. قم بربط محول شوكة خرطوم أنثى × 1/16 بوصة مناسبا لذلك (الشكل 2D).
- قم بتوصيل الأنابيب ذات الحجم المناسب 2 توقفا بتوصيلات النفايات والمصدر المقابلة. تستخدم خطوط النفايات أنابيب 1.14 مم ID 2-stop ، بينما تستخدم خطوط المصدر أنابيب 1.02 مم ID 2-stop. على الطرف الآخر من الأنبوب ذو التوقف ، قم بإرفاق أنثى أخرى × 1/16 بوصة تركيب محول شوكة خرطوم (الشكل 2 د).
- قم بقص قطع 20 ، 5 سم من E-LFL ، وأنابيب 2.06 مم ، وأدخل اللور الذكر بحلقة قفل × تركيبات محول خرطوم شائكة مقاس 1/8 بوصة على طرفي كل أنبوب. قم بتوصيل أحد طرفي الأنبوب مقاس 5 سم مع اللور الذكر مع حلقة قفل × محول شوكة خرطوم 1/8 بوصة المناسب لمحول الخرطوم غير المأهول × 1/16 بوصة في نهاية كل قسم من أقسام الأنابيب ذات التوقف. كرر هذه العملية مع 19 قطعة متبقية من الأنابيب (الشكل 2 د).
- قم بتوصيل أنبوب E-LFL مقاس 2.06 مم لخطوط مصدر آبار المفاعل 1 و 2 باستخدام طرفي نقيض من نقطة الإنطلاق الأنثوية. قم بتوصيل إحدى قطع الأنابيب مقاس 5 سم مع الطلاء الذكوري مع حلقة قفل × تركيبات محول 1/8 بوصة على كل طرف بالمخرج الأوسط للنقطة الإنطلاق ، مما يؤدي إلى تقاطع نقطة الإنطلاق الثاني (الشكل 2E).
- قم بتوصيل أنبوب المصدر E-LFL مقاس 2.06 مم للمفاعل الثالث بالجانب الآخر من نقطة الإنطلاق الثانية. يجب إرفاق أنبوب آخر مقاس 5 سم مع لور ذكر مع حلقة قفل × محول 1/8 بوصة على أحد طرفيه ، بينما يجب أن يحتوي الطرف الآخر على لوير أنثى مع حلقة قفل × محول 1/8 بوصة مرفق. اتبع نفس النمط للمفاعلات 4 و 5 و 6 (الشكل 2E).
- قم بقص قطعة مقاس 25 سم من E-LFL ، وأنبوب 2.06 مم ، وربط سهر ذكر بحلقة قفل × محول شوكة خرطوم 1/8 بوصة في أحد طرفي الأنبوب ، والذي سيتم إرفاقه بآخر تقاطع أنثوي متبقي ، وعلى الطرف الآخر قم بإرفاق أنثى luer × 1/8 بوصة تركيب محول خرطوم شائك. قم بتغطية هذه النهاية بورق الألمنيوم (الشكل 2 ه).
ملاحظة: أثناء العملية ، من الضروري إبقاء الأطراف المفتوحة معقمة ، لذلك نوصي بإبقائها مغطاة بورق الألمنيوم أثناء التعقيم وتثبيتها في مكانها بشريط لاصق. - قم بإعداد خطوط النفايات بتكرار نفس الإجراء مثل خطوط المصدر الموضحة في الخطوات 2.12-2.14 (الشكل 2E).
- لتجميع زجاجة جمع النفايات ، قم بتثبيت غطاء زجاجة بفتحتين بشكل غير محكم على زجاجة سعة 2 لتر. أدخل تركيبات الخيط الذكور 1 / 4-28 في كلا فتحتي الغطاء. قم بتوصيل لوير أنثوي بمحولات شوكة خرطوم مقاس 1/8 بوصة بتركيب الخيط الذكري الذي لا يتصل بأنبوب PTFE المرفق مسبقا في الغطاء (الشكل 2F).
- بعد ذلك ، قم بقص قطعة مقاس 5 سم من أنبوب E-LFL 2.06 مم وقم بتوصيلها بمحول شوكة الخرطوم على الزجاجة. قم بتوصيل لوير ذكر مع حلقة قفل × محول شوكة خرطوم 1/8 بوصة بالطرف الآخر من الأنبوب 5 سم وقم بتغطيته بورق الألمنيوم (يعمل هذا الأنبوب كفتحة تهوية ؛ بعد التعقيم ، سيتم إضافة مرشح حقنة 0.22 ميكرومتر لمنع التلوث ؛ الشكل 2F).
- قم بتغطية الغطاء بالكامل بورق الألمنيوم. قم بتعقيم المفاعلات وزجاجة النفايات عند 121 درجة مئوية و 15 رطل لكل بوصة مربعة على الأقل لمدة 45 دقيقة باستخدام برنامج العادم البطيء الذي يتم ضبطه عادة للسوائل. بمجرد أن تبرد المفاعلات ، قم بإحكام ربط التركيبات وأختام رقائق الألومنيوم وضعها في الغرفة اللاهوائية لمدة 48 ساعة قبل الاستخدام.
3. إعداد وسائط MEGA
- إعداد جميع حلول المخزون وفقا للجدول التكميلي 1 ، الجدول التكميلي 2 ، الجدول التكميلي 3 ، الجدول التكميلي 4 ، الجدول التكميلي 5 ، الجدول التكميلي 6 ، الجدول التكميلي 7 ، الجدول التكميلي 8.
- في زجاجة زجاجية سعة 2 لتر ، أضف جميع المكونات الجافة من الجدول التكميلي 9 ، متبوعا ب 1640 مل من الماء عالي النقاء ثم باقي المكونات السائلة للجدول التكميلي 10 . يضاف شريط التحريك ويذوب تماما على نار متوسطة (90 درجة مئوية) على طبق تقليب. ستكون الوسائط زرقاء شاحبة إلى بنفسجية اللون ولن تكون واضحة تماما ولكن لن تحتوي على أي كتل واضحة غير مذابة.
ملاحظة: يمكن أن يؤدي تعقيم الجلوكوز والسكريات الأخرى في وجود الببتيدات إلى التعديل وقد يقلل من السكر المتاح في الوسائط. إذا رغبت في ذلك ، يمكن ترشيح جميع محاليل السكر معقمة وإضافتها مع مكونات الجدول التكميلي 10 ، كما هو موضح في الخطوة 3.7. - بمجرد الخلط الكامل ، اضبط درجة الحموضة في الوسائط إلى 7.0 عن طريق إضافة 10 نيوتن هيدروكسيد الصوديوم (NaOH) ، لقياس مقدار الحجم المضاف بالضبط. بعد قياس الأس الهيدروجيني ، أضف 14.4 مل من الماء مطروحا منه حجم هيدروكسيد الصوديوم المضاف ليصل الحجم إلى 2 لتر بالضبط.
- قم بإعداد غطاء زجاجة من فتحتين عن طريق إدخال خيط ذكر 1 / 4-28 مم في كلتا الفتحتين.
- في فتحة الغطاء غير المرفقة مسبقا بأنابيب PTFE ، قم بقص قطعة 5 سم من الأنابيب المرنة C وتوصيلها بشوكة الخرطوم مقاس 1/8 بوصة لتركيب اللور الأنثوي. في الطرف الآخر من الأنبوب 5 سم ، أدخل لور ذكر آخر بحلقة قفل ومحول شوكة خرطوم 1/8 بوصة ، وقم بتغطيته بورق الألمنيوم (سيتم توصيله أيضا بمرشح حقنة 0.22 ميكرومتر).
- قم بتغطية الغطاء بالكامل بورق الألمنيوم وقم بالمسمار أعلى زجاجة الوسائط MEGA سعة 2 لتر. الأوتوكلاف عند 121 درجة مئوية وحد أدنى 15 رطل لكل بوصة مربعة لمدة 45 دقيقة ، باستخدام برنامج العادم البطيء للسوائل.
- قم بإزالة الوسائط من الأوتوكلاف واتركها لتبرد مع التقليب حتى تصبح فاترة. أضف المكونات الموجودة في الجدول التكميلي 10 إلى زجاجة الوسائط سعة 2 لتر في خزانة السلامة الحيوية ، وأغلق الغطاء ، ثم انتقل إلى طبق التحريك للتجانس. بمجرد أن تبرد الوسائط ، قم بإحكام ربط التركيبات وأختام رقائق الألومنيوم وضعها في الغرفة اللاهوائية لمدة 48 ساعة قبل الاستخدام.
ملاحظة: نوصي بتشغيل مضخة المصدر بسرعة 16 ميكرولتر/دقيقة (0.94 مل/ساعة) لمدة 16 ساعة من الاستبقاء. بالنسبة لمعدل التدفق هذا ، يستخدم مفاعل مكون من 6 آبار ما يقرب من 0.135 لتر من الوسائط يوميا. نوصي أيضا بتشغيل مضخة النفايات بسرعة 40 ميكرولتر / دقيقة لمنع تكون الحصار في أنابيب النفايات. راقب الأنبوب والتدفق، مع ملاحظة أنه يمكن زيادة تدفق النفايات حسب الاقتضاء في حالة حدوث انسدادات. كل من معدلات تدفق المصدر والنفايات قابلة للتعديل ، ولكن يجب على الباحثين مراقبة تكوين المجتمع ومعدلات النمو بعناية لأنها قد تتغير أيضا مع تدفق أسرع أو أبطأ. لتشغيل مفاعل 6 آبار لمدة أسبوع واحد ، نوصي بعمل 2 لتر على الأقل من الوسائط (ستستهلك أكثر بقليل من 1 لتر).
4. إعداد المصفوفة في الغرفة اللاهوائية
ملاحظة: من الضروري تنظيف الجزء الداخلي من غطاء المحرك وقفازات غطاء المحرك بنسبة 3٪ بيروكسيد الهيدروجين متبوعا بشطف الماء منزوع الأيونات ثلاث مرات لضمان عدم تلوث السطح قبل التجميع. إذا تم إجراء التوصيلات بسرعة بعد إزالة الرقاقة ، ولم يتم إجراء اتصال مباشر مع الجزء الداخلي من التركيبات وقفازات الغرفة اللاهوائية ، فهناك فرصة ضئيلة للتلوث
- قم بمحاذاة المصفوفة فوق لوحة تحريك مغناطيسية في الغرفة اللاهوائية. تأكد من محاذاة المصفوفة بشكل صحيح عن طريق ضبط وحدة التحكم في لوحة التحريك على السرعة القصوى (1600 دورة في الدقيقة) ومراقبة دوران قضبان التقليب.
- قم بتركيب الأنبوب ذو التوقف 2 للمصدر والنفايات في المشابك الموجودة على المضخات التمعجية المقابلة. إذا قمت بذلك قبل أقل من 24 ساعة من الاستخدام المقصود ، فقم بقفل المشابك في مكانها. خلاف ذلك ، اتركه فضفاضا حتى يصبح جاهزا للاستخدام لتقليل تآكل الأنبوب.
- قم بإزالة غطاء الرقائق المعدنية على تركيبات محول الخرطوم الأنثوي × 1/8 بوصة على خطوط المصدر والنفايات وقم بتثبيتها في اللورد الذكر إلى 1/4 -28 تركيبات تهديد مثبتة في الأغطية (تأكد من توصيل هذه الفتحة بأنبوب PTFE الداخلي).
- قم بإزالة أغطية القصدير وقم بتوصيل مرشح حقنة 0.22 ميكرومتر بخط التهوية 5 سم لزجاجة المصدر وخط التهوية لزجاجة النفايات.
- ابدأ التدفق بمعدل معتدل (1 مل / دقيقة على مضخة المصدر و 2 مل / دقيقة على مضخة النفايات) لبدء ملء المفاعلات. تأكد من أن أنبوب خط النفايات في كل بئر مفاعل أقل من أنبوب المصدر ، مما يمنع الإفراط في الملء أو إفراغ كل بئر.
- عندما تبدأ المفاعلات في الملء ، تأكد من أن جميعها تصل إلى نفس الحجم وأن الوسائط تتدفق إلى خط النفايات. مع القياسات الموضحة هنا ، يبلغ حجم عمل كل مفاعل 15 مل.
ملاحظة: إذا لم تملأ أي مفاعلات فردية ، فقم بإحكام ربط أي تركيبات مفكوكة وفحص خطوط المصدر بحثا عن مشكلات ، واستبدلها بإضافات معدة إذا لزم الأمر. إذا استمرت المشكلة، فاستبدل الزجاجة المصدر إذا كانت متوفرة. إذا ارتفع المستوى المتوسط فوق خط النفايات الداخلي في المفاعلات ، فتحقق من أن أنبوب PTFE الموجود داخل منفذ نفايات المفاعل لا يزال في مكانه. - بعد ملء كل مفاعل ، اضبط إعدادات المضخة على معدل التدفق البالغ 16 ميكرولتر / دقيقة ، ثم قم بإيقاف تشغيل المضخات.
- اترك الوسيط يبقى في المفاعلات وزجاجة (زجاجات) النفايات طوال الليل قبل التلقيح. يسمح هذا بمزيد من التكييف اللاهوائي للوسائط (ليصبح المجموع ~ 72 ساعة) ويمكن المستخدم من تأكيد عقم النظام.
- للتأكد من عقم النظام قبل تلقيح عينة البراز ، قم بأخذ عينات من كل مفاعل ووسائط المصدر مباشرة بعد الملء الأولي (الخطوة 4.7) ومرة أخرى بعد الخطوة 4.8. اتبع إجراء أخذ العينات المعقمة للمفاعلات الموصوفة في الخطوة 6.
- التأكد من أن قياس الكثافة البصرية لجميع العينات هو نفسه قياس الكثافة الضوئية للوسائط المصدر ؛ إذا لوحظت زيادة الكثافة البصرية ، يشتبه في وجود تلوث ، ويجب تفكيك جميع الوسائط والنظام وتنظيفها وإعادة تجميعها.
5. تلقيح عينة البراز
- ضع أطراف ماصة معقمة عريضة التجويف، ومحلول ملحي معقم، وأنابيب مخروطية سعة 50 مل، وماصات مصلية معقمة سعة 25 مل، ومحاقن سعة 5 مل، وإبر قياس 16 في الغرفة اللاهوائية لتكييفها في البيئة اللاهوائية لمدة 24 ساعة على الأقل.
- احسب كمية البراز المطلوبة لتلقيح العدد المطلوب من المفاعلات. يتطلب كل بئر مفاعل 3.8 مل من المادة الطافية في ملاط براز 25٪ م / ف. بالنسبة لستة آبار مفاعلات ، يجب أن يوفر ما مجموعه 22.8 مل من ملاط البراز 25٪ م / v ما يكفي من المواد الطافية للتلقيح ، الأمر الذي سيتطلب 5.7 جم من البراز الصلب.
- انقل عينات البراز المحفوظة في قوارير مبردة إلى الغرفة اللاهوائية واتركها تذوب لمدة 15 دقيقة.
- استخدم طرف ماصة عريض التجويف لنقل المواد البرازية من القوارير المبردة إلى أنبوب مخروطي سعة 50 مل، وأغلقها بإحكام، وجهاز الطرد المركزي عند 200 × جم لمدة 5 دقائق لتسوية الجسيمات.
- انقله مرة أخرى إلى غرفة لاهوائية وقم بإزالة المادة الطافية. باستخدام ملعقة مختبرية معقمة ، انقل المواد الصلبة البرازية إلى أنبوب مخروطي جديد سعة 50 مل ، مما يحقق كتلة إجمالية تبلغ 5.7 جم. أضف 17.1 مل من المحلول الملحي المعقم اللاهوائي إلى الأنبوب وأغلقه بإحكام.
- قم بإزالة الأنابيب المخروطية من الغرفة ، وتجانسها بواسطة الدوامة لمدة 5 دقائق ، ثم جهاز الطرد المركزي عند 200 × جم لمدة 5 دقائق لتسوية الجسيمات.
- قم بتعقيم الحاجز الموجود أعلى كل مفاعل بمنديل مختبري مبيض بنسبة 10٪ لمدة دقيقتين على الأقل أثناء وضع العينات في جهاز الطرد المركزي.
- أعد العينات إلى الغرفة اللاهوائية، وباستخدام الماصات المصلية المعقمة، انقل المواد الطافية إلى أنابيب مخروطية جديدة سعة 50 مل.
- قم بتحميل 3.8 مل من الملاط البرازي الطافي في ست محاقن منفصلة سعة 5 مل مع إبر 16 جم 1.5 بوصة.
- قم بإزالة المنديل ، وأدخل الإبرة من خلال الحاجز ، وقم بحقن الملاط البرازي ببطء في المفاعل.
- السماح لمجتمعات البراز بالتأسيس في كل مفاعل لمدة 16-18 ساعة تقريبا قبل بدء التدفق إلى المفاعل. اضبط لوحة التحريك المغناطيسية على السرعة القصوى من وقت حقن الملاط البرازي (1600 دورة في الدقيقة).
6. جمع معقم للعينات من آبار المفاعلات
- ثقب الغلاف على ست محاقن معقمة سعة 1 مل وست إبر معقمة 22G 3 بوصة وضعها في الغرفة اللاهوائية للتخلص منها لمدة 24 ساعة.
- قبل أخذ العينات مباشرة ، قم بتعقيم الحاجز أعلى كل مفاعل بمنديل مختبري مبيض بنسبة 10٪ لمدة دقيقتين على الأقل.
- قم بإزالة مسح مختبر التبييض وقم بتوصيل إبرة على الفور بحقنة وأدخل الإبرة في وسط حاجز المفاعل الأول جيدا.
- اسحب 1 مل من العينة ، وأزل الإبرة من الحاجز ، وانقل العينة من المحقنة إلى أنبوب مسمى 1.7 مل للاستخدام في اتجاه المصب. سيتم إعادة إغلاق الحاجز المطاطي عند إزالة الإبرة. استخدم إبرة وحقنة جديدة لكل بئر مفاعل لمنع التلوث المتبادل.
- إذا كان المادة الطافية مطلوبة ، فقم بإزالة الأنابيب من الغرفة اللاهوائية وأجهزة الطرد المركزي عند 20,000 × جم لمدة 1 دقيقة لبيليه الخلايا البكتيرية.
- انقل المادة الطافية إلى أنبوب 1.7 مل مسمى بشكل منفصل وخزنها في درجة حرارة -80 درجة مئوية.
7. تفكيك وتنظيف نظام المفاعل الحيوي المصغر
- افصل زجاجة المصدر عن نقطة الإنطلاق المصدر وقم برفع معدل التدفق (1 مل / دقيقة على مضخة المصدر و 2 مل / دقيقة على مضخة النفايات) لبدء إفراغ الأنبوب. اترك الأنبوب يفرغ تماما. أغلق طبق التحريك.
- بمجرد أن يصبح الأنبوب فارغا ، افصل زجاجة النفايات عن نقطة الإنطلاق للنفايات. بعد ذلك ، ضع مجموعة المفاعل في غرفة معادلة الضغط في غرفة اللاهوائية وقم بإزالتها من الغرفة.
- افصل جميع أنابيب E-LFL 2.06 مم وأجزاء أنابيب PTFE وتخلص منها. افصل جميع التركيبات وضعها في محلول مبيض بنسبة 10٪.
- قم بإزالة قضبان التحريك الصغيرة من كل مجموعة جيدا وضعها في محلول التبييض. اقلب مجموعة المفاعلات لتفريغ الوسائط في محلول مبيض منفصل بنسبة 10٪ للتطهير. ثم اغمر المصفوفة الفارغة في محلول مبيض جديد.
- اسمح لجميع التركيبات ومجموعة المفاعلات بالنقع في محلول التبييض بنسبة 10٪ لمدة 30 دقيقة (سيؤدي النقع الممتد إلى تغير اللون).
- اشطف التركيبات ومجموعة المفاعلات بالماء منزوع الأيونات ، ثم اغمرها طوال الليل في محلول منظف إنزيمي وفقا لتعليمات الشركة المصنعة.
- اشطف التركيبات ومجموعة المفاعلات ثلاث مرات بالماء منزوع الأيونات ، ثم اتركها تجف تماما في الهواء لمدة 3 أيام على الأقل. بمجرد أن يجف ، يمكن استخدام مجموعة المفاعلات والتجهيزات للتجميع مرة أخرى.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم جمع عينات البراز من الفئران المستعمرة بملاط البراز البشري بعد أسبوعين من التلقيح وتخزينها عند -80 درجة مئوية. تم إعداد نظام المفاعل الحيوي بتدفق وسائط MEGA المستمر لبئرين مفاعلين مكررين (الشكل 3 أ). تم تحضير الملاط البرازي من كريات براز ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يتيح نظام المفاعل الحيوي المصغر الموصوف في هذا البروتوكول زراعة مجتمعات البراز المستقلة للتجارب المتوازية. هذه القدرة على دراسة المجتمعات الميكروبية بمعزل عن العوامل المضيفة هي نهج أساسي لفهم القدرة الجوهرية للكائنات الحية الدقيقة على التكيف مع بيئتها. يمكن تكييف هذا...
Access restricted. Please log in or start a trial to view this content.
Disclosures
لا يوجد تضارب في المصالح بين المؤلفين.
Acknowledgements
يعرب المؤلفون عن امتنانهم لجوزي غوتييه للمساعدة في تسلسل جين 16S rRNA. تم دعم هذا البحث ، جزئيا ، من قبل صناديق مركز السرطان الصحي UF (CJ) وصندوق جاتوريد التابع لوزارة الطب في جامعة فلوريدا (CJ). R.Z.G. تم دعمه من قبل أموال مركز UF الصحي للسرطان. تم دعم R.C.N. من قبل منحة تدريب المعاهد الوطنية للصحة TL1 في جامعة فلوريدا (TL1TR001428 ، UL1TR001427) ، والمعهد الوطني للسرطان التابع للمعهد الوطني للصحة القائم على فريق المعاهد الوطنية للصحة ، وجائزة برنامج التدريب على أبحاث السرطان متعدد التخصصات القائم على المعاهد الوطنية للصحة T32CA257923 ومركز UF الصحي للسرطان. تم دعم البحث الوارد في هذا المنشور من قبل مركز UF الصحي للسرطان ، مدعوما جزئيا باعتمادات الدولة المقدمة في فلوريدا. إحصائيات § 381.915 والمعهد الوطني للسرطان التابع للمعاهد الوطنية للصحة بموجب الجائزة رقم P30CA247796. المحتوى هو مسؤولية المؤلفين وحدهم ولا يمثل بالضرورة وجهات النظر الرسمية للمعاهد الوطنية للصحة أو ولاية فلوريدا. لم يكن للممولين أي دور في تصميم الدراسة وجمع البيانات وتحليلها. قرار النشر؛ أو إعداد المخطوطة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL BD Slip Tip Syringe sterile, single use | Fisher Scientific | 309659 | |
| 1/4-28 mm thread to barbed male adaptor (3.2 mm), 5/pack | Cole-Parmer | 008NB32-KD5L | To build 1 6-well array, need 2 packs |
| 10M NaOH (Sodium Hydroxide) | Sigma | 72068-100ML | |
| 2.0ml Screw Cap Tube, NonKnurl, Skirted,Natural, E-Beam Sterile tube w/ attached cap | Fisher Scientific | 14-755-228 | |
| 2mag MIXdrive 60 Stirring Drive | 2mag | 40060 | 60-position magnetic stir plate (optional addition of heating capacity- cat# 40260) |
| 6-well reactor arrray, ABS-Like Translucent Clear plastic | Protolabs | Custom | See supplementary files for .stl file for 3D printing |
| Absolute Ethanol (200 Proof) | Fisher Scientific | BP2818 | |
| Acetic acid, glacial | Sigma | A6283 | |
| Adapter, nylon, male luer to 1/4-28 thread, 25/pack | Cole-Parmer | EW-45505-82 | To build 1 6-well array, need 6 (1 pack) |
| Aluminum foil | Fisher Scientific | 01-213-100 | |
| Anaerobic chamber | Coy Lab Products | Type B | |
| Bel-Art SP Scienceware Flea Micro Spinbar Magnetic Stirring Bars (1/pk) | Fisher Scientific | 22-261679 | To build 1 6-well array, need 6 |
| Biosafety cabinet class 2 | Nuaire | ||
| Butyric acid | Sigma | B103500 | |
| CaCl2 · 2H2O (Calcium Chloride Dihydrate) | Sigma | C7902 | |
| Clorox Healthcare Germicidal Wipes With Bleach, Unscented, 6" x 5", Pack Of 150 Wipes | Office Depot | 129202 | |
| D-(-)-Fructose | Sigma | F0127-100G | |
| D-(+)-Cellobiose | Sigma | C7252-100G | |
| D-(+)-Glucose | Sigma | G8270-100G | |
| D-(+)-Maltose monohydrate | Sigma | M5885-100G | |
| Drill America Plug Hand Tap DWTP1/4-28 | Home Depot | 305699489 | |
| Dulbecco's Phosphate Buffered Saline, 1X without Ca and Mg, Sterile | Genesee | 25-508 | |
| Female luer × 1/16″ hose barb adapter, Nylon, 25/pack | Cole-Parmer | EW-45502-00 | To build 1 6-well array, need 24 (1 pack) |
| Female luer × 1/8″ hose barb adapter, Nylon 25/pack | Cole-Parmer | EW-45502-04 | To build 1 6-well array, need 6 (1 pack) |
| Female luer × 3/32″ hose barb adapter, Nylon, 25/ pack | Cole-Parmer | EW-45502-02 | To build 1 6-well array, need 6 (1 pack) |
| Female luer tee, Nylon, 25/pack | Cole-Parmer | EW-45502-56 | To build 1 6-well array, need 10 (1 pack) |
| FeSO4 · 7H2O (Iron [II] Sulfate Heptahydrate) | Sigma | F8633 | |
| Hematin | Sigma | H3281 | |
| Histidine | Sigma | H7750 | |
| Isovaleric acid | Sigma | 129542 | |
| K2HPO4 dibasic (dipotassium hydrogen phosphate) | Sigma | P2222-1KG | |
| KH2PO4 monobasic (potassium dihydrogen phosphate) | Sigma | P0662-500G | |
| Large Orifice Pipet Tips | Fisher Scientific | 02-707-134 | |
| L-Cysteine hydrochloride | Sigma | C1276-10G | |
| Male luer with lock ring × 1/8″ hose barb adapter, Nylon, 25/pack | Cole-Parmer | EW-45505-04 | To build 1 6-well array, need 42 (2 packs) |
| Meat extract | Sigma | 70164-500G | |
| Med Vet International Exel Needle, 20G X 1", Hypodermic, 100/Box, 26417 | Fisher Scientific | 50-209-2532 | |
| Menadione (Vitamin K3) | Sigma | M5625 | |
| MgSO4 · 7H2O (Magnesium Sulfate Heptahydrate) | Sigma | M1880-500G | |
| Milli-Q water | |||
| NaCl (Sodium Chloride) | Sigma | S9888-500G | |
| NaHCO3 (Sodium Bicarbonate) | Sigma | S5761-500G | |
| Omnifi t Q-series two hole bottle cap | Cole-Parmer | 00945Q-2 | To build 1 6-well array, need 1 |
| PMP IPC-N L 24CHNL 8RLR 115V | MasterFlex | ISM939C-115V | 24-channel peristaltic pump, require 1 for source and 1 for waste |
| Precision Seal® rubber septa,white, 7 mm O.D. glass tubing (100/pk) | Millipore Sigma | Z553905-100EA | To build 1 6-well array, need 6 septa |
| Propionic acid | Sigma | P5561 | |
| Pump Tubing, 2-Stop, Tygon S3 E-Lab, 1.02 mm ID; 12/PK | VWR | MFLX96460-28 | To build 1 6-well array, need 6 (1 pack) |
| Pump Tubing, 2-Stop, Tygon S3 E-Lab, 1.14 mm ID; 12/PK | VWR | MFLX96460-30 | To build 1 6-well array, need 6 (1 pack) |
| Puritan Cary-Blair Medium, 5 ml | Fisher Scientific | 22-029-646 | |
| PYREX 2L Round Media Storage Bottles, with GL45 Screw Cap | Fisher Scientific | 06-414-1E | |
| Razor Blades | Genesee | 12-640 | |
| Resazurin, sodium salt | ACROS Organics from ThermoFisher | AC41890-0010 | |
| Soluble starch | Sigma | S9765-100G | |
| Stainless Steel Micro Spatulas, spoon like blade | Fisher Scientific | S50823 | |
| TBNG TYGON ELFL 2.06MMID 100' | VWR | MFLX06449-42 | To build 1 6-well array, need 205.5 cm |
| Trace Mineral Supplement | ATCC | MD-TMS | |
| Trypticase Peptone (BBL) | Fisher Scientific | B11921 | |
| Tubing, PTFE, 1/8″ (3.2 mm) OD × 1.5 mm ID, 10 M | Cole-Parmer | 008 T32-150-10 | To build 1 6-well array, need 300 mm |
| Tween 80 | Sigma | P1754 | |
| Vitamin Supplement | ATCC | MD-VS | |
| Yeast Extract (Bacto) | Fisher Scientific | DF0127-17-9 |
References
- Sender, R., Fuchs, S., Milo, R. Revised estimates for the number of human and bacteria cells in the body. PLoS Biol. 14 (8), e1002533(2016).
- Postler, T. S., Ghosh, S. Understanding the holobiont: how microbial metabolites affect human health and shape the immune system. Cell Metab. 26 (1), 110-130 (2017).
- Rooks, M. G., Garrett, W. S. Gut microbiota, metabolites and host immunity. Nat Rev Immunol. 16 (6), 341-352 (2016).
- Auchtung, J. M., Robinson, C. D., Farrell, K., Britton, R. A. MiniBioReactor Arrays (MBRAs) as a tool for studying C. difficile physiology in the presence of a complex community. Methods Mol Biol. 1476, 235-258 (2016).
- Han, S., et al. A metabolomics pipeline for the mechanistic interrogation of the gut microbiome. Nature. 595 (7867), 415-420 (2021).
- Bilinski, J., et al. Fresh versus frozen stool for fecal microbiota transplantation-assessment by multimethod approach combining culturing, flow cytometry, and next-generation sequencing. Front Microbiol. 13, 872735(2022).
- Li, X. M., et al. Effects of stool sample preservation methods on gut microbiota biodiversity: New original data and systematic review with meta-analysis. Microbiol Spectr. 11 (3), e0429722(2023).
- Fouhy, F., et al. The effects of freezing on faecal microbiota as determined using MiSeq sequencing and culture-based investigations. PLoS One. 10 (3), e0119355(2015).
- Sun, X., et al. Microbiota-derived metabolic factors reduce Campylobacteriosis in mice. Gastroenterology. 154 (6), 1751-1763.e2 (2018).
- He, Z., et al. Campylobacter jejuni promotes colorectal tumorigenesis through the action of cytolethal distending toxin. Gut. 68 (2), 289-300 (2019).
- Newsome, R. C., et al. Interaction of bacterial genera associated with therapeutic response to immune checkpoint PD-1 blockade in a United States cohort. Genome Med. 14 (1), 35(2022).
- Ziv, N., Brandt, N. J., Gresham, D. The use of chemostats in microbial systems biology. J Vis Exp. (80), e50168(2013).
- Wille, J., Coenye, T. Biofilm dispersion: The key to biofilm eradication or opening Pandora's box. Biofilm. 2, 100027(2020).
- Biagini, F., et al. Designs and methodologies to recreate in vitro human gut microbiota models. Bio-des Manuf. 6 (3), 298-318 (2023).
- Qi, Y., Yu, L., Tian, F., Zhao, J., Zhai, Q. In vitro models to study human gut-microbiota interactions: Applications, advances, and limitations. Microbiol Res. 270, 127336(2023).
- Gościniak, A., Eder, P., Walkowiak, J., Cielecka-Piontek, J. Artificial gastrointestinal models for nutraceuticals research-achievements and challenges: A practical review. Nutrients. 14 (13), 2560(2022).
- Marrero, D., et al. Gut-on-a-chip: Mimicking and monitoring the human intestine. Biosens Bioelectron. 181, 113156(2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved