Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Conjunto de biorreactor para el cultivo continuo de comunidades fecales complejas
En este artículo
Resumen
Este protocolo detalla el ensamblaje de matrices de mini-biorreactores que se utilizarán para el cultivo de flujo continuo de comunidades fecales complejas en condiciones anaeróbicas. También discutimos los métodos de ensamblaje, inoculación y muestreo de los reactores para su posterior análisis.
Resumen
La microbiota, especialmente las bacterias, responde a diversas exposiciones ambientales, como micro y macronutrientes, compuestos farmacológicos y mediadores inflamatorios, que alteran dinámicamente la composición de la comunidad y la producción metabólica microbiana. La comprensión de cómo las condiciones fisiológicas del cultivo afectan a las comunidades y diversidad microbianas y a su capacidad metabólica aportará importantes conocimientos sobre su impacto en la salud y las enfermedades. Aquí, presentamos un protocolo adaptado de la plantilla publicada por Auchtung et al. para crear matrices de mini-biorreactores que pueden cultivar comunidades fecales complejas, definir consorcios bacterianos o cepas individuales en condiciones precisas, incluida la disponibilidad de nutrientes, la temperatura, el caudal, el pH y el contenido de oxígeno. Describimos el proceso de construcción del sistema de mini-biorreactor, incluyendo adaptaciones para mejorar las limitaciones en el protocolo publicado. También discutimos la configuración del sistema de mini-biorreactor en condiciones anaeróbicas con el uso de medios MEGA (adaptado de Han et al.), que es un medio rico que apoya el crecimiento de diversas bacterias. Describimos la inoculación de muestras fecales de ratón humanizadas intestinalmente en el sistema de mini-biorreactor, seguida del establecimiento de cultivos comunitarios complejos dentro del sistema de mini-biorreactor, que pueden cultivarse bajo flujo continuo con muestreo aséptico para monitorear la composición de la comunidad. Este sistema es adaptable a los cambios dietéticos y otras modificaciones culturales. Las técnicas aquí descritas permiten la caracterización de comunidades fecales diversas y fastidiosas en condiciones dinámicas o en respuesta a perturbaciones aisladas de factores derivados del huésped.
Introducción
La microbiota intestinal es una vasta red de microorganismos, entre los que se encuentran bacterias, hongos, arqueas y virus, que contienen un enorme repertorio genético y metabólico que supera en gran medida al de un huésped humano1. La rica capacidad metabólica del microbioma incluye metabolitos producidos a partir del procesamiento bacteriano de nutrientes dietéticos, metabolitos del huésped modificados químicamente por bacterias y metabolitos sintetizados únicamente por la microbiota2. La microbiota está implicada en casi todos los bioprocesos del huésped, pero también en estados patológicos como la enfermedad inflamatoria intestinal, el cáncer, los trastornos metabólicos e incluso los trastornos neurológicos 2,3. Diseccionar la contribución de la microbiota a la del huésped es esencial para comprender el papel de microorganismos específicos o comunidades complejas en la salud y la enfermedad. Un enfoque que permite esta disección es el uso de biorreactores microbianos, que cultivan diversas comunidades microbianas en condiciones dinámicas. Hay muchos biorreactores disponibles comercialmente que permiten el crecimiento de comunidades bacterianas fecales para casi cualquier propósito, incluido el cultivo de bioproductos a gran escala o el control preciso de factores nutritivos específicos para el estudio de los procesos metabólicos. Sin embargo, estos sistemas son enormemente costosos y requieren una preparación extensa, y no permiten examinar diversas condiciones experimentales en paralelo. Para un enfoque simplificado que sea menos costoso, más adaptable y permita muchas condiciones paralelas, presentamos aquí el protocolo para la configuración y el uso de un conjunto de mini-biorreactores bajo flujo continuo adaptado de Auchtung et al.4.
La configuración completa del sistema de mini-biorreactor se muestra en la Figura 1A. Este sistema de mini-biorreactor utiliza matrices de 6 pozos de reactor, que son completamente independientes entre sí y están configurados en una cámara anaeróbica bajo flujo peristáltico para permitir la entrega y eliminación continua de medios (Figura 1A). Cada conjunto de reactores se asienta sobre una placa de agitación magnética de 60 posiciones, con dos bombas peristálticas de 48 casetes que sostienen tubos de 2 paradas para el medio fuente y el flujo de desechos (Figura 1A). La cámara anaeróbica está equipada con un monitor anaeróbico CAM-12 para el contenido de oxígeno, una caja de catalizadores para eliminar oxígeno con capacidad de calentamiento y una columna de eliminación de sulfuro de hidrógeno para absorber el exceso de gas del metabolismo bacteriano. Cada pozo del reactor está equipado con una entrada de medio fuente, una salida de desechos y un puerto de muestreo, lo que permite la inoculación o el muestreo de cada pozo de reactor individual (Figura 1B).
Como se describe, el sistema de biorreactor permite el control dinámico de la temperatura, el consumo de medios y la disponibilidad de nutrientes para apoyar el cultivo y el mantenimiento de las comunidades fecales. La temperatura es modulada por una caja de catalizadores con capacidad calorífica, lo que permite implementar rápidamente cambios de temperatura en toda la cámara anaeróbica. El consumo de medios está regulado por los caudales de la bomba peristáltica, que se pueden modificar para cambiar la rotación de los medios en los reactores. La rotación de medios se puede personalizar para los tipos de comunidad que se cultivan en los reactores, por ejemplo, que se adaptan para cepas objetivo de crecimiento lento o muy rápido. Por último, la disponibilidad de nutrientes se puede modificar dinámicamente mediante la adición de componentes a través de los puertos de muestra individuales para cada pozo del reactor. Las condiciones estáticas que pueden modificarse al comienzo de un experimento, pero que no tienen control dinámico en el sistema, son el tipo de medio, el contenido de oxígeno y el número de reactores simultáneos. Los investigadores pueden optar por implementar cualquier medio de origen que deseen, y mientras se describe un medio aquí, se han implementado con éxito muchos otros tipos de medios de origen. Se pueden operar los reactores en condiciones aeróbicas o microaerófilas (dependiendo de la disponibilidad de una cámara microaerófila). Por último, se pueden instalar tantos o tan pocos reactores como sea necesario en función de las necesidades experimentales del investigador. Si bien los reactores están en grupos de seis dentro de una matriz, cada reactor funciona independientemente de los demás, y cada uno se puede conectar a una fuente diferente si se desea.
Este sistema de biorreactor modular se puede configurar completamente por alrededor de $ 25,000 (sin incluir la cámara anaeróbica o los componentes específicos de la cámara), y la única parte no reutilizable es la tubería que se puede reemplazar por menos de $ 100 por ejecución del sistema. El sistema está automatizado en su mayor parte, pero requiere una verificación diaria de los niveles de medios, ya que las botellas de fuentes de medios deberán cambiarse cuando estén vacías. Además, cualquier muestreo debe completarse manualmente, y cualquier cambio condicional dinámico en el sistema deberá iniciarse manualmente (por ejemplo, cambiar la temperatura). A partir del protocolo del sistema original publicado por Auchtung et al., se implementaron algunas modificaciones para mejorar el rendimiento general y la utilidad4. En primer lugar, el material para la impresión 3D de la matriz de biorreactores se modifica para que sea un plástico transparente translúcido similar al ABS para mejorar la integridad estructural del sistema mediante rondas repetidas de autoclave. Además, en lugar de la tubería de PTFE de 1/8 de pulgada (3,2 mm) de diámetro exterior, E-LFL, 2,06 mm de diámetro interior, se utiliza una tubería de 100 pies debido al material más resistente, que es más resistente al colapso, lo que causaría bloqueos en el flujo en el sistema. Por último, se utiliza un accesorio adicional que utiliza una rosca de 1/4 -28 mm a adaptadores macho de púas para reducir los cambios en el deslizamiento del tubo de las botellas de fuente de medios. De Han et al., la receta adaptada de medios MEGA proporciona un medio indefinido, complejo y altamente rico que permite el cultivo de microorganismos anaeróbicos exigentes5. El medio se modifica para utilizar una preparación alternativa del componente histidina-hematina, ya que el original ya no está disponible comercialmente. El hidróxido de sodio también se utiliza para pH del medio a 7.0 o cualquier pH deseado. En general, este sistema es económico y fácil de usar, optimizado y un excelente punto de entrada a los sistemas de cultivo de flujo continuo.
En este protocolo, describimos en detalle la configuración de este sistema de matriz de mini-biorreactores, incluidos los materiales, la esterilización del sistema y el uso posterior para el cultivo de muestras fecales murinas humanizadas intestinalmente. El objetivo general de este método es construir un sistema de biorreactor adaptable y rentable que pueda utilizarse para cultivar comunidades microbianas en condiciones controladas. En la Figura 2 se proporciona un esquema detallado del flujo de trabajo para el ensamblaje del sistema de mini-biorreactor y se hace referencia a él en los pasos apropiados dentro del protocolo. En nuestro ejemplo, inoculamos dos reactores con la misma muestra fecal de ratones intestinales humanizados y describimos la estructura de la comunidad microbiana bajo un flujo continuo de medios MEGA.

Figura 1: Diagrama esquemático de la configuración del conjunto de mini-biorreactores en la cámara anaeróbica. (A) Vista completa de la configuración completa del conjunto de mini-biorreactores en la cámara anaeróbica. El conjunto de biorreactores de 6 pocillos está situado en la placa de agitación magnética de 60 posiciones. La red de tee luer de origen está conectada al medio de origen en el lado izquierdo a través de la tapa de botella de dos orificios. Dos bombas peristálticas sujetan la tubería de 2 paradas desde la fuente y las redes de residuos a la izquierda y a la derecha, respectivamente. La red de residuos se vacía en la botella de residuos del lado derecho. El equipo esencial para el funcionamiento de la cámara anaeróbica, incluido el monitor CAM-12, la caja de catalizador con capacidad de calentamiento y la columna de eliminación de sulfuro de hidrógeno, están dispuestos dentro de la cámara alrededor del sistema de matriz. (B) Vista superior de los puertos de fuente, muestra y desechos conectados a un pozo de reactor con medios a la altura adecuada en el reactor. Haga clic aquí para ver una versión más grande de esta figura.
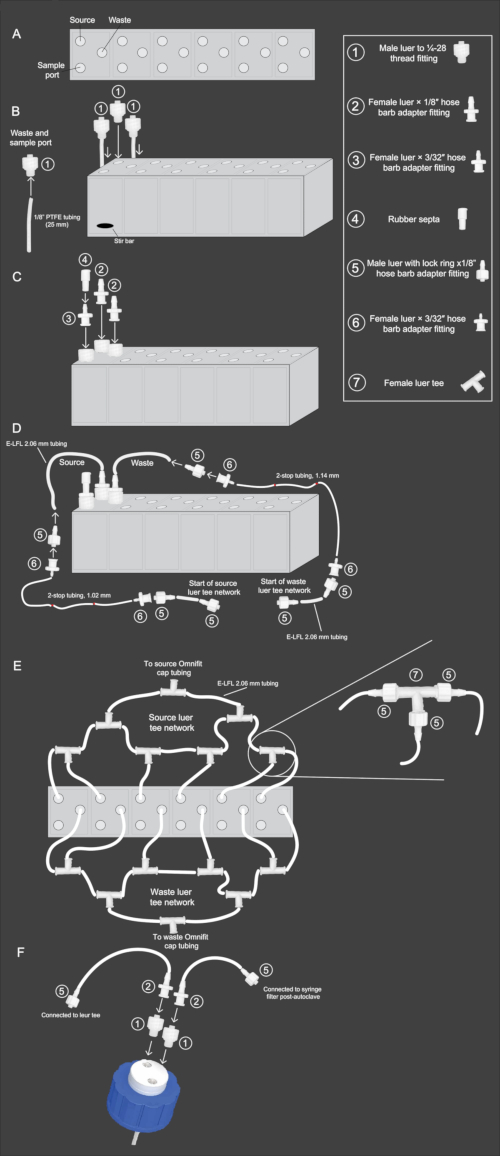
Figura 2: Diagrama esquemático del flujo de trabajo de ensamblaje de matrices de mini-biorreactores. (A) Vista de arriba hacia abajo del conjunto de mini-biorreactores, que muestra la orientación de la fuente, los desechos y los puertos de muestra. (B) Vista lateral del conjunto de mini-biorreactores con una vista que ilustra los pasos 2.3-2.4 del protocolo. El tubo y el accesorio de PTFE de 1/8 de pulgada (1) se conectan e insertan en los puertos de desechos y muestras. El accesorio (1) sin PTFE se inserta en el puerto de origen. (C) Vista lateral del conjunto de mini-biorreactores que ilustra los pasos 2.5-2.6 del protocolo. El accesorio (2) está conectado a los puertos de origen y desechos. El accesorio (3) se conecta al puerto de muestra, y a él, el accesorio (4) se inserta en la parte superior. (D) Vista lateral del conjunto de mini-biorreactores que ilustra los pasos 2.9-2.11. La tubería E-LFL de 2,06 mm está conectada a los puertos de origen y desagüe, y el otro extremo está conectado a los accesorios (5) y luego (6). A continuación, se conecta un tubo de 2 paradas del diámetro adecuado al accesorio (6). A continuación, la conexión inversa se repite en el extremo del tubo de 2 pasos, con el accesorio (6) conectándose al tubo de 2 pasos y el accesorio (5) conectándose a él. Por último, la tubería E-LFL de 2,06 mm se conectará al racor (5) para la conexión a la red de luer tee. (E) Vista arriba hacia abajo del conjunto de mini-biorreactores que muestra la fuente y la configuración de la red de aguas residuales descrita en los pasos 2.12-2.15. La tubería E-LFL de 2,06 mm que termina en el accesorio (5) se utiliza para conectar cada reactor a varios accesorios (7), cuya última abertura está conectada a la tapa de la fuente o botella de desecho. (F) Vista lateral del conjunto de tapas de botellas de dos orificios descrito en los pasos 2.16-2.17. Una abertura en la tapa está conectada a un tubo de PTFE que se coloca dentro de la botella. A esa abertura se inserta el accesorio (1), seguido del accesorio (2) y el tubo E-LFL de 2,06 mm conectado al accesorio (5). Este accesorio se conecta a la red de fuente o de residuos. En la abertura no conectada a la tubería de PTFE, se inserta el accesorio (1), seguido del accesorio (2), y el tubo E-LFL de 2,06 mm se conecta a otro accesorio (5). Este extremo se tapa con papel de aluminio durante la esterilización en autoclave para su futura conexión a un filtro de jeringa estéril de 0,22 μM. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Las muestras fecales utilizadas en este estudio se obtuvieron de experimentos aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Florida (UF) y se realizaron en las Instalaciones de Cuidado Animal de la UF (Protocolo #IACUC202300000005 IACUC). En resumen, el tipo salvaje libre de gérmenes de género mixto (GF WT; Los ratones C57BL/6) (criados y mantenidos en aisladores por la División Libre de Gérmenes de UF Animal Care Services) fueron transferidos de los aisladores de cría y colocados en el sistema de bioexclusión ISOcage P para permitir la manipulación microbiana. Unidades formadoras de colonias (UFC) iguales de las heces de donantes humanos se agruparon para la sonda nasogástrica en ratones. Dos semanas después de la inoculación, se recogieron muestras fecales de estos ratones de forma aséptica para su almacenamiento y posterior uso en este protocolo.
NOTA: La recolección y preparación de muestras fecales descritas aquí solo pretenden ser un ejemplo de un procedimiento adecuado, ya que dependiendo del tipo de muestras recolectadas (humano, ratón, otro animal) y el almacenamiento de estas muestras, este procedimiento puede variar ampliamente. Las personas deben consultar la bibliografía apropiada para diseñar un protocolo para la recolección y preservación de muestras fecales basado en las necesidades del investigador individual.
1. Preparación típica de muestras fecales para almacenamiento a -80 °C
- Seleccione un medio anaeróbico de preservación de la viabilidad (en este caso, utilizamos Cary Blair). Alícuota 1 mL de medio de conservación en tubos estériles, con tapón de rosca de 2 mL en un gabinete de bioseguridad, y luego transfiéralos a la cámara anaeróbica.
- Antes de recibir muestras fecales, asegúrese de que todos los suministros (espátulas esterilizadas en autoclave, solución salina estéril y viales criogénicos con tapón de rosca que contengan medios de conservación) estén prereducidos durante 24 horas en la cámara anaeróbica.
- Recoja muestras fecales asépticamente de ratones utilizando tubos estériles con tapón a presión en una cabina de bioseguridad utilizando tazas y pinzas de recolección de heces esterilizadas en autoclave. Inmediatamente después de la recolección, congele los tubos en nitrógeno líquido.
- Transfiera inmediatamente las muestras a una cámara anaeróbica junto con una báscula portátil para el pesaje. Pesa previamente cada tubo. En el caso de las muestras fecales de ratón, se pueden alícuota separadas de gránulos fecales por tubo. Si utiliza muestras humanas, utilice las espátulas estériles para agitar cada muestra y dividirla en partes iguales en viales criogénicos. Después de volver a pesar cada tubo, agregue medios en una proporción estimada de 1:10 medios de heces (masa: masa) a cada tubo para una conservación óptima.
NOTA: Se recomienda la conservación anaeróbica inmediata de las muestras fecales después de la recolección. Las muestras no preservadas inmediatamente pueden tener una viabilidad reducida, cambios en la composición, etc., en comparación con las muestras recién conservadas 6,7,8. Los medios de conservación de Cary Blair mantienen la viabilidad de las comunidades bacterianas al tiempo que inhiben el crecimiento posterior y pueden almacenarse a -80 °C. Para la relación estimada entre los medios de conservación y las heces, aunque el peso húmedo de la muestra fecal es muy variable, esta es la mejor estimación disponible. - Etiquete, selle, retire los viales de la cámara anaeróbica, congele el flash con nitrógeno líquido y almacene a -80 °C durante un año o más.
2. Construcción de un conjunto de reactores de 6 pozos
- Utilice el archivo CAD (archivo complementario 1) para la impresión 3D del reactor de 6 pocillos. Este archivo se puede enviar a cualquier empresa de impresión 3D para su producción. Utilice plástico transparente translúcido similar al ABS como material de impresión para permitir la visualización a través de los reactores y, al mismo tiempo, ser resistente a los ciclos repetidos de autoclave.
NOTA: Encargamos que los conjuntos de reactores de 6 pozos se hicieran de plástico transparente translúcido similar a AB mediante estereolitografía. Recomendamos que la matriz esté inclinada (es decir, que la pieza se imprima en 3D en un ángulo del 30% al 45%) en la producción, lo que reduce las imprecisiones dimensionales. Esta corrección dará como resultado líneas de capa visibles que corren en diagonal a través del conjunto, pero esto no afecta el rendimiento de los reactores. - Con una herramienta de roscado de 25-28 mm, introduzca roscas de tornillo en cada abertura del conjunto de reactores.
- Corte tiras de 12 de 25 mm del tubo de PTFE de 1/8 de pulgada e inserte un extremo de cada segmento de tubo en la abertura de la rosca del tornillo de un accesorio de rosca luer macho a 25-28. Atornille firmemente los accesorios en las aberturas designadas para residuos y muestras de la matriz (Figura 2B).
NOTA: Se puede usar una cuchilla de afeitar para afeitar ligeramente los extremos del tubo en una configuración similar a un cono para que el tubo se ajuste mejor a la inserción. - Inserte una micro barra agitadora en cada pocillo del reactor y luego atornille un accesorio de rosca macho de 1/4-28 en los orificios de la fuente de cada pocillo del reactor (Figura 2B).
- Atornille los accesorios del adaptador de lengüeta de manguera luer hembra x 1/8 de pulgada en los accesorios de rosca 1/4-28 para el desperdicio y la fuente de cada pozo del reactor (Figura 2C).
- Atornille los accesorios del adaptador de lengüeta de manguera luer hembra x 3/32 pulgadas en los accesorios de rosca 1/4-28 para el puerto de muestra. Coloque un tabique de goma sobre los adaptadores de lengüeta de la manguera de 3/32 de pulgada y doble la parte superior (Figura 2C).
- Corte dos juegos de tubos E-LFL de 2,06 mm en las siguientes longitudes para las líneas de residuos y fuentes: 14 cm, 15,25 cm, 16,5 cm, 17,75 cm, 19 cm y 20,25 cm.
NOTA: Se puede usar cinta adhesiva de color envuelta alrededor de la sección media para identificar cada longitud de tubo. - Conecte el tubo E-LFL de 2,06 mm a los accesorios del adaptador de lengüeta de manguera luer hembra de 1/8 de pulgada para las conexiones de origen y desagüe (Figura 2D). Use agua caliente para hacer que el tubo sea más maleable. Esto permitirá que el tubo encaje fácilmente en los adaptadores.
- Conecte un luer macho con un anillo de bloqueo x un accesorio adaptador de lengüeta de manguera de 1/8 de pulgada al otro extremo del tubo. Atornille un adaptador de lengüeta de manguera luer x 1/16 de pulgada que encaja en él (Figura 2D).
- Conecte el tubo de 2 pasos del tamaño adecuado a las conexiones de desagüe y fuente correspondientes. Las líneas de desagüe utilizan tubos de 1,14 mm de diámetro interno y 2 paradas, mientras que las líneas de origen utilizan tubos de 1,02 mm de diámetro interno y 2 paradas. En el otro extremo del tubo de 2 paradas, conecte otro accesorio adaptador de lengüeta de manguera luer x 1/16 de pulgada hembra (Figura 2D).
- Corte 20 piezas de 5 cm de tubo E-LFL de 2,06 mm e inserte el luer macho con anillo de bloqueo x accesorios adaptadores de lengüeta de manguera de 1/8 de pulgada en ambos extremos de cada tubo. Conecte un extremo del tubo de 5 cm con el luer macho con anillo de bloqueo x accesorio adaptador de lengüeta de manguera de 1/8 de pulgada al luer hembra desocupado x accesorio adaptador de lengüeta de manguera de 1/16 de pulgada en el extremo de cada sección de tubo de 2 paradas. Repita este proceso para las 19 piezas restantes de tubo (Figura 2D).
- Conecte la tubería E-LFL de 2,06 mm para las líneas de origen de los pozos del reactor 1 y 2 utilizando los extremos opuestos de una T luer hembra. Conecte una de las piezas de tubería de 5 cm con luer macho con anillo de bloqueo x accesorios adaptadores de 1/8 de pulgada en cada extremo a la salida central de la T, que conduce a una segunda unión en T (Figura 2E).
- Conecte el tubo fuente E-LFL de 2,06 mm para el tercer reactor al lado opuesto de la segunda T. Otro tubo de 5 cm con un luer macho con un anillo de bloqueo x adaptador de 1/8 de pulgada debe estar conectado en un extremo, mientras que el otro extremo debe tener un luer hembra con un anillo de bloqueo x adaptador de 1/8 de pulgada conectado. Siga el mismo patrón para los reactores 4, 5 y 6 (Figura 2E).
- Corte un trozo de tubo E-LFL de 2,06 mm de 25 cm, fijando un luer macho con anillo de bloqueo x accesorio adaptador de lengüeta de manguera de 1/8 de pulgada a un extremo del tubo, que se conectará a la última unión en T de luer hembra restante, y en el otro extremo conecte un accesorio adaptador de lengüeta de manguera luer hembra x 1/8 de pulgada. Cubra este extremo con papel de aluminio (Figura 2E).
NOTA: Durante la operación, es esencial mantener estériles los extremos abiertos, por lo que recomendamos mantenerlos tapados en papel de aluminio durante el autoclave y asegurados en su lugar con cinta adhesiva. - Prepare las líneas de desagüe repitiendo el mismo procedimiento que las líneas de origen descritas en los pasos 2.12-2.14 (Figura 2E).
- Para montar una botella de recogida de residuos, fije sin apretar una tapa de botella de dos orificios en una botella de 2 L. Inserte los accesorios de rosca macho 1/4-28 en ambos orificios de la tapa. Conecte un luer hembra con adaptadores de lengüeta de manguera de 1/8 de pulgada al accesorio de rosca macho que no se conecta al tubo de PTFE preconectado en la tapa (Figura 2F).
- A continuación, corte un trozo de tubo E-LFL de 2,06 mm de 5 cm y conéctelo al adaptador de la lengüeta de la manguera de la botella. Conecte un luer macho con anillo de bloqueo x adaptador de lengüeta de manguera de 1/8 de pulgada al otro extremo del tubo de 5 cm y cúbralo con papel de aluminio (este tubo sirve como ventilación de aire; después del autoclave, se agregará un filtro de jeringa de 0,22 μm para evitar la contaminación; Figura 2F).
- Cubre toda la tapa con papel de aluminio. Autoclave los reactores y la botella de residuos a 121 °C y un mínimo de 15 psi durante 45 minutos utilizando el programa de escape lento que normalmente se establece para líquidos. Una vez que los reactores se hayan enfriado, apriete los accesorios y los sellos de papel de aluminio y colóquelos en la cámara anaeróbica durante 48 h antes de su uso.
3. Preparación de medios MEGA
- Prepare todas las soluciones madre según la Tabla Suplementaria 1, la Tabla Suplementaria 2, la Tabla Suplementaria 3, la Tabla Suplementaria 4, la Tabla Suplementaria 5, la Tabla Suplementaria 6, la Tabla Suplementaria 7, la Tabla Suplementaria 8.
- En una botella de vidrio de 2 L, agregue todos los ingredientes secos de la Tabla Suplementaria 9, seguido de 1640 mL de agua ultrapura y luego el resto de los ingredientes líquidos de la Tabla Suplementaria 10 . Agregue una barra para remover y disuelva completamente a fuego medio (90 ° C) en una placa para remover. Los medios serán de color azul pálido a violeta y no serán completamente transparentes, pero no tendrán bultos obvios sin disolver.
NOTA: La esterilización en autoclave de la glucosa y otros azúcares en presencia de péptidos puede provocar modificaciones y puede reducir el azúcar disponible en los medios. Si se desea, todas las soluciones de azúcar pueden filtrarse estérilmente y añadirse con los componentes de la Tabla Suplementaria 10, como se describe en el paso 3.7. - Una vez que esté completamente mezclado, ajuste el pH del medio a 7.0 agregando hidróxido de sodio (NaOH) 10 N, midiendo exactamente cuánto volumen se agrega. Después de la medición del pH, agregue 14,4 mL de agua menos el volumen de hidróxido de sodio agregado para llevar el volumen exactamente a 2 L.
- Prepare un tapón de botella de dos orificios insertando un accesorio de rosca luer macho de 1/4-28 mm en ambas aberturas.
- En el orificio de la tapa que no está prefijado al tubo de PTFE, corte un trozo de tubo C-flex de 5 cm y conéctelo a la lengüeta de la manguera de 1/8 de pulgada del accesorio luer hembra. En el otro extremo del tubo de 5 cm, inserte otro luer macho con un anillo de bloqueo y un adaptador de lengüeta de manguera de 1/8 de pulgada, y cúbralo con papel de aluminio (también se conectará a un filtro de jeringa de 0,22 μM).
- Cubra toda la tapa con papel de aluminio y enrosque la parte superior de la botella de medios MEGA de 2 L. Autoclave a 121 °C y un mínimo de 15 psi durante 45 min, utilizando el programa de escape lento para líquidos.
- Retire el medio del autoclave y deje que se enfríe mientras revuelve hasta que esté tibio. Agregue los componentes de la Tabla Suplementaria 10 a la botella de medios de 2 L en un gabinete de bioseguridad, selle la tapa y luego muévala a una placa de agitación para homogeneizar. Una vez que el medio se haya enfriado, apriete los accesorios y los sellos de papel de aluminio y colóquelos en la cámara anaeróbica durante 48 h antes de su uso.
NOTA: Recomendamos hacer funcionar la bomba fuente a 16 μL/min (0,94 mL/h) durante un tiempo de retención de 16 h. Para este caudal, un reactor de 6 pocillos utiliza aproximadamente 0,135 L de medio al día. También recomendamos hacer funcionar la bomba de residuos a 40 μL/min para evitar la formación de bloqueos en el tubo de residuos. Monitoree la tubería y el flujo, teniendo en cuenta que el flujo de desechos se puede aumentar según corresponda si se producen obstrucciones. Tanto las tasas de flujo de la fuente como las de los desechos son modificables, pero los investigadores deben monitorear cuidadosamente su composición comunitaria y las tasas de crecimiento, ya que también pueden cambiar con un flujo más rápido o más lento. Para hacer funcionar un reactor de 6 pocillos durante una semana, recomendamos hacer al menos 2 litros de medio (consumirá un poco más de 1 litro).
4. Configuración de la matriz en cámara anaeróbica
NOTA: Es esencial limpiar el interior de la capucha y los guantes de la capucha con peróxido de hidrógeno al 3%, seguido de un triple enjuague con agua desionizada para garantizar que no se contamine la superficie antes del montaje. Si las conexiones se realizan rápidamente después de la extracción de la lámina y no se produce un contacto directo con el interior de los accesorios y los guantes de la cámara anaeróbica, la posibilidad de contaminación es mínima
- Alinee el conjunto sobre una placa de agitación magnética en la cámara anaeróbica. Asegúrese de que la matriz esté alineada correctamente configurando el controlador de la placa de agitación a la velocidad máxima (1600 rpm) y observando el giro de las barras de agitación.
- Coloque el tubo de 2 pasos para la fuente y los residuos en las abrazaderas de las bombas peristálticas correspondientes. Si lo hace menos de 24 horas antes del uso previsto, bloquee las abrazaderas en su lugar. De lo contrario, déjelo suelto hasta que esté listo para usar para reducir el desgaste del tubo.
- Retire la tapa de aluminio del luer hembra x accesorios del adaptador de lengüeta de manguera de 1/8 de pulgada en las líneas de origen y desagüe y atorníllela en el luer macho a los accesorios de amenaza de 1/4 -28 atornillados en las tapas (asegúrese de que esta abertura esté conectada al tubo interno de PTFE).
- Retire los tapones de aluminio y coloque un filtro de jeringa de 0,22 μm en la línea de ventilación de 5 cm de la botella de origen y en la línea de ventilación de la botella de desecho.
- Comience el flujo a una velocidad moderada (1 mL/min en la bomba de origen y 2 mL/min en la bomba de desechos) para comenzar a llenar los reactores. Asegúrese de que el tubo de la línea de desagüe en cada pozo del reactor sea más bajo que el del tubo fuente, lo que evitará el sobrellenado o el vaciado de cada pozo.
- A medida que los reactores comiencen a llenarse, asegúrese de que todos alcancen el mismo volumen y que los medios fluyan hacia la línea de desechos. Con las mediciones descritas aquí, el volumen de trabajo de cada reactor es de 15 mL.
NOTA: Si algún reactor individual no se llena, apriete los accesorios sueltos e inspeccione las líneas de origen en busca de problemas, reemplazándolos con extras preparados si es necesario. Si el problema persiste, reemplace la botella de origen si está disponible. Si el nivel medio se eleva por encima de la línea de desagüe interior de los reactores, inspeccione que la tubería de PTFE en el interior del puerto de desagüe del reactor aún esté en su lugar. - Después de que cada reactor se haya llenado, ajuste la configuración de la bomba al caudal de 16 μL/min y, a continuación, apague las bombas.
- Deje que el medio permanezca en los reactores y en la(s) botella(s) de residuos durante la noche antes de la inoculación. Esto permite un mayor acondicionamiento anaeróbico de los medios (durante un total de ~72 h) y permite al usuario confirmar la esterilidad del sistema.
- Para confirmar la esterilidad del sistema antes de la inoculación de la muestra fecal, tome muestras de cada reactor y del medio fuente directamente después del llenado inicial (paso 4.7) y de nuevo después del paso 4.8. Siga el procedimiento para el muestreo aséptico de los reactores descrito en el paso 6.
- Asegúrese de que la medición de la densidad óptica de todas las muestras sea la misma que la del medio fuente; Si se observa un aumento de la densidad óptica, se sospecha de contaminación y todos los medios y el sistema deben desconstruirse, limpiarse y volver a ensamblarse.
5. Inoculación de muestras fecales
- Coloque puntas de pipeta estériles de diámetro ancho, solución salina estéril, tubos cónicos de 50 mL, pipetas serológicas estériles de 25 mL, jeringas de 5 mL y agujas de calibre 16 en la cámara anaeróbica para acondicionar en el entorno anaeróbico durante al menos 24 h.
- Calcular la cantidad de materia fecal necesaria para inocular el número deseado de reactores. Cada pozo del reactor requiere 3,8 mL de sobrenadante en una suspensión fecal al 25% m/v. Para los seis pozos del reactor, un total de 22,8 mL de lodo fecal al 25% m/v debería proporcionar suficiente sobrenadante para la inoculación, que requerirá 5,7 g de materia fecal sólida.
- Transfiera las muestras fecales conservadas en viales criogénicos a la cámara anaeróbica y déjelas descongelar durante 15 minutos.
- Utilice una punta de pipeta de diámetro ancho para transferir el material fecal de los viales criogénicos a un tubo cónico de 50 ml, selle herméticamente y centrifugue a 200 x g durante 5 minutos para sedimentar las partículas.
- Transfiera de nuevo a una cámara anaeróbica y retire el sobrenadante. Con una espátula de laboratorio esterilizada en autoclave, transfiera los sólidos fecales a un nuevo tubo cónico de 50 mL, logrando una masa total de 5,7 g. Agregue 17,1 mL de solución salina estéril anaeróbica al tubo y selle herméticamente.
- Retire los tubos cónicos de la cámara, homogeneice por vórtice durante 5 minutos, luego centrifugue a 200 x g durante 5 minutos para sedimentar las partículas.
- Esterilice los tabiques en la parte superior de cada reactor con una toallita de laboratorio con lejía al 10% durante al menos 2 minutos mientras las muestras se colocan en la centrífuga.
- Regrese las muestras a la cámara anaeróbica y, utilizando pipetas serológicas estériles, transfiera los sobrenadantes a nuevos tubos cónicos de 50 mL.
- Cargue 3.8 mL de sobrenadante de lodo fecal en seis jeringas separadas de 5 mL con agujas de 16 G y 1.5 pulgadas.
- Retire la toallita, inserte la aguja a través del tabique e inyecte lentamente la suspensión fecal en el reactor.
- Permita que las comunidades fecales se establezcan en cada reactor durante aproximadamente 16-18 h antes de iniciar el flujo hacia el reactor. Ajuste la placa de agitación magnética a la velocidad máxima desde el momento en que se inyecta la suspensión fecal (1600 rpm).
6. Recogida aséptica de muestras de los pozos de los reactores
- Perfore el envoltorio con seis jeringas estériles de 1 mL y seis agujas estériles de 22G de 3 pulgadas y colóquelas en la cámara anaeróbica para desgasificar durante 24 h.
- Inmediatamente antes de la toma de muestras, esterilice los tabiques en la parte superior de cada reactor con una toallita de laboratorio con lejía al 10% durante al menos 2 minutos.
- Retire la toallita de laboratorio con lejía e inmediatamente conecte una aguja a una jeringa e inserte la aguja en el centro de los tabiques del primer pozo del reactor.
- Tome 1 mL de la muestra, retire la aguja de los tabiques y transfiera la muestra de la jeringa a un tubo marcado de 1,7 mL para su uso posterior. Los tabiques de goma se volverán a sellar al retirar la aguja. Utilice una aguja y una jeringa nuevas para cada pocillo del reactor para evitar la contaminación cruzada.
- Si se desea el sobrenadante, retire los tubos de la cámara anaeróbica y centrifugue a 20.000 x g durante 1 minuto para pellet las células bacterianas.
- Transfiera el sobrenadante a un tubo de 1,7 ml etiquetado por separado y guárdelo a -80 °C.
7. Deconstrucción y limpieza del sistema de mini-biorreactor
- Desconecte la botella de origen de la fuente de lubricación y aumente el caudal (1 mL/min en la bomba de origen y 2 mL/min en la bomba de desagüe) para comenzar a vaciar el tubo. Deje que el tubo se vacíe por completo. Apague la placa para revolver.
- Una vez que el tubo esté vacío, desconecte la botella de residuos de la válvula de desechos. Luego, coloque el conjunto del reactor en la esclusa de aire de la cámara anaeróbica y retírelo de la cámara.
- Desconecte todos los segmentos de tubería E-LFL de 2,06 mm y PTFE y deséchelos. Desconecte todos los accesorios y colóquelos en una solución de lejía al 10%.
- Retire las minibarras de agitación de cada pozo de la matriz y colóquelas en la solución de lejía. Invierta la matriz del reactor para vaciar el medio en una solución de lejía al 10% separada para la desinfección. Luego, sumerja la matriz vacía en una solución de lejía nueva.
- Deje que todos los accesorios y el conjunto del reactor se remojen en la solución de lejía al 10% durante 30 minutos (el remojo prolongado causará decoloración).
- Enjuague los accesorios y el conjunto del reactor con agua desionizada, luego sumérjalos durante la noche en una solución de detergente enzimático de acuerdo con las instrucciones del fabricante.
- Enjuague tres veces los accesorios y la matriz del reactor con agua desionizada, luego deje que se sequen completamente al aire durante al menos 3 días. Una vez secos, el conjunto de reactores y los accesorios se pueden utilizar para el montaje una vez más.
Resultados
Se recogieron muestras fecales de ratones colonizados con purín fecal humano 2 semanas después de la inoculación y se almacenaron a -80 °C. El sistema de biorreactor se configuró con flujo continuo de medios MEGA para dos pozos de reactores replicados (Figura 3A). La suspensión fecal se preparó a partir de los gránulos fecales de ratón de acuerdo con el protocolo descrito en el paso 6, y ambos reactores se inocularo...
Discusión
El sistema de mini-biorreactor descrito en este protocolo permite el cultivo de comunidades fecales independientes para la experimentación paralela. Esta capacidad de estudiar las comunidades microbianas de forma aislada de los factores del huésped es un enfoque esencial para comprender la capacidad intrínseca de los microorganismos para adaptarse a su entorno. Este protocolo se puede adaptar fácilmente para el cultivo de consorcios bacterianos definidos o incluso cultivos aislados i...
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Los autores están agradecidos a Josee Gauthier por la ayuda con la secuenciación del gen 16S rRNA. Esta investigación fue apoyada, en parte, por los Fondos del Centro Oncológico de UF Health (C.J.) y el Fondo Gatorade del Departamento de Medicina de la UF (C.J.). R.Z.G. contó con el apoyo de los fondos del Centro Oncológico de UF Health. R.C.N. contó con el apoyo de la Subvención de Capacitación TL1 de los Institutos Nacionales de Salud de la Universidad de Florida (TL1TR001428, UL1TR001427), el Programa de Capacitación en Investigación del Cáncer Interdisciplinario Basado en Equipos del Instituto Nacional del Cáncer de los Institutos Nacionales de Salud T32CA257923 y el Centro Oncológico de UF Health. La investigación reportada en esta publicación fue apoyada por el UF Health Cancer Center, respaldada en parte por las asignaciones estatales provistas en Fla. Stat. § 381.915 y el Instituto Nacional del Cáncer de los Institutos Nacionales de Salud bajo la Adjudicación Número P30CA247796. El contenido es responsabilidad exclusiva de los autores y no representa necesariamente las opiniones oficiales de los Institutos Nacionales de Salud o del Estado de Florida. Los financiadores no desempeñaron ningún papel en el diseño del estudio, la recopilación de datos y el análisis; decisión de publicar; o la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL BD Slip Tip Syringe sterile, single use | Fisher Scientific | 309659 | |
| 1/4-28 mm thread to barbed male adaptor (3.2 mm), 5/pack | Cole-Parmer | 008NB32-KD5L | To build 1 6-well array, need 2 packs |
| 10M NaOH (Sodium Hydroxide) | Sigma | 72068-100ML | |
| 2.0ml Screw Cap Tube, NonKnurl, Skirted,Natural, E-Beam Sterile tube w/ attached cap | Fisher Scientific | 14-755-228 | |
| 2mag MIXdrive 60 Stirring Drive | 2mag | 40060 | 60-position magnetic stir plate (optional addition of heating capacity- cat# 40260) |
| 6-well reactor arrray, ABS-Like Translucent Clear plastic | Protolabs | Custom | See supplementary files for .stl file for 3D printing |
| Absolute Ethanol (200 Proof) | Fisher Scientific | BP2818 | |
| Acetic acid, glacial | Sigma | A6283 | |
| Adapter, nylon, male luer to 1/4-28 thread, 25/pack | Cole-Parmer | EW-45505-82 | To build 1 6-well array, need 6 (1 pack) |
| Aluminum foil | Fisher Scientific | 01-213-100 | |
| Anaerobic chamber | Coy Lab Products | Type B | |
| Bel-Art SP Scienceware Flea Micro Spinbar Magnetic Stirring Bars (1/pk) | Fisher Scientific | 22-261679 | To build 1 6-well array, need 6 |
| Biosafety cabinet class 2 | Nuaire | ||
| Butyric acid | Sigma | B103500 | |
| CaCl2 · 2H2O (Calcium Chloride Dihydrate) | Sigma | C7902 | |
| Clorox Healthcare Germicidal Wipes With Bleach, Unscented, 6" x 5", Pack Of 150 Wipes | Office Depot | 129202 | |
| D-(-)-Fructose | Sigma | F0127-100G | |
| D-(+)-Cellobiose | Sigma | C7252-100G | |
| D-(+)-Glucose | Sigma | G8270-100G | |
| D-(+)-Maltose monohydrate | Sigma | M5885-100G | |
| Drill America Plug Hand Tap DWTP1/4-28 | Home Depot | 305699489 | |
| Dulbecco's Phosphate Buffered Saline, 1X without Ca and Mg, Sterile | Genesee | 25-508 | |
| Female luer × 1/16″ hose barb adapter, Nylon, 25/pack | Cole-Parmer | EW-45502-00 | To build 1 6-well array, need 24 (1 pack) |
| Female luer × 1/8″ hose barb adapter, Nylon 25/pack | Cole-Parmer | EW-45502-04 | To build 1 6-well array, need 6 (1 pack) |
| Female luer × 3/32″ hose barb adapter, Nylon, 25/ pack | Cole-Parmer | EW-45502-02 | To build 1 6-well array, need 6 (1 pack) |
| Female luer tee, Nylon, 25/pack | Cole-Parmer | EW-45502-56 | To build 1 6-well array, need 10 (1 pack) |
| FeSO4 · 7H2O (Iron [II] Sulfate Heptahydrate) | Sigma | F8633 | |
| Hematin | Sigma | H3281 | |
| Histidine | Sigma | H7750 | |
| Isovaleric acid | Sigma | 129542 | |
| K2HPO4 dibasic (dipotassium hydrogen phosphate) | Sigma | P2222-1KG | |
| KH2PO4 monobasic (potassium dihydrogen phosphate) | Sigma | P0662-500G | |
| Large Orifice Pipet Tips | Fisher Scientific | 02-707-134 | |
| L-Cysteine hydrochloride | Sigma | C1276-10G | |
| Male luer with lock ring × 1/8″ hose barb adapter, Nylon, 25/pack | Cole-Parmer | EW-45505-04 | To build 1 6-well array, need 42 (2 packs) |
| Meat extract | Sigma | 70164-500G | |
| Med Vet International Exel Needle, 20G X 1", Hypodermic, 100/Box, 26417 | Fisher Scientific | 50-209-2532 | |
| Menadione (Vitamin K3) | Sigma | M5625 | |
| MgSO4 · 7H2O (Magnesium Sulfate Heptahydrate) | Sigma | M1880-500G | |
| Milli-Q water | |||
| NaCl (Sodium Chloride) | Sigma | S9888-500G | |
| NaHCO3 (Sodium Bicarbonate) | Sigma | S5761-500G | |
| Omnifi t Q-series two hole bottle cap | Cole-Parmer | 00945Q-2 | To build 1 6-well array, need 1 |
| PMP IPC-N L 24CHNL 8RLR 115V | MasterFlex | ISM939C-115V | 24-channel peristaltic pump, require 1 for source and 1 for waste |
| Precision Seal® rubber septa,white, 7 mm O.D. glass tubing (100/pk) | Millipore Sigma | Z553905-100EA | To build 1 6-well array, need 6 septa |
| Propionic acid | Sigma | P5561 | |
| Pump Tubing, 2-Stop, Tygon S3 E-Lab, 1.02 mm ID; 12/PK | VWR | MFLX96460-28 | To build 1 6-well array, need 6 (1 pack) |
| Pump Tubing, 2-Stop, Tygon S3 E-Lab, 1.14 mm ID; 12/PK | VWR | MFLX96460-30 | To build 1 6-well array, need 6 (1 pack) |
| Puritan Cary-Blair Medium, 5 ml | Fisher Scientific | 22-029-646 | |
| PYREX 2L Round Media Storage Bottles, with GL45 Screw Cap | Fisher Scientific | 06-414-1E | |
| Razor Blades | Genesee | 12-640 | |
| Resazurin, sodium salt | ACROS Organics from ThermoFisher | AC41890-0010 | |
| Soluble starch | Sigma | S9765-100G | |
| Stainless Steel Micro Spatulas, spoon like blade | Fisher Scientific | S50823 | |
| TBNG TYGON ELFL 2.06MMID 100' | VWR | MFLX06449-42 | To build 1 6-well array, need 205.5 cm |
| Trace Mineral Supplement | ATCC | MD-TMS | |
| Trypticase Peptone (BBL) | Fisher Scientific | B11921 | |
| Tubing, PTFE, 1/8″ (3.2 mm) OD × 1.5 mm ID, 10 M | Cole-Parmer | 008 T32-150-10 | To build 1 6-well array, need 300 mm |
| Tween 80 | Sigma | P1754 | |
| Vitamin Supplement | ATCC | MD-VS | |
| Yeast Extract (Bacto) | Fisher Scientific | DF0127-17-9 |
Referencias
- Sender, R., Fuchs, S., Milo, R. Revised estimates for the number of human and bacteria cells in the body. PLoS Biol. 14 (8), e1002533 (2016).
- Postler, T. S., Ghosh, S. Understanding the holobiont: how microbial metabolites affect human health and shape the immune system. Cell Metab. 26 (1), 110-130 (2017).
- Rooks, M. G., Garrett, W. S. Gut microbiota, metabolites and host immunity. Nat Rev Immunol. 16 (6), 341-352 (2016).
- Auchtung, J. M., Robinson, C. D., Farrell, K., Britton, R. A. MiniBioReactor Arrays (MBRAs) as a tool for studying C. difficile physiology in the presence of a complex community. Methods Mol Biol. 1476, 235-258 (2016).
- Han, S., et al. A metabolomics pipeline for the mechanistic interrogation of the gut microbiome. Nature. 595 (7867), 415-420 (2021).
- Bilinski, J., et al. Fresh versus frozen stool for fecal microbiota transplantation-assessment by multimethod approach combining culturing, flow cytometry, and next-generation sequencing. Front Microbiol. 13, 872735 (2022).
- Li, X. M., et al. Effects of stool sample preservation methods on gut microbiota biodiversity: New original data and systematic review with meta-analysis. Microbiol Spectr. 11 (3), e0429722 (2023).
- Fouhy, F., et al. The effects of freezing on faecal microbiota as determined using MiSeq sequencing and culture-based investigations. PLoS One. 10 (3), e0119355 (2015).
- Sun, X., et al. Microbiota-derived metabolic factors reduce Campylobacteriosis in mice. Gastroenterology. 154 (6), 1751-1763.e2 (2018).
- He, Z., et al. Campylobacter jejuni promotes colorectal tumorigenesis through the action of cytolethal distending toxin. Gut. 68 (2), 289-300 (2019).
- Newsome, R. C., et al. Interaction of bacterial genera associated with therapeutic response to immune checkpoint PD-1 blockade in a United States cohort. Genome Med. 14 (1), 35 (2022).
- Ziv, N., Brandt, N. J., Gresham, D. The use of chemostats in microbial systems biology. J Vis Exp. (80), e50168 (2013).
- Wille, J., Coenye, T. Biofilm dispersion: The key to biofilm eradication or opening Pandora's box. Biofilm. 2, 100027 (2020).
- Biagini, F., et al. Designs and methodologies to recreate in vitro human gut microbiota models. Bio-des Manuf. 6 (3), 298-318 (2023).
- Qi, Y., Yu, L., Tian, F., Zhao, J., Zhai, Q. In vitro models to study human gut-microbiota interactions: Applications, advances, and limitations. Microbiol Res. 270, 127336 (2023).
- Gościniak, A., Eder, P., Walkowiak, J., Cielecka-Piontek, J. Artificial gastrointestinal models for nutraceuticals research-achievements and challenges: A practical review. Nutrients. 14 (13), 2560 (2022).
- Marrero, D., et al. Gut-on-a-chip: Mimicking and monitoring the human intestine. Biosens Bioelectron. 181, 113156 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados