É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Montagem de biorreatores para cultura contínua de comunidades fecais complexas
Neste Artigo
Resumo
Este protocolo detalha a montagem de matrizes de mini-biorreatores a serem utilizados para cultura de fluxo contínuo de comunidades fecais complexas sob condições anaeróbicas. Também discutimos os métodos de montagem, inoculação e amostragem dos reatores para análise posterior.
Resumo
A microbiota, especialmente as bactérias, responde a várias exposições ambientais, como micro e macronutrientes, compostos farmacológicos e mediadores inflamatórios, que alteram dinamicamente a composição da comunidade e a produção metabólica microbiana. Compreender como as condições fisiológicas da cultura afetam as comunidades e a diversidade microbiana e sua capacidade metabólica contribuirá com um conhecimento importante de seu impacto na saúde e nas doenças. Aqui, apresentamos um protocolo adaptado do modelo publicado por Auchtung et al. para criar matrizes de mini-biorreatores que podem cultivar comunidades fecais complexas, definir consórcios bacterianos ou cepas únicas sob condições precisas, incluindo disponibilidade de nutrientes, temperatura, taxa de fluxo, pH e teor de oxigênio. Descrevemos o processo de construção do sistema de mini-biorreator, incluindo adaptações para melhorar as limitações no protocolo publicado. Também discutimos a configuração do sistema de mini-biorreator sob condições anaeróbicas com o uso de meios MEGA (adaptados de Han et al.), que é um meio rico que suporta o crescimento de diversas bactérias. Descrevemos a inoculação de amostras fecais de camundongos humanizadas no intestino no sistema de mini-biorreator, seguida pelo estabelecimento de culturas complexas de comunidades dentro do sistema de mini-biorreator, que podem ser cultivadas sob fluxo contínuo com amostragem asséptica para monitorar a composição da comunidade. Este sistema é adaptável a mudanças na dieta e outras modificações culturais. As técnicas descritas aqui permitem a caracterização de diversas comunidades fecais exigentes sob condições dinâmicas ou em resposta à perturbação isolada de fatores derivados do hospedeiro.
Introdução
A microbiota intestinal é uma vasta rede de microrganismos, incluindo bactérias, fungos, arqueias e vírus, que contêm um enorme repertório genético e metabólico que supera em muito o de um hospedeiro humano1. A rica capacidade metabólica do microbioma inclui metabólitos produzidos a partir do processamento bacteriano de nutrientes dietéticos, metabólitos hospedeiros quimicamente modificados por bactérias e metabólitos sintetizados exclusivamente pela microbiota2. A microbiota está implicada em quase todos os bioprocessos do hospedeiro, mas também em estados de doença como doença inflamatória intestinal, câncer, distúrbios metabólicos e até distúrbios neurológicos 2,3. Dissecar a contribuição da microbiota da do hospedeiro é essencial para entender o papel de microrganismos específicos ou comunidades complexas na saúde e na doença. Uma abordagem que permite essa dissecação é o uso de biorreatores microbianos, que cultivam diversas comunidades microbianas sob condições dinâmicas. Existem muitos biorreatores disponíveis comercialmente que permitem o crescimento de comunidades bacterianas fecais para quase qualquer finalidade, incluindo o cultivo de bioprodutos em larga escala ou o controle preciso de fatores nutritivos específicos para o estudo de processos metabólicos. No entanto, esses sistemas são extremamente caros e requerem preparação extensiva, e não permitem que diversas condições experimentais sejam examinadas em paralelo. Para uma abordagem simplificada que seja menos dispendiosa, mais adaptável e permita muitas condições paralelas, apresentamos aqui o protocolo para a configuração e uso de um arranjo de mini-biorreatores sob fluxo contínuo adaptado de Auchtung et al.4.
A configuração completa do sistema de mini-biorreator é demonstrada na Figura 1A. Este sistema de mini-biorreator usa matrizes de 6 poços de reatores, que são completamente independentes uns dos outros e são configurados em uma câmara anaeróbica sob fluxo peristáltico para permitir a entrega e remoção contínua do meio (Figura 1A). Cada conjunto de reatores fica em uma placa de agitação magnética de 60 posições, com duas bombas peristálticas de 48 segurando tubos de 2 pontos para o meio de origem e fluxo de resíduos (Figura 1A). A câmara anaeróbica está equipada com um monitor anaeróbico CAM-12 para conteúdo de oxigênio, uma caixa de catalisador para remover oxigênio com capacidade de aquecimento e uma coluna de remoção de sulfeto de hidrogênio para absorver o excesso de gás do metabolismo bacteriano. Cada poço do reator é equipado com uma entrada de meio de origem, saída de resíduos e porta de amostra, o que permite a inoculação ou amostragem de cada poço de reator individual (Figura 1B).
Conforme descrito, o sistema de biorreator permite o controle dinâmico sobre a temperatura, o consumo de meio e a disponibilidade de nutrientes para apoiar o cultivo e a manutenção das comunidades fecais. A temperatura é modulada por uma caixa de catalisador com capacidade de aquecimento, permitindo que mudanças de temperatura em toda a câmara anaeróbica sejam implementadas rapidamente. O consumo de mídia é regulado por taxas de fluxo de bomba peristáltica, que podem ser modificadas para alterar a rotatividade de mídia nos reatores. A rotatividade do meio pode ser personalizada para os tipos de comunidade que estão sendo cultivados em reatores, por exemplo, sendo adaptados para cepas-alvo de crescimento lento ou muito rápido. Por fim, a disponibilidade de nutrientes pode ser modificada dinamicamente adicionando componentes através das portas de amostra individuais para cada poço do reator. As condições estáticas que podem ser modificadas no início de um experimento, mas que não têm controle dinâmico no sistema, são o tipo de meio, o teor de oxigênio e o número de reatores simultâneos. Os investigadores podem optar por implementar qualquer mídia de origem que desejarem e, embora uma mídia seja descrita aqui, vários outros tipos de mídia de origem foram implementados com sucesso. Pode-se operar os reatores em condições aeróbicas ou microaerofílicas (dependendo da disponibilidade de uma câmara microaerofílica). Por fim, podem ser instalados tantos ou menos reactores quantos forem necessários, dependendo das necessidades experimentais do investigador. Enquanto os reatores estão em conjuntos de seis dentro de uma matriz, cada reator opera independentemente dos outros e cada um pode ser conectado a uma fonte diferente, se desejado.
Este sistema modular de biorreator pode ser completamente configurado por cerca de US $ 25.000 (sem incluir a câmara anaeróbica ou componentes específicos da câmara), com a única parte não reutilizável sendo a tubulação que pode ser substituída por menos de US $ 100 por execução do sistema. O sistema é principalmente automatizado, mas requer verificação diária dos níveis de mídia, pois os frascos de fonte de mídia precisarão ser trocados quando vazios. Além disso, qualquer amostragem deve ser concluída manualmente e quaisquer alterações condicionais dinâmicas no sistema precisarão ser iniciadas manualmente (por exemplo, alteração da temperatura). A partir do protocolo original do sistema publicado por Auchtung et al., algumas modificações foram implementadas para melhorar o desempenho geral e a utilidade4. Em primeiro lugar, o material para impressão 3D da matriz do biorreator é modificado para ser plástico transparente translúcido semelhante ao ABS para melhorar a integridade estrutural do sistema por meio de repetidas rodadas de autoclavagem. Além disso, no lugar da tubulação de PTFE de 1/8 de polegada (3,2 mm) OD, E-LFL, 2,06 mm de diâmetro interno, a tubulação de 100 pés é usada devido ao material mais resistente, que é mais resistente ao colapso, o que causaria bloqueios no fluxo no sistema. Por fim, um encaixe adicional usando rosca de 1/4 -28 mm para adaptadores macho farpado é usado para reduzir as mudanças no deslizamento do tubo dos frascos de fonte de mídia. De Han et al., a receita de mídia MEGA adaptada fornece um meio indefinido, complexo e altamente rico que permite o cultivo de microrganismos anaeróbicos exigentes5. O meio é modificado para utilizar a preparação alternativa do componente histidina-hematina, pois o original não está mais disponível comercialmente. O hidróxido de sódio também é usado para pH do meio para 7,0 ou qualquer pH desejado. No geral, este sistema é econômico e fácil de usar, otimizado e um excelente ponto de entrada para sistemas de cultura de fluxo contínuo.
Neste protocolo, descrevemos em detalhes a configuração deste sistema de matriz de mini-biorreatores, incluindo materiais, esterilização do sistema e uso subsequente para cultivo de amostras fecais murinas humanizadas no intestino. O objetivo geral deste método é construir um sistema de biorreator adaptável e econômico que possa ser utilizado para cultivar comunidades microbianas sob condições controladas. Um esquema detalhado do fluxo de trabalho para a montagem do sistema de mini-biorreator é fornecido na Figura 2 e referenciado nas etapas apropriadas dentro do protocolo. Em nosso exemplo, inoculamos dois reatores com a mesma amostra fecal de camundongos intestinais humanizados e descrevemos a estrutura da comunidade microbiana sob um fluxo contínuo de meio MEGA.

Figura 1: Diagrama esquemático da configuração da matriz de minibiorreatores na câmara anaeróbica. (A) Visão completa da configuração completa da matriz de minibiorreatores na câmara anaeróbica. O conjunto de biorreatores de 6 poços está situado na placa de agitação magnética de 60 posições. A rede luer tee de origem é conectada à mídia de origem no lado esquerdo através da tampa da garrafa de dois orifícios. Duas bombas peristálticas seguram a tubulação de 2 pontos da fonte e das redes de resíduos à esquerda e à direita, respectivamente. A rede de resíduos luer tee deságua na garrafa de resíduos do lado direito. Equipamentos essenciais para a operação da câmara anaeróbica, incluindo o monitor CAM-12, caixa de catalisador com capacidade de aquecimento e coluna de remoção de sulfeto de hidrogênio, estão dispostos dentro da câmara ao redor do sistema de matriz. (B) Vista superior da fonte, amostra e portas de resíduos conectadas a um poço de reator com mídia na altura apropriada no reator. Clique aqui para ver uma versão maior desta figura.
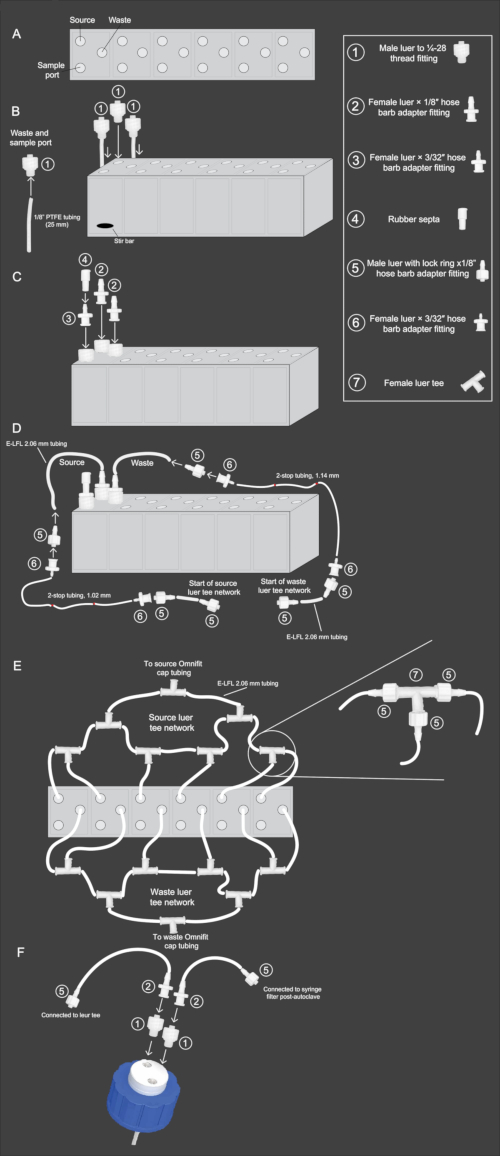
Figura 2: Diagrama esquemático do fluxo de trabalho de montagem da matriz de mini-biorreatores. (A) Vista de cima para baixo da matriz de mini-biorreatores, mostrando a orientação da fonte, resíduos e portas de amostra. (B) Vista lateral da matriz de mini-biorreatores com vista ilustrando as etapas 2.3-2.4 do protocolo. A tubulação e a conexão de PTFE de 1/8 de polegada (1) são conectadas e inseridas nas portas de resíduos e amostras. A conexão (1) sem PTFE é inserida na porta de origem. (C) Vista lateral da matriz de mini-biorreatores ilustrando as etapas 2.5-2.6 do protocolo. O encaixe (2) está conectado às portas de origem e resíduos. O encaixe (3) é conectado à porta de amostra e, a isso, o encaixe (4) é inserido na parte superior. (D) Vista lateral da matriz de mini-biorreatores ilustrando as etapas 2.9-2.11. A tubulação E-LFL de 2.06 mm é conectada às portas de origem e resíduos, e a outra extremidade é conectada às conexões (5) e depois (6). A tubulação de 2 paradas do diâmetro apropriado é então conectada à conexão (6). A conexão reversa é então repetida na extremidade da tubulação de 2 pontos, com a conexão (6) conectando à tubulação de 2 pontos e a conexão (5) conectando-se a ela. Por fim, a tubulação E-LFL de 2.06 mm será conectada ao encaixe (5) para conexão à rede luer tee. (E) Vista de cima para baixo da matriz de minibiorreatores exibindo a configuração da rede luer tee de fontes e resíduos descrita nas etapas 2.12-2.15. A tubulação E-LFL de 2.06 mm terminando na conexão (5) é usada para conectar cada reator a várias conexões (7), cuja última abertura é conectada à tampa da fonte ou garrafa de resíduos. (F) Vista lateral do conjunto da tampa da garrafa de dois orifícios descrito nas etapas 2.16-2.17. Uma abertura na tampa é conectada à tubulação de PTFE que é colocada dentro da garrafa. A essa abertura é inserido o encaixe (1), seguido pelo encaixe (2) e a tubulação E-LFL de 2.06 mm conectada ao encaixe (5). Este acessório é conectado à rede luer de origem ou resíduo. Na abertura não conectada à tubulação de PTFE, a conexão (1) é inserida, seguida pela conexão (2), e a tubulação E-LFL de 2.06 mm é conectada a outra conexão (5). Esta extremidade é tampada com papel alumínio durante a esterilização em autoclave para futura fixação a um filtro de seringa estéril de 0,22 μM. Clique aqui para ver uma versão maior desta figura.
Protocolo
As amostras fecais utilizadas neste estudo foram obtidas de experimentos aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade da Flórida (UF) e realizados nas Instalações de Cuidados com Animais da UF (Protocolo IACUC #IACUC202300000005). Resumidamente, o tipo selvagem livre de germes de gênero misto (GF WT; C57BL / 6) (criados e mantidos em isoladores pela Divisão Livre de Germes da UF Animal Care Services) foram transferidos de isoladores de reprodução e colocados no sistema de bioexclusão ISOcage P para permitir a manipulação microbiana. Unidades formadoras de colônias (UFC) iguais de fezes de doadores humanos foram agrupadas para gavagem em camundongos. Duas semanas após a inoculação, amostras fecais desses camundongos foram coletadas assepticamente para armazenamento e posterior uso neste protocolo.
NOTA: A coleta e preparação de amostras fecais descritas aqui são apenas um exemplo de procedimento adequado, pois dependendo do tipo de amostras coletadas (humano, camundongo, outro animal) e do armazenamento dessas amostras, esse procedimento pode variar muito. Os indivíduos devem consultar a literatura apropriada para elaborar um protocolo para coleta e preservação de amostras fecais com base nas necessidades de cada pesquisador.
1. Preparação típica de amostras fecais para armazenamento a -80 °C
- Selecione um meio de preservação de viabilidade anaeróbica (aqui, usamos Cary Blair). Alicote 1 mL de meio de preservação em tubos estéreis, tampa de rosca de 2 mL em um gabinete de biossegurança e, em seguida, transfira para a câmara anaeróbica.
- Antes de receber amostras fecais, certifique-se de que todos os suprimentos (espátulas autoclavadas, solução salina estéril e frascos criogênicos com tampa de rosca contendo meios de preservação) sejam pré-reduzidos por 24 h na câmara anaeróbica.
- Colete amostras fecais assepticamente de camundongos usando tubos estéreis em um gabinete de biossegurança usando copos e pinças de coleta de fezes autoclavados. Imediatamente após a coleta, congele os tubos em nitrogênio líquido.
- Transfira imediatamente as amostras para uma câmara anaeróbica junto com uma balança portátil para pesagem. Pré-pesar cada tubo. Para amostras fecais de camundongos, pastilhas fecais separadas podem ser aliquotadas por tubo. Se estiver usando amostras humanas, use as espátulas estéreis para agitar cada amostra e divida-a igualmente em frascos criogênicos. Depois de pesar novamente cada tubo, adicione meio a uma proporção estimada de 1:10 meio de fezes (massa: massa) a cada tubo para preservação ideal.
NOTA: Recomenda-se a preservação anaeróbica imediata de amostras fecais após a coleta. Amostras não preservadas imediatamente podem ter viabilidade reduzida, alterações de composição, etc., em comparação com amostras recém-preservadas 6,7,8. Os meios de preservação Cary Blair mantêm a viabilidade das comunidades bacterianas enquanto inibem o crescimento e podem ser armazenados a -80 °C. Para a proporção estimada de meios de preservação para fezes, embora o peso úmido da amostra fecal seja altamente variável, esta é a melhor estimativa disponível. - Rotule, feche, remova os frascos da câmara anaeróbica, congele o flash com nitrogênio líquido e armazene a -80 ° C por até um ano ou mais.
2. Construindo um conjunto de reatores de 6 poços
- Use o arquivo CAD (Arquivo Suplementar 1) para impressão 3D do reator de 6 poços. Este arquivo pode ser enviado a qualquer empresa de impressão 3D para produção. Use plástico transparente translúcido semelhante a ABS como material de impressão para permitir a visualização através dos reatores, ao mesmo tempo em que é resistente a ciclos repetidos de autoclavagem.
NOTA: Comissionamos as matrizes de reatores de 6 poços para serem feitas de plástico transparente translúcido semelhante a ABs por estereolitografia. Recomendamos que a matriz seja inclinada (ou seja, que a peça seja impressa em 3D em um ângulo de 30% a 45%) na produção, o que reduz as imprecisões dimensionais. Essa correção resultará em linhas de camada visíveis correndo diagonalmente pela matriz, mas isso não afeta o desempenho dos reatores. - Usando uma ferramenta de rosqueamento de 25-28 mm, introduza roscas de parafuso em cada abertura da matriz do reator.
- Corte tiras de 12 e 25 mm da tubulação de PTFE de 1/8 de polegada e insira uma extremidade de cada segmento da tubulação na abertura da rosca de um luer macho para encaixe de rosca 25-28. Aparafuse firmemente as conexões nas aberturas designadas de resíduos e samples da matriz (Figura 2B).
NOTA: Uma lâmina de barbear pode ser usada para raspar levemente as extremidades do tubo em uma configuração semelhante a um cone para tornar o tubo mais adequado para a inserção. - Insira uma micro barra de agitação em cada poço do reator e, em seguida, aparafuse um encaixe de rosca macho 1/4-28 nos orifícios de origem de cada poço do reator (Figura 2B).
- Aparafuse as conexões do adaptador de farpa de mangueira luer x 1/8 de polegada nos encaixes de rosca 1/4-28 para os resíduos e a fonte de cada poço do reator (Figura 2C).
- Aparafuse as conexões do adaptador de farpa de mangueira luer x 3/32 de polegada nas conexões de rosca 1/4-28 para a porta de amostra. Coloque um septo de borracha sobre os adaptadores de farpa de mangueira de 3/32 de polegada e dobre a parte superior (Figura 2C).
- Corte dois conjuntos de tubos E-LFL, 2.06 mm nos seguintes comprimentos para as linhas de resíduos e fontes: 14 cm, 15.25 cm, 16.5 cm, 17.75 cm, 19 cm e 20.25 cm.
NOTA: A fita adesiva colorida enrolada no meio pode ser usada para identificar cada comprimento de tubo. - Conecte a tubulação E-LFL de 2.06 mm às conexões do adaptador de espiga de mangueira luer fêmea de 1/8 de polegada para as conexões de fonte e resíduos (Figura 2D). Use água quente para tornar a tubulação mais maleável. Isso permitirá que a tubulação se encaixe facilmente nos adaptadores.
- Conecte um luer macho com um anel de trava x adaptador de farpa de mangueira de 1/8 de polegada na outra extremidade da tubulação. Aparafuse um adaptador de espiga de mangueira luer x 1/16 de polegada fêmea encaixado nele (Figura 2D).
- Conecte a tubulação de 2 pontos de tamanho apropriado às conexões de resíduos e fontes correspondentes. As linhas de resíduos usam tubos de 1,14 mm de diâmetro interno de 2 pontos, enquanto as linhas de origem usam tubos de 1,02 mm de diâmetro interno de 2 pontos. Na outra extremidade da tubulação de 2 paradas, conecte outro encaixe adaptador de espiga de mangueira luer x 1/16 de polegada fêmea (Figura 2D).
- Corte pedaços de 20,5 cm de E-LFL, tubo de 2.06 mm e insira luer macho com anel de trava x conexões adaptadoras de farpa de mangueira de 1/8 de polegada em ambas as extremidades de cada tubo. Conecte uma extremidade da tubulação de 5 cm com o luer macho com anel de trava x adaptador de farpa de mangueira de 1/8 de polegada ao adaptador de luer fêmea desocupado x adaptador de espiga de mangueira de 1/16 de polegada na extremidade de cada seção de tubulação de 2 paradas. Repita esse processo para os 19 pedaços restantes de tubulação (Figura 2D).
- Conecte a tubulação E-LFL, de 2.06 mm para as linhas de origem dos poços do reator 1 e 2 usando extremidades opostas de um T luer fêmea. Conecte um dos pedaços de tubulação de 5 cm com luer macho com anel de trava x conexões adaptadoras de 1/8 de polegada em cada extremidade à saída do meio do T, levando a uma segunda junção em T (Figura 2E).
- Conecte o E-LFL, tubulação de fonte de 2.06 mm para o terceiro reator, ao lado oposto do segundo tee. Outro tubo de 5 cm com um luer macho com um anel de trava x adaptador de 1/8 de polegada deve ser conectado em uma extremidade, enquanto a outra extremidade deve ter um luer fêmea com um adaptador de anel de trava x 1/8 de polegada conectado. Siga o mesmo padrão para os reatores 4, 5 e 6 (Figura 2E).
- Corte um pedaço de 25 cm de E-LFL, tubulação de 2.06 mm, conectando um luer macho com anel de trava x adaptador de farpa de mangueira de 1/8 de polegada encaixe em uma extremidade da tubulação, que será anexado à última junção em T luer fêmea restante, e na outra extremidade conecte um encaixe adaptador de farpa de mangueira luer fêmea x 1/8 de polegada. Cubra esta extremidade com papel alumínio (Figura 2E).
NOTA: Durante a operação, é essencial manter as extremidades abertas estéreis, por isso recomendamos mantê-las tampadas com papel alumínio durante a autoclavagem e presas com fita adesiva. - Prepare as linhas de resíduos repetindo o mesmo procedimento que as linhas de origem descritas nas etapas 2.12-2.14 (Figura 2E).
- Para montar uma garrafa de coleta de lixo, prenda frouxamente uma tampa de garrafa de dois orifícios em uma garrafa de 2 L. Insira conexões de rosca macho 1/4-28 em ambos os orifícios da tampa. Conecte um luer fêmea com adaptadores de farpa de mangueira de 1/8 de polegada ao encaixe de rosca macho que não se conecta ao tubo de PTFE pré-conectado na tampa (Figura 2F).
- Em seguida, corte um pedaço de 5 cm de tubo E-LFL de 2.06 mm e conecte-o ao adaptador de farpa da mangueira na garrafa. Conecte um luer macho com anel de trava x adaptador de farpa de mangueira de 1/8 de polegada na outra extremidade do tubo de 5 cm e cubra-o com papel alumínio (este tubo serve como saída de ar; após a autoclavagem, um filtro de seringa de 0.22 μm será adicionado para evitar contaminação; Figura 2F).
- Cubra toda a tampa com papel alumínio. Autoclave os reatores e o frasco de resíduos a 121 °C e um mínimo de 15 psi por 45 min usando o programa de exaustão lenta normalmente definido para líquidos. Uma vez que os reatores tenham resfriado, aperte as conexões e as vedações de folha de alumínio e coloque-as na câmara anaeróbica por 48 h antes do uso.
3. Preparação de mídia MEGA
- Prepare todas as soluções-mãe de acordo com a Tabela Suplementar 1, Tabela Suplementar 2, Tabela Suplementar 3, Tabela Suplementar 4, Tabela Suplementar 5, Tabela Suplementar 6, Tabela Suplementar 7, Tabela Suplementar 8.
- Em uma garrafa de vidro de 2 L, adicione todos os ingredientes secos da Tabela Suplementar 9, seguidos por 1640 mL de água ultrapura e, em seguida, o restante dos ingredientes líquidos da Tabela Suplementar 10 . Adicione um A mídia será de cor azul pálida a violeta e não será totalmente clara, mas não terá nenhum nódulo óbvio não dissolvido.
NOTA: A autoclavagem de glicose e outros açúcares na presença de peptídeos pode levar à modificação e reduzir o açúcar disponível no meio. Se desejado, todas as soluções de açúcar podem ser filtradas estérilmente e adicionadas com os componentes da Tabela Suplementar 10, conforme descrito na etapa 3.7. - Depois de totalmente misturado, ajuste o pH do meio para 7,0 adicionando 10 N de hidróxido de sódio (NaOH), medindo exatamente quanto volume é adicionado. Após a medição do pH, adicione 14,4 mL de água menos o volume de hidróxido de sódio adicionado para trazer o volume para exatamente 2 L.
- Prepare uma tampa de garrafa de dois orifícios inserindo um encaixe de rosca luer macho de 1/4-28 mm em ambas as aberturas.
- No orifício da tampa não pré-fixada à tubulação de PTFE, corte um pedaço de 5 cm da tubulação C-flex e conecte-o à farpa da mangueira de 1/8 de polegada da conexão luer fêmea. Na outra extremidade do tubo de 5 cm, insira outro luer macho com um anel de trava e um adaptador de farpa de mangueira de 1/8 de polegada e cubra com papel alumínio (este também será conectado a um filtro de seringa de 0.22 μM).
- Cubra toda a tampa com papel alumínio e enrosque a parte superior do frasco de mídia MEGA de 2 L. Autoclave a 121 °C e um mínimo de 15 psi por 45 min, usando o programa de exaustão lenta para líquidos.
- Remova a mídia da autoclave e deixe esfriar mexendo até ficar morna. Adicione os componentes da Tabela Suplementar 10 ao frasco de mídia de 2 L em um gabinete de biossegurança, feche a tampa e passe para uma placa de agitação para homogeneizar. Assim que o meio esfriar, aperte as conexões e as vedações de folha de alumínio e coloque-as na câmara anaeróbica por 48 h antes do uso.
NOTA: Recomendamos operar a bomba de origem a 16 μL/min (0.94 mL/h) por um tempo de retenção de 16 h. Para essa vazão, um reator de 6 poços usa aproximadamente 0,135 L de meio por dia. Também recomendamos operar a bomba de resíduos a 40 μL/min para evitar a formação de bloqueio na tubulação de resíduos. Monitore a tubulação e o fluxo, observando que o fluxo de resíduos pode ser aumentado conforme apropriado se ocorrerem bloqueios. As taxas de fluxo de fonte e resíduos são modificáveis, mas os investigadores devem monitorar cuidadosamente a composição e as taxas de crescimento da comunidade, pois elas também podem mudar com um fluxo mais rápido ou mais lento. Para operar um reator de 6 poços por uma semana, recomendamos fazer pelo menos 2L de mídia (consumirá um pouco mais de 1 L).
4. Configuração da matriz na câmara anaeróbica
NOTA: É essencial limpar o interior do capô e as luvas do capuz com peróxido de hidrogênio a 3%, seguido de enxágue triplo com água deionizada para garantir que não haja contaminação da superfície antes da montagem. Se as conexões forem feitas rapidamente após a remoção da película e nenhum contato direto for feito com o interior das conexões e as luvas da câmara anaeróbica, há uma chance mínima de contaminação
- Alinhe a matriz sobre uma placa de agitação magnética na câmara anaeróbica. Certifique-se de que a matriz esteja alinhada corretamente ajustando o controlador da placa de agitação para a velocidade máxima (1600 rpm) e observando as barras de agitação girando.
- Encaixe a tubulação de 2 pontos para a fonte e resíduos nas braçadeiras nas bombas peristálticas correspondentes. Se fizer isso menos de 24 horas antes do uso pretendido, trave o clamps no lugar. Caso contrário, deixe-o solto até a hora de usar para reduzir o desgaste da tubulação.
- Remova a tampa da folha nas conexões do adaptador de farpa de mangueira luer x 1/8 de polegada fêmea nas linhas de origem e resíduos e aparafuse na luer macho às conexões de ameaça de 1/4 -28 aparafusadas nas tampas (certifique-se de que esta abertura esteja conectada à tubulação interna de PTFE).
- Remova as tampas de alumínio e conecte um filtro de seringa de 0,22 μm à linha de ventilação de 5 cm do frasco de origem e à linha de ventilação do frasco de resíduos.
- Inicie o fluxo a uma taxa moderada (1 mL/min na bomba de origem e 2 mL/min na bomba de resíduos) para começar a encher os reatores. Certifique-se de que o tubo da linha de resíduos em cada poço do reator seja mais baixo do que o tubo de origem, o que evitará o enchimento excessivo ou o esvaziamento de cada poço.
- À medida que os reatores começarem a encher, certifique-se de que todos atinjam o mesmo volume e que o meio flua para a linha de resíduos. Com as medições descritas aqui, o volume de trabalho de cada reator é de 15 mL.
NOTA: Se algum reator individual não encher, aperte os encaixes soltos e inspecione as linhas de origem quanto a problemas, substituindo-as por extras preparados, se necessário. Se o problema persistir, substitua a garrafa de origem, se disponível. Se o nível médio subir acima da linha de resíduos interna nos reatores, inspecione se a tubulação de PTFE no interior da porta de resíduos do reator ainda está no lugar. - Após o enchimento de cada reator, ajuste as configurações da bomba para a vazão de 16 μL/min e, em seguida, desligue as bombas.
- Deixar o meio permanecer nos reactores e na(s) garrafa(s) de resíduos durante a noite antes da inoculação. Isso permite um condicionamento anaeróbico adicional do meio (por um total de ~ 72 h) e permite que o usuário confirme a esterilidade do sistema.
- Para confirmar a esterilidade do sistema antes da inoculação da amostra fecal, amostrar cada reator e o meio de origem diretamente após o enchimento inicial (etapa 4.7) e novamente após a etapa 4.8. Siga o procedimento de amostragem asséptica dos reatores descrito na etapa 6.
- Certifique-se de que a medição da densidade óptica de todas as amostras seja a mesma do meio de origem; Se for observado um aumento da densidade óptica, suspeita-se de contaminação e todos os meios e o sistema devem ser desconstruídos, limpos e remontados.
5. Inoculação de amostras fecais
- Coloque pontas de pipeta estéreis de calibre largo, solução salina estéril, tubos cônicos de 50 mL, pipetas sorológicas estéreis de 25 mL, seringas de 5 mL e agulhas de calibre 16 na câmara anaeróbica para condicionar no ambiente anaeróbico por pelo menos 24 h.
- Calcule a quantidade de material fecal necessária para inocular o número desejado de reatores. Cada poço do reator requer 3,8 mL de sobrenadante em uma pasta fecal de 25% m/v. Para seis poços de reatores, um total de 22,8 mL de lama fecal a 25% m/v deve fornecer sobrenadante suficiente para inoculação, o que exigirá 5,7 g de matéria fecal sólida.
- Transfira as amostras fecais preservadas em frascos criogênicos para a câmara anaeróbica e deixe-as descongelar por 15 min.
- Use uma ponta de pipeta de calibre largo para transferir material fecal dos frascos criogênicos para um tubo cônico de 50 mL, feche bem e centrifugue a 200 x g por 5 min para sedimentar as partículas.
- Transfira de volta para uma câmara anaeróbica e remova o sobrenadante. Usando uma espátula de laboratório autoclavada, transfira os sólidos fecais para um novo tubo cônico de 50 mL, atingindo uma massa total de 5,7 g. Adicione 17,1 mL de solução salina estéril anaeróbica ao tubo e feche bem.
- Remova os tubos cônicos da câmara, homogeneize por vórtice por 5 min e centrifugue a 200 x g por 5 min para sedimentar as partículas.
- Esterilize os septos em cima de cada reator com um lenço de laboratório com alvejante a 10% por pelo menos 2 minutos enquanto as amostras são colocadas na centrífuga.
- Retorne as amostras para a câmara anaeróbia e, usando pipetas serológicas estéreis, transfira os sobrenadantes para novos tubos cónicos de 50 ml.
- Carregue 3,8 mL de sobrenadante de pasta fecal em seis seringas separadas de 5 mL com agulhas de 16 G de 1,5 polegada.
- Remova o lenço, insira a agulha no septo e injete lentamente a pasta fecal no reator.
- Permita que as comunidades fecais se estabeleçam em cada reator por aproximadamente 16-18 h antes de iniciar o fluxo para o reator. Ajuste a placa de agitação magnética para a velocidade máxima a partir do momento em que a pasta fecal é injetada (1600 rpm).
6. Coleta asséptica de amostras de poços de reatores
- Perfure a embalagem em seis seringas estéreis de 1 mL e seis agulhas estéreis 22G de 3 polegadas e coloque-as na câmara anaeróbica para desgaseificar por 24 h.
- Imediatamente antes da amostragem, esterilize os septos no topo de cada reator com um lenço de laboratório com alvejante a 10% por pelo menos 2 min.
- Remova o lenço umedecido do laboratório de alvejante e imediatamente coloque uma agulha em uma seringa e insira a agulha no centro dos septos do primeiro poço do reator.
- Puxe 1 mL da amostra, remova a agulha dos septos e transfira a amostra da seringa para um tubo marcado de 1,7 mL para uso a jusante. Os septos de borracha serão selados novamente após a remoção da agulha. Use uma nova agulha e seringa para cada poço do reator para evitar contaminação cruzada.
- Se o sobrenadante for desejado, remova os tubos da câmara anaeróbica e centrifugue a 20.000 x g por 1 min para pellet células bacterianas.
- Transfira o sobrenadante para um tubo de 1,7 ml rotulado separadamente e armazene a -80 °C.
7. Desconstrução e limpeza do sistema de mini-biorreator
- Desconecte a garrafa de origem do tee luer de origem e aumente a vazão (1 mL/min na bomba de origem e 2 mL/min na bomba de resíduos) para começar a esvaziar a tubulação. Deixe o tubo esvaziar completamente. Desligue a placa de agitação.
- Quando a tubulação estiver vazia, desconecte a garrafa de resíduos do tee luer de resíduos. Em seguida, coloque o conjunto do reator na câmara anaeróbica e remova-o da câmara.
- Desconecte todos os segmentos de tubulação E-LFL de 2.06 mm e tubulação de PTFE e descarte-os. Desconecte todas as conexões e coloque-as em uma solução de alvejante a 10%.
- Remova bem as barras de mini-agitação de cada matriz e coloque-as na solução de alvejante. Inverta a matriz do reator para esvaziar o meio em uma solução separada de alvejante a 10% para desinfecção. Em seguida, mergulhe a matriz vazia em uma solução de alvejante fresca.
- Deixe todas as conexões e o conjunto do reator de molho na solução de alvejante a 10% por 30 min (a imersão prolongada causará descoloração).
- Enxágue as conexões e o conjunto do reator com água deionizada e mergulhe durante a noite em solução de detergente enzimático de acordo com as instruções do fabricante.
- Enxágue três vezes as conexões e o conjunto do reator com água deionizada e deixe secar completamente ao ar por pelo menos 3 dias. Depois de secos, o conjunto e os acessórios do reator podem ser usados para montagem novamente.
Resultados
Amostras fecais foram coletadas de camundongos colonizados com dejeto líquido fecal humano 2 semanas após a inoculação e armazenadas a -80 °C. O sistema de biorreator foi configurado com fluxo contínuo de meio MEGA para dois poços de reator replicados (Figura 3A). A pasta fecal foi preparada a partir dos pellets fecais de camundongo de acordo com o protocolo descrito na etapa 6, e ambos os reatores foram inoculados po...
Discussão
O sistema de mini-biorreator descrito neste protocolo permite o cultivo de comunidades fecais independentes para experimentação paralela. Essa capacidade de estudar comunidades microbianas isoladamente dos fatores do hospedeiro é uma abordagem essencial para entender a capacidade intrínseca dos microrganismos de se adaptarem ao seu ambiente. Este protocolo pode ser facilmente adaptado para o cultivo de consórcios bacterianos definidos ou mesmo culturas isoladas únicas, se desejado....
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
Os autores agradecem a Josee Gauthier pela assistência no sequenciamento do gene 16S rRNA. Esta pesquisa foi apoiada, em parte, pelos Fundos do UF Health Cancer Center (CJ) e pelo Fundo Gatorade do Departamento de Medicina da UF (CJ). R.Z.G. foi apoiado por fundos do UF Health Cancer Center. RCN foi apoiado pelo National Institutes of Health TL1 Training Grant da Universidade da Flórida (TL1TR001428, UL1TR001427), o prêmio do National Cancer Institute of the National Institutes of Health Team-Based Cancer Research Program T32CA257923 e o UF Health Cancer Center. A pesquisa relatada nesta publicação foi apoiada pelo UF Health Cancer Center, apoiada em parte por dotações estaduais fornecidas em Fla. Stat. § 381.915 e pelo Instituto Nacional do Câncer dos Institutos Nacionais de Saúde sob o Prêmio Número P30CA247796. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais dos Institutos Nacionais de Saúde ou do Estado da Flórida. Os financiadores não tiveram nenhum papel no desenho do estudo, coleta de dados e análise; decisão de publicar; ou preparação do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL BD Slip Tip Syringe sterile, single use | Fisher Scientific | 309659 | |
| 1/4-28 mm thread to barbed male adaptor (3.2 mm), 5/pack | Cole-Parmer | 008NB32-KD5L | To build 1 6-well array, need 2 packs |
| 10M NaOH (Sodium Hydroxide) | Sigma | 72068-100ML | |
| 2.0ml Screw Cap Tube, NonKnurl, Skirted,Natural, E-Beam Sterile tube w/ attached cap | Fisher Scientific | 14-755-228 | |
| 2mag MIXdrive 60 Stirring Drive | 2mag | 40060 | 60-position magnetic stir plate (optional addition of heating capacity- cat# 40260) |
| 6-well reactor arrray, ABS-Like Translucent Clear plastic | Protolabs | Custom | See supplementary files for .stl file for 3D printing |
| Absolute Ethanol (200 Proof) | Fisher Scientific | BP2818 | |
| Acetic acid, glacial | Sigma | A6283 | |
| Adapter, nylon, male luer to 1/4-28 thread, 25/pack | Cole-Parmer | EW-45505-82 | To build 1 6-well array, need 6 (1 pack) |
| Aluminum foil | Fisher Scientific | 01-213-100 | |
| Anaerobic chamber | Coy Lab Products | Type B | |
| Bel-Art SP Scienceware Flea Micro Spinbar Magnetic Stirring Bars (1/pk) | Fisher Scientific | 22-261679 | To build 1 6-well array, need 6 |
| Biosafety cabinet class 2 | Nuaire | ||
| Butyric acid | Sigma | B103500 | |
| CaCl2 · 2H2O (Calcium Chloride Dihydrate) | Sigma | C7902 | |
| Clorox Healthcare Germicidal Wipes With Bleach, Unscented, 6" x 5", Pack Of 150 Wipes | Office Depot | 129202 | |
| D-(-)-Fructose | Sigma | F0127-100G | |
| D-(+)-Cellobiose | Sigma | C7252-100G | |
| D-(+)-Glucose | Sigma | G8270-100G | |
| D-(+)-Maltose monohydrate | Sigma | M5885-100G | |
| Drill America Plug Hand Tap DWTP1/4-28 | Home Depot | 305699489 | |
| Dulbecco's Phosphate Buffered Saline, 1X without Ca and Mg, Sterile | Genesee | 25-508 | |
| Female luer × 1/16″ hose barb adapter, Nylon, 25/pack | Cole-Parmer | EW-45502-00 | To build 1 6-well array, need 24 (1 pack) |
| Female luer × 1/8″ hose barb adapter, Nylon 25/pack | Cole-Parmer | EW-45502-04 | To build 1 6-well array, need 6 (1 pack) |
| Female luer × 3/32″ hose barb adapter, Nylon, 25/ pack | Cole-Parmer | EW-45502-02 | To build 1 6-well array, need 6 (1 pack) |
| Female luer tee, Nylon, 25/pack | Cole-Parmer | EW-45502-56 | To build 1 6-well array, need 10 (1 pack) |
| FeSO4 · 7H2O (Iron [II] Sulfate Heptahydrate) | Sigma | F8633 | |
| Hematin | Sigma | H3281 | |
| Histidine | Sigma | H7750 | |
| Isovaleric acid | Sigma | 129542 | |
| K2HPO4 dibasic (dipotassium hydrogen phosphate) | Sigma | P2222-1KG | |
| KH2PO4 monobasic (potassium dihydrogen phosphate) | Sigma | P0662-500G | |
| Large Orifice Pipet Tips | Fisher Scientific | 02-707-134 | |
| L-Cysteine hydrochloride | Sigma | C1276-10G | |
| Male luer with lock ring × 1/8″ hose barb adapter, Nylon, 25/pack | Cole-Parmer | EW-45505-04 | To build 1 6-well array, need 42 (2 packs) |
| Meat extract | Sigma | 70164-500G | |
| Med Vet International Exel Needle, 20G X 1", Hypodermic, 100/Box, 26417 | Fisher Scientific | 50-209-2532 | |
| Menadione (Vitamin K3) | Sigma | M5625 | |
| MgSO4 · 7H2O (Magnesium Sulfate Heptahydrate) | Sigma | M1880-500G | |
| Milli-Q water | |||
| NaCl (Sodium Chloride) | Sigma | S9888-500G | |
| NaHCO3 (Sodium Bicarbonate) | Sigma | S5761-500G | |
| Omnifi t Q-series two hole bottle cap | Cole-Parmer | 00945Q-2 | To build 1 6-well array, need 1 |
| PMP IPC-N L 24CHNL 8RLR 115V | MasterFlex | ISM939C-115V | 24-channel peristaltic pump, require 1 for source and 1 for waste |
| Precision Seal® rubber septa,white, 7 mm O.D. glass tubing (100/pk) | Millipore Sigma | Z553905-100EA | To build 1 6-well array, need 6 septa |
| Propionic acid | Sigma | P5561 | |
| Pump Tubing, 2-Stop, Tygon S3 E-Lab, 1.02 mm ID; 12/PK | VWR | MFLX96460-28 | To build 1 6-well array, need 6 (1 pack) |
| Pump Tubing, 2-Stop, Tygon S3 E-Lab, 1.14 mm ID; 12/PK | VWR | MFLX96460-30 | To build 1 6-well array, need 6 (1 pack) |
| Puritan Cary-Blair Medium, 5 ml | Fisher Scientific | 22-029-646 | |
| PYREX 2L Round Media Storage Bottles, with GL45 Screw Cap | Fisher Scientific | 06-414-1E | |
| Razor Blades | Genesee | 12-640 | |
| Resazurin, sodium salt | ACROS Organics from ThermoFisher | AC41890-0010 | |
| Soluble starch | Sigma | S9765-100G | |
| Stainless Steel Micro Spatulas, spoon like blade | Fisher Scientific | S50823 | |
| TBNG TYGON ELFL 2.06MMID 100' | VWR | MFLX06449-42 | To build 1 6-well array, need 205.5 cm |
| Trace Mineral Supplement | ATCC | MD-TMS | |
| Trypticase Peptone (BBL) | Fisher Scientific | B11921 | |
| Tubing, PTFE, 1/8″ (3.2 mm) OD × 1.5 mm ID, 10 M | Cole-Parmer | 008 T32-150-10 | To build 1 6-well array, need 300 mm |
| Tween 80 | Sigma | P1754 | |
| Vitamin Supplement | ATCC | MD-VS | |
| Yeast Extract (Bacto) | Fisher Scientific | DF0127-17-9 |
Referências
- Sender, R., Fuchs, S., Milo, R. Revised estimates for the number of human and bacteria cells in the body. PLoS Biol. 14 (8), e1002533 (2016).
- Postler, T. S., Ghosh, S. Understanding the holobiont: how microbial metabolites affect human health and shape the immune system. Cell Metab. 26 (1), 110-130 (2017).
- Rooks, M. G., Garrett, W. S. Gut microbiota, metabolites and host immunity. Nat Rev Immunol. 16 (6), 341-352 (2016).
- Auchtung, J. M., Robinson, C. D., Farrell, K., Britton, R. A. MiniBioReactor Arrays (MBRAs) as a tool for studying C. difficile physiology in the presence of a complex community. Methods Mol Biol. 1476, 235-258 (2016).
- Han, S., et al. A metabolomics pipeline for the mechanistic interrogation of the gut microbiome. Nature. 595 (7867), 415-420 (2021).
- Bilinski, J., et al. Fresh versus frozen stool for fecal microbiota transplantation-assessment by multimethod approach combining culturing, flow cytometry, and next-generation sequencing. Front Microbiol. 13, 872735 (2022).
- Li, X. M., et al. Effects of stool sample preservation methods on gut microbiota biodiversity: New original data and systematic review with meta-analysis. Microbiol Spectr. 11 (3), e0429722 (2023).
- Fouhy, F., et al. The effects of freezing on faecal microbiota as determined using MiSeq sequencing and culture-based investigations. PLoS One. 10 (3), e0119355 (2015).
- Sun, X., et al. Microbiota-derived metabolic factors reduce Campylobacteriosis in mice. Gastroenterology. 154 (6), 1751-1763.e2 (2018).
- He, Z., et al. Campylobacter jejuni promotes colorectal tumorigenesis through the action of cytolethal distending toxin. Gut. 68 (2), 289-300 (2019).
- Newsome, R. C., et al. Interaction of bacterial genera associated with therapeutic response to immune checkpoint PD-1 blockade in a United States cohort. Genome Med. 14 (1), 35 (2022).
- Ziv, N., Brandt, N. J., Gresham, D. The use of chemostats in microbial systems biology. J Vis Exp. (80), e50168 (2013).
- Wille, J., Coenye, T. Biofilm dispersion: The key to biofilm eradication or opening Pandora's box. Biofilm. 2, 100027 (2020).
- Biagini, F., et al. Designs and methodologies to recreate in vitro human gut microbiota models. Bio-des Manuf. 6 (3), 298-318 (2023).
- Qi, Y., Yu, L., Tian, F., Zhao, J., Zhai, Q. In vitro models to study human gut-microbiota interactions: Applications, advances, and limitations. Microbiol Res. 270, 127336 (2023).
- Gościniak, A., Eder, P., Walkowiak, J., Cielecka-Piontek, J. Artificial gastrointestinal models for nutraceuticals research-achievements and challenges: A practical review. Nutrients. 14 (13), 2560 (2022).
- Marrero, D., et al. Gut-on-a-chip: Mimicking and monitoring the human intestine. Biosens Bioelectron. 181, 113156 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados